Method Article
Измерение потенциала митохондриальной мембраны in vivo с помощью генетически закодированного индикатора напряжения
В этой статье
Резюме
Этот протокол описывает применение генетически кодируемых индикаторов напряжения (GEVI), нацеленных на митохондрии. Эти GEVI имеют значительное преимущество по сравнению с традиционными красителями для создания потенциала митохондриальной мембраны, позволяя проводить специфический мониторинг потенциала митохондриальной мембраны in vivo и в режиме реального времени.
Аннотация
Потенциал митохондриальной мембраны (ММП, ΔΨm) имеет решающее значение для функций митохондрий, включая синтез АТФ, транспорт ионов, генерацию активных форм кислорода (АФК) и импорт белков, кодируемых ядром. Существующие методы измерения ΔΨm обычно используют липофильные катионные красители, такие как Родамин 800 и метиловый эфир тетраметилродамина (TMRM), но они ограничены низкой специфичностью и не очень хорошо подходят для применения in vivo . Чтобы устранить эти ограничения, мы разработали новый протокол, использующий генетически закодированные индикаторы напряжения (GEVI). Генетически кодируемые индикаторы напряжения (GEVI), которые генерируют флуоресцентные сигналы в ответ на изменения мембранных потенциалов, продемонстрировали значительный потенциал для мониторинга плазматических мембран и нейронных потенциалов. Тем не менее, их применение к митохондриальным мембранам остается неизученным. В этой статье мы разработали митохондриальные ГВИ на основе белков, способные обнаруживать флуктуации ΔΨm в клетках и моторной коре живых животных. Индикатор митохондриального потенциала (MPI) предлагает неинвазивный подход к изучению динамики ΔΨm в режиме реального времени, обеспечивая метод исследования функции митохондрий как в норме, так и при патологии.
Введение
Митохондрии являются важными органеллами в эукариотических клетках, служащими основными поставщиками энергии посредством производства аденозинтрифосфата (АТФ), а также выполняют множество других важных функций, таких как синтез метаболитов, буферизация ионов кальция, производство тепла и регуляциявыживаемости клеток. Их роль особенно важна в высокометаболических тканях, таких как мозг и сердце, где они помогают поддерживать клеточный гомеостаз. Потенциал митохондриальной мембраны (ММП, Ψm) играет центральную роль в этих процессах, в том числе стимулирует синтез АТФ посредством окислительного фосфорилирования, облегчает транспорт метаболитов и ионов через митохондриальные мембраны и способствует образованию активных форм кислорода (АФК)2,3. ММП также влияет на морфологиюи динамику митохондрий4, включая митофагию (избирательную деградацию митохондрий)5и апоптоз (запрограммированную гибель клеток)6. Поддержание соответствующего Ψm имеет важное значение для клеточной функции; Его дисрегуляция связана с многочисленными патологиями, включая нейродегенеративные заболевания, сердечную недостаточность и рак. Современные методы измерения Ψm были в основном основаны на использовании липофильных катионных красителей, включая TMRM (метиловый эфир тетраметилродамина), TMRE (этиловый эфир тетраметилродамина), Rhodamine 123, Safranin O, Rhodamine 800, DiOC6, JC-1 и др.7. Однако эти флуоресцентные молекулы имеют несколько ограничений. Эти красители не обладают клеточной специфичностью, поддаются гашению, а некоторые из них токсичны. Кроме того, они могут диффундировать с течением времени, и когда митохондриальная ΔΨ теряется, они вытекают, что делает их неспособными указывать на мембранный потенциал деполяризованных митохондрий. Кроме того, красители на основе родамина, такие как TMRM и TMRE, чувствительны ктемпературе8, что требует тщательного рассмотрения влияния температуры на флуоресценцию красителя, особенно при измерении напряжения митохондриальной мембраны во время физиологической активности, включающей клеточный термогенез.
Генетически кодируемые индикаторы напряжения (GEVI), белки, способные обнаруживать изменения мембранных потенциалов с помощью флуоресцентных сигналов 9,10, стали мощными инструментами для мониторинга мембранных потенциалов в различных клеточных контекстах11. В то время как GEVI широко применялись для изучения плазматических мембран, был достигнут небольшой прогресс в их адаптации для измерения потенциалов внутриклеточных мембран, особенно для митохондрий. Этот протокол направлен на устранение этого пробела за счет использования митохондриальных ГЭВИ, которые могут контролировать потенциал митохондриальной мембраны in vitro и in vivo. Добавляя митохондриальную сигнальную последовательность к существующим GEVI, соответствующие GEVI могут быть нацелены на митохондрии12. Эти показатели митохондриального потенциала (MPI) позволят по-новому взглянуть на физиологию митохондрий и предоставят значительный потенциал для изучения функции митохондрий при различных заболеваниях in vivo, улучшая наше понимание того, как митохондриальная динамика влияет как на нормальные, так и на патологические клеточные процессы.
протокол
Весь уход за животными и эксперименты проводились в соответствии с руководящими принципами Комитета по уходу за животными и их использованию Университета Чжэнчжоу. Стерилизуйте все хирургические инструменты перед использованием. Следуйте асептическим методам для предотвращения инфекции. После того, как все данные были получены, животных усыпляли с помощью передозировки ингаляционной анестезии с последующей обезглавливанием.
1. Применение in vitro
- Конструирование плазмид
- Получить ускоренный сенсор потенциалов действия 1 (ASAP1) и ASAP3 генов из Addgene или синтезировать из последовательности. (ASAP1, идентификатор присоединения NCBI: AHV90412.1, идентификатор Addgene: 52519; ASAP3, Addgene ID: 132331).
- Для плазмидных конструкций используйте грунтовки, перечисленные в таблице 1 .
- Для экспрессии в клетках используйте вектор EGFPN1 для построения.
- Первоначально синтезируют последовательность гена cox8 (NP_004065, аминокислоты 1-29) с четырьмя тандемными повторами (4cox8), фланкированными сайтами рестрикции NheI и XhoI. Расщепляют синтезированный фрагмент 4cox8 и вектор EGFPN1 с NheI и XhoI с последующим лигированием для генерации вектора 4cox8-EGFP.
- В последующем проводят ПЦР-амплификацию последовательности ASAP1 с праймером 1 и праймером 2. Расщепите фрагмент ASAP1 и вектор 4cox8-EGFP с помощью SalI и NotI, а затем лигирование для получения конечного вектора MPI-1 (MPI расшифровывается как индикатор митохондриального потенциала).
ПРИМЕЧАНИЕ: Векторная карта CMV-MPI-1 изображена на рисунке 1. Доступ к подробной последовательности можно получить в NCBI (идентификатор доступа: PQ678920).
- Для специфической экспрессии в нейронах проводят ПЦР-амплификацию последовательности промотора hSyn из плазмиды AAV-hSyn-EGFP (идентификатор присоединения NCBI: MH458079, идентификатор Addgene: 50465) с использованием праймера 3 и праймера 4.
- Расщепляйте последовательность hSyn и вектор 4cox8-EGFP с помощью AseI и NheI с последующим лигированием для получения вектора hSyn-4cox8-EGFP. В последующем проводят ПЦР-амплификацию последовательности ASAP3 с праймером 1 и праймером 2.
- Расщепляют вектор hSyn-4cox8-EGFP и последовательность ASAP3 с помощью SalI и NotI с последующим лигированием для получения вектора hSyn-MPI-2.
ПРИМЕЧАНИЕ: Условия ПЦР будут варьироваться в зависимости от конкретных ферментов и температуры плавления праймера (Tm). Типичная реакция ПЦР включает в себя начальную стадию денатурации при 95 °C в течение 30 с, за которой следуют 25-35 циклов денатурации (95 °C, 10 с), отжига (55 °C, 30 с) и удлинения (72 °C, 30 с/кб). Заключительная стадия удлинения при 72 °C в течение 5 мин обеспечивает полный синтез продукта, за которой следует выдержка при 4 °C. Температура отжига должна быть примерно на 5 °C ниже Tm грунтовок. Обратитесь к инструкции производителя для получения оптимальных параметров ПЦР. Праймеры для ASAP1 и ASAP3 идентичны.
- Визуализация в живых клетках
- Питательную среду DMEM приготовить, добавив в среду 10% фетальную бычью сыворотку и 100 мг/л пенициллина/стрептомицина.
- Приготовьте реагенты для трансфекции Ca2+ : 2,5 моль/л CaCl2, 2x HEBS (274 ммоль/л NaCl, 10 ммоль/л KCl, 1,4 ммоль/л Na2HPO4, 15 ммоль/л D-глюкозы, 42 ммоль/л HEPES, pH 7,07).
- Приготовьте буфер Тироде для поддержания клеток во время визуализации (145 ммоль/л NaCl, 3 ммоль/л KCl, 10 ммоль/л HEPES, 10 ммоль/л глюкозы, pH 7,4).
- Культура клеток Hela в 35 мм культуральной чашке, скармливаемой питательной средой DMEM в инкубаторе с температурой 37 °C и атмосферой 5% CO2/95% воздуха. Добавьте 2-3 покровных листочка на каждую чашку, чтобы на них выросли клетки.
- Трансфектируйте клетки Hela методом осаждения фосфата кальция.
- Чтобы трансфицировать клетки, начните с замены старой питательной среды 2 мл бессывороточного DMEM. Через 35 мин приготовьте раствор DNA/Ca2+ , смешав 10 г ДНК, 4 мкл CaCl2 и ddH2O до конечного объема 40 мкл в микроцентрифужной пробирке.
- Добавьте 40 мкл 2x HEBS в раствор DNA/Ca2+ по каплям, энергично перемешивая. Вдуйте в смесь пузырьковый воздух с помощью пипетки, чтобы облегчить осаждение фосфата кальция.
- Через 25 мин добавьте 80 мкл этого раствора осадка в чашку с клетками и верните ее в инкубатор еще на 1-2 ч. Затем удалите несывороточный DMEM и промойте клетки 15% глицерином (растворенным в PBS) в течение 2 минут.
- После аспирации глицерина добавьте 2 мл DMEM, содержащего 10% FBS, и продолжайте культивирование клеток в течение 16-24 часов.
- Поместите покровные листы с клетками в чашку для культивирования диаметром 35 мм с 2 мл буфера Тироде и окрасьте клетки красителем родамином 800, добавив в чашку 20 мкмоль/л родамина 800 (растворенного в ddH2O) до конечной концентрации 50 нмоль/л.
- Подготовьте флуоресцентный микроскоп и установите на него соответствующие фильтры и источник света, чтобы возбуждать белок с помощью источника света с длиной волны 488 нм и собирать излучение в диапазоне 490-540 нм. Возбуждайте краситель родамин 800 с помощью источника света с длиной волны 633 нм и собирайте излучение в диапазоне 650-720 нм.
- Приготовьте раствор карбонилцианида m-хлорфенилгидразона (ССХП) в концентрации 500 мкМ (запас) и добавьте в клетки до конечной концентрации 5 мкМ во время визуализации.
ПРИМЕЧАНИЕ: pH раствора 2x HEBS имеет решающее значение для эффективности трансфекции. pH следует тщательно регулировать до 7,07 с твердым гидроксидом натрия. pH не может быть ниже 7,01 или выше 7,12.

Рисунок 1: Векторная карта CMV-MPI-1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Приложения in vivo
- Плазмидная конструкция
- Для экспрессии in vivo используйте вирус AAV для трансдукции. Получите экспрессирующую основу для упаковки AAV (Addgene ID: 46954 или 26968), которая содержит последовательности инвертированных терминальных повторов (ITR) для упаковки вирусов AAV.
- Проводят ПЦР-амплификацию вектора hSyn-MPI-2 (начиная с шага 1.1.4) с использованием праймеров 5 и 7 в таблице 1.
- Проводят вторую амплификацию ПЦР с использованием того же шаблона и праймеров 6 и 8, приведенных в таблице 1.
- Проводят окончательную ПЦР с использованием продукта из первой и второй ПЦР (шаги 2.1.2 и 2.1.3) в качестве матрицы и праймеров 5 и 8 в таблице 1, генерируя окончательную последовательность hSyn-MPI-2.
- Расщепите последовательность hSyn-MPI-2 и остов pAAV с помощью MluI и EcoRI с последующим лигированием для получения окончательной конструкции pAAV-hSyn-MPI-2. Векторная карта pAAV-hSyn-MPI-2 проиллюстрирована на рисунке 2. С подробной последовательностью можно ознакомиться в NCBI (идентификатор доступа: PQ678919).
Примечание: Вектор hSyn-MPI-2 содержит внутренний сайт EcoRI, происходящий из исходного остова EGFPN1, который удаляется с помощью модифицированных праймеров в перекрывающейся стратегии ПЦР (шаги 2.1.2-2.1.4).
- Подготовка и трансдукция вирусов
- Культивируют клетки HEK293t в 100 мм культуральной чашке, скармливают 10% питательную среду FBS DMEM в инкубаторе с температурой 37 °C и атмосферой 5% CO2/95% воздуха для достижения 70% конфлюенции.
- Котрансфектировать клетки HEK293t плазмидой гена AAV, капсидом (pAAV-DJ или pAAV9) и хелперными плазмидами (pHelper) с использованием метода осаждения фосфата кальция. Количество ДНК для каждой плазмиды было следующим: ген: 10 мкг, pHelper: 11 мкг, капсид: 9 мкг. Количество реагента для трансфекции: 12 мкл CaCl2, 120 мкл 2x HEBS.
- Инкубируйте трансфицированные клетки в течение 72 часов, чтобы обеспечить выработку вируса.
- После инкубационного периода соберите клетки центрифугой по 400 г. Промойте клетки PBS 2 раза и повторно суспендируйте ячейку в 400 μл PBS.
- Собирают вирусы из клеточной суспензии с помощью четырех циклов методов замораживания-размораживания (37 °C и -80 °C). Центрифугируйте лизат при 13 500 × г при 4 °C и выбросьте гранулы. Надосадочная жидкость содержит вирус AAV.
- Выполнение ПЦР в реальном времени для определения титрования подготовленного вируса. Подробный протокол определения титрования AAV можно найти в https://www.addgene.org/protocols/aav-titration-qpcr-using-sybr-green-technology/.
- Аликвотировать и хранить подготовленный вирус AAV при температуре -80 °С.
- Стереотаксическая инъекция вируса
- Обезболить взрослого самца мыши C57/BL массой 24-26 г 3% пентобарбитала натрия путем внутрибрюшинной инъекции в дозировке 30 мг/кг. После обезболивания зафиксируйте мышей на стереотаксическом аппарате, чтобы сохранить стабильное положение на протяжении всей процедуры.
- Применяйте ветеринарную офтальмологическую мазь для защиты глаз от светового повреждения и поддержания влажности глаз.
- Используйте крем для депиляции, чтобы удалить волосы на голове мыши и обнажить кожу головы.
- Вскройте кожу головы с помощью хирургических ножниц и обнажите череп. Обработайте череп 3% перекисью водорода для стерилизации и визуализации ключевых достопримечательностей, таких как участки брегмы и лямбды.
- Отрегулируйте положение головы мыши, чтобы череп находился горизонтально.
- Используйте программируемый съемщик микропипеток для извлечения стеклянных пипеток нужной формы и размера для точных инъекций. Наполните стеклянную микропипетку парафиновым маслом.
- Расположите микропипетку в целевом месте. В этом протоколе целью является область M2 с правой стороны, используя следующие координаты: AP (передне-задний), +1,94 мм; ML (медиолатеральный), +0,75 мм; DV (дорсовентральный), -1,5 мм.
- С помощью электродрели сделайте небольшое отверстие в черепе в месте назначения.
- Получите 500 нл вируса в титре 1,5 x10 11 копий генома на миллилитр (GC/мл) через кончик микропипетки. Введите 500 нл вируса в целевой участок с помощью инжекционного насоса со скоростью потока 100 нл/мин.
- После инъекции оставьте пипетку на месте примерно на 5 минут, чтобы обеспечить диффузию, прежде чем осторожно втянуть ее.
- Имплантируйте оптическое волокно (диаметр 200 мкм, числовая апертура 0,37, длина 2 мм) в место инъекции.
- Закрепите оптическое волокно на месте с помощью стоматологического цемента.
- Зашить кожу головы мыши нейлоновой нитью 5-0 (эстетическая игла Δ1/2 4x12) и вернуть ее в домашнюю клетку.
- Поместите домашнюю клетку на грелку, чтобы поддерживать температуру тела мыши до тех пор, пока она полностью не оправится от анестезии.
- Выключите грелку, как только животное начнет двигаться. Подождите еще 2 часа на привыкание к комнатной температуре (RT), прежде чем перемещать мышь в помещение.
- Домашняя мышь в 12-часовом световом/12-часовом темном цикле при температуре 22 °C с ограниченным доступом к пище и воде в течение 2-3 недель для обеспечения вирусной экспрессии.
- Фиброметрия
- Подключите оптическое волокно, имплантированное в мышь, к оптическому кабелю.
- Подключите другой конец оптического кабеля к детектору, который будет использоваться для захвата данных изображения.
- Для визуализации используйте источник света, который возбуждает белки на длине волны 488 нм. Настройте детектор на сбор излучаемого света на длинах волн от 490 нм до 540 нм.
- Отрегулируйте интенсивность возбуждающего света, чтобы оптимизировать сигнал, не вызывая повреждения тканей мозга.
- Изменяйте усиление флуоресцентного сигнала, чтобы детектор улавливал четкий и сильный сигнал.
- Чтобы избежать быстрого обесцвечивания флуоресценции, которое может привести к снижению качества изображения, при необходимости отрегулируйте интенсивность света и усиление флуоресцентного сигнала.
- Проведите тест поведения мыши.
- Непрерывный мониторинг процесса визуализации во время поведенческого теста.
- Анализ данных
- Используйте Python и GNUplot для создания тепловой карты экспериментальных испытаний для визуального представления данных. Исходные коды приведены в Дополнительном файле 1.
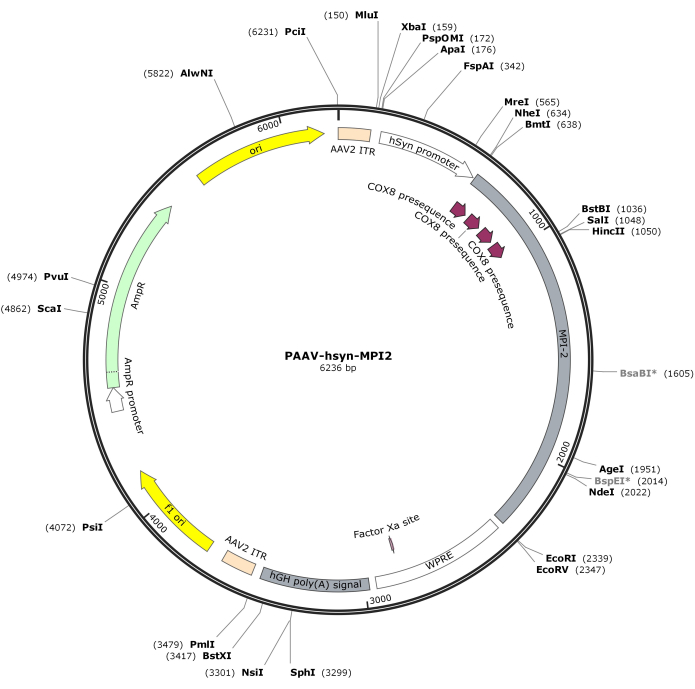
Рисунок 2: Векторная карта AAV-hSyn-MPI-2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
После создания плазмиды CMV-MPI-1 ее способность нацеливаться на митохондрии была проверена в клетках Hela с использованием митохондриального маркера Rhodamine 800 для окрашивания. Эксперименты по колокализации показали высокую степень перекрытия между сигналом флуоресценции MPI-1 и сигналом от Rhodamine 800, что указывает на успешную локализацию MPI-1 в митохондриях (рис. 3).

Рисунок 3: Колокализация MPI-1 с митохондриями в клетках Hela. CMV-MPI-1 трансфицировали в клетках Hela и окрашивали родамином 800, веществителем, чувствительным к потенциалу митохондриальной мембраны. Масштабная линейка: 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
После трансфекции MPI-1 в клетки HeLa чувствительность клеток к напряжению проверяли путем введения CCCP (карбонилцианида m-хлорфенилгидразона), митохондриального развязки. Добавление CCCP к клеткам приводило к деполяризации митохондрий. Использовали потенциал-чувствительный краситель (родамин800), что можно наблюдать как снижение флуоресценции потенциал-чувствительного красителя (родамина800) или MPI-1 (рис. 4).
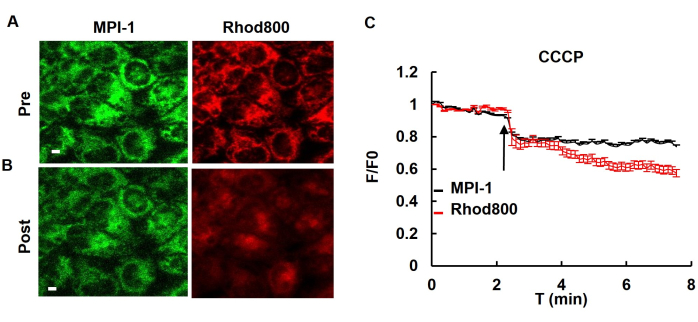
Иллюстрация 4: Потенциал-чувствительные флуоресцентные изменения в ответ на лечение CCCP. (A) Флуоресцентные изображения клеток HeLa, стабильно экспрессирующих MPI-1 до и после добавления развязывающего CCCP в концентрации 5 мкМ. Родамин 800 служил традиционным индикатором потенциала митохондриальной мембраны. Масштабная линейка: 5 мкм. (B) Изменение интенсивности флуоресценции MPI-1 и родамина 800 при применении CCCP (n = 14 клеток). Сокращения: T: Time. Этот рисунок был изменен с разрешения Yang et al.12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
После инъекции вируса hSyn-MPI-2 AAV в кору M2 мыши изменение флуоресценции контролировалось во время анестезии, вызванной изофлураном. Флуоресценция MPI-2 снижалась после анестезии (рис. 5), что свидетельствует о снижении MMP во время этого процесса.
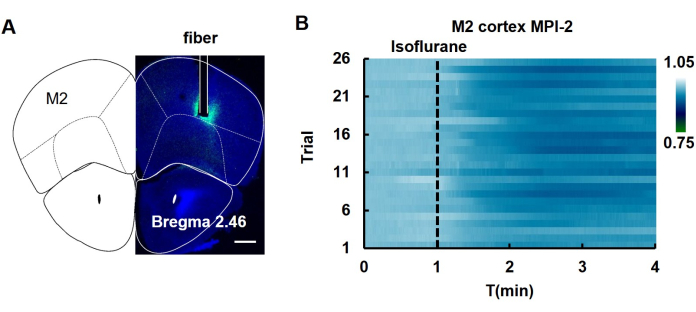
Рисунок 5: Волоконная фотометрия MPI-2 in vivo в коре M2 во время изофлуран-индуцированной анестезии. (A) Изображения, показывающие флуоресценцию участков мозга после инъекции вируса. Область, где было имплантировано волокно, отмечена белыми линиями. Флуоресцентное изображение было объединено с картой мозга мыши, чтобы показать, где была сделана инъекция. Масштабная линейка: 500 мкм. (B) Изменения флуоресценции MPI-2, наблюдаемые в многочисленных испытаниях анестезии, индуцированной изофлураном (n = 26 испытаний с участием 5 мышей). Сокращения: T: Time. Пунктирная линия показывает, когда был применен изофлуран. Этот рисунок был изменен с разрешения Yang et al.12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Нет. | Название грунтовки | Последовательность(5'->3') | ||||
| 1 | ASAP(SalI)-FP | ACGCGTCGACGatggagacgactgtgaggtatgaacagg | ||||
| 2 | ASAP(NotI)-RP | AAAAGGAAAAGCGGCCGCttaggttaccacttcaagttttttctctgtgaag | ||||
| 3 | hSyn(AseI)-FP | ATGCATTAATTGTACagtCTagACGGGGC | ||||
| 4 | hSyn(NheI)-RP | ctaGCTAGCctgcgctcaggcacgacgactcc | ||||
| 5 | hsyn(MluI)-FP | agctacgcgtgtgtctagactgcagagggccctgcgt | ||||
| 6 | delete-internal_EcoRI-FP | GAGCTCAAGCTTCGAATACTGCAGTCGACG | ||||
| 7 | delete-internal_EcoRI-RP | CGTCGACTGCAGTATTCGAAGCTTGAGCTC | ||||
| 8 | ASAP(EcoRI)-RP | cggaattcttaggttaccacttcaagttttttctgaag | ||||
Таблица 1: Грунтовки для плазмидных конструкций.
Дополнительный файл 1: Исходный код для анализа данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Напряжение митохондриальной мембраны поддерживается на уровне -120--180 мВ в условиях покоя и колеблется при изменении метаболического состояния. В настоящее время измерение потенциала митохондриальной мембраны может быть выполнено с помощью электрофизиологических методов и методов флуоресцентных красителей. Зажим митохондриального пластыря требует изоляции митохондрий и разрушения клеточных структур13. Такой подход может привести к измерениям, которые отклоняются от физиологических условий. Метод флуоресцентного зонда является распространенным подходом к измерению MMP. Однако эти флуоресцентные молекулы не могут окрашивать определенные клетки, склонны к гашению, а некоторые красители токсичны. Кроме того, эти красители не подходят для применения in vivo из-за присущих им ограничений, включая недостаточную клеточную специфичность и равновесие в течение длительного периода времени (~30 минут).
Этот протокол предоставляет новый метод мониторинга MMP, особенно in vivo. Ключом к этому методу является поиск подходящего GEVI, который может быть нацелен на митохондрии путем слияния его N-концевого с митохондриальным сигналом нацеливания. Предыдущие исследования показали, что некоторые из GEVI, такие как Arclight и SomArchon, не смогли локализоваться в митохондриях12. Тем не менее, семейства белков ускоренного сенсора потенциалов действия (ASAP) могут быть нацелены на митохондрии путем их слияния с митохондриальным сигналом нацеливания12.
Начальная фаза протокола включает в себя конструирование плазмиды с четырехкратной повторяющейся последовательностью ЦОГ8, что невозможно с помощью ПЦР из-за ее повторяющегося характера. Вместо этого для создания последовательности 4cox8 используется синтез ДНК или методы, связанные с ферментами. Другие митохондриальные последовательности, нацеленныена 14, также могут быть подходящими, что потребовало анализа колокализации. Пакет AAV имеет решающее значение для последующих применений in vivo . Титрование AAV должно быть целесообразным для обеспечения эффективной трансфекции без причинения токсичности. Для повышения эффективности необходимы такие модификации, как оптимизация условий трансфекции. Это может быть достигнуто путем регулировки количества используемой ДНК и реагентов для трансфекции, что повышает эффективность трансфекции. Для трансфекции осадков кальция рН HEBS имеет решающее значение. Он не может быть ниже 7.01 или выше 7.12.
MPI превосходит традиционные красители MMP по нескольким параметрам. Он позволяет отслеживать изменения MMP в режиме реального времени, возможность, которой нет у традиционных красителей из-за их требования к равновесному времени. Генетическое кодирование MPI также обеспечивает специфическую для типа клеток экспрессию, обходя неспецифичность традиционных красителей. Кроме того, MPI сохраняет свое митохондриальное нацеливание даже после деполяризации, в отличие от традиционных красителей, которые теряют свое митохондриальное нацеливание в таких условиях. Более того, стабильное митохондриальное нацеливание MPI делает его отличным кандидатом для применения в визуализации in vivo .
Несмотря на свои преимущества, MPI имеет определенные ограничения. Фотообесцвечивание, распространенная проблема с флуоресцентными белками, может быть проблемой при использовании MPI. Это можно частично смягчить, минимизировав воздействие света во время визуализации. Кроме того, существует вероятность спектрального перекрытия между MPI и другими флуорофорами, что требует тщательного выбора фильтров для многоцветной визуализации. Фоновая флуоресценция – фактор, требующий внимания. Чтобы решить эту проблему, клетки могут быть совместно трансфицированы с митохондрийным нацеленным mCherry. Эта стратегия помогает отличать истинные сигналы от ложных срабатываний в процессе мониторинга. Текущая версия MPI, как и другие GEVI, используемые для обнаружения изменений напряжения нейронной плазматической мембраны, может отслеживать только колебания потенциала митохондриальной мембраны, а не абсолютные значения. Для калибровки сигналов и преобразования их в фактические значения мембранного потенциала в вольтах перспективен метод метрических отношений15, который предполагает слияние с другим флуоресцентным белком. Поскольку семейство белков ASAP продолжает развиваться16, мы ожидаем дальнейшего улучшения чувствительности. Это открывает захватывающие возможности для разработки более чувствительных MPI в будущем.
MPI имеет значительные перспективы для исследований в различных областях, включая биоэнергетику, митохондриальную динамику и моделирование заболеваний. В нейробиологии он может быть использован для мониторинга ММП в нейронах, что дает представление о нейродегенеративных заболеваниях, связанных с митохондриальной дисфункцией. В кардиологии высокая чувствительность MPI к высокому напряжению делает его пригодным для изучения митохондрий сердца в моделях ишемии и сердечной недостаточности. Кроме того, в исследованиях рака MPI может быть использован для изучения биоэнергетических сдвигов, характерных для раковых клеток, способствуя лучшему пониманию этого сложного заболевания.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим за поддержку Национальный фонд естественных наук (NSF) Китая: JSK (32071137 и 92054103) и Финансирование группы научных исследований и инноваций Первой аффилированной больницы Университета Чжэнчжоу: JSK (ZYCXTD2023014).
Материалы
| Name | Company | Catalog Number | Comments |
| BamHI | Thermo | FD0054 | |
| Calcium chloride | Sigma | C4901 | |
| CCCP | Sigma | C2759 | |
| Centrifuge | eppendorf | 5430R | |
| Centrifuge (cell culture) | eppendorf | 5810R | |
| CO2 cell incubator | ESCO | 170L IR Sensor | |
| Coverslips | Glaswarenfabrik Karl Hecht GmbH & Co.KG | 92100100030 | |
| Dental adhensive resin cement | Sun medical company, LTD. | Super-Bond C&B Kit | |
| D-glucose | Sigma | G7021 | |
| DNA Ligation Kit Ver. 2.1 | Takara | 6022 | |
| Dulbecco's modified Eagle medium | Gibco | 11965092 | |
| Electric drill | RWD Instruments | 78001 | |
| Fetal bovine serum | Gibco | A5670701 | |
| Fiber optic cannula | RWD Instruments | R-FOC-L200C-39NA | |
| Fiber photometry detector | Thinker | QAXK_FPS-TC-MC-LED | |
| Fluorescence microscope | Olympus | IX83 | |
| Glass pipette (for injection) | Drummond Scientific company | 3.5" Drummond # 3-000-203-G/X | |
| HEK293t | ATCC | Cat# CRL-3216 | |
| Hela cells | ATCC | Cat# CCL-2 | |
| HEPES | Sigma | H3375 | |
| Injection pump | Drummond Scientific company | 3-000-207 | |
| Isoflurane | RWD Instruments | R510-22 | |
| Laser scanning confocal microscope | Zeiss | LSM980 | |
| MluI | Thermo | FD0564 | |
| NheI | Thermo | FD0974 | |
| Optical fibers | RWD Instruments | R-FC-L-N3-200-L1 | |
| Paraffin oil | Sangon | B500301 | |
| PCR thermal Cycler | analytik jena | Biometra Tone 96G | |
| Pentobarbital sodium | Sinopharm Chemical Reagent Co.LTD | 57-33-0 | |
| Potassium chloride | Sigma | P5405 | |
| PrimeSTAR HS DNA Polymerase | Takara | R010A | |
| Programmable micropipette puller | Sutter Instruments | P2000 | |
| Quick self-curing acrylic resin | Yamahachi | V-PINK | |
| Real-time PCR thermal Cycler | analytik jena | qTOWER³ auto | |
| Rhodamine 800 | Sigma | 83701 | |
| SalI | Thermo | FD0644 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium phosphate dibasic | Sigma | S9763 | |
| Stereotaxic apparatus | RWD Instruments | E06354 | |
| Veterinary ophthalmic ointment | Puralube | NA | |
| XhoI | Thermo | FD0694 |
Ссылки
- Vyas, S., Zaganjor, E., Haigis, M. C. Mitochondria and cancer. Cell. 166 (3), 555-566 (2016).
- Dzbek, J., Korzeniewski, B. Control over the contribution of the mitochondrial membrane potential (ΔΨ) and proton gradient (ΔpH) to the protonmotive force (Δp): IN SILICO STUDIES. J Biol Chem. 283 (48), 33232-33239 (2008).
- O'Rourke, B., Cortassa, S., Aon, M. A. Mitochondrial ion channels: Gatekeepers of life and death. Physiology. 20 (5), 303-315 (2005).
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol. 22 (1), 79-99 (2006).
- Jin, S. M., Lazarou, M., Wang, C., Kane, L. A., Narendra, D. P., Youle, R. J. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. J Cell Biol. 191 (5), 933-942 (2010).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Meng, X. -. Y., et al. A sensitive mitochondrial thermometry 2.0 and the availability of thermogenic capacity of brown adipocyte. Front Physiol. 13, 977431 (2022).
- Kaestner, L., et al. Genetically encoded voltage indicators in circulation research. Int J Mol Sci. 16 (9), 21626-21642 (2015).
- Yang, H. H., St-Pierre, F. Genetically encoded voltage indicators: Opportunities and challenges. J Neurosci. 36 (39), 9977 (2016).
- Sepehri Rad, M., Cohen, L. B., Braubach, O., Baker, B. J. Monitoring voltage fluctuations of intracellular membranes. Sci Rep. 8 (1), 6911 (2018).
- Yang, R. -. Z., Wang, D. -. D., Li, S. -. M., Liu, P. -. P., Kang, J. -. S. Development and application of a mitochondrial genetically encoded voltage indicator in narcosis. Neurosci Bull. 40 (10), 1529-1544 (2024).
- Kumari, A., Nguyen, D. M., Garg, V. Patch-clamp technique to study mitochondrial membrane biophysics. J Gen Physiol. 155 (8), e202313347 (2023).
- Bayne, A. N., Dong, J., Amiri, S., Farhan, S. M. K., Trempe, J. -. F. MTSviewer: A database to visualize mitochondrial targeting sequences, cleavage sites, and mutations on protein structures. PLoS One. 18 (4), e0284541 (2023).
- Kim, B. B., et al. A red fluorescent protein with improved monomericity enables ratiometric voltage imaging with ASAP3. Sci Rep. 12 (1), 3678 (2022).
- Evans, S. W., et al. A positively tuned voltage indicator for extended electrical recordings in the brain. Nat Methods. 20 (7), 1104-1113 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены