Method Article
使用基因编码的电压指示器测量 体内 线粒体膜电位
摘要
该协议描述了线粒体靶向基因编码电压指示剂 (GEVI) 的应用。与传统的线粒体膜电位染料相比,这些 GEVI 具有显著的优势,能够特异性、 体内和实时监测线粒体膜电位。
摘要
线粒体膜电位 (MMP, ΔΨm) 对线粒体功能至关重要,包括 ATP 合成、离子转运、活性氧 (ROS) 生成以及细胞核编码的蛋白质的输入。现有的测量 ΔΨm 的方法通常使用亲脂性阳离子染料,例如罗丹明 800 和四甲基罗丹明甲酯 (TMRM),但这些方法受到低特异性的限制,不太适合 体内应用。 为了解决这些限制,我们开发了一种利用基因编码电压指示器 (GEVI) 的新协议。基因编码电压指示剂 (GEVI) 响应膜电位变化而产生荧光信号,已显示出监测质膜和神经元电位的巨大潜力。然而,它们在线粒体膜中的应用仍未得到探索。在这里,我们开发了基于蛋白质的线粒体靶向 GEVIs,能够检测活体动物细胞和运动皮层中的 ΔΨm 波动。线粒体电位指标 (MPI) 提供了一种实时研究 ΔΨm 动力学的非侵入性方法,提供了一种在正常和病理条件下研究线粒体功能的方法。
引言
线粒体是真核细胞中必不可少的细胞器,通过三磷酸腺苷 (ATP) 生成作为主要能量供应者,同时还执行各种其他关键功能,例如代谢物合成、钙离子缓冲、产热和细胞存活调节1。它们在大脑和心脏等高度代谢组织中的作用尤为关键,它们有助于维持细胞稳态。线粒体膜电位 (MMP, Ψm) 是这些过程的核心,包括通过氧化磷酸化驱动 ATP 合成,促进代谢物和离子穿过线粒体膜的转运,并有助于活性氧 (ROS) 的产生2,3。MMP 还影响线粒体形态和动力学4,包括线粒体自噬(线粒体的选择性降解)5和细胞凋亡(程序性细胞死亡)6。维持适当的 Ψm 对于细胞功能至关重要;其失调与许多病症有关,包括神经退行性疾病、心力衰竭和癌症。目前测量 Ψm 的方法主要基于亲脂性阳离子染料的使用,包括 TMRM(四甲基罗丹明甲酯)、TMRE(四甲基罗丹明乙酯)、罗丹明 123、番红霉素 O、罗丹明 800、DiOC6、JC-1 等7。然而,这些荧光分子有几个局限性。这些染料缺乏细胞特异性,易淬灭,有些有毒。此外,它们会随着时间的推移而扩散,当线粒体 ΔΨ 丢失时,它们会泄漏出来,使它们无法指示去极化线粒体的膜电位。此外,TMRM 和 TMRE 等基于罗丹明的染料对温度敏感8,因此需要仔细考虑温度对染料荧光的影响,尤其是在涉及细胞产热的生理活动期间测量线粒体膜电压时。
基因编码电压指示剂 (GEVI) 是一种能够通过荧光信号检测膜电位变化的蛋白质 9,10,已成为在各种细胞环境中监测膜电位的强大工具11。虽然 GEVI 已广泛用于研究质膜,但在使它们用于测量细胞内电位方面进展甚微,尤其是线粒体。该协议旨在通过使用线粒体靶向的 GEVI 来解决这一差距,这些 GEVI 可以在体外和体内监测线粒体膜电位。通过将线粒体信号序列添加到现有的 GEVI 中,适当的 GEVI 可以靶向线粒体12。这些线粒体电位指标 (MPI) 将为线粒体生理学提供新的见解,并为探索体内各种疾病状态下的线粒体功能提供重要潜力,增强我们对线粒体动力学如何促进正常和病理细胞过程的理解。
研究方案
所有动物护理和实验均按照郑州大学机构动物护理和使用委员会指南进行。使用前对所有手术器械进行消毒。遵循无菌技术以防止感染。获得所有数据后,使用过量的吸入麻醉剂对动物实施安乐死,然后斩首。
1. 体外 应用
- 质粒构建
- 从 Addgene 或从序列合成中获得动作电位 1 (ASAP1) 和 ASAP3 基因的加速传感器。(ASAP1,NCBI 登录 ID:AHV90412.1,Addgene ID:52519;ASAP3,Addgene ID:132331)。
- 使用 表 1 中列出的引物进行质粒构建。
- 对于细胞中的表达,使用 EGFPN1 载体进行构建。
- 最初,合成 cox8 基因序列 (NP_004065,氨基酸 1-29),具有四个串联重复序列 (4cox8),两侧是 NheI 和 XhoI 限制性位点。用 NheI 和 XhoI 消化合成的 4cox8 片段和 EGFPN1 载体,然后连接以生成 4cox8-EGFP 载体。
- 随后,使用引物 1 和引物 2 对 ASAP1 序列进行 PCR 扩增。用 SalI 和 NotI 消化 ASAP1 片段和 4cox8-EGFP 载体,然后连接以生成最终的 MPI-1 载体(MPI 代表线粒体电位指示剂)。
注意:CMV-MPI-1 的矢量图如图 1 所示。详细序列可从 NCBI (Accession ID: PQ678920) 获取。
- 对于神经元中的特异性表达,使用引物 3 和引物 4 对 AAV-hSyn-EGFP 质粒(NCBI 登录 ID:MH458079,Addgene ID:50465)的 hSyn 启动子序列进行 PCR 扩增。
- 用 AseI 和 NheI 消化 hSyn 序列和 4cox8-EGFP 载体,然后连接以生成 hSyn-4cox8-EGFP 载体。随后,使用引物 1 和引物 2 对 ASAP3 序列进行 PCR 扩增。
- 用 SalI 和 NotI 消化 hSyn-4cox8-EGFP 载体和 ASAP3 序列,然后连接以生成 hSyn-MPI-2 载体。
注:PCR 条件将根据特定酶和引物熔解温度 (Tm) 而有所不同。典型的 PCR 反应包括在 95 °C 下进行 30 秒的初始变性步骤,然后是 25-35 个变性循环(95 °C,10 秒)、退火(55 °C,30 秒)和延伸(72°C,30 秒/kb)。最后的延伸步骤在 72 °C 下持续 5 分钟可确保产物完全合成,然后在 4 °C 下保持。 退火温度应比引物的 Tm 低约 5 °C。请参阅制造商的说明以获得最佳 PCR 参数。ASAP1 和 ASAP3 的引物相同。
- 活细胞成像
- 通过向培养基中加入 10% 胎牛血清和 100 mg/L 青霉素/链霉素来制备 DMEM 培养基。
- 制备 Ca2+ 转染试剂:2.5 mol/L CaCl2、2x HEBS(274 mmol/L NaCl、10 mmol/L KCl、1.4 mmol/L Na2HPO4、15 mmol/L D-葡萄糖、42 mmol/L HEPES,pH 7.07)。
- 准备 Tyrode 缓冲液以在成像过程中维持细胞(145 mmol/L NaCl、3 mmol/L KCl、10 mmol/L HEPES、10 mmol/L 葡萄糖,pH 7.4)。
- 在 35 mm 培养皿中培养 Hela 细胞,培养皿中加入 DMEM 培养基,培养箱温度为 37 °C,气氛为 5% CO2/95% 空气。每个培养皿添加 2-3 个盖玻片,以使细胞在其上生长。
- 通过磷酸钙沉淀法转染 Hela 细胞。
- 要转染细胞,首先用 2 mL 无血清 DMEM 替换旧培养基。35 分钟后,通过在微量离心管中混合 10 μg DNA、4 μL CaCl2 和 ddH2O 至最终体积为 40 μL 来制备 DNA/Ca2+ 溶液。
- 在 DNA/Ca2+ 溶液中滴加 40 μL 2x HEBS,同时剧烈搅拌。用移液管将空气鼓泡到混合物中,以促进磷酸钙沉淀。
- 25 分钟后,将 80 μL 这种沉淀溶液添加到装有细胞的培养皿中,然后将其放回培养箱中再放置 1-2 小时。然后,去除非血清 DMEM,并用 15% 甘油(溶于 PBS)冲洗细胞 2 分钟。
- 吸出甘油后,加入 2 mL 含有 10% FBS 的 DMEM,并继续培养细胞 16-24 小时。
- 将装有细胞的盖玻片放入含有 2 mL Tyrode 缓冲液的 35 mm 培养皿中,向培养皿中加入 20 μmol/L 罗丹明 800(溶于 ddH2O)至终浓度为 50 nmol/L,用罗丹明 800 染料对细胞进行染色。
- 准备荧光显微镜并设置适当的滤光片和光源,以用 488 nm 光源激发蛋白质并收集 490-540 nm 之间的发射光。用 633 nm 光源激发罗丹明 800 染料,并收集 650-720 nm 之间的发射光。
- 制备 500 μM(原液)的羰基氰化物间氯苯腙 (CCCP) 溶液,并在成像过程中加入细胞至终浓度为 5 μM。
注:2x HEBS 溶液的 pH 值对于转染效率至关重要。应使用固体氢氧化钠小心调节 pH 值至 7.07。pH 值不能低于 7.01 或高于 7.12。

图 1:CMV-MPI-1 的矢量图。请单击此处查看此图的较大版本。
2. 体内 应用
- 质粒构建体
- 对于 体内 表达,使用 AAV 病毒进行转导。获得 AAV 包装的表达骨架(Addgene ID:46954 或 26968),其中包含用于 AAV 病毒包装的倒置末端重复序列 (ITR) 序列。
- 使用 表 1 中的引物 5 和 7 对 hSyn-MPI-2 载体(来自步骤 1.1.4)进行 PCR 扩增。
- 使用相同的模板和 表 1 中的引物 6 和 8 进行第二次 PCR 扩增。
- 使用来自第一次和第二次 PCR(步骤 2.1.2 和 2.1.3)的产物作为模板和 表 1 中的引物 5 和 8 进行最终 PCR,生成最终的 hSyn-MPI-2 序列。
- 用 MluI 和 EcoRI 消化 hSyn-MPI-2 序列和 pAAV 骨架,然后连接以生成最终的 pAAV-hSyn-MPI-2 构建体。pAAV-hSyn-MPI-2 的矢量图如图 2 所示。详细序列可从 NCBI 获取(Accession ID: PQ678919)。
注:hSyn-MPI-2 载体包含一个源自原始 EGFPN1 骨架的内部 EcoRI 位点,在重叠 PCR 策略中使用修饰的引物将其去除(步骤 2.1.2-2.1.4)。
- 病毒制备和转导
- 在 100 mm 培养皿中培养 HEK293t 细胞,该培养皿在 37 °C 的温度和 5% CO2/95% 空气的气氛中用 10% FBS DMEM 培养基喂养,以达到 70% 汇合。
- 使用磷酸钙沉淀法,用 AAV 基因质粒、衣壳(pAAV-DJ 或 pAAV9)和辅助质粒(pHelper)共转染 HEK293t 细胞。每个质粒的 DNA 量如下:基因:10 μg,pHelper:11 μg,衣壳:9 μg。转染试剂量:12 μL CaCl 2,120 μL 2x HEBS。
- 将转染的细胞孵育 72 小时以产生病毒。
- 孵育期后,通过以 400 g 离心机收获细胞。用 PBS 冲洗细胞 2 次,并将细胞重悬于 400 μL PBS 中。
- 用四次冻融法(37°C和-80°C)循环从细胞悬液中收获病毒。在 4 °C 下以 13,500 × g 离心裂解物并弃去沉淀。上清液含有 AAV 病毒。
- 进行实时 PCR 以确定制备病毒的滴定。AAV 滴定测定的详细方案可在 https://www.addgene.org/protocols/aav-titration-qpcr-using-sybr-green-technology/ 中找到。
- 将制备好的 AAV 病毒分装并储存在 -80 °C。
- 立体定向病毒注射
- 通过腹膜内注射以 30 mg/kg 的剂量麻醉体重 24-26 g 和 3% 戊巴比妥钠的成年 C57/BL 雄性小鼠。麻醉后,将小鼠固定在立体定位装置上,以在整个过程中保持稳定的位置。
- 涂抹兽用眼药膏以保护眼睛免受光损伤并保持眼睛湿润。
- 使用脱毛霜去除小鼠头上的毛发并露出头皮。
- 用手术剪刀打开头皮,露出头骨。用 3% 的过氧化氢处理颅骨,以消毒并可视化关键标志,例如前囟和 lambda 部位。
- 调整鼠标头部的位置,确保头骨水平。
- 使用可编程微量移液器拉拔器将玻璃移液器拉至所需的形状和尺寸,以进行精确注射。用石蜡油填充玻璃微量移液器。
- 将微量移液器放置在目标部位。在该协议中,目标是右侧的 M2 区域,使用以下坐标:AP(前后),+1.94 毫米;ML(中外侧),+0.75 毫米;DV(背腹),-1.5 毫米。
- 使用电钻在目标部位的颅骨上打一个小孔。
- 通过微量移液管的尖端以 1.5 x 1011 基因组拷贝/毫升 (GC/mL) 的滴度吸取 500 nL 病毒。使用注射泵以 100 nL/min 的流速将 500 nL 病毒注入目标部位。
- 注射后,将移液器留在原位约 5 分钟以允许扩散,然后小心地缩回。
- 将光纤(直径 200 μm,数值孔径 0.37,长度 2 mm)注入注射部位。
- 使用牙科粘结剂将光纤固定到位。
- 用 5-0 尼龙线(美容针 Δ1/2 4x12)缝合小鼠的头皮,然后将其放回笼子。
- 将家笼放在加热垫上,以保持鼠标的体温,直到它从麻醉中完全恢复。
- 一旦动物开始四处走动,请关闭加热垫。在将鼠标转移到住房设施之前,再适应室温 (RT) 2 小时。
- 家鼠在 22 °C 下进行 12 小时光照/12 小时黑暗循环,随意获取食物和水 2-3 周,以允许病毒表达。
- 光纤光度法
- 将植入鼠标中的光纤连接到光缆。
- 将光缆的另一端连接到将用于捕获成像数据的探测器。
- 对于成像,使用光源激发 488 nm 波长的蛋白质。设置检测器以收集波长范围为 490 nm 至 540 nm 的发射光。
- 调整激发光的强度以优化信号,而不会对脑组织造成损害。
- 修改荧光信号的增益,以确保检测器捕获清晰而强烈的信号。
- 为避免荧光快速漂白,这会降低成像质量,请根据需要微调荧光信号的光强度和增益。
- 进行鼠标行为测试。
- 在行为测试期间持续监测成像过程。
- 数据分析
- 使用 Python 和 GNUplot 创建实验试验的热图,以直观地表示数据。补充 文件 1 中提供了源代码。
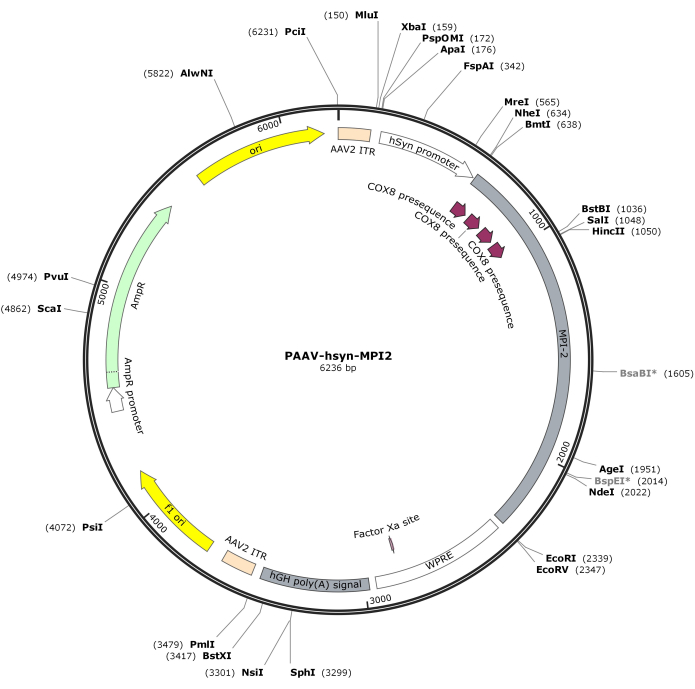
图 2:AAV-hSyn-MPI-2 的矢量图。请单击此处查看此图的较大版本。
结果
构建 CMV-MPI-1 质粒后,使用线粒体标志物 Rhodamine 800 在 Hela 细胞中测试其靶向线粒体的能力进行染色。共定位实验显示,MPI-1 的荧光信号与罗丹明 800 的信号高度重叠,表明 MPI-1 成功定位到线粒体(图 3)。

图 3:MPI-1 与 Hela 细胞中线粒体的共定位。 在 Hela 细胞中转染 CMV-MPI-1,并用线粒体膜电位敏感染料罗丹明 800 染色。比例尺:5 μm。 请点击此处查看此图的较大版本。
将 MPI-1 转染到 HeLa 细胞中后,通过引入线粒体解偶联剂 CCCP (羰基氰化物间氯苯腙) 来测试细胞的电压敏感性。向细胞中添加 CCCP 导致线粒体去极化。使用电压敏感染料 (rhodamin800),可以观察到电压敏感染料 (rhodamin800) 或 MPI-1 的荧光减弱(图 4)。
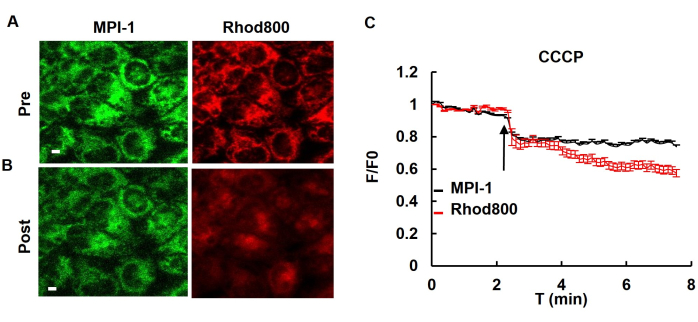
图 4:响应 CCCP 处理的电压敏感荧光变化。(A) 在加入浓度为 5 μM 的解偶联剂 CCCP 前后稳定表达 MPI-1 的 HeLa 细胞的荧光图像。罗丹明 800 用作线粒体膜电位的传统指标。比例尺:5 μm。CCCP 应用后 MPI-1 和罗丹明 800 的荧光强度变化 (n = 14 个细胞)。缩写: T: 时间。此数字经 Yang 等人 12 许可进行了修改。请单击此处查看此图的较大版本。
将 hSyn-MPI-2 AAV 病毒注射到小鼠的 M2 皮层后,在异氟醚诱导的麻醉期间监测荧光变化。麻醉后 MPI-2 的荧光减弱(图 5),表明在此过程中 MMP 减少。
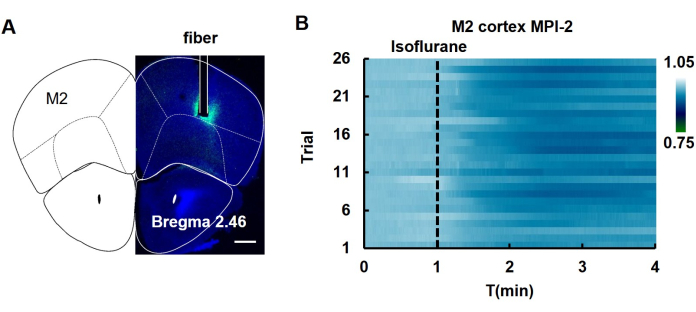
图 5:异氟醚诱导麻醉期间 M2 皮层中 MPI-2 的 体内 纤维光度测定。 (A) 显示病毒注射后脑切片荧光的图像。纤维植入的区域用白线标记。荧光图像与小鼠脑图相结合,以显示注射的位置。比例尺:500 μm。(B) 在异氟醚诱导麻醉的多项试验中观察到的 MPI-2 荧光变化(n = 26 项试验,涉及 5 只小鼠)。缩写: T: 时间。虚线显示异氟醚的应用时间。此数字经 Yang 等人 12 许可进行了修改。 请单击此处查看此图的较大版本。
| 不。 | 引物名称 | 序列(5'->3') | ||||
| 1 | ASAP(SalI)-FP | ACGCGTCGACGatggagacgactgtgaggtatgaacagg | ||||
| 2 | ASAP(NotI)-RP | AAAAGGAAAAGCGGCCGCttaggttaccacttcaagttgtttcttctgtgaag | ||||
| 3 | hSyn(AseI)-FP | atgcattaattgtacagtgtctagactgcagagggc | ||||
| 4 | hSyn(NheI)-RP | ctaGCTAGCctgcgctctcaggcacgacacgactcc | ||||
| 5 | hsyn(MluI)-FP | agctacgcgtgtgtctagactgcagagggccctgcgt | ||||
| 6 | 删除-internal_EcoRI-FP | GAGCTCAAGCTTCGAATACTGCAGTCGACG | ||||
| 7 | 删除 internal_EcoRI RP | CGTCGACTGCAGTATTCGAAGCTTGAGCTC | ||||
| 8 | 尽快 (EcoRI)-RP | cggaattcttaggttaccacttcaagttgtttcttctgtgaag | ||||
表 1:质粒构建的引物。
补充文件 1:数据分析的源代码。请点击此处下载此文件。
讨论
线粒体膜电压在静息条件下维持在 -120--180 mV,并随代谢状态的变化而波动。目前,可以使用电生理学方法和荧光染料方法进行线粒体膜电位的测量。线粒体膜片钳需要分离线粒体和破坏细胞结构13。这种方法可能会导致测量结果偏离生理条件。荧光探针法是 MMP 测量的常用方法。然而,这些荧光分子不能对特定细胞进行染色,容易猝灭,并且某些染料有毒。此外,由于其固有的局限性,这些染料不适合 体内应用, 包括在较长的时间尺度 (~30 分钟) 内缺乏细胞特异性和平衡。
该协议提供了一种监测 MMP 的新方法,尤其是在 体内。这种方法的关键是通过将线粒体的 N 端与线粒体靶向信号融合,找到合适的 GEVI,该 GEVI 可以靶向线粒体。以前的研究表明,一些 GEVIs,如 Arclight 和 SomArchon,未能定位到线粒体12。然而,加速动作电位传感器 (ASAP) 蛋白家族可以通过将它们融合到线粒体靶向信号来靶向线粒体12。
该方案的初始阶段涉及构建具有 COX8 四次重复序列的质粒,由于其重复性,这无法通过 PCR 进行。相反,采用 DNA 合成或酶联方法来创建 4cox8 序列。其他线粒体靶向序列14 也可能是合适的,这需要共定位分析。AAV 的包装对于后续的 体内 应用至关重要。AAV 的滴定必须适当,以确保有效转染而不会引起毒性。为了提高疗效,需要进行优化转染条件等修改。这可以通过调整 DNA 和转染试剂的数量来实现,从而提高转染效率。对于钙沉淀转染,HEBS 的 pH 值至关重要。它不能低于 7.01 或高于 7.12。
MPI 在几个方面优于传统的 MMP 染料。它允许实时监测 MMP 变化,这是传统染料由于需要平衡时间而缺乏的功能。MPI 的遗传编码还支持细胞类型特异性表达,绕过传统染料的非特异性。此外,即使在去极化后,MPI 也能保持其线粒体靶向,这与传统染料不同,传统染料在这种情况下会失去线粒体靶向。此外,MPI 的稳定线粒体靶向使其成为 体内 成像应用的绝佳候选者。
尽管 MPI 具有优势,但它仍存在一定的局限性。光漂白是荧光蛋白的一个常见问题,可能是 MPI 的一个问题。这可以通过在成像过程中尽量减少曝光来部分缓解。此外,MPI 和其他荧光团之间可能存在光谱重叠,因此需要仔细选择用于多色成像的滤光片。背景荧光是一个需要注意的因素。为了解决这个问题,可以用线粒体靶向的 mCherry 共转染细胞。此策略有助于在监控过程中区分真实信号和误报。当前版本的 MPI 与其他用于检测神经元质膜电压变化的 GEVI 一样,只能监测线粒体膜电位的波动,而不能监测绝对值。为了校准信号并将其转换为以伏特为单位的实际膜电位值,涉及与另一种荧光蛋白融合的比率度量方法15 是很有前途的。随着 ASAP 蛋白家族的不断发展16,我们预计灵敏度会进一步提高。这为将来开发更敏感的 MPI 提供了令人兴奋的可能性。
MPI 为生物能量学、线粒体动力学和疾病建模等各个领域的研究带来了重大前景。在神经科学中,它可用于监测神经元中的 MMP,为与线粒体功能障碍相关的神经退行性疾病提供见解。在心脏病学中,MPI 的高电压敏感性使其适用于研究缺血和心力衰竭模型中的心脏线粒体。此外,在癌症研究中,MPI 可用于研究癌细胞的生物能量变化特征,有助于更好地了解这种复杂的疾病。
披露声明
作者没有什么可披露的。
致谢
我们感谢中国国家自然科学基金 (NSF) JSK(32071137 和 92054103)的支持以及郑州大学第一附属医院科学研究和创新团队 JSK (ZYCXTD2023014) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| BamHI | Thermo | FD0054 | |
| Calcium chloride | Sigma | C4901 | |
| CCCP | Sigma | C2759 | |
| Centrifuge | eppendorf | 5430R | |
| Centrifuge (cell culture) | eppendorf | 5810R | |
| CO2 cell incubator | ESCO | 170L IR Sensor | |
| Coverslips | Glaswarenfabrik Karl Hecht GmbH & Co.KG | 92100100030 | |
| Dental adhensive resin cement | Sun medical company, LTD. | Super-Bond C&B Kit | |
| D-glucose | Sigma | G7021 | |
| DNA Ligation Kit Ver. 2.1 | Takara | 6022 | |
| Dulbecco's modified Eagle medium | Gibco | 11965092 | |
| Electric drill | RWD Instruments | 78001 | |
| Fetal bovine serum | Gibco | A5670701 | |
| Fiber optic cannula | RWD Instruments | R-FOC-L200C-39NA | |
| Fiber photometry detector | Thinker | QAXK_FPS-TC-MC-LED | |
| Fluorescence microscope | Olympus | IX83 | |
| Glass pipette (for injection) | Drummond Scientific company | 3.5" Drummond # 3-000-203-G/X | |
| HEK293t | ATCC | Cat# CRL-3216 | |
| Hela cells | ATCC | Cat# CCL-2 | |
| HEPES | Sigma | H3375 | |
| Injection pump | Drummond Scientific company | 3-000-207 | |
| Isoflurane | RWD Instruments | R510-22 | |
| Laser scanning confocal microscope | Zeiss | LSM980 | |
| MluI | Thermo | FD0564 | |
| NheI | Thermo | FD0974 | |
| Optical fibers | RWD Instruments | R-FC-L-N3-200-L1 | |
| Paraffin oil | Sangon | B500301 | |
| PCR thermal Cycler | analytik jena | Biometra Tone 96G | |
| Pentobarbital sodium | Sinopharm Chemical Reagent Co.LTD | 57-33-0 | |
| Potassium chloride | Sigma | P5405 | |
| PrimeSTAR HS DNA Polymerase | Takara | R010A | |
| Programmable micropipette puller | Sutter Instruments | P2000 | |
| Quick self-curing acrylic resin | Yamahachi | V-PINK | |
| Real-time PCR thermal Cycler | analytik jena | qTOWER³ auto | |
| Rhodamine 800 | Sigma | 83701 | |
| SalI | Thermo | FD0644 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium phosphate dibasic | Sigma | S9763 | |
| Stereotaxic apparatus | RWD Instruments | E06354 | |
| Veterinary ophthalmic ointment | Puralube | NA | |
| XhoI | Thermo | FD0694 |
参考文献
- Vyas, S., Zaganjor, E., Haigis, M. C. Mitochondria and cancer. Cell. 166 (3), 555-566 (2016).
- Dzbek, J., Korzeniewski, B. Control over the contribution of the mitochondrial membrane potential (ΔΨ) and proton gradient (ΔpH) to the protonmotive force (Δp): IN SILICO STUDIES. J Biol Chem. 283 (48), 33232-33239 (2008).
- O'Rourke, B., Cortassa, S., Aon, M. A. Mitochondrial ion channels: Gatekeepers of life and death. Physiology. 20 (5), 303-315 (2005).
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol. 22 (1), 79-99 (2006).
- Jin, S. M., Lazarou, M., Wang, C., Kane, L. A., Narendra, D. P., Youle, R. J. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. J Cell Biol. 191 (5), 933-942 (2010).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Meng, X. -. Y., et al. A sensitive mitochondrial thermometry 2.0 and the availability of thermogenic capacity of brown adipocyte. Front Physiol. 13, 977431 (2022).
- Kaestner, L., et al. Genetically encoded voltage indicators in circulation research. Int J Mol Sci. 16 (9), 21626-21642 (2015).
- Yang, H. H., St-Pierre, F. Genetically encoded voltage indicators: Opportunities and challenges. J Neurosci. 36 (39), 9977 (2016).
- Sepehri Rad, M., Cohen, L. B., Braubach, O., Baker, B. J. Monitoring voltage fluctuations of intracellular membranes. Sci Rep. 8 (1), 6911 (2018).
- Yang, R. -. Z., Wang, D. -. D., Li, S. -. M., Liu, P. -. P., Kang, J. -. S. Development and application of a mitochondrial genetically encoded voltage indicator in narcosis. Neurosci Bull. 40 (10), 1529-1544 (2024).
- Kumari, A., Nguyen, D. M., Garg, V. Patch-clamp technique to study mitochondrial membrane biophysics. J Gen Physiol. 155 (8), e202313347 (2023).
- Bayne, A. N., Dong, J., Amiri, S., Farhan, S. M. K., Trempe, J. -. F. MTSviewer: A database to visualize mitochondrial targeting sequences, cleavage sites, and mutations on protein structures. PLoS One. 18 (4), e0284541 (2023).
- Kim, B. B., et al. A red fluorescent protein with improved monomericity enables ratiometric voltage imaging with ASAP3. Sci Rep. 12 (1), 3678 (2022).
- Evans, S. W., et al. A positively tuned voltage indicator for extended electrical recordings in the brain. Nat Methods. 20 (7), 1104-1113 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。