Method Article
Очистка саркоэндоплазматического ретикулума Ca+-АТФазы из мышц кролика
В этой статье
Резюме
Этот протокол описывает усовершенствованный метод очистки SERCA, который включает в себя дисахарид трегалозу на заключительной стадии центрифугирования. Этот углевод стабилизирует белки в суровых условиях. Очищенный SERCA был каталитически активным и демонстрировал высокую чистоту, что делало его пригодным для структурных и функциональных исследований.
Аннотация
Некоторые АТФазы Р-типа, такие как сарко/эндоплазматический ретикулум Ca2+-АТФаза (SERCA), по своей сути являются лабильными мембранными белками, которые требуют определенных физико-химических условий при очистке для получения их с высокой чистотой и структурным качеством и в каталитически активной форме. Дисахарид трегалоза является совместимым растворенным веществом, которое синтезируется и накапливается в высоких концентрациях в цитоплазме дрожжей для стабилизации мембран и белков. Использование трегалозы в качестве добавки в протокол очистки плазматической мембраны Н+-АТФазы позволяет получить высококачественный препарат, гексамерная структура которого показана биохимическими аналитическими методами. Таким образом, трегалозу можно использовать в качестве стабилизирующей добавки для очистки мембранных белков (Р-АТФаз). Данный протокол описывает модификацию классического протокола очистки SERCA путем центрифугирования SERCA на градиенте концентрации трегалозы. Включение этого углевода привело к очистке SERCA в каталитически активную форму с высокой чистотой и, что немаловажно, в стабильную форму. Частичная биохимическая характеристика очищенного SERCA (SDS-PAGE, кинетика фермента, мечение FITC, спектроскопия кругового дихроизма) показала, что фермент пригоден для функциональных и структурных исследований. Предложено использование трегалозы в протоколе очистки АТФаз Р-типа и других лабильных мембранных (и цитозольных) белков.
Введение
Мембранные белки/ферменты являются важными биологическими компонентами клеток, поскольку они играют важнейшую роль в различных процессах 1,2,3. Некоторые из функций могут включать транспортировку ионов и молекул внутрь и из клетки/внутренних компартментов (активный/пассивный), межклеточное распознавание, межклеточное связывание, закрепление/прикрепление и восприятие внешней среды путем интеграции с механизмом передачи сигнала в нормальных и суровых физических и химических условиях (высокое содержание соли, низкое содержание воды, высокая температура, устойчивость к лекарственным препаратам, и т.д.)3 Таким образом, определение трехмерной (3D) структуры мембранных белков и/или ферментов приобрело большое значение как для фундаментальных, так и для прикладных исследований 4,7,6. Важно отметить, что мембранные белки/ферменты широко используются в качестве мишеней для разработки лекарств (как естественных, так и преднамеренных)7,8,9. То есть, мембранные белки имеют неотъемлемое значение для здоровья 9,10,11.
Гидрофобный характер мембранных белков/ферментов является наиболее технически сложным физико-химическим свойством для экспериментальной лаборатории 12,13,14, особенно при работе с олигомерными и/или высоколабильными интегральными мембранными белками 15,16. Выделение соответствующих количеств мембранного белка/фермента с максимально возможным качеством для функциональных экспериментальных анализов и структурных исследований крайне желательно17. Мембранные белки, будучи по своей природе гидрофобными, очень трудно поддаются очистке, и выбор моющего средства обычно является одним из самых важных вопросов, которые следует учитывать 17,18,19,20. В связи с этим лабораторные методы, используемые для выделения мембранных белков, обычно вызывают некоторую степень повреждения трехмерной структурной структуры белка21. Некоторые из этих методов включают использование (а) ультразвуковых волн высокой частоты/энергии), (б) растворяющих белки детергентов (жестких, средних или щадящих)22, (в) относительно высоких давлений в колоночной хроматографии и высокоскоростном ультрацентрифугировании23, (г) осаждающих молекул, (д) пищеварительных ферментов и др.21. Все эти процессы могут способствовать или быть основной причиной дестабилизации белка при очистке21. В этом отношении некоторые протоколы, по-видимому, работают относительно хорошо для данного мембранного белка. Тем не менее, оптимизация всегда приветствуется при использовании новых современных анализов или методов, требующих более высокого качества мембранного белкового препарата для получения удовлетворительных результатов24. Этапы оптимизации могут включать, но не ограничиваться ими, улучшение конструкции конструкции, поиск оптимальных условий для экспрессии мембранных белков, установление лучших условий обработки (т.е. pH, температуры и т.д.), поиск наиболее совместимого моющего средства, корректировку этапов очистки, таких как время ультразвуковой обработки, скорость центрифугирования, изменение рецептуры буферных растворов путем добавления стабилизирующих агентов и т.д.25,26,27. Поэтому любое изменение в методике очистки, которое приводит к повышению качества (чистоты) и активности очищенного мембранного белка/фермента, имеет важное значение.
В семействе АТФаз Р-типа плазматическая мембрана дрожжей H+-АТФаза, по-видимому, является одним из наиболее лабильных членов28,29. H+-АТФаза теряет свою гидролизующую активность АТФ при дегидратации (сублимационной сушке), тепловом шоке и т.д.28,29. Использование трегалозы в качестве стабилизатора белка было опробовано при выделении плазматической мембраны Н+-АТФазы из дрожжей K. lactis30,31; полученный препарат H+-АТФазы отличался высокой чистотой и каталитически активен. Важно отметить, что это позволило определить олигомерное состояние фермента биохимическими методами, показав, что он является гексамером, и позже подтвердить его с помощью криоэлектронной микроскопии 31,32,33,34,35. Таким образом, представляется вероятным, что тонкое трехмерное (3D) расположение мембранных белков может быть утрачено в относительно суровых условиях во времяочистки. Кинетика двухфазной инактивации наблюдается для H+-АТФазы во время термоопосредованной инактивации29. В дрожжевых клетках, как и во многих других организмах, дисахарид трегалоза накапливается в высоких концентрациях в условиях стресса окружающей среды 37,38,39. Трегалоза поддерживает целостность мембраны и транспортную функцию, стабилизируя белки (как мембранные, так и цитозольные) и клеточные мембраны40,41. Стабилизирующий механизм трегалозы был широко изучен несколькими группами и нашей лабораторией 42,43,44,45. Эксперименты с Н+-АТФазой и другими ферментами показали, что трегалоза является наиболее эффективным стабилизатором белка среди моно- и дисахаридов28,29. Это привело к его включению в протокол очистки H+-АТФазы30. В последнее время трегалоза также используется для очистки саркоплазматического ретикулума Ca+-АТФазы (SERCA) из быстро сокращающейся мышцы кролика с хорошими результатами по чистоте и активности белка46. Таким образом, трегалоза представляется хорошей и подходящей добавкой для очистки АТФаз Р-типа и, вероятно, других мембранных и цитозольных белков.
Для-АТФаз существование структурных цитоплазматических доменов является экспериментальным преимуществом, особенно для исследований взаимодействия субстрата и лиганда47; Связывание АТФ было изучено в высокочистых рекомбинантных N-доменах47,48,49, что устраняет технические соображения по очистке ферментов целой мембраны 47,48,50, в том числе51. К сожалению, некоторые функциональные (каталитическое/энергетическое преобразование) и структурные (расположение субъединиц и взаимодействие с другими белками) исследования все еще требуют полной Р-АТФазы52,53. В связи с этим очистка SERCA была достигнута несколькими исследовательскими группами 54,55,56,57,58. Тем не менее, усовершенствования все еще могутбыть реализованы, например, увеличение интактности очищенной АТФазы59, предотвращение денатурации белка/разрушения белковых комплексов25, повышение солюбилизации без денатурации мембранного белка (т.е. предотвращение образования высокомолекулярных агрегатов)60, улучшение совместимости с анализами и другими последующими аналитическими методами61 Кроме того, поскольку в научной литературе появляются новые экспериментальные стратегии, добавки, ингибиторы ферментов и т.д. 61,62,63,64,65,66, их иногда необходимо тестировать с целой Р-АТФазой. В данной работе описан протокол очистки SERCA и использование трегалозы в качестве добавки для стабилизации структуры белка и активности АТФазы; Т.е., помимо повышения ферментного (структурного) качества, трегалоза помогает предотвратить потерю структуры и активности фермента при выделении и хранении фермента, что способствует сохранению биологического материала и тем самым уменьшению количества ферментных очисток.
протокол
Все процедуры на животных выполнялись в соответствии с международными и местными (NORMA Oficial Mexicana NOM-062-ZOO-1999) рекомендациями по обращению с животными в экспериментальных лабораториях 51,67,68. Мышечная ткань была получена от дикого вида Oryctolagus cuniculus из местного подразделения по обработке животных (INE/CITES/DGVS-ZOO-E0055-SLP-98)46. Ветеринарный врач с опытом работы с лабораторными животными провел первоначальное рассечение и обработку мышц. Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Выделение саркоплазматического ретикулума из быстро сокращающейся мышцы кролика (Тайминг, 7 - 9 ч)
ПРИМЕЧАНИЕ: Для получения подробной информации о процедуре обратитесь к Champeil et al.69.
- Получите быстро сокращающуюся мышечную ткань (~70 г с обеих задних ног на животное) от дикого типа Oryctolagus cuniculus.
ПРИМЕЧАНИЕ: Требуется предварительная визуальная идентификация мышц, подлежащих рассечению, 70,71. - Измельчите быстро сокращающуюся мышцу в блендере, суспензировав ее в трех объемах по 100 мМ KCl, с 1 минутой на и 1 минутой на ледяном отдыхе, повторите три разапо 72.
- Удалите остатки ткани центрифугированием (1500 × г) при 4 °C в течение 5 минут; При необходимости проводится повторное центрифугирование (4200 × г).
- Соберите надосадочную жидкость и гомогенизируйте ее с помощью тканевого измельчителя (10 ударов при низкой скорости, т.е. 500-1 500 об/мин)72,73. Центрифугируйте гомогенат (10 000 × г) при 4 °C в течение 15 минут.
ПРИМЕЧАНИЕ: Необходимо соблюдать осторожность при гомогенизации, так как использование относительно высокой скорости может привести к повреждению системы и оператора. - Центрифугировать надосадочную жидкость (содержащую саркоплазматический ретикулум) (33 000 × г) при 4 °С в течение 120 мин.
- Суспензировать гранулы в 40 мл 0,5 М сахарозы и центрифугировать (12 000 × г) при 4 °C в течение 15 минут. Разбавляют надосадочную жидкость (0,6 М KCl и 0,15 М сахарозы) и центрифугируют суспензию (34000 × г) при 4°С в течение 165 мин.
- Суспендируйте гранулу, содержащую листы везикул саркоплазматического ретикулума (SRV), в 0,3 М сахарозы, 0,1 М KCl и 5 мМ Tris-HCl, pH 7,0. Определите концентрацию белка с помощью анализа Лоури74 и сывороточного альбумина человека в качестве стандарта белка.
- Аликвотируйте SRV (30-32 мг/мл) в объеме 1 мл. Храните образцы SRV при температуре -72 °C для дальнейшей обработки.
ПРИМЕЧАНИЕ: Выход белка составляет 100-110 мг SRV на животное.
2. Очистка SERCA (Время, 18 - 20 часов)
ПРИМЕЧАНИЕ: Для получения подробной информации о процедуре обратитесь к Rivera-Morán et al.46.
- Разбавьте суспензию SRV до 2 мг белка/мл с помощью ледяных 75 мМ Tris-HCl, pH 7,2, 0,6 M KCl, 6 мМ ЭДТА, 1 мМ EGTA и 0,1% (w/v) дезоксихолата (DOC). Инкубировать суспензию СРВ на льду в течение 10 мин при слабом перемешивании. Центрифугировать суспензию SRV (100 000 × г) при 4 °C в течение 60 мин.
ПРИМЕЧАНИЕ: DOC следует добавлять по каплям. - Суспендируйте гранулы в <3 мл 25 мМ Tris-HCl, pH 7,5, 0,3 М KCl, 45% глицерина (v/v) и 2 мМ ЭДТА. Гомогенизируйте суспензию и доведите до конечного объема 10 мл. Определите концентрацию белка, а затем отрегулируйте ее до 6,5 мг/мл. Добавьте азолектин в дозе 5 мг/мл и 0,85 (масс./масса) Цвиттергент 3-14.
ПРИМЕЧАНИЕ: Азолектин и Цвиттергент 3-14 следует добавлять по каплям. - Гомогенизируйте суспензию и центрифугу (100 000 × г) при 4 °C в течение 60 минут. Соберите надосадочную жидкость и разведите 1:2 с 2 мМ EGTA (pH 7,2).
- Аккуратно влейте суспензию на прерывистый градиент концентрации трегалозы (45, 40, 35 и 30% по массе) в 10 мМ трис-HCl, pH 7,0, 1 мМ ЭДТА, 0,1% дезоксихолата и 1 мг/мл азолектина. Центрифуга (100 000 × г) при 4 °C в течение 14 ч. Соберите прозрачные, слегка желтоватые гранулы, образовавшиеся на дне трубочек.
Примечание: Как формирование градиента трегалозы, так и добавление суспензии образца должны быть выполнены с использованием соответствующих методов. Рекомендуется центрифугирование в течение ночи. - Осторожно суспендируйте гранулу в небольшом объеме (<1,5 мл): 25 мМ Tris-HCl, pH 7,5, 0,3 M KCl, 45% глицерина и 2 мМ ЭДТА. Определите концентрацию белка. Отрегулируйте концентрацию белка путем разведения до 2 мг/мл. Возьмите аликвоты (~50 μл) суспензии и храните очищенную SERCA при температуре −72 °C до ее использования.
- Выполните SDS-PAGE очищенного SERCA72, а также образцов белка, взятых на разных ступенях очистки. Окрасьте гель Coomassie Blue72.
Использование 0,6 М трегалозы вместо глицерина в суспензионном буфере повышает стабильность фермента во время циклов хранения и замораживания-размораживания28,29.
3. Анализ на активность АТФазы (время, 1 - 2 ч)
- Ферментный анализ: АТФаза-пируваткиназа-лактатдегидрогеназа
- Готовят реакционную смесь (1 мл): 50 мМ MOPS (pH 7,0), 1 мМ EGTA, 80 мМ KCl, 5 мМ MgCl2, 3 мМ CaCl2, 5 мМ фосфоенолпируват, 250 мкМ NADH. Включите переменные концентрации АТФ (от 0,001 до 0,25 мМ).
- Тщательно гомогенизируйте реакционный анализ путем вортексирования. Инкубируйте анализ реакции при температуре 37 °C в течение 10 мин. Добавьте 0,9 Ед L-лактатдегидрогеназы (ЛДГ) и 1,5 Ед пируваткиназы (ФК).
- Инициируют АТФазную реакцию добавлением 10 мкг SERCA.
- Определите образование НАДН. Отслеживайте изменение интенсивности поглощения каждую секунду в течение 600 с на длине волны (λ) 340 нм с течением времени с помощью спектрофотометра с термостатным держателем ячейки.
Примечание: Временной интервал для измерения абсорбции может варьироваться, но постарайтесь записать как можно больше точек данных, чтобы провести начальную прямую линию АТФазной реакции.
- Определение скорости гидролиза АТФ
ПРИМЕЧАНИЕ: Для получения подробной информации о процедуре обратитесь к Rivera-Morán et al.46.- Рассчитайте величину наклона (Δabs/min) линейной части в каждой формируемой кривой. Используйте коэффициент угасания моляров (ε) НАДН (λ = 6,220 М−1·см−1) для определения активности АТФазы (μмоли гидролизованной АТФ/мин.мг прот.)
- Определение параметров кинетики Km и Vmax
- Построение графика зависимости данных о скорости от концентрации АТФ с помощью программного обеспечения для анализа данных и построения графиков.
- Подгоним данные с помощью нелинейной регрессии к уравнению Михаэлиса-Ментена (уравнение 1)46:
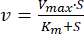
где v — скорость, Vmax — максимальная скорость, [S] — концентрация АТФ, а Km — постоянная Михаэлиса-Ментена. - Определите Km и Vmax с помощью итерации.
ПРИМЕЧАНИЕ: Включение DOC может увеличить реакцию АТФазы; Для поиска оптимальной концентрации рекомендуется проводить тестирование различных концентраций РОУ.
4. Мечение SERCA флуоресцеином изотиоцианатом (FITC) (время, 30 - 45 мин, только для мечения FITC)
ПРИМЕЧАНИЕ: Для получения подробной информации о процедуре см. 54,75,76.
- Суспендируйте SERCA (20 мкг) в 50 мкл (конечный объем) меченого буфера (100 мМ KCl, 5 мМ MgCl2 и 30 мМ Tris-HCl, pH 8,9), содержащем 1 мМ FITC. Перемешайте путем вортексинга.
- Инкубируйте образцы в разное время (15 мин, 10 мин, 7 мин, 5 мин и 2 мин) в темноте и при комнатной температуре.
- Остановите реакцию мечения, добавив 1 объем ледяного буфера (480 мМ сахарозы и 48 мМ MOPS, pH 7,0), содержащего АТФ (5 мМ). Выдерживать на льду в течение 5 минут в темноте.
- Подчините SERCA с маркировкой FITC паспорту безопасности (стр.72). Подвергайте прозрачные гели воздействию ультрафиолетового излучения (λ = 302 нм). Задокументируйте результат на фото.
- Окрасьте гель синим цветом Кумасси. Задокументируйте результат на фото.
ПРИМЕЧАНИЕ: Выполнение маркировки FITC в темной комнате может улучшить качество флуоресцентного сигнала.
5. Спектры кругового дихроизма (CD) (Хронометраж, 30 мин)
ПРИМЕЧАНИЕ: Для получения подробной информации о процедуре см.11,77.
- Суспендировать SERCA (3 мкМ) в 400 мкл 10 мМ фосфатного буфера (pH 7,0) при 25 °C.
- Загрузите образец в ячейку с длиной пути 0,1 см. Заданные дальние УФ-спектры λ находятся в диапазоне 190-260 нм. Установите внутреннее разрешение и пропускную способность на 1 нм.
- Запишите сигнал CD со скоростью 50 нм/мин при 25 °C.
Результаты
SDS-PAGE SERCA-на разных стадиях очистки (Рисунок 1). Окрашенный в синий цвет гель Coomassie демонстрирует обогащение белковой полосы SERCA (кажущаяся молекулярная масса >100 кДа) по мере прохождения протокола очистки. Белковая полоса, соответствующая SERCA, показывает чистоту >90% после центрифугирования на градиенте концентрации трегалозы. График зависимости скорости гидролиза АТФ от концентрации АТФ (Рисунок 2A). Кинетика АТФазы Михаэлиса-Ментена (гиперболическая картина) наблюдается для очищенного SERCA. График Лайнвивера-Берка данных на рисунке 2А (рисунок 2В). На графике значение Km для SERCA (10 μM) получено из x-пересечения (K m-1), которое аналогично тому, которое было обнаружено в предыдущих исследованиях 25,78,79. Маркировка SERCA с помощью FITC (Рисунок 3). После маркировки SERCA подвергается обработке SDS-PAGE. Затем прозрачный гель подвергается воздействию ультрафиолетового излучения, чтобы обнажить флуоресцентную полосу SERCA-FITC (Рисунок 3A). Мечение SERCA методом FITC указывает на наличие интактного сайта связывания нуклеотидов; это связано с тем, что мечение SERCA методом FITC зависит от правильного расположения аминокислотных остатков для связывания с FITC для последующей химической реакции с остатком лизина (Lys) 47,54,80. То есть маркировка FITC происходит только в правильно сложенном SERCA47; На рисунке 3B белок SERCA, окрашенный Coomassie Blue, точно соответствовал белку FITC (рисунок 3B). Спектр кругового дихроизма (CD) SERCA представлен на рисунке 4A. Содержание вторичной структуры SERCA определяется путем анализа спектра CD 27,47,81.
Примечательно, что SRV содержат большое количество SERCA; высокий процент (73%) белка в везикулах соответствует SERCA (рис. 1B). После ультрацентрифугирования на градиенте концентрации трегалозы чистота SERCA увеличилась до более чем 90% (рис. 1В); Т.е. большая часть сопутствующих белков была удалена в ходе этого процесса. Программное обеспечение imageJ (https://imagej.net/ij/)82 и Origin использовалось для сбора и анализа данных (гауссова мультипиковая аппроксимация) соответственно. Препарат SERCA отличается высоким структурным качеством (Рисунок 1 и Рисунок 4); Можно проводить анализы белок-белковых взаимодействий, титрование сайта связывания АТФ можно контролировать по изменениям в спектре DC, а также можно рассчитать аффинность нуклеотидов46. Каталитическая активность, проявляемая очищенным SERCA (рис. 2), может быть использована для тестирования любых физических и химических условий, которые могут изменить активность (структуру) АТФазы фермента. Кроме того, могут быть проверены исследования переноса ионов в везикулах и преобразования химической энергии в потенциальную ферментом. Кроме того, могут быть проведены испытания ингибиторами, как натуральными, так и синтетическими. В этом контексте интактность нуклеотид-связывающего сайта наглядно демонстрируется с помощью мечения FITC (рис. 3); Могут быть проведены эксперименты по изучению структуры активного центра в различных условиях и на наличие потенциальных взаимодействующих агентов.

Рисунок 1: SDS-PAGE и денситометрический анализ. (A) SDS-PAGE саркоплазматического ретикулума Ca+-АТФазы (SERCA). SERCA был очищен из изолированных саркоплазматических везикул (СРВ) из быстро сокращающихся мышц кролика. После центрифугирования на градиенте концентрации трегалозы собирали гранулы (содержащие SERCA чистотой >90%). Рисунок адаптирован из Rivera-Morán et al.46. (B) Денситометрический анализ изолированных полос SRV и SERCA в (A). Красными линиями являются наборы экспериментальных данных (с коррекцией базовых линий), сгенерированные программным обеспечением ImageJ после анализа полос SRV и SERCA, а черные и синие линии представляют многопиковую гауссову аппроксимацию; Результаты включаются в виде таблиц-вставок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
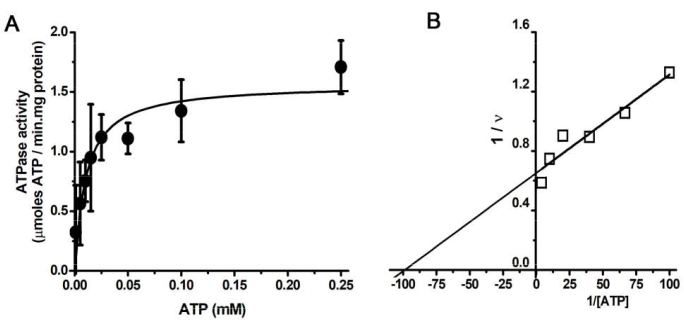
Рисунок 2: Гидролиз АТФ методом SERCA. (A) График зависимости скорости АТФазы от концентрации АТФ. Отслеживали скорость гидролиза АТФ (абсорбция НАДН на длине волны 340 нм) в ферментативном анализе, состоящем из пируваткиназы и лактатдегидрогеназы. Точки данных являются средним значением трех независимых экспериментов ± стандартным отклонением. (B) График Лайнвивера-Берка данных в А. Точка пересечения прямой по оси x — это значение K m-1 для SERCA. Рисунок адаптирован из Rivera-Morán et al.46. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
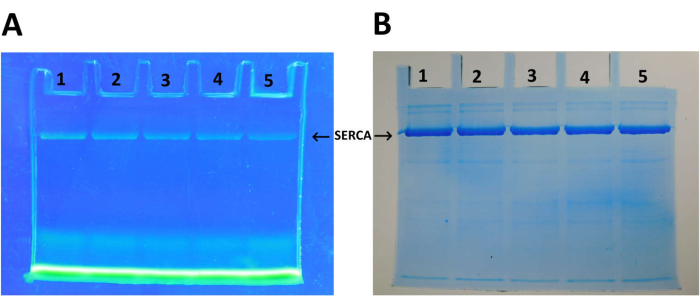
Рисунок 3: Маркировка SERCA FITC. (A) SERCA, маркированная FITC, во время инкубации: (1) 15 мин, (2) 10 мин, (3) 7 мин, (4) 5 мин и (5) 2 мин подвергали воздействию SDS-PAGE. Флуоресценция SERCA-FITC наблюдается в прозрачном геле после воздействия ультрафиолетового излучения. (В) Кумасси синее пятно геля в (А). Рисунок адаптирован из Rivera-Morán et al.46. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 4: Спектр циркулярдихроизма (CD) SERCA. Спектр CD SERCA (3 мкМ), взвешенный в 10 мМ фосфатного буфера, pH 8,0. Рисунок адаптирован из Rivera-Morán et al.46. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Большинство молекул и ионов не могут свободно пересекать клеточные мембраны, например, протону (H+) требуется мембранный транспортер в плазматической мембране различных организмов и органелл, таких как митохондрии83,84. Клеточные мембраны избирательны, а молекулы и ионы, которые пересекают клеточные мембраны, разнообразны, поэтому в клетке можно найти несколько типов мембранных белков, таких как (а) транспортеры ABC, (b) ионные каналы, (c) мембраносвязанные АТФазы, (d) транспортеры SLC и (e) водныеканалы. В структурной биологии получение трехмерной конформации фермента/транспортера на большинстве этапов функционального (каталитического) цикла стало основной проблемой85,86. То есть, детальное знание функционального структурного ландшафта ферментов важно для понимания каталитического механизма 5,87,88,89. Выделение мембранного белка в высокой чистоте и активной форме является первым шагом в этих исследованиях90. Гидрофобность (присущее мембранным белкам физико-химическое свойство), по-видимому, является основной проблемой при работе с этимибелками12. Неоптимальные протоколы очистки, неподходящие условия эксперимента, водные буферы, в которых находятся мембранные белки, обычно встречаются при попытке работы с мембранными белками 25,27,91. Потеря каталитической активности во время хранения также может произойти с мембранными ферментами после очистки21.
Для-АТФаз отличной альтернативой является проведение экспериментальных исследований в рекомбинантных доменах (например, N-домене)47,48 и с использованием систем гетерологичной экспрессии белков53. Однако эксперименты иногда требуют использования всей нативной Р-АТФазы53, и поэтому необходим эффективный протокол для получения высококачественного фермента, который стабилизируется во время процедуры выделения, а затем при хранении. Вышесказанное особенно спасло бы от чрезмерного использования биологической ткани и ее живого источника.
В настоящее время использование искусственного интеллекта (ИИ, постоянно развивающийся инструмент) является одной из конечных стратегий, направленных на улучшение растворимости, стабильности и функции белков как в новых, так и в существующих 36,92,93. Тем не менее, ИИ в основном сосредоточен на растворимых белках; Мембранные белки кажутся нетрадиционными для этой новой технологии, по крайней мере, в течение некоторого времени.
Оптимизация протокола для очистки мембранных белков/ферментов — это вариант, над которым наша лаборатория работает уже два десятилетия. Содержание SERCA в изолированных SRV составляет ~73%. Стадией очистки, определенной для улучшения, была заключительная стадия центрифугирования, которая теперь выполняется на градиенте концентрации трегалозы. Чистота и структурные качества очищенного SERCA были высокими (>90%) (Рисунок 1B и Рисунок 4). Максимальное значение SERCA V было в пределах диапазона, зарегистрированного для других препаратов 94,95,96, в то время как значение Km было аналогично значению SRV. Трегалоза представляет собой молекулу, которая, как известно, стабилизирует трехмерную структуру белков в условиях стресса окружающей среды, таких как те, которые применяются на некоторых стадиях очистки. Это уже было продемонстрировано для членов семейства АТФазы P-типа, таких как плазматическая мембрана дрожжей H+-АТФаза, а теперь и для SERCA31,46. Вполне вероятно, что другая АТФаза Р-типа может быть очищена с использованием настоящего протокола для биофизических, ферментативных кинетических (тестирование ингибиторов) и структурных (четвертичная структура) исследований. В связи с этим предлагается использование трегалозы в протоколах очистки (а также для хранения) лабильных мембранных/цитозольных белков.
Раскрытие информации
Автор заявляет, что у него нет конкурирующих финансовых интересов.
Благодарности
Автор выражает признательность Эдмундо Мата-Моралесу в монтаже видео, VM, Валентину де ла Крус-Торресу в очистке SRV, Мигелю А. Ривере-Морану в очистке и анализе SERCA, а также Хуану К. Гонсалесу-Кастро, Франко Э. Хуаресу, Алехандре Неварес, Николасу Роча-Визуэту и Джослину И. Рамиресу-Алонсо в производстве видео. Никаких средств, грантов или другой поддержки для проведения данного исследования получено не было.
Материалы
| Name | Company | Catalog Number | Comments |
| ATP | Sigma-Aldrich Corp | A2383 | |
| Azolectin from soybean | Sigma-Aldrich Corp | 44924 | |
| Benchtop UV transilluminator | Cole-Parmer | EW-97623-08 | Dual intensity High setting is ideal for analytical documentation. Low setting reduces photonicking or photobleaching of gel samples while doing preparative work. |
| CaCl2 • 2H2O | Sigma-Aldrich Corp | 223506 | |
| Coolpix B500 camera | Nikon Corp | S210 | |
| Coomassie brilliant blue G-250 | Bio-Rad | 1610406 | |
| Dodecyl maltoside | Sigma-Aldrich Corp | D4641 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma-Aldrich Corp | E4378 | |
| Ethylenediaminetetraacetic acid tetrasodium salt dihydrate | Sigma-Aldrich Corp | E6511 | |
| Fluorescein isothiocyanate | Sigma-Aldrich Corp | F3651 | |
| KCl | JT Baker | 7447-40-7 | |
| MgCl2 • 6H2O | Sigma-Aldrich Corp | M9272 | |
| MOPS | Sigma-Aldrich Corp | M1254 | |
| NADH | Chem-Impex International Inc | 230 | |
| N-tetradecyl-N,N- dimethyl-3-ammonium-1-propanesulfonate | Sigma-Aldrich Corp | D0431 | |
| Phosphoenolpyruvate (PEP) | Chem-Impex International Inc | 9711 | |
| Rabbit muscle lactate dehydrogenase | Roche | 10003557103 | |
| Rabbit muscle pyruvate kinase | Sigma-Aldrich Corp | P1506 | |
| Sodium deoxycholate | Sigma-Aldrich Corp | D6750 | |
| Sodium dodecyl sulfate | Bio-Rad | 1610302 | |
| Spectropolarimeter | Jasco Corp. | Jasco J1500 | |
| Sucrose | Sigma-Aldrich Corp | 84100 | |
| Trehalose | Sigma-Aldrich Corp | T0167 | Dihydrate |
| Tris(hydroxymethyl)aminomethane hydrochloride | Sigma-Aldrich Corp | 857645 | |
| Ultracentrifuge | Beckman | Optima XPN | |
| UV/VIS spectrophotometer | Agilent Technologies | 8453 | The Agilent 8453 UV-Vis Spectrophotometer uses a photodiode array for simultaneous measurement of the complete ultra-violet to visible light spectrum |
| WiseStir HS- 30E | Daihan Scientific Co. | DH.WOS01010 | Ideal for all disperging and homogenizing applications, designed for tissue grinders. |
Ссылки
- Schuberth, C., Wedlich-Söldner, R. Building a patchwork - The yeast plasma membrane as model to study lateral domain formation. Biochim Biophys Acta Mol Cell Res. 1853 (4), 767-774 (2015).
- Douglas, L. M., Konopka, J. B. Fungal membrane organization: The eisosome concept. Annu Rev Microbiol. 68 (1), 377-393 (2014).
- Borrell, J. H., Domènech, &. #. 2. 1. 0. ;., Keough, K. M. W. . Membrane protein - Lipid interactions: Physics and Chemistry in the Bilayer. , (2016).
- Moraes, I., Evans, G., Sanchez-Weatherby, J., Newstead, S., Stewart, P. D. . The next generation in membrane protein structure determination. , (2016).
- White, S. H. Biophysical dissection of membrane proteins. Nature. 459 (7245), 344-346 (2009).
- Lacapère, J. -. J. Membrane protein structure determination. Methods Mol Biol. , 459 (1002).
- Palmgren, M. G. Plant plasma membrane H+-ATPases: Powerhouses for nutrient uptake. Annu Rev Plant Physiol Plant Mol Biol. 52 (1), 817-845 (2001).
- Yatime, L., et al. P-type ATPases as drug targets: Tools for medicine and science. Biochim Biophys Acta Bioenerg. 1787 (4), 207-220 (2009).
- Drews, J. Tetrahydrobiopterin biosynthesis as an off-target of sulfa drugs. Science. 287 (5460), 1960-1964 (2000).
- Xu, Z., Meshcheryakov, V. A., Poce, G., Chng, S. -. S. MmpL3 is the flippase for mycolic acids in mycobacteria. Proc Natl Acad Sci USA. 114 (30), 7993-7998 (2017).
- Siligardi, G., Hussain, R., Patching, S. G., Phillips-Jones, M. K. Ligand- and drug-binding studies of membrane proteins revealed through circular dichroism spectroscopy. Biochim Biophys Acta Biomembr. 1838 (1 PARTA), 34-42 (2014).
- Rawlings, A. E. Membrane proteins: Always an insoluble problem. Biochem Soc Trans. 44 (3), 790-795 (2016).
- Popot, J. -. L. . Membrane proteins in aqueous solutions. , 708 (2018).
- Palmgren, M. G., Sommarin, M., Ulvskov, P., Larsson, C. Effect of detergents on the H+-ATPase activity of inside-out and right-side-out plant plasma membrane vesicles. Biochim Biophys Acta Biomembr. 1021 (2), 133-140 (1990).
- McBride, Z., Chen, D., Reick, C., Xie, J., Szymanski, D. B. Global analysis of membrane-associated protein oligomerization using protein correlation profiling. Mol Cell Proteomics. 16 (11), 1972-1989 (2017).
- Yoneda, J. S., et al. Multimeric species in equilibrium in detergent-solubilized Na, K-ATPase. Int J Biol Macromol. 89, 238-245 (2016).
- Ohlendieck, K. Extraction of membrane proteins. Protein Purif Protocols. 59, 283-294 (2004).
- Champeil, P., et al. A robust method to screen detergents for membrane protein stabilization, revisited. Anal Biochem. 511, 31-35 (2016).
- Gimpl, K., Klement, J., Keller, S. Characterising protein/detergent complexes by triple-detection size-exclusion chromatography. Biol Proced Online. 18, 4 (2016).
- le Maire, M., et al. Gel chromatography and analytical ultracentrifugation to determine the extent of detergent binding and aggregation, and Stokes radius of membrane proteins using sarcoplasmic reticulum Ca2+-ATPase as an example. Nat Protoc. 3 (11), 1782-1795 (2008).
- Du, M., et al. Progress, applications, challenges and prospects of protein purification technology. Front Bioeng Biotechnol. 10, 1-26 (2022).
- Slotboom, D. J., Duurkens, R. H., Olieman, K., Erkens, G. B. Static light scattering to characterize membrane proteins in detergent solution. Methods. 46 (2), 73-82 (2008).
- Harding, S. E. Analytical ultracentrifugation as a matrix-free probe for the study of kinase related cellular and bacterial membrane proteins and glycans. Molecules. 26, 6080 (2021).
- Chen, Y. -. C., et al. Thermal stability, storage and release of proteins with tailored fit in silica. Sci Rep. 7 (1), 46568 (2017).
- Montigny, C. C., Arnou, B., Marchal, E., Champeil, P. Use of glycerol-containing media to study the intrinsic fluorescence properties of detergent-solubilized native or expressed SERCA1a. Biochemistry. 47 (46), 12159-12174 (2008).
- Simongini, M., Puglisi, A., Genovese, F., Hochkoeppler, A. Trehalose counteracts the dissociation of tetrameric rabbit lactate dehydrogenase induced by acidic pH conditions. Arch Biochem Biophys. 740, 109584 (2023).
- Shivanna, B. D., Rowe, E. S. Preservation of the native structure and function of Ca2+-ATPase from sarcoplasmic reticulum: Solubilization and reconstitution by new short-chain phospholipid detergent 1,2-diheptanoyl-sn-phosphatidylcholine. Biochem J. 325 (2), 533-542 (1997).
- Sampedro, J. G., Guerra, G., Pardo, J. P., Uribe, S. Trehalose-mediated protection of the plasma membrane H+-ATPase from Kluyveromyces lactis during freeze-drying and rehydration. Cryobiology. 37 (2), 131-138 (1998).
- Sampedro, J. G., Cortés, P., Muñoz-Clares, R. A., Fernández, A., Uribe, S. Thermal inactivation of the plasma membrane H+-ATPase from Kluyveromyces lactis. Protection by Trehalose. Biochim Biophys Acta Proteins Proteomics. 1544 (1-2), 64-73 (2001).
- Sampedro, J. G., et al. Fluorescence quenching by nucleotides of the plasma membrane H+-ATPase from Kluyveromyces lactis. Biochemistry. 46 (18), 5616-5622 (2007).
- Ruiz-Granados, Y. G., De La Cruz-Torres, V., Sampedro, J. G. The oligomeric state of the plasma membrane H+-ATPase from Kluyveromyces lactis. Molecules. 24 (5), 958 (2019).
- Zhao, P., Zhao, C., Chen, D., Yun, C., Li, H., Bai, L. Structure and activation mechanism of the hexameric plasma membrane H+-ATPase. Nat Commun. 12 (1), 6439 (2021).
- Auer, M., Scarborough, G. A., Kühlbrandt, W. Surface crystallization of the plasma membrane H+-ATPase on a carbon support film for electron crystallography. J Mol Biol. 287 (5), 961-968 (1999).
- Hennessey, J. P., Scarborough, G. A. Secondary structure of the Neurospora CRASSA plasma membrane H+-ATPase as estimated by circular dichroism. J Biol Chem. 263 (7), 3123-3130 (1988).
- Scarborough, G. A. Crystallization, structure and dynamics of the proton-translocating P-type ATPase. J Exp Biol. 203 (Pt 1), 147-154 (2000).
- Sumida, K. H., et al. Improving protein expression, stability, and function with proteinMPNN. J Am Chem Soc. 146 (3), 2054-2061 (2024).
- Eleutherio, E., Panek, A., De Mesquita, J. F., Trevisol, E., Magalhães, R. Revisiting yeast trehalose metabolism. Curr Genet. 61 (3), 263-274 (2015).
- Attfield, P. V. Trehalose accumulates in Saccharomyces cerevisiae during exposure to agents that induce heat shock response. FEBS Lett. 225 (1-2), 259-263 (1987).
- Marunde, M. R., et al. Improved tolerance to salt and water stress in Drosophila melanogaster cells conferred by late embryogenesis abundant protein. J Insect Physiol. 59 (4), 377-386 (2013).
- Crowe, J. H. Anhydrobiosis: An unsolved problem with applications in human welfare. Subcell Biochem. 71, 263-280 (2015).
- Crowe, J. H., Crowe, L. M., Chapman, D. Preservation of membranes in anhydrobiotic organisms: The role of trehalose. Science. 223 (4637), 701-703 (1984).
- Sampedro, J. G., Rivera-Moran, M. A., Uribe-Carvajal, S. Kramers' theory and the dependence of enzyme dynamics on trehalose-mediated viscosity. Catalysts. 10 (6), 1-19 (2020).
- Sampedro, J. G., Uribe, S. Trehalose-enzyme interactions result in structure stabilization and activity inhibition. The role of viscosity. Mol Cell Biochem. 256 - 257 (1-2), 319-327 (2004).
- Crowe, J. H. Trehalose as a "chemical chaperone": Fact and fantasy. Adv Exp Med Biol. 594, 143-158 (2007).
- Crowe, J. H., Carpenter, J. F., Crowe, L. M., Anchordoguy, T. J. Are freezing and dehydration similar stress vectors? A comparison of modes of interaction of stabilizing solutes with biomolecules. Cryobiology. 27 (3), 219-231 (1990).
- Rivera-Morán, M. A., Sampedro, J. G. Isolation of the sarcoplasmic reticulum Ca2+-ATPase from rabbit fast-twitch muscle. Methods Protoc. 6 (5), 102 (2023).
- Páez-Pérez, E. D., De La Cruz-Torres, V., Sampedro, J. G. Nucleotide binding in an engineered recombinant Ca2+-ATPase N-domain. Biochemistry. 55 (49), 6751-6765 (2016).
- Ramírez-Alonso, J. I., Sampedro, J. G. Effect of cations on ATP binding to the N-domain of Na+, K+-ATPase. J Fluoresc. , (2024).
- De la Cruz-Torres, V., Cataño, V., Olivo-Rodríguez, M., Sampedro, J. G. ANS Interacts with the Ca2+-ATPase nucleotide binding site. J Fluoresc. 30 (3), 483-496 (2020).
- Sampedro, J. G., Nájera, H., Uribe-Carvajal, S., Ruiz-Granados, Y. G. Mapping the ATP binding site in the plasma membrane H+-ATPase from Kluyveromyces lactis. J Fluoresc. 24 (6), 1849-1859 (2014).
- Kiani, A. K., et al. Ethical considerations regarding animal experimentation. J Prev Med Hyg. 63 (2 Suppl 3), E255-E266 (2022).
- Ruiz-Granados, Y., De La Cruz-Torres, V., Sampedro, J. The oligomeric state of the plasma membrane H+-ATPase from Kluyveromyces lactis. Molecules. 24 (5), 958 (2019).
- Wang, S., et al. Structural basis for sarcolipin's regulation of muscle thermogenesis by the sarcoplasmic reticulum Ca2+-ATPase. Sci Adv. 7 (48), eabi7154 (2021).
- Champeil, P., et al. ATP regulation of sarcoplasmic reticulum Ca2+-ATPase. Metal-free ATP and 8-bromo-ATP bind with high affinity to the catalytic site of phosphorylated ATPase and accelerate dephosphorylation. J Biol Chem. 263 (25), 12288-12294 (1988).
- Møller, J. V., Olesen, C. Preparation of Ca(2+)-ATPase1a enzyme from rabbit sarcoplasmic reticulum. Methods Mol Biol. 1377, 11-17 (2016).
- Wuytack, F., De Schutter, G., Casteels, R. Partial purification of (Ca2+ + Mg2+)-dependent ATPase from pig smooth muscle and reconstitution of an ATP-dependent Ca2+-transport system. Biochem J. 198 (2), 265-271 (1981).
- Mandal, A., et al. Solubilization, purification and reconstitution of Ca2+-ATPase from bovine pulmonary artery smooth muscle microsomes by different detergents: Preservation of native structure and function of the enzyme by DHPC. Biochim Biophys Acta Gen Subj. 1760 (1), 20-31 (2006).
- Inesi, G., Ma, H., Hua, S., Toyoshima, C. Characterization of Ca2+ ATPase residues involved in substrate and cation binding. Ann NY Acad Sci. 986 (1), 63-71 (2003).
- Van Winkle, W. B., Pitts, B. J., Entman, M. L. Rapid purification of canine cardiac sarcoplasmic reticulum Ca2+-ATPase. J Biol Chem. 253 (24), 8671-8673 (1978).
- Ruiz-Granados, Y. G., De La Cruz-Torres, V., Sampedro, J. G. The oligomeric state of the plasma membrane H+-ATPase from Kluyveromyces lactis. Molecules. 24 (5), 958 (2019).
- Teramoto, N., Sachinvala, N. D., Shibata, M. Trehalose and trehalose-based polymers for environmentally benign, biocompatible, and bioactive materials. Molecules. 13 (8), 1773-1816 (2008).
- Dao, T. T., et al. Demethoxycurcumin is a potent inhibitor of P-type ATPases from diverse kingdoms of life. PLOS ONE. 11 (9), e0163260 (2016).
- Bleeker, N. P., Cornea, R. L., Thomas, D. D., Xing, C. A novel SERCA inhibitor demonstrates synergy with classic SERCA inhibitors and targets multidrug-resistant AML. Mol Pharmaceutics. 10 (11), 4358-4366 (2013).
- Michelangeli, F., East, J. M. A diversity of SERCA Ca2+ pump inhibitors. Biochem Soc Trans. 39 (3), 789-797 (2011).
- Tadini-Buoninsegni, F., Smeazzetto, S., Gualdani, R., Moncelli, M. R. Drug interactions with the Ca2+-ATPase from Sarco(Endo)Plasmic Reticulum (SERCA). Front Mol Biosci. 5, 36 (2018).
- Clausen, J. D., et al. Elucidation of antimicrobial activity and mechanism of action by N-substituted carbazole derivatives. Bioorg Med Chem Lett. 27 (19), 4564-4570 (2017).
- Leary, S., et al. . AVMA guidelines for the euthanasia of animals: 2020 Edition, Members of the Panel on Euthanasia AVMA Staff Consultants. , (2020).
- de Aluja, A. S. Laboratory animals and official Mexican norms (NOM-062-ZOO-1999). Gac Med Mex. 138 (3), 295-298 (2002).
- Champeil, P., Buschlen-Boucly, S., Bastide, F., Gary-Bobo, C. Sarcoplasmic reticulum ATPase. Spin labeling detection of ligand-induced changes in the relative reactivities of certain sulfhydryl groups. J Biol Chem. 253 (4), 1179-1186 (1978).
- Skalec, A., Janeczek, M., Czerski, A. Anatomy and histology of the rabbit common calcanean tendon. J Vet Med Series C: Anat Histol Embryol. 48 (5), 466-475 (2019).
- Janes, L. E., Mioton, L. M., Fracol, M. E., Ko, J. H. An in vivo comparison: Novel mesh suture versus traditional suture-based repair in a rabbit tendon model. J Hand Surg Glob Online. 4 (1), 32-39 (2022).
- Bollag, D. M., Rozycki, M. D., Edelstein, S. J. . Protein Methods. , (1996).
- Gagné, F. Tissue preparation and subcellular fractionation techniques. Biochem Ecotoxicol. , 21-31 (2014).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J Biol Chem. 193 (1), 265-275 (1951).
- Autry, J. M., Rubin, J. E., Svensson, B., Li, J. L., Thomas, D. D. Nucleotide activation of the Ca-ATPase. J Biol Chem. 287 (46), 39070-39082 (2012).
- Winters, D. L., Autry, J. M., Svensson, B., Thomas, D. D. Interdomain fluorescence resonance energy transfer in SERCA probed by cyan-fluorescent protein fused to the actuator domain. Biochemistry. 47 (14), 4246-4256 (2008).
- Miles, A. J., Wallace, B. A. Circular dichroism spectroscopy of membrane proteins. Chem Soc Rev. 14 (45), 1130-1135 (2016).
- Scofano, H. M., Vieyra, A., de Meis, L. Substrate regulation of the sarcoplasmic reticulum ATPase. Transient kinetic studies. J Biol Chem. 254 (20), 10227-10231 (1979).
- Yamamoto, T., Tonomura, Y. Reaction mechanism of the Ca++-dependent ATPase of sarcoplasmic reticulum from skeletal muscle: I. Kinetic studies. J Biochem. 62 (5), 558-575 (1967).
- Murphy, A. J. Affinity labeling of the active site of the Ca2+-ATPase of sarcoplasmic reticulum. Biochim Biophys Acta - Biomembr. 946 (1), 57-65 (1988).
- Csermely, P., Katopis, C., Wallace, B. A., Martonosi, A. The E1→E2 transition of Ca2+-transporting ATPase in sarcoplasmic reticulum occurs without major changes in secondary structure. A circular-dichroism study. Biochem J. 241 (3), 663-669 (1987).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics Int. 11 (7), 36-42 (2004).
- Scarborough, G. A. The plasma membrane proton-translocating ATPase. Cell Mol Life Sci. 57 (6), 871-883 (2000).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. Proc Natl Acad Sci. 95 (12), 6803-6808 (1998).
- Kanai, R., Vilsen, B., Cornelius, F., Toyoshima, C. Crystal structures of Na+, K+-ATPase reveal the mechanism that converts the K+-bound form to Na+-bound form and opens and closes the cytoplasmic gate. FEBS Lett. 597 (15), 1957-1976 (2023).
- Palmgren, M. P-type ATPases: Many more enigmas left to solve. J Biol Chem. 299 (11), 105352 (2023).
- Frauenfelder, H. Ask not what physics can do for biology-Ask what biology can do for physics. Phys Biol. 11 (5), 053004 (2014).
- Frauenfelder, H. The physics of proteins. Annu Rev Biophys Biomol Struct. 36, (2010).
- Narhi, L. O. . Biophysics for Therapeutic Protein Development. , (2013).
- East, J. M. Purification of a membrane protein (Ca2+/Mg2+-ATPase) and its reconstitution into lipid vesicles. Methods Mol Biol. 27, 87-94 (1994).
- Lee, E. -. H., et al. Enhancement of enzyme activity and stability by poly(γ-glutamic acid). Polymer J. 42 (10), 818-822 (2010).
- Norrild, R. K., et al. Increasing protein stability by inferring substitution effects from high-throughput experiments. Cell Rep Methods. 2 (11), 100333 (2022).
- Song, Z., Zhang, Q., Wu, W., Pu, Z., Yu, H. Rational design of enzyme activity and enantioselectivity. Front Bioeng Biotechnol. 11, 1-14 (2023).
- Jidenko, M., Lenoir, G., Fuentes, J. M., le Maire, M., Jaxel, C. Expression in yeast and purification of a membrane protein, SERCA1a, using a biotinylated acceptor domain. Protein Expr Purif. 48 (1), 32-42 (2006).
- Hua, S., Ma, H., Lewis, D., Inesi, G., Toyoshima, C. Functional role of "N" (nucleotide) and "P" (phosphorylation) domain interactions in the sarcoplasmic reticulum (SERCA) ATPase. Biochemistry. 41 (7), 2264-2272 (2002).
- Pang, Y. -. H., Chen, J. -. W. Anisodamine causes the changes of structure and function in the transmembrane domain of the Ca2+-ATPase from sarcoplasmic reticulum. Biosci Biotechnol Biochem. 68 (1), 126-131 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены