Method Article
Разработка комбинаторных методов лечения травмы спинного мозга с использованием доставки стволовых клеток
В этой статье
Резюме
В этом исследовании были разработаны и охарактеризованы нервамиметические композитные гидрогели, которые могут быть использованы для изучения и извлечения выгоды из прорегенеративного поведения стволовых клеток, полученных из жировой ткани, для восстановления травм спинного мозга.
Аннотация
Травматическое повреждение спинного мозга (ТСМ) вызывает постоянный сенсомоторный дефицит ниже места повреждения. Он затрагивает примерно четверть миллиона человек в США и представляет собой неизмеримую проблему общественного здравоохранения. Были проведены исследования для обеспечения эффективной терапии; тем не менее, ТСМ по-прежнему считается неизлечимой из-за сложного характера места повреждения. Исследуются различные стратегии, включая доставку лекарств, трансплантацию клеток и инъекционные биоматериалы, но только одна стратегия ограничивает их эффективность для регенерации. Таким образом, в последнее время внимание привлекли комбинаторные методы лечения, которые могут быть нацелены на многогранные особенности травмы. Было показано, что внеклеточные матрицы (ВКМ) могут повышать эффективность трансплантации клеток при ТСМ. С этой целью были разработаны и охарактеризованы 3D-гидрогели, состоящие из децеллюляризованных спинных мозгов (dSC) и седалищных нервов (dSNs) в различных соотношениях. Гистологический анализ dSCs и dSN подтвердил удаление клеточных и ядерных компонентов, а нативные тканевые архитектуры были сохранены после децеллюляризации. После этого были созданы композитные гидрогели в различных объемных соотношении и подвергнуты анализу кинетики мутного гелеобразования, механических свойств и жизнеспособности встроенных стволовых клеток, полученных из жировой ткани человека (hASC). Не было обнаружено существенных различий в механических свойствах между различными соотношениями гидрогелей и децеллюляризованных матриц спинного мозга. ASC человека, встроенные в гели, оставались жизнеспособными в течение 14-дневной культуры. Это исследование предоставляет средства для создания тканеинженерных комбинаторных гидрогелей, которые представляют собой нервно-специфические ВКМ и прорегенеративные мезенхимальные стволовые клетки. Эта платформа может дать новое представление о нейрорегенеративных стратегиях после ТСМ с будущими исследованиями.
Введение
Около 296 000 человек страдают от травматической ТСМ, и каждый год в США происходит около 18 000 новых случаев ТСМ1. Травматическая ТСМ обычно вызывается падениями, огнестрельными ранениями, автомобильными авариями и занятиями спортом и часто приводит к необратимой потере сенсомоторной функции ниже места травмы. Предполагаемые пожизненные затраты на лечение ТСМ варьируются от одного до пяти миллионов долларов на одногочеловека, при этом ожидаемая продолжительность жизни значительно ниже. Тем не менее, ТСМ все еще плохо изучена и в значительной степени неизлечима, в основном из-за сложных патофизиологических последствий после травмы. Были исследованы различные стратегии, включая трансплантацию клеток и каркасы на основе биоматериалов. В то время как трансплантация клеток и биоматериалов продемонстрировала свой потенциал, многогранный характер ТСМ предполагает, что комбинаторные подходы могут бытьболее полезными. В результате было исследовано множество комбинаторных стратегий, которые продемонстрировали лучшую терапевтическую эффективность, чем отдельные компоненты. Тем не менее, необходимы дальнейшие исследования, чтобы получить новые биоматериалы для доставки клеток и лекарств3.
Одним из перспективных подходов к производству натуральных гидрогелей является децеллюляризация тканей. В процессе децеллюляризации используются ионные, неионные, физические и комбинаторные методы для удаления всех или большинства клеточных и нуклеиновых материалов с сохранением компонентов ВКМ. Удаляя все или большую часть клеточных компонентов, гидрогели, полученные из ВКМ, менее иммунореактивны для хозяина после имплантации/инъекции. Для оценки качества децеллюляризованных тканей необходимо измерить несколько параметров: удаление клеточного/нуклеинового содержимого, механические свойства и сохранность ВКМ. Для предотвращения неблагоприятных иммунных реакций были установлены следующие критерии: 1) менее 50 нг двухцепочечной ДНК (дцДНК) на мг сухого веса ВКМ, 2) длина фрагмента ДНК менее 200.о. и 3) почти или без видимого ядерного материала, окрашенного 4'6-диамидино-2-фенуилиндолом (DAPI)5. Механические свойства могут быть количественно оценены с помощью испытаний на растяжение, сжатие и/или реологические испытания, и они должны быть аналогичны исходной ткани6. Кроме того, сохранение белка может быть оценено с помощью протеомики или количественных анализов, сосредоточенных на основных компонентах децеллюляризированных тканей, например, ламинине, гликозаминогликане (ГАГ) и хондроитина сульфатном протеогликане (CSPG) для спинного мозга 7,8. Проверенные гидрогели, полученные из ВКМ, могут быть рецеллюляризированы с различными типами клеток для помощи в клеточной терапии9.
Различные типы клеток, такие как шванновские клетки, обонятельные оболочечные клетки, мезенхимальные стволовые клетки (МСК), полученные из костного мозга, и нейральные стволовые/прогениторные клетки, были изучены для репарации ТСМ 10,11,12. Тем не менее, клиническое использование этих клеток ограничено из-за этических проблем, редкой интеграции с соседними клетками/тканями, отсутствия тканевых источников для высокой продуктивности, неспособности к самообновлению и/или ограниченной пролиферативной способности 13,14,15. В отличие от этих типов клеток, МСК, полученные из жировой ткани человека (hASCs), являются привлекательными кандидатами, поскольку они легко выделяются минимально инвазивным способом с использованием липоаспиратов, иможно получить большое количество клеток. Кроме того, hASC обладают способностью секретировать факторы роста и цитокины, которые обладают потенциалом нейропротекторного, ангиогенетического, заживления ран, регенерации тканей и иммуносупрессии 17,18,19,20,21.
Как было описано, было проведено множество исследований 22,23,24, и из них было многому научено, но гетерогенные характеристики ТСМ ограничили их эффективность в содействии функциональному восстановлению. Таким образом, были предложены комбинаторные подходы для повышения эффективности лечения ТСМ. В этом исследовании композитные гидрогели были разработаны путем объединения децеллюляризованных спинного мозга и седалищных нервов для трехмерной (3D) культуры hASC. Успешная децеллюляризация была подтверждена гистологическим и ДНК-анализами, а различные соотношения нервных композитных гидрогелей были охарактеризованы кинетикой гелеобразования и компрессионными тестами. Жизнеспособность hASC в нервных композитных гидрогелях была исследована, чтобы доказать, что этот гидрогель может быть использован в качестве платформы для 3D-культивирования клеток.
протокол
Свиные ткани были получены коммерческим путем, поэтому одобрение комитета по этике животных не требовалось.
1. Децеллюляризация спинного мозга свиней (Расчетное время: 5 дней)
ПРИМЕЧАНИЕ: Выполняйте децеллюляризацию с использованием ранее установленных протоколов с модификациями25,26. Все процедуры должны проводиться в стерильном шкафу биобезопасности при комнатной температуре, если не указано иное. Все растворы должны быть стерильно отфильтрованы с помощью бутылочного фильтра (размер пор 0,2 мкм) в автоклавные флаконы. Процедуры, проводимые при температуре 37 °C, можно проводить в инкубаторе или в чистой духовке, настроенной на 37 °C.
- Приготовление растворов для децеллюляризации
ПРИМЕЧАНИЕ: Все растворы рассчитаны на 1 л. Пользователям может потребоваться отрегулировать конечный требуемый объем в соответствии с их экспериментальными потребностями.- Разбавьте 500 мл 0,05% трипсина/этилендиаминтетрауксусной кислоты (ЭДТА) с 500 мл фосфатно-солевого буфера (PBS) до получения 0,025% трипсина/ЭДТА.
- Разбавьте 300 мл 10% Triton X-100 с 700 мл PBS, чтобы получить 3% Triton X-100. Смешайте 0,56 г NaCl, 1,31 г2PO4H2O и 10,85 г HNa2O4P·7H2O в 1 л деионизированной воды для получения 100 мМ Na/50 мМ фос-буфера.
- Смешайте 32,4 г сахарозы с 1 л деионизированной воды, чтобы получилась 1 М сахарозы. Смешайте 40 г дезоксихолата натрия (SD) с 1 л деионизированной воды до получения 4% раствора SD. Разведите 6,7 мл 15% надуксусной кислоты с 993,3 мл 4% этанола.
- Подготовка спинного мозга свиньи
ПРИМЕЧАНИЕ: Спинной мозг поставлялся в замороженном виде без какого-либо раствора и хранился при температуре -80 °C до использования.- Разморозьте спинной мозг при 4 °C в холодильнике в течение 18-24 ч до децеллюляризации. С помощью стерильных ножниц аккуратно удалите твердую мозговую оболочку.
- Разрежьте спинной мозг на небольшие кусочки (длиной примерно 1 см). Поместите одну штуку в пробирку объемом 15 мл или максимум три штуки в пробирку объемом 50 мл.
- Децеллюляризация спинного мозга
ПРИМЕЧАНИЕ: После каждого этапа растворы децеллюляризации вручную наливаются в большую мензурку, которую нужно выбросить. Небольшое автоклавируемое ситечко из нержавеющей стали можно использовать для удаления растворов децеллюляризации без потери тканей, необходимых для каждого этапа. Спинной мозг возбуждался при 83 об/мин, если не указано иное.- Промывайте спинной мозг деионизированной водой в течение 18-24 часов при температуре 4 °C и 60 об/мин.
- Промывайте спинной мозг 0,025% трипсином/ЭДТА в течение 1 ч при 37 °C и 40 об/мин. Затем промойте спинной мозг PBS в течение 15 минут, 2 раза.
- Промывайте спинной мозг 3% Triton X-100 в течение 2 часов. Промойте спинной мозг 100 мМ Na/50 мМ фос-буфером в течение 15 мин, 2 раза.
- Промывайте спинной мозг 1 М сахарозой в течение 1 ч. Затем промойте спинной мозг деионизированной водой в течение 1 часа.
- Промойте спинной мозг 4% SD в течение 2 часов. Затем промойте спинной мозг фосовым буфером 100 мМ Na/50 мМ в течение 15 мин, 2 раза.
- Промыть спинной мозг 0,1% надуксусной кислотой в 4% этаноле в течение 4 ч. Затем промывайте спинной мозг PBS в течение 1 часа.
- Промывайте спинной мозг деионизированной водой в течение 1 ч, 2х. Затем промывайте спинной мозг PBS в течение 1 часа.
- Лиофилизировать спинной мозг при температуре 0,01 мбар и -56 °C в течение 3 дней и хранить в сухом виде до использования.
2. Децеллюляризация седалищного нерва свиньи (Расчетное время: 5 дней)
ПРИМЕЧАНИЕ: Выполните децеллюляризацию с использованием ранее установленного протокола27. Все процедуры должны проводиться в стерильном шкафу биобезопасности при комнатной температуре, если не указано иное. Все растворы должны быть стерильно отфильтрованы с помощью бутылочного фильтра (размер пор 0,2 мкм) в автоклавные флаконы. Процедуры, проводимые при температуре 37 °C, можно проводить в инкубаторе или в чистой духовке, настроенной на 37 °C.
- Приготовление растворов для децеллюляризации
ПРИМЕЧАНИЕ: Все растворы рассчитаны на 1 л. Пользователям может потребоваться отрегулировать конечный требуемый объем в соответствии с их экспериментальными потребностями.- Приготовьте фос-буфер с концентрацией 50 мМ Na/10 мМ, смешав 1,86 г NaCl, 0,262 г d2PO4H2O и 2,17 г HNa2O4P·7H2O в 1 л деионизированной воды.
- Приготовьте 125 мМ раствор сульфобетаина-10 (SB-10), смешав 38,4 г SB-10 с 1 л 50 мМ Na/10 мМ фос-буфера.
- Приготовьте 3 % SD/0,6 мМ раствор сульфобетаина-16 (SB-16) путем смешивания 30 г SD и 0,24 г SB-16 в 1 л 50 мМ Na/10 мМ фос-буфера.
- Препарирование седалищного нерва свиньи
ПРИМЕЧАНИЕ: Седалищные нервы поставлялись в замороженном виде с PBS и хранились при температуре -80 °C до использования.- Разморозьте седалищный нерв при 4 °C в холодильнике за 18-24 часа до децеллюляризации.
- Разрежьте седалищный нерв на небольшие кусочки (длиной примерно 1 см). Поместите одну штуку в пробирку объемом 15 мл или максимум три штуки в пробирку объемом 50 мл.
- Децеллюляризация седалищного нерва
ПРИМЕЧАНИЕ: После каждого этапа растворы децеллюляризации вручную заливаются в большой стакан, который нужно выбросить, а небольшое автоклавируемое ситечко из нержавеющей стали может быть использовано для удаления растворов децеллюляризации без потери тканей, необходимых для каждого этапа. Седалищный нерв возбуждался при 15 об/мин, если не указано иное.- Промывайте седалищный нерв деионизированной водой в течение 7 ч. Затем промойте седалищный нерв 125 мМ сульфобетаином-10 (SB-10) в 50 мМ Na/10 мМ фос-буфере в течение 18 ч.
- Промойте седалищный нерв 100 мМ Na/50 мМ фос-буфером в течение 15 минут. Затем промойте седалищный нерв 3% SD/0,6 мМ сульфобетаина-16 (SB-16) в 50 мМ Na/10 мМ фос-буфере в течение 2 ч.
- Промойте седалищный нерв 100 мМ Na/50 мМ фос-буфером в течение 15 мин, 3 раза. Затем промойте седалищный нерв 125 мМ SB-10 в 50 мМ Na/10 мМ фос-буфере в течение 7 ч.
- Промойте седалищный нерв 100 мМ Na/50 мМ фос-буфером в течение 15 минут. Затем промойте седалищный нерв 3% SD/0,6 мМ SB-16 в 50 мМ Na/10 мМ фос-буфере в течение 1,5 ч.
- Промойте седалищный нерв фос-буфером 50 мМ Na/10 мМ в течение 15 мин, 3 раза. Затем промойте седалищный нерв 75 Ед/мл дезоксирибонуклеазы (ДНКазы) в течение 3 ч без взбалтывания.
- Промойте седалищный нерв фос-буфером 50 мМ Na/10 мМ в течение 1 ч, 3 раза. Затем промойте седалищный нерв 0,2 Ед/мл хондроитиназы ABC в течение 16 ч без перемешивания при 37 °C.
- Промывайте седалищный нерв PBS в течение 3 ч, 3х. Лиофилизируйте седалищный нерв при температуре 0,01 мбар и -56 °C в течение 3 дней и храните в сухом виде до использования.
3. Расщепление децеллюляризованных тканей и изготовление композитных гидрогелей (Расчетное время: 4 дня)
- Измельчите или измельчите децеллюляризированные ткани в порошок с помощью ножниц или гомогенизатора. Стерилизуйте инструменты для измельчения или измельчите салфетки с помощью автоклава при температуре 121 °C в течение 45 минут. Также применим метод окиси этилена.
- Расщепляют ткани отдельно в 0,01 Н растворе соляной кислоты (HCl), содержащем 1 мг/мл пепсина в концентрации 15 мг/мл. Расчетный вес децеллюляризованного спинного мозга и седалищного нерва составляет 50-100 мг и 100-150 мг за штуку соответственно.
- Поместите магнитный стержень и перемешивайте при 500 об/мин и 4 °C в течение не менее 4 дней, чтобы получить прегельные растворы.
- Смешайте прегель седалищного нерва и спинного мозга в следующих объемных соотношениях: 2:1, 1:1 и 1:2. Отрегулируйте pH 7,4 с помощью 1 N гидроксида натрия (NaOH) и HCl и разбавьте до желаемой концентрации с помощью среды M199 и 1x PBS. Выдерживать при 37 °C в течение 30 минут.
ПРИМЕЧАНИЕ: Добавляйте NaOH по 1 мкл за один раз. Среду M199 можно использовать в качестве индикатора pH, так как она становится светло-розовой при pH 7,4, но для подтверждения уровня pH следует использовать полоски pH.
4. Верификация децеллюляризации
- Окрашивание гематоксилином и эозином (H&E; Расчетное время: 8 дней)
ПРИМЕЧАНИЕ: После каждого этапа полоскания растворы вручную выливаются в большую мензурку, которую нужно выбросить.- Зафиксировать свежий и децеллюляризированный спинной мозг и седалищный нерв в 3,7% формальдегиде при 4 °C в течение 18 часов. Поместите одну деталь в пробирку объемом 15 мл.
- Удалите формальдегид и поместите салфетки в 10% сахарозу на 1 сутки. Удалите 10% сахарозу и поместите салфетки в 30% сахарозу на 6 дней.
- Заполните криомолд соответствующего размера с оптимальной температурой резки (OCT) наполовину. Поместите децеллюляризованные ткани, накройте их ОКТ и дайте им впитаться в течение 1 суток.
- Через 1 сутки заморозьте салфетки на ночь при температуре -80 °C. Криосекция тканей толщиной 10 мкм с помощью криостата.
- Смойте 1x PBS в течение 5 мин, 2x. Затем смойте водой из-под крана в течение 5 минут.
- Окрашивать раствором гематоксилина в течение 1 мин. Смыть водопроводной водой в течение 1 минуты, 3 раза.
- Окрашивать раствором эозина в течение 1 мин. Промыть 95% этанолом в течение 1 мин, 2x и 100% этанолом в течение 1 мин, 3x.
- Смыть ксилолом в течение 1 мин, 2 мин, а затем 1 мин. Дайте предметным стеклам высохнуть в течение 5 минут.
- С помощью ватного тампона капните 3-4 капли раствора монтировочного полистирола дибутилфталата (DPX) на предметные стекла. Поместите покровные стекла поверх слайдов, покрытых DPX. Дайте предметным стеклам высохнуть в течение ночи.
- Анализ ДНК (Расчетное время: 1 час)
- Взвесьте децеллюляризованные и лиофилизированные ткани. Изолируйте и количественно оцените ДНК с помощью коммерчески доступных наборов в соответствии с инструкциями производителя.
5. Характеристика композитных гидрогелей
- Тест на мутность гелеобразования (расчетное время: 1 час)
- Поместите по 100 мкл растворов прегеля в каждую лунку 96-луночного планшета на льду. Считывание поглощения на длине волны 405 нм каждые 2 мин в течение 45 мин с помощью считывателя пластин.
- Рассчитайте нормализованное поглощение с помощью следующего уравнения:
(Поглощение -Начальное поглощение) / (Максимум поглощения -Начальное поглощение) - Рассчитайте наклон кривой и время достижения 50% и 95% гелеобразования, t1/2 и t95 соответственно.
- Испытание на сжатие (расчетное время: 1 минута на гидрогель)
- Изготавливают композитные гидрогели в концентрации 12 мг/мл диаметром 8 мм и высотой 2 мм.
- Используйте реометр для сжатия образцов с нагрузкой 250 Н между параллельными пластинами из нержавеющей стали со скоростью деформации 10% от высоты образца/мин. Программное обеспечение, которое предоставляет показания реометра, предоставит кривую напряжения-деформации, прикладывая силу и измеряя деформацию до тех пор, пока гидрогели не сломаются.
- Вычислите модуль Юнга по наклону линейной области кривых зависимости напряжения-деформации.
6. Трехмерная культура ИСС человека в нервных композитных гидрогелях
- Подготовка трехмерной (3D) платформы (Расчетное время: 3 часа)
- Травить кремниевую пластину с помощью фоторезиста SU-8 для получения круглых узоров глубиной 200 мкм и диаметром 4 мм.
- Смешайте основу полидиметилсилоксана (PDMS) и отвердитель в соотношении 10:1. Вылейте смесь на силиконовую пластину и оставьте на 20 минут, чтобы удалить все пузырьки, образующиеся при смешивании основы PDMS и отвердителя.
- Поставьте в духовку и выдерживайте в течение 2 часов при температуре 70 °C. Дефолдируйте отвержденный лист PDMS и выдавите его с помощью биопсийного пуансона диаметром 8 мм, чтобы сделать микролунки PDMS.
- Поместите микролунки в 96-луночный планшет и поместите луночный планшет в воздушно-плазменный очиститель для стерилизации микролунок PDMS.
- Функционализируйте микролунки PDMS 1% полиэтиленимином (PEI) и 0,1% глутаральдегидом (GA) в течение 10 мин и 20 мин соответственно. Промойте микролунки дистиллированной водой, 2х.
- Подготовка к ЧАСК (Расчетное время: 7 дней)
- Культивирование клеток пассажа на 2-5 пассажей в питательных средах hASC (базальные среды hASCs с добавлением фетальной бычьей сыворотки (FBS) и пенициллином/стрептомицином (Pen-strep)) до слияния. Пройдите и подсчитайте количество клеток с помощью гемацитометра или счетчика клеток.
- Композитные гидрогели для нервов, насыщенные ASC (Расчетное время: 2 часа)
- Смешайте прегель для седалищного нерва и спинного мозга в объемном соотношении 2:1, 1:1, 1:2 и приготовьте гидрогель только для спинного мозга, не смешивая его с прегелем седалищного нерва.
- Добавьте среду M199 и отрегулируйте pH 7,4 с помощью 1 N NaOH и HCl. Ресуспендируйте hASC с питательной средой в прегеле с плотностью 1 x 106 клеток/мл.
ПРИМЕЧАНИЕ: Количество М199 и клеточной суспензии должно составлять 10% от прегеля. - Разбавьте прегель до 12 мг/мл с помощью 1x PBS. Поместите прегель на микролунки и выдерживайте в течение 30 минут. Культивирование гидрогелей, насыщенных ASC, в питательных средах hASC.
- Тест на жизнеспособность клеток (расчетное время: 4 часа в день)
- Готовьте растворы для испытаний на жизнеспособность с использованием имеющихся в продаже реагентов в соответствии с инструкциями производителя.
- Аспирация среды в дни 1, 4, 7 и 14. Добавьте реагент в лунки и инкубируйте при 37 °C в течение 3 ч, следуя инструкциям производителя.
- Считывание флуоресценции при возбуждении/излучении 560/590 нм с помощью считывателя пластин. Рассчитайте процентную разницу по следующей формуле:
[(образец флуоресценции- флуоресцентныйбланк) / флуоресцентныйбланк] x 100
Результаты
Децеллюляризированные ткани препарировали по ранее разработанным протоколам с незначительными изменениями26,27. После децеллюляризации, лиофилизации и пищеварения были изготовлены нервные композитные гидрогели в соотношении SN:SC = 2:1, 1:1, 1:2 и гидрогели только для спинного мозга (рис. 1). Удаление ядерных компонентов было подтверждено окрашиванием H&E (рис. 2A). Для количественной оценки децеллюляризации остаточную ДНК измеряли в ВКМ. Содержание дцДНК в свежей твердой мозговой оболочке составило 132,6 ± 21,3 нг дцДНК/мг сухой ткани, в то время как свежая и децеллюляризованная паренхима спинного мозга содержала 22,6 ± 8,3 нг дцДНК/мг сухой ткани и 23,74 ± 6,69 нг дцДНК/мг сухой ткани соответственно (рис. 2B). Это указывало на то, что твердая мозговая оболочка должна быть удалена до децеллюляризации. Количество дцДНК свежей и децеллюляризованной седалищного нерва составило 222,5 ± 42,65 и 0,63 нг дцДНК/мг сухой ткани соответственно (рис. 2C).
Кинетика гелеобразования нервных композитных гидрогелей была оценена для определения скорости гелеобразования (S) и времени достижения 50% и 95% от конечного помутнения (t1/2 и t95). Кинетика гелеобразования показала сигмоидальную форму для всех групп гидрогелей (рис. 3А). Скорость гелеобразования (S) во всех гидрогелевых группах существенно не отличалась друг от друга. Время, необходимое для достижения половины конечного помутнения, t1/2, составило 11,32 ± 0,57 мин, 13,33 ± 0,6 мин, 15,7 ± 0,92 мин и 17,23 ± 1,13 мин для SN:SC = 2:1, 1:1, 1:2 и гидрогелей только для спинного мозга соответственно. Время, необходимое для достижения 95% конечного помутнения, t95, составило 13,8 ± 0,83 мин, 15,53 ± 0,83 мин, 18,38 ± 0,79 мин и 19,62 ± 1,27 для SN:SC = 2:1, 1:1, 1:2 и гидрогелей только для спинного мозга соответственно. Эти результаты указывают на то, что гидрогели с большим содержанием седалищного нерва быстрее достигают устойчивого состояния, а ЭКМ седалищного нерва может способствовать сборке гидрогеля. Результат компрессионного теста показал тенденцию, что гидрогели с большим содержанием спинного мозга обеспечивают повышенную жесткость; тем не менее, он существенно не отличался во всех различных соотношениях композитных гидрогелей (рисунок 3B).
Наконец, для определения жизнеспособности клеток hASC во всех гидрогелевых группах были созданы 3D-культуры с использованием микролунок PDMS, изготовленных из микроматериалов, как показано на рисунке 4. На протяжении 14-дневного культивирования жизнеспособность ASC измеряли с помощью коммерчески доступного колориметрического и флуоресцентного метаболического анализа на основе клеточных культур, где процентные различия от показаний рассчитывались в четырех различных временных точках: день 1, день 4, день 7 и день 14 (рисунок 5). Значение процентной разницы увеличивалось по мере увеличения временных точек, а значение гидрогеля только для спинного мозга было ниже, чем в остальных группах в 1, 4 и 14 дни. В совокупности эти данные свидетельствуют о том, что жизнеспособность hASC увеличивалась в течение периода культивирования из-за пролиферации клеток и увеличения метаболической активности клеток.

Рисунок 1: Изготовление композитных гидрогелей для нервов. Спинной мозг свиньи и седалищные нервы были децеллюляризованы, лиофилизированы и переварены с получением прегелевых растворов. Растворы прегеля седалищного нерва и спинного мозга смешивали в соотношении 2:1, 1:1 и 1:2, а также готовили прегель только для спинного мозга. Все растворы прегеля инкубировали при 37 °C для получения нервных композитных гидрогелей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
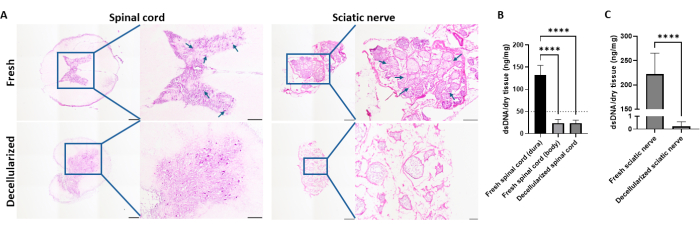
Рисунок 2: Верификация децеллюляризации. (A) Окрашивание H&E свежих и децеллюляризованных спинных мозгов свиней и седалищных нервов. Стрелки указывают на наличие клеток в тканях. Масштабные линейки = 1 мм для широкоугольных изображений и 500 мкм для увеличенных изображений (200 мкм только для увеличенных децеллюляризованных изображений седалищного нерва). (B) Анализ ДНК свежей твердой мозговой оболочки, паренхимы и децеллюляризованного спинного мозга (n=10, 16 и 6 соответственно). (В) Анализ ДНК свежих и децеллюляризованных седалищных нервов (n=8 и 3 соответственно). Полосы погрешностей представляют собой стандартные отклонения. Статистический анализ проводили с помощью одностороннего ANOVA с апостериорным тестом Тьюки для (B) и t-критерием для (C). Сокращения: нс = не значимо. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Характеристика нервных композитных гидрогелей. (A) Нормированная абсорбция нервных композитных гидрогелей (n = 5). (B) Модуль Юнга децеллюляризованных гидрогелей спинного мозга и нервных композитных гидрогелей (n = 4 для децеллюляризованного спинного мозга и 3 для каждой группы композитных гидрогелей соответственно). Полосы погрешностей представляют собой стандартные отклонения. Статистический анализ проводился с помощью одностороннего ANOVA с помощью апостериорного теста Тьюки. Сокращения: нс = не значимо. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
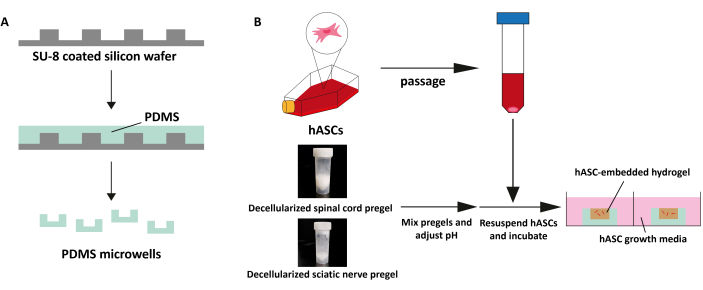
Рисунок 4: Схематическое изображение 3D-культуры. (A) Микролунки PDMS были изготовлены на кремниевой пластине с покрытием SU-8. Каждая микролунка была выбита с помощью 8-миллиметрового биопсийного пунша. (B) Децеллюляризируйте спинной мозг и седалищный нерв при различных соотношениях, отрегулируйте pH до 7,4, ресуспендируйте с помощью hASC, поместите прегель в микролунку и инкубируйте в течение 30 минут при 37°C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
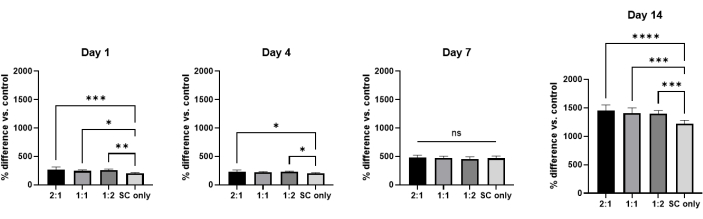
Рисунок 5: Анализ жизнеспособности клеток. Процентная разница hASCs, культивируемых в нервных композитных гидрогелях на 1, 4, 7 и 14 день (n = 3). Полосы погрешностей представляют собой стандартные отклонения. Статистический анализ проводился с помощью одностороннего ANOVA с помощью апостериорного теста Тьюки. * р<0,05; ** р<0,01; р<0,005; р<0,001; НС: Не существенно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Широко распространено мнение, что патофизиология ТСМ сложна и многогранна. Несмотря на то, что отдельные методы лечения, такие как трансплантация клеток, доставка лекарств и биоматериалы, предоставили ценную информацию о ТСМ, сложный характер ТСМ может ограничить их индивидуальную эффективность 28,29,30,31. В связи с этим активизировались усилия по разработке эффективных комбинаторных методов лечения. Нервные композитные гидрогели, описанные в этом исследовании, могут служить эффективным средством доставки клеток или лекарств. Что касается клеток, то ASC являются одним из перспективных кандидатов на трансплантацию клеток. ASC секретируют иммуномодулирующие факторы, такие как интерлейкин-10 (IL-10) и трансформирующий фактор роста бета (TGF-β), а также нейротрофические факторы, такие как фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF), глиальный нейротрофический фактор (GDNF) и нейротрофин-3 (NT-3), которые приводят к увеличению роста ганглиев нейритов дорсальных корешков in vitro и восстановлению функции in vivo 17,19,32,33, 34. ИСС, вводимые в виде водных растворов, способствовали функциональному восстановлению после ТСМ у крыс и человека; тем не менее, были отмечены проблемы с опосредованной миграцией, дифференцировкой, выживаемостью и дифференциацией ИСС 35,36,37. Кроме того, существуют противоречивые сообщения об опухолевом потенциале трансплантированных ИСС; В то время как некоторые исследования показали, что ASC могут способствовать пролиферации и метастазированию различных типов рака, другие исследования также показали противоопухолевые потенциалы 38,39,40,41 Следовательно, долгосрочный профиль безопасности ASC в нервных композитных гидрогелях необходимо исследовать в будущем. Здесь децеллюляризованные спинной мозг и седалищные нервы были изучены отдельно для восстановления ТСМ.
Децеллюляризованный спинной мозг вводили в крысу модель ТСМ и стимулировали аксональное врастание в очаг поражения и повышенное функциональное восстановление; Однако из-за быстрой деградации образовалась киста, и восстановление уменьшилось после 4-8 недель лечения4, 42. Бесклеточный гидрогель седалищного нерва вводился крысам с ТСМ и способствовал регенерации нейронов, но эффективность гидрогеля была ограничена из-за быстрой деградации. Поэтому в последнее время внимание уделяется комбинаторным подходам с использованием децеллюляризированных тканей. Сообщалось, что децеллюляризованные гидрогели спинного мозга способствуют пролиферации, миграции и дифференцировке нейральных стволовых клеток/клеток-предшественников в нейроны4. Это также способствовало вырастанию 3D-нейритов из клеток нейробластомы N1E-115, что указывает на то, что децеллюляризованные гидрогели спинного мозга могут быть привлекательным каркасом для стимуляции регенерации аксонов. Децеллюляризованные седалищные нервы были изучены с помощью инкапсуляции по Шванну и показали потенциал в качестве нервного трансплантата после ТСМ43. В совокупности ожидается, что комбинация децеллюляризованных спинных мозгов и седалищных нервов будет способствовать как аксональной регенерации, так и восстановлению тканей. Текущее исследование также не включает оценку терапевтических эффектов гидрогелей для нервов, насыщенных ASC. Поэтому важно оценить регенеративные потенциалы, такие как проангиогенные и нейротрофические эффекты, платформы с помощью исследований in vitro и in vivo . Кроме того, нервные композитные гидрогели могут быть легко применены для инкапсуляции других типов клеток, таких как шванновские клетки, обонятельные стволовые клетки и нейральные стволовые клетки, для повышения терапевтической эффективности трансплантации клеток. Было бы интересно исследовать безопасность и эффективность различных типов клеток в составе нервного композитного гидрогеля на разных стадиях ТСМ.
Одним из важнейших этапов создания композитных гидрогелей является подготовка достаточного количества тканей, особенно спинного мозга. Выход децеллюляризованного спинного мозга значительно низок, что отмечено в протоколе (50-100 мг кусочка спинного мозга и 100-150 мг кусочка седалищного нерва); Таким образом, сбор или получение спинного мозга у мелких животных, таких как мыши и крысы, не рекомендуется. Предполагается, что по крайней мере животные среднего размера, такие как кролики, должны набрать значительное количество матриц спинного мозга. Кроме того, важно проверять pH при переваривании децеллюляризованных тканей, поскольку добавление ткани может сдвинуть pH за пределы необходимого диапазона активации пепсина, который составляет около 1,5-2. Время возбуждения при децеллюляризации спинного мозга больше, чем при использовании ранее установленного метода26 , поскольку скорость возбуждения в текущем протоколе ниже. Вращатель, используемый в этом протоколе, обеспечивает скорость вращения до 83 об/мин, в то время как в ранее установленных методах использовалось максимум 200 об/мин. Поэтому время перемешивания было увеличено в два раза, чтобы тщательно промыть весь клеточный мусор. Чтобы гарантировать, что все растворы для децеллюляризации могут проникать в ткани и вымывать все клеточное и ядерное содержимое, время и скорость перемешивания должны быть оптимизированы с помощью гистологии или анализа ДНК со стороны пользователя. Предполагается, что соотношение между тканями и децеллюляризирующим раствором должно быть минимальным 1:15 [w/v]. Децеллюляризованные ткани в ранее установленном протоколе26 расщепляли/перемешивали при комнатной температуре; однако в этом протоколе они переваривались с помощью магнитного стержня на перемешивающей пластине при 4 °C и 500 об/мин в течение 4 дней. Двигатель мешалки может генерировать тепло и вводить его в раствор прегеля. Поэтому рекомендуется переваривать при низких температурах или использовать температурную пластину для перемешивания.
Как отмечается в анализе ДНК (рис. 2B), крайне важно удалить твердую мозговую оболочку спинного мозга, поскольку значительное количество ДНК может быть обнаружено внутри твердой мозговой оболочки. Твердая мозговая оболочка, в отличие от паренхимы спинного мозга, состоит из фиброзной ткани; Следовательно, следует использовать различные методы децеллюляризации, как описано ранее44,45. Для проверки эффективности процесса децеллюляризации были использованы окрашивание H&E и анализ ДНК децеллюляризованных тканей. Для достижения целей успешной децеллюляризации необходимо удовлетворять следующим критериям: 1. Менее 50 нг дцДНК/мг сухого веса ВКМ, 2. Длина фрагмента ДНК менее 200.о., 3. Отсутствие ядерного материала в срезах тканей или H&E5. Качественный анализ окрашивания H&E после децеллюляризации показал отсутствие окрашивания ядер, что свидетельствует об успешном удалении клеток. Кроме того, компоненты ВКМ, такие как коллаген и другие матричные белки, были сохранены, а интенсивность окрашивания снижалась после децеллюляризации, что отражало удаление клеточного материала. После децеллюляризации содержание ДНК составило 0,63 нг в седалищном нерве и 23,74 ± 6,69 нг в спинном мозге на мг сухой массы ВКМ, что ниже допустимого порога для применения in vivo.
Реологические измерения композитных гидрогелей должны быть тщательно спроектированы, поскольку реометры с высокой силой сжатия или тестеры на растяжение не могут использоваться для анализа механических свойств мягких материалов, таких как нервные композитные гидрогели, созданные в этом исследовании. Образцы будут разорваны/разорваны на части, когда они будут захвачены на испытателе на растяжение, а сжатие с высокой силой не даст данных, достаточно чувствительных для анализа. В этом исследовании использовался реометр с силой сжатия 250 Н, и рекомендуется найти прибор с аналогичной или подходящей силой для целей пользователей. В качестве альтернативы различные реологические измерения, такие как измерение колебательного сдвига, могут помочь определить модули накопления и потерь. Снижение механических свойств после децеллюляризации является ограничением в данном исследовании. Несмотря на то, что модуль Юнга для всех групп гидрогелей аналогичен модулю децеллюляризованного спинного мозга, он значительно отличается от свежего спинного мозга (данные не показаны). Нейральные стволовые клетки и МСК, культивируемые на относительно мягких материалах, показали повышенную дифференцировку нейронов и экспрессию тубулина β-III, соответственно46,47. Тем не менее, можно армировать или сшивать децеллюляризованные материалы с другими материалами, такими как альгинат, полиэтиленгликоль, генипин и глутаральдегид 48,49,50,51. Оптимизация будет необходима, чтобы гарантировать, что эти стратегии для улучшения механических свойств гидрогелей не влияют на клеточное поведение или жизнеспособность.
Может наблюдаться вариабельность гидрогелей нервных композитов от партии к партии, отчасти из-за различий в возрасте, поле, весе и видах животных. Контролируемое и постоянное использование одного и того же вида животных может помочь смягчить изменчивость. Объединение образцов тканей различных животных также может помочь уменьшить вариабельность между партиями52. Одной из потенциальных проблем для переноса этого исследования в клиническое применение является масштабируемость. Низкий выход децеллюляризации спинного мозга будет препятствовать производству большого количества децеллюляризованных тканей. Необходимо будет разработать / оптимизировать новые методы для создания большего количества тканей, или твердая мозговая оболочка может быть децеллюляризирована вместе, чтобы увеличить выход после децеллюляризации. Еще одной потенциальной проблемой является получение разрешений регулирующих органов. В США FDA отвечает за одобрение регулирующими органами клеточнойтерапии. Регулирующий орган Республики Корея одобрил выход на рынок препарата CARTISTEM, который представляет собой продукт на основе МСК, состоящий из аллогенных МСК, полученных из пуповинной крови, и 4% гиалуронатного гидрогеля для лечения дефектов хряща коленного сустава54. Подобные прецедентные случаи могут помочь оптимизировать процесс проверки регулирующих органов, предоставляя данные о безопасности и эффективности.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Фондом PhRMA и Национальными институтами здравоохранения в виде награды No P20GM139768 и R15NS121884, присужденной YS. Мы хотим поблагодарить доктора Картика Балачандрана и доктора Раджа Рао с факультета биомедицинской инженерии Университета Арканзаса за предоставленную нам возможность использовать их оборудование. Кроме того, мы хотим поблагодарить доктора Джин-Ву Кима и г-на Патрика Кучвару из Департамента биологической и сельскохозяйственной инженерии Университета Арканзаса за проведение обучения по реометру.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-(Decyldimethylammonio)propane sulfonate inner salt | Sigma-Aldrich | D4266 | Used during sciatic nerve decellularization, SB-10 |
| 3-(N,N-Dimethylpalmitylammonio)propane sulfonate | Sigma-Aldrich | H6883 | Used during sciatic nerve decellularization, SB-16 |
| AlamarBlue reagent | Fisher Scientific | DAL1100 | Used during AlamaBlue cell viabiiltiy test |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | Used during sciatic nerve decellularization |
| Cryostat | Leica | CM1860 | |
| Deoxyribonuclase | Sigma-Aldrich | D4263 | Used during sciatic nerve decellularization |
| Disodium hydrogen phosphate heptahydrate | VWR | BDH9296 | Chemical for 100 mM Na/50 mM phos and 50 mM Na/10 mM phos buffer |
| DNeasy Blood & Tissue kit | Qiagen | 69506 | Used during DNA analysis |
| Dpx Mountant for histology,slide mounting medium | Sigma-Aldrich | 6522 | Used during H&E staining |
| Eosin | Sigma-Aldrich | HT110216 | Used during H&E staining |
| Ethanol | VWR | 89125-172 | |
| Formaldehyde | Sigma-Aldrich | 252549 | Used during H&E staining |
| Glutaraldehyde (GA) | Sigma-Aldrich | G6257 | Used during PDMS surface functionalization |
| hASC growth media | Lonza | PT-4505 | Used to culture hASCs, containing of fetal bovine serum and penicilin/streptomycin |
| Hematoxylin | VWR | 26041-06 | Used during H&E staining |
| human adipose-derived stem cell | Lonza | PT-5006 | |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 320331 | Used to digest decellularizied tissues and adjust pregels solutions |
| M199 media | Sigma-Aldrich | M0650 | Used to dilute pregels to desired concentration |
| Optimal cutting temperatue compound | Tissue-Tek | 4583 | |
| Pepsin | Sigma-Aldrich | P7000 | Used to digest decellularized tissues |
| Peracetic acid | Lab Alley | PAA1001 | Used during spinal cord decellularization |
| Phosphate buffered saline (PBS) | VWR | 97062-948 | |
| Plate reader | BioTek Instruments | Synergy Mx | |
| Polyethyleneimine (PEI) | Sigma-Aldrich | 181978 | Used during PDMS surface functionalization |
| Porcine sciatic nerve | Tissue Source LLC | Live pigs, with no identifiable information and no traceability details | |
| Porcine spinal cord | Tissue Source LLC | Live pigs, with no identifiable information and no traceability details | |
| QuantiFluor dsDNA system | Promega | E2670 | Used to analyze DNA contents |
| Rheometer | TA Instruments | DHR 2 | |
| Rugged rotator | Glas-co | 099A RD4512 | Used during spinal cord decellularization |
| Sodium chloride (NaCl) | VWR | BDH9286 | Chemical for 100 mM Na/50 mM phos and 50 mM Na/10 mM phos buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dihydrogen phosphate monohydrate | VWR | BDH9298 | Chemical for 100 mM Na/50 mM phos and 50 mM Na/10 mM phos buffer |
| Sodium hydroxide solution (NaOH) | Sigma-Aldrich | 415443 | Used to adjust pregels solutions |
| SU-8 | Kayaku advnaced materials | SU8-100 | Used to coat silicon wafer |
| Sucrose | Sigma-Aldrich | S8501 | Used during spinal cord decellularization |
| Sylgard 184 silicone elastomer kit | DOW | 1317318 | Polydimethylxiloxane (PDMS) base and curing agent |
| Triton X-100 | Sigma-Aldrich | X100 | Used during spinal cord decellularization |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher | 25300062 | Used during hASC work and during spinal cord decellularization |
| Tube revolver rotator | Thermo Fisher | 88881001 | Used during sciatic nerve decellularization |
| Xylene | VWR | MK866816 | Used during H&E staining |
Ссылки
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. National Spinal Cord Injury Statistical Center. , (2017).
- Anjum, A., et al. Spinal cord injury: Pathophysiology, multimolecular interactions, and underlying recovery mechanisms. Int J Mol Sci. 21 (20), 1-35 (2020).
- Führmann, T., Anandakumaran, P. N., Shoichet, M. S. Combinatorial therapies after spinal cord injury: How can biomaterials help. Adv Healthcare Mater. 6 (10), 1-21 (2017).
- Xu, Y., et al. Understanding the role of tissue-specific decellularized spinal cord matrix hydrogel for neural stem/progenitor cell microenvironment reconstruction and spinal cord injury. Biomaterials. 268, 120596 (2021).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Franko, R., et al. Mechanical properties of native and decellularized reproductive tissues: insights for tissue engineering strategies. Sci Rep. 14 (1), 1-14 (2024).
- Rowlands, D., Sugahara, K., Kwok, J. C. F. Glycosaminoglycans and glycomimetics in the central nervous system. Molecules. 20 (3), 3527-3548 (2015).
- Silver, D. J., Silver, J. Contributions of chondroitin sulfate proteoglycans to neurodevelopment, injury, and cancer. Curr Opinion Neurobiol. 27, 171-178 (2014).
- Porzionato, A., et al. Tissue-engineered grafts from human decellularized extracellular matrices: A systematic review and future perspectives. Int J Mol Sci. 19 (12), 4117 (2018).
- Deng, L. X., et al. A novel growth-promoting pathway formed by GDNFoverexpressing Schwann cells promotes propriospinal axonal regeneration, synapse formation, and partial recovery of function after spinal cord injury. J Neurosci. 33 (13), 5655-5667 (2013).
- Tabakow, P., et al. Transplantation of autologous olfactory ensheathing cells in complete human spinal cord injury. Cell Transpl. 22 (9), 1591-1612 (2013).
- Hawryluk, G. W. J., et al. An in vivo characterization of trophic factor production following neural precursor cell or bone marrow stromal cell transplantation for spinal cord injury. Stem Cells Dev. 21 (12), 2222-2238 (2012).
- Zipser, C. M., et al. Cell-based and stem-cell-based treatments for spinal cord injury: evidence from clinical trials. Lancet Neurol. 21 (7), 659-670 (2022).
- Mackay-Sim, A., et al. Autologous olfactory ensheathing cell transplantation in human paraplegia: A 3-year clinical trial. Brain. 131 (9), 2376-2386 (2008).
- Suzuki, H., et al. Current concepts of neural stem/progenitor cell therapy for chronic spinal cord injury. Front Cell Neurosci. 15, 794692 (2022).
- Kokai, L. E., Marra, K., Rubin, J. P. Adipose stem cells: Biology and clinical applications for tissue repair and regeneration. Trans Res. 163 (4), 399-408 (2014).
- Kingham, P. J., Kolar, M. K., Novikova, L. N., Novikov, L. N., Wiberg, M. Stimulating the neurotrophic and angiogenic properties of human adipose-derived stem cells enhances nerve repair. Stem Cells Dev. 23 (7), 741-754 (2014).
- Song, Y. H., Shon, S. H., Shan, M., Stroock, A. D., Fischbach, C. Adipose-derived stem cells increase angiogenesis through matrix metalloproteinase-dependent collagen remodeling. Integr Biol (United Kingdom). 8 (2), 205-215 (2016).
- Ribeiro, C. A., et al. The secretome of stem cells isolated from the adipose tissue and Wharton jelly acts differently on central nervous system derived cell populations. Stem Cell Res Ther. 3 (3), 18 (2012).
- Salgado, J. B. O. G., et al. Adipose tissue derived stem cells secretome: Soluble factors and their roles in regenerative medicine. Curr Stem Cell Res Ther. 5 (2), 103-110 (2010).
- Kapur, S. K., Katz, A. J. Review of the adipose derived stem cell secretome. Biochimie. 95 (12), 2222-2228 (2013).
- Xu, X. M., Chen, A., Guénard, V., Kleitman, N., Bunge, M. B. Bridging Schwann cell transplants promote axonal regeneration from both the rostral and caudal stumps of transected adult rat spinal cord. J Neurocytol. 26 (1), 1-16 (1997).
- Guest, J. D., et al. Influence of IN-1 antibody and acidic FGF-fibrin glue on the response of injured corticospinal tract axons to human Schwann cell grafts. J Neurosci Res. 50 (5), 888-905 (1997).
- Cornelison, R. C., et al. Injectable hydrogels of optimized acellular nerve for injection in the injured spinal cord. Biomed. Mater. 13 (3), 034110 (2018).
- Crapo, P. M., et al. Biologic scaffolds composed of central nervous system extracellular matrix. Biomaterials. 33 (13), 3539-3547 (2012).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- McCrary, M. W., et al. Novel sodium deoxycholate-based chemical decellularization method for peripheral nerve. Tissue Eng Part C. 26 (1), 23-36 (2020).
- Shahemi, N. H., et al. Application of conductive hydrogels on spinal cord injury repair: A Review. ACS Biomater Sci Eng. 9 (7), 4045-4085 (2023).
- Huang, L. Y., et al. Cell transplantation therapies for spinal cord injury focusing on bone marrow mesenchymal stem cells: Advances and challenges. World J Stem Cells. 15 (5), 385-399 (2023).
- Chakraborty, A., Ciciriello, A. J., Dumont, C. M., Pearson, R. M. Nanoparticle-based delivery to treat spinal cord injury - a mini- review. AAPS PharmSciTech. 22 (3), 101 (2022).
- Upadhyay, R. K. Drug delivery systems, CNS protection, and the blood brain barrier. BioMed Res Int. , d869269 (2014).
- Liu, G., et al. Transplantation of adipose-derived stem cells for peripheral nerve repair. Int J Mol Med. 28 (4), 565-572 (2011).
- Sun, T., et al. Adipose-derived stem cells in immune-related skin disease: a review of current research and underlying mechanisms. Stem Cell Res Ther. 15 (1), 1-14 (2024).
- Lewis, M., et al. Materials today bio neuro-regenerative behavior of adipose-derived stem cells in aligned collagen I hydrogels. Mater Today Bio. 22, 100762 (2023).
- Thuret, S., Moon, L. D. F., Gage, F. H. Therapeutic interventions after spinal cord injury. Nat Rev Neurosci. 7 (8), 628-643 (2006).
- Ohta, Y., et al. Intravenous infusion of adipose-derived stem/stromal cells improves functional recovery of rats with spinal cord injury. Cytotherapy. 19 (7), 839-848 (2017).
- Hur, J. W., et al. Intrathecal transplantation of autologous adipose-derived mesenchymal stem cells for treating spinal cord injury: A human trial. J Spinal Cord Med. 39 (6), 655-664 (2016).
- Muehlberg, F. L., et al. Tissue-resident stem cells promote breast cancer growth and metastasis. Carcinogenesis. 30 (4), 589-597 (2009).
- Ji, S. Q., et al. Adipose tissue-derived stem cells promote pancreatic cancer cell proliferation and invasion. Brazilian J Med Biol Res. 46 (9), 758-764 (2013).
- Zhu, Y., et al. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1. Leukemia. 23 (5), 925-933 (2009).
- Cousin, B., et al. Adult stromal cells derived from human adipose tissue provoke pancreatic cancer cell death both in vitro and in vivo. PLoS ONE. 4 (7), 31-34 (2009).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Eng Part A. 22 (3-4), 306-317 (2016).
- Bousalis, D., et al. Decellularized peripheral nerve as an injectable delivery vehicle for neural applications. Biomed Mater Res Part A. 110, 595-611 (2022).
- Sharma, A., Liao, J., Williams, L. N. Structure and mechanics of native and decellularized porcine cranial dura mater. Eng. 4 (2), 205-213 (2023).
- Ozudogru, E., et al. Decellularized spinal cord meninges extracellular matrix hydrogel that supports neurogenic differentiation and vascular structure formation. J Tissue Eng Regen Med. 15 (11), 948-963 (2021).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Saha, K., et al. Substrate modulus directs neural stem cell behavior. Biophys J. 95 (9), 4426-4438 (2008).
- Jiang, T., et al. Preparation and characterization of genipin-crosslinked rat acellular spinal cord scaffolds. Mater Sci Eng C. 33 (6), 3514-3521 (2013).
- Gao, S., et al. Comparison of glutaraldehyde and carbodiimides to crosslink tissue engineering scaffolds fabricated by decellularized porcine menisci. Mater Sci Eng C. 71, 891-900 (2017).
- Zhou, J., et al. Tissue engineering of heart valves: PEGylation of decellularized porcine aortic valve as a scaffold for in vitro recellularization. BioMe Eng Onl. 12 (1), 1-12 (2013).
- Sun, D., et al. Novel decellularized liver matrix-alginate hybrid gel beads for the 3D culture of hepatocellular carcinoma cells. Int J Biol Macromol. 109, 1154-1163 (2018).
- Gaetani, R., et al. Evaluation of different decellularization orotocols on the generation of pancreas-derived hydrogels. Tiss Engi C. 24 (12), 697-708 (2018).
- Mendicino, M., Fan, Y., Griffin, D., Gunter, K. C., Nichols, K. Current state of U.S. Food and Drug Administration regulation for cellular and gene therapy products: potential cures on the horizon. Cytotherapy. 21 (7), 699-724 (2019).
- Lim, H. C., et al. Allogeneic umbilical cord blood-derived mesenchymal stem cell implantation versus microfracture for large, full-thickness cartilage defects in older patients: A multicenter randomized clinical trial and extended 5-year clinical follow-up. Ortho J Sports Med. 9 (1), 1-15 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены