Method Article
Desenvolvimento de Terapêutica Combinatória para Lesão Medular usando Entrega de Células-Tronco
Neste Artigo
Resumo
Neste estudo, foram desenvolvidos e caracterizados hidrogéis compostos miméticos de nervos que podem ser utilizados para investigar e capitalizar o comportamento pró-regenerativo de células-tronco derivadas do tecido adiposo para reparo de lesões medulares.
Resumo
A lesão medular traumática (LM) induz deficit sensório-motor permanente abaixo do local da lesão. Afeta aproximadamente um quarto de milhão de pessoas nos EUA e representa uma preocupação imensurável de saúde pública. Pesquisas foram conduzidas para fornecer terapia eficaz; no entanto, a LM ainda é considerada incurável devido à natureza complexa do local da lesão. Uma variedade de estratégias, incluindo administração de medicamentos, transplante de células e biomateriais injetáveis, são investigadas, mas uma estratégia sozinha limita sua eficácia para a regeneração. Como tal, as terapias combinatórias ganharam recentemente atenção e podem atingir características multifacetadas da lesão. Foi demonstrado que as matrizes extracelulares (MEC) podem aumentar a eficácia do transplante de células para LME. Para tanto, hidrogéis 3D constituídos por medula espinhal descelularizada (dSCs) e nervos ciáticos (dSNs) foram desenvolvidos em diferentes proporções e caracterizados. A análise histológica de dSCs e dSNs confirmou a remoção de componentes celulares e nucleares, e as arquiteturas de tecido nativo foram mantidas após a descelularização. Posteriormente, hidrogéis compostos foram criados em diferentes proporções volumétricas e submetidos a análises de cinética de gelificação de turbidez, propriedades mecânicas e viabilidade de células-tronco derivadas de tecido adiposo humano (hASC) incorporadas. Não foram encontradas diferenças significativas nas propriedades mecânicas entre as diferentes proporções de hidrogéis e matrizes medularizadas descelularizadas. As ASCs humanas incorporadas nos géis permaneceram viáveis durante toda a cultura de 14 dias. Este estudo fornece um meio de gerar hidrogéis combinatórios de engenharia de tecidos que apresentam ECM específica do nervo e células-tronco mesenquimais pró-regenerativas. Esta plataforma pode fornecer novos insights sobre estratégias neuro-regenerativas após a LME com investigações futuras.
Introdução
Aproximadamente 296.000 pessoas sofrem de LME traumática e, a cada ano, ocorrem cerca de 18.000 novos casos de LME nos EUA1. A LME traumática é comumente causada por quedas, ferimentos por arma de fogo, acidentes com veículos e atividades esportivas e geralmente causa perda permanente da função sensório-motora abaixo do local da lesão. As despesas estimadas ao longo da vida para o tratamento da LME variam entre um a cinco milhões de dólares por indivíduo, com expectativas de vida significativamente mais baixas1. No entanto, a LM ainda é pouco compreendida e em grande parte incurável, principalmente devido às complexas consequências fisiopatológicas após a lesão2. Várias estratégias foram investigadas, incluindo transplante de células e andaimes baseados em biomateriais. Embora o transplante de células e biomateriais tenha demonstrado potencial, a natureza multifacetada da LME sugere que abordagens combinatórias podem ser mais benéficas3. Como resultado, muitas estratégias combinatórias foram investigadas e demonstraram melhor eficácia terapêutica do que os componentes individuais. No entanto, mais estudos são necessários para fornecer novos biomateriais para a entrega de células e fármacos3.
Uma abordagem promissora para a fabricação de hidrogéis naturais é a descelularização do tecido. O processo de descelularização utiliza métodos iônicos, não iônicos, físicos e combinatórios para remover todos ou a maioria dos materiais celulares e nucléicos, preservando os componentes da MEC. Ao remover todos ou a maioria dos componentes celulares, os hidrogéis derivados da MEC são menos imunorreativos para o hospedeiro após a implantação/injeção4. Existem vários parâmetros a serem medidos para avaliar a qualidade dos tecidos descelularizados: remoção do conteúdo celular/nucléico, propriedades mecânicas e preservação da MEC. Os seguintes critérios foram estabelecidos para evitar respostas imunes adversas: 1) menos de 50 ng de DNA de fita dupla (dsDNA) por mg de peso seco da MEC, 2) menos de 200 pb de comprimento de fragmento de DNA e 3) quase ou nenhum material nuclear visível corado com 4'6-diamidino-2-fenuilindol (DAPI)5. As propriedades mecânicas podem ser quantificadas por testes de tração, compressão e/ou reologia, e devem ser semelhantes ao tecido original6. Além disso, a preservação proteica pode ser avaliada por proteômica ou ensaios quantitativos com foco nos principais componentes dos tecidos descelularizados, por exemplo, laminina, glicosaminoglicano (GAG) e proteoglicano de sulfato de condroitina (CSPG) para a medula espinhal 7,8. Os hidrogéis derivados de ECM verificados podem ser recelularizados com diferentes tipos de células para auxiliar na terapia baseada em células9.
Uma variedade de tipos de células, como células de Schwann, células de revestimento olfatório, células-tronco mesenquimais derivadas da medula óssea (MSCs) e células-tronco neurais/progenitoras, foram estudadas para reparo de LME 10,11,12. No entanto, o uso clínico dessas células é limitado devido a preocupações éticas, integração esparsa com células/tecidos vizinhos, falta de fontes teciduais para alto rendimento, incapacidade de auto-renovação e/ou capacidade proliferativa limitada 13,14,15. Ao contrário desses tipos celulares, as CTMs derivadas do tecido adiposo humano (hASCs) são candidatas atraentes porque são facilmente isoladas de maneira minimamente invasiva usando lipoaspirados, e um grande número de células pode ser obtido16. Além disso, as hASCs têm a capacidade de secretar fatores de crescimento e citocinas que têm o potencial de neuroproteção, angiogenética, cicatrização de feridas, regeneração tecidual e imunossupressão 17,18,19,20,21.
Como foi descrito, vários estudos foram realizados 22,23,24, e muito foi aprendido com eles, mas as características heterogêneas da LM limitaram sua eficácia na promoção da recuperação funcional. Como tal, abordagens combinatórias foram propostas para aumentar a eficácia do tratamento para LM. Neste estudo, hidrogéis compostos foram desenvolvidos combinando medula espinhal descelularizada e nervos ciáticos para uma cultura tridimensional (3D) de hASC. A descelularização bem-sucedida foi confirmada por análises histológicas e de DNA, e diferentes proporções de hidrogéis compostos nervosos foram caracterizadas por cinética de gelificação e testes de compressão. A viabilidade de hASCs nos hidrogéis compostos de nervos foi investigada para provar que este hidrogel pode ser utilizado como uma plataforma de cultura de células 3D.
Protocolo
Os tecidos suínos foram obtidos comercialmente, portanto, a aprovação não foi exigida pelo comitê de ética animal.
1. Descelularização da medula espinhal suína (Tempo estimado: 5 dias)
NOTA: Realizar a descelularização utilizando protocolos previamente estabelecidos com modificações25,26. Todos os procedimentos devem ser feitos em um gabinete de biossegurança estéril à temperatura ambiente, salvo indicação em contrário. Todas as soluções devem ser filtradas estéreis usando um filtro superior de frasco (tamanho de poro de 0,2 μm) em frascos autoclavados. Os procedimentos a serem realizados a 37 °C podem ser feitos dentro de uma incubadora ou de um forno limpo regulado para 37 °C.
- Preparação de soluções de descelularização
NOTA: Todas as soluções são calculadas para 1 L. Os usuários podem precisar ajustar o volume final necessário de acordo com suas necessidades experimentais.- Dilua 500 mL de tripsina a 0,05% / ácido etilenodiaminotetracético (EDTA) com 500 mL de solução salina tamponada com fosfato (PBS) para produzir 0,025% de tripsina / EDTA.
- Dilua 300 mL de Triton X-100 a 10% com 700 mL de PBS para fazer 3% de Triton X-100. Misture 0,56 g de NaCl, 1,31 g de NaH2PO4H2O e 10,85 g de HNa2O4P·7H2O em 1 L de água deionizada para fazer 100 mM de tampão Na/50 mM phos.
- Misture 32,4 g de sacarose em 1 L de água deionizada para fazer 1 M de sacarose. Misture 40 g de desoxicolato de sódio (SD) em 1 L de água deionizada para fazer uma solução de 4% de SD. Diluir 6,7 mL de ácido peracético a 15% com 993,3 mL de etanol a 4%.
- Preparação da medula espinhal suína
NOTA: As medulas espinhais foram enviadas congeladas sem qualquer solução e mantidas a -80 °C até o uso.- Descongele a medula espinhal a 4 °C na geladeira por 18-24 h antes da descelularização. Use uma tesoura estéril para remover a dura-máter com cuidado.
- Corte a medula espinhal em pedaços pequenos (aproximadamente 1 cm de comprimento). Coloque uma peça em um tubo de 15 mL ou no máximo três peças em um tubo de 50 mL.
- Descelularização da medula espinhal
NOTA: Após cada etapa, as soluções de descelularização são despejadas manualmente em um béquer grande para serem descartadas. Um pequeno filtro de aço inoxidável autoclavável pode ser usado para ajudar a descartar soluções de descelularização sem perder os tecidos necessários para cada etapa. A medula espinhal foi agitada a 83 rpm, salvo indicação em contrário.- Enxágue a medula espinhal com água deionizada por 18-24 h a 4 °C e 60 rpm.
- Enxágue a medula espinhal com 0,025% de tripsina / EDTA por 1 h a 37 ° C e 40 rpm. Em seguida, enxágue a medula espinhal com PBS por 15 min, 2x.
- Enxágue a medula espinhal com Triton X-100 a 3% por 2 h. Enxágue a medula espinhal com 100 mM de tampão-foso por 15 min, 2x.
- Enxágue a medula espinhal com sacarose 1 M por 1 h. Em seguida, enxágue a medula espinhal com água deionizada por 1 h.
- Enxágue a medula espinhal com 4% de SD por 2 h. Em seguida, enxágue a medula espinhal com 100 mM de tampão de Na / 50 mM de fósforo por 15 min, 2x.
- Enxágue a medula espinhal com ácido peracético a 0,1% em etanol a 4% por 4 h. Em seguida, enxágue a medula espinhal com PBS por 1 h.
- Enxágue a medula espinhal com água deionizada por 1 h, 2x. Em seguida, enxágue a medula espinhal com PBS por 1 h.
- Liofilizar a medula espinhal a 0,01 mbar e -56 °C por 3 dias e armazenar seco até o uso.
2. Descelularização do nervo ciático suíno (Tempo estimado: 5 dias)
NOTA: Realizar a descelularização utilizando protocolo previamente estabelecido27. Todos os procedimentos devem ser feitos em um gabinete de biossegurança estéril à temperatura ambiente, salvo indicação em contrário. Todas as soluções devem ser filtradas estéreis usando um filtro superior de frasco (tamanho de poro de 0,2 μm) em frascos autoclavados. Os procedimentos a serem realizados a 37 °C podem ser feitos dentro de uma incubadora ou de um forno limpo regulado para 37°C.
- Preparação de soluções de descelularização
NOTA: Todas as soluções são calculadas para 1 L. Os usuários podem precisar ajustar o volume final necessário de acordo com suas necessidades experimentais.- Prepare 50 mM de tampão Na/10 mM phos misturando 1,86 g de NaCl, 0,262 g de d NaH2PO4H2O e 2,17 g de HNa2O4P·7H2O em 1 L de água deionizada.
- Prepare a solução de sulfobetaína-10 (SB-10) a 125 mM misturando 38,4 g de SB-10 em 1 L de tampão foso 50 mM Na/10 mM.
- Preparar a solução de sulfobetaína-16 (SB-16) a 3 % SD/0,6 mM misturando 30 g de SD e 0,24 g de SB-16 em 1 l de tampão fosfo-50 mM Na/10 mM.
- Preparação do nervo ciático suíno
NOTA: Os nervos ciáticos foram enviados congelados com PBS e mantidos a -80 ° C até o uso.- Descongele o nervo ciático a 4 °C na geladeira 18-24 h antes da descelularização.
- Corte o nervo ciático em pedaços pequenos (aproximadamente 1 cm de comprimento). Coloque uma peça em um tubo de 15 mL ou no máximo três peças em um tubo de 50 mL.
- Descelularização do nervo ciático
NOTA: Após cada etapa, as soluções de descelularização são despejadas manualmente em um béquer grande para serem descartadas, e um pequeno filtro autoclavável de aço inoxidável pode ser usado para ajudar a descartar as soluções de descelularização sem perder os tecidos necessários para cada etapa. O nervo ciático foi agitado a 15 rpm, salvo indicação em contrário.- Enxágue o nervo ciático com água deionizada por 7 h. Em seguida, enxágue o nervo ciático com sulfobetaína-10 125 mM (SB-10) em tampão fosfós 50 mM / 10 mM por 18 h.
- Enxágue o nervo ciático com 100 mM de tampão Na/50 mM de phos por 15 min. Em seguida, enxágue o nervo ciático com 3% de SD / 0,6 mM de sulfobetaína-16 (SB-16) em tampão foso 50 mM de Na / 10 mM por 2 h.
- Enxágue o nervo ciático com 100 mM de tampão de Na/50 mM de phos por 15 min, 3x. Em seguida, enxágue o nervo ciático com 125 mM SB-10 em tampão 50 mM Na/10 mM phos por 7 h.
- Enxágue o nervo ciático com 100 mM de tampão Na/50 mM de phos por 15 min. Em seguida, enxágue o nervo ciático com 3% de SD / 0,6 mM de SB-16 em 50 mM de tampão de phos de Na / 10 mM por 1,5 h.
- Enxágue o nervo ciático com 50 mM de tampão de Na / 10 mM de phos por 15 min, 3x. Em seguida, enxágue o nervo ciático com 75 U / mL de desoxirribonuclease (DNase) por 3 h sem agitação.
- Lave o nervo ciático com 50 mM de tampão de Na / 10 mM de phos por 1 h, 3x. Em seguida, enxágue o nervo ciático com 0,2 U / mL de Condroitinase ABC por 16 h sem agitação a 37 ° C.
- Enxágue o nervo ciático com PBS por 3 h, 3x. Liofilize o nervo ciático a 0,01 mbar e -56 °C por 3 dias e armazene seco até o uso.
3. Digestão de tecidos descelularizados e fabricação de hidrogéis compostos (Tempo estimado: 4 dias)
- Pique ou triture os tecidos descelularizados em pó usando uma tesoura ou homogeneizador. Esterilize as ferramentas para picar ou triturar os tecidos usando uma autoclave a 121 °C por 45 min. O método do óxido de etileno também é aplicável.
- Digerir os tecidos separadamente em solução de ácido clorídrico (HCl) 0,01 N contendo 1 mg/ml de pepsina a uma concentração de 15 mg/ml. Os pesos estimados da medula espinhal descelularizada e do nervo ciático são de 50-100 mg e 100-150 mg por peça, respectivamente.
- Coloque a barra magnética e mexa a 500 rpm e 4 °C por pelo menos 4 dias para gerar soluções de pré-gel.
- Misture o pré-gel do nervo ciático e da medula espinhal nas seguintes proporções volumétricas: 2:1, 1:1 e 1:2. Ajuste o pH 7,4 usando hidróxido de sódio (NaOH) 1 N e HCl e dilua até a concentração desejada usando meio M199 e 1x PBS. Incubar a 37 °C durante 30 min.
NOTA: Adicione NaOH 1 μL de cada vez. O meio M199 pode ser usado como um indicador de pH, pois fica rosa claro quando o pH é 7,4, mas as tiras de pH devem ser usadas para confirmar o nível de pH.
4. Verificação da descelularização
- A coloração de hematoxilina e eosina (H&E; Tempo estimado: 8 dias)
NOTA: Após cada etapa de enxágue, as soluções são despejadas manualmente em um béquer grande para serem descartadas.- Fixe a medula espinhal e o nervo ciático frescos e descelularizados em formaldeído a 3,7% a 4 ° C por 18 h. Coloque uma peça em um tubo de 15 mL.
- Retire o formaldeído e coloque os tecidos em sacarose a 10% por 1 dia. Retire 10% de sacarose e coloque os tecidos em 30% de sacarose por 6 dias.
- Encha um criomoldor de tamanho apropriado com temperatura de corte ideal (OCT) até a metade. Coloque os tecidos descelularizados, cubra-os com OCT e deixe-os absorver o OCT por 1 dia.
- Após 1 dia, congele os tecidos durante a noite a -80 °C. Criosecção dos tecidos com 10 μm de espessura usando um criostato.
- Enxágüe com 1x PBS por 5 min, 2x. Em seguida, enxágue com água da torneira por 5 min.
- Manchar com solução de hematoxilina por 1 min. Enxágüe com água da torneira por 1 min, 3x.
- Manchar com solução de eosina por 1 min. Enxágue com etanol a 95% por 1 min, 2x e com etanol a 100% por 1 min, 3x.
- Enxágüe com xileno por 1 min, 2 min e depois 1 min. Deixe as lâminas secarem por 5 min.
- Use um cotonete para pingar 3 a 4 gotas de solução de montagem de dibutilftalato poliestireno xileno (DPX) nas lâminas. Coloque as lamínulas em cima dos slides cobertos com DPX. Deixe as lâminas secarem durante a noite.
- Análise de DNA (Tempo estimado: 1 h)
- Pesar tecidos descelularizados e liofilizados. Isole e quantifique o DNA usando kits disponíveis comercialmente de acordo com as instruções do fabricante.
5. Caracterização de hidrogéis compósitos
- Teste de turbidez de gelificação (Tempo estimado: 1 h)
- Coloque 100 μL de soluções de pré-gel em cada poço de uma placa de 96 poços no gelo. Leia a absorbância a 405 nm a cada 2 minutos por 45 minutos usando um leitor de placas.
- Calcular a absorbância normalizada utilizando a seguinte equação:
(Absorbância - AbsorbânciaInicial) / (AbsorbânciaMáxima - AbsorbânciaInicial) - Calcule a inclinação da curva e o tempo para atingir 50% e 95% de gelificação, t1/2 e t95, respectivamente.
- Teste de compressão (tempo estimado: 1 min por hidrogel)
- Fabricar hidrogéis compósitos na concentração de 12 mg/mL com 8 mm de diâmetro e 2 mm de altura.
- Use um reômetro para comprimir as amostras com uma carga de 250 N entre placas paralelas de aço inoxidável a uma taxa de deformação de 10% da altura da amostra/min. O software que fornece leituras do reômetro fornecerá uma curva tensão-deformação aplicando a força e medindo a deformação até que os hidrogéis se quebrem.
- Calcule o módulo de Young a partir da inclinação da região linear das curvas tensão-deformação.
6. Cultura tridimensional de ASCs humanos em hidrogéis compostos de nervos
- Preparação de plataforma tridimensional (3D) (Tempo estimado: 3 h)
- Gravura em àgua forte a bolacha de silicone com SU-8 fotorresistente para gerar testes padrões circulares de 200 μm na profundidade e de 4 milímetros no diâmetro.
- Misture a base de polidimetilsiloxano (PDMS) e o agente de cura na proporção de 10:1. Despeje a mistura no wafer de silício e deixe descansar por 20 min para remover todas as bolhas que surgem da mistura da base PDMS e do agente de cura.
- Leve ao forno e catalise durante 2 h a 70 °C. Desenforme a folha de PDMS curada e perfure usando um punção de biópsia de 8 mm de diâmetro para fazer micropoços PDMS.
- Coloque os micropoços em uma placa de 96 poços e coloque a placa de poço em um limpador de plasma de ar para esterilizar os micropoços PDMS.
- Funcionalize micropoços PDMS com 1% de polietilenoimina (PEI) e 0,1% de glutaraldeído (GA) por 10 min e 20 min, respectivamente. Lave os micropoços com água destilada, 2x.
- Preparação de hASCs (Tempo estimado: 7 dias)
- Células de passagem de cultura por 2-5 passagens em meios de crescimento de hASCs (meios basais de hASCs suplementados com soro fetal bovino (FBS) e penicilina/estreptomicina (Pen-strep)) até confluentes. Passe e calcule o número de células usando um hemacitômetro ou contador de células.
- Hidrogéis compostos de nervo carregados de ASC (Tempo estimado: 2 h)
- Misture o pré-gel do nervo ciático e da medula espinhal em uma proporção volumétrica de 2:1, 1:1, 1:2 e prepare o hidrogel somente da medula espinhal sem misturar nenhum pré-gel do nervo ciático.
- Adicione o meio M199 e ajuste o pH 7,4 usando 1 N NaOH e HCl. Ressuspenda os hASCs com meio de crescimento no pré-gel a uma densidade de 1 x 106 células / mL.
NOTA: A quantidade de M199 e suspensão celular deve ser de 10% de pré-gel. - Dilua o pré-gel para 12 mg/mL usando 1x PBS. Coloque o pré-gel em micropoços e incube por 30 min. Cultura de hidrogéis carregados de ASC em meios de crescimento de hASCs.
- Teste de viabilidade celular (Tempo estimado: 4 h por dia)
- Preparar soluções de teste de viabilidade usando reagentes disponíveis comercialmente de acordo com as instruções do fabricante.
- Aspire a média nos dias 1, 4, 7 e 14. Adicionar o reagente aos alvéolos e incubar a 37 °C durante 3 h, seguindo as instruções do fabricante.
- Ler fluorescência com excitação/emissão de 560/590 nm utilizando um leitor de placas. Calcule a diferença percentual usando a seguinte equação:
[(amostra de fluorescência -branco de fluorescência) /branco de fluorescência] x 100
Resultados
Os tecidos descelularizados foram preparados usando protocolos previamente estabelecidos com pequenas modificações26,27. Após a descelularização, liofilização e digestão, foram fabricados hidrogéis compostos nervosos nas proporções de SN:SC = 2:1, 1:1, 1:2 e hidrogéis somente da medula espinhal (Figura 1). A remoção dos componentes nucleares foi confirmada pela coloração H&E (Figura 2A). Para avaliar quantitativamente a descelularização, o DNA residual foi medido dentro da MEC. O conteúdo de dsDNA na dura-máter fresca foi de 132,6 ± 21,3 ng dsDNA/mg de tecido seco, enquanto o parênquima fresco e descelularizado da medula espinhal continha 22,6 ± 8,3 ng de dsDNA/mg de tecido seco e 23,74 ± 6,69 ng dsDNA/mg de tecido seco, respectivamente (Figura 2B). Indicava que a dura-máter deveria ser removida antes da descelularização. A quantidade de dsDNA do nervo ciático fresco e descelularizado foi de 222,5 ± 42,65 e 0,63 ng dsDNA/mg de tecido seco, respectivamente (Figura 2C).
A cinética de gelificação dos hidrogéis compostos nervosos foi avaliada para determinar a velocidade de gelificação (S) e os tempos para atingir 50% e 95% da turbidez final (t1/2 e t95). A cinética de gelificação mostrou uma forma sigmoidal para todos os grupos de hidrogel (Figura 3A). A velocidade de gelificação (S) em todos os grupos de hidrogel não foi significativamente diferente entre si. O tempo necessário para atingir metade da turbidez final, t1/2, foi de 11,32 ± 0,57 min, 13,33 ± 0,6 min e 15,7 ± 0,92 min e 17,23 ± 1,13 min para SN: SC = 2: 1, 1: 1, 1: 2 e hidrogéis somente da medula espinhal, respectivamente. O tempo necessário para atingir 95% da turbidez final, t95, foi de 13,8 ± 0,83 min, 15,53 ± 0,83 min, 18,38 ± 0,79 min e 19,62 ± 1,27 para SN:SC= 2:1, 1:1, 1:2 e hidrogéis apenas da medula espinhal, respectivamente. Esses resultados indicam que os hidrogéis com maior conteúdo do nervo ciático atingem o estado estacionário mais rapidamente, e a MEC do nervo ciático pode promover a montagem do hidrogel. O resultado do teste de compressão mostrou uma tendência de que hidrogéis com maior conteúdo na medula espinhal proporcionam maior rigidez; no entanto, não foi significativamente diferente em todas as diferentes proporções de hidrogéis compostos ( Figura 3B ).
Por fim, para determinar a viabilidade celular das hASCs em todos os grupos de hidrogel, as culturas 3D foram montadas usando micropoços PDMS microfabricados, conforme mostrado na Figura 4. Ao longo da cultura de 14 dias, a viabilidade do ASC foi medida usando um ensaio metabólico colorimétrico e de fluorescência baseado em meios de cultura celular comercialmente disponíveis, onde as diferenças percentuais das leituras foram calculadas em quatro pontos de tempo diferentes: dia 1, dia 4, dia 7 e dia 14 (Figura 5). O valor da diferença percentual aumentou à medida que os pontos de tempo aumentaram, e o do hidrogel apenas da medula espinhal foi menor do que o restante dos grupos nos dias 1, 4 e 14. Em conjunto, esses dados sugerem que a viabilidade do hASC aumentou ao longo do período de cultivo devido à proliferação celular e ao incremento na atividade metabólica celular.

Figura 1: Fabricação de hidrogéis compostos nervosos. A medula espinhal suína e os nervos ciáticos foram descelularizados, liofilizados e digeridos para obter soluções de pré-gel. As soluções de pré-gel do nervo ciático e da medula espinhal foram misturadas na proporção de 2:1, 1:1 e 1:2, e o pré-gel somente da medula espinhal também foi preparado. Todas as soluções de pré-gel foram incubadas a 37 °C para gerar hidrogéis compostos nervosos. Clique aqui para ver uma versão maior desta figura.
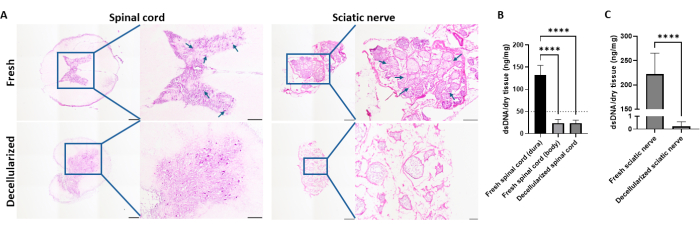
Figura 2: Verificação da descelularização. (A) Coloração de H&E de medula espinhal suína fresca e descelularizada e nervos ciáticos. As setas indicam a presença de células nos tecidos. Barras de escala = 1 mm para imagens de visão ampla e 500 μm para imagens de zoom (200 μm apenas para imagens do nervo ciático descelularizado com zoom). (B) Análise de DNA da dura-máter fresca, parênquima e medula espinhal descelularizada (n = 10, 16 e 6, respectivamente). (C) Análise de DNA dos nervos ciático fresco e descelularizado (n = 8 e 3, respectivamente). As barras de erro representam desvios padrão. A análise estatística foi feita por meio de ANOVA one-way com teste post-hoc de Tukey para (B) e teste t para (C). Abreviaturas: ns = não significativo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Caracterizações de hidrogéis compostos nervosos. (A) Absorbância normalizada de hidrogéis compostos nervosos (n = 5). (B) Módulo de Young de hidrogéis compostos descelularizados da medula espinhal e do nervo (n = 4 para medula espinhal descelularizada e 3 para cada grupo composto de hidrogel, respectivamente). As barras de erro representam desvios padrão. A análise estatística foi feita por meio de ANOVA one-way com teste post-hoc de Tukey. Abreviaturas: ns = não significativo. Clique aqui para ver uma versão maior desta figura.
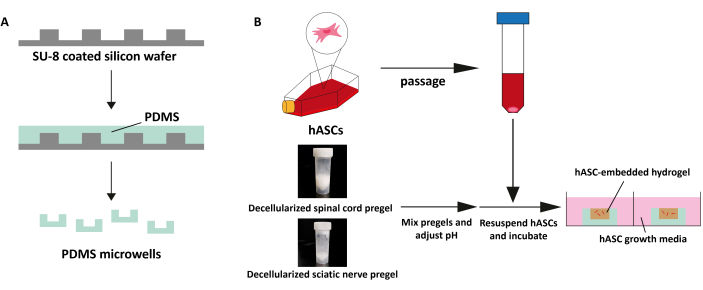
Figura 4: Imagem esquemática da cultura 3D. (A) Os micropoços PDMS foram fabricados em um wafer de silício revestido com SU-8. Cada micropoço foi perfurado usando um punção de biópsia de 8 mm. (B) Descelularizar a medula espinhal e o nervo ciático em diferentes proporções, ajustar o pH para 7,4, ressuspender com hASCs, colocar o pré-gel no micropoço e incubar por 30 min a 37 ° C. Clique aqui para ver uma versão maior desta figura.
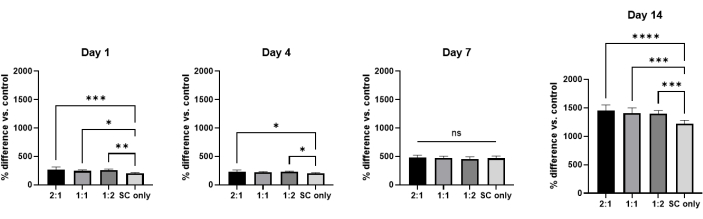
Figura 5: Ensaio de viabilidade celular. A diferença percentual de hASCs cultivadas em hidrogéis compostos de nervo nos dias 1, 4, 7 e 14 (n = 3). As barras de erro representam desvios padrão. A análise estatística foi feita por meio de ANOVA one-way com teste post-hoc de Tukey. * p<0,05; ** p<0,01; p<0,005; p<0,001; NS: Não significativo. Clique aqui para ver uma versão maior desta figura.
Discussão
Acredita-se amplamente que a fisiopatologia da LM é complexa e multifacetada. Embora terapias únicas, como transplante de células, administração de medicamentos e biomateriais, tenham fornecido informações valiosas sobre a LME, a natureza complicada da LME pode limitar sua eficácia individual 28,29,30,31. Portanto, os esforços para desenvolver terapias combinatórias eficazes aumentaram. Os hidrogéis compostos nervosos descritos neste estudo podem servir como um veículo de entrega eficaz para células ou medicamentos. No que diz respeito às células, os ASCs são um dos candidatos promissores para o transplante de células. As ASCs secretam fatores imunomoduladores, como interleucina-10 (IL-10) e fator de crescimento transformador beta (TGF-β), bem como fatores neurotróficos, como fator de crescimento nervoso (NGF), fator neurotrófico derivado do cérebro (BDNF), fator neurotrófico derivado da glia (GDNF) e neurotrofina-3 (NT-3), que levam ao aumento do crescimento de neuritos dos gânglios da raiz dorsal in vitro e recuperação da função in vivo 17,19,32,33, 34. ASCs entregues em soluções aquosas promoveram recuperação funcional após LM em ratos e humanos; no entanto, foram observados desafios com a mediação da migração, diferenciação, sobrevivência e diferenciação de ASCs 35,36,37. Além disso, existem relatos conflitantes sobre o potencial tumorigênico das ASCs transplantadas; enquanto alguns estudos indicaram que as ASCs podem contribuir para a proliferação e metástase de diferentes tipos de câncer, outros estudos também mostraram potenciais antitumorigênicos 38,39,40,41 Portanto, um perfil de segurança de longo prazo das ASCs em hidrogéis compostos nervosos precisa ser investigado no futuro. Aqui, a medula espinhal descelularizada e os nervos ciáticos foram estudados separadamente para o reparo da LME.
Medula espinhal descelularizada foi injetada em um modelo de rato com LM e estimulou o crescimento axonal na lesão e elevou a recuperação funcional; no entanto, devido à rápida degradação, um cisto foi formado e a recuperação diminuiu após 4-8 semanas de tratamento4, 42. O hidrogel acelular descelularizado do nervo ciático foi injetado em ratos com LME e promoveu a regeneração neural, mas a eficácia do hidrogel foi limitada devido à rápida degradação24. Portanto, abordagens combinatórias usando tecidos descelularizados têm ganhado atenção recentemente. Foi relatado que hidrogéis descelularizados da medula espinhal promoveram a proliferação, migração e diferenciação de células-tronco neurais / células progenitoras em neurônios4. Também facilitou o crescimento de neuritos 3D de células de neuroblastoma N1E-115, indicando que os hidrogéis da medula espinhal descelularizados podem ser um andaime atraente para promover a regeneração axonal26. Os nervos ciáticos descelularizados foram estudados com encapsulamento de Schwann e mostraram potencial como enxerto de nervo após LM43. Em conjunto, espera-se que uma combinação de medula espinhal descelularizada e nervos ciáticos promova a regeneração axonal e a restauração tecidual. O presente estudo também não inclui a avaliação dos efeitos terapêuticos dos hidrogéis nervosos carregados de ASC. Portanto, é essencial avaliar os potenciais regenerativos, como efeitos pró-angiogênicos e neurotróficos, da plataforma por meio de estudos in vitro e in vivo . Além disso, os hidrogéis compostos de nervos podem ser facilmente aplicados para encapsular outros tipos de células, como células de Schwann, células-tronco olfativas e células-tronco neurais, para melhorar a eficácia terapêutica do transplante de células. Seria intrigante investigar a segurança e a eficácia de vários tipos de células dentro do hidrogel composto do nervo em diferentes estágios da LME.
Uma das etapas críticas na criação de hidrogéis compostos é preparar uma quantidade adequada de tecido, especialmente a medula espinhal. O rendimento da medula espinhal descelularizada é significativamente baixo, conforme observado no protocolo (50-100 mg de medula espinhal e 100-150 mg de nervo ciático); Assim, a colheita ou obtenção de medula espinhal de pequenos animais, como camundongos e ratos, não é recomendada. Sugere-se que pelo menos animais de médio porte, como coelhos, ganhem uma quantidade substancial de matrizes da medula espinhal. Além disso, é importante verificar o pH ao digerir tecidos descelularizados, pois a adição de tecido pode mudar o pH além da faixa de ativação da pepsina necessária, que é de cerca de 1,5-2. Os tempos de agitação para descelularização da medula espinhal são maiores do que o método previamente estabelecido26 porque a velocidade de agitação é mais lenta no protocolo atual. O rotador utilizado neste protocolo oferece até 83 rpm, enquanto um máximo de 200 rpm foi utilizado nos métodos previamente estabelecidos. Portanto, os tempos de agitação foram aumentados duas vezes para lavar completamente todos os detritos celulares. Para garantir que todas as soluções de descelularização possam penetrar nos tecidos e lavar todo o conteúdo celular e nuclear, os tempos e a velocidade de agitação precisam ser otimizados usando histologia ou análise de DNA do lado do usuário. Sugere-se que a relação entre os tecidos e a solução de descelularização seja de no mínimo 1:15 [p/v]. Os tecidos descelularizados no protocolo previamente estabelecido26 foram digeridos/agitados à temperatura ambiente; no entanto, neste protocolo, eles foram digeridos com uma barra magnética em uma placa de agitação a 4 °C e 500 rpm por 4 dias. O motor da placa de agitação pode gerar calor e introduzi-lo na solução de pré-gel. Portanto, recomenda-se digerir em baixas temperaturas ou usar uma placa de agitação com temperatura controlável.
Conforme observado na análise de DNA (Figura 2B), é fundamental remover a dura-máter da medula espinhal porque uma quantidade significativa de DNA pode ser encontrada na dura-máter. A dura-máter, ao contrário do parênquima da medula espinhal, consiste em tecido fibroso; portanto, diferentes métodos de descelularização devem ser utilizados, conforme documentado anteriormente44,45. A coloração H&E e a análise de DNA de tecidos descelularizados têm sido utilizadas para verificar a eficácia do processo de descelularização. Os seguintes critérios precisam ser satisfeitos para cumprir os objetivos de descelularização bem-sucedida: 1. Menos de 50 ng dsDNA / mg de peso seco da ECM, 2. Menos de 200 pb de comprimento do fragmento de DNA, 3. Falta de material nuclear em seções de tecido ou H & E5. A análise qualitativa da coloração de H&E após a descelularização mostrou uma falta de coloração de núcleos, sugerindo uma remoção bem-sucedida de células. Além disso, componentes da MEC, como colágeno e outras proteínas da matriz, foram retidos, e a intensidade da coloração foi reduzida após a descelularização, refletindo a remoção do material celular. Após a descelularização, o conteúdo de DNA foi de 0,63 ng no nervo ciático e 23,74 ± 6,69 ng na medula espinhal por mg de peso seco da MEC, o que está abaixo do limite aceitável para aplicação in vivo.
As medições reológicas de hidrogéis compostos precisam ser cuidadosamente projetadas, pois reômetros com alta força de compressão ou testadores de tração não podem ser usados para analisar as propriedades mecânicas de materiais macios, como hidrogéis compostos nervosos criados neste estudo. As amostras serão rasgadas/rasgadas quando forem agarradas no testador de tração, e a compressão com alta força não fornecerá dados sensíveis o suficiente para serem analisados. Neste estudo, foi utilizado um reômetro com força de compressão de 250 N, sendo aconselhável encontrar um aparelho com força semelhante ou adequada para os propósitos dos usuários. Como alternativa, diferentes medições reológicas, como medição de cisalhamento oscilatório, podem ajudar a determinar os módulos de armazenamento e perda. A redução das propriedades mecânicas após a descelularização é uma limitação neste estudo. Embora o módulo de Young de todos os grupos de hidrogel seja semelhante ao da medula espinhal descelularizada, ele é significativamente diferente da medula espinhal fresca (dados não mostrados). Células-tronco neurais e MSCs cultivadas em materiais relativamente moles mostraram aumento da diferenciação neuronal e expressão de tubulina β-III, respectivamente46,47. No entanto, é possível reforçar ou reticular os materiais descelularizados com outros materiais, como alginato, poli (etilenoglicol), genipina e glutaraldeído 48,49,50,51. A otimização será necessária para garantir que essas estratégias para melhorar as propriedades mecânicas dos hidrogéis não influenciem o comportamento ou a viabilidade celular.
A variabilidade lote a lote de hidrogéis compostos nervosos pode ser observada em parte devido a diferenças na idade, sexo, peso e espécie dos animais. O uso controlado e consistente do mesmo tipo de animais pode ajudar a mitigar a variabilidade. Agrupar as amostras de tecido de diferentes animais também pode ajudar a reduzir a variabilidade entre os lotes52. Um dos desafios potenciais para traduzir este estudo para aplicações clínicas é a escalabilidade. O baixo rendimento da descelularização da medula espinhal dificultaria a produção de uma grande quantidade de tecidos descelularizados. Novos métodos precisariam ser desenvolvidos/otimizados para gerar mais tecidos, ou a dura-máter poderia ser descelularizada em conjunto para aumentar o rendimento após a descelularização. Outro desafio potencial é a autorização regulatória. Nos EUA, o FDA é responsável pela aprovação regulatória de terapias baseadas em células53. A autoridade reguladora da República da Coreia aprovou a entrada no mercado do CARTISTEM, que é um produto à base de MSC que consiste em MSCs alogênicas derivadas do sangue do cordão umbilical e 4% de hidrogel de hialuronato para tratamento de defeitos da cartilagem do joelho54. Casos precedentes como esses podem ajudar a agilizar o processo de revisão regulatória, fornecendo dados de segurança e eficiência.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pela Fundação PhRMA e pelos Institutos Nacionais de Saúde por meio do prêmio número P20GM139768 e R15NS121884 concedido à YS. Queremos agradecer ao Dr. Kartik Balachandran e ao Dr. Raj Rao, do Departamento de Engenharia Biomédica da Universidade de Arkansas, por nos deixarem usar seus equipamentos. Além disso, queremos agradecer ao Dr. Jin-Woo Kim e ao Sr. Patrick Kuczwara, do Departamento de Engenharia Biológica e Agrícola da Universidade de Arkansas, por fornecerem treinamento em reômetro.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-(Decyldimethylammonio)propane sulfonate inner salt | Sigma-Aldrich | D4266 | Used during sciatic nerve decellularization, SB-10 |
| 3-(N,N-Dimethylpalmitylammonio)propane sulfonate | Sigma-Aldrich | H6883 | Used during sciatic nerve decellularization, SB-16 |
| AlamarBlue reagent | Fisher Scientific | DAL1100 | Used during AlamaBlue cell viabiiltiy test |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | Used during sciatic nerve decellularization |
| Cryostat | Leica | CM1860 | |
| Deoxyribonuclase | Sigma-Aldrich | D4263 | Used during sciatic nerve decellularization |
| Disodium hydrogen phosphate heptahydrate | VWR | BDH9296 | Chemical for 100 mM Na/50 mM phos and 50 mM Na/10 mM phos buffer |
| DNeasy Blood & Tissue kit | Qiagen | 69506 | Used during DNA analysis |
| Dpx Mountant for histology,slide mounting medium | Sigma-Aldrich | 6522 | Used during H&E staining |
| Eosin | Sigma-Aldrich | HT110216 | Used during H&E staining |
| Ethanol | VWR | 89125-172 | |
| Formaldehyde | Sigma-Aldrich | 252549 | Used during H&E staining |
| Glutaraldehyde (GA) | Sigma-Aldrich | G6257 | Used during PDMS surface functionalization |
| hASC growth media | Lonza | PT-4505 | Used to culture hASCs, containing of fetal bovine serum and penicilin/streptomycin |
| Hematoxylin | VWR | 26041-06 | Used during H&E staining |
| human adipose-derived stem cell | Lonza | PT-5006 | |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 320331 | Used to digest decellularizied tissues and adjust pregels solutions |
| M199 media | Sigma-Aldrich | M0650 | Used to dilute pregels to desired concentration |
| Optimal cutting temperatue compound | Tissue-Tek | 4583 | |
| Pepsin | Sigma-Aldrich | P7000 | Used to digest decellularized tissues |
| Peracetic acid | Lab Alley | PAA1001 | Used during spinal cord decellularization |
| Phosphate buffered saline (PBS) | VWR | 97062-948 | |
| Plate reader | BioTek Instruments | Synergy Mx | |
| Polyethyleneimine (PEI) | Sigma-Aldrich | 181978 | Used during PDMS surface functionalization |
| Porcine sciatic nerve | Tissue Source LLC | Live pigs, with no identifiable information and no traceability details | |
| Porcine spinal cord | Tissue Source LLC | Live pigs, with no identifiable information and no traceability details | |
| QuantiFluor dsDNA system | Promega | E2670 | Used to analyze DNA contents |
| Rheometer | TA Instruments | DHR 2 | |
| Rugged rotator | Glas-co | 099A RD4512 | Used during spinal cord decellularization |
| Sodium chloride (NaCl) | VWR | BDH9286 | Chemical for 100 mM Na/50 mM phos and 50 mM Na/10 mM phos buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sodium dihydrogen phosphate monohydrate | VWR | BDH9298 | Chemical for 100 mM Na/50 mM phos and 50 mM Na/10 mM phos buffer |
| Sodium hydroxide solution (NaOH) | Sigma-Aldrich | 415443 | Used to adjust pregels solutions |
| SU-8 | Kayaku advnaced materials | SU8-100 | Used to coat silicon wafer |
| Sucrose | Sigma-Aldrich | S8501 | Used during spinal cord decellularization |
| Sylgard 184 silicone elastomer kit | DOW | 1317318 | Polydimethylxiloxane (PDMS) base and curing agent |
| Triton X-100 | Sigma-Aldrich | X100 | Used during spinal cord decellularization |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher | 25300062 | Used during hASC work and during spinal cord decellularization |
| Tube revolver rotator | Thermo Fisher | 88881001 | Used during sciatic nerve decellularization |
| Xylene | VWR | MK866816 | Used during H&E staining |
Referências
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. National Spinal Cord Injury Statistical Center. , (2017).
- Anjum, A., et al. Spinal cord injury: Pathophysiology, multimolecular interactions, and underlying recovery mechanisms. Int J Mol Sci. 21 (20), 1-35 (2020).
- Führmann, T., Anandakumaran, P. N., Shoichet, M. S. Combinatorial therapies after spinal cord injury: How can biomaterials help. Adv Healthcare Mater. 6 (10), 1-21 (2017).
- Xu, Y., et al. Understanding the role of tissue-specific decellularized spinal cord matrix hydrogel for neural stem/progenitor cell microenvironment reconstruction and spinal cord injury. Biomaterials. 268, 120596 (2021).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Franko, R., et al. Mechanical properties of native and decellularized reproductive tissues: insights for tissue engineering strategies. Sci Rep. 14 (1), 1-14 (2024).
- Rowlands, D., Sugahara, K., Kwok, J. C. F. Glycosaminoglycans and glycomimetics in the central nervous system. Molecules. 20 (3), 3527-3548 (2015).
- Silver, D. J., Silver, J. Contributions of chondroitin sulfate proteoglycans to neurodevelopment, injury, and cancer. Curr Opinion Neurobiol. 27, 171-178 (2014).
- Porzionato, A., et al. Tissue-engineered grafts from human decellularized extracellular matrices: A systematic review and future perspectives. Int J Mol Sci. 19 (12), 4117 (2018).
- Deng, L. X., et al. A novel growth-promoting pathway formed by GDNFoverexpressing Schwann cells promotes propriospinal axonal regeneration, synapse formation, and partial recovery of function after spinal cord injury. J Neurosci. 33 (13), 5655-5667 (2013).
- Tabakow, P., et al. Transplantation of autologous olfactory ensheathing cells in complete human spinal cord injury. Cell Transpl. 22 (9), 1591-1612 (2013).
- Hawryluk, G. W. J., et al. An in vivo characterization of trophic factor production following neural precursor cell or bone marrow stromal cell transplantation for spinal cord injury. Stem Cells Dev. 21 (12), 2222-2238 (2012).
- Zipser, C. M., et al. Cell-based and stem-cell-based treatments for spinal cord injury: evidence from clinical trials. Lancet Neurol. 21 (7), 659-670 (2022).
- Mackay-Sim, A., et al. Autologous olfactory ensheathing cell transplantation in human paraplegia: A 3-year clinical trial. Brain. 131 (9), 2376-2386 (2008).
- Suzuki, H., et al. Current concepts of neural stem/progenitor cell therapy for chronic spinal cord injury. Front Cell Neurosci. 15, 794692 (2022).
- Kokai, L. E., Marra, K., Rubin, J. P. Adipose stem cells: Biology and clinical applications for tissue repair and regeneration. Trans Res. 163 (4), 399-408 (2014).
- Kingham, P. J., Kolar, M. K., Novikova, L. N., Novikov, L. N., Wiberg, M. Stimulating the neurotrophic and angiogenic properties of human adipose-derived stem cells enhances nerve repair. Stem Cells Dev. 23 (7), 741-754 (2014).
- Song, Y. H., Shon, S. H., Shan, M., Stroock, A. D., Fischbach, C. Adipose-derived stem cells increase angiogenesis through matrix metalloproteinase-dependent collagen remodeling. Integr Biol (United Kingdom). 8 (2), 205-215 (2016).
- Ribeiro, C. A., et al. The secretome of stem cells isolated from the adipose tissue and Wharton jelly acts differently on central nervous system derived cell populations. Stem Cell Res Ther. 3 (3), 18 (2012).
- Salgado, J. B. O. G., et al. Adipose tissue derived stem cells secretome: Soluble factors and their roles in regenerative medicine. Curr Stem Cell Res Ther. 5 (2), 103-110 (2010).
- Kapur, S. K., Katz, A. J. Review of the adipose derived stem cell secretome. Biochimie. 95 (12), 2222-2228 (2013).
- Xu, X. M., Chen, A., Guénard, V., Kleitman, N., Bunge, M. B. Bridging Schwann cell transplants promote axonal regeneration from both the rostral and caudal stumps of transected adult rat spinal cord. J Neurocytol. 26 (1), 1-16 (1997).
- Guest, J. D., et al. Influence of IN-1 antibody and acidic FGF-fibrin glue on the response of injured corticospinal tract axons to human Schwann cell grafts. J Neurosci Res. 50 (5), 888-905 (1997).
- Cornelison, R. C., et al. Injectable hydrogels of optimized acellular nerve for injection in the injured spinal cord. Biomed. Mater. 13 (3), 034110 (2018).
- Crapo, P. M., et al. Biologic scaffolds composed of central nervous system extracellular matrix. Biomaterials. 33 (13), 3539-3547 (2012).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- McCrary, M. W., et al. Novel sodium deoxycholate-based chemical decellularization method for peripheral nerve. Tissue Eng Part C. 26 (1), 23-36 (2020).
- Shahemi, N. H., et al. Application of conductive hydrogels on spinal cord injury repair: A Review. ACS Biomater Sci Eng. 9 (7), 4045-4085 (2023).
- Huang, L. Y., et al. Cell transplantation therapies for spinal cord injury focusing on bone marrow mesenchymal stem cells: Advances and challenges. World J Stem Cells. 15 (5), 385-399 (2023).
- Chakraborty, A., Ciciriello, A. J., Dumont, C. M., Pearson, R. M. Nanoparticle-based delivery to treat spinal cord injury - a mini- review. AAPS PharmSciTech. 22 (3), 101 (2022).
- Upadhyay, R. K. Drug delivery systems, CNS protection, and the blood brain barrier. BioMed Res Int. , d869269 (2014).
- Liu, G., et al. Transplantation of adipose-derived stem cells for peripheral nerve repair. Int J Mol Med. 28 (4), 565-572 (2011).
- Sun, T., et al. Adipose-derived stem cells in immune-related skin disease: a review of current research and underlying mechanisms. Stem Cell Res Ther. 15 (1), 1-14 (2024).
- Lewis, M., et al. Materials today bio neuro-regenerative behavior of adipose-derived stem cells in aligned collagen I hydrogels. Mater Today Bio. 22, 100762 (2023).
- Thuret, S., Moon, L. D. F., Gage, F. H. Therapeutic interventions after spinal cord injury. Nat Rev Neurosci. 7 (8), 628-643 (2006).
- Ohta, Y., et al. Intravenous infusion of adipose-derived stem/stromal cells improves functional recovery of rats with spinal cord injury. Cytotherapy. 19 (7), 839-848 (2017).
- Hur, J. W., et al. Intrathecal transplantation of autologous adipose-derived mesenchymal stem cells for treating spinal cord injury: A human trial. J Spinal Cord Med. 39 (6), 655-664 (2016).
- Muehlberg, F. L., et al. Tissue-resident stem cells promote breast cancer growth and metastasis. Carcinogenesis. 30 (4), 589-597 (2009).
- Ji, S. Q., et al. Adipose tissue-derived stem cells promote pancreatic cancer cell proliferation and invasion. Brazilian J Med Biol Res. 46 (9), 758-764 (2013).
- Zhu, Y., et al. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1. Leukemia. 23 (5), 925-933 (2009).
- Cousin, B., et al. Adult stromal cells derived from human adipose tissue provoke pancreatic cancer cell death both in vitro and in vivo. PLoS ONE. 4 (7), 31-34 (2009).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Eng Part A. 22 (3-4), 306-317 (2016).
- Bousalis, D., et al. Decellularized peripheral nerve as an injectable delivery vehicle for neural applications. Biomed Mater Res Part A. 110, 595-611 (2022).
- Sharma, A., Liao, J., Williams, L. N. Structure and mechanics of native and decellularized porcine cranial dura mater. Eng. 4 (2), 205-213 (2023).
- Ozudogru, E., et al. Decellularized spinal cord meninges extracellular matrix hydrogel that supports neurogenic differentiation and vascular structure formation. J Tissue Eng Regen Med. 15 (11), 948-963 (2021).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Saha, K., et al. Substrate modulus directs neural stem cell behavior. Biophys J. 95 (9), 4426-4438 (2008).
- Jiang, T., et al. Preparation and characterization of genipin-crosslinked rat acellular spinal cord scaffolds. Mater Sci Eng C. 33 (6), 3514-3521 (2013).
- Gao, S., et al. Comparison of glutaraldehyde and carbodiimides to crosslink tissue engineering scaffolds fabricated by decellularized porcine menisci. Mater Sci Eng C. 71, 891-900 (2017).
- Zhou, J., et al. Tissue engineering of heart valves: PEGylation of decellularized porcine aortic valve as a scaffold for in vitro recellularization. BioMe Eng Onl. 12 (1), 1-12 (2013).
- Sun, D., et al. Novel decellularized liver matrix-alginate hybrid gel beads for the 3D culture of hepatocellular carcinoma cells. Int J Biol Macromol. 109, 1154-1163 (2018).
- Gaetani, R., et al. Evaluation of different decellularization orotocols on the generation of pancreas-derived hydrogels. Tiss Engi C. 24 (12), 697-708 (2018).
- Mendicino, M., Fan, Y., Griffin, D., Gunter, K. C., Nichols, K. Current state of U.S. Food and Drug Administration regulation for cellular and gene therapy products: potential cures on the horizon. Cytotherapy. 21 (7), 699-724 (2019).
- Lim, H. C., et al. Allogeneic umbilical cord blood-derived mesenchymal stem cell implantation versus microfracture for large, full-thickness cartilage defects in older patients: A multicenter randomized clinical trial and extended 5-year clinical follow-up. Ortho J Sports Med. 9 (1), 1-15 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados