Method Article
Анализ ДНК-белковых взаимодействий с биослойной интерферометрией на основе стрептавидина
В этой статье
Резюме
В данной статье описан протокол изучения ДНК-белковых взаимодействий с использованием системы биослойной интерферометрии (BLI) на основе стрептавидина. В нем изложены основные шаги и соображения по использованию базовой или расширенной кинетики связывания для определения равновесной аффинности связывания (KD) взаимодействия.
Аннотация
Белок-ДНК-взаимодействия лежат в основе основных клеточных процессов. Понимание этих взаимодействий имеет решающее значение для выяснения молекулярных механизмов различных путей. Ключевые факторы, такие как структура, последовательность и длина молекулы ДНК, могут существенно влиять на связывание с белками. Биослойная интерферометрия (BLI) — это метод без меток, который измеряет кинетику связывания между молекулами, предлагая простой и точный подход к количественному изучению взаимодействий белка и ДНК. Основным преимуществом BLI по сравнению с традиционными методами на основе геля является его способность предоставлять данные о кинетике связывания в режиме реального времени, что позволяет точно измерять константу диссоциации равновесия (KD) для динамических взаимодействий белка и ДНК. В данной статье представлен базовый протокол определения значения KD взаимодействия между белком репликации ДНК, белком репликации А (RPA) и субстратом одноцепочечной ДНК (ssDNA). RPA связывается с одноцепленной ДНК с высокой аффинностью, но также должна быть легко вытеснена для облегчения последующих взаимодействий белков в биологических путях. В описанном анализе BLI биотинилированная одноцеклеточная ДНК иммобилизуется на биосенсоре, покрытом стрептавидином. Затем измеряется кинетика связывания (ассоциация и диссоциация) RPA с биосенсор-связанной ДНК. Полученные данные анализируются для получения точных значений константы скорости ассоциации (ka), константы скорости диссоциации (kd) и константы равновесной связи (KD) с использованием системного программного обеспечения.
Введение
Клеточные белки играют ключевую роль в управлении сложными биологическими процессами, происходящими в живых организмах. Оптимальное функционирование этих путей зависит от взаимодействия между белками и другими биомолекулами внутри клетки, включая взаимодействие с белками-партнерами и нуклеиновымикислотами. Таким образом, постижение тонкостей клеточных процессов требует глубокого понимания динамики белково-нуклеиновых взаимодействий.
Традиционно белок-нуклеиновые взаимодействия изучались с помощью электрофоретического анализа сдвига подвижности геля (EMSAs)2. В этом анализе белки инкубируют с синтетическими олигонуклеотидами (либо ДНК/РНК, содержащими определенные длины или последовательности) в течение короткого периода времени, а затем реакцию электрофорезируют на нативном геле из полиакриламида (PAGE) 3,4,5. Чтобы обеспечить визуализацию белок-олигонуклеотидного взаимодействия, олигонуклеотиды обычно радиоактивно мечаются 32P или флуоресцентными молекулами. Если белок взаимодействует и связывает олигонуклеотид, то связывание белка замедляет подвижность нуклеиновой кислоты внутри геля 6,7. Таким образом, этот метод также называется гелевым сдвигом или анализом замедления геля. Несмотря на то, что этот метод широко используется, существуют некоторые ограничения, которые следует учитывать при использовании этого метода для получения значений KD, включая низкое разрешение из-за слабого или динамического связывания, требование значительно высокой концентрации белков и большие усилия. Кроме того, EMSA не являются анализами в реальном времени и, следовательно, не могут точно измерить кинетику связывания 7,8.
Для преодоленияэтих ограничений появились инновационные методы, такие как поверхностный плазмонный резонанс (SPR) и биослойная интерферометрия (BLI) 9,10,11,12. Оба метода измеряют константы скорости ассоциации/диссоциации и константы сродства между молекулами без меток. Поскольку белок не обязательно должен быть помечен, эти методы устраняют риск изменения свойств белка или блокирования сайта связывания. В SPR поляризованный свет взаимодействует с датчиком (металлической проводящей пленкой, обычно золотой), генерируя волну плотности заряда электронов, называемую плазмоном. Это взаимодействие уменьшает интенсивность отраженного луча, и детектор измеряет изменение удельного угла, известного как резонансный угол13. Для исследования взаимодействий лиганда (нуклеиновой кислоты) – аналита (белка) лиганд иммобилизуют в одной проточной ячейке на сенсорном чипе, а анализируемый вводят в проточную ячейку, содержащую иммобилизованный лиганд. При связывании аналита с лигандом происходит заметное изменение показателя преломления вблизи поверхности сенсора, что позволяет измерять молекулярные взаимодействия 14,15,16.
Биослойная интерферометрия (BLI) измеряет характер световой интерференции при прохождении света через оптическое волокно с биослоем, состоящим из лиганда (приманки) и его партнера по связыванию (аналита), на нижней поверхности кончика биосенсора. Свет проходит через наконечник и отражается на обоих концах биослоя благодаря свойствам биослоя. Толщина биослоя пропорциональна количеству связанных молекул, влияющих на характер отраженного света. Сравнивая изменение кривой относительной интенсивности в зависимости от Длина волны, вызванная интерференцией между отраженным светом от опорного интерфейса и от границы раздела биослой/буфер, можно определить изменение толщины биослоя. Когда связывается больше молекул, происходит больший сдвиг, что делает BLI мощным инструментом для изучения биомолекулярных взаимодействий в режиме реального времени. Изменение интерференционной картины измеряется и представляется на сенсорной схеме в виде спектрального сдвига 17,18 (рис. 1А). Характер связывающего взаимодействия может быть точно определен с помощью соответствующих средств контроля, таких как установка, в которой отсутствуют лигандно-изменяющиеся концентрации связывающего партнера 19,20,21. По сравнению с SPR, BLI является экономически эффективным и удобным для пользователя, что делает его доступным для широкого круга исследователей. Кроме того, образцы, используемые в BLI, остаются неповрежденными, если не происходит деградации или агрегации. Это позволяет восстановить и повторно использовать их, тем самым сводя к минимуму отходы. Прибор BLI работает без использования микрофлюидики, тем самым устраняя недостатки жидкостной системы, такие как необходимость технического обслуживания/ухода, засорение или использование дегазированных буферов. Это также сводит к минимуму риск загрязнения прибора нефильтрованными или сырыми образцами белка.
В эксперименте BLI биослой создается путем иммобилизации молекулы приманки на биосенсоре. Биослой биосенсоров может взаимодействовать с различными метками, что позволяет изучать взаимодействия между молекулами (в том числе нуклеиновыми кислотами, белками, антителами, вирусами, малыми молекулами и т.д.)22. Для установления этой иммобилизации могут быть использованы различные стратегии захвата, включая биотин/стрептавидин, 6X-His-tag/Ni-NTA, FLAG/анти-FLAG, GST/анти-GST, а также антитела/анти-Fc. Сохранение структуры и активности иммобилизованного лиганда имеет решающее значение при выборе биосенсора. На изменения интерференционной картины влияет количество связанной молекулы, а также матрица23. Белок-нуклеиновые взаимодействия изучаются с помощью биотинилированных олигонуклеотидных зондов, которые могут быть иммобилизованы на биосенсорах, покрытых стрептавидином. Образцы белка, которые, как ожидается, будут взаимодействовать с иммобилизованной приманкой (олигонуклеотидом), находятся в контакте с олигонуклеотидом в течение определенного периода времени в связывающем буфере для измерения ассоциации, а затем переключаются на пустой связывающий буфер для измерения диссоциации. Схематическое изображение связывания аналита и соответствующих изменений в кривой связывания показано на рисунке 1B. Кроме того, белок-нуклеиновые взаимодействия также могут быть изучены с помощью обратного пути иммобилизации, при котором белок (приманка) захватывается биосенсором и взаимодействует с нуклеиновой кислотой (аналитом).
В настоящее время в продаже доступно множество приборов, работающих по принципу биослойной интерферометрии. Простой и экономичный инструмент известен как система Octet N1, которая имеет один канал для передачи данных. Он требует ручного управления, потребляет минимальный объем пробы (4 мкл) и выполняет анализ пробы при температуре окружающей среды 9,23. Этот одноканальный прибор может определять эффективность связывания белков с массой более 10 кДа и измерять сродство в микромолярном (μM) и наномолярном (нМ) диапазоне11,12. Некоторые приборы с 2, 8, 16 и 96 каналами для автоматического считывания данных также доступны и совместимы с форматами96 или 384 лунок 19,20. Некоторые из этих приборов также могут работать в диапазоне от 4 °C до 40 °C, обнаруживать биомолекулы с молекулярной массой до 150 Да и измерять сродство в диапазонеот миллимоляра до пикомолара 19,21. В то время как описанная система является экономичной, более дорогие приборы с несколькими каналами обеспечивают высокую пропускную способность автоматической обработки. Эти усовершенствованные системы обычно используются для определения характеристик и разработки биологических молекул лекарственных средств 9,23.
В настоящем протоколе описаны этапы, связанные с измерением параметров связывания репликационного белка А (RPA) с одноцепочечной ДНК (ss-DNA) с использованием одноканальной ручной системы биослойной интерферометрии. RPA представляет собой гетеротримерный, связывающий ssDNA-связывающий белковый комплекс, который играет важную роль почти во всех аспектах метаболизма ДНК, включая репликацию, репарацию и рекомбинацию ДНК24. Благодаря своему высокому сродству к одноцепочечной ДНК (измеренной в субнаномолярном диапазоне), она может быстро связываться с одноцепочечной ДНК, образующейся во время различных транзакций ДНК, защищать ее от нуклеолитической деградации и предотвращать импровизированное связывание других нижестоящих белков. РПА также играет решающую роль в предотвращении формирования неканонических вторичных и третичных структур, таких как G-квадруплексы25. RPA человека состоит из трех субъединиц: RPA70 (70 кДа), RPA32 (32 кДа) и RPA14 (14 кДа), также называемых RPA 1, RPA 2 и RPA 3, соответственно 24,26,27. Эти субъединицы содержат шесть олигонуклеотидных/олигосахаридных связывающих складок (OB-складок), помеченных от A до F. Среди них ДНК-связывающие домены (DBD) находятся на субъединицах RPA1 (DBD-A, DBD-B, DBD-C) и RPA2 (DBD-D)28. Сначала было высказано мнение, что в зависимости от длины ДНК RPA проявляет различные способы связывания, при которых различные DBD были задействованы на определенной длине ДНК29. Данные недавних структурных исследований и исследований отдельных молекул помогли уточнить эти модели, предположив, что связывание различных DBD RPA является более динамичным, чем первоначально предполагалось 30,31,32,33,34,35,36. Эта особенность свойства динамического связывания имеет важное значение для функционирования RPA, поскольку RPA должна быть способна плотно связываться с субстратом ДНК во время определенных транзакций ДНК; Тем не менее, он также должен иметь возможность вытесняться из субстрата, чтобы передать субстрат следующему белку в ходе биологического процесса. С помощью различных биохимических методов было определено, что KD для RPA составляет около 0,4 нМ для субстрата ss-(polydT)30 и 80 нМ и 200 нМ для субстратов ss-(polydA)257 и dG-(polydG)602 соответственно, что было измерено с помощью флуоресцентной поляризационной анизотропии (FPA)37,38. RPA также демонстрирует примерно в 50 раз большее предпочтение связыванию с последовательностями, богатыми пиримидином, по сравнению с пуринами. Несмотря на то, что различные биохимические методы определили различия в измерениях БК для РПА, все измерения были в наномолярном диапазоне, что свидетельствует о высоком сродстве связывания РПА с одноцепочной ДНК. С помощью флуоресцентной микроскопии полного внутреннего отражения (TIRFM) было обнаружено, что на основе длины ДНК RPA ассоциирована, по крайней мере, с двумя режимами связывания: одним, который был определен при быстрой диссоциации (Kd, 680 пМ) и медленно диссоциирующим (Kd, 60 пМ) комплексом33,39. Учитывая его ключевое участие почти во всех метаболических путях ДНК, существует большой интерес к созданию ингибиторов, которые могут препятствовать взаимодействию между RPA и одноцепочечной ДНК (ssDNA). Эти химические ингибиторы жизненно важны для нарушения реакции на повреждение ДНК, делая раковые клетки более восприимчивыми к повреждающим ДНК агентам, используемым в клинической терапии. Использование анализа BLI позволяет точно количественно оценить эффективность ингибитора в модуляции связывающей функции RPA40,41.
Настройка BLI позволяет выполнять различные настройки: базовую и расширенную кинетику. В режиме базовой кинетики анализ состоит из трех основных стадий: установление исходного уровня, ассоциация и диссоциация. Однако перед проведением этого анализа биосенсоры необходимо покрыть отдельно, используя либо прибор, либо вручную на лабораторном столе. И наоборот, режим расширенной кинетики выходит за рамки трех основных этапов, позволяя включать дополнительные шаги. Эти дополнительные этапы могут служить различным целям, таким как адаптация биосенсора к изменениям буфера или облегчение обнаружения последующих белковых взаимодействий. Усовершенствованная кинетика также позволяет очистить биосенсор от аналита с помощью хорошего метода регенерации для потенциального повторного использования, при условии, что приманка и биосенсор остаются нетронутыми. Как правило, расширенная кинетика используется вместо базовой кинетики, когда анализ включает в себя несколько этапов или анализ должен быть выполнен в более сложном формате.
В этом протоколе описаны оба метода с использованием одной и той же приманки [3'Bio-ss-poly (dT)32] и аналита (RPA). Для иммобилизации приманки будет использоваться биосенсор, покрытый стрептавидином, и будут получены измерения KD для анализируемого вещества. В этом протоколе описывается полный подход к проведению анализа BLI с использованием одноканальной инструментальной биослойной интерферометрии, охватывающий подготовку приманки для биосенсора, соображения по буферу и пошаговое описание процедуры.
протокол
Подробная информация о реагентах и оборудовании, использованном в исследовании , приведена в Таблице материалов.
1. Подготовка приманки, аналита, буферов и очистка дроп-держателя
- Настройка прибора: Включите прибор как минимум за 1 час до начала эксперимента. Это позволит лампе прогреться.
- Подготовка буферов для снятия изоляции и очистки
- Буфер для отпаривания: Приготовьте 50 мл 0,15 М фосфорной кислоты [pH 2,0]).
- Буфер для очистки: Приготовьте 10 мл 0,5 Н HCl.
- Приготовление буфера BLI
- Приготовьте 50 мл 1x BLI буфера (50 мМ Tris pH 7,5, 1 мМ ЭДТА, 100 мМ NaCl, 0,1 мг/мл БСА, 1 мМ DTT, 0,05% Tween 20). Храните этот буфер при температуре 4 °C. Перед постановкой этого анализа доведите буфер до комнатной температуры.
ПРИМЕЧАНИЕ: Настоятельно рекомендуется готовить свежие буферы для анализа, так как состаренные буферы могут подвергаться изменениям pH или образованию агрегатов, а также могут иметь микробное загрязнение, что потенциально ставит под угрозу воспроизводимость и точность результатов. Не рекомендуется использовать буферы, которые хранились более двух недель.
- Приготовьте 50 мл 1x BLI буфера (50 мМ Tris pH 7,5, 1 мМ ЭДТА, 100 мМ NaCl, 0,1 мг/мл БСА, 1 мМ DTT, 0,05% Tween 20). Храните этот буфер при температуре 4 °C. Перед постановкой этого анализа доведите буфер до комнатной температуры.
- Приготовление приманки/субстрата
- Приготовьте 12,5 нМ субстрата 3'Bio-ss-poly (dT)32 (5' TTT TTT TTT TTT TTT TTT TTT TTT TTT TTT 3'Bio) с использованием буфера BLI.
- Приготовление запасов концентраций белка
- Приготовьте четыре концентрации RPA (5 нМ, 10 нМ, 20 нМ, 40 нМ) с использованием буфера LI. Наибольшая концентрация белка (40 нМ) получается при разведении исходного белка в буфере LI. Последующие разведения получают путем последовательного разведения рабочего раствора с концентрацией 40 нМ. Убедитесь, что все запасы белка находятся на льду на протяжении всего эксперимента, чтобы сохранить стабильность.
- Очистка держателя капель
- Добавьте 4 μL дистиллированной воды и очистите держатель капель безворсовой салфеткой (повторите 3 раза). Затем повторите этот шаг с 4 мкл 70% этанола и очистите безворсовой салфеткой. Этот этап обеспечивает удаление поверхностных загрязнений и частиц пыли.
- Добавьте 4 мкл 0,5 Н HCl и оставьте его в держателе на 1 минуту. Очистите его безворсовой салфеткой и повторите этот шаг еще раз. Это обеспечивает глубокую очистку держателя капель. Глубокая очистка особенно полезна для очистки держателя капель от засохших капель от предыдущего использования.
- 1Повторите шаг 1, чтобы промыть держатель дистиллированной водой с 70% этанолом и вытереть его насухо безворсовой салфеткой. Теперь держатель готов к использованию.
2. Базовая кинетика
- Настройка прибора и программного обеспечения
- Откройте программу и выберите «Базовая кинетика » на левой панели (дополнительный рисунок 1).
- Извлеките штатив с биосенсорами из лотка (полученных из коммерческих источников) и поместите в лоток планшет на 96 лунок. Добавьте в первую лунку 200 μL буфера BLI. Затем поместите лоток с биосенсорами обратно на 96-луночную пластину, убедившись, что каждый биосенсор вставлен в соответствующую лунку. Теперь первый биосенсор должен быть погружен в буфер BLI в первой лунке.
- В программном обеспечении нажмите « Гидратация » и включите таймер на 10 минут, позволив одному биосенсору гидратировать не менее 10 минут. Этот этап гидратирует биосенсор, чтобы подготовить его к анализу BLI.
- Пока биосенсор гидратируется, пипетка 250 мкл буфера BLI в две пробирки объемом 0,5 мл. Обозначьте одну из них как «А» (ассоциация), а другую — как «Д» (диссоциация).
- Заполните данные о программном обеспечении (Название: Покрытие подложки и описание анализа: RPA-3'Bio-ss-poly (dT)32: Базовая кинетика).
- Отрегулируйте настройку выполнения для каждого шага: Базовый уровень (30 с), Ассоциация (120 с), Диссоциация (120 с) (Таблица 1). Держите шейкер включенным для трубки и держателя капель. Скорость вибростенда установлена на уровне 2200 об/мин (диапазон, 1000–2600 об/мин), что предотвращает эффекты массопереноса, вызванные ограниченной диффузией вблизи поверхности биосенсора.
ПРИМЕЧАНИЕ: Оптимизация продолжительности каждого этапа (исходный уровень, загрузка, ассоциация, диссоциация) при настройке анализа кинетики связывания рекомендуется для улучшения сбора данных.
- Построение базовой кривой
- Поместите трубку А в держатель пробирки и прикрепите гидратированный биосенсор к системе LI. Сдвиньте держатель пробирки под биосенсор (положение А, рисунок 2).
ПРИМЕЧАНИЕ: Биосенсоры не должны быть полностью высушены в любое время эксперимента. Если оставить его до высыхания, показания эксперимента могут быть значительно искажены. - Нажмите «Выполнить » и следуйте инструкциям в подсказке.
- После завершения начального базового уровня откройте крышку и добавьте 4 мкл буфера BLI в держатель. Сдвиньте его вправо под тот же биосенсор (положение В, рисунок 2). Закройте крышку и следите за кривой BLI в программном обеспечении (рисунок 3, синяя кривая).
- После завершения откройте крышку, чтобы заменить пробирку «A» на «D», и вставьте ее под биосенсор (положение A, рисунок 2). Закройте крышку и приступайте к этапу диссоциации. После завершения откройте крышку, отсоедините биосенсор, поместите его обратно в лоток и убедитесь, что биосенсор погружен в буфер LI.
- Извлеките образец/буфер, очистите держатель с буфером перед сушкой безворсовыми салфетками и извлеките пробирку «D» из держателя пробирки.
- Поместите трубку А в держатель пробирки и прикрепите гидратированный биосенсор к системе LI. Сдвиньте держатель пробирки под биосенсор (положение А, рисунок 2).
- Покрытие подложки
- Поместите трубку А в держатель пробирки и прикрепите гидратированный биосенсор к системе LI. Сдвиньте держатель пробирки под биосенсор и нажмите «Выполнить».
- После начального исходного этапа добавьте 4 мкл субстрата 12,5 нМ [3'Bio-ss-poly (dT)32] в держатель капель и вставьте его под биосенсор. Закройте крышку и следите за кривой BLI в программном обеспечении. Убедитесь, что эта реакция выше исходного уровня (рисунок 3).
ПРИМЕЧАНИЕ: Концентрацию субстрата можно оптимизировать, покрывая биосенсоры различными концентрациями (только одна концентрация на биосенсор) и наблюдая за кривыми связывания. Кривая связывания с заметно более высоким сигналом по сравнению с базовой линией достаточна для подтверждения покрытия подложки. Перегрузка биосенсора может привести к стерической помехе или скученности на поверхности. На рисунке 3показаны кривые для пяти концентраций биотинилированного субстрата 3'Bio-ss-poly (dT)32 . Кроме того, после завершения этапа загрузки приманки биосенсоры можно погрузить в стрептавидин-блокирующий буфер (биоцитин) на 30 с, после чего промыть в BLI-буфере. Это заблокирует несвязанную поверхность стрептавидина и предотвратит неспецифическое связывание. - После завершения этапа ассоциации откройте крышку и замените пробирку «A» на трубку «D». Вставьте ее под биосенсор и закройте крышку.
- После завершения этапа диссоциации откройте крышку, отсоедините биосенсор и поместите его в лоток для биосенсора, содержащий буфер BLI. Убедитесь, что биосенсор полностью погружен в буфер и достаточно гидратирован для следующих шагов. Очистите держатель с помощью буфера для анализа, вытрите его безворсовыми салфетками и извлеките пробирку «D» из держателя пробирки. Теперь биосенсор покрыт субстратом 3'Bio-ss-poly (dT)32 .
- Связывание с белками
- Пипетка 250 мкл буфера BLI в десять черных микрофужей объемом 0,5 мл. Обозначьте их от A1 до A5 и от D1 до D5.
- В другой 96-луночный планшет добавьте в лунку 200 мкл отпарного буфера, соответствующего положению гидратированного биосенсора.
- Перед началом анализа 3 раза очистите держатель капель с помощью буфера LI.
- Откройте новый файл в программе и выберите «Базовая кинетика » на левой панели. Назовите анализ и при необходимости добавьте описание (дополнительный рисунок 2). При необходимости отрегулируйте параметры прогона (Таблица 1).
- Поместите пробирку с маркировкой A1 в держатель пробирки и прикрепите биосенсор с покрытием 3'Bio-ss-poly (dT)32 к системе BLI. Вставьте трубку под биосенсор и нажмите «Выполнить».
- После завершения начального базового этапа откройте крышку, добавьте 4 мкл буфера BLI в держатель капель и вставьте его под биосенсор. Это будет концентрация белка 0 нМ и послужит эталонной кривой.
- После завершения этапа ассоциации замените пробирку A1 на D1 и вставьте ее под биосенсор.
- После завершения этапа диссоциации извлеките биосенсор и поместите его обратно в лоток. Убедитесь, что биосенсор полностью погружен в буфер и достаточно гидратирован для следующих шагов. Извлеките пробирку D1, очистите держатель капель с помощью буфера для анализа и вытрите его безворсовой салфеткой.
- Далее будет получена кривая привязки для запаса 5 нМ RPA. Заполните данные образца (Концентрация: 5 нМ, Молекулярная масса: 116 кДа) и нажмите Calc. Это позволит рассчитать концентрацию белка в μг/μл.
- Прикрепите биосенсор с покрытием 3'Bio-ss-poly (dT)32 и вставьте трубку A2 в держатель трубки. Проведите его под биосенсором и нажмите «Выполнить».
- После исходного уровня добавьте 4 мкл 5 нМ RPA в держатель капель и вставьте его под биосенсор. Закройте крышку и следите за кривой ассоциации. Связывание белка с приманкой можно визуализировать с помощью кривой, проходящей выше исходной кривой. После шага ассоциации замените A2 на D2, вставьте его под биосенсор и завершите этап диссоциации.
- Извлеките биосенсор, опустите его в буфер для снятия на 30 с, а затем опустите в буфер BLI на 3 минуты.
ПРИМЕЧАНИЕ: Эффективность регенерации зависит от обездвиженной приманки и разрушенного аналита. Некоторые иммобилизованные биосенсоры выдерживают десять и более циклов регенерации. Мы могли бы зачистить биотинилированный субстрат 3'Bio-ss-poly (dT)32 более трех раз (дополнительный рисунок 3), не наблюдая заметных изменений в реакции. - Повторите шаги 2.4.9–2.4.12 для трех других концентраций RPA 10 нМ, 20 нМ и 40 нМ. Обязательно снимайте биосенсор для каждой концентрации.
ПРИМЕЧАНИЕ: Для анализа BLI эксперты рекомендуют использовать четыре (исключая референсную кривую) концентрации, охватывающие примерно от 0,1x до 10x ожидаемого KD для точных кинетических измерений. Здесь четыре концентрации были получены путем последовательного разведения.
- Анализ данных и вычисление значений KD
- Перед вычислением значения KD необходимо визуально осмотреть сенсорную схему для каждой концентрации связывания RPA на подложке 3'Bio-ss-poly (dT)32 . Убедитесь, что сигнал BLI увеличивается с увеличением концентрации RPA до тех пор, пока иммобилизованная ДНК не будет насыщена (рис. 4).
ПРИМЕЧАНИЕ: Для получения надежных результатов убедитесь, что не менее четырех концентраций белка успешно связываются с субстратом, за исключением концентрации аналита 0 нМ. Обратитесь к разделу обсуждения для устранения потенциальных ошибок. - В таблице «Run List» отметьте Ref для концентрации аналита 0 нМ, которая будет служить эталонной кривой. Отметьте Анализ для всех концентраций анализируемого вещества.
- Затем выберите Начало связи и Начало диссоциации для пошаговой коррекции. Это позволит выровнять начало ассоциации с концом базовой линии, а начало диссоциации с концом ассоциации, которая обычно вызвана различными моделями отражения между держателем капли и трубкой, если буфер хорошо совпадает.
- Выберите Global Fitting (1:1) для этого анализа. Глобальный анализ рассчитывает значения KD для всего набора концентраций белка, в то время как локальный анализ — для одной концентрации белка.
ПРИМЕЧАНИЕ: Программное обеспечение, прилагаемое к прибору, позволяет выполнять настройку только в соотношении 1:1. Это может быть потенциальным предостережением, когда ожидается, что приманка и аналит впишутся в другие подходящие модели. Данные из этого программного обеспечения могут быть экспортированы в другие программы для построения графиков и вписаны в необходимые подогнанные модели. - Затем выберите Анализировать. При этом будут рассчитаны значения KD, ka/kd (Таблица 2). Погрешность ka и k d в пределах 10% от значения обычно считается приемлемой.
ПРИМЕЧАНИЕ: Убедитесь, что эти значения находятся в разумных пределах. Если погрешность составляет менее 10%, это говорит о том, что подгонка данных является надежной для изучения взаимодействий между биологическими молекулами. Кроме того, рассчитанная KD (константа диссоциации равновесия) с использованием этих значений ka иk d должна быть достаточно точной для большинствапрактических применений. - Чтобы экспортировать подогнанные данные, щелкните правой кнопкой мыши по графику, созданному с использованием проанализированных данных. Выберите «Экспорт данных», затем выберите «Текст/данные». Нажмите « Файл и обзор», чтобы сохранить данные в формате «.dat». Этот файл может быть открыт в Microsoft Excel и использован в других программах для построения графиков.
ПРИМЕЧАНИЕ: Глобальная аппроксимация учитывает все данные кривой связывания в группе, в то время как локальная аппроксимация фокусируется исключительно на кинетических параметрах для каждой отдельной концентрации аналита.
- Перед вычислением значения KD необходимо визуально осмотреть сенсорную схему для каждой концентрации связывания RPA на подложке 3'Bio-ss-poly (dT)32 . Убедитесь, что сигнал BLI увеличивается с увеличением концентрации RPA до тех пор, пока иммобилизованная ДНК не будет насыщена (рис. 4).
3. Настройка прибора для работы с расширенной кинетикой
- Откройте программу и выберите «Расширенная кинетика » на левой панели (дополнительный рисунок 1).
- Поместите 96-луночный планшет в лоток, в котором находятся биосенсоры. Добавьте 200 μL буфера BLI в пять лунок. Поместите лоток с биосенсорами на 96-луночный планшет так, чтобы пять биосенсоров погрузились в лунку, содержащую буфер.
- В программном обеспечении нажмите « Гидратация » и включите таймер на 10 минут, позволив одному биосенсору гидратировать не менее 10 минут.
- Пока биосенсоры гидратируются, пипетка 250 μл буфера BLI в десять черных центрифужных пробирок объемом 0,5 мл. Обозначьте их как от A1 до A5 и от D1 до D5.
- Заполните данные о программном обеспечении (Название: Покрытие подложки и описание анализа: RPA-3'Bio-ss-poly (dT)32: Advanced Kinetics).
- Введите продолжительность для каждого шага (дополнительный рисунок 4). Исходный уровень (30 с), Нагрузка (120 с), Исходный уровень (30 с), Ассоциация (120 с), Диссоциация (120 с). При необходимости отрегулируйте параметры прогона (Таблица 1).
- Заполните данные в программном обеспечении (Концентрация: 0 нМ, Молекулярная масса: 116 кДа) и нажмите Calc.
- Поместите пробирку А1 в держатель пробирки и прикрепите биосенсор. Сдвиньте держатель пробирки под биосенсор и нажмите кнопку Run, чтобы получить начальную базовую линию.
- Добавьте 4 мкл субстрата 12,5 нМ в держатель капель и вставьте его под биосенсор. Закройте крышку. Это позволит загрузить субстрат на биосенсор. Замените A1 на D1 в держателе пробирки и вставьте его под биосенсор. Это даст базовую кривую.
- Очистите держатель с помощью безворсовой салфетки и загрузите 4 мкл буфера LI. Вставьте его под биосенсор и закройте крышку. Это будет концентрация белка 0 нМ и будет служить эталонной кривой.
- Выполнив этап ассоциации, вставьте трубку D2 под биосенсор. Перейдите к этапу диссоциации. Дождитесь завершения диссоциации.
- Отсоедините биосенсор, извлеките D2 из держателя пробирки и очистите держатель капель безворсовой салфеткой.
- Введите данные (Концентрация: 5 нМ, Молекулярная масса: 116 кДа) для следующего прогона и нажмите Calc.
- Подключите второй биосенсор к системе BLItz, поместите трубку A2 в держатель трубки и вставьте ее под биосенсор.
- После установления исходного исходного уровня добавьте 4 мкл подложки 12,5 нМ в держатель капель. Вставьте его под биосенсор и закройте крышку. Замените трубку A2 на D3 и вставьте ее под биосенсор. Затем добавьте 4 мкл 10 нМ запаса RPA в держатель пробирки и вставьте его под биосенсор.
- После ассоциации подведите D4 под биосенсор для диссоциации.
- Повторите шаги 3.1.12–3.1.15 для последующих трех концентраций RPA (10 нМ, 20 нМ, 40 нМ). Кривые связывания для этих концентраций показаны на рисунке 5.
- Анализ данных и значение KD могут быть подогнаны по той же процедуре, что и базовая кинетика BLI (шаг 2.5, таблица 2).
Результаты
В BLI белый свет отражается от границы раздела биослой/буфер и внутреннего опорного интерфейса к спектрометру. Результирующая интерференционная картина записывается, а спектральный сдвиг измеряется в течение определенного периода времени и изображается в виде отклика кривых связи в нм. Репрезентативный рисунок, показывающий наконечник биосенсора со связыванием аналита и без него и соответствующим спектральным сдвигом длины волны (нм), показан на рисунке 1. Кривые связывания соответствуют базовым линиям, загрузке приманки и ассоциации аналита с последующей диссоциацией аналита, как показано на рисунке 2.
Для этого анализа был приготовлен буфер для кинетики BLI, как указано в протоколе, и использован для получения акций 3'Bio-ss-poly (dT)32 и белковых запасов RPA. Рекомендуется использовать один и тот же буфер для всех разведений на протяжении всего анализа. Стрептавидиновый биосенсор гидратировали в буфере для кинетики BLI при комнатной температуре, а затем покрывали субстратом 3'Bio-ss-poly (dT)32 для базовой кинетики. Для оптимизации концентрации субстрата оценивали четыре концентрации, а также отрицательный контроль (0 нМ) (рис. 4). В качестве опорной кривой будет служить сенсорная грамма для подложки 0 нМ. Для анализа кинетики рекомендуется использовать более низкую плотность лиганда/приманки, которая обеспечивает достаточный сигнал для получения точных результатов 17,18. На рисунке 3 крутой рисунок сенсорных схем для концентрации субстрата 25 нМ, 50 нМ и 100 нМ может быть обусловлен измерением откликов в держателе капель и пробирке, которые имеют несколько иные условия (характер отражения, расстояние от поверхности сенсора до поверхности образца и т. д.) для биосенсора. Однако этап загрузки не является частью данных кинетики связывания для подгонки и не влияет на результат. Биосенсор загружали 12,5 нМ биотинилированным 3'Bio-ss-poly (dT)32 в течение 120 с и использовали для получения кривых связывания для пяти концентраций RPA.
Сенсорная схема для связывания RPA с использованием базовой кинетики показана на рисунке 4. Кривая связывания для белка 0 нМ будет служить ориентиром для вычитания. Мощность сигнала BLI будет увеличиваться с увеличением концентрации RPA до тех пор, пока иммобилизованная ДНК не будет насыщена. В этом анализе однонагруженный биосенсор использовали для изучения кинетики связывания одной концентрации RPA, после чего биосенсор подвергался процессу регенерации и повторно использовался для следующей концентрации. Регенерацию проводили погружением биосенсора в 0,15 М фосфорной кислоты на 30 с с последующей нейтрализацией в буфере BLI в течение 2 мин.
Сенсорная схема для связывания RPA с использованием расширенной кинетики показана на рисунке 5. Пять биосенсоров гидратировали с помощью буфера BLI в течение не менее 10 минут. Впоследствии каждый биосенсор нагружали субстратом 12,5 нМ 3'Bio-ss-poly (dT)32 в течение 120 с и использовали для оценки кинетики связывания при сингулярной концентрации RPA. В частности, для каждой концентрации анализируемого вещества выделяется один биосенсор.
После выбора опорных кривых анализируемые данные будут отображать только сенсорные граммы для концентраций белков (5 нМ, 10 нМ, 20 нМ и 40 нМ). Опорные кривые будут использоваться для нейтрализации фонового сигнала перед выравниванием кривых ассоциации и диссоциации.
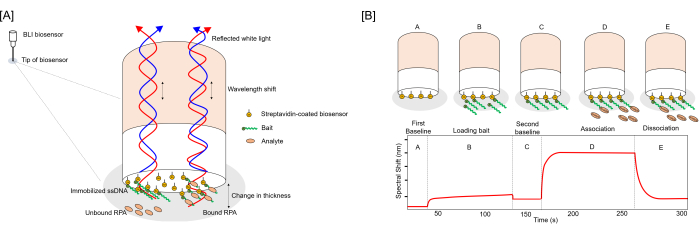
Рисунок 1: Схематическое изображение анализа связывания биосенсора и взаимодействия лигандов. (A) Схема, иллюстрирующая покрытые приманкой биосенсоры в несвязанном и связанном с аналитом состояниях. Связывание аналита изменяет толщину биомолекулярного слоя на поверхности биосенсора, смещая интерференционную картину падающего белого света и вызывая сдвиг длины волны на кривой относительная интенсивность/длина волны. Кривые связывания генерируются путем измерения спектральных сдвигов (в нм) во времени. СА: стрептавидин, Б: приманка. (B) Диаграмма с подробным описанием связывания лиганда с биотинилированной приманкой из одноцепочечной ДНК, загруженной на стрептавидиновые биосенсоры, и соответствующими изменениями в кривой связывания, измеренными с помощью усовершенствованной кинетики. Анализ включает в себя несколько этапов: [A] Установление исходного уровня для биосенсоров, [B] Иммобилизация приманки 3'Bio-ss-poly(dT)32 на биосенсоре, [C] Погружение биосенсоров в буфер BLI для оценки уровня загрузки приманки, [D] Измерение ассоциации аналит-приманка путем погружения биосенсоров в буфер BLI с анализитом, и [E] Измерение диссоциации аналита путем погружения биосенсора обратно в буфер BLI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Положения ползунка для держателя трубки и держателя капли по отношению к черному наконечнику стрелки. В положении A держатель пробирки будет находиться под биосенсором. В положении B держатель капли будет находиться под биосенсором. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
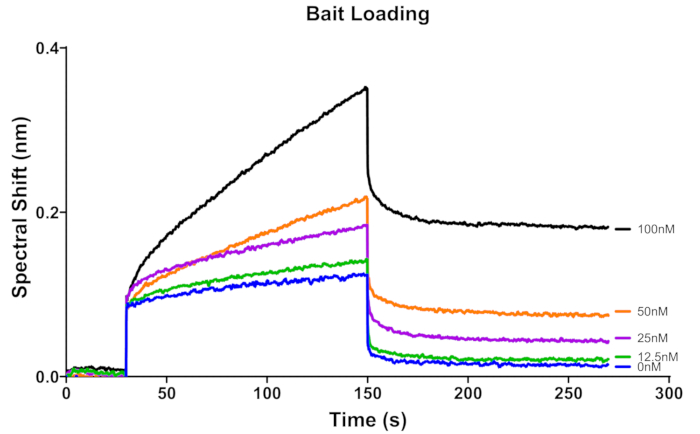
Рисунок 3: Связывающая сенсорограмма для пяти концентраций (0 нМ, 12,5 нМ, 25 нМ, 50 нМ, 100 нМ) приманки 3'Bio-ss-poly (dT)32 на биосенсоре, покрытом стрептавидином. Эти сенсорные диаграммы представляют собой исходные данные. Время 0-30 с представляет собой исходный уровень биосенсора до загрузки, 30-150 с — загрузку приманки, а 150-270 с — второй базовый уровень, обеспечивающий стабильную связь некоторых молекул с сенсором. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4:Сенсорная диаграмма BLI, полученная с помощью базовой кинетики. Получены кривые связывания для четырех концентраций RPA (5 нМ, 10 нМ, 20 нМ, 40 нМ), связанных с иммобилизованным субстратом 3' Bio-ss-poly (dT)32. Черными линиями обозначены подходящие кривые, подходящие для модели 1:1. Фиолетовая линия представляет собой сенсорную грамму, соответствующую каждой концентрации. Время 0-150 с представляет ассоциацию, а 150-270 с — диссоциацию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
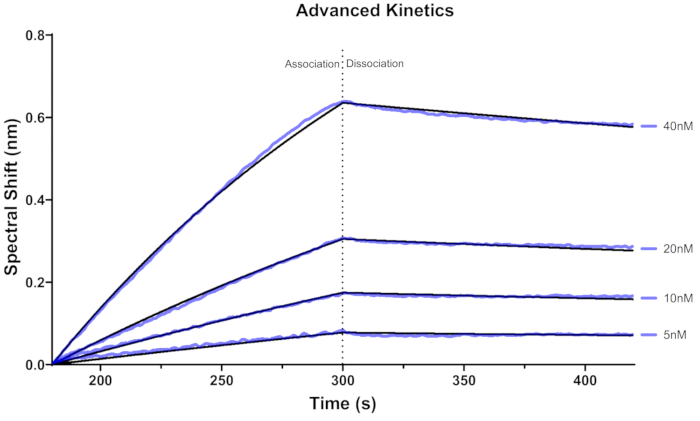
Рисунок 5: Сенсорная грамма BLI, полученная с помощью усовершенствованной кинетики. Кривые связывания для четырех концентраций RPA (5 нМ, 10 нМ, 20 нМ, 40 нМ), связанных с иммобилизованным субстратом 3' Bio-ss-poly (dT)32. Черными линиями обозначены подходящие кривые, подходящие для модели 1:1. Фиолетовая линия представляет собой сенсорную грамму, соответствующую каждой концентрации. Время 0-300 с представляет ассоциацию, а 300-450 с — диссоциацию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| (А) | |||
| Тип шага | Продолжительность (с) | Позиция | |
| 1 | Базис | 30 | Тюбик |
| 2 | Ассоциация | 120 | Капля |
| 3 | Диссоциация | 120 | Тюбик |
| (В) | |||
| Тип шага | Продолжительность (с) | Позиция | |
| 1 | Исходный базовый уровень | 30 | Тюбик |
| 2 | Погрузка | 120 | Капля |
| 3 | Базис | 30 | Тюбик |
| 4 | Ассоциация | 120 | Капля |
| 5 | Диссоциация | 120 | Тюбик |
Таблица 1: Настройки запуска. Настройки прогона для (A) базовой кинетики и (B) расширенной кинетики. Продолжительность этапов и положение биосенсора для каждого этапа, выполняемого во время анализа.
| К Д (нМ) | Ошибка KD (нМ) | ка (1/мс) | ka Ошибка | КД (1/с) | kd Ошибка | |
| Базовая кинетика | 5.5 | 0.2 | 2.24Э+05 | 1.58Э+04 | 1.23Э-03 | 7.19Э-05 |
| Продвинутая кинетика | 6.8 | 0.2 | 1.18Э+05 | 6.59Э+03 | 8.11Э-04 | 2.26Э-05 |
Таблица 2: Проанализированные данные по базовой и продвинутой кинетике. В таблице проанализированных данных представлены расчетные значения для KD, ka и kd, а также их соответствующие погрешности.
| Выпуск | Возможные причины | Предлагаемые решения |
| Противоречивые результаты | Неправильная настройка прибора | Избегайте размещения прибора BLI рядом с центрифугой или любых других вибраций, которые могут повлиять на показания. |
| Аномальные кривые | Старый/изношенный внутренний источник света. | Замените внутренний источник света/лампу. |
| Не держите прибор под прямыми солнечными лучами. | ||
| Старые/просроченные биосенсоры | Убедитесь, что биосенсоры запечатаны силикагелевыми пакетами и хранятся в сухом, прохладном и темном месте. | |
| Пики/падения данных, нестабильная базовая линия, кривые, идущие ниже базовой линии, или смещение базовой линии | Рассогласование буфера | Используйте свежеприготовленные буферы. |
| Все разведения делайте в одном буфере. | ||
| Убедитесь, что на протяжении всего анализа используются одни и те же буферы. | ||
| Пузырьки в образце | Тщательно центрифугируйте и пипетируйте образец. | |
| Отфильтруйте образец с помощью фильтра 0,22 мкМ. | ||
| Низкий сигнал | Неравномерная загрузка приманки | Увеличить продолжительность загрузки приманки. |
| Низкая/высокая концентрация приманки | Оптимизируйте концентрацию приманки, проверив диапазон. | |
| Скошенные ассоциативные кривые | Неспецифическое взаимодействие аналита и биосенсора | Гасят биосенсор с помощью соответствующего гасителя, например, биоцитина. |
| Отсутствие изменений сигнала при диссоциации | Плотное связывание аналита | Норма для аналита с медленной скоростью выключения. Увеличить продолжительность диссоциации. |
| Начальный дрейф вверх при диссоциации | Нестабильное взаимодействие приманки и аналита | Оптимизируйте концентрацию приманки и аналита. Отрегулируйте продолжительность ассоциации. |
| Поддерживайте постоянный состав буфера и предотвращайте агрегацию белков. | ||
| Ослабление сигнала после первоначальной загрузки приманки | Нестабильная приманка/приманка диссоциация от биосенсора. | Увеличьте концентрацию приманки и продолжительность этапа диссоциации. |
Таблица 3: Руководство по устранению неполадок с помощью анализов LI. Возможные проблемы и рекомендуемые решения.
Дополнительный рисунок 1: Домашняя страница программного обеспечения для оборудования. На скриншоте программного обеспечения показаны опции «БАЗОВАЯ КИНЕТИКА» и «РАСШИРЕННАЯ КИНЕТИКА» на левой панели. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный рисунок 2: Страница программного обеспечения для базовой кинетики. На скриншоте программного обеспечения показаны детали эксперимента и настройка продолжительности для базовой кинетики. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный рисунок 3: Репрезентативный рисунок, показывающий связывание аналита с иммобилизованным биосенсором приманки после многократной регенерации. Каждая цветная коробка представляет собой одну загрузку приманки, связывание аналита, за которым следует событие регенерации. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный рисунок 4: Расширенная кинетика страницы программного обеспечения. На скриншоте программного обеспечения показаны детали эксперимента и настройка продолжительности для расширенной кинетики. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Обсуждение
Возможность анализа кинетики связывания любого белка с его субстратом с помощью BLI позволяет выделить и охарактеризовать специфические факторы (такие как последовательность, структура или длина ДНК), регулирующие белок-ДНК-взаимодействиявнутри клетки. Система Octet N1, основанная на принципах биослойной интерферометрии, позволяет количественно измерять белок-белковые и белок-нуклеиновые взаимодействия. Кроме того, взаимодействия между липидами, антителами и малыми молекулами могут быть определены с использованием данной методики 42,43,44. Несмотря на то, что система довольно проста и понятна в использовании, есть некоторые нюансы, которые следует учитывать при использовании системы для измерения кинетики связывания.
В текущем протоколе измеряется кинетика связывания белкового комплекса RPA с одноцепочечной ДНК – взаимодействие, которое оценивалось на протяжении последних многих десятилетий. Поскольку RPA имеет несколько ДНК-связывающих доменов, исследования также были сосредоточены на вовлечении различных доменов при воздействии субстратов одноцепочечной ДНК разной длины. Исследования модульного связывания показали, что RPA вступает в контакт с 8-нтр одноцепочечной ДНК с низким сродством и переключается на высокоаффинное связывание при взаимодействии с одноцепочечной ДНК ~28-30 нт длиной33,39. Используя анализ BLI, для подложки из поли dT 32 нт KD был рассчитан как 5,5 нМ с использованием базовой кинетики и 6,8 нМ с использованием расширенной кинетики. Исследования с использованием других методов, таких как EMSA, флуоресцентная поляризационная анизотропия (FPA) и флуоресцентная микроскопия с полным внутренним отражением одной молекулы (smTIRF), последовательно обнаруживали значение KD в низком наномолярном диапазоне. Тем не менее, существует примерно 10-кратная разница между различными анализами. Это расхождение подчеркивает, что, хотя эти исследования дают ценную информацию о сродстве связывания, они не являются абсолютными величинами.
Оценивая кривую связывания, полученную на рисунках 4 и 5, очевидно, что аналит (RPA) не полностью диссоциирует от приманки [3' Bio-ss-poly(dT)32] в течение ограниченного времени. Учитывая, что RPA, как известно, очень медленно диссоциирует от субстрата в отсутствие конкурирующих белков, неудивительно, что мы не наблюдаем значительной диссоциации в анализе. Это также согласуется с нашим недавним отчетом, в котором мы должны были использовать 1000-кратное избыток конкурирующей одноцепочечной ДНК, чтобы показать диссоциацию RPA после связывания с субстратом45 многоцеклеточной ДНК с 28 нт. Weeramange et al. использовали альтернативный подход для анализа кинетики связывания, характеризующейся медленной диссоциацией, в частности, с использованием стационарной аппроксимации. Этот метод позволяет определить константу диссоциации (KD) исключительно на основе реакции связывания в равновесии, соответствующем плато кривой связывания46. Для достижения более точных значений KD следует проводить анализы с использованием различных концентраций анализируемого вещества, а полученные данные должны быть согласованы в глобальном масштабе.
Учитывая чувствительный характер кинетики BLI, крайне важно не загрязнять держатель прибора. Перед началом эксперимента держатель капли очищается с помощью 70% этанола и воды для удаления поверхностных загрязнений. Затем HCl (0,5 Н) используется для глубокой очистки держателя капли. Это необходимо для того, чтобы обеспечить удаление любых засохших капель из предыдущих экспериментальных запусков. Еще одна промывка этанолом и водой удаляет HCl. Наконец, держатель промывается буфером и готов к эксперименту. Держатель капли промывается буфером между заходами для удаления остатков приманки/белка. Четырехступенчатый протокол очистки, включающий этанол, воду, HCl и буфер, не является обязательным между прогонами одного и того же эксперимента, но рекомендуется перед началом нового эксперимента. Эта первоначальная подготовка имеет решающее значение, поскольку она гарантирует, что все оборудование не содержит загрязнений, создавая прочную основу для надежных результатов.
Аналогичным образом, перед проведением анализа BLI необходимо тщательно рассмотреть различные параметры, такие как выбор буфера, выбор биосенсора, оптимальная концентрация приманки и диапазон концентраций аналита. Несмотря на то, что BLI совместим с широким спектром буферов, крайне важно убедиться, что каждый компонент совместим и не мешает измерениям. Нестабильная базовая линия может быть вызвана неподходящим содержимым буфера или осадками в буфере. Некоторые детергенты могут вызывать аномальное связывание с белками, и, таким образом, концентрации этих агентов должны поддерживаться ниже критической концентрации мицелл для улучшения их солюбилизирующих свойств47,48. Также важно поддерживать один и тот же буфер на протяжении всего эксперимента, чтобы установить базовую кривую и сделать разведения приманки и аналита. Несоответствие буфера может привести к скачкам или падениям на кривой данных и привести к смещению базовой линии из-за изменений в окружающей среде биослоя. Рекомендуется начать с буфера, который ранее работал для интересующего белка, и использовать один и тот же буфер на протяжении всего анализа для гидратации биосенсоров и приготовления аналита и приманки. Кинетика BLI может учитывать различные буферы, устанавливая базовый уровень перед каждым использованием буфера. Для предотвращения неспецифического связывания в буфер можно добавить BSA (диапазон: 0,1-10 мг/мл) или Tween20 (диапазон: 0,005%-0,05%). Однако необходимо оптимизировать их концентрации в буфере19,21. Кроме того, можно также использовать коммерчески доступные блокирующие буферы (например, биоцитин).
Начало анализа биомолекулярных взаимодействий начинается с иммобилизации приманки на биосенсоре, что подчеркивает важность выбора подходящего биосенсора. Крайне важно учитывать чувствительность этих биосенсоров, их взаимодействие с приманкой и аналитом, потенциальное неспецифическое связывание и их способность сохранять биологическую активность после иммобилизации. Чаще всего используются взаимодействия биотина и стрептавидина, но в зависимости от приманки можно использовать и другие биосенсоры, такие как зонды anti-FLAG/FLAG, анти-GST/GST и анти-Fc/IgG.
Надлежащие меры контроля, относящиеся к анализу, имеют решающее значение для подтверждения результатов экспериментов и точного доступа к данным. Для большинства прогонов они включают в себя контроль без приманки и без аналита. Примеси в аналите или агрегации образцов также могут изменить сенсорную схему и привести к нестабильному базовому уровню. Концентрация и форма кривой связывания зависят от сродства к анализируемому веществу. В зависимости от индивидуального характера приманки и анализируемого вещества, эти временные интервалы могут быть скорректированы и оптимизированы. Кроме того, неспецифическое связывание также можно контролировать путем измерения взаимодействия между анализируемым веществом и биосенсором без оболочки. В базовой кинетике биосенсор с одним покрытием может быть использован для определения кривой связывания, по крайней мере, четырех различных концентраций аналита с регенерацией между различными образцами в наших анализах. При регенерации биосенсор очищается от связанного аналита и повторно используется для следующей концентрации аналита. В расширенной кинетике можно также использовать один биосенсор для нескольких концентраций аналита с регенерацией, но при этом можно включить стадию регенерации в анализ49,50.
Стрептавидиновые биосенсоры, использованные в эксперименте, обездвиживают биотинилированную приманку за счет нековалентного, почти необратимого и стабильного взаимодействия. Для получения точных данных необходима оптимизация плотности иммобилизованного лиганда на биосенсоре. Крутая кривая нагрузки может указывать на неравномерную загрузку. Перенасыщение биосенсора может привести к слабым неспецифическим взаимодействиям при более высоких концентрациях аналита или к повторному связыванию при более низких концентрациях аналита. И наоборот, загрузка приманки в низкой концентрации может привести к более низкому ответному сигналу, который слишком слаб для обнаружения. Как правило, постепенная загрузка предпочтительнее быстрой загрузки для обеспечения надлежащего покрытия биосенсора и предотвращения артефактов анализа17. Оптимальные результаты могут быть достигнуты путем выбора наименьшей концентрации приманки, которая дает ответный сигнал, отличающийся от установленного исходного уровня на этапе ассоциации аналита. Как правило, в безметочных анализах, таких как BLI или SPR, использование самой низкой концентрации, которая все еще обеспечивает достаточный сигнал, дает более точные результаты, так как более низкая нагрузка сводит к минимуму эффекты массопереноса и другие артефакты 49,50,51.
Диапазон концентраций аналитов может быть выбран на основе их известного значения KD . Выбор концентрации аналита, которая будет использоваться в анализе связывания, должен варьироваться от 0,1 до 10 раз выше ожидаемого или расчетного значения KD . Если значение KD неизвестно, диапазон концентраций можно оценить путем экспериментального получения данных BLI при различных концентрациях аналита. Увеличение концентрации лигандов должно приводить к соответствующему изменению кривой связывания. Если связывание с известным образцом отсутствует, это может быть связано с несколькими факторами, такими как деградация/иммобилизация приманки, обдирание приманки, неспособность взаимодействовать из-за агрегации лиганда или низкое качество биосенсорных наконечников. Руководство по устранению потенциальных проблем приведено в таблице 3.
Несмотря на то, что BLI не требует частого обслуживания оборудования и удобен в эксплуатации, он уступает по чувствительности SPR. Кроме того, ему не хватает строгого контроля над испарением17,49. При тестировании очень плотного связывания (KD = ниже диапазона pM) анализ обычно требует длительной диссоциации (в течение нескольких часов), и испарение может быть проблемой, которая приводит к изменениям. Несмотря на эти проблемы, анализ BLI без меток в режиме реального времени обеспечивает быстрые и точные кинетические параметры, что делает его надежным количественным анализом. BLI является разнообразным инструментом для исследовательских и аналитических приложений, что делает его ценным ресурсом для изучения сложных молекулярных взаимодействий.
Раскрытие информации
Авторы не могут заявить о конфликте интересов.
Благодарности
Эта работа финансировалась за счет грантов Национального научного фонда (1929346) и Американского онкологического общества (RSG-21-028-01). Мы также хотели бы поблагодарить сотрудников Балакришнанской лаборатории за полезные дискуссии.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 mL Micro Centrifuge Tubes | Globe Scientific | 111554A | |
| 96 Well Standard Black Microplate | Dot Scientific | 4ti-0223 | |
| Biotinylated poly dT Oligonucleotide | IDT | ||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-10G | |
| Dithiothreitol (DTT) | Dot Scientific | DSD11000-10 | |
| Ethylenediaminetetraacetic acid (EDTA) | Dot Scientific | DSE57020-500 | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Kimtec Science Kimwipes | Kimtech | 34120 | |
| Octet N1 Software | Sartorius | 1.4.0.13 | |
| Octet SA Biosensor | Sartorius | 18-5019 | |
| PBS pH 7.2 (10x) | Gibco | 1666711 | |
| Personal Assay Octet N1 System | Sartorius | ||
| Phosphoric Acid | Ward's Science | 470302-024 | |
| Sodium Chloride (NaCl) | Dot Scientific | DSS23020-5000 | |
| Tris Base | Dot Scientific | DST60040-5000 | |
| Tween20 | Bio-Rad | 170-6531 |
Ссылки
- Kalodimos, C. G., et al. Structure and flexibility adaptation in non-specific and specific protein-DNA complexes. Science. 305 (5682), 386-389 (2004).
- Fried, M., Crothers, D. M. Equilibria and kinetics of lac repressor-operator interactions by polyacrylamide gel electrophoresis. Nucleic Acids Res. 9 (23), 6505-6525 (1981).
- Lane, D., Prentki, P., Chandler, M. Use of gel retardation to analyze protein-nucleic acid interactions. Microbiol Rev. 56 (4), 509-528 (1992).
- Dyer, R. B., Herzog, N. K. Immunodepletion EMSA: A novel method to identify proteins in a protein-DNA complex. Nucleic Acids Res. 23 (16), 3345-3346 (1995).
- Dudley, R. K. A laboratory guide to in vitro studies of protein-DNA interactions. FEBS Lett. 306, 2-3 (1991).
- Tsai, C., Smider, V., Hwang, B. J., Chu, G. Electrophoretic mobility shift assays for protein-DNA complexes involved in DNA repair. Methods Mol Biol. 920, 53-78 (2012).
- Hellman, L. M., Fried, M. G. Electrophoretic mobility shift assay (EMSA) for detecting protein-nucleic acid interactions. Nat Protoc. 2 (8), 1849-1861 (2007).
- Heffler, M. A., Walters, R. D., Kugel, J. F. Using electrophoretic mobility shift assays to measure equilibrium dissociation constants: GAL4-p53 binding DNA as a model system. Biochem Mol Biol Educ. 40 (6), 383-387 (2012).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383 (2014).
- Wallner, J., Lhota, G., Jeschek, D., Mader, A., Vorauer-Uhl, K. Application of bio-layer interferometry for the analysis of protein/liposome interactions. J Pharm Biomed Anal. 72, 150-154 (2013).
- Abdiche, Y., Malashock, D., Pinkerton, A., Pons, J. Determining kinetics and affinities of protein interactions using a parallel real-time label-free biosensor, the Octet. Anal Biochem. 377 (2), 209-217 (2008).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Comparison of biosensor platforms in the evaluation of high affinity antibody-antigen binding kinetics. Anal Biochem. 508, 78-96 (2016).
- Schasfoort, R. B. M., Tudos, A. J. . Handbook of surface plasmon resonance. , (2008).
- Douzi, B. Surface plasmon resonance: A sensitive tool to study protein-protein interactions. Methods Mol Biol. 2715, 363-382 (2024).
- Douzi, B. Protein-protein interactions: Surface plasmon resonance. Methods Mol Biol. 1615, 257-275 (2017).
- Drescher, D. G., Selvakumar, D., Drescher, M. J. Analysis of protein interactions by surface plasmon resonance. Adv Protein Chem Struct Biol. 110, 1-30 (2018).
- Martin, S. R., Ramos, A., Masino, L. Biolayer interferometry: Protein-RNA interactions. Methods Mol Biol. 2263, 351-368 (2021).
- Apiyo, D. . Biomolecular binding kinetics assays on the Octet BLI platform. , (2022).
- Barrows, J. K., Van Dyke, M. W. Biolayer interferometry for DNA-protein interactions. PLoS One. 17 (2), e0263322 (2022).
- Desai, M., Di, R., Fan, H. Application of biolayer interferometry (BLI) for studying protein-protein interactions in transcription. J Vis Exp. (149), e59687 (2019).
- Sultana, A., Lee, J. E. Measuring protein-protein and protein-nucleic acid interactions by biolayer interferometry. Curr Protoc Protein Sci. 79, 19.25.1-19.25.26 (2015).
- Petersen, R. L. Strategies using bio-layer interferometry biosensor technology for vaccine research and development. Biosensors (Basel). 7 (4), 49 (2017).
- Concepcion, J., et al. Label-free detection of biomolecular interactions using biolayer interferometry for kinetic characterization. Comb Chem High Throughput Screen. 12 (8), 791-800 (2009).
- Wold, M. S. Replication protein A: A heterotrimeric, single-stranded DNA-binding protein required for eukaryotic DNA metabolism. Annu Rev Biochem. 66, 61-92 (1997).
- Qureshi, M. H., Ray, S., Sewell, A. L., Basu, S., Balci, H. Replication protein A unfolds G-quadruplex structures with varying degrees of efficiency. J Phys Chem B. 116 (19), 5588-5594 (2012).
- Wold, M. S., Kelly, T. Purification and characterization of replication protein A, a cellular protein required for in vitro replication of simian virus 40 DNA. Proc Natl Acad Sci U S A. 85 (8), 2523-2527 (1988).
- Bochkareva, E., Korolev, S., Lees-Miller, S. P., Bochkarev, A. Structure of the RPA trimerization core and its role in the multistep DNA-binding mechanism of RPA. EMBO J. 21 (7), 1855-1863 (2002).
- Brosey, C. A., et al. NMR analysis of the architecture and functional remodeling of a modular multidomain protein, RPA. J Am Chem Soc. 131 (18), 6346-6347 (2009).
- Fanning, E., Klimovich, V., Nager, A. R. A dynamic model for replication protein A (RPA) function in DNA processing pathways. Nucleic Acids Res. 34 (15), 4126-4137 (2006).
- Gibb, B., et al. Protein dynamics during presynaptic-complex assembly on individual single-stranded DNA molecules. Nat Struct Mol Biol. 21 (10), 893-900 (2014).
- Nguyen, B., et al. Diffusion of human replication protein A along single-stranded DNA. J Mol Biol. 426 (19), 3246-3261 (2014).
- Brosey, C. A., et al. Functional dynamics in replication protein A DNA binding and protein recruitment domains. Structure. 23 (6), 1028-1038 (2015).
- Chen, R., Subramanyam, S., Elcock, A. H., Spies, M., Wold, M. S. Dynamic binding of replication protein a is required for DNA repair. Nucleic Acids Res. 44 (12), 5758-5772 (2016).
- Kemmerich, F. E., et al. Force regulated dynamics of RPA on a DNA fork. Nucleic Acids Res. 44 (12), 5837-5848 (2016).
- Pokhrel, N., et al. Dynamics and selective remodeling of the DNA-binding domains of RPA. Nat Struct Mol Biol. 26 (2), 129-136 (2019).
- Wang, Q. M., et al. Human replication protein A induces dynamic changes in single-stranded DNA and RNA structures. J Biol Chem. 294 (38), 13915-13927 (2019).
- Wyka, I. M., Dhar, K., Binz, S. K., Wold, M. S. Replication protein A interactions with DNA: Differential binding of the core domains and analysis of the DNA interaction surface. Biochemistry. 42 (44), 12909-12918 (2003).
- Kim, C., Snyder, R. O., Wold, M. S. Binding properties of replication protein A from human and yeast cells. Mol Cell Biol. 12 (7), 3050-3059 (1992).
- Caldwell, C. C., Spies, M. Dynamic elements of replication protein A at the crossroads of DNA replication, recombination, and repair. Crit Rev Biochem Mol Biol. 55 (5), 482-507 (2020).
- Mishra, A. K., Dormi, S. S., Turchi, A. M., Woods, D. S., Turchi, J. J. Chemical inhibitor targeting the replication protein A-DNA interaction increases the efficacy of Pt-based chemotherapy in lung and ovarian cancer. Biochem Pharmacol. 93 (1), 25-33 (2015).
- Gavande, N. S., et al. Structure-guided optimization of replication Protein A (RPA)-DNA interaction inhibitors. ACS Med Chem Lett. 11 (6), 1118-1124 (2020).
- Ana Jug, T. B., Janez Ilaš, . Biolayer interferometry and its applications in drug discovery and development. TrAC Trends Anal Chem. 176, 117741 (2024).
- . Using BLI for viral and lipid-based vector analytics Available from: https://www.news-medical.net/whitepaper/20230322/Using-BLI-for-viral-and-lipid-based-vector-analytics.aspx (2023)
- Noy-Porat, T., et al. Characterization of antibody-antigen interactions using biolayer interferometry. STAR Protoc. 2 (4), 100836 (2021).
- Onyekachi Ononye, S. S., et al. Biochemical impact of p300-mediated acetylation of replication protein A: Implications for DNA metabolic pathway choice. bioRxiv. , (2024).
- Weeramange, C. J., Fairlamb, M. S., Singh, D., Fenton, A. W., Swint-Kruse, L. The strengths and limitations of using biolayer interferometry to monitor equilibrium titrations of biomolecules. Protein Sci. 29 (4), 1018-1034 (2020).
- Artem Stetsenko, A. G. An Overview of the top ten detergents used for membrane protein crystallization. Crystals. 7 (7), 197 (2017).
- Hubbe, M. A., Szlek, D. B., Vera, R. E. Detergency mechanisms and cellulosic surfaces: A review. BioResources. 17 (4), 7167-7249 (2022).
- . Research the Industry Standard for Label-Free of Biomolecular Interactions Analysis (BIA) Available from: https://www.sartorius.com/en/products/biolayer-interferometry/bli-resources (2021)
- . Octet NTA Biosensor Kinetic Assays Available from: https://www.sartorius.com/resource/blob/552398/b27ccc2fdfde7a9320909572ced3f6a1/ni-nta-biosensor-kinetic-assays-technical-note-en-sartorius-data.pdf (2024)
- . Application Guides: Kinetics and affinity measurements with Biacore systems Available from: https://cdn.cytivalifesciences.com/api/public/content/digi-33042-pdf (2021)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены