Method Article
Высокопроизводительный метод количественной оценки образования внеклеточных ловушек нейтрофилов в нейтрофилах человека в режиме реального времени
В этой статье
Резюме
Мы представляем автоматизированный высокопроизводительный метод количественного определения внеклеточных ловушек нейтрофилов (НВЛ) с использованием системы анализа живых клеток в сочетании с подходом двойного красителя, зависящим от проницаемости мембраны.
Аннотация
Нейтрофилы – это клетки миелоидной линии, которые составляют важнейшую часть врожденной иммунной системы. Последнее десятилетие выявило дополнительные ключевые роли, которые нейтрофилы играют в патогенезе рака, аутоиммунных заболеваний и различных острых и хронических воспалительных состояний, способствуя инициированию и сохранению иммунной дисрегуляции с помощью многочисленных механизмов, включая образование внеклеточных ловушек нейтрофилов (НВЛ), которые являются структурами, имеющими решающее значение для противомикробной защиты. Ограниченность методов количественной оценки образования НВЛ объективным, воспроизводимым и эффективным способом ограничила нашу способность к дальнейшему пониманию роли нейтрофилов в здоровье и болезнях. Мы описываем автоматизированный высокопроизводительный метод количественного определения нейтрофилов, претерпевающих образование НВЛ, в режиме реального времени, с использованием платформы визуализации живых клеток в сочетании с подходом двойного красителя, зависящим от проницаемости мембраны, с использованием двух разных красителей ДНК для визуализации внутриклеточной и внеклеточной ДНК. Эта методика может помочь оценить физиологию нейтрофилов и протестировать молекулы, которые могут быть нацелены на образование НВЛ.
Введение
Внеклеточные ловушки нейтрофилов (НВЛ) представляют собой паутиноподобные структуры хроматина, выдавливаемые из нейтрофилов в ответ на различные воспалительные стимулы. НВЛ состоят из ДНК, гистонов и различных антимикробных белков/пептидов, которые улавливают и убивают инфекционные патогены и вызывают воспалительные реакции1.
В то время как НВЛ полезны для защиты организма от патогенов, они привлекли внимание как потенциальный фактор различных аутоиммунных заболеваний2, тромбоза3, метаболических заболеваний4 и метастатического роста рака5. Таким образом, ингибирование образования НВЛ является потенциальным терапевтическим вариантом для этих заболеваний. Однако, несмотря на то, что некоторые многообещающие молекулы, нацеленные на НВЛ, находятся в разработке6, до сих пор не существует одобренной терапии, которая бы конкретно влияла на этот механизм. Это, по крайней мере частично, объясняется отсутствием объективных, непредвзятых, воспроизводимых и высокопроизводительных методов количественной оценки для формирования НВЛ.
Мы разработали и описали новый метод с использованием двухцветной платформы визуализации живых клеток 7,8. Покадровые изображения нейтрофилов, окрашенных мембранопроницаемым ядерным красителем и мембранонепроницаемым красителем ДНК, анализируются программным обеспечением, и количество нейтрофилов до и после образования НВЛ подсчитывается в нескольких временных точках. Поскольку целостность плазматической мембраны теряется при образовании НВЛ в результате регуляции PKCα-опосредованного ламина B и CDK4/6-опосредованного ламина A/C9, нейтрофилы, образующие NET, окрашиваются мембранонепроницаемым красителем ДНК, в то время как здоровые нейтрофилы — нет. Этот метод преодолевает проблемы, связанные с ранее описанными методами количественной оценки образования НВЛ, и обеспечивает непредвзятое, высокопроизводительное, воспроизводимое и точное количественное определение НВЛ в автоматическом режиме.
протокол
Нейтрофилы от здоровых людей были получены после того, как было предоставлено информированное согласие в соответствии с протоколом, утвержденным Национальным институтом здравоохранения (NIH) Институциональным наблюдательным советом (IRB). Протокол соответствует рекомендациям комитета по этике исследований на людях NIH.
1. Окрашивание нейтрофилов и подготовка пробирного планшета
- Возьмите периферическую кровь с соответствующего письменного информированного согласия в соответствии с рекомендациями каждого института и изолируйте нейтрофилы любым желаемым методом. Например, метод Фиколла-декстрана10,11 является широко используемым методом выделения нейтрофилов из периферической крови человека.
ПРИМЕЧАНИЕ: Несмотря на то, что в обсуждаемом здесь методе используются нейтрофилы человека, нейтрофилы мышей также могут быть проанализированы с использованием аналогичного протокола. - Ресуспендировать нейтрофилы в Мемориальном институте Розуэлл-Парка (RPMI; см. таблицу материалов) 1640 среда 2,0 x 106 нейтрофилов/мл и поместить суспензию нейтрофилов в центрифужную пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Обычно мы не добавляем фетальную бычью сыворотку (ФБС) в питательную среду, потому что альбумин в ФБС может снижать образование НВЛ12 , а термостабильная нуклеаза в ФБС может разрушать НВЛ13. - Добавьте мембранопроницаемый красный краситель ДНК (см. таблицу материалов) из расчета 1 мкл на 1,5 мл суспензии нейтрофилов.
- Выдерживают при комнатной температуре 5 мин в темноте. Центрифугу при 2500 х г в течение 5 мин при комнатной температуре и удалить надосадочную жидкость.
- Ресуспендировать нейтрофилы в 1 мл RPMI, затем центрифугировать при 2500 x g в течение 5 мин при комнатной температуре и удалить надосадочную жидкость. Повторить 2 раза (стирка всего 3 раза).
- Ресуспендировать нейтрофилы в 1 мл RPMI и подсчитывать с помощью счетчика клеток. Разбавляют суспензию нейтрофилов до 1,5 х10,5 нейтрофилов/мл.
- Добавьте 4 мкл предварительно разбавленного мембранонепроницаемого зеленого красителя ДНК в соотношении 1:100 (см. таблицу материалов) на 1 мл суспензии нейтрофилов.
- Поместить 100 мкл суспензии нейтрофилов на лунку в прозрачную обработанную тканевой культурой 96-луночный планшет (см. таблицу материалов). Задайте каждое условие в трех экземплярах.
ПРИМЕЧАНИЕ: Ранеемы показали, что нет никакой разницы в образовании и количественном определении НВЛ с помощью этого метода, если нейтрофилы помещены в планшеты с поли-L-лизиновым покрытием или без него. Поэтому для данного метода достаточно использования культуры ткани, обработанной пластиной. - Добавьте 100 мкл RPMI, содержащего стимульные реагенты с ингибитором или без него, или любой другой интересующий реагент в соответствующие лунки. Всегда используйте положительные контрольные лунки, добавляя 500 нМ форбол-12-миристат-13-ацетат (PMA) или 2,5 мкМ ионофор кальция (A23187), здесь использовали ингибитор AKT 30 мкМ.
- Поместите планшет в систему анализа живых клеток (см. Таблицу материалов), которая размещена в инкубаторе с содержанием 5%CO2 .
ПРИМЕЧАНИЕ: Конденсат может появиться на верхней и нижней части пластины через несколько минут после этого шага. Это может препятствовать правильной визуализации. Тщательно протрите и удалите конденсат перед началом сканирования. Поместите пластину в устройство, запустите программное обеспечение, введите протокол сканирования, а затем протрите пластину непосредственно перед первым сканированием.
2. Сканирующая пластина для визуализации NET-образующих нейтрофилов
- Запустите программное обеспечение (подробную информацию о программном обеспечении см. в Таблице материалов ). Запустите Add Vessel , нажав + в левом верхнем углу.
- Выберите Сканировать по расписанию. Выберите Создать.
ПРИМЕЧАНИЕ: После того, как он будет создан, запустите тот же протокол сканирования, выбрав Копировать предыдущий и выбрав сохраненный протокол на следующем экране. - Выберите Стандартный. Задайте параметры сканирования следующим образом: Параметры ячейки: Нет; Каналы изображения: фаза, зеленый (время съемки: 200 мс), красный (время съемки: 400 мс); Цель: 20x.
- Выберите используемую пластину из списка. Выберите местоположение сосуда, в которое будет помещена пластина на лоток системы визуализации живых клеток.
- Выберите скважины, в которых присутствуют образцы, и решите, сколько изображений нужно сделать для каждой скважины. Исходя из количества изображений на лунку, определите приблизительную продолжительность сканирования пластины. Обычно достаточно 4 снимков на лунку; Однако это может варьироваться в зависимости от условий и частоты сканирования.
- Введите информацию из каждой скважины (например, тип ячейки и состав), щелкнув Create Plate Map , чтобы указать имя для исследования.
ПРИМЕЧАНИЕ: Карта пластин может быть подготовлена и сохранена заранее с помощью редактора карт пластин в программном обеспечении. На этом шаге можно импортировать сохраненные данные карты пластин. При желании ввод информации о карте пластин можно пропустить и выполнить позже. Данные также могут быть получены без ввода информации о расположении пластин. Тем не менее, рекомендуется вводить информацию о пластине, чтобы облегчить последующий анализ. - На следующем экране выберите Базовый анализатор в качестве типа анализа, а затем выберите Протокол анализа из выпадающего списка, в котором отображаются ранее использованные определения анализа (не протоколы сканирования). Спектральное несмешивание как для зеленого, так и для красного цвета может быть оставлено на уровне 0,0 %.
ПРИМЕЧАНИЕ: При желании этот шаг можно пропустить. - Запланируйте сканирование. Для эксперимента здесь сканируйте каждые 15-20 минут в течение 8 часов. Установите время начала сканирования, перетащив белую и серую полосы в верхней части экрана.
ПРИМЕЧАНИЕ: Избегайте слишком частого сканирования, иначе устройство может работать плохо из-за перегрева. Время сканирования не должно превышать 12 ч за 24 ч. Вы можете увидеть предупреждение, если сканирование выполняется слишком часто. - Проверьте настройки сканирования на следующем экране и нажмите Добавить в расписание , чтобы начать сканирование. Подождите, пока будет отсканирован первоначальный набор изображений, чтобы убедиться, что все работает правильно.
- Иногда клетки могут быть неправильно сфокусированы. В этом случае проверьте, присутствует ли конденсат (и протрите соответствующим образом), правильно ли установлена пластина на лотке, правильно ли указано положение пластины и т. д. Если ячейки все еще плавают и не осели на дно лунки, подождите около 5 минут перед сканированием.
3. Задание определения анализа для количественной оценки NET
- Откройте исследование (сосуд) для анализа на вкладке Вид. Нажмите Launch Analysis в левой части экрана. Выберите "Создать новое определение анализа".
- Если анализ был выполнен ранее, используйте то же определение анализа с незначительными изменениями, выбрав Копировать существующее определение анализа. В этом случае перейдите к шагу 3.3. Если вы используете анализ без каких-либо изменений, выберите "Использовать существующее определение анализа"; Это не рекомендуется, потому что уровень флуоресценции может варьироваться между анализами в разные дни, и обычно необходимы некоторые незначительные коррекции.
- Выберите Базовый анализатор. Используйте все каналы изображения: «Фаза», «Зеленый», «Красный» и «Перекрытие».
ПРИМЕЧАНИЕ: Несмотря на то, что мы обычно используем зеленую и красную маски объектов для подсчета NET, маска перекрывающихся объектов полезна, когда мусор имеет значение. В таких случаях в качестве числителей будет использоваться количество перекрывающихся объектов вместо числа зеленых объектов (см. шаг 3.9). Если вместо зеленого счетчика объектов используется количество перекрывающихся объектов, все красные сигналы должны быть подсчитаны правильно. Отрегулируйте настройку красного сигнала, чтобы подсчитывать все красные объекты с низким красным сигналом на изображениях, сделанных в более поздние моменты времени, но не подсчитывать обломки. - Выберите 6 - 8 репрезентативных образцов изображений для обучения. Для эксперимента приложите следующие изображения:
Изображения, сделанные в период от 0 до 20 минут для оптимизации настройки зеленого сигнала для компенсации слабых зеленых сигналов, которые могут генерироваться в нейтрофилах, не образующих НВЛ.
Изображения максимальных НВЛ с положительным контролем, сделанные в период от 3 до 6 ч (время варьируется в зависимости от используемой стимуляции) для оптимизации настройки зеленого сигнала для определения нейтрофилов, образующих НВЛ
Изображения, сделанные примерно через 1 час времени, чтобы подсчитать общее количество клеток (окрашенных красным красителем), так как ядерный красный сигнал является наиболее сильным около 1 часа времени (когда все клетки осели на дно лунки) и постепенно уменьшается из-за гибели клеток.
Изображения, содержащие обломки, чтобы исключить их из подсчета. - Задайте определение анализа. Красные и зеленые объекты соответствуют ядрам всех нейтрофилов и тех, которые образуют НВЛ, соответственно. Начните со следующего примера и нажмите Preview Current или Preview All, а затем модулируйте каждый параметр для оптимизации результатов:
Для зеленого: Сегментация - Вычитание фона: Цилиндр; Радиус: 100 мкм; Пороговое значение: 0,3 ГПА; Разделение края: Вкл; Чувствительность к краю: -20; Очистка -Заполнение отверстий: 100мкм 2; Отрегулируйте размер 0 пикселей; Фильтры- Площадь: мин. 20 мкм2, макс. 500мкм 2; Эксцентриситет: макс. 0,97; Средняя интенсивность: мин. 1,00
Для красного: Сегментация - Вычитание фона: Цилиндр; Радиус: 10 мкМ; Пороговое значение: 1,0 GCU; Разделение кромки: ВКЛ; Чувствительность к краю: -50; Заполнение отверстия для очистки: 50мкм 2; Отрегулируйте размер 0 пикселей; Фильтры- Площадь: мин. 20 мкм2, макс. 400мкм 2; Средняя интенсивность: мин. 1,5.- Если избыточный зеленый сигнал появляется в нейтрофилах, которые не должны образовывать НВЛ (например, нестимулированные нейтрофилы на 0 мин, у которых есть дольчатые ядра), это может быть связано с переполнением красного сигнала, обнаруженного в зеленом канале. В этом случае вернитесь к шагу 3.1, откройте слои изображения в левой части экрана и удалите красные сигналы из зеленого канала с помощью инструмента Спектральное несмешивание.
- Другой вариант — установить одну лунку для одиночного окрашивания ядерно-красным красителем, чтобы уточнить, какая часть красного сигнала должна быть удалена из зеленого канала. С другой стороны, обычно зеленый сигнал, просачивающийся в красный канал, не влияет на анализы.
ПРИМЕЧАНИЕ: Не имеет значения, если чувствительность к красному сигналу низкая, и не все красные сигналы улавливаются на изображениях, сделанных в более поздние моменты времени (например, 6 часов). Максимальное количество красных объектов на каждом изображении считается общим числом нейтрофилов на изображении и будет использоваться в качестве знаменателя на шаге 3.9. Обычно ядерные красные сигналы достигают пика около 1 ч и постепенно ослабевают из-за гибели клеток (рис. 1B). Поэтому отрегулируйте настройку красного сигнала, чтобы правильно подсчитывать красные объекты на изображениях с максимальным количеством красных сигналов.
- Выберите время сканирования и лунки для анализа. Как правило, анализируются все временные точки и скважины. Укажите метку для определения анализа.
- Проверьте сводку и запустите анализ. На завершение анализа уходит несколько часов (продолжительность зависит от количества временных точек и скважин). После запуска имя определения анализа будет отображаться под именем исследования на вкладке Вид, а когда оно будет завершено, будет показана полная дата.
- После его завершения откройте анализируемое исследование, дважды щелкнув имя определения анализа. Откройте «Слои » в левой части экрана и проверьте, правильно ли отмечена каждая ячейка. Если он отмечен неправильно, вернитесь к шагу 3.1 и повторите последующие шаги.
- Щелкните Метрики графика в левой части экрана, чтобы экспортировать данные. Выберите «Количество зеленого», «Количество красного» или «Количество перекрытий (на изображении)», а затем выберите временные точки и скважины для экспорта. Для выбора группировки выберите Реплицировать карту пластин, если все скважины правильно указаны при сканировании.
- Экспортируйте данные. Рассчитайте процент ячеек, образующих NET, для каждого условия/момента времени по следующему уравнению с помощью соответствующего программного обеспечения.

ПРИМЕЧАНИЕ: Причина, по которой знаменателем является максимальное количество красных объектов, заключается в том, что количество красных объектов достигает максимума примерно в 1 час и постепенно уменьшается из-за гибели клеток.
Результаты
Этот метод позволяет получать фазово-контрастные, красные флуоресцентные (мембранопроницаемый краситель) и зеленые флуоресцентные (мембранонепроницаемый краситель) изображения, полученные в каждый момент времени. Наряду с процессом формирования НВЛ, морфологические изменения наблюдаются на фазово-контрастных и красных флуоресцентных изображениях, а после прорыва мембраны можно наблюдать зеленую флуоресценцию (рис. 1). В этом анализе нейтрофилы, образующие НВЛ, обычно имеют круглую форму, а не перепончатую структуру. Это связано с тем, что разрешение машины недостаточно высокое, чтобы улавливать тонкую паутинистую структуру и мембрану, непроницаемый зеленый краситель, окрашивает хроматин до того, как он будет высвобожден после разрыва мембраны. Ранеемы показали, что НЭО могут быть визуализированы с помощью конфокальной визуализации в 96-луночных планшетах, извлеченных после 4-часовой инкубации.
При правильном определении анализа все нейтрофилы на изображении помечаются красным объектом, а нейтрофилы, образующие НВЛ, помечаются зеленым объектом (рис. 2). Машина подсчитывает количество красных и зеленых объектов в каждый момент времени. Временной ход образования НВЛ визуализируется путем построения графика процента нейтрофилов, образующих НВЛ, в каждый момент времени (рис. 3). Потенциальные молекулы, нацеленные на образование НВЛ (например, ингибитор AKT), могут быть протестированы с высокой пропускной способностью с использованием этой методологии.
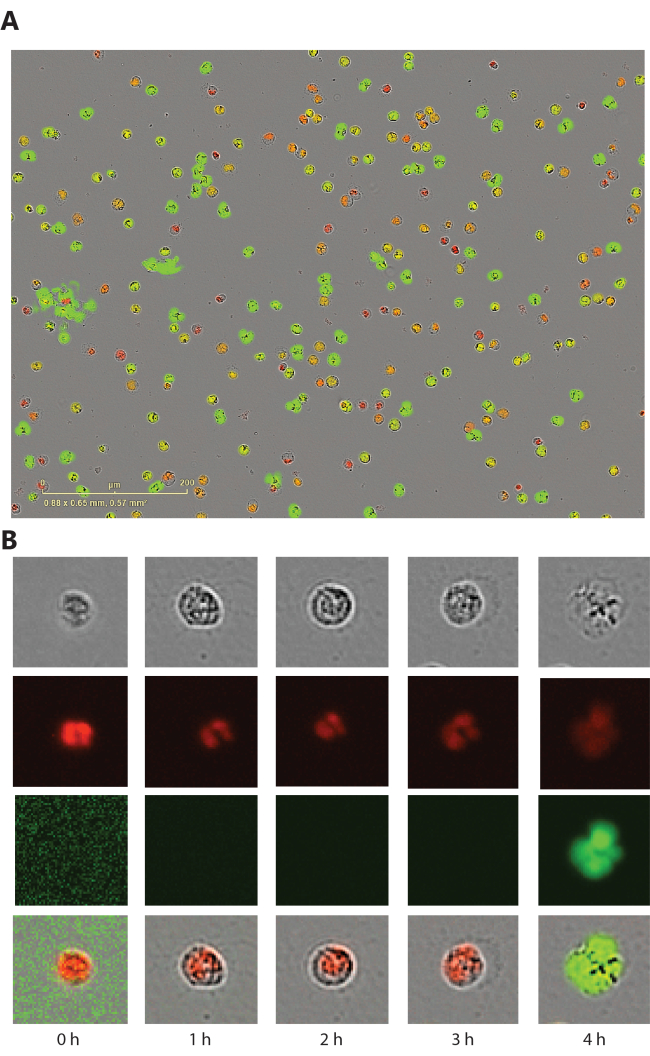
Рисунок 1: Морфологические изменения нейтрофилов, претерпевающих образование НВЛ. (A) Нейтрофилы периферической крови человека, которые стимулировали ионофором кальция 2,5 мкМ в течение 3 ч. (B) Репрезентативные одноклеточные изображения фазово-контрастного изображения, красного канала (мембранопроницаемый ядерный краситель), зеленого канала (мембранонепроницаемый краситель ДНК) и объединенного изображения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативные изображения, показывающие программное распознавание нейтрофилов и НВЛ. Нейтрофилы здоровых добровольцев стимулировали ионофором кальция 2,5 мкМ в течение 1 ч. Отображаются наложенные друг на друга изображения фазово-контрастной визуализации и каждого сигнала или маски. Ядра были окрашены (А) проницаемым для мембраны красным красителем, и программное обеспечение распознало и подсчитало (В) ядра, отмеченные синим цветом, в то время как НВЛ были окрашены (С) мембранонепроницаемым зеленым красителем, а программное обеспечение пометило их как (D) фиолетовым. Если происходит (E) избыточное срабатывание или (F) недостаточное срабатывание, возможно, потребуется изменить параметр. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Временной ход процентного содержания НВЛ-образующих нейтрофилов. Нейтрофилы стимулировали 25 нМ форболом-12-миристат-13-ацетатом (ПМА) или 2,5 мкМ ионофором кальция для индуцирования НВЛ или оставляли нестимулированными в RPMI. Для блокирования образования НВЛ добавляли 30 мкМ ингибитора АКТ. Изображения получались программой каждые 20 минут в течение 6 часов. Процент NET-образующих клеток рассчитывали путем деления количества зеленых объектов (= количество NET-образующих клеток) на количество красных объектов (= количество всех нейтрофилов). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Современные методы количественного определения НВЛ ex vivo имеют ряд недостатков, которые ограничивают нашу способность изучать нейтрофилы, НВЛ и потенциальные терапевтические мишени непредвзятым и высокопроизводительнымспособом. Например, прямой подсчет НВЛ-образующих клеток после иммунофлуоресцентного окрашивания, считающийся золотым стандартом количественного определения НВЛ, является малопроизводительным и зависит от субъективного мнения оператора. Планшетный анализ, обнаруживающий флуоресценцию мембранонепроницаемого красителя ДНК, объективно и с высокой пропускной способностью количественно определяет внеклеточную ДНК в качестве суррогатного маркера НВЛ, но, поскольку морфологическая информация не может быть получена этим методом, высвобождение ДНК при других типах клеточной гибели может быть ошибочно расценено как НВЛ. С другой стороны, метод обеспечивает высокую пропускную способность и объективную количественную оценку НЭО7. Учитывая, что можно получить информацию о морфологических изменениях нейтрофилов и их временном ходе, НВЛ можно точно отличить от других типов клеточной гибели. В недавних работах была высказана мысль о патогенетической роли НВЛ при различных заболеваниях 2,3,4,5, и ингибирование НВЛ в настоящее время рассматривается как потенциальноперспективная мишень лечения. Этот метод будет полезен для быстрого и беспристрастного изучения нескольких молекул, нацеленных на НВЛ.
Есть несколько ключевых моментов для успешной количественной оценки. Выбор мембранопроницаемого ДНК-связывающего красителя является очень важным фактором для правильной визуализации. Некоторые красители являются цитотоксическими, а другим красителям требуется время, чтобы проникнуть в ядра. Поскольку образование НВЛ происходит относительно быстро, краситель должен быстро проникать в ядра. Мы выбрали ядерный красный краситель (см. таблицу материалов) с учетом этих факторов. Количество ячеек в каждой лунке также важно для точного подсчета. Если он слишком переполнен, зеленый и красный сигналы каждого нейтрофила будут накладываться друг на друга, что затрудняет раздельный подсчет каждого нейтрофила.
У этого метода есть несколько ограничений. В то время как внутрипробная вариабельность в этом анализе превосходна, межпромежвидовая вариабельность неясна. Это связано с тем, что нейтрофилы, даже если они выделены от одного и того же донора с сохранением всех условий, действуют по-разному в разные дни, и могут быть некоторые различия между анализами, проведенными в другой день. Поэтому, если необходимо объединить данные за разные дни, необходимо тщательно спроектировать анализ: например, включить одинаковое количество образцов из группы заболевания и контрольной группы в каждый день. Кроме того, несмотря на то, что оценка формирования NET является объективной после определения анализа (шаг 3), сама установка определения в некоторой степени зависит от субъективного взгляда каждого оператора. Этапы 3.3 и 3.4 являются важнейшими шагами для исключения субъективных суждений и минимизации межтестовой вариабельности. Кроме того, каждый раз должен быть включен положительный контроль (например, нейтрофилы, стимулированные 500 нМ ПМА или 2,5 мкМ ионофором кальция), чтобы установить соответствующий предел для подсчета всех НВЛ.
С другой стороны, следует отметить, что другие типы клеточной гибели могут быть учтены как НВЛ. Когда клеточная мембрана прорывается, или ДНК высвобождается во внеклеточное пространство, будут наблюдаться зеленые сигналы. Когда клетки подвергаются некротической клеточной гибели или апоптотические клетки подвергаются вторичному некрозу, их ДНК окрашивается зеленым красителем7. Чтобы предотвратить неточное включение этих типов клеточной гибели, необходимо учитывать ход времени и морфологические изменения. В то время как апоптотическим клеткам обычно требуется более 8 ч для выполнения вторичного некроза, образование НВЛ достигает пика через 3-6 ч после стимуляции15. Отчетливые морфологические изменения можно увидеть с помощью фазово-контрастной визуализации, которая полезна для дифференцировки типа клеточной гибели7.
В целом, метод позволяет нам точно количественно оценивать НВЛ с высокой пропускной способностью и объективностью.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов.
Благодарности
Мы благодарим Секцию световой визуализации Управления науки и технологий Национального института артрита и заболеваний опорно-двигательного аппарата и кожи Национальных институтов здравоохранения. Это исследование было поддержано Программой внутренних исследований Национального института артрита и заболеваний опорно-двигательного аппарата и кожи Национальных институтов здоровья (ZIA AR041199).
Материалы
| Name | Company | Catalog Number | Comments |
| AKT inhibitor | Calbiochem | 124028 | |
| Clear 96-well plate | Corning | 3596 | |
| Live cell analysis system | Sartorius | N/A | Incucyte Software (v2019B) |
| Membrane-impermeable DNA green dye | Thermo Fisher Scientific | S7020 | |
| Nuclear red dye | Enzo | ENZ-52406 | Neutrophil pellet becomes bluish after staining. |
| RPMI | Thermo Fisher Scientific | 11835030 | Phenol red containig RPMI can be used. |
Ссылки
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Wigerblad, G., Kaplan, M. J. Neutrophil extracellular traps in systemic autoimmune and autoinflammatory diseases. Nat Rev Immunol. 23 (5), 274-288 (2022).
- Wagner, D. D., Heger, L. A. Thromboinflammation: From atherosclerosis to COVID-19. Arterioscler Thromb Vasc Biol. 42 (9), 1103-1112 (2022).
- Njeim, R., et al. NETosis contributes to the pathogenesis of diabetes and its complications. J Mol Endocrinol. 65 (4), R65-R76 (2020).
- De Meo, M. L., Spicer, J. D. The role of neutrophil extracellular traps in cancer progression and metastasis. Semin Immunol. 57, 101595 (2021).
- Nakabo, S., Romo-Tena, J., Kaplan, M. J. Neutrophils as drivers of immune dysregulation in autoimmune diseases with skin manifestations. J Invest Dermatol. 142 (3 Pt B), 823-833 (2022).
- Gupta, S., Chan, D. W., Zaal, K. J., Kaplan, M. J. A high-throughput real-time imaging technique to quantify NETosis and distinguish mechanisms of cell death in human neutrophils. J Immunol. 200 (2), 869-879 (2018).
- Nakabo, S., Kaplan, M. J., Gupta, S. Quantification of neutrophils undergoing NET formation and distinguishing mechanisms of neutrophil cell death by use of a high-throughput method. Methods Mol Biol. 2543, 129-140 (2022).
- Singh, J., et al. Moonlighting chromatin: when DNA escapes nuclear control. Cell Death Differ. 30 (4), 861-875 (2023).
- Carmona-Rivera, C., Kaplan, M. J. Induction and quantification of NETosis. Curr Protoc Immunol. 115, 14.41.11-14.41.14 (2016).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. J Vis Exp. (175), 62837 (2021).
- Neubert, E., et al. Serum and serum albumin inhibit in vitro formation of neutrophil extracellular traps (NETs). Front Immunol. 10, 12 (2019).
- von Kockritz-Blickwede, M., Chow, O. A., Nizet, V. Fetal calf serum contains heat-stable nucleases that degrade neutrophil extracellular traps. Blood. 114 (25), 5245-5246 (2009).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. J Immunol Methods. 423, 104-110 (2015).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 18 (2), 134-147 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены