Method Article
Técnica de alto rendimiento en tiempo real para cuantificar la formación de trampas extracelulares de neutrófilos en neutrófilos humanos
En este artículo
Resumen
Presentamos un método automatizado de alto rendimiento para cuantificar las trampas extracelulares de neutrófilos (NET) utilizando el sistema de análisis de células vivas, junto con un enfoque de doble colorante dependiente de la permeabilidad de la membrana.
Resumen
Los neutrófilos son células de linaje mieloide que forman una parte crucial del sistema inmunitario innato. La última década ha revelado funciones clave adicionales que desempeñan los neutrófilos en la patogénesis del cáncer, las enfermedades autoinmunes y diversas afecciones inflamatorias agudas y crónicas al contribuir al inicio y la perpetuación de la desregulación inmunitaria a través de múltiples mecanismos, incluida la formación de trampas extracelulares de neutrófilos (NET), que son estructuras cruciales en la defensa antimicrobiana. Las limitaciones en las técnicas para cuantificar la formación de NET de una manera imparcial, reproducible y eficiente han restringido nuestra capacidad para comprender mejor el papel de los neutrófilos en la salud y las enfermedades. Describimos un método automatizado, en tiempo real y de alto rendimiento para cuantificar neutrófilos que experimentan formación de NET utilizando una plataforma de imágenes de células vivas junto con un enfoque de doble colorante dependiente de la permeabilidad de la membrana que utiliza dos colorantes de ADN diferentes para obtener imágenes de ADN intracelular y extracelular. Esta metodología es capaz de ayudar a evaluar la fisiología de los neutrófilos y probar moléculas que pueden dirigirse a la formación de NET.
Introducción
Las trampas extracelulares de neutrófilos (NET) son estructuras de cromatina en forma de red extruidas de neutrófilos en respuesta a diversos estímulos inflamatorios. Los TNE están compuestos de ADN, histonas y varias proteínas/péptidos antimicrobianos, que atrapan y matan patógenos infecciosos e invocan respuestas inflamatorias1.
Si bien los TNE son beneficiosos para la defensa del huésped contra los patógenos, han llamado la atención como un posible impulsor de diversas enfermedades autoinmunes2, trombosis3, enfermedades metabólicas4 y crecimiento metastásico de cánceres5. Por lo tanto, la inhibición de la formación de NET es una opción terapéutica potencial para estas enfermedades. Sin embargo, a pesar de que se están desarrollando algunas moléculas prometedoras dirigidas a los NETs6, todavía no existe una terapia aprobada que afecte específicamente a este mecanismo. Esto se debe, al menos en parte, a la falta de métodos de cuantificación objetivos, imparciales, reproducibles y de alto rendimiento para la formación de NET.
Establecimos y reportamos un nuevo método que utiliza una plataforma de imágenes de células vivas de dos colores 7,8. El software analiza las imágenes de lapso de tiempo de neutrófilos teñidos con colorante nuclear permeable a la membrana y colorante de ADN impermeable a la membrana, y el número de neutrófilos antes y después de la formación de NET se cuenta en múltiples puntos de tiempo. Dado que la integridad de la membrana plasmática se pierde durante la formación de NET por la regulación deldesensamblaje de Lamin B mediado por PKCα y Lamin A/C mediado por CDK4/6 9, los neutrófilos formadores de NET se tiñen con un colorante de ADN impermeable a la membrana, mientras que los neutrófilos sanos no lo hacen. Este método supera los problemas de las técnicas previamente informadas para cuantificar la formación de NET y proporciona una cuantificación de NET imparcial, de alto rendimiento, reproducible y precisa de manera automatizada.
Protocolo
Los neutrófilos de sujetos humanos sanos se obtuvieron después de que se proporcionara el consentimiento informado según el protocolo aprobado por la Junta de Revisión Institucional (IRB) de los Institutos Nacionales de Salud (NIH). El protocolo sigue las directrices del comité de ética de la investigación en seres humanos de los NIH.
1. Tinción de los neutrófilos y preparación de la placa de ensayo
- Tomar sangre periférica con el consentimiento informado por escrito adecuado siguiendo las directrices de cada instituto y aislar los neutrófilos utilizando cualquier método deseado. Por ejemplo, el método Ficoll-dextrano 10,11 es un método comúnmente utilizado para el aislamiento de neutrófilos de sangre periférica humana.
NOTA: Aunque el método discutido aquí utiliza neutrófilos humanos, los neutrófilos de ratón también pueden analizarse utilizando un protocolo similar. - Resuspenda los neutrófilos en el medio Roswell Park Memorial Institute (RPMI; consulte la Tabla de materiales) 1640 a 2.0 x 106 neutrófilos/mL y coloque la suspensión de neutrófilos en un tubo de centrífuga de 1.5 mL.
NOTA: Por lo general, no agregamos suero fetal bovino (FBS) a los medios de cultivo porque la albúmina en FBS puede reducir la formación de NET12 y la nucleasa termoestable en FBS puede degradar NET13. - Agregue colorante de ADN rojo permeable a la membrana (consulte la Tabla de materiales) a 1 μL por 1,5 mL de suspensión de neutrófilos.
- Incubar a temperatura ambiente durante 5 minutos en la oscuridad. Centrifugar a 2500 x g durante 5 min a temperatura ambiente y eliminar el sobrenadante.
- Resuspender los neutrófilos en 1 mL de RPMI, luego centrifugar a 2500 x g durante 5 min a temperatura ambiente y eliminar el sobrenadante. Repita 2 veces (lave en total 3 veces).
- Resuspenda los neutrófilos en 1 mL de RPMI y cuente usando un contador de células. Diluir la suspensión de neutrófilos a 1,5 x 105 neutrófilos/ml.
- Agregue 4 μL de colorante de ADN verde impermeable a la membrana 1:100 prediluido (ver Tabla de materiales) por 1 mL de suspensión de neutrófilos.
- Coloque 100 μL de suspensión de neutrófilos por pocillo en una placa de 96 pocillos tratada con cultivo de tejido transparente (consulte la Tabla de materiales). Establezca cada condición por triplicado.
NOTA:Hemos demostrado previamente que no hay diferencia en la formación y cuantificación de NET con este método si los neutrófilos se colocan en placas con o sin recubrimiento de poli-L-lisina. Por lo tanto, el uso de placa tratada con cultivo de tejidos es suficiente para este método. - Añadir 100 μL de RPMI que contenga reactivos de estímulo con o sin inhibidor, o cualquier otro reactivo de interés en los pocillos respectivos. Utilice siempre pocillos de control positivo añadiendo 500 nM de forbol 12-miristato 13-acetato (PMA) o 2,5 μM de ionóforo de calcio (A23187), aquí se utilizó un inhibidor de AKT de 30 μM.
- Coloque la placa en el sistema de análisis de células vivas (consulte la Tabla de materiales) que se encuentra en una incubadora de CO2 al 5%.
NOTA: Puede aparecer condensación en la parte superior e inferior de la placa unos minutos después de este paso. Esto puede inhibir la obtención adecuada de imágenes. Limpie y elimine bien la condensación antes de comenzar el escaneo. Coloque la placa en la máquina, inicie el software, ingrese el protocolo de escaneo y luego limpie la placa justo antes del primer escaneo.
2. Placa de escaneo para visualizar neutrófilos formadores de NET
- Inicie el software (consulte la Tabla de materiales para obtener más información sobre el software). Inicie Add Vessel presionando + en la esquina superior izquierda.
- Elija Escanear según programación. Elija Nuevo.
NOTA: Una vez creado esto, ejecute el mismo protocolo de escaneo eligiendo Copiar anterior y seleccionando el protocolo almacenado en la siguiente pantalla. - Elija Estándar. Establezca la configuración de escaneo como: Opciones de celda por celda: Ninguna; Canales de imagen: Fase, Verde (Tiempo de adquisición: 200 ms), Rojo (Tiempo de adquisición: 400 ms); Objetivo: 20x.
- Elija la placa que se está utilizando de la lista. Seleccione la ubicación del recipiente donde colocar la placa en la bandeja del sistema de adquisición de imágenes de células vivas.
- Seleccione los pocillos en los que haya muestras y decida cuántas imágenes tomar por pocillo. En función del número de imágenes por pocillo, genere una duración estimada del escaneo de la placa. Por lo general, 4 imágenes por pocillo son suficientes; Sin embargo, esto puede variar según las condiciones y la frecuencia de las exploraciones.
- Introduzca la información de cada pozo (por ejemplo, el tipo de célula y el compuesto) haciendo clic en Crear mapa de placas para proporcionar un nombre para el estudio.
NOTA: El mapa de placas se puede preparar y guardar de antemano utilizando el editor de mapas de placas en el software. Los datos del mapa de placas guardados se pueden importar durante este paso. Si lo desea, la introducción de la información del mapa de placas se puede omitir y realizar más tarde. Los datos también se pueden obtener sin ingresar información sobre el diseño de la placa. Sin embargo, se recomienda introducir la información de la placa para facilitar el análisis posterior. - En la siguiente pantalla, seleccione Basic Analyzer como tipo de análisis y elija Protocolo de análisis en la lista desplegable, que muestra las definiciones de análisis utilizadas anteriormente (no los protocolos de análisis). La desmezcla espectral tanto para el verde como para el rojo puede dejarse en 0,0 %.
NOTA: Este paso puede omitirse, si lo desea. - Programar el escaneo. Para el experimento aquí, escanee cada 15-20 minutos durante 8 h . Establezca la hora de inicio del escaneo arrastrando la barra blanca y gris en la parte superior de la pantalla.
NOTA: Evite escanear con demasiada frecuencia, de lo contrario, es posible que la máquina no funcione bien debido al sobrecalentamiento. El tiempo de escaneo no debe exceder las 12 h por 24 h. Es posible que vea una alerta si el escaneo es demasiado frecuente. - Verifique la configuración de escaneo en la siguiente pantalla y presione Agregar a la programación para comenzar a escanear. Espere hasta que se escanee el conjunto inicial de imágenes para confirmar si todo funciona bien.
- A veces, es posible que las células no estén enfocadas correctamente. En ese caso, verifique si hay condensación (y limpie en consecuencia), si la placa está correctamente colocada en la bandeja o si la posición de la placa está especificada correctamente, etc. Si las células todavía están flotando y no se han asentado en el fondo del pozo, espere unos 5 minutos antes de escanear.
3. Establecer la definición de análisis para cuantificar los NET
- Abra el estudio (recipiente) que se va a analizar en la pestaña Ver. Presione Iniciar análisis a la izquierda de la pantalla. Elija Create New Analysis Definition (Crear nueva definición de análisis).
- Si se ha realizado un análisis anteriormente, utilice la misma definición de análisis con pequeñas modificaciones seleccionando Copiar definición de análisis existente. En este caso, vaya al paso 3.3. Si utiliza el análisis sin ninguna alteración, seleccione Usar definición de análisis existente; Esto no se recomienda porque el nivel de fluorescencia puede variar entre ensayos en diferentes días y, por lo general, son necesarias algunas correcciones menores.
- Seleccione Analizador básico. Utilice todos los canales de imagen: Fase, Verde, Rojo y Superposición.
NOTA: Aunque normalmente usamos máscaras de objetos verdes y rojas para contar las NET, la máscara de objetos superpuesta es útil cuando los escombros son importantes. En tales casos, el número de objetos superpuestos se utilizará como numeradores en lugar del recuento de objetos verdes (consulte el paso 3.9). Si se utiliza el recuento de objetos superpuestos en lugar del recuento de objetos verdes, todas las señales rojas deben contarse correctamente. Ajuste la configuración de la señal roja para contar todos los objetos rojos con señal roja baja en las imágenes tomadas en puntos de tiempo posteriores, pero no para contar los residuos. - Elija de 6 a 8 imágenes de muestra representativas para el entrenamiento. Para el experimento aquí, incluya las siguientes imágenes:
Imágenes tomadas entre 0 y 20 minutos para optimizar el ajuste de la señal verde para compensar las señales verdes sutiles que se pueden generar en neutrófilos no formadores de NET
Imágenes de NET máximos con control positivo, tomadas entre 3 y 6 h (el tiempo varía en función de la estimulación utilizada) para optimizar el ajuste de la señal verde para definir los neutrófilos formadores de NET
Imágenes tomadas alrededor del punto de tiempo de 1 h para contar el número total de células (teñidas con tinte rojo) ya que la señal roja nuclear es la más fuerte alrededor del punto de tiempo de 1 h (cuando todas las células se han asentado en el fondo del pocillo) y disminuye gradualmente debido a la muerte celular.
Imágenes que contengan escombros, para excluirlos del recuento. - Establezca la definición del análisis. Los objetos rojos y los objetos verdes se corresponden con los núcleos de todos los neutrófilos y los que están formando NETs, respectivamente. Comience con el siguiente ejemplo de y presione Vista previa actual o Vista previa de todo, y module cada parámetro para optimizar los resultados:
Para verde: Segmentación- Resta de fondo: Sombrero de copa; Radio: 100 μM; Umbral: 0,3 GCU; División de bordes: Activado; Sensibilidad de los bordes: -20; Limpieza -Relleno de agujeros: 100 μm2; Ajuste el tamaño 0 píxeles; Filtros- Área: mín. 20 μm2, máx. 500 μm2; Excentricidad: máx. 0,97; Intensidad media: min 1.00
Para Rojo: Segmentación- Resta de fondo: Sombrero de copa; Radio: 10 μM; Umbral: 1.0 GCU; División de bordes: ON; Sensibilidad de los bordes: -50; Relleno del orificio de limpieza: 50 μm2; Ajuste el tamaño 0 píxeles; Filtros- Área: mín. 20 μm2, máx. 400 μm2; Intensidad media: min 1.5.- Si aparece una señal verde excesiva en neutrófilos que no deberían estar formando TNE (por ejemplo, neutrófilos no estimulados a 0 min que tienen núcleos lobulados), puede deberse a un desbordamiento de la señal roja detectada en el canal verde. En tal caso, regrese al paso 3.1, abra Capas de imagen a la izquierda de la pantalla y elimine las señales rojas del canal verde utilizando Desmezcla espectral.
- Otra opción es configurar un pocillo para tinción única con tinte rojo nuclear para aclarar qué parte de la señal roja debe eliminarse del canal verde. Por otro lado, por lo general, el sangrado de la señal verde en el canal rojo no afecta a los análisis.
NOTA: No importa si la sensibilidad a la señal roja es baja y no todas las señales rojas se capturan en las imágenes que se toman en puntos de tiempo posteriores (por ejemplo, punto de tiempo de 6 h). El número máximo de objetos rojos en cada imagen se considera como el número total de neutrófilos en la imagen y se utilizará como denominador en el paso 3.9. Por lo general, las señales rojas nucleares alcanzan su punto máximo alrededor de 1 h y disminuyen gradualmente debido a la muerte celular (Figura 1B). Por lo tanto, ajuste la configuración de la señal roja para contar correctamente los objetos rojos en las imágenes con señales rojas máximas.
- Seleccione los tiempos de escaneo y los pozos que se van a analizar. Por lo general, se deben analizar todos los puntos de tiempo y pozos. Proporcione una etiqueta a la definición de análisis.
- Compruebe el resumen e inicie el análisis. Se tarda unas horas en completar el análisis (la duración depende del número de puntos de tiempo y pozos). Una vez iniciado, el nombre de la definición de análisis se mostrará debajo del nombre del estudio en la pestaña Ver y la fecha completa se mostrará cuando finalice.
- Una vez completado, abra el estudio analizado haciendo doble clic en el nombre de la definición del análisis. Abra Capas a la izquierda de la pantalla y verifique si cada celda está marcada correctamente. Si no está marcado correctamente, vuelva al paso 3.1 y repita los pasos siguientes.
- Haga clic en Métricas de gráfico a la izquierda de la pantalla para exportar los datos. Seleccione Recuento verde, Recuento rojo o Recuento de superposición (por imagen) y, a continuación, elija los puntos de tiempo y los pozos que desea exportar. Para seleccionar agrupación, seleccione Réplicas de mapa de placas si todos los pozos se especifican correctamente al finalizar la exploración.
- Exporte los datos. Calcule el porcentaje de celdas formadoras de NET para cada condición/punto de tiempo mediante la siguiente ecuación utilizando un software apropiado.

NOTA: La razón por la que el denominador es el recuento máximo de objetos rojos es que el número de objetos rojos alcanza su punto máximo alrededor de 1 h y disminuye gradualmente debido a la muerte de la célula.
Resultados
Este método proporciona imágenes de contraste de fase, fluorescente rojo (colorante permeable a la membrana) y fluorescente verde (colorante impermeable a la membrana) tomadas en cada punto de tiempo. Junto con el proceso de formación de NET, se observan cambios morfológicos en el contraste de fase y en las imágenes fluorescentes rojas, y una vez que se rompe la membrana, se puede observar fluorescencia verde (Figura 1). En este ensayo, los neutrófilos formadores de NET son generalmente redondos, en lugar de formar una estructura similar a una red. Esto se debe a que la resolución de la máquina no es lo suficientemente alta como para capturar la estructura fina en forma de red y el tinte verde impermeable a la membrana tiñe la cromatina antes de que se libere una vez que se rompe la membrana. Anteriormentehemos demostrado 7 que los TNE se pueden visualizar mediante el uso de imágenes confocales en las placas de 96 pocillos recuperadas después de 4 h de incubación.
Cuando la definición de análisis se establece adecuadamente, todos los neutrófilos de la imagen se marcan como objeto rojo y los neutrófilos formadores de NET se marcan como objeto verde (Figura 2). La máquina cuenta el número de objetos rojos y verdes en cada punto de tiempo. El curso temporal de la formación de NET se visualiza representando gráficamente el porcentaje de neutrófilos formadores de NET en cada punto de tiempo (Figura 3). Las moléculas potenciales que se dirigen a la formación de NET (por ejemplo, el inhibidor de AKT) pueden probarse de una manera de alto rendimiento utilizando esta metodología.
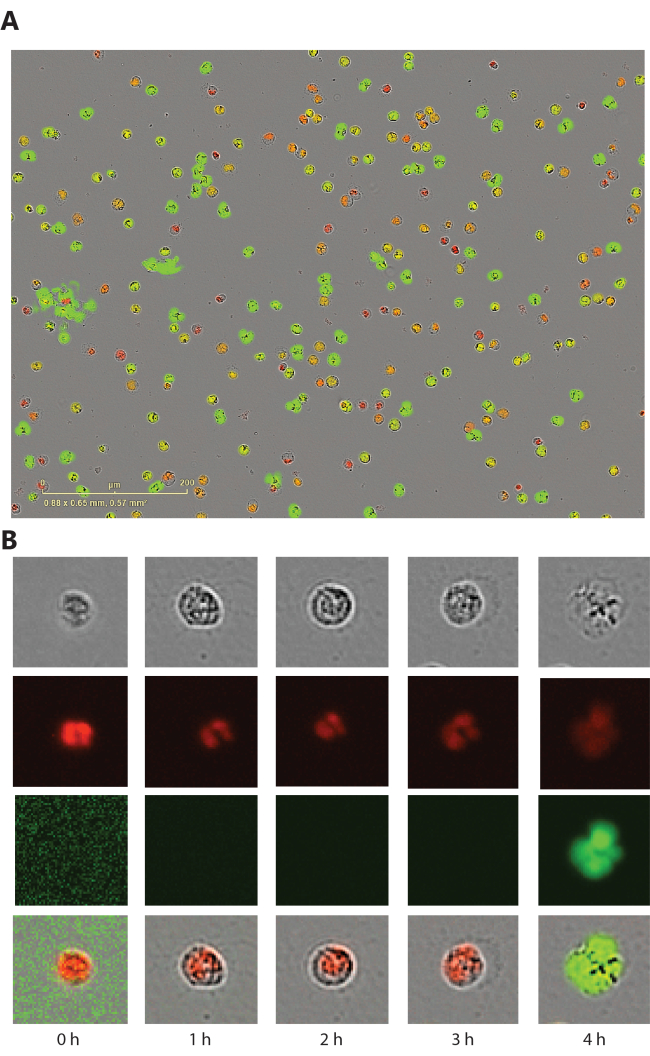
Figura 1: Cambios morfológicos en neutrófilos sometidos a formación de NET. (A) Neutrófilos de sangre periférica humana que fueron estimulados con ionóforo de calcio de 2,5 μM durante 3 h. (B) Vistas representativas de una sola célula de la imagen de contraste de fase, el canal rojo (colorante nuclear permeable a la membrana), el canal verde (colorante de ADN impermeable a la membrana) y la imagen combinada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes representativas que muestran el reconocimiento por software de neutrófilos y NETs. Los neutrófilos de voluntarios sanos humanos se estimularon con 2,5 μM de ionóforo de calcio durante 1 h. Se muestran imágenes superpuestas de imágenes de contraste de fase y cada señal o máscara. Los núcleos se tiñeron con (A) colorante rojo permeable a la membrana, y el software reconoció y contó (B) núcleos marcados en azul, mientras que los NET se tiñeron con (C) colorante verde impermeable a la membrana y el software los marcó como (D) púrpura. Si se produce (E) detección excesiva o (F) detección insuficiente, es posible que sea necesario cambiar el parámetro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Evolución temporal del porcentaje de neutrófilos formadores de NET. Los neutrófilos fueron estimulados por 25 nM de forbol 12-miristato 13-acetato (PMA) o 2,5 μM de ionóforo de calcio para inducir NET o no estimulados en RPMI. Se añadió 30 μM de inhibidor de AKT para bloquear la formación de NET. Las imágenes fueron obtenidas por el software cada 20 min durante 6 h. El porcentaje de células formadoras de NET se calculó dividiendo el recuento de objetos verdes (= el número de células formadoras de NET) por el recuento de objetos rojos (= el número de todos los neutrófilos). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los métodos actuales para cuantificar los NETs ex vivo tienen varios inconvenientes que limitan nuestra capacidad para estudiar neutrófilos, NETs y potenciales dianas terapéuticas de forma imparcial y de alto rendimiento10,14. Por ejemplo, el recuento directo de células formadoras de NET después de la tinción inmunofluorescente, considerado el estándar de oro para la cuantificación de NET, es de bajo rendimiento y depende de la visión subjetiva del operador. Un ensayo en placa que detecta la fluorescencia de un colorante de ADN impermeable a la membrana cuantifica el ADN extracelular como marcador sustituto de los TNE de una manera objetiva y de alto rendimiento, pero dado que la información morfológica no se puede obtener mediante este método, la liberación de ADN por otros tipos de muerte celular puede considerarse erróneamente como TNE. Por otro lado, el método proporciona una cuantificación objetiva y de alto rendimiento de los NETs7. Dado que se puede obtener información sobre los cambios morfológicos de los neutrófilos y su curso temporal, los NET se discriminan con precisión de otros tipos de muerte celular. Trabajos recientes han sugerido el papel patogénico de los TNE en diversas enfermedades 2,3,4,5, y la inhibición de los TNE se considera actualmente como un objetivo terapéutico potencialmente prometedor 6. El método será beneficioso para explorar múltiples moléculas dirigidas a NET de una manera rápida e imparcial.
Hay varios puntos clave para una cuantificación exitosa. La elección del colorante de unión al ADN permeable a la membrana es un factor muy importante para obtener imágenes adecuadas. Algunos colorantes son citotóxicos y otros tardan en penetrar en los núcleos. Dado que la formación de NET es relativamente rápida, el colorante debe penetrar rápidamente en los núcleos. Elegimos un tinte rojo nuclear (ver Tabla de Materiales) teniendo en cuenta estos factores. El número de celdas en cada pocillo también es importante para un conteo preciso. Si está demasiado lleno, las señales verdes y rojas de cada neutrófilo se superpondrán entre sí, lo que dificulta el recuento de cada neutrófilo por separado.
Este método tiene algunas limitaciones. Si bien la variabilidad dentro del ensayo es excelente en este ensayo, la variabilidad entre ensayos no está clara. Esto se debe a que los neutrófilos, incluso cuando se aíslan del mismo donante con todas las condiciones mantenidas constantes, actúan de manera diferente en diferentes días y puede haber alguna variación entre los ensayos realizados en otro día. Por lo tanto, si es necesario combinar datos de diferentes días, es necesario diseñar cuidadosamente el ensayo: por ejemplo, incluir el mismo número de muestras de la enfermedad y de los grupos de control en cada día. Además, aunque la evaluación de la formación de NET es objetiva una vez definida la definición del análisis (paso 3), el establecimiento de la definición en sí depende en cierta medida de la visión subjetiva de cada operador. Los pasos 3.3 y 3.4 son los pasos críticos para excluir los juicios subjetivos y mantener la variabilidad entre ensayos lo más pequeña posible. Además, se debe incluir un control positivo (p. ej., neutrófilos estimulados por 500 nM de PMA o 2,5 μM de ionóforo de calcio) cada vez, para establecer el punto de corte adecuado para contar todos los TNE.
Por otro lado, hay que tener en cuenta que otros tipos de muerte celular pueden contarse como NET. Cuando se rompe la membrana celular o se libera ADN al espacio extracelular, se observarán señales verdes. Cuando las células sufren muerte celular necrótica o las células apoptóticas sufren necrosis secundaria, su ADN se tiñe con colorante verde7. Para evitar la inclusión inexacta de estos tipos de muerte celular, se debe considerar el curso temporal y los cambios morfológicos. Mientras que las células apoptóticas suelen tardar más de 8 h en realizar necrosis secundaria, la formación de NET alcanza su punto máximo entre 3 y 6 h después de la estimulación15. Se pueden observar cambios morfológicos distintivos mediante imágenes de contraste de fase, lo que es beneficioso para la diferenciación del tipo de muerte celular7.
En general, el método nos permite cuantificar con precisión los NET de una manera objetiva y de alto rendimiento.
Divulgaciones
Los autores no tienen intereses financieros contrapuestos.
Agradecimientos
Agradecemos a la Sección de Imágenes Ópticas de la Oficina de Ciencia y Tecnología del Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel de los Institutos Nacionales de Salud. Esta investigación fue apoyada por el Programa de Investigación Intramuros del Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel de los Institutos Nacionales de Salud (ZIA AR041199).
Materiales
| Name | Company | Catalog Number | Comments |
| AKT inhibitor | Calbiochem | 124028 | |
| Clear 96-well plate | Corning | 3596 | |
| Live cell analysis system | Sartorius | N/A | Incucyte Software (v2019B) |
| Membrane-impermeable DNA green dye | Thermo Fisher Scientific | S7020 | |
| Nuclear red dye | Enzo | ENZ-52406 | Neutrophil pellet becomes bluish after staining. |
| RPMI | Thermo Fisher Scientific | 11835030 | Phenol red containig RPMI can be used. |
Referencias
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Wigerblad, G., Kaplan, M. J. Neutrophil extracellular traps in systemic autoimmune and autoinflammatory diseases. Nat Rev Immunol. 23 (5), 274-288 (2022).
- Wagner, D. D., Heger, L. A. Thromboinflammation: From atherosclerosis to COVID-19. Arterioscler Thromb Vasc Biol. 42 (9), 1103-1112 (2022).
- Njeim, R., et al. NETosis contributes to the pathogenesis of diabetes and its complications. J Mol Endocrinol. 65 (4), R65-R76 (2020).
- De Meo, M. L., Spicer, J. D. The role of neutrophil extracellular traps in cancer progression and metastasis. Semin Immunol. 57, 101595 (2021).
- Nakabo, S., Romo-Tena, J., Kaplan, M. J. Neutrophils as drivers of immune dysregulation in autoimmune diseases with skin manifestations. J Invest Dermatol. 142 (3 Pt B), 823-833 (2022).
- Gupta, S., Chan, D. W., Zaal, K. J., Kaplan, M. J. A high-throughput real-time imaging technique to quantify NETosis and distinguish mechanisms of cell death in human neutrophils. J Immunol. 200 (2), 869-879 (2018).
- Nakabo, S., Kaplan, M. J., Gupta, S. Quantification of neutrophils undergoing NET formation and distinguishing mechanisms of neutrophil cell death by use of a high-throughput method. Methods Mol Biol. 2543, 129-140 (2022).
- Singh, J., et al. Moonlighting chromatin: when DNA escapes nuclear control. Cell Death Differ. 30 (4), 861-875 (2023).
- Carmona-Rivera, C., Kaplan, M. J. Induction and quantification of NETosis. Curr Protoc Immunol. 115, 14.41.11-14.41.14 (2016).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. J Vis Exp. (175), 62837 (2021).
- Neubert, E., et al. Serum and serum albumin inhibit in vitro formation of neutrophil extracellular traps (NETs). Front Immunol. 10, 12 (2019).
- von Kockritz-Blickwede, M., Chow, O. A., Nizet, V. Fetal calf serum contains heat-stable nucleases that degrade neutrophil extracellular traps. Blood. 114 (25), 5245-5246 (2009).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. J Immunol Methods. 423, 104-110 (2015).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 18 (2), 134-147 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados