Method Article
Терапевтические эффекты отвара Хуачжуоцзеду при предраковых поражениях рака желудка путем регуляции митофагии
В этой статье
Резюме
Здесь мы представляем протокол, который демонстрирует терапевтическую эффективность отвара Хуачжуоцзеду (HZJD) в облегчении предраковых поражений рака желудка с помощью регуляции митофагии.
Аннотация
Данное исследование направлено на изучение терапевтического эффекта и потенциальных механизмов применения отвара Хуачжуоцзеду (HZJD) для облегчения предраковых поражений рака желудка (PLGC) как in vivo , так и in vitro. HZJD — это традиционная китайская травяная формула, состоящая из 11 трав. Крысы Спрага-Доули (SD) были случайным образом разделены на четыре подгруппы: контрольная группа, модельная группа, группа положительных препаратов и группа HZJD. После 10 недель лечения HZJD проводили окрашивание гематоксилин-эозином (H&E), окрашивание с высоким содержанием железа, окрашивание с высоким содержанием железа, периодическую кислоту Шиффа (AB-PAS), иммуногистохимию, иммунофлуоресценцию, ОТ-кПЦР и вестерн-блоттинг. Для выявления пролиферации клеток in vitro использовали набор для подсчета клеток-8 (CCK-8) и 5-этинил-2'-дезоксиуридин (EdU). Для оценки уровня митофагии проводили ОТ-кПЦР и вестерн-блоттинг. Результаты показали, что HZJD может замедлить патологическое прогрессирование у крыс PLGC и снизить пролиферацию клеток PLGC. Лечение HZJD значительно повысило уровни экспрессии мРНК и белка Sirt3, Foxo3a, Parkin и LC3 II/I, в то время как уровни экспрессии мРНК и белка p62 и Tomm20 значительно увеличили. Было обнаружено, что HZJD обладает способностью обращать вспять снижение активности митофагии как in vivo , так и in vitro. В заключение следует отметить, что в исследовании оценивалось влияние HZJD и были представлены данные о его потенциальном молекулярном механизме.
Введение
Рак желудка (РЖ) остается одним из самых распространенных злокачественных заболеваний, поражающих пищеварительную систему во всем мире. По оценкам, на долю ГК приходится примерно 6% всех случаев рака во всем мире, занимая5-е место среди наиболее часто диагностируемых видов рака и3-е место среди смертей, связанных с раком. ГК широко признана как прогрессивный, многоступенчатый биологический процесс. До начала ГК слизистая оболочка желудка часто в течение нескольких лет подвергается предраковым поражениям, называемым предраковыми поражениями стадии рака желудка (PLGC). Теория каскада Корреа широко принята и дает объяснение последовательному прогрессированию от нормальной слизистой оболочки к хроническому неатрофическому гастриту, атрофическому гастриту, кишечной метаплазии (ИМ), дисплазии (Дис) и, в конечном итоге, к карциноме2. PLGC представляет собой важнейший этап в развитии ГК, и своевременное вмешательство и мониторинг PLGC имеют жизненно важное значение для ранней профилактики ГК.
Недавние клинические оценки и экспериментальные исследования подтвердили, что традиционная китайская медицина (ТКМ) становится одним из наиболее эффективных методов лечения PLGC 3,4. Отвар HZJD — это формула ТКМ, разработанная на основе клинического опыта и основанная на теории ТКМ по удалению тепла и влаги. Предыдущие исследования продемонстрировали благотворное влияние отвара HZJD в лечении PLGC, в частности в облегчении клинических симптомов и патологических проявлений 5,6. В ходе исследований, связанных с сетевой фармакологией, мы определили активные компоненты отвара HZJD, а также их потенциальные мишени для PLGC7. Результаты предыдущего исследования показали, что отвар HZJD обладает способностью увеличивать разнообразие, оптимизировать структуру сообщества и увеличивать относительную численность кишечной флоры у крыс PLGC8. Кроме того, было подтверждено, что отвар HZJD может улучшать PLGC за счет регуляции кишечной микробиоты и ее метаболитов9. В недавней работе мы продемонстрировали, что отвар HZJD может регулировать динамический баланс пролиферации и апоптоза клеток PLGC за счет подавления экспрессии lnc 51736810.
Все большее число исследований подтверждают, что митофагия играет важную роль в развитии различных видов рака. Митофагия избирательно устраняет поврежденные и деполяризованные митохондрии и дополнительно предотвращает чрезмерное накопление цитотоксических активных форм кислорода (АФК) из дисфункциональной митохондрии, что, в свою очередь, ингибирует онкогенез11. Митофагия, избирательная деградация поврежденных или дисфункциональных митохондрий, неразрывно связана с митохондриальным окислительным фосфорилированием (OXPHOS). Нарушение или отсутствие митофагии может привести к сдвигу клеточного энергетического метаболизма в сторону аэробного гликолиза, феномену, широко известному как эффект Варбурга. Повышенная продукция лактатных и кетоновых тел, возникающая в результате эффекта Варбурга, способствует созданию опухолевого микроокружения, способствующего пролиферации клеток.
В этом исследовании представлен комплексный протокол использования отвара HZJD в качестве терапевтического подхода для смягчения прогрессирования PLGC. В ходе нашей оценки мы наблюдали значительный положительный эффект отвара HZJD, в частности, в его способности регулировать миофагию. Исследование дает ценную информацию о потенциальных молекулярных механизмах отвара HZJD при лечении PLGC.
протокол
Все экспериментальные процедуры и уход за животными были одобрены Комитетом по институциональному уходу за животными и их использованию Хэбэйского университета традиционной китайской медицины (номер одобрения: DWLL2019031) и выполнялись в соответствии с этическими принципами. В общей сложности 90 специфических самцов крыс породы Спрэг-Доули (SD) без патогенов (возраст = 6 недель; вес = 150-180 г; см. таблицу материалов) выращивали при постоянной температуре (24 °C ± 4 °C) и влажности (50%-60%) в контролируемом темне/световом цикле в течение 12 часов. Крыс акклиматизировали к новой среде в течение 1 недели до начала экспериментов.
1. Подготовка к эксперименту на животных
- Крысиная модель ПЛСК
- Случайным образом распределите крыс по контрольной группе (n=20) и модельной группе PLGC (n=70). Снабжайте крыс в контрольной группе стандартной гранулированной диетой для грызунов и водой в неограниченном количестве. Кормить крыс модельной группы PLGC нерегулярным рационом (1 день голодания, 1 день кормления).
- Размещайте крыс группами по пять человек в клетке. Обеспечьте контрольную группу 150 г/сутки корма на клетку. Обеспечьте модельной группе PLGC свободный доступ к пище в течение 23 ч (150 г/день/на клетку). Через 23 ч уберите остатки корма.
- Обеспечить крыс модельной группы PLGC раствором 1-метил-3-нитро-1-нитрозогуанидина (МННГ) (200 мкг/мл) для свободного питья10,13. Обеспечьте крыс в модельной группе PLGC 200 мл раствора MNNG на клетку. Поместите раствор МННГ в непрозрачные бутылки для питья и заменяйте ежедневно.
- Зондирование крыс в модельной группе PLGC 2% салицилатом натрия после 24 ч голодания (1 раз в 2 дня зондированием). Для зондирования используйте силиконовую иглу (см. Таблицу материалов) с минимальной глубиной иглы, равной 6 см. Выполняйте зондирование последовательно в одно и то же время утром с 8:30 до 9:30 утра.
- Случайным образом выбрать двух крыс из модельной группы PLGC для патологического обследования на 12, 16, 20 и 24 неделях с целью оценки становления модели PLGC. Считайте, что модель успешна, когда у обеих крыс диагностирован PLGC путем патологической оценки, как описано впункте 9.
- Этот процесс моделирования длится около 24 недель. Позвольте двум старшим патологоанатомам провести патологоанатомическую оценку независимо друг от друга. Определите патологический диагноз PLGC у крыс с помощью совместной оценки двух патологоанатомов. Примите во внимание их диагностические заключения и используйте предыдущие рекомендации в качестве ориентира в процессе оценки 14,15,16,17.
- Приготовление отвара HZJD
- Приготовьте отвар HZJD по методу, описанному впункте 7.
ПРИМЕЧАНИЕ: Травы в отваре HZJD были приобретены и аутентифицированы больницей традиционной китайской медицины провинции Хэбэй.
- Приготовьте отвар HZJD по методу, описанному впункте 7.
- Группировка и лекарственная интервенция
- Случайным образом разделите модельную группу PLGC на три подгруппы: модельная группа (n=20), группа положительных препаратов (n=20) и группа отвара Хуачжуоцзиеду (HZJD, n=20, табл. 1).
- Вводите крысам в группе положительных препаратов 0,7 мг/кг/сут витамина В12 через18 минут. Обработайте крыс в группе HZJD отваром HZJD в дозе 14,81 г/кг/день 8. Крысам в контрольной и модельной группах вводят дистиллированной водой (10 мл/кг). Все четыре группы получают внутрижелудочное введение один раз в день в течение 10 недель.
ПРИМЕЧАНИЕ: Суточная рекомендуемая доза отвара HZJD для человека составляет 142 г/день 10. С помощью метода расчета площади поверхности тела было установлено, что рекомендуемая дозировка для крыс в 6,25 раз выше, чем для человека. Поэтому суточная дозировка отвара HZJD для крыс составляет 14,81 г/кг. Дозировка корректировалась еженедельно в соответствии с весом крыс. Максимальный объем зонда не превышал 3 мл.
- Забор образцов
- Принесите в жертву всех крыс после 24 ч голодания (со свободным доступом к воде) на 35 неделе. Обезболить всех крыс изофлураном (5% индукция, 2% для поддержания, скорость потока 1 л/мин).
- Побрейте область живота и простерилизуйте кожу этанолом и йодом после подтверждения потери болевой стимуляции. Разрежьте скальпелем кожу живота с мечевидного хряща по средней линии живота.
- Тупым путем отделите подкожную клетчатку щипцами и скальпелем до тех пор, пока не обнажится живот. Рассеките желудок по большей кривизне ножницами и сразу же промойте его фосфатно-солевым буфером (PBS).
- Разверните ткани желудка на ледяной пластине. Соберите образцы желудка (2 мм x 2 мм) из антрального отдела, тела и меньшей кривизны угловой области. Если на желудке есть какие-либо видимые поражения, соберите и обработайте эти конкретные части в качестве образцов.
- Зафиксировать образцы желудка в 4% параформальдегиде в течение 24 ч. Поместите оставшиеся ткани желудка в криопробирки. Заморозьте их в жидком азоте, а затем храните при температуре -80 °C.
- Усыпьте крыс путем вдыхания углекислого газа. Поместите туши крыс в герметичные пакеты, а затем положите пакеты в шкаф для хранения туш животных.
2. Патологоанатомическое обследование
- Обрежьте и разгладьте неподвижные ткани желудка ножницами. Обезвоживайте ткани градиентным спиртовым рядом, т.е. 75% этанола в течение 30 мин, 85% этанола в течение 30 мин, 95% этанола в течение 30 мин и 2x в безводном этаноле в течение 30 мин каждый. Погрузите салфетки в раствор ксилола/этанола (1:1) на 1 час и 2 раза в 100% ксилол на 30 минут.
- Вылейте половину расплавленного воска в форму, а затем быстро поместите пропитанные ткани в форму. Поместите салфетки во вторую половину расплавленного воска. Отметьте заложенную коробку и дайте воску полностью застыть.
- С помощью микротома нарезать ломтиками толщиной 4 мкм. Выложите ломтики на горки.
- Поместите ломтики 2 раза в 100% ксилол на 10 мин каждый, затем в раствор ксилола/этанола (1:1) на 10 мин, снова 2 раза в безводный этанол на 5 мин, затем в 95% этанол на 5 мин, затем 85% этанол на 5 мин и, наконец, в 70% этанол на 5 мин. Промойте ломтики проточной водой.
- Срезы окрашивать гематоксилином в течение 5 мин. Дифференцировать путем погружения в 0,5% соляную кислоту-этанол на 10 с. Окрашиваем ломтики эозином в течение 2 мин.
- Промойте ломтики дистиллированной водой. Обезвоживайте ломтики градиентным спиртовым рядом, т.е. 70% этанола в течение 30 с, 80% этанола в течение 30 с, 95% этанола в течение 30 с, безводного этанола в течение 30 с. Пропитайте ломтики 100% ксилолом 2x. Заклейте ломтики нейтральным бальзамитом.
- Смешайте раствор HID A и раствор HID B в соотношении 50:3 для приготовления рабочего раствора HID. Окрашивайте ломтики рабочим раствором HID в течение 24 часов.
- Промойте под проточной водой, а затем обмажьте ломтики альцианом на 20 минут. Закрасьте ломтики ядерным быстрым красным раствором в течение 10 минут. Обезвожьте и запечатайте ломтики, как описано в шаге 2.6.
- Обкрашиваем ломтики альцианом в течение 20 минут. Выдержать ломтики в 1% водном растворе периодической кислоты в течение 5 минут. Обмажьте ломтики Schiff в течение 20 минут.
- Инкубируйте предметные стекла с гематоксилином в течение 2 минут, чтобы окрасить ядра. Добавьте раствор кислотной дифференцировки (входит в комплект HID) в течение 5 с. Нанесите раствор синего Скотта на 3 минуты, чтобы окрасить слайды в синий цвет. Обезвожьте и запечатайте ломтики, как описано выше в шаге 2.6.
ПРИМЕЧАНИЕ: Процесс окрашивания должен быть защищен от света. Температура должна поддерживаться ниже 22 °C при использовании 1% водного раствора периодической кислоты. Ломтики должны быть обезвожены и запечатаны, как описано в шаге 2.6. - Рассмотрите окрашенные срезы под оптическим микроскопом при увеличении 10х и 20х.
3. Иммуногистохимия
- Используйте срезы, полученные на шаге 2.4. Поместите ломтики в буфер цитрата натрия 0,01 М и нагревайте в течение 10 минут для извлечения антигена.
- Добавьте 3% перекись водорода на 30 минут, чтобы погасить эндогенную пероксидазу и биотин. Залейте ломтики козьей сывороткой на 30 минут.
- Инкубируйте ломтики с разведенными первичными антителами против sirt3 (1:200), foxo3a (1:100) и паркина (1:200) в течение ночи при 4 °C. Замените первичные антитела на PBS для отрицательного контроля.
- Промойте ломтики 3 раза в течение 5 минут за промывку PBS. Инкубируйте срезы с соответствующим вторичным антителом при комнатной температуре в течение 1 ч.
- Добавьте 20 мкл 3,3'-диаминобензидина (DAB) в течение 3 мин. Обезвожьте и запечатайте ломтики, как описано выше в шаге 2.6.
- Получите изображение всех срезов с 40-кратным увеличением под оптическим микроскопом. Используйте программное обеспечение Image-Pro Plus 6.0 для выполнения количественного анализа изображений.
4. Иммунофлюоресценция
- Используйте срезы, полученные на шаге 3.1. Повторите шаг 3.3.
- Инкубируйте срезы с разведенными первичными антителами против ЦОГ IV (1:500) и LC3 (1:500) в течение ночи при 4 °C. Промойте ломтики 3 раза в течение 5 минут за промывку PBS.
- Инкубируйте ломтики с козьим антикроличьим IgG (1:1000) и козьим антимышиным IgG (1:1000) при комнатной температуре в течение 1,5 часа. Промойте ломтики 3 раза в течение 5 минут за промывку PBS.
- Добавьте раствор для окрашивания DAPI и выдерживайте при комнатной температуре в течение 10 минут в темноте. Промойте ломтики 3 раза в течение 5 минут за промывку PBS.
- Добавьте раствор для окрашивания DAPI по каплям и выдерживайте при комнатной температуре в течение 10 минут в темноте. Закрепите срезы с помощью флуоресцентной монтажной среды, препятствующей выцветанию.
- Визуализируйте и сфотографируйте срезы под флуоресцентным микроскопом (см. Таблицу материалов) при 40-кратном увеличении.
5. Вестерн-блоттинг
- Весить 100 мг тканей желудка точно. Добавьте 1 мл буферного раствора RIPA (см. Таблицу материалов). Тщательно измельчите салфетки с помощью гомогенизатора (10 000 x g, 15 с каждый раз для 3x).
- Поместите гомогенированную ткань на лед на 30 минут. Центрифугируйте при 12 000 x g в течение 20 минут при 4 °C, а затем соберите надосадочную жидкость.
- Количественное определение концентрации белка с помощью набора для определения концентрации белка бицинхониловой кислоты (BCA) (см. Таблицу материалов). Отрегулируйте концентрацию белка полученной надосадочной жидкости так, чтобы она была постоянной в пределах образцов.
- Приготовьте гель SDS-PAGE, состоящий из 10% разделительного геля и 5% укладывающего геля. Налейте 10% разделительный гель в стеклянную пластину на 2/3 от общей высоты. Добавляйте деионизированную воду поверх геля, пока гель не застынет. Налейте 5% стекирующий гель, чтобы заполнить стеклянную тарелку. Вставьте гребень для электрофореза.
ПРИМЕЧАНИЕ: Следует следить за тем, чтобы в геле не было пузырьков. - Смешайте надосадочную жидкость с 5-кратным буфером загрузки в соотношении 1:4. Опустите его в кипящую воду на 5 минут для денатурации. Храните при температуре -20 °C.
- Соберите подготовленный гель SDS-PAGE в системе электрофореза Вестерн-блоттинг. Добавьте свежий раствор электрофореза (см. Таблицу материалов). Загрузите в гель 20 мкл образца из каждой лунки. Запустите электрофорез при напряжении 80 В в течение 40 минут, а затем переключитесь на напряжение 120 В.
- Соберите гель и создайте бутерброд для переноса следующим образом: два слоя губчатой прокладки, два слоя фильтровальной бумаги, гель, мембрана из поливинилиденфторида (PVDF) (см. Таблицу материалов), два слоя фильтровальной бумаги, два слоя губчатой прокладки (от отрицательного полюса к положительному полюсу). Добавьте предварительно охлажденный буфер для переноса. Выполняйте влажный перенос при давлении 350 мА в течение 2 ч.
ПРИМЕЧАНИЕ: Перед сборкой переносного сэндвича мембрана из ПВДФ должна быть предварительно обработана метанолом. Кроме того, губка, фильтровальная бумага и предварительно обработанная мембрана из ПВДФ должны быть предварительно погружены в буфер для переноса (см. Таблицу материалов). - Заблокируйте мембрану 5% обезжиренным молоком в трис-буферном физрастворе с tween 20 (TBST) в течение 2 часов на шейкере. Инкубировать мембрану в течение ночи при 4 °C со следующими разведенными первичными антителами (Sirt3 = 1:500, Foxo3a = 1:1000, Parkin = 1:2000, P62 = 1:1000, LC3 = 1:1000, Tomm20 = 1:2000, β-актин = 1:5000, GAPDH = 1:5000).
ПРИМЕЧАНИЕ: GAPDH был выбран в качестве эталона для обнаружения паркина из-за того, что молекулярная масса паркина (50 кДа) близка к молекулярной массе β-актина (42 кДа). - Промойте мембрану 4 раза с TBST в течение 5 минут каждый раз. Инкубируйте его с разведенным вторичным антителом (1:5000) при комнатной температуре в течение 1 ч.
- Капните рабочий раствор ECL на белковую сторону мембран на 2 мин. Получение изображений с помощью системы хемилюминесцентной визуализации. Используйте программное обеспечение ImageJ для измерения значений оттенков серого.
6. Количественный анализ ПЦР в реальном времени
- Очистите все экспериментальные устройства 0,1% диэтилпирокарбонатом (ДЭПК), а затем заранее простерилизуйте их при высокой температуре и высоком давлении.
- Весить 50 мг тканей желудочного сока. Добавьте 1 мл Редзола (см. Таблицу материалов) и измельчите в гомогенизаторе. Перенесите гомогенат тканей в центрифужную пробирку без РНКазы и дайте ей постоять при комнатной температуре в течение 10 минут.
- Добавьте 0,2 мл трихлорметана и тщательно перемешайте. Дайте постоять при комнатной температуре 3 минуты. Центрифуга при 4 °C и 12 000 x g в течение 15 минут.
- Осторожно удалите верхнюю водную фазу и смешайте ее с 0,5 мл изопропанола в течение 10 минут. Центрифугируйте 12 000 x g в течение 10 минут при 4 °C для осаждения РНК. Выбросьте надосадочную жидкость, а затем промойте РНК-осадок 3 раза с 75% этанолом.
- Центрифуга при 7 500 x g в течение 5 мин при 4 °C. Выбросьте надосадочную жидкость, а затем высадите сухую РНК в стерильном верстаке в течение 10 минут. Растворите осадок в 50 μл DEPC.
- Выполните обратную транскрибацию 1 мкг РНК в кДНК. Добавьте 1 мкл смеси 20x RTase, 4 мкл 5x RT реакционного буфера (см. Таблицу материалов) и доведите DEPC до общего объема 20 мкл. Установите процедуру реакции следующим образом: 10 мин при 25 °C, 40 мин при 42 °C, 10 мин при 85 °C, а затем подержать при 4 °C.
- Приготовьте реакционную смесь амплификации, содержащую 2 мкл кДНК, 2 мкл прямого праймера, 2 мкл обратного праймера (Таблица 2), 10 мкл 2x предварительной смеси SYBR (см. Таблицу материалов) и 4 мкл DEPC. Установите процедуру реакции следующим образом: 95 °C в течение 15 с, 60 °C в течение 10 с и 72 °C в течение 30 с (40 циклов).
- Используйте β-актин в качестве эндогенного референта. Получите значения Ct. Рассчитайте относительную экспрессию генов-мишеней с помощью метода 2-ΔΔCt.
7. Подготовка к клеточным экспериментам
- Модель ячейки PLGC
- Культивировали клетки GES-1 в среде Roswell Park Memorial Institute (RPMI) 1640 в сочетании с 10% фетальной бычьей сывороткой (FBS) и 1% пенициллин-стрептомицином. Культивируют клетки при концентрации 2 x10-5 клеток на лунку в 6-луночном планшете, содержащем 1,5 мл среды RPMI 1640 без сыворотки и антибиотиков при 37 °C с 5%CO2.
- Индуцировать клетки GES-1 с помощью MNNG для злокачественной трансформации. Задайте схему моделирования, как описано ниже.
- На 0-й день проводят предварительную реанимацию и пассаж клеток GES-1 для поддержания их в логарифмической фазе роста. Инокулируйте клетки GES-1 в логарифмические колбы и культивируйте их в течение ночи.
- В день 1 и день 2 замените среду, содержащую MNNG (10 мкМ/л). На 3-й день замените среду, содержащую МННГ, на безнаркотическую.
- На 4-й и 6-й день обрабатывайте клетки средой, содержащей MNNG (5 мкМ/л) в течение 24 ч. На 7-й день замените среду, содержащую МННГ, на безнаркотическую. Удалите многочисленные умирающие и отслаивающиеся клетки и продолжите культивирование клеток.
- На 8-й и 10-й день обрабатывайте клетки средой, содержащей MNNG (5 мкМ/л) в течение 24 ч. На 11-й день постройте модель ячейки PLGC (MC).
ПРИМЕЧАНИЕ: В течение периода моделирования следует регулярно наблюдать за состоянием клеток. Если клетки показывают плохое состояние, рекомендуется обрабатывать их МННГ в течение разных временных интервалов, желательно с интервалом в 2 дня. В качестве альтернативы клетки могут быть обработаны низкой дозой МНГ (3 мкМ/л). Критерии патологического диагноза клеток МК могут быть использованы в предыдущих исследованиях для точной оценки состояния клеток 10,19,20,21.
- Приготовление препаратосодержащей сыворотки
- Кормите 30 крыс SD (самец, 220 г) стандартной гранулированной диетой для грызунов и водой в неограниченном количестве, пока вес всех крыс не превысит 350 г. Случайным образом распределите крыс по группе положительной лекарственно-содержащей сыворотки (n=10), группе HZJD-содержащей сыворотке (n=10) и нормальной группе сыворотки крыс (n=10).
- Проводите введение препарата крысам, как описано в шаге 1.3.2. Вводите крысам 2 раза в день в 8:00 и 20:00. Продолжайте медикаментозное вмешательство в течение 7 дней.
- Соберите образцы крови в течение 1 часа после последнего введения на 8-й день (8:00 утра). Поместите образцы в пробирки с антикоагулянтами при температуре 4 °C на 1 ч. Центрифугируйте при 3 000 x g в течение 15 минут при 4 °C, а затем соберите надосадочную жидкость.
- Группировка и интервенционные методы клеточных экспериментов
- Разделите клеточные эксперименты следующим образом: группа GES-1 (GES-1), группа MC (MC), группа положительного препарата (положительный препарат), группа отвара HZJD (HZJD), группа сайленсинга Sirt3 (si-Sirt3), группа отрицательного контроля (si-NC) и сайленсинг Sirt3 в сочетании с группой отвара HZJD (si-Sirt3+HZJD).
- Клетки в группе положительного препарата и группе HZJD обрабатывают 10% сывороткой, содержащей витамин B12, и 10% сывороткой, содержащей HZJD, соответственно. В других группах вводите 10% нормальной сыворотки крыс.
Примечание: На основании предыдущих исследований для лечения клеток была выбрана10-10% лекарственно-содержащая сыворотка. - Проведите трансфекцию Si-РНК Sirt3 (см. Таблицу материалов) для клеток группы si-Sirt3 и группы si-Sirt3+HZJD. Настройте отрицательную контрольную группу, получающую пустой вектор, а именно si-NC.
- Растворите 2,5 нМ мощности миРНК в 125 мкл DEPC для приготовления раствора миРНК. Разведите 5 мкл раствора миРНК с 250 мкл минимально незаменимой среды и разведите 5 мкл липофектамина 2000 с 250 мкл минимальной незаменимой среды. Равномерно перемешайте их вместе.
- Добавьте смесь в среду RPMI 1640 (1,5 мл/на лунку) в 6-луночный планшет. Инкубировать при 37 °C с 5%CO2. Проведите вестерн-блоттинг для определения уровня экспрессии белка Sirt3 через 48 ч после трансфекции.
8. Анализ CCK-8
- Приготовьте клетки в клеточную суспензию, когда клетки покроют 70% дна бутылки. Используйте счетчик клеток для подсчета количества клеток в суспензии. Отрегулируйте концентрацию так, чтобы обеспечить 2 000 клеток на лунку, и каждая лунка содержит 100 мкл среды RPMI 1640. Засейте клетки в 96-луночные планшеты и поддерживайте при температуре 37 °C в инкубаторе с 5%CO2 в течение 24 ч. Установите по 6 повторяющихся скважин для каждой группы.
ПРИМЕЧАНИЕ: Периферийные лунки 96-луночных планшетов, которые не используются, заполнены 200 μL PBS для уменьшения испарения в течение инкубационного периода. - После культивирования клеток в течение 24 ч замените питательную среду другой питательной средой, содержащей лекарственные средства. Культивируют клетки в течение 48 ч положительной лекарственно-содержащей питательной средой и HZJD-содержащей питательной средой.
ПРИМЕЧАНИЕ: Питательная среда прозрачна. Наблюдая за дном бутылки с культурой на свету, можно заметить, что клетки соединены в листы. Это явление может свидетельствовать о том, что клетки прилипли к стенке. При наблюдении под микроскопом адгезивные клетки расширяются в челноки на дне флакона, и при встряхивании питательной среды клетки не двигаются. Клетки обычно прилипают к стенке через 24 ч после посева. - Замените лекарственно-содержащую питательную среду свежей питательной средой. Добавьте 10 μL раствора CCK-8 (см. Таблицу материалов) в каждую лунку и инкубируйте при 37 °C в течение 1 ч. Чтобы избежать образования пузырьков воздуха, раствор ССС-8 добавляют наискось на стенку тарелки культуры.
- Определение значения наружного диаметра каждой лунки с помощью микропланшетного ридера на длине волны 450 нм.
9. Анализ пролиферации клеток EdU
- Засейте клетки в 96-луночные планшеты, как описано в шаге 7.1. Заменяйте питательную среду другой лекарственносодержащей питательной средой на 48 ч.
ПРИМЕЧАНИЕ: В ходе предварительных экспериментов было подтверждено, что оптимальное время лечения составляет 48 часов. - Удалите среду и промойте клетки PBS. Добавьте 100 μл питательной среды на лунку. Приготовьте 2x раствор EdU (см. Таблицу материалов, 20 μM). Добавьте 6 мкл стокового раствора EdU в 3 мл питательной среды. Добавьте 100 μл 2x раствора EdU (предварительно нагретый до 37 °C) в лунку и затем инкубируйте в течение 2,5 часов.
ПРИМЕЧАНИЕ: Стоковый раствор EdU был разбавлен в соотношении 1:500 для получения 2x раствора EdU. Фактический объем 2x раствора EdU составил 2,4 мл для 24 скважин. - Удалите среду, содержащую EdU. Добавьте 200 мкл 4% параформальдегида в лунку при комнатной температуре в течение 15 мин. Удалите параформальдегид. Промойте клетки промывочным раствором (3% бычий сывороточный альбумин [BSA] в PBS) 3 раза по 5 минут каждая.
- Удалите раствор для стирки. Добавьте 200 мкл раствора для пермеабилизации (0,3% Triton-X 100 в PBS) на лунку при комнатной температуре в течение 20 мин. Удалите раствор для пермеабилизации. Промойте ячейки промывочным раствором (3% BSA в PBS) 2 раза по 5 минут каждая.
- Растворите добавку в 1,3 мл деионизированной воды для полного раствора. Готовят реакционный раствор, содержащий 1,72 мл реакционного буфера, 4 мкл азида 488, 80 мкл CuSO4 и 200 мкл раствора добавки.
- Добавьте 50 мкл реакционного раствора на лунку. Образцы инкубировать при комнатной температуре в течение 30 минут в темноте. Промойте ячейки промывочным раствором 3 раза по 5 минут каждая.
- Удалите раствор для стирки. Добавьте 200 μл 1x раствора Hoechst 33342 и инкубируйте образцы при комнатной температуре в течение 10 минут в темноте.
- Получение изображений с помощью флуоресцентного микроскопа. Используйте программное обеспечение Image-Pro plus 6.0 для выполнения количественного анализа изображений.
ПРИМЕЧАНИЕ: Максимальные длины волн возбуждения и излучения Azide 488 составляют 495 нм и 519 нм соответственно. Максимальные длины волн возбуждения и излучения Hoechst 33342 составляют 346 нм и 460 нм соответственно.
10. Обнаружение митофагии в живых клетках
- Засейте ячейки по 2 х 10 по4 ячейки в 24-луночный стакан со стеклянным дном. Культивирование ночных клеток средой RPMI 1640 без антибиотиков при 37 °C с 5%CO2.
- Приготовьте рабочий раствор красителя мтфагии и рабочий раствор лизокрасителя (см. Таблицу материалов). Разбавьте раствор красителя мтфагии буфером HEPES Hanks' до концентрации 100 нМ/л. Разбавьте раствор лизокрасителя буфером HEPES Hanks' до концентрации 100 мкМ/л.
- Удалите питательную среду и промойте клетки буфером HEPES Hanks' 2x. Добавьте 500 мкл рабочего раствора красителя мтфагии (100 нМ/л) и затем инкубируйте при 37 °C в течение 30 минут.
- Промойте клетки буфером HEPES Hanks' 2x. Добавьте 500 μL рабочего раствора лизокрасителя (100 μМ/л) и затем инкубируйте при 37 °C в течение 30 минут.
- Промойте клетки буфером HEPES Hanks' 2x. Определяют уровень митофагии методом конфокальной флуоресцентной микроскопии.
ПРИМЕЧАНИЕ: Клетки были визуализированы без какой-либо фиксации до или после окрашивания. Процесс визуализации был проведен как можно быстрее, чтобы свести к минимуму любые потенциальные изменения или изменения в клеточном состоянии.
11. Статистический анализ
- Используйте коммерческое программное обеспечение для выполнения статистического анализа. Сравните различия между различными группами с помощью одностороннего ANOVA с последующим тестом на ЛСД. Представьте данные в виде среднего значения ± стандартного отклонения (SD). Установите статистическую значимость как P<0,05.
Результаты
MNNG индуцирует прогрессирование PLGC в животной модели и способствует морфологической трансформации клеток GES-1
При макроскопическом наблюдении слизистая оболочка желудка крыс контрольной группы выглядела равномерно ярко-красной, гладкой и мягкой, со складками слизистой оболочки, расположенными линейно. В отличие от крыс в контрольной группе, слизистая оболочка желудка крыс в модельной группе показала бледность и шероховатость, а слизистые оболочки были плоскими или даже исчезли (рис. 1B). Начиная с12-й недели применяли гистологическое исследование для наблюдения за патологическими изменениями слизистой оболочки желудка крыс. На12-й неделе при гистологическом исследовании выявлено воспаление и расширение сосудов в слизистой оболочке желудка, а также незначительные дефекты эпителиальных клеток. Толщина слизистой была в норме, а железы располагались исправно. На16-й неделе слизистая желудка стала значительно истонченнее, а желудочные железы сократились и вакуолировались. ИМ и DYS иногда наблюдались с обширной кистозной дилатацией желудочных желез на 20-й неделе. До 24-й недели в слизистой оболочке желудка наблюдался дис. Внутренние железы показали уменьшение количества и были аномально выровнены. Также наблюдалась цитологическая атипия, включая гиперхроматические ядра, аномально большое ядерное/цитоплазматическое соотношение и потерю полярности (рис. 1A). Модель клетки in vitro была успешно сконструирована путем введения МННГ. Некоторые морфологические изменения наблюдались в модели МЦ-клеток. Было замечено, что клетки GES-1 демонстрируют монослойный рост, проявляющийся в виде однородных веретенообразных клеток с овальными или круглыми ядрами. Напротив, клетки МС демонстрировали многослойный рост и неравномерное распределение. Клетки МК были удлиненными с неправильными ядрами и веретенообразной формой, похожей на фибробласты (рис. 1C).
Отвар HZJD облегчает процесс выработки PLGC in vivo и подавляет пролиферацию клеток МЦ
После верификации модели PLGC крыс лечили еще 10 недель для дальнейшего уточнения эффекта отвара HZJD. Результаты окрашивания H&E показали, что слизистая оболочка желудка в контрольной группе была толстой с обильными железами и массивными париетальными клетками. Напротив, у крыс модельной группы наблюдались патологические изменения, в том числе IM и Dys. Патология слизистой оболочки желудка значительно улучшилась в группе HZJD по сравнению с модельной группой. В частности, слизистая оболочка желудка показала воспаление, но эпителиальные клетки остались относительно неповрежденными. Железы имели правильное расположение, а париетальные клетки были разбросаны. Однако терапевтический эффект положительного препарата не очевиден (рисунок 2А). Для дальнейшего уточнения степени PLGC проводили окрашивание HID-AB и окрашивание AB-PAS для классификации IM. Окрашивание HID-AB использовали для дифференциации сульфомуцинов от сиаломуцинов, а окрашивание AB-PAS использовали для дифференциации кислых муцинов от нейтральных муцинов13,22. В контрольной группе эпителиальные клетки слизистой оболочки желудка демонстрировали равномерное распределение синего цвета вместо коричневого при окрашивании HID-AB. Кроме того, при окрашивании AB-PAS эпителиальные клетки имели пурпурно-красный цвет. Слизистая оболочка желудка модельной группы имела коричневый цвет при окрашивании HID-AB и синий при окрашивании AB-PAS, что свидетельствовало о наличии метаплазии толстой кишки (C-IM). В группе HZJD слизистая оболочка желудка не имела коричневого пятна при окрашивании HID-AB, но преимущественно имела пурпурно-красный цвет при окрашивании AB-PAS (рис. 2B). Результаты окрашивания показали, что HZJD может ингибировать прогрессирование атипичной гиперплазии.
Чтобы определить, может ли HZJD влиять на жизнеспособность клеток, был использован анализ CCK-8 для оценки влияния HZJD на клетки MC. Клетки обрабатывали в разное время курсами по 24 ч, 48 ч и 72 ч. Результаты анализа CCK-8 показали, что достоверной разницы в жизнеспособности клеток между группами через 24 ч не наблюдалось (p > 0,05). Через 48 ч жизнеспособность МЦ-клеток была значительно увеличена, по сравнению с GES-1 (p < 0,0001). Отвар HZJD подавлял жизнеспособность клеток (p < 0,0001). Несмотря на то, что клетки в положительной группе препарата показали более низкую жизнеспособность клеток по сравнению с МК, это снижение не было статистически значимым (p = 0,1681). Результаты анализа CCK-8 показали, что лечение HZJD ингибирует жизнеспособность МЦ в зависимости от времени (Рисунок 2D). Оценка пролиферации клеток с помощью анализа EdU дала результаты, согласующиеся с результатами анализа CCK-8. Примечательно, что пролиферация клеток МС была значительно выше по сравнению с клетками GES-1 (p < 0,0001). В группе HZJD соотношение EdU было явно снижено по сравнению с MC-клетками (p < 0,001). Вышеуказанные результаты показали, что HZJD оказывает ингибирующее действие на пролиферацию клеток МЦ (рис. 2C,E).
Отвар HZJD способствует развитию митофагии у крыс PLGC и клеток МС
Чтобы изучить участие митофагии в PLGC, мы обнаружили уровни экспрессии молекул, связанных с митофагией, включая Parkin, Tomm20, P62 и LC3 II/I. In vivo уровни экспрессии белков паркина и LC3 II/I были явно снижены у модельных крыс по сравнению с контрольной группой. Лечение отваром HZJD приводило к заметному повышению уровня белка Parkin и LC3 II/I. Уровни экспрессии белков Tomm20 и P62 у модельных крыс были заметно повышены по сравнению с контрольной группой, в то время как лечение HZJD значительно ингибировало уровни Tomm20 и P62 (рис. 3A, C). В то же время уровни экспрессии белков Parkin, Tomm20, P62 и LC3 II/I были обнаружены in vitro. Результаты показали, что уровни экспрессии белков Parkin и LC3 II/I были значительно снижены в клетках MC по сравнению с GES-1. Очевидно, что HZJD может увеличивать уровни экспрессии белков Parkin и LC3 II/I. MC клетки показали повышенную экспрессию белков Tomm20 и P62, в то время как лечение HZJD снижало избыточную экспрессию (рис. 4A, C).
Уровни мРНК Parkin, Tomm20, P62 и LC3 II/I также исследовали с помощью ОТ-кПЦР как in vivo , так и in vitro. Результаты показали, что уровни экспрессии мРНК паркина и LC3 II/I были значительно снижены у модельных крыс и клеток MC, в то время как уровни экспрессии Tomm20 и P62 были значительно повышены по сравнению с клетками GES-1 и контрольными крысами. Ткани и клетки желудка, получавшие HZJD, показали повышение регуляции Parkin и LC3 II/I, в то время как снижение регуляции Tomm20 и P62 (рис. 3B, рис. 4B). Еще одним заслуживающим внимания результатом эксперимента на животных было то, что лечение положительным препаратом обратило вспять изменения уровней мРНК Parkin, LC3 II/I и Tomm20 у модельных крыс, но этот регуляторный эффект не достиг статистической значимости (p > 0,05; Рисунок 3В). Эти результаты свидетельствуют о том, что положительный препарат значительно менее эффективен, чем HZJD.
Кроме того, иммунофлуоресцентный анализ показал, что сигналы ЦОГ IV и LC3 у модельных крыс были снижены по сравнению с контрольными крысами. HZJD заметно повышал уровни экспрессии ЦОГ IV и LC3 (рис. 3D,E), что позволяет предположить, что HZJD может способствовать митофагии в тканях желудка крыс PLGC. Для дальнейшей валидации влияния HZJD на митофагию в МЦ-клетках мы изучили флуоресцентную интенсивность митофагии путем окрашивания как митохондриальных фагосом, так и лизосом. Когда митохондриальные фагосомы и лизосомы сливались, интенсивность флуоресценции (красная) изменялась от слабой флуоресценции к сильной флуоресценции. Полученные данные показали, что в клетках МС наблюдалась слабая интенсивность, но сигнал был значительно усилен в клетках, обработанных HZJD (рис. 4D, E), что указывает на то, что HZJD может активировать митофагию, ингибированную MNNG, в клетках МС.
Отвар HZJD регулирует путь Sirt3/Foxo3a/Parkin у крыс PLGC и клеток MC
Хорошо известно, что путь Sirt3/Foxo3a/Parkin играет важную роль в активации митофагического пути23. Таким образом, мы изучили, может ли HZJD регулировать путь Sirt3/Foxo3a/Parkin в PLGC. Sirt3, Foxo3a и Parkin были в основном локализованы в цитоплазме. Результаты иммуногистохимии показали, что уровни экспрессии Sirt3, Foxo3a и Parkin были значительно снижены у модельных крыс по сравнению с контрольными крысами. HZJD продемонстрировал значительно превосходящий эффект по сравнению с положительным препаратом в повышении уровней экспрессии Sirt3, Foxo3a и Parkin (рис. 5A, B). Затем были определены уровни экспрессии белка и мРНК Sirt3 и Foxo3a как in vivo, так и in vitro. Результаты вестерн-блоттинга показали, что Sirt3 и Foxo3a были слабо экспрессированы в клетках PLGC крыс и MC, в то время как повышенные уровни экспрессии указанных молекул наблюдались в контрольных крысах и клетках GES-1. Мы также обнаружили, что HZJD может увеличивать уровни экспрессии Sirt3 и Foxo3a по сравнению с модельной группой (рис. 5C, E, F). Результаты ОТ-кПЦР показали, что уровни мРНК Sirt3 и Foxo3a были снижены у крыс PLGC и клеток MC по сравнению с контрольными крысами и клетками GES-1. После введения HZJD мы отметили очевидную тенденцию к росту (Рисунок 5D, G). Эти результаты свидетельствуют о том, что HZJD может способствовать митофагии как in vivo, так и in vitro, возможно, в некоторой степени вмешиваясь в путь Sirt3/Foxo3a/Parkin.
HZJD способствует митофагии путем активации пути Sirt3/Foxo3a/Parkin в клетках МК
Для дальнейшего выяснения возможного механизма HZJD в запуске митофагии MC-клетки трансфицировали si-sirt3. Как показано на рисунке 6, уровни экспрессии белков Sirt3 и Foxo3a в группе si-Sirt3 были значительно снижены по сравнению с таковыми в группе si-NC. Затем были обнаружены уровни экспрессии белков молекул Parkin, Tomm20, P62 и LC3 II/I, связанных с митофагией. В отличие от группы MC, уровни экспрессии Parkin и LC3 II/I были заметно снижены в группе si-Sirt3, в то время как уровни экспрессии белков Tomm20 и P62 были сверхэкспрессированы в группе si-Sirt3. Эти данные показывают, что нокдаун sirt3 может ингибировать митофагию в клетках МС. Также наблюдалось снижение уровней экспрессии Sirt3 и Foxo3a в группе si-Sirt3+HZJD по сравнению с группой HZJD. Между тем, по сравнению с группой HZJD, экспрессия белка Parkin и соотношение LC3 II/I были явно снижены, в то время как уровни экспрессии Tomm20 и P62 также были значительно повышены в группе si-Sirt3+HZJD (рис. 6A, B). Эти данные указывают на то, что si-sirt3 может ослаблять митофагию, вызванную отваром HZJD. Результаты ОТ-кПЦР хорошо согласуются с результатами западного блоттинга (рис. 6C). Кроме того, мы также наблюдали ультраструктуру МЦ-клеток с помощью просвечивающей электронной микроскопии. Результаты показали, что митохондриальные структуры клеток GES-1 были в основном нормальными без явных повреждений митохондрий. Кроме того, наблюдалось увеличение митохондрий в клетках МЦ и исчезновение митохондриальных кристов, что указывает на снижение митофагии в клетках МЦ. В группе si-Sirt3 наблюдалось увеличение митохондриальных мембран, а степень митохондриального разрушения была увеличена по сравнению с группой si-NC. Мы также наблюдали накопление аутофагических везикул в группе HZJD по сравнению с группой si-Sirt3+HZJD (рис. 6D). Все эти результаты еще раз подтверждают, что отвар HZJD индуцирует митофагию, регулируя путь Sirt3/Foxo3a/Parkin.

Рисунок 1: MNNG индуцирует морфологические и патологические изменения в животных моделях и клетках GES-1. (A) Патологоанатомические наблюдения модельной группы на12-й,16-й,20-й и24-й неделях (окрашивание H&E, 100-кратное увеличение). (Б) Морфология слизистой оболочки желудка на24-й неделе в контрольной и модельной группах (n=6). (C) Морфология клеток в группе GES-1 и группе MC (n=3). Сокращения: 12 Вт = 12 неделя, 16 Вт = 16 неделя, 20 Вт = 20 неделя, 24 Вт = 24 неделя. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Отвар HZJD улучшает гистопатологию слизистой оболочки желудка и ингибирует пролиферацию клеток МС. (A) Репрезентативные патологические изображения тканей желудка в каждой группе (окрашивание H&E, 100-кратное увеличение; n=6). (B) Репрезентативные изображения тканей желудка в каждой группе (окрашивание HID/AB и окрашивание AB/PAS, 100-кратное увеличение, n=6). (C) Уровни пролиферации клеток в каждой группе проверяются с помощью анализа EdU (n=6). (D) Уровни жизнеспособности клеток в каждой группе, проверенные с помощью анализа CCK-8 (n=6). (E) Количественный анализ пролиферации клеток. *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Отвар HZJD улучшает митофагию у крыс PLGC. (A) Сводка данных об относительных уровнях экспрессии белка Parkin после нормализации к GAPDH, а также LC3 II/I, P62 и Tomm20 после нормализации к β-актину (n=3). (B) Сводка данных по уровням экспрессии мРНК Parkin, LC3, P62 и Tomm20 (n=9). (C) Уровни экспрессии белков Parkin, LC3 II/I, P62 и Tomm20 (n=3). (Д, Д) Анализ флуоресцентной кололокализации ЦОГ IV и LC3 (n=6). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
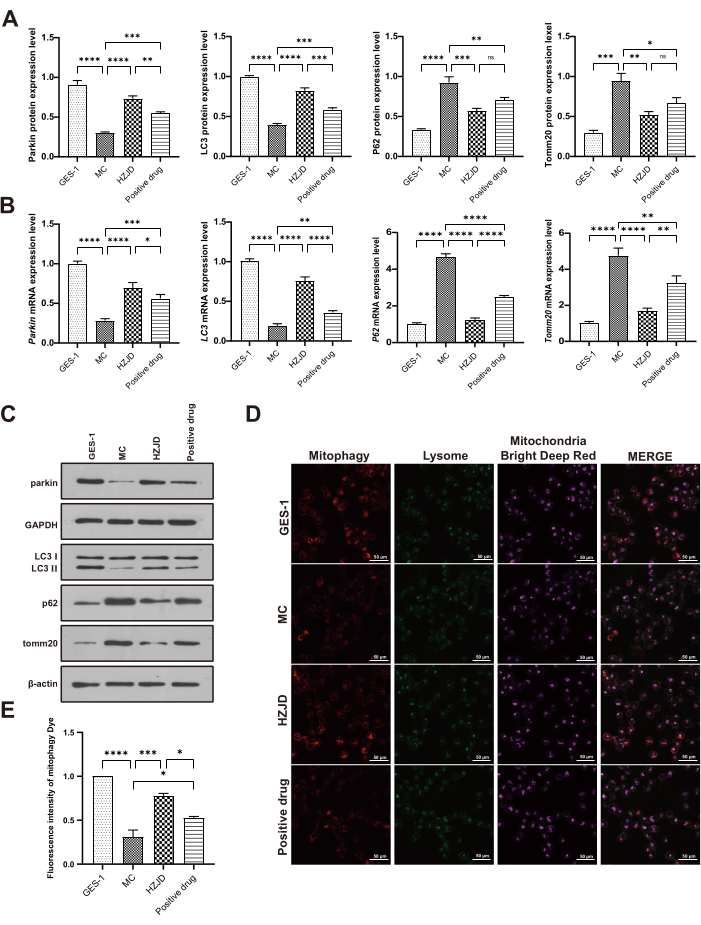
Рисунок 4: Отвар HZJD улучшает митофагию в клетках MC. (A) Сводка данных об относительных уровнях экспрессии белка Parkin после нормализации к GAPDH, а также LC3 II/I, P62 и Tomm20 после нормализации к β-актину (n=3). (B) Сводка данных по уровням экспрессии мРНК Parkin, LC3 II/I, P62, Tomm20 (n=9). (C) Уровни экспрессии белков Parkin, LC3 II/I, P62 и Tomm20 (n=3). (Д, Д) Репрезентативные конфокальные изображения клеточной митофагии в каждой группе (n=3). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Отвар HZJD регулирует путь Sirt3/Foxo3a/Parkin как in vivo , так и in vitro. (А, Б) Репрезентативные иммуногистохимические изображения Sirt3, Foxo3a и Parkin в тканях желудка в каждой группе (n=6). (С, Е) Уровни экспрессии белков Sirt3 и Foxo3a in vivo (n=3). (D) Уровни экспрессии мРНК Sirt3 и Foxo3ain vivo (n=9). (F) Уровни экспрессии белков Sirt3 и Foxo3a in vitro (n=3). (G) Уровни экспрессии мРНК Sirt3 и Foxo3ain vitro (n=9). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: si-sirt3 обращает действие отвара HZJD на модель клеток PLGC. (А, Б) Уровни экспрессии белков Sirt3, Foxo3a, Parkin, LC3 II/I, P62 и Tomm20 в каждой группе in vitro (n=3). (C) Уровни экспрессии мРНК Sirt3, Foxo3a, Parkin, LC3, P62 и Tomm20 в каждой группе in vitro (n=9). (D) Репрезентативные ПЭМ-изображения ультраструктуры клеток в каждой группе. Красные стрелки представляют митохондрии. Желтыми стрелками обозначены аутофагические вакуоли (n=3). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. Здесь si-NC представляет отрицательную контрольную группу, si-Sirt3 представляет группу подавления Sirt3, si-Sirt3+HZJD представляет собой группу подавления Sirt3 в сочетании с группой отвара HZJD (si-Sirt3+HZJD). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Китайское название | Латинское название | Пропорция |
| Иньчэнь | Полынь капиллярная Тунб. | 11% |
| Байхуашешецао | Hedyotis diffusa Willd. | 11% |
| Банлаген | Isatis tinctoria Линнея. | 11% |
| Банбянльский | Lobelia chinensis Хмурость. | 11% |
| Баньжилян | Scutellaria barbata D. Don. | 11% |
| Цзяогулань | Gynostemma pentaphyllum (Thunb.) Макино. | 11% |
| Хуанцинь | Шлемник байкальский (Scutellaria baicalensis) Георгий. | 8% |
| Хуанлянь | Coptis chinensis Franch. | 8% |
| Кушен | Sophora flavescens Alt. | 7% |
| Гуанхуосян | Pogostemon cablin (Blanco) Benth. | 6% |
| Пейлань | Eupatorium fortunei Turcz. | 6% |
Таблица 1: Состав препарата и пропорция, содержащиеся в отваре HZJD.
| Гены | Грунтовка Forwad (5'-3') | Обратная грунтовка (5'-3') |
| Сирт3 | GGCGGCAGGGACGATTATTA | AAGGGCTTGGGGTTGAAA |
| Фоксо3а | AAGGGAGGAGGAGGAATGTGGAA | GGTTGTGCCGGATGGAGTT |
| Паркин | AGGATTACCCAGGAGACCGC | ATCATGGTCACTGGGTAGGTG |
| П62 | ТГАГАГАКАААГККААГГАГГ | CTGGTCCCATTCCAGTCGTC |
| ЛК3 | CAGCGTCTCCACCAATCT | GCGGGTTTTGTGAACCTGAA |
| Томм20 | ATGAGCTGGGTGTCACTTGG | GTGCATTCTTCTGGCAGGGA |
| β-актин | CCGTTGCCCTGAGGCTTT | CCTTCTGCATCCTGTCAGCAA |
Таблица 2: Последовательности праймеров, используемые в анализе ОТ-кПЦР.
Обсуждение
PLGC служит ключевым процессом в прогрессировании от хронического гастрита к ГК. В последние годы было доказано, что ТКМ является многообещающим методом лечения и вмешательства для PLGC24,25. В последние годы ТКМ стала многообещающим подходом к лечению и вмешательству в PLGC. Это согласуется с предыдущими исследованиями10. Результаты патологоанатомического обследования показали, что отвар HZJD явно ослабляет патологическое поражение у крыс PLGC. Более того, результаты клеточных экспериментов также показали, что отвар HZJD оказывает лечебное воздействие на клетки. Результаты анализа CCK-8 согласуются с результатами анализа EdU, что указывает на то, что отвар HZJD может подавлять пролиферацию клеток МС. Эти результаты подтверждают, что отвар HZJD может задерживать прогрессирование PLGC как in vivo, так и in vitro.
Митофагия тесно связана с желудочно-кишечными расстройствами и опухолями желудка. Zhang et al. продемонстрировали, что активация митофагии может восстановить функцию митохондрий, тем самым способствуя сокращению гладких мышц желудка при функциональной диспепсии26. Сообщалось, что дефицит митофагии может способствовать агрессивности ГК за счет накопления аберрантных митохондриальных АФК27. Это согласуется с текущими результатами. В клеточных экспериментах результаты обнаружения митофагии показали, что клетки МС демонстрируют более низкий уровень митофагии по сравнению с клетками GES-1. Отвар HZJD может подавлять чрезмерную пролиферацию клеток, способствуя митофагии. Аналогичным образом, мы также наблюдали снижение уровня митофагии у крыс PLGC. Цитохром с оксидаза IV (ЦОГ IV) — белок, расположенный во внутренней мембране митохондрий и часто используемый в качестве маркера для идентификации и локализации митохондрий28. Легкая цепь 3 (LC3), ассоциированный с микротрубочками, была использована в качестве маркера для мечения аутофагосом29. Иммунофлуоресцентный анализ выявил достоверное снижение степени колокализации ЦОГ IV и LC3 в тканях желудка крыс PLGC. Однако после лечения HZJD наблюдалось увеличение колокализации. Эти результаты свидетельствуют о том, что HZJD играет роль в облегчении прогрессирования PLGC путем регуляции митофагии.
Sirt3 широко признан в качестве митохондриально-локализованного супрессора опухолей. Было обнаружено, что Sirt3 участвует в прогрессировании доброкачественных поражений в ГК. При прогрессировании от хронического гастрита к ИМ и, в конечном счете, к ГК уровень экспрессии Sirt3 постепенно снижается. Эти изменения в экспрессии Sirt3 начинаются на стадии ИМ и становятся более выраженными по мере прогрессирования заболевания до GC30. Sirt3 активирует Foxo3a путем модификации деацетилирования для дальнейшей инициации каскада митофагии. Foxo3a не только напрямую связывается с Паркином, но и синергетически действует с Паркином, активируя митофагию. Гиперэкспрессия Foxo3a и Parkin может заметно ингибировать пролиферацию GC-клеток31. Во время митофагии, вызванной паркинами, поврежденные митохондрии приводят к потере потенциала митохондриальной мембраны. Впоследствии паркин рекрутируется в митохондрии и активируется. Паркин убиквитинирует белки митохондриальной внешней мембраны, а затем P62 помечает измененные белки внешней мембраны митохондрий. LC3 может специфически связываться с P62, индуцируя митофагию и способствуя деградации дисфункциональных митохондрий32. Tomm20 является маркером митохондриальной мембраны, который точно отражает митохондриальную массу33. При активации митофагии уровни Tomm20 и P62 снижаются34, в то время как уровень экспрессии Parkin повышается вместе с увеличением соотношения LC3II/I32,35. Вышеуказанные результаты исследования согласуются с этими наблюдениями и выводами. Результаты иммуногистохимии показали, что уровень Sirt3 снижался, а экспрессия Foxo3a и Parkin одновременно снижалась в модельной группе. Кроме того, отвар HZJD может обратить вспять нисходящую тенденцию оси Sirt3/Foxo3a/Parkin в модельной группе. Мы также обнаружили, что уровни мРНК и белков Sirt3, Foxo3a, Parkin и LC3 в модельной группе были значительно ниже, чем в контрольной группе. Отвар HZJD может обратить вспять эту тенденцию к снижению. Кроме того, отвар HZJD значительно подавлял сверхэкспрессию Tomm20 и P62.
Для оценки участия Sirt3 в регуляторных эффектах HZJD на митофагию мы провели эксперименты по трансфекции si-Sirt3 в клетках МС. Как и ожидалось, нокдаун Sirt3 привел к значительному снижению уровней Foxo3a и Parkin. В то же время, митофагия была ограничена, что указывает на то, что Sirt3 играет роль в опосредовании регуляторных эффектов HZJD на митофагию. Результаты показали, что отвар HZJD может активировать митофагию и повышать регуляцию сигнального пути Sirt3/Foxo3a/Parkin. Тем не менее, было замечено, что положительный эффект HZJD влиял при блокировании Sirt3. Эти данные свидетельствуют о том, что отвар HZJD улучшает митофагию, регулируя путь Sirt3/Foxo3a/Parkin. Наше исследование показывает, что HZJD улучшает PLGC за счет усиления митофагии и регуляции пути Sirt3/Foxo3a/Parkin.
Для определения влияния отвара HZJD на PLGC была построена животная модель PLGC у крыс. Для моделирования процесса предракового поражения, напоминающего естественное патологическое прогрессирование, мы использовали MNNG для моделирования потребления нитритов и нестероидные противовоспалительные препараты для моделирования хронического воспаления. Кроме того, была внедрена нерегулярная диета для дальнейшей имитации условий, способствующих развитию предраковых поражений. По сравнению с другими методами моделирования, такими как MNNG в сочетании с этанолом или дезоксихолатом натрия, эти методы моделирования могут сократить период моделирования и свести к минимуму случайную смерть крыс. Чтобы максимально последовать естественному развитию PLGC и свести к минимуму чрезмерную стимуляцию, мы решили предоставить крысам свободный доступ к MNNG для питья. Стоит отметить, что МННГ необходимо защищать от света и заменять ежедневно, чтобы избежать потери МННГ при неподходящих температурных и световых условиях. Однако у этого метода моделирования есть определенные недостатки, которые необходимо признать. Введение 1-дневного периода голодания может эффективно стимулировать слизистую оболочку желудка у крыс. Тем не менее, важно учитывать, что голодание может повлиять на потребление воды, что потенциально может привести к снижению потребления МННГ крысами. В дальнейшем мы будем дополнительно исследовать время голодания, чтобы достичь наиболее оптимальных результатов. Кроме того, мы построим клетки MC в качестве модели клетки. Чтобы индуцировать эти клетки, мы будем использовать долгосрочное введение MNNG в клетках GES-1 в низкой концентрации. Такой подход помогает предотвратить быстрое восстановление клеток, которое может произойти при резком прекращении индукции, обеспечивая более стабильный и устойчивый клеточный ответ для экспериментов. Предыдущие исследования подтвердили, что даже после 4-недельного прекращения введения МННГ клетки МЦ все еще сохраняют состояние злокачественнойтрансформации. Этот метод моделирования обеспечивает хорошую экспериментальную модель для изучения PLGC.
В этом исследовании терапевтический эффект отвара HZJD был дополнительно подтвержден окрашиванием H&E, иммуногистохимией и другими различными молекулярно-биологическими методами. Этот всеобъемлющий протокол служит ценным справочным материалом для разработки препаратов для лечения PLGC. Наши текущие результаты подтвердили, что отвар HZJD проявляет терапевтический эффект PLGC путем активации митофагии. Путь Sirt3/Foxo3a/Parkin был идентифицирован как потенциальный молекулярный механизм, лежащий в основе активации митофагии отваром HZJD. Это исследование может предоставить новую информацию и идеи для лечения PLGC. Тем не менее, некоторые ограничения в исследовании все же имелись. Хотя мы подтвердили, что отвар HZJD опосредует митофагию через ось Sirt3/Foxo3a/Parkin, нельзя исключать участие других путей митофагии и потенциальных клеточных событий. В будущих исследованиях крайне важно еще больше усовершенствовать и усовершенствовать этот протокол, чтобы выяснить активные вещества, присутствующие в отваре HZJD, и разгадать его точный механизм действия.
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Этот проект был профинансирован Фондом естественных наук провинции Хэбэй в Китае (H2020423207).
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Methyl-3-nitro-1-nitrosoguanidine | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | R030453 | |
| 3,3’-diaminobenzidine | Beijing Zhong Shan-Golden Bridge Biological Technology Co., Ltd., Beijing, CHN | ZLI0919 | |
| Alcian blue periodic acid schiff staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G1285 | |
| Anti-fade fluorescence mounting medium | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | S2110 | |
| Bicinchoninic acid protein concentration determination kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G2026-1000T | |
| CCK-8 reagent kit | Boster Biological Engineering co., Ltd., Wuhan, CHN | AR1160 | |
| Confocal fluorescence microscopy | Leica Instruments Co., Ltd., Weztlar, GER | TCS-SP8SR | |
COX  antibody antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab202554 | |
| DAPI staining solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | C0065 | |
| DEPC | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3004 | |
| EdU cell proliferation kit | Beyotime Biotechnology Co., Ltd., Shanghai, CHN | C0071S | |
| Electrophoresis solution | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0139 | |
| Ethanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 64-17-5 | |
| FBS | Gibco Corporation, Gaithersburg, USA | 16000044 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| Foxo3a antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 23683 | |
| GAPDH antibody | Wuhan Sanying Biology Technology Co., Ltd., Wuhan, CHN | 10494-1-AP | |
| Gel preparation kit | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0138 | |
| GES-1 cell | Procell Life Science&Technology Co., Ltd., Wuhan, CHN | CL-0563 | |
| Goat-anti-mouse IgG | CST Biological Reagents Co., Ltd., Shanghai, CHN | 4409 | |
| Goat-anti-rabbit IgG | Abcam Trading Co., Ltd., Shanghai, CHN | ab150077 | |
| Hematoxylin-eosin staining solution | Zhuhai Beso Biotechnology Co., Ltd., Shenzhen, CHN | BA4027 | |
| High iron diamine/alcian blue staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G2070 | |
| ImageJ | National Institutes of Health, Bethesda, USA | ||
| Image-Pro Plus 6.0 software | Media Cybernetics Inc., Maryland, USA | ||
| Isopropanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 67-63-0 | |
| LC3 antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 83506 | |
| Loading buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0198 | |
| Microplate reader | Rayto Life and Analytical Sciences Co., Ltd., Shenzhen, CHN | RT6100 | |
| Microtome | Leica Instruments Co., Ltd., Weztlar, GER | RM2245 | |
| Mitophagy kit | Dojindo Laboratories, Kyushu Island, JPN | MD01-10 | |
| Neutral balsam | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | WG10004160 | |
| Optical microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| P62 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab91526 | |
| Paraformaldehyde | Biosharp Life Sciences, Anhui, CHN | BL539A | |
| Parkin antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 32833 | |
| Penicillin–streptomycin | Gibco Corporation, Gaithersburg, USA | 15140122 | |
| phosphate-buffered saline | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0002-15 | |
| PVDF membrane | Millipore Corporation, Michigan, USA | IPVH00010 | |
| Redzol | SBS Genetech Co., Ltd., Beijing, CHN | FTR-50 | |
| Reverse transcription reagent kit | Igene Biotechnology Co., Ltd., Guangzhou, CHN | QP057 | |
| RIPA Buffer solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | R002 | |
| Roswell Park Memorial Institute | Gibco Corporation, Gaithersburg, USA | 11875093 | |
| Silicone needle | Zhongke Life Biotechnology Co., Ltd., Beijing, CHN | TFEP-2 | |
| siRNA | Wuhan Genecreate Biological Engineering Co., Ltd. ,Wuhan,CHN | ||
| Sirt3 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 189860 | |
| Sodium salicylate | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, CHN | S104176 | |
| Sprague-Dawley rat | Beijing Huafukang Biotechnology Co., Ltd., Beijing, CHN | 110322210102553975 | |
| SYBR quantitative PCR kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3320-15 | |
| Tomm20 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab186735 | |
| Transferring buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0141 | |
| Trichloromethane | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | 821112 | |
| Tris-buffered saline with Tween 20 | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0004 | |
| VDAC1 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab15895 | |
| Xylene | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 1330-20-7 | |
| β-actin antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab8226 |
Ссылки
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- He, J., et al. Helicobacter pylori infection induces stem cell-like properties in Correa cascade of gastric cancer. Cancer Letters. 542, 215764 (2022).
- Xu, W., Li, B., Xu, M., Yang, T., Hao, X. Traditional Chinese medicine for precancerous lesions of gastric cancer: A review. Biomedicine & Pharmacotherapy. 146, 112542 (2022).
- Yang, L., et al. A Systematic Review of the Mechanisms Underlying Treatment of Gastric Precancerous Lesions by Traditional Chinese Medicine. Evidence-Based Complementary and Alternative Medicine. 2020, 9154738 (2020).
- Ping, Z., Yan, W., Jing, L., Qian, J., Xin, H. The Effect of Huazhuo Jiedu recipe on Epithelial -Mesenchymal-Transition in Chronic Erosive Gastritis Patients with Zhuoduneiyun syndrome. Pharmacology and Clinics of Chinese Materia Medica. 35 (6), 154-158 (2019).
- Yan, W., Jing, L., Pan, Z. The effect of Huazhuojiedu formula on HGF/c-Met signal pathway in patients with chronic erosive gastritis. Pharmacology and Clinics of Chinese Materia Medica. 33 (02), 186-189 (2017).
- Hao, X., et al. Integrating Network Pharmacology and Experimental Validation to Investigate the Mechanisms of Huazhuojiedu Decoction to Treat Chronic Atrophic Gastritis. Evidence-Based Complementary and Alternative Medicine. 2020, 2638362 (2020).
- Zhou, P., et al. 16S rRNA sequencing-based evaluation of the protective effects of Hua-Zhuo-Jie-Du on rats with chronic atrophic gastritis. BMC Complementary Medicine and Therapies. 22 (1), 71 (2022).
- Zhou, P., et al. Determination of the protective effects of Hua-Zhuo-Jie-Du in chronic atrophic gastritis by regulating intestinal microbiota and metabolites: combination of liquid chromatograph mass spectrometer metabolic profiling and 16S rRNA gene sequencing. Chinese Medicine. 16 (1), 37 (2021).
- Hao, X., Zhou, P., Yang, Z., Yang, T., Wang, Y. The therapeutic effect of Huazhuojiedu decoction on precancerous lesions in a gastric cancer model via the regulation of lnc 517368. Journal of Ethnopharmacology. 283, 114635 (2022).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Zhang, C., et al. Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16259-16264 (2011).
- Cai, T., et al. Protective effects of Weipixiao decoction against MNNG-induced gastric precancerous lesions in rats. Biomedicine & Pharmacotherapy. 120, 109427 (2019).
- Shah, S. C., Piazuelo, M. B., Kuipers, E. J., Li, D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 161 (4), 1325-1332 (2021).
- Pimentel-Nunes, P., et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 51 (4), 365-388 (2019).
- Nagtegaal, I. D., et al. The 2019 WHO classification of tumours of the digestive system. Histopathology. 76 (2), 182-188 (2020).
- Kushima, R. The updated WHO classification of digestive system tumours-gastric adenocarcinoma and dysplasia. Der Pathologe. 43 (1), 8-15 (2022).
- Yang, P., et al. Weipiling decoction alleviates N-methyl-N-nitro-N'-nitrosoguanidine-induced gastric precancerous lesions via NF-κB signalling pathway inhibition. Chinese Medicine. 17 (1), 104 (2022).
- Xu, J., et al. Xiao Tan He Wei Decoction reverses MNNG-induced precancerous lesions of gastric carcinoma in vivo and vitro: Regulation of apoptosis through NF-κB pathway. Biomedicine & Pharmacotherapy. 108, 95-102 (2018).
- Li, S. Study on the mechanism of regulating NF-kB activity and inhibiting the migration of gastric "inflammation-cancer" transformed cells by invigorating spleen, removing blood stasis and detoxifying. Guangzhou University of Chinese Medicine. , 17-19 (2021).
- Liu, H. Research Progress of Cell Models of Gastric Cancer Precancerous Lesions. Traditional Chinese Drug Research and Clinical Pharmacology. 27 (4), 592-596 (2016).
- Zheng, J., et al. Chronic stress accelerates the process of gastric precancerous lesions in rats. Journal of Cancer. 12 (14), 4121-4133 (2021).
- Yu, W., et al. Sirt3 deficiency exacerbates diabetic cardiac dysfunction: Role of Foxo3A-Parkin-mediated mitophagy. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (8), 1973-1983 (2017).
- Cao, Y., et al. Efficacy of Banxia Xiexin decoction for chronic atrophic gastritis: A systematic review and meta-analysis. PLoS One. 15 (10), e0241202 (2020).
- Yin, J., et al. Weiqi Decoction Attenuated Chronic Atrophic Gastritis with Precancerous Lesion through Regulating Microcirculation Disturbance and HIF-1α Signaling Pathway. Evidence-Based Complementary and Alternative Medicine. 2019, 2651037 (2019).
- Zhang, J., Wang, X., Wang, F., Tang, X. Xiangsha Liujunzi Decoction improves gastrointestinal motility in functional dyspepsia with spleen deficiency syndrome by restoring mitochondrial quality control homeostasis. Phytomedicine. 105, 154374 (2022).
- Shida, M., et al. Impaired mitophagy activates mtROS/HIF-1α interplay and increases cancer aggressiveness in gastric cancer cells under hypoxia. International Journal of Oncology. 48 (4), 1379-1390 (2016).
- Zhou, X. Y., et al. Inhibition of autophagy blocks cathepsins-tBid-mitochondrial apoptotic signaling pathway via stabilization of lysosomal membrane in ischemic astrocytes. Cell Death & Disease. 8 (2), e2618 (2017).
- He, R., Peng, J., Yuan, P., Xu, F., Wei, W. Divergent roles of BECN1 in LC3 lipidation and autophagosomal function. Autophagy. 11 (5), 740-747 (2015).
- Fernández-Coto, D. L., et al. Quantitative proteomics reveals proteins involved in the progression from non-cancerous lesions to gastric cancer. Journal of Proteomics. 186, 15-27 (2018).
- Ding, D., et al. Post-translational modification of Parkin and its research progress in cancer. Cancer Communications. 39 (1), 77 (2019).
- Wang, Y., et al. The Role of Mitochondrial Dynamics and Mitophagy in Carcinogenesis, Metastasis and Therapy. Frontiers in Cell and Developmental Biology. 8, 413 (2020).
- Gehrke, S., et al. PINK1 and Parkin control localized translation of respiratory chain component mRNAs on mitochondria outer membrane. Cell Metabolism. 21 (1), 95-108 (2015).
- Fu, Z. J., et al. HIF-1α-BNIP3-mediated mitophagy in tubular cells protects against renal ischemia/reperfusion injury. Redox Biology. 36, 101671 (2020).
- Jia, Q., et al. Hesperidin promotes gastric motility in rats with functional dyspepsia by regulating Drp1-mediated ICC mitophagy. Frontiers in Pharmacology. 13, 945624 (2022).
- Chen, Y. The N-alkylamides induces MGMT gene hypomethylation in gastric epithelium cells malignant transformation. Zhejiang University. , 33-35 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены