Method Article
השפעות טיפוליות של מרתח Huazhuojiedu על נגעים טרום סרטניים של סרטן הקיבה על ידי ויסות מיטופגיה
In This Article
Summary
כאן, אנו מציגים פרוטוקול המדגים את היעילות הטיפולית של מרתח Huazhuojiedu (HZJD) בהקלה על נגעים טרום סרטניים של סרטן הקיבה באמצעות ויסות מיטופגיה.
Abstract
מחקר זה נועד לחקור את ההשפעה הטיפולית והמנגנונים הפוטנציאליים של מרתח Huazhuojiedu (HZJD) להקלה על נגעים טרום סרטניים של סרטן הקיבה (PLGC) הן in vivo והן in vitro. HZJD היא פורמולה צמחית סינית מסורתית המורכבת מ-11 צמחי מרפא. חולדות Sprague-Dawley (SD) חולקו באופן אקראי לארבע תת-קבוצות: קבוצת ביקורת, קבוצת מודל, קבוצת תרופות חיוביות וקבוצת HZJD. צביעת המטוקסילין-אאוזין (H&E), צביעה עשירה בברזל דיאמין-כחול אלציאן (HID-AB), צביעת חומצה כחולה אלציאן שיף (AB-PAS), אימונוהיסטוכימיה, אימונופלואורסצנטיות, RT-qPCR ובדיקות כתמים מערביים בוצעו לאחר 10 שבועות של טיפול ב-HZJD. במבחנה, נעשה שימוש במבחני ערכת ספירת התאים 8 (CCK-8) ו-5-ethynyl-2'-deoxyuridine (EdU) לאיתור התפשטות תאים. בדיקות RT-qPCR וכתם מערבי בוצעו כדי להעריך את רמות המיטופיה. התוצאות הצביעו על כך ש-HZJD יכול לעכב את ההתקדמות הפתולוגית בחולדות PLGC ולהפחית את התפשטות תאי PLGC. טיפול ב-HZJD העלה באופן משמעותי את רמות ביטוי ה-mRNA והחלבון של Sirt3, Foxo3a, Parkin ו-LC3 II/I, תוך הפחתת רמות ביטוי ה-mRNA והחלבון של p62 ו-Tomm20. HZJD נמצא כבעל יכולת להפוך את הירידה בפעילות המיטופאגיה הן in vivo והן in vitro. לסיכום, המחקר העריך את ההשפעה של HZJD וסיפק ראיות לגבי המנגנון המולקולרי הפוטנציאלי שלו.
Introduction
סרטן הקיבה (GC) נותר אחת המחלות הממאירות השכיחות ביותר הפוגעות במערכת העיכול ברחבי העולם. ההערכה היא כי GC מהווה כ-6% מכלל מקרי הסרטן ברחבי העולם, ומדורגבמקום ה-5 בין סוגי הסרטן המאובחנים בתדירות הגבוהה ביותרובמקום ה-3 בין מקרי המוות הקשורים לסרטן1. GC מוכר כתהליך ביולוגי מתקדם ורב-שלבי. לפני הופעת GC, רירית הקיבה עוברת לעתים קרובות מספר שנים של נגעים טרום סרטניים, המכונים נגעים טרום סרטניים של סרטן הקיבה (PLGC). תיאוריית מפל Correa מקובלת ומספקת הסבר להתקדמות הרציפה מרירית תקינה לדלקת קיבה כרונית שאינה אטרופית, דלקת קיבה אטרופית, מטפלזיה במעי (IM), דיספלזיה (Dys), ובסופו של דבר קרצינומה2. PLGC מייצג שלב מכריע בפיתוח GC, והתערבות וניטור בזמן של PLGC חיוניים למניעה מוקדמת של GC.
הערכות קליניות אחרונות ומחקרים ניסיוניים אישרו כי הרפואה הסינית המסורתית (TCM) מסתמנת כאחד הטיפולים היעילים ביותר לטיפול ב-PLGC 3,4. מרתח HZJD הוא פורמולה של TCM שפותחה על סמך ניסיון קליני ומושרשת בתיאוריית הרפואה הסינית המסורתית של הסרת חום ורטיבות. מחקרים קודמים הוכיחו את ההשפעות המועילות של מרתח HZJD בטיפול ב- PLGC, במיוחד בהקלה על תסמינים קליניים וביטויים פתולוגיים 5,6. באמצעות מחקרים הקשורים לפרמקולוגיה ברשת, זיהינו את המרכיבים הפעילים של מרתח HZJD כמו גם את היעדים הפוטנציאליים שלהם עבור PLGC7. הממצאים ממחקר קודם הצביעו על כך שלמרתח HZJD יש את היכולת לשפר את הגיוון, לייעל את מבנה הקהילה ולהגדיל את השפע היחסי של פלורת המעיים בחולדות PLGC8. יתר על כן, אומת כי מרתח HZJD יכול לשפר את PLGC על ידי ויסות מיקרוביוטת המעי והמטבוליטים שלה9. בעבודה שנערכה לאחרונה, הראינו כי מרתח HZJD יכול לווסת את האיזון הדינמי של התפשטות תאים ואפופטוזיס בתאי PLGC על ידי ויסות הביטוי של lnc 51736810.
מספר הולך וגדל של מחקרים אישרו כי מיטופגיה ממלאת תפקיד חשוב בסוגי סרטן שונים. מיטוכונדריה מבטלת באופן סלקטיבי מיטוכונדריה פגומה ודפולרית ומונעת עוד יותר הצטברות מוגזמת של מיני חמצן תגובתי ציטוטוקסיים (ROS) מהמיטוכונדריון הלא מתפקד, אשר בתורו מעכב גידול11. מיטופגיה, פירוק סלקטיבי של מיטוכונדריה פגומה או לא מתפקדת, קשור באופן מורכב לזרחון חמצוני מיטוכונדריאלי (OXPHOS). הפגיעה או היעדר מיטופגיה יכולה להוביל לשינוי בחילוף החומרים של האנרגיה התאית לכיוון גליקוליזה אירובית, תופעה הידועה בכינויה אפקט ורבורג. הייצור המוגבר של גופי לקטט וקטון, הנובע מאפקט ורבורג, תורם לבניית מיקרו-סביבה של גידול התורמת לשגשוג תאים12.
מחקר זה מציג פרוטוקול מקיף לשימוש במרתח HZJD כגישה טיפולית להפחתת התקדמות PLGC. באמצעות ההערכה שלנו, ראינו השפעה חיובית משמעותית של מרתח HZJD, במיוחד ביכולתו לווסת מיטופגיה. המחקר מספק תובנות חשובות לגבי המנגנונים המולקולריים הפוטנציאליים של מרתח HZJD בטיפול ב-PLGC.
Protocol
כל הליכי הניסוי והטיפול בבעלי חיים אושרו על ידי הנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת הביי לרפואה סינית מסורתית (מספר אישור: DWLL2019031) ובוצעו בהתאם להנחיות האתיות. בסך הכל 90 חולדות Sprague-Dawley (SD) זכרים נטולי פתוגנים (גיל = 6 שבועות; משקל = 150-180 גרם; ראה טבלת חומרים) גודלו בטמפרטורה קבועה (24 מעלות צלזיוס ±-4 מעלות צלזיוס) ולחות (50%-60%) במחזור חושך/אור מבוקר של 12 שעות. החולדות הסתגלו לסביבה החדשה במשך שבוע לפני תחילת הניסויים.
1. הכנה לניסויים בבעלי חיים
- דגם חולדה של PLGC
- הקצה את החולדות באופן אקראי לקבוצת ביקורת (n=20) ולקבוצת מודל PLGC (n=70). ספקו לחולדות בקבוצת הביקורת תזונה סטנדרטית של כדורי מכרסמים ומים אד ליביטום. האכילו את החולדות בקבוצת מודל PLGC בתזונה לא סדירה (יום צום אחד, יום האכלה אחד).
- אכסנו את החולדות בקבוצות של חמש בכל כלוב. ספק לקבוצת הביקורת 150 גרם ליום של מזון לכלוב. אפשר לקבוצת דגמי PLGC גישה חופשית למזון למשך 23 שעות (150 גרם ליום לכלוב). לאחר 23 שעות, הסר את שארית ההזנה.
- ספק לחולדות בקבוצת מודל PLGC תמיסת 1-methyl-3-nitro-1-nitrosoguanidine (MNNG) (200 מיקרוגרם/מ"ל) לשתייה חופשית10,13. ספק לחולדות בקבוצת המודל PLGC 200 מ"ל של תמיסת MNNG לכל כלוב. יש להניח את תמיסת ה-MNNG בבקבוקי שתייה אטומים ולהחליף מדי יום.
- גבאז' את החולדות בקבוצת מודל PLGC עם 2% נתרן סליצילאט לאחר 24 שעות של צום (אחת ליומיים על ידי gavage). לצורך גבאז', השתמש במחט סיליקון (ראה טבלת חומרים) עם עומק מינימלי של המחט השווה ל-6 ס"מ. בצע גבאז' באופן עקבי באותה שעה בבוקר בין השעות 8:30 ל-9:30 בבוקר.
- בחר באופן אקראי שתי חולדות מקבוצת מודל PLGC לבדיקה פתולוגית בשבועות 12, 16, 20 ו-24 על מנת להעריך את הקמת מודל PLGC. קחו בחשבון את המודל המוצלח כאשר שתי החולדות מאובחנות עם PLGC על ידי הערכה פתולוגית כמתוארב-9.
- תהליך דוגמנות זה נמשך כ-24 שבועות. אפשר לבצע את ההערכה הפתולוגית באופן עצמאי על ידי שני פתולוגים בכירים. קבע את האבחנה הפתולוגית של PLGC בחולדות באמצעות הערכה משותפת של שני פתולוגים. קחו בחשבון את חוות הדעת האבחנתיות שלהם והשתמשו בהנחיות הקודמות כאסמכתא במהלך תהליך ההערכה 14,15,16,17.
- הכנת מרתח HZJD
- הכן מרתח HZJD לפי השיטה המתוארת ב7.
הערה: צמחי המרפא במרתח HZJD נרכשו ואושרו על ידי בית החולים לרפואה סינית מסורתית בהביי.
- הכן מרתח HZJD לפי השיטה המתוארת ב7.
- קיבוץ והתערבות תרופתית
- חלקו באופן אקראי את קבוצת מודל PLGC לשלוש תת-קבוצות: קבוצת מודל (n=20), קבוצת תרופות חיוביות (n=20) וקבוצת מרתח Huazhuojiedu (HZJD, n=20, טבלה 1).
- החולדות בקבוצת התרופה החיובית עם 0.7 מ"ג/ק"ג/יום של ויטמין B12 על ידי gavage18. טפל בחולדות בקבוצת HZJD עם מרתח HZJD ב-14.81 גרם/ק"ג/יום8. יש לתת את החולדות בקבוצת הביקורת ובקבוצת המודל עם מים מזוקקים (10 מ"ל/ק"ג). כל ארבע הקבוצות מקבלות את המתן התוך-קיבה פעם ביום למשך 10 שבועות.
הערה: המינון היומי המומלץ של מרתח HZJD לבני אדם הוא 142 גרם ליום10. בשיטת חישוב שטח הגוף נקבע כי המינון המומלץ לחולדות הוא פי 6.25 מזה של בני אדם. לכן, המינון היומי של מרתח HZJD לחולדות הוא 14.81 גרם לק"ג. המינון הותאם מדי שבוע בהתאם למשקל החולדות. נפח הגוואג' המרבי לא עלה על 3 מ"ל.
- איסוף דוגמאות
- הקריבו את כל החולדות לאחר 24 שעות של צום (עם גישה חופשית למים) בשבוע 35. להרדים את כל החולדות עם איזופלורן (5% אינדוקציה, 2% לתחזוקה, קצב זרימה של 1 ליטר לדקה).
- לגלח את אזור הבטן ולעקר את העור באתנול ויוד לאחר אישור אובדן גירוי הכאב. חותכים את עור הבטן מסחוס ה- xiphoid לאורך קו האמצע של הבטן בעזרת אזמל.
- בלאנט מפרידים את הרקמה התת עורית בעזרת מלקחיים ואזמל עד לחשיפת הקיבה. מנתחים את הקיבה לאורך העקמומיות הגדולה יותר בעזרת מספריים ושוטפים אותה מיד במי מלח חוצצים פוספט (PBS).
- פרשו את רקמות הקיבה על צלחת קרח. אסוף דגימות קיבה (2 מ"מ על 2 מ"מ) מהאנטרום, הקורפוס והעקמומיות הקטנה יותר של האזור הזוויתי. אם יש נגעים גלויים על הבטן, אספו ועבדו את החלקים הספציפיים הללו כדגימות.
- תקן דגימות קיבה ב-4% פרפורמלדהיד למשך 24 שעות. הנח את רקמות הקיבה הנותרות לתוך קריו-צינורות. מקפיאים אותם בחנקן נוזלי, ואז מאחסנים אותם בטמפרטורה של -80 מעלות צלזיוס.
- המתת חסד של החולדות באמצעות שאיפת פחמן דו חמצני. הניחו פגרי חולדות בשקיות אטומות ולאחר מכן הכניסו שקיות לארון אחסון פגרי בעלי החיים.
2. בדיקה פתולוגית
- חתוך והחליק את רקמות הקיבה הקבועות במספריים. ייבשו רקמות עם סדרת אלכוהול שיפוע, כלומר 75% אתנול למשך 30 דקות, 85% אתנול למשך 30 דקות, 95% אתנול למשך 30 דקות ופי 2 באתנול נטול מים למשך 30 דקות כל אחד. טבלו רקמות בתמיסת קסילן/אתנול (1:1) למשך שעה, ו-2x בתמיסת 100% קסילן למשך 30 דקות כל אחת.
- יוצקים מחצית מהשעווה המותכת לתבנית, ולאחר מכן מכניסים את הרקמות החדירות לתבנית במהירות. מניחים את הרקמות בחצי השני של השעווה המותכת. סמן את הקופסה המוטבעת ואפשר לשעווה להתמצק לחלוטין.
- השתמש במיקרוטום כדי לחתוך לפרוסות בעובי של 4 מיקרומטר. הניחו את הפרוסות על השקופיות.
- מניחים את הפרוסות 2x ב-100% קסילן למשך 10 דקות כל אחת, ואז בתמיסת קסילן/אתנול (1:1) למשך 10 דקות, 2x שוב באתנול נטול מים למשך 5 דקות, ואז ב-95% אתנול למשך 5 דקות, ואחריו 85% אתנול למשך 5 דקות, ולבסוף ב-70% אתנול למשך 5 דקות. שוטפים את הפרוסות במים זורמים.
- מכתימים את הפרוסות בהמטוקסילין למשך 5 דקות. להבדיל על ידי טבילה ב-0.5% חומצה הידרוכלורית-אתנול למשך 10 שניות. מכתימים את הפרוסות באאוזין למשך 2 דקות.
- שוטפים את הפרוסות במים מזוקקים. מייבשים את הפרוסות בסדרת אלכוהול שיפוע, כלומר 70% אתנול למשך 30 שניות, 80% אתנול למשך 30 שניות, 95% אתנול למשך 30 שניות, אתנול נטול מים למשך 30 שניות. מחלחלים את הפרוסות עם 100% קסילן פי 2. אוטמים את הפרוסות בבלסם ניטרלי.
- מערבבים תמיסת HID A ופתרון HID B ביחס של 50:3 להכנת פתרון העבודה HID. מכתימים את הפרוסות בתמיסת העבודה HID למשך 24 שעות.
- שוטפים תחת מים זורמים ואז מכתימים את הפרוסות באלציאן למשך 20 דקות. מכתים את הפרוסות בתמיסה האדומה המהירה הגרעינית למשך 10 דקות. מייבשים ואוטמים את הפרוסות כמתואר בשלב 2.6.
- מכתימים את הפרוסות באלציאן למשך 20 דקות. דוגרים את הפרוסות בתמיסה מימית של 1% של חומצה תקופתית למשך 5 דקות. מכתימים את הפרוסות בשיף למשך 20 דקות.
- דגרו את השקופיות עם המטוקסילין למשך 2 דקות כדי להכתים את הגרעינים. הוסף את תמיסת הבידול החומצית (המסופקת עם ערכת HID) למשך 5 שניות. מרחו את התמיסה הכחולה של סקוט למשך 3 דקות כדי לצבוע את השקופיות בכחול. מייבשים ואוטמים את הפרוסות כמתואר לעיל בשלב 2.6.
הערה: יש להגן על תהליך הצביעה מפני אור. יש לשמור על הטמפרטורה מתחת ל-22 מעלות צלזיוס בעת שימוש בתמיסה מימית של 1% של חומצה תקופתית. יש לייבש את הפרוסות ולאטום אותן כמתואר בשלב 2.6. - בחנו את הפרוסות המוכתמות במיקרוסקופ אופטי בהגדלה של פי 10 ו-20x.
3. אימונוהיסטוכימיה
- השתמש בפרוסות שהתקבלו בשלב 2.4. הכניסו את הפרוסות למאגר נתרן ציטראט 0.01 M וחממו למשך 10 דקות כדי לבצע אחזור אנטיגן.
- הוסף 3% מי חמצן למשך 30 דקות כדי להרוות את הפרוקסידאז והביוטין האנדוגניים. חוסמים את הפרוסות בסרום עיזים למשך 30 דקות.
- דגרו את הפרוסות עם הנוגדנים הראשוניים המדוללים כנגד sirt3 (1:200), foxo3a (1:100) ופרקין (1:200) למשך הלילה ב-4 מעלות צלזיוס. החלף את הנוגדנים העיקריים ב-PBS לבקרה השלילית.
- שוטפים את הפרוסות 3 פעמים למשך 5 דקות לשטיפה עם PBS. דגרו את הפרוסות עם הנוגדן המשני המתאים בטמפרטורת החדר למשך שעה.
- הוסף 20 מיקרוליטר של 3,3'-diaminobenzidine (DAB) למשך 3 דקות. מייבשים ואוטמים את הפרוסות כמתואר לעיל בשלב 2.6.
- צלם את כל הפרוסות בהגדלה של פי 40 תחת המיקרוסקופ האופטי. השתמש בתוכנת Image-Pro Plus 6.0 כדי לבצע ניתוח תמונה כמותי.
4. אימונופלואורסצנציה
- השתמש בפרוסות שהתקבלו בשלב 3.1. חזור על שלב 3.3.
- דגרו את הפרוסות עם הנוגדנים הראשוניים המדוללים כנגד COX IV (1:500), ו-LC3 (1:500) למשך הלילה ב-4 מעלות צלזיוס. שוטפים את הפרוסות 3 פעמים למשך 5 דקות לשטיפה עם PBS.
- דגרו את הפרוסות עם IgG נגד ארנב עז (1:1000) ו-IgG נגד עכבר עז (1:1000) בטמפרטורת החדר למשך 1.5 שעות. שוטפים את הפרוסות 3 פעמים למשך 5 דקות לשטיפה עם PBS.
- הוסף תמיסת מכתים DAPI ודגר בטמפרטורת החדר למשך 10 דקות בחושך. שוטפים את הפרוסות 3 פעמים למשך 5 דקות לשטיפה עם PBS.
- הוסף תמיסת צביעה DAPI טיפתית ודגר בטמפרטורת החדר למשך 10 דקות בחושך. הרכיבו את הפרוסות עם מדיום הרכבה פלואורסצנטי נגד דהייה.
- דמיין וצלם את הפרוסות תחת מיקרוסקופ פלואורסצנטי (ראה טבלת חומרים) בהגדלה של פי 40.
5. ניתוח כתמים מערביים
- שקלו 100 מ"ג רקמות קיבה במדויק. הוסף 1 מ"ל של תמיסת חיץ RIPA (ראה טבלת חומרים). טוחנים היטב את הרקמות באמצעות הומוגנייזר (10,000 x גרם, 15 שניות בכל פעם למשך 3x).
- מניחים את הרקמה הומוגנית על קרח למשך 30 דקות. צנטריפוגה ב-12,000 x גרם למשך 20 דקות ב-4 מעלות צלזיוס, ולאחר מכן אוספים את הסופרנטנט.
- כמת את ריכוז החלבון באמצעות ערכת קביעת ריכוז החלבון של חומצה ביצינצ'ונינית (BCA) (ראה טבלת חומרים). התאם את ריכוז החלבון של הסופרנטנט המתקבל כך שיהיה עקבי בתוך הדגימות.
- הכן ג'ל SDS-PAGE המורכב מג'ל מפריד של 10% וג'ל ערימה של 5%. יוצקים את ג'ל ההפרדה של 10% לצלחת הזכוכית עד 2/3 מהגובה הכולל. מוסיפים מים נטולי יונים מעל הג'ל עד שהג'ל מתמצק. יוצקים את ג'ל הערימה של 5% למילוי צלחת הזכוכית. הכנס את מסרק האלקטרופורזה.
הערה: יש להקפיד על כך שאין בועות בג'ל. - מערבבים את חומר החלבון עם חוצץ העמסה פי 5 ביחס של 1:4. הכניסו אותו למים רותחים למשך 5 דקות לדנטורציה. אחסן אותו בטמפרטורה של -20 מעלות צלזיוס.
- הרכיבו את ג'ל ה-SDS-PAGE המוכן במערכת האלקטרופורזה של Western Blotting. הוסף תמיסת אלקטרופורזה טרייה (ראה טבלת חומרים). טען 20 מיקרוליטר דגימה לכל באר על הג'ל. התחל את האלקטרופורזה ב-80 וולט למשך 40 דקות ולאחר מכן עבור ל-120 וולט.
- אוספים את הג'ל ויוצרים כריך העברה באופן הבא: שתי שכבות של כרית ספוג, שתי שכבות של נייר פילטר, ג'ל, קרום פלואוריד פוליווינילידן (PVDF) (ראה טבלת חומרים), שתי שכבות של נייר פילטר, שתי שכבות של כרית ספוג (מהקוטב השלילי לקוטב החיובי). הוסף מאגר העברה מקורר מראש. בצע העברה רטובה ב-350 mA למשך שעתיים.
הערה: לפני הרכבת כריך ההעברה, יש לטפל מראש בקרום PVDF במתנול. בנוסף, יש לטבול את הספוג, נייר הסינון וממברנת ה-PVDF שטופלה מראש במאגר ההעברה (ראה טבלת חומרים) מראש. - חסמו את הממברנה עם חלב נטול שומן 5% בתמיסת מלח עם טריס עם tween 20 (TBST) למשך שעתיים על שייקר. דגרו את הממברנה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס עם הנוגדנים הראשוניים המדוללים הבאים (Sirt3 = 1:500, Foxo3a = 1:1000, Parkin = 1:2000, P62 = 1:1000, LC3 = 1:1000, Tomm20 = 1:2000, β-actin = 1:5000, GAPDH = 1:5000).
הערה: GAPDH נבחר כהתייחסות לגילוי פרקין בשל המשקל המולקולרי של פרקין (50 kDa) קרוב לזה של β-אקטין (42 kDa). - שוטפים את הממברנה 4 פעמים עם TBST למשך 5 דקות בכל פעם. דגרו אותו עם הנוגדן המשני המדולל (1:5000) בטמפרטורת החדר למשך שעה.
- זרוק את תמיסת העבודה של ECL בצד החלבון של הממברנות למשך 2 דקות. רכוש את התמונות באמצעות מערכת ההדמיה הכימילומינסנציה. השתמש בתוכנת ImageJ כדי למדוד את ערכי גווני האפור.
6. ניתוח PCR כמותי בזמן אמת
- נקו את כל מכשירי הניסוי עם 0.1% דיאתיל פירוקרבונט (DEPC), ולאחר מכן עקרו אותם בטמפרטורה גבוהה ובלחץ גבוה מראש.
- שוקלים 50 מ"ג רקמות קיבה. מוסיפים 1 מ"ל של Redzol (ראה טבלת חומרים) וטוחנים בהומוגנייזר. העבירו רקמה הומוגנית לתוך צינור צנטריפוגה נטול RNase ותנו לו לעמוד בטמפרטורת החדר למשך 10 דקות.
- מוסיפים 0.2 מ"ל טריכלורומתאן ומערבבים היטב. תן לו לעמוד בטמפרטורת החדר למשך 3 דקות. צנטריפוגה בטמפרטורה של 4 מעלות צלזיוס ו-12,000 x גרם למשך 15 דקות.
- הסר את השלב המימי העליון בזהירות וערבב אותו עם 0.5 מ"ל איזופרופנול למשך 10 דקות. צנטריפוגה 12,000 x גרם למשך 10 דקות ב-4 מעלות צלזיוס כדי לזרז RNA. השליכו את הסופרנטנט ולאחר מכן שטפו את משקעי ה-RNA פי 3 עם 75% אתנול.
- צנטריפוגה ב-7,500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. השליכו את הסופרנטנט ולאחר מכן יבשו את משקעי ה-RNA בשולחן עבודה סטרילי למשך 10 דקות. ממיסים את המשקעים ב -50 מיקרוליטר של DEPC.
- תמלול הפוך של 1 מיקרוגרם RNA ל-cDNA. הוסף 1 מיקרוליטר של תערובת RTase 20x, 4 μL של מאגר תגובה 5x RT (ראה טבלת חומרים) וחדש את DEPC לנפח כולל של 20 μL. הגדר את הליך התגובה באופן הבא: 10 דקות ב-25 מעלות צלזיוס, 40 דקות ב-42 מעלות צלזיוס, 10 דקות ב-85 מעלות צלזיוס, ולאחר מכן החזק ב-4 מעלות צלזיוס.
- הכן תערובת תגובת הגברה המכילה 2 מיקרוליטר של cDNA, 2 מיקרוליטר של פריימר קדימה, 2 מיקרוליטר של פריימר הפוך (טבלה 2), 10 מיקרוליטר של 2x SYBR premix (ראה טבלת חומרים), ו-4 מיקרוליטר של DEPC. הגדר את הליך התגובה באופן הבא: 95 מעלות צלזיוס למשך 15 שניות, 60 מעלות צלזיוס למשך 10 שניות ו-72 מעלות צלזיוס למשך 30 שניות (40 מחזורים).
- השתמש β-אקטין כהתייחסות אנדוגנית. השג את ערכי ה-Ct. חשב את הביטוי היחסי של גני המטרה באמצעות שיטת 2-ΔΔCt.
7. הכנה לניסויים בתא
- מודל תא של PLGC
- תרבית תאי GES-1 במכון רוזוול פארק ממוריאל (RPMI) 1640 בינוני בשילוב עם 10% סרום בקר עוברי (FBS) ו-1% פניצילין-סטרפטומיצין. תרבית התאים ב-2 x 105 תאים לבאר בצלחת של 6 בארות המכילה 1.5 מ"ל של מדיום RPMI 1640 ללא סרום ואנטיביוטיקה ב-37 מעלות צלזיוס עם 5% CO2.
- לגרום לתאי GES-1 עם MNNG לטרנספורמציה ממאירה. הגדר את סידור הדוגמנות כמתואר להלן.
- ביום 0, יש לבצע החייאה מוקדמת ולהעביר תאי GES-1 כדי לשמור עליהם בשלב הגידול הלוגריתמי. חסנו את תאי ה-GES-1 בשלב הלוגי בצלוחיות תרבית ותרבו אותם למשך הלילה.
- ביום הראשון וביום השני, החלף את המדיום המכיל MNNG (10 מיקרומטר/ליטר). ביום השלישי, החלף את המדיום המכיל MNGG במדיום נטול תרופות.
- ביום הרביעי וביום השישי, טפלו בתאים במדיום המכיל MNNG (5 מיקרומטר/ליטר) למשך 24 שעות. ביום השביעי, החלף את המדיום המכיל MNGG במדיום נטול תרופות. הסר את התאים הגוססים והנושרים הרבים והמשיך בתרבית התאים.
- ביום 8 וביום 10, טפלו בתאים במדיום המכיל MNNG (5 מיקרומטר/ליטר) למשך 24 שעות. ביום ה-11, בנה את מודל התא של PLGC (MC).
הערה: במהלך תקופת הדוגמנות, יש להקפיד על מצב התאים באופן קבוע. אם התאים מראים מצב ירוד, מומלץ לטפל בהם ב-MNNG למרווחי זמן שונים, רצוי במרווח של יומיים. לחלופין, ניתן לטפל בתאים במינון נמוך של MNNG (3 מיקרומטר/ליטר). ניתן להתייחס לקריטריוני האבחון הפתולוגיים של תאי MC ממחקרים קודמים כדי להעריך את מצב התאים במדויק 10,19,20,21.
- הכנת סרום המכיל תרופות
- האכילו 30 חולדות SD (זכר, 220 גרם) בתזונה סטנדרטית של כדורי מכרסמים ומים עד שכל החולדות שוקלות יותר מ-350 גרם. הקצה את החולדות באופן אקראי לקבוצת סרום המכילה תרופות חיוביות (n=10), קבוצת סרום המכילה HZJD (n=10) וקבוצת סרום חולדה רגילה (n=10).
- בצע מתן תרופות בחולדות כמתואר בשלב 1.3.2. יש לתת את החולדות פעמיים ביום בשעות 8:00 ו-20:00. להמשיך בהתערבות התרופתית במשך 7 ימים.
- יש לאסוף את דגימות הדם תוך שעה אחת לאחר המתן האחרון ביום ה-8 (8:00 בבוקר). מניחים את הדגימות בצינורות נוגדי קרישה בטמפרטורה של 4 מעלות צלזיוס למשך שעה. צנטריפוגה ב-3,000 x גרם למשך 15 דקות ב-4 מעלות צלזיוס ולאחר מכן אוספים את הסופרנטנט.
- שיטות קיבוץ והתערבות של ניסויים תאיים
- חלקו את ניסויי התאים באופן הבא: קבוצת GES-1 (GES-1), קבוצת MC (MC), קבוצת תרופות חיוביות (תרופה חיובית), קבוצת מרתח HZJD (HZJD), קבוצת השתקת Sirt3 (si-Sirt3), קבוצת ביקורת שלילית (si-NC) והשתקת Sirt3 בשילוב עם קבוצת מרתח HZJD (si-Sirt3+HZJD).
- טפל בתאים בקבוצת התרופות החיוביות ובקבוצת HZJD עם סרום המכיל 10% ויטמין B12 ו-10% סרום המכיל HZJD, בהתאמה. יש לתת קבוצות אחרות עם 10% נסיוב חולדות רגיל.
הערה: בהתבסס על מחקרים קודמים10, 10% סרום המכיל תרופות נבחר לטיפול בתאים. - בצע טרנספקציה של Sirt3 si-RNA (ראה טבלת חומרים) עבור התאים בקבוצת si-Sirt3 ובקבוצת si-Sirt3+HZJD. הגדירו קבוצת ביקורת שלילית שמקבלת וקטור ריק, כלומר, si-NC.
- ממיסים כוח siRNA של 2.5 ננומטר ב-125 מיקרוליטר של DEPC להכנת תמיסת siRNA. לדלל 5 מיקרוליטר של תמיסת siRNA עם 250 מיקרוליטר של מדיום חיוני מינימלי ולדלל 5 מיקרוליטר של ליפופקטמין 2000 עם 250 מיקרוליטר של מדיום חיוני מינימלי. מערבבים אותם יחד באופן שווה.
- מוסיפים את התערובת ל-RPMI 1640 בינוני (1.5 מ"ל/לבאר) בצלחת של 6 בארות. דגירה בטמפרטורה של 37 מעלות צלזיוס עם 5%CO2. בצע ניתוח כתמים מערביים כדי לזהות את רמת ביטוי החלבון של Sirt3 לאחר 48 שעות לאחר הטרנספקציה.
8. בדיקת CCK-8
- הכן את התאים לתרחיף תאים כאשר התאים מכסים 70% מתחתית הבקבוק. השתמש במונה התאים כדי לספור את מספר התאים בהרחף. התאם את הריכוז כדי להבטיח 2,000 תאים לבאר, וכל באר מכילה 100 מיקרוליטר של מדיום RPMI 1640. זרעו את התאים בצלחות של 96 בארות ושמרו על טמפרטורה של 37 מעלות צלזיוס בחממה עם 5% CO2 למשך 24 שעות. הגדר 6 בארות שכפול לכל קבוצה.
הערה: הבארות ההיקפיות של צלחות 96 הבארות שאינן בשימוש מלאות ב-200 מיקרוליטר PBS על מנת להפחית את האידוי במהלך תקופת הדגירה. - לאחר תרבית התאים במשך 24 שעות, החלף את מדיום התרבות במדיום תרבית אחר המכיל תרופות. תרבית התאים במשך 48 שעות עם מדיום תרבית המכיל תרופה חיובית ומדיום תרבית המכיל HZJD.
הערה: מדיום התרבות ברור. בהתבוננות בתחתית בקבוק התרבות באור, ניתן לראות כי התאים מחוברים לסדינים. תופעה זו יכולה להוכיח שהתאים נדבקו לקיר. כאשר הם נצפים במיקרוסקופ, התאים הדבקים משתרעים למעבורות בתחתית הבקבוק וכאשר מנערים את מדיום התרבית, התאים אינם זזים. תאים בדרך כלל נצמדים לקיר לאחר 24 שעות של תרבית. - החלף את מדיום התרבות המכיל תרופות במדיום תרבית טרי. הוסף 10 מיקרוליטר של תמיסת CCK-8 (ראה טבלת חומרים) לכל באר ודגירה בטמפרטורה של 37 מעלות צלזיוס למשך שעה. כדי למנוע היווצרות בועות אוויר, הוסף את תמיסת CCK-8 בצורה אלכסונית לקיר צלחת התרבות.
- זהה את ערך ה-OD של כל באר באמצעות קורא מיקרו-פלטות באורך גל של 450 ננומטר.
9. בדיקת התפשטות תאי EdU
- זרע את התאים בצלחות של 96 בארות כמתואר בשלב 7.1. החלף את מדיום התרבות במדיום תרבית שונה המכיל תרופות למשך 48 שעות.
הערה: זמן הטיפול האופטימלי אושר כ-48 שעות באמצעות ניסויים ראשוניים. - הסר את המדיום ושטוף את התאים עם PBS. הוסף 100 מיקרוליטר מדיום תרבות לבאר. הכן את תמיסת ה-2x EdU (ראה טבלת חומרים, 20 מיקרומטר). הוסף 6 מיקרוליטר מתמיסת המלאי EdU ל -3 מ"ל של מדיום תרבית. הוסף 100 מיקרוליטר מתמיסת EdU 2x (37 מעלות צלזיוס מחוממת מראש) לבאר ולאחר מכן דגירה למשך 2.5 שעות.
הערה: תמיסת המלאי של EdU דוללה ביחס של 1:500 כדי לקבל את תמיסת ה-EdU פי 2. הנפח בפועל של תמיסת EdU 2x היה 2.4 מ"ל עבור 24 בארות. - הסר את המדיום המכיל EdU. מוסיפים 200 מיקרוליטר של 4% פרפורמלדהיד לבאר בטמפרטורת החדר למשך 15 דקות. שטפו את התאים בתמיסת שטיפה (3% אלבומין סרום בקר [BSA] ב-PBS) 3 פעמים למשך 5 דקות כל אחד.
- הסר את תמיסת הכביסה. הוסף 200 מיקרוליטר של תמיסת חדירות (0.3% Triton-X 100 ב-PBS) לבאר בטמפרטורת החדר למשך 20 דקות. הסר את תמיסת החדירה. שוטפים את התאים בתמיסת שטיפה (3% BSA ב- PBS) פעמיים למשך 5 דקות כל אחד.
- ממיסים את התוסף עם 1.3 מ"ל מים נטולי יונים להשלמת התמיסה. הכן את תמיסת התגובה המכילה 1.72 מ"ל של מאגר תגובה, 4 מיקרוליטר של אזיד 488, 80 מיקרוליטר של CuSO4 ו-200 מיקרוליטר של תמיסה תוספת.
- הוסף 50 מיקרוליטר של תמיסת תגובה לבאר. דגרו את הדגימות בטמפרטורת החדר למשך 30 דקות בחושך. שוטפים את התאים בתמיסת כביסה 3x למשך 5 דקות כל אחד.
- הסר את תמיסת הכביסה. הוסף 200 מיקרוליטר של תמיסת Hoechst 33342 1x ודגר את הדגימות בטמפרטורת החדר למשך 10 דקות בחושך.
- רכוש תמונות באמצעות מיקרוסקופ הקרינה. השתמש בתוכנת Image-Pro plus 6.0 כדי לבצע ניתוח כמותי של תמונה.
הערה: אורכי גל העירור והפליטה המרביים של אזיד 488 הם 495 ננומטר ו-519 ננומטר, בהתאמה. אורכי גל העירור והפליטה המקסימליים של Hoechst 33342 הם 346 ננומטר ו-460 ננומטר, בהתאמה.
10. זיהוי מיטופגיה בתאים חיים
- זרעו את התאים בגודל 2 x 104 תאים לבאר בצלחת זכוכית עם 24 בארות. תרבית תאי לילה עם מדיום RPMI 1640 ללא אנטיביוטיקה ב-37 מעלות צלזיוס עם 5% CO2.
- הכן את תמיסת העבודה של צבע mtphagy ואת תמיסת העבודה של צבע lyso (ראה טבלת חומרים). לדלל את תמיסת הצבע mtphagy עם מאגר HEPES של הנקס לריכוז של 100 ננומטר/ליטר. לדלל את תמיסת צבע הליסו עם מאגר HEPES של הנקס לריכוז של 100 מיקרומטר/ליטר.
- הסר את מצע התרבית ושטוף את התאים עם מאגר HEPES של הנקס פי 2. הוסף 500 מיקרוליטר של תמיסת עבודה של צבע mtphagy (100 ננומטר/ליטר) ולאחר מכן דגירה ב-37 מעלות צלזיוס למשך 30 דקות.
- שטפו את התאים עם מאגר HEPES של הנקס פי 2. הוסף 500 מיקרוליטר של תמיסת עבודה של צבע ליסו (100 מיקרומטר/ליטר) ולאחר מכן דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות.
- שטפו את התאים עם מאגר HEPES של הנקס פי 2. קבע את רמת המיטופאגיה על ידי מיקרוסקופ פלואורסצנטי קונפוקלי.
הערה: התאים צולמו ללא כל קיבוע לפני או אחרי הצביעה. תהליך ההדמיה בוצע במהירות האפשרית כדי למזער שינויים או שינויים פוטנציאליים במצב התאי.
11. ניתוחים סטטיסטיים
- להשתמש בתוכנה מסחרית לביצוע ניתוחים סטטיסטיים. השווה את ההבדלים בין קבוצות שונות עם ANOVA חד כיווני ואחריו מבחן פוסט הוק LSD. הצג את הנתונים כממוצע ± סטיית תקן (SD). הגדר את המובהקות הסטטיסטית כ-P<0.05.
תוצאות
MNNG גורם להתקדמות PLGC במודל בעלי חיים ומקדם טרנספורמציה מורפולוגית של תאי GES-1
בתצפית מקרוסקופית, רירית הקיבה של חולדות בקבוצת הביקורת נראתה באופן אחיד באדום בוהק, חלק ורך, כאשר קפלי הרירית מסודרים בתבנית ליניארית. בניגוד לחולדות בקבוצת הביקורת, רירית הקיבה של החולדות בקבוצת המודל הראתה חיוורון וחספוס, והריריות היו שטוחות או אפילו נעלמו (איור 1B). החל מהשבועה-12 נעשה שימוש בבדיקה היסטולוגית כדי לצפות בשינויים הפתולוגיים ברירית הקיבה של חולדות. בשבועה-12 , בדיקה היסטולוגית גילתה דלקת והרחבת כלי דם ברירית הקיבה, יחד עם פגמים קלים בתאי האפיתל. עובי הרירית היה תקין, והבלוטות היו מסודרות באופן קבוע. בשבועה-16 , רירית הקיבה נעשתה דקה יותר באופן משמעותי, ובלוטות הקיבה הצטמצמו ושואבות. IM ו-Dys נצפו מדי פעם עם התרחבות ציסטית נרחבת של בלוטות הקיבה בשבוע 20. עד השבועה-24 נצפה דיס ברירית הקיבה. הבלוטות הפנימיות הראו ירידה במספרן והיו מיושרות בצורה חריגה. נצפתה גם אטיפיה ציטולוגית, כולל גרעינים היפרכרומטיים, יחס גרעיני/ציטופלזמי גדול באופן חריג ואובדן קוטביות (איור 1A). במבחנה, מודל התא נבנה בהצלחה על ידי מתן MNNG. כמה שינויים מורפולוגיים נצפו במודל תאי MC. תאי GES-1 נצפו כמציגים צמיחה חד-שכבתית, המופיעים כתאים אחידים בצורת ציר עם גרעינים סגלגלים או עגולים. לעומת זאת, תאי MC הראו צמיחה רב-שכבתית ופיזור לא אחיד. תאי MC היו מוארכים עם גרעינים לא סדירים וצורת ציר בדומה לפיברובלסטים (איור 1C).
מרתח HZJD מקל על תהליך הפיתוח של PLGC in vivo ומעכב את התפשטות תאי MC
לאחר אימות מודל PLGC, חולדות טופלו במשך 10 שבועות נוספים כדי להבהיר עוד יותר את ההשפעה של מרתח HZJD. תוצאות צביעת H&E הצביעו על כך שרירית הקיבה בקבוצת הביקורת הייתה עבה עם בלוטות רבות ותאים קודקודיים מסיביים. להיפך, החולדות בקבוצת המודל הראו שינויים פתולוגיים, כולל IM ו-Dys. הפתולוגיה של רירית הקיבה השתפרה משמעותית בקבוצת HZJD בהשוואה לקבוצת המודל. בפירוט, רירית הקיבה הדגימה דלקת, אך תאי האפיתל נותרו שלמים יחסית. הבלוטות הראו סידור קבוע, והתאים הקודקודיים היו מפוזרים. אולם ההשפעה הטיפולית של תרופה חיובית אינה ברורה (איור 2A). כדי להבהיר עוד יותר את מידת ה-PLGC, בוצעו צביעת HID-AB וצביעה AB-PAS לסיווג IM. צביעת HID-AB שימשה להבדיל בין סולפומוצינים לסיאלומוצינים וצביעת AB-PAS שימשה להבחנה בין מוצינים חומציים למוצינים ניטרליים 13,22. בקבוצת הביקורת, תאי אפיתל רירית הקיבה הראו פיזור אחיד של צבע כחול במקום חום בצביעת HID-AB. בנוסף, בצביעת AB-PAS, תאי האפיתל הראו צבע אדום-סגול. רירית הקיבה של קבוצת המודל הראתה צבע חום בצביעת HID-AB וכחול בצביעת AB-PAS, מה שהצביע על נוכחות של מטפלזיה מסוג המעי הגס (C-IM). בקבוצת HZJD, רירית הקיבה לא הראתה כתם חום בצביעת HID-AB, אלא הראתה בעיקר צבע אדום-סגול בצביעה AB-PAS (איור 2B). תוצאות הצביעה חשפו כי HZJD יכול לעכב את התקדמות ההיפרפלזיה הלא טיפוסית.
כדי לזהות אם HZJD יכול להשפיע על כדאיות התאים, נעשה שימוש בבדיקת CCK-8 כדי להעריך את ההשפעה של HZJD על תאי MC. התאים טופלו במחזורי זמן שונים של 24 שעות, 48 שעות ו-72 שעות. תוצאות בדיקת CCK-8 הראו כי לא היה הבדל משמעותי בכדאיות התאים בין הקבוצות לאחר 24 שעות (p > 0.05). לאחר 48 שעות, הכדאיות של תאי MC עלתה משמעותית, בהשוואה ל-GES-1 (p < 0.0001). מרתח HZJD עיכב את כדאיות התאים (p < 0.0001). למרות שהתאים בקבוצת התרופה החיובית הראו כדאיות תאים נמוכה יותר בהשוואה ל-MC, ירידה זו לא הייתה מובהקת סטטיסטית (p = 0.1681). תוצאות בדיקת CCK-8 הצביעו על כך שטיפול ב-HZJD עיכב את כדאיות ה-MC באופן תלוי זמן (איור 2D). הערכת התפשטות התאים באמצעות מבחן EdU הניבה תוצאות העולות בקנה אחד עם ממצאי בדיקת CCK-8. יש לציין כי התפשטות התאים של תאי MC הייתה גבוהה משמעותית בהשוואה לזו של תאי GES-1 (p < 0.0001). בקבוצת HZJD, היחס של EdU ירד באופן ברור, בהשוואה לתאי MC (p < 0.001). התוצאות לעיל הצביעו על כך של-HZJD הייתה השפעה מעכבת על התפשטות תאי MC (איור 2C,E).
מרתח HZJD מקדם מיטופגיה בחולדות PLGC ותאי MC
כדי לחקור את המעורבות של מיטופגיה ב-PLGC, זיהינו את רמות הביטוי של מולקולות הקשורות למיטופגיה, כולל פרקין, Tomm20, P62 ו-LC3 II/I. in vivo, רמות ביטוי החלבון של פרקין ו-LC3 II/I ירדו בבירור בחולדות מודל, בהשוואה לקבוצת הביקורת. טיפול במרתח HZJD הוביל לעלייה ניכרת ברמות החלבון של פרקין ו-LC3 II/I. רמות ביטוי החלבון של Tomm20 ו-P62 בחולדות מודל היו גבוהות באופן בולט בהשוואה לאלו בקבוצת הביקורת, בעוד שטיפול ב-HZJD עיכב באופן משמעותי את הרמות של Tomm20 ו-P62 (איור 3A,C). במקביל, רמות ביטוי החלבון של Parkin, Tomm20, P62 ו-LC3 II/I זוהו במבחנה. התוצאות הראו כי רמות ביטוי החלבון של פרקין ו-LC3 II/I היו מווסתות באופן ניכר בתאי MC בהשוואה ל-GES-1. HZJD יכול כמובן להגביר את רמות ביטוי החלבון של פרקין ו-LC3 II/I. תאי MC הראו ביטוי מוגבר של חלבוני Tomm20 ו-P62, בעוד שטיפול ב-HZJD הפחית את הביטוי המוגזם (איור 4A,C).
רמות ה-mRNA של Parkin, Tomm20, P62 ו-LC3 II/I נבדקו גם על ידי RT-qPCR הן in vivo והן in vitro. התוצאות הראו כי רמות ביטוי ה-mRNA של פרקין ו-LC3 II/I פחתו באופן ניכר בחולדות המודל ובתאי MC, בעוד שאלו של Tomm20 ו-P62 היו גבוהות משמעותית בהשוואה לתאי GES-1 וחולדות ביקורת. רקמות הקיבה והתאים שטופלו ב-HZJD הראו ויסות מוגבר של פרקין ו-LC3 II/I, בעוד ויסות נמוך של Tomm20 ו-P62 (איור 3B, איור 4B). תוצאה ראויה לציון נוספת בניסוי בבעלי חיים הייתה שטיפול בתרופה החיובית הפך את השינויים ברמות ה-mRNA של Parkin, LC3 II/I ו-Tomm20 בחולדות המודל, אך השפעה רגולטורית זו לא הגיעה למובהקות סטטיסטית (p > 0.05; איור 3B). תוצאות אלה מצביעות על כך שהתרופה החיובית יעילה הרבה פחות מ-HZJD.
בנוסף, ניתוח האימונופלואורסצנציה גילה כי האותות של COX IV ו-LC3 בחולדות המודל הופחתו בהשוואה לחולדות הביקורת. HZJD העלה באופן ניכר את רמות הביטוי של COX IV ו-LC3 (איור 3D,E), מה שמרמז על כך ש-HZJD יכול לקדם מיטופגיה ברקמות הקיבה של חולדות PLGC. כדי לאמת עוד יותר את ההשפעות של HZJD על מיטופגיה בתאי MC, בחנו את העוצמה הפלואורסצנטית של מיטופגיה על ידי צביעת פגוזומים מיטוכונדריאלים וליזוזומים. כאשר פגוזומים וליזוזומים מיטוכונדריאלים התמזגו, עוצמת הפלואורסצנט (אדום) השתנתה מפלואורסצנטיות חלשה לפלואורסצנטיות חזקה. הממצאים הצביעו על כך שנצפתה עוצמה חלשה בתאי MC, אך האות השתפר באופן משמעותי בתאים שטופלו ב-HZJD (איור 4D,E), מה שמצביע על כך ש-HZJD יכול להפעיל מיטופגיה מעוכבת על ידי MNNG בתאי MC.
מרתח HZJD מווסת את מסלול Sirt3/Foxo3a/Parkin בחולדות PLGC ובתאי MC
ידוע כי מסלול Sirt3/Foxo3a/Parkin ממלא תפקיד חשוב בהפעלת מסלול מיטופגי23. לפיכך, בדקנו אם HZJD יכול לווסת את מסלול Sirt3/Foxo3a/Parkin ב-PLGC. Sirt3, Foxo3a ו-Parkin היו ממוקמים בעיקר בציטופלזמה. תוצאות האימונוהיסטוכימיה הראו כי רמות הביטוי של Sirt3, Foxo3a ו-Parkin פחתו באופן ניכר בחולדות המודל בהשוואה לאלו בחולדות הביקורת. HZJD הראה השפעה טובה יותר באופן משמעותי בהשוואה לתרופה החיובית בהעלאת רמות הביטוי של Sirt3, Foxo3a ו-Parkin (איור 5A,B). לאחר מכן, רמות ביטוי החלבון וה-mRNA של Sirt3 ו-Foxo3a נקבעו הן in vivo והן in vitro. התוצאות של Western Blotting הראו כי Sirt3 ו-Foxo3a באו לידי ביטוי בדלילות בחולדות PLGC ובתאי MC, בעוד שרמות הביטוי המווסתות של המולקולות הנ"ל נצפו בחולדות הביקורת ובתאי GES-1. מצאנו גם ש-HZJD יכול להגדיל את רמות הביטוי של Sirt3 ו-Foxo3a בהשוואה לקבוצת המודל (איור 5C,E,F). תוצאות RT-qPCR חשפו כי רמות ה-mRNA של Sirt3 ו-Foxo3a הופחתו בחולדות PLGC ובתאי MC בהשוואה לחולדות ביקורת ותאי GES-1. לאחר מתן HZJD, שמנו לב למגמת עלייה ברורה (איור 5D,G). תוצאות אלה מצביעות על כך ש-HZJD יכול לקדם מיטופגיה הן in vivo והן in vitro, אולי על ידי הפרעה למסלול Sirt3/Foxo3a/Parkin במידה מסוימת.
HZJD מקדם מיטופגיה על ידי הפעלת מסלול Sirt3/Foxo3a/Parkin בתאי MC
כדי להבהיר עוד יותר את המנגנון האפשרי של HZJD בהפעלת מיטופגיה, תאי MC הועברו עם si-sirt3. כפי שמוצג באיור 6, רמות ביטוי החלבון של Sirt3 ו-Foxo3a בקבוצת si-Sirt3 ירדו באופן משמעותי בהשוואה לאלו בקבוצת si-NC. לאחר מכן, התגלו רמות ביטוי החלבון של מולקולות הקשורות למיטופאגיה Parkin, Tomm20, P62 ו-LC3 II/I. בניגוד לקבוצת MC, רמות הביטוי של פרקין ו-LC3 II/I ירדו באופן ניכר בקבוצת si-Sirt3, בעוד אלו של חלבוני Tomm20 ו-P62 התבטאו יתר על המידה בקבוצת si-Sirt3. נתונים אלה מראים כי הפלה של sirt3 יכולה לעכב מיטופגיה בתאי MC. ראינו גם ירידה ברמות הביטוי של Sirt3 ו-Foxo3a בקבוצת si-Sirt3+HZJD בהשוואה לקבוצת HZJD. בינתיים, בהשוואה לקבוצת HZJD, ביטוי החלבון של פרקין והיחס של LC3 II/I היו מווסתים באופן ברור כלפי מטה, בעוד שרמות הביטוי של Tomm20 ו-P62 היו מווסתות באופן משמעותי גם בקבוצת si-Sirt3+HZJD (איור 6A,B). נתונים אלה מצביעים על כך ש-si-sirt3 יכול להחליש מיטופגיה הנגרמת על ידי מרתח HZJD. התוצאות של RT-qPCR היו תואמות היטב את הכתמים המערביים (איור 6C). בנוסף, צפינו גם במבנה העל של תאי MC באמצעות מיקרוסקופ אלקטרונים הולכה. התוצאות הראו כי המבנים המיטוכונדריאלים של תאי GES-1 היו תקינים ביסודם ללא נזק מיטוכונדריאלי ברור. יתר על כן, המיטוכונדריה הנפוחה בתאי MC נצפתה והקריסטה המיטוכונדריאלית נעלמה, מה שמצביע על כך שהמיטוכונדריה בתאי MC הופחתה. בקבוצת si-Sirt3 נצפו ממברנות מיטוכונדריאליות נפוחות, ומידת ההפרעה המיטוכונדריאלית גדלה בהשוואה לקבוצת si-NC. ראינו גם הצטברות של שלפוחיות אוטופאגיות בקבוצת HZJD בהשוואה לקבוצת si-Sirt3+HZJD (איור 6D). כל התוצאות הללו מאשרות עוד יותר כי מרתח HZJD גורם למיטופאגיה על ידי ויסות מסלול Sirt3/Foxo3a/Parkin.

איור 1: MNNG גורם לשינויים מורפולוגיים ופתולוגיים במודל של בעלי חיים ובתאי GES-1. (A) התצפיות הפתולוגיות בשבועה-12,ה-16, ה-20 וה-24 של קבוצת המודל (צביעת H&E, הגדלה פי 100). (B) המורפולוגיה של רירית הקיבה בשבועה-24 בקבוצת הביקורת ובקבוצת המודל (n=6). (C) המורפולוגיה של התא בקבוצת GES-1 ובקבוצת MC (n=3). קיצורים: 12 W = 12 שבועות, 16 W = 16 שבועות, 20 W = 20 שבועות, 24 W = 24 שבועות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מרתח HZJD משפר את ההיסטופתולוגיה של רירית הקיבה ומעכב את התפשטות תאי MC. (A) תמונות פתולוגיות מייצגות של רקמות קיבה בכל קבוצה (צביעת H&E, הגדלה פי 100; n=6). (B) תמונות מייצגות של רקמות קיבה בכל קבוצה (צביעת HID/AB וצביעה AB/PAS, הגדלה פי 100, n=6). (C) רמות התפשטות התאים בכל קבוצה נבדקות על ידי בדיקת EdU (n=6). (D) רמות כדאיות התאים בכל קבוצה, כפי שנבדקו על ידי בדיקת CCK-8 (n=6). (ה) ניתוח כמותי של התפשטות התאים. *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: מרתח HZJD משפר את המיטופאגיה בחולדות PLGC. (A) סיכום נתונים עבור רמות ביטוי החלבון היחסיות של פרקין לאחר נורמליזציה ל-GAPDH, כמו גם LC3 II/I, P62 ו-Tomm20 לאחר נורמליזציה ל-β-אקטין (n=3). (B) סיכום נתונים עבור רמות ביטוי ה-mRNA של Parkin, LC3, P62 ו-Tomm20 (n=9). (C) רמות ביטוי החלבון של פרקין, LC3 II/I, P62 ו-Tomm20 (n=3). (ד, ה) ניתוח הלוקליזציה הקרינה של COX IV ו-LC3 (n=6). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
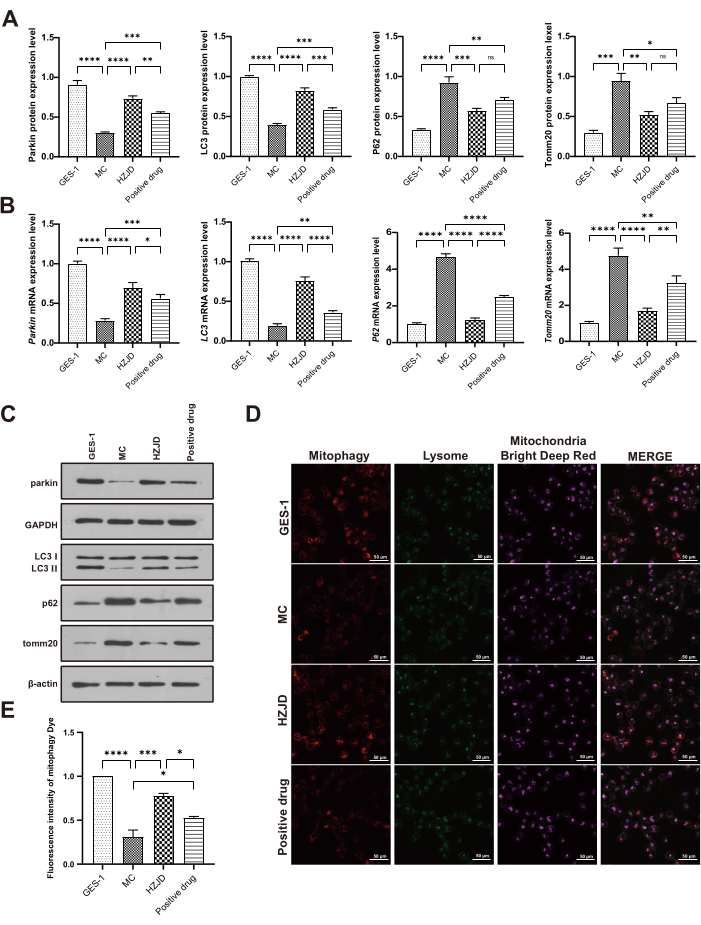
איור 4: מרתח HZJD משפר את המיטופאגיה בתאי MC. (A) סיכום נתונים עבור רמות ביטוי החלבון היחסיות של פרקין לאחר נורמליזציה ל-GAPDH, כמו גם LC3 II/I, P62 ו-Tomm20 לאחר נורמליזציה ל-β-אקטין (n=3). (B) סיכום נתונים עבור רמות ביטוי ה-mRNA של Parkin, LC3 II/I, P62, Tomm20 (n=9). (C) רמות ביטוי החלבון של פרקין, LC3 II/I, P62 ו-Tomm20 (n=3). (ד, ה) תמונות קונפוקליות מייצגות של מיטופגיה של תאים בכל קבוצה (n=3). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מרתח HZJD מווסת את מסלול Sirt3/Foxo3a/Parkin הן in vivo והן in vitro. (א, ב) תמונות אימונוהיסטוכימיות מייצגות של Sirt3, Foxo3a ו-Parkin ברקמות הקיבה בכל קבוצה (n=6). (ג, ה) רמות ביטוי החלבון של Sirt3 ו-Foxo3a in vivo (n=3). (D) רמות ביטוי ה-mRNA של Sirt3 ו-Foxo3ain vivo (n=9). (F) רמות ביטוי החלבון של Sirt3 ו-Foxo3a במבחנה (n=3). (G) רמות ביטוי ה-mRNA של Sirt3 ו-Foxo3ain vitro (n=9). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: si-sirt3 הופך את ההשפעה של מרתח HZJD על מודל תאי PLGC. (א, ב) רמות ביטוי החלבון של Sirt3, Foxo3a, Parkin, LC3 II/I, P62 ו-Tomm20 בכל קבוצה במבחנה (n=3). (C) רמות ביטוי ה-mRNA של Sirt3, Foxo3a, Parkin, LC3, P62 ו-Tomm20 בכל קבוצה במבחנה (n=9). (D) תמונות TEM מייצגות של אולטרה-מבנה תאי בכל קבוצה. חיצים אדומים מייצגים מיטוכונדריון. חיצים צהובים מייצגים ואקואולים אוטופאגיים (n=3). *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001, nsp>0.05. כאן, si-NC מייצג קבוצת ביקורת שלילית, si-Sirt3 מייצג את קבוצת ההשתקה Sirt3, si-Sirt3+HZJD מייצג השתקת Sirt3 בשילוב עם קבוצת מרתח HZJD (si-Sirt3+HZJD). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| שם סיני | שם לטיני | יחס |
| יינצ'ן | Artemisia capillaris ת'ונב. | 11% |
| Baihuasheshecao | Hedyotis diffusa Willd. | 11% |
| בנלאגן | איזטיס טינקטוריה ליניאוס. | 11% |
| בנביאנליאן | Lobelia chinensis לור. | 11% |
| בנז'יליאן | Scutellaria barbata D. Don. | 11% |
| ג'יאוגולאן | Gynostemma pentaphyllum (Thunb.) מאקינו. | 11% |
| חואנגצ'ין | Scutellaria baicalensis גאורגי. | 8% |
| הואנגליאן | קופטיס צ'יננסיס פרנץ'. | 8% |
| קושן | Sophora flavescens Alt. | 7% |
| גואנגחואושיאנג | פוגוסטמון קבלין (בלנקו) בנת'. | 6% |
| פיילן | Eupatorium fortunei טורץ'. | 6% |
טבלה 1: הרכב התרופה והפרופורציה הכלולה במרתח HZJD.
| גנים | פריימר פורוואד (5'-3') | פריימר הפוך (5'-3') |
| Sirt3 | GGCGGCAGGGACGATTATTA | AAGGGCTTGGGGTTGTGAAA |
| פוקסו3א | AAGGGAGGAGGAGGAATGTGGAA | GGTTGTGCCGGATGGAGTT |
| פרקין | AGGATTACCCAGGAGACCGC | ATCATGGTCACTGGGTAGGTG |
| עמ' 62 | TGAGAGACAAAGCCAAGGAGG | CTGGTCCCATTCCAGTCGTC |
| LC3 | CAGCGTCTCCACACCAATCT | GCGGGTTTTGTGAACCTGAA |
| טום20 | ATGAGCTGGGTGTCACTTGG | GTGCATTCTTCTGGCAGGGA |
| β-אקטין | CCGTTGCCCTGAGGCTCTTTTT | CCTTCTGCATCCTGTCAGCAA |
טבלה 2: רצפי פריימר המשמשים בניתוח RT-qPCR.
Discussion
PLGC משמש כתהליך מפתח בהתקדמות מדלקת קיבה כרונית ל-GC. הרפואה הסינית המסורתית הוכחה כטיפול והתערבות מבטיחים ל-PLGC בשנים האחרונות24,25. בשנים האחרונות, הרפואה הסינית המסורתית התגלתה כגישה מבטיחה לטיפול והתערבות ב-PLGC. זה עולה בקנה אחד עם מחקר קודם10. תוצאות הבדיקה הפתולוגית חשפו כי מרתח HZJD החליש בבירור פגיעה פתולוגית בחולדות PLGC. יתר על כן, תוצאות הניסויים בתאים הראו גם כי למרתח HZJD הייתה השפעה טיפולית על התאים. התוצאות של בדיקת CCK-8 היו תואמות לאלו של בדיקת EdU, שתיהן מצביעות על כך שמרתח HZJD יכול לדכא את התפשטות תאי MC. ממצאים אלה מאשרים כי מרתח HZJD יכול לעכב את התקדמות PLGC הן in vivo והן in vitro.
מיטופגיה קשורה קשר הדוק להפרעות במערכת העיכול וגידולי קיבה. Zhang et al. הראו כי הפעלת מיטופגיה יכולה להחזיר את תפקוד המיטוכונדריה, ובכך לקדם התכווצות שריר חלק בקיבה בדיספפסיה תפקודית26. דווח כי מחסור במיטופאגיה יכול לקדם אגרסיביות GC באמצעות הצטברות של ROS27 מיטוכונדריאלי חריג. זה עולה בקנה אחד עם הממצאים הנוכחיים. בניסויים מבוססי תאים, תוצאות זיהוי המיטופאגיה הראו שתאי MC הראו רמה נמוכה יותר של מיטופגיה בהשוואה לתאי GES-1. מרתח HZJD יכול לעכב התפשטות תאים מוגזמת על ידי קידום מיטופגיה. באופן דומה, ראינו גם ירידה ברמות המיטופאגיה בחולדות PLGC. ציטוכרום c אוקסידאז IV (COX IV) הוא חלבון הממוקם בקרום הפנימי של המיטוכונדריה ומשמש לעתים קרובות כסמן לזיהוי ולוקליזציה של המיטוכונדריה28. חלבון 1 הקשור למיקרו-צינוריות 1 שרשרת קלה 3 (LC3) שימש כסמן לסימון אוטופאגוזומים29. הניתוח האימונופלואורסצנטי חשף ירידה משמעותית במידת הלוקליזציה של COX IV ו-LC3 ברקמות הקיבה של חולדות PLGC. עם זאת, לאחר טיפול ב-HZJD, נצפתה עלייה בלוקליזציה משותפת. ממצאים אלה מצביעים על כך ש-HZJD ממלא תפקיד בהקלה על התקדמות PLGC על ידי ויסות מיטופגיה.
Sirt3 הוכר באופן נרחב כמדכא גידול מקומי במיטוכונדריה. נמצא כי Sirt3 מעורב בהתקדמות נגעים לא סרטניים ל-GC. בהתקדמות מדלקת קיבה כרונית ל-IM, ובסופו של דבר ל-GC, רמת הביטוי של Sirt3 יורדת בהדרגה. שינויים אלה בביטוי Sirt3 מתחילים בשלב ה-IM והופכים בולטים יותר ככל שהמחלה מתקדמת ל-GC30. Sirt3 מפעיל את Foxo3a באמצעות שינוי דה-אצטילציה כדי ליזום עוד יותר את מפל המיטופגיה. Foxo3a לא רק נקשר ישירות לפרקין, אלא גם פועל באופן סינרגטי עם פרקין כדי להפעיל מיטופגיה. ביטוי יתר של Foxo3a ו-Parkin יכול לעכב באופן ניכר את התפשטות תאי GC31. במהלך מיטוכונדריה הנגרמת על ידי פרקין, מיטוכונדריה פגומה מובילה לאובדן פוטנציאל הממברנה המיטוכונדריאלית. לאחר מכן, פרקין מגויס למיטוכונדריה ומופעל. פרקין בכל מקום מחלבוני הממברנה החיצונית המיטוכונדריאלית, ואז P62 מסמן את חלבוני הממברנה החיצונית המיטוכונדריאלית שהשתנו. LC3 יכול להיקשר באופן ספציפי ל-P62 כדי לגרום למיטופאגיה ולקדם את הפירוק של מיטוכונדריון32 לא מתפקד. Tomm20 הוא סמן ממברנה מיטוכונדריאלית המשקף במדויק את המסה המיטוכונדריאלית33. עם הפעלת מיטופגיה, רמות Tomm20 ו-P62 מווסתות כלפי מטה34, בעוד שרמת הביטוי של פרקין מווסתת כלפי מעלה יחד עם עלייה ביחס LC3II/I32,35. ממצאי המחקר לעיל עולים בקנה אחד עם התצפיות והממצאים הללו. תוצאות האימונוהיסטוכימיה הראו כי רמת Sirt3 ירדה, והביטויים של Foxo3a ו-Parkin היו מווסתים בו זמנית בקבוצת המודל. יתר על כן, מרתח HZJD יכול להפוך את מגמת הירידה של ציר Sirt3/Foxo3a/Parkin בקבוצת המודל. מצאנו גם שרמות ה-mRNA והחלבון של Sirt3, Foxo3a, Parkin ו-LC3 בקבוצת המודל היו נמוכות משמעותית מאלו בקבוצת הביקורת. מרתח HZJD יכול להפוך את מגמת הירידה הזו. בנוסף, מרתח HZJD דיכא משמעותית את ביטוי היתר של Tomm20 ו-P62.
כדי להעריך את המעורבות של Sirt3 בהשפעות הרגולטוריות של HZJD על מיטופגיה, ערכנו ניסויי טרנספקציה si-Sirt3 בתאי MC. כצפוי, הפלת Sirt3 הובילה לירידה משמעותית ברמות Foxo3a ו-Parkin. במקביל, מיטופגיה הייתה מרוסנת, מה שמצביע על כך ש-Sirt3 ממלא תפקיד בתיווך ההשפעות הרגולטוריות של HZJD על מיטופגיה. התוצאות הצביעו על כך שמרתח HZJD יכול להפעיל מיטופגיה ולווסת את מסלול האיתות Sirt3/Foxo3a/Parkin. עם זאת, נצפה כי ההשפעה החיובית של HZJD הושפעה כאשר Sirt3 נחסם. ממצאים אלה מצביעים על כך שמרתח HZJD משפר את המיטופאגיה על ידי ויסות מסלול Sirt3/Foxo3a/Parkin. המחקר שלנו מרמז כי HZJD משפר את PLGC באמצעות שיפור מיטופגיה וויסות מסלול Sirt3/Foxo3a/Parkin.
כדי לקבוע את ההשפעה של מרתח HZJD על PLGC, נבנה מודל בעלי חיים של PLGC בחולדות. כדי לדמות את תהליך הנגע הטרום סרטני הדומה להתקדמות הפתולוגית הטבעית, השתמשנו ב-MNNG כדי לדמות צריכת ניטריט ותרופות אנטי דלקתיות לא סטרואידיות כדי לדמות דלקת כרונית. בנוסף, יושמה תזונה לא סדירה כדי לחקות עוד יותר את התנאים התורמים להתפתחות נגעים טרום סרטניים. בהשוואה לשיטות מידול אחרות כגון MNNG בשילוב עם אתנול או נתרן דאוקסיכולאט, שיטות מידול אלה יכולות לקצר את תקופת הדוגמנות ולמזער את המוות בשוגג של החולדות. כדי להידמות מאוד להתפתחות הטבעית של PLGC ולמזער גירוי מוגזם, בחרנו לספק לחולדות גישה חופשית ל-MNNG לשתייה. ראוי לציין כי יש להגן על MNNG מפני אור ולהחליף אותו מדי יום כדי למנוע אובדן MNNG בתנאי טמפרטורה ואור לא מתאימים. עם זאת, לשיטת דוגמנות זו יש חסרונות מסוימים שיש להכיר בהם. יישום תקופת צום של יום אחד יכול לעורר ביעילות את רירית הקיבה בחולדות. עם זאת, חשוב לקחת בחשבון שצום עשוי להשפיע על צריכת המים, מה שעלול להוביל להפחתת צריכת MNGG על ידי החולדות. בעתיד, נמשיך לחקור את זמן הצום על מנת להשיג את התוצאות האופטימליות ביותר. בנוסף, נבנה תאי MC כמודל תא. כדי לגרום לתאים אלה, נשתמש במתן ארוך טווח בריכוז נמוך של MNNG לתאי GES-1. גישה זו מסייעת במניעת התאוששות תאים מהירה שעלולה להתרחש כאשר האינדוקציה נסוגה בפתאומיות, מה שמבטיח תגובה תאית יציבה ומתמשכת יותר לניסויים. מחקרים קודמים אישרו כי גם לאחר הפסקה של 4 שבועות של מתן MNNG, תאי MC עדיין שומרים על מצב הטרנספורמציה הממאירה שלהם36. שיטת מידול זו מספקת מודל ניסיוני טוב לחקר PLGC.
במחקר זה, ההשפעה הטיפולית של מרתח HZJD אושרה עוד יותר על ידי צביעת H&E, אימונוהיסטוכימיה וטכניקות ביולוגיות מולקולריות שונות אחרות. פרוטוקול מקיף זה משמש כאסמכתא חשובה לפיתוח תרופות לטיפול ב-PLGC. התוצאות הנוכחיות שלנו אימתו כי מרתח HZJD הראה את ההשפעה הטיפולית של PLGC על ידי הפעלת מיטופגיה. מסלול Sirt3/Foxo3a/Parkin זוהה כמנגנון מולקולרי פוטנציאלי העומד בבסיס הפעלת מיטופגיה על ידי מרתח HZJD. מחקר זה עשוי לספק מידע ורעיונות חדשים לטיפול ב-PLGC. עם זאת, עדיין היו כמה מגבלות במחקר. למרות שאישרנו שמרתח HZJD תיווך מיטופגיה דרך ציר Sirt3/Foxo3a/Parkin, לא ניתן היה לשלול מעורבות של מסלולי מיטופגיה אחרים ואירועים תאיים פוטנציאליים. במאמצי מחקר עתידיים, חיוני לשפר ולחדד פרוטוקול זה כדי להבהיר את החומרים הפעילים הקיימים במרתח HZJD ולפענח את מנגנון הפעולה המדויק שלו.
Disclosures
כל המחברים מצהירים שאין להם ניגוד אינטרסים.
Acknowledgements
פרויקט זה מומן על ידי הקרן למדעי הטבע של מחוז הביי בסין (H2020423207).
Materials
| Name | Company | Catalog Number | Comments |
| 1-Methyl-3-nitro-1-nitrosoguanidine | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | R030453 | |
| 3,3’-diaminobenzidine | Beijing Zhong Shan-Golden Bridge Biological Technology Co., Ltd., Beijing, CHN | ZLI0919 | |
| Alcian blue periodic acid schiff staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G1285 | |
| Anti-fade fluorescence mounting medium | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | S2110 | |
| Bicinchoninic acid protein concentration determination kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G2026-1000T | |
| CCK-8 reagent kit | Boster Biological Engineering co., Ltd., Wuhan, CHN | AR1160 | |
| Confocal fluorescence microscopy | Leica Instruments Co., Ltd., Weztlar, GER | TCS-SP8SR | |
COX  antibody antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab202554 | |
| DAPI staining solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | C0065 | |
| DEPC | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3004 | |
| EdU cell proliferation kit | Beyotime Biotechnology Co., Ltd., Shanghai, CHN | C0071S | |
| Electrophoresis solution | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0139 | |
| Ethanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 64-17-5 | |
| FBS | Gibco Corporation, Gaithersburg, USA | 16000044 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| Foxo3a antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 23683 | |
| GAPDH antibody | Wuhan Sanying Biology Technology Co., Ltd., Wuhan, CHN | 10494-1-AP | |
| Gel preparation kit | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0138 | |
| GES-1 cell | Procell Life Science&Technology Co., Ltd., Wuhan, CHN | CL-0563 | |
| Goat-anti-mouse IgG | CST Biological Reagents Co., Ltd., Shanghai, CHN | 4409 | |
| Goat-anti-rabbit IgG | Abcam Trading Co., Ltd., Shanghai, CHN | ab150077 | |
| Hematoxylin-eosin staining solution | Zhuhai Beso Biotechnology Co., Ltd., Shenzhen, CHN | BA4027 | |
| High iron diamine/alcian blue staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G2070 | |
| ImageJ | National Institutes of Health, Bethesda, USA | ||
| Image-Pro Plus 6.0 software | Media Cybernetics Inc., Maryland, USA | ||
| Isopropanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 67-63-0 | |
| LC3 antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 83506 | |
| Loading buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0198 | |
| Microplate reader | Rayto Life and Analytical Sciences Co., Ltd., Shenzhen, CHN | RT6100 | |
| Microtome | Leica Instruments Co., Ltd., Weztlar, GER | RM2245 | |
| Mitophagy kit | Dojindo Laboratories, Kyushu Island, JPN | MD01-10 | |
| Neutral balsam | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | WG10004160 | |
| Optical microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| P62 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab91526 | |
| Paraformaldehyde | Biosharp Life Sciences, Anhui, CHN | BL539A | |
| Parkin antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 32833 | |
| Penicillin–streptomycin | Gibco Corporation, Gaithersburg, USA | 15140122 | |
| phosphate-buffered saline | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0002-15 | |
| PVDF membrane | Millipore Corporation, Michigan, USA | IPVH00010 | |
| Redzol | SBS Genetech Co., Ltd., Beijing, CHN | FTR-50 | |
| Reverse transcription reagent kit | Igene Biotechnology Co., Ltd., Guangzhou, CHN | QP057 | |
| RIPA Buffer solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | R002 | |
| Roswell Park Memorial Institute | Gibco Corporation, Gaithersburg, USA | 11875093 | |
| Silicone needle | Zhongke Life Biotechnology Co., Ltd., Beijing, CHN | TFEP-2 | |
| siRNA | Wuhan Genecreate Biological Engineering Co., Ltd. ,Wuhan,CHN | ||
| Sirt3 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 189860 | |
| Sodium salicylate | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, CHN | S104176 | |
| Sprague-Dawley rat | Beijing Huafukang Biotechnology Co., Ltd., Beijing, CHN | 110322210102553975 | |
| SYBR quantitative PCR kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3320-15 | |
| Tomm20 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab186735 | |
| Transferring buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0141 | |
| Trichloromethane | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | 821112 | |
| Tris-buffered saline with Tween 20 | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0004 | |
| VDAC1 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab15895 | |
| Xylene | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 1330-20-7 | |
| β-actin antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab8226 |
References
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- He, J., et al. Helicobacter pylori infection induces stem cell-like properties in Correa cascade of gastric cancer. Cancer Letters. 542, 215764(2022).
- Xu, W., Li, B., Xu, M., Yang, T., Hao, X. Traditional Chinese medicine for precancerous lesions of gastric cancer: A review. Biomedicine & Pharmacotherapy. 146, 112542(2022).
- Yang, L., et al. A Systematic Review of the Mechanisms Underlying Treatment of Gastric Precancerous Lesions by Traditional Chinese Medicine. Evidence-Based Complementary and Alternative Medicine. 2020, 9154738(2020).
- Ping, Z., Yan, W., Jing, L., Qian, J., Xin, H. The Effect of Huazhuo Jiedu recipe on Epithelial -Mesenchymal-Transition in Chronic Erosive Gastritis Patients with Zhuoduneiyun syndrome. Pharmacology and Clinics of Chinese Materia Medica. 35 (6), 154-158 (2019).
- Yan, W., Jing, L., Pan, Z. The effect of Huazhuojiedu formula on HGF/c-Met signal pathway in patients with chronic erosive gastritis. Pharmacology and Clinics of Chinese Materia Medica. 33 (02), 186-189 (2017).
- Hao, X., et al. Integrating Network Pharmacology and Experimental Validation to Investigate the Mechanisms of Huazhuojiedu Decoction to Treat Chronic Atrophic Gastritis. Evidence-Based Complementary and Alternative Medicine. 2020, 2638362(2020).
- Zhou, P., et al. 16S rRNA sequencing-based evaluation of the protective effects of Hua-Zhuo-Jie-Du on rats with chronic atrophic gastritis. BMC Complementary Medicine and Therapies. 22 (1), 71(2022).
- Zhou, P., et al. Determination of the protective effects of Hua-Zhuo-Jie-Du in chronic atrophic gastritis by regulating intestinal microbiota and metabolites: combination of liquid chromatograph mass spectrometer metabolic profiling and 16S rRNA gene sequencing. Chinese Medicine. 16 (1), 37(2021).
- Hao, X., Zhou, P., Yang, Z., Yang, T., Wang, Y. The therapeutic effect of Huazhuojiedu decoction on precancerous lesions in a gastric cancer model via the regulation of lnc 517368. Journal of Ethnopharmacology. 283, 114635(2022).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Zhang, C., et al. Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16259-16264 (2011).
- Cai, T., et al. Protective effects of Weipixiao decoction against MNNG-induced gastric precancerous lesions in rats. Biomedicine & Pharmacotherapy. 120, 109427(2019).
- Shah, S. C., Piazuelo, M. B., Kuipers, E. J., Li, D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 161 (4), 1325-1332 (2021).
- Pimentel-Nunes, P., et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 51 (4), 365-388 (2019).
- Nagtegaal, I. D., et al. The 2019 WHO classification of tumours of the digestive system. Histopathology. 76 (2), 182-188 (2020).
- Kushima, R. The updated WHO classification of digestive system tumours-gastric adenocarcinoma and dysplasia. Der Pathologe. 43 (1), 8-15 (2022).
- Yang, P., et al. Weipiling decoction alleviates N-methyl-N-nitro-N'-nitrosoguanidine-induced gastric precancerous lesions via NF-κB signalling pathway inhibition. Chinese Medicine. 17 (1), 104(2022).
- Xu, J., et al. Xiao Tan He Wei Decoction reverses MNNG-induced precancerous lesions of gastric carcinoma in vivo and vitro: Regulation of apoptosis through NF-κB pathway. Biomedicine & Pharmacotherapy. 108, 95-102 (2018).
- Li, S. Study on the mechanism of regulating NF-kB activity and inhibiting the migration of gastric "inflammation-cancer" transformed cells by invigorating spleen, removing blood stasis and detoxifying. Guangzhou University of Chinese Medicine. , 17-19 (2021).
- Liu, H. Research Progress of Cell Models of Gastric Cancer Precancerous Lesions. Traditional Chinese Drug Research and Clinical Pharmacology. 27 (4), 592-596 (2016).
- Zheng, J., et al. Chronic stress accelerates the process of gastric precancerous lesions in rats. Journal of Cancer. 12 (14), 4121-4133 (2021).
- Yu, W., et al. Sirt3 deficiency exacerbates diabetic cardiac dysfunction: Role of Foxo3A-Parkin-mediated mitophagy. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (8), 1973-1983 (2017).
- Cao, Y., et al. Efficacy of Banxia Xiexin decoction for chronic atrophic gastritis: A systematic review and meta-analysis. PLoS One. 15 (10), e0241202(2020).
- Yin, J., et al. Weiqi Decoction Attenuated Chronic Atrophic Gastritis with Precancerous Lesion through Regulating Microcirculation Disturbance and HIF-1α Signaling Pathway. Evidence-Based Complementary and Alternative Medicine. 2019, 2651037(2019).
- Zhang, J., Wang, X., Wang, F., Tang, X. Xiangsha Liujunzi Decoction improves gastrointestinal motility in functional dyspepsia with spleen deficiency syndrome by restoring mitochondrial quality control homeostasis. Phytomedicine. 105, 154374(2022).
- Shida, M., et al. Impaired mitophagy activates mtROS/HIF-1α interplay and increases cancer aggressiveness in gastric cancer cells under hypoxia. International Journal of Oncology. 48 (4), 1379-1390 (2016).
- Zhou, X. Y., et al. Inhibition of autophagy blocks cathepsins-tBid-mitochondrial apoptotic signaling pathway via stabilization of lysosomal membrane in ischemic astrocytes. Cell Death & Disease. 8 (2), e2618(2017).
- He, R., Peng, J., Yuan, P., Xu, F., Wei, W. Divergent roles of BECN1 in LC3 lipidation and autophagosomal function. Autophagy. 11 (5), 740-747 (2015).
- Fernández-Coto, D. L., et al. Quantitative proteomics reveals proteins involved in the progression from non-cancerous lesions to gastric cancer. Journal of Proteomics. 186, 15-27 (2018).
- Ding, D., et al. Post-translational modification of Parkin and its research progress in cancer. Cancer Communications. 39 (1), 77(2019).
- Wang, Y., et al. The Role of Mitochondrial Dynamics and Mitophagy in Carcinogenesis, Metastasis and Therapy. Frontiers in Cell and Developmental Biology. 8, 413(2020).
- Gehrke, S., et al. PINK1 and Parkin control localized translation of respiratory chain component mRNAs on mitochondria outer membrane. Cell Metabolism. 21 (1), 95-108 (2015).
- Fu, Z. J., et al. HIF-1α-BNIP3-mediated mitophagy in tubular cells protects against renal ischemia/reperfusion injury. Redox Biology. 36, 101671(2020).
- Jia, Q., et al. Hesperidin promotes gastric motility in rats with functional dyspepsia by regulating Drp1-mediated ICC mitophagy. Frontiers in Pharmacology. 13, 945624(2022).
- Chen, Y. The N-alkylamides induces MGMT gene hypomethylation in gastric epithelium cells malignant transformation. Zhejiang University. , 33-35 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved