Method Article
Неинвазивное компрессионно-индуцированное повреждение передней крестообразной связки (ПКС) и визуализация активности протеазы in vivo у мышей
В этой статье
Резюме
Неинвазивное повреждение передней крестообразной связки является надежным и клинически значимым методом инициации посттравматического остеоартрита (ПТОА) у мышей. Этот метод также позволяет in vivo количественно оценить активность протеазы в суставе в ранние моменты времени после травмы с помощью активируемых протеазами зондов ближнего инфракрасного диапазона и визуализации отражения флуоресценции.
Аннотация
Травматические повреждения суставов, такие как разрыв передней крестообразной связки (ПКС) или разрыв мениска, обычно приводят к посттравматическому остеоартриту (ПТОА) в течение 10-20 лет после травмы. Понимание ранних биологических процессов, инициированных повреждениями суставов (например, воспаление, матриксные металлопротеиназы (ММП), катепсиновые протеазы, резорбция костной ткани), имеет решающее значение для понимания этиологии ПТОА. Тем не менее, существует несколько вариантов измерения этих биологических процессов in vivo , и ранние биологические реакции могут быть искажены, если для инициирования ОА используются инвазивные хирургические методы или инъекции. В наших исследованиях ПТОА мы использовали коммерчески доступные зонды, активируемые протеазой ближнего инфракрасного диапазона, в сочетании с флуоресцентной отражательной визуализацией (FRI) для количественной оценки активности протеазы in vivo после неинвазивного компрессионного повреждения передней крестообразной связки у мышей. Этот неинвазивный метод повреждения передней крестообразной связки точно повторяет клинически значимые состояния травмы и является полностью асептическим, поскольку он не включает в себя повреждение кожи или капсулы сустава. Комбинация этих методов травмы и визуализации позволяет изучать динамику активности протеазы в различные моменты времени после травматического повреждения сустава.
Введение
Остеоартрит является широко распространенной проблемой здравоохранения, которая затрагивает миллионы людейв Соединенных Штатах 1. Посттравматический остеоартрит (ПТОА) — это разновидность остеоартрита, которая возникает в результате повреждения сустава, такого как разрыв передней крестообразной связки (ПКС), повреждение мениска или внутрисуставной перелом2. Доля пациентов с симптоматическим ОА, которые могут быть классифицированы как ПТОА, составляет не менее 12%3, и эта этиология обычно поражает более молодую популяцию, чем идиопатическая ОА4. Мышиные модели ОА являются важнейшими инструментами для изучения этиологии заболевания и потенциальных методов лечения ОА в гораздо более короткие сроки (4-12 недель у мышей по сравнению с 10-20 годами у людей). Тем не менее, методы инициирования ОА у мышей обычно включают инвазивные хирургические методы, такие как рассечение передней крестообразной связки 5,6, удаление или дестабилизация медиального мениска 5,7,8,9,10,11,12,13,14,15,16 или комбинацию этих двух методов 17,18,19, которые не воспроизводят клинически значимые состояния повреждения. Хирургические модели также усугубляют воспаление в суставе из-за разрушения суставной капсулы, что может ускорить прогрессирование ОА.
Неинвазивные мышиные модели травмы коленного сустава дают возможность изучать биологические и биомеханические изменения в ранние моменты времени после травмы и могут дать более клинически значимые результаты20. Наша лаборатория создала неинвазивную модель травмы, которая использует одну внешнюю компрессионную перегрузку большеберцовой кости для индуцирования разрыва передней крестообразной связки (ПКС) у мышей 21,22,23,24. Этот неинвазивный метод травмы способен вызвать асептическое повреждение сустава, не повреждая кожу или суставную капсулу.
Флуоресцентная отражательная визуализация (FRI) — это метод оптической визуализации, который включает в себя возбуждение мишени инфракрасным светом на определенной длине волны и количественную оценку отраженного света, излучаемого на другой длине волны. Коммерчески доступные протеаза-специфические зонды могут быть введены в животные модели, а FRI затем может быть использован для количественной оценки активности протеазы в определенных участках, таких как коленный сустав. Этот метод широко используется для обнаружения in vivo биологической активности, такой как воспаление. Зонды, используемые для этого применения, флуоресцентно гасят до тех пор, пока они не встретятся с соответствующими протеазами. Затем эти протеазы разрушают сайт расщепления фермента на зондах, после чего они производят флуоресцентный сигнал ближнего инфракрасного диапазона. Эти зонды и этот метод визуализации были широко проверены и использованы в исследованиях рака 25,26,27,28 и атеросклероза 29,30,31,32, и наша группа использовала их для исследований опорно-двигательного аппарата для измерения маркеров воспаления и деградации матрикса 23,24,33.
Вместе неинвазивное повреждение сустава в сочетании с FRI in vivo и зондами, активируемыми протеазой, обеспечивает уникальную возможность отслеживать воспаление и активность протеазы после травматического повреждения сустава. Этот анализ может быть проведен уже через несколько часов или даже минут после травмы, и одно и то же животное может быть оценено несколько раз, чтобы изучить временной ход активности протеазы в суставе. Важно отметить, что этот метод визуализации может быть неосуществим в сочетании с хирургическими моделями ОА, поскольку разрушение кожи и капсулы сустава приводит к флуоресцентному сигналу, который искажает сигнал изнутри сустава.
протокол
Все описанные процедуры были одобрены Комитетом по уходу за животными и их использованию при Калифорнийском университете в Дэвисе. Для настоящего исследования были использованы 3-месячные самцы мышей C57BL/6J.
1. Неинвазивная травма передней крестообразной связки
ПРИМЕЧАНИЕ: Травма передней крестообразной связки, вызванная внешней сжимающей нагрузкой, является простым и воспроизводимым методом, который точно повторяет условия травмы передней крестообразной связки у людей. Этот протокол написан для коммерчески доступного прибора с нагрузочной рамой (см. таблицу материалов), но может быть адаптирован и для аналогичных систем.
- Откройте программное обеспечение, совместимое с прибором с нагрузочной рамой (см. Таблицу материалов), и выберите существующий файл управления или создайте новый файл.
- Включите питание привода.
- В меню калибровки проверьте показания усилия тензодатчика и установите смещение привода на 0.
- Используйте 1%-4% ингаляционный изофлуран в кислороде для обезболивания мышей и обеспечения того, чтобы животные были полностью обезболены путем защемления пальцев ног и/или хвоста.
- Поместите мышь в положение лежа на платформе. Расположите нижнюю ногу вертикально между двумя загрузочными приспособлениями (Рисунок 1) (см. Таблицу материалов). Вставьте стопу в вырез верхнего приспособления, а колено в чашку нижнего приспособления.
- Вручную отрегулируйте высоту нижнего приспособления, чтобы применить преднатяг 1-2 Н (контролируется в режиме реального времени на экране компьютера), и затяните установочный винт, чтобы удерживать положение. Преднатяг необходим для того, чтобы удерживать ногу в правильном положении перед приложением травматической нагрузки.
- Приложите одинарную сжимающую нагрузку к целевому усилию (~12-15 Н) или смещению цели (~1,5-2,0 мм).
ПРИМЕЧАНИЕ: Приложение нагрузки с более низкой скоростью нагружения (~1 мм/с) обеспечит более высокий уровень мониторинга и управления в режиме реального времени, но, скорее всего, приведет к отказу ACL при отключении. Применение более высокой скорости нагрузки (~200 мм/с) с большей вероятностью приведет к повреждению передней крестообразной связки22. Если установлено, что произошел перелом большеберцовой кости или другая чрезмерная травма, усыпьте животное с помощью метода, одобренного IACUC, до того, как животное оправится от анестезии.- Установите скорость загрузки в файле управления программного обеспечения и подтвердите с помощью данных о силе-перемещении.
ПРИМЕЧАНИЕ: Перелом кости во время компрессионной нагрузки большеберцовой кости, как правило, не вызывает беспокойства, поскольку сила перелома (~20 Н) значительно выше, чем сила травмы передней крестообразной связки. Тем не менее, это следует контролировать с помощью пальпации, и визуализация (т.е. рентген) может быть использована для подтверждения того, что переломов большеберцовой кости не было.
- Установите скорость загрузки в файле управления программного обеспечения и подтвердите с помощью данных о силе-перемещении.
- Травма обычно обозначается звуком («щелчок» или «хруст») и высвобождением силы, которое можно идентифицировать на графиках «сила-смещение» (рис. 1C). Если используется более медленная скорость нагрузки, прекратите компрессионную нагрузку сразу после травмы, чтобы предотвратить дальнейшую нагрузку и возможное повреждение других тканей сустава.
ПРИМЕЧАНИЕ: Повреждение передней крестообразной связки обычно происходит при 8-15 Н в зависимости от массы тела34. Важно установить целевую силу, превышающую ожидаемую силу травмы передней крестообразной связки. - Подтвердите травму передней крестообразной связки с помощью передне-заднего теста35,36 или сопоставимой оценки нестабильности сустава.
- Вводят мышам после травмы дозу, зависящую от массы тела животного (например, 0,05-0,1 мг/кг/к/к или ВМ бупренорфина, см. Таблицу материалов) с продолжительностью и дозой в соответствии с рекомендациями и одобренными IACUC в домашнем учреждении.
ПРИМЕЧАНИЕ: НПВП могут изменять прогрессирование ПТА после травмы, поэтому не рекомендуется использовать НПВП для обезболивания в этой модели травмы, если это не является конкретной целью исследования.
2. Подготовка животных к визуализации FRI
ПРИМЕЧАНИЕ: Для оптической визуализации мех животных (особенно темный мех) очень эффективен в блокировании, поглощении и рассеивании света, поэтому перед визуализацией мех должен быть максимально удален из области вокруг коленных суставов. Крем для депиляции, как правило, более эффективен для удаления шерсти, чем машинки для стрижки. Голые или голые мыши не требуют удаления шерсти. Тем не менее, удаление шерсти необходимо для наиболее часто используемых линий мышей (например, C57BL/6). Если возможно, кормите мышей очищенным кормом с низкой флуоресценцией перед визуализацией. Стандартная мышиная чау-чау содержит хлорофилл, который автоматически флуоресцирует с длиной волны около 700 нм и может влиять на сбор данных из системы ближнего инфракрасного диапазона FRI.
- Обезболивайте мышей 1%-4% ингаляционным изофлураном в кислороде. Держите мышей на грелке как можно дольше и наносите глазную мазь, чтобы предотвратить раздражение глаз.
- С помощью ватного тампона нанесите крем для депиляции (см. Таблицу материалов) на переднюю (черепную) сторону ног мышей вокруг коленного сустава.
- Дайте крему постоять ~1 минуту, затем используйте салфетки, чтобы удалить крем и шерсть с ноги. При необходимости повторите процедуру.
- После того, как коленные суставы будут полностью обнажены без шерсти, покрывающей эту область, очистите ноги спиртовыми салфетками, чтобы удалить остатки крема для депиляции.
ПРИМЕЧАНИЕ: Крем для депиляции можно использовать на одних и тех же мышах несколько раз в течение исследования, но эти нанесения должны быть не менее одной недели с интервалом, чтобы предотвратить ненужное раздражение кожи.
3. Приготовление зондового раствора
- При необходимости разбавьте флуоресцентный активируемый зонд в соответствии с инструкциями производителя в стерильном 1x фосфатно-солевом буфере (PBS). Один флакон коммерчески доступного зонда (см. таблицу материалов) обычно содержит 20 нмоль в 0,15 мл 1x PBS. Чтобы разбавить раствор во флаконе, добавьте 1,35 мл 1x PBS, чтобы получить 20 нмоль в 1,5 мл 1x PBS.
ПРИМЕЧАНИЕ: После разведения один флакон можно использовать для визуализации десяти мышей при введении 0,15 мл на мышь. - Встряхните раствор с минимальной скоростью (~2000 об/мин) в течение 30 с, чтобы убедиться, что зонд растворен в растворе, а затем кратковременно центрифугируют, чтобы убедиться, что вся жидкость вышла из крышки.
ПРИМЕЧАНИЕ: Раствор можно хранить при температуре 2-8 °C в защищенном от света месте до 12 месяцев.
4. Ретроорбитальная инжекция
ПРИМЕЧАНИЕ: Обратитесь к Yardeni et al. относительно подробностей этой процедуры37.
- Используйте 1%-4% ингаляционный изофлуран в кислороде для анестезии мышей и положите мышь на бок мордой в носовой конус.
- Используйте инсулиновые шприцы ~29 G для введения зондового раствора (приготовленного на шаге 3).
- Перед использованием держите шприц закрытым, чтобы предотвратить воздействие света.
- При введении инъекции:
- Сделайте инъекцию на внутреннюю часть глаза (слезную карункулу) и убедитесь, что скос шприца направлен к глазу. Для правшей рекомендуется делать инъекцию в правый глаз мыши так, чтобы животное смотрело вправо.
- Рукой, не делающей инъекции, осторожно оттяните кожу вокруг глаза, чтобы стабилизировать голову и заставить глаз выпячиваться.
- Расположите шприц параллельно корпусу мыши.
- Осторожно проведите шприц мимо глаза, пока он не встретит жесткое сопротивление; Не пытайтесь перешагнуть эту точку.
- Медленно введите раствор зонда в ретроорбитальный синус, затем медленно вытащите иглу из глазницы. Если с помощью иглы раствор не выходит, инъекция проходит успешно.
- Нанесите физиологический раствор или глазную мазь на глаз, в который введена инъекция.
ПРИМЕЧАНИЕ: Исходя из документации, прилагаемой к датчикам для визуализации, оптимальное время визуализации обычно составляет от 1 до 2 дней после введения раствора зонда. Если возможно, рекомендуется провести первичный временной скрининг, чтобы определить оптимальное время визуализации для каждого конкретного применения. Мыши метаболизируют введенный зонд в течение примерно 7 дней, после чего необходимо будет ввести новую дозу раствора зонда, если потребуются дополнительные моменты времени.
5. Визуализация флуоресцентного отражения
ПРИМЕЧАНИЕ: Процедуры, описанные в этом разделе, относятся к коммерчески доступной оптической системе визуализации (см. Таблицу материалов). Аналогичная визуализация может быть выполнена с помощью сопоставимых систем.
- Обезболивайте мышей 1%-4% ингаляционным изофлураном в кислороде и помещайте животное лежа на спине в систему визуализации так, чтобы морда находилась в носовом конусе.
- Расположите мышь так, чтобы голени были вытянуты так, чтобы колени были слегка направлены в воздух (возможно, потребуется заклеить ступни). Очень важно, чтобы для всех животных использовалось одинаковое позиционирование.
- Откройте совместимое программное обеспечение (см. Таблицу материалов) на компьютере системы обработки изображений; появится «Панель управления сбором данных».
- Чтобы прогреть систему, нажмите « Инициализировать » и подождите, пока индикатор температуры не станет зеленым.
- Нажмите на Imaging Wizard и убедитесь, что появится окно «Imaging Wizard».
- Нажмите « Пара фильтров» и убедитесь, что выбрано значение «Эпи-подсветка», затем нажмите «Далее».
- Чтобы выбрать правильные настройки возбуждения/излучения, найдите интересующий датчик из выпадающего списка. Если вы не можете найти нужный зонд, найдите имя 'Input Ex/Em' и вручную введите значения Excitation Peak и Emission Peak в зависимости от свойства датчика, который будет использоваться (например, для Excitation Peak введите 675, а для Emission Peak введите 720). Нажмите « Далее».
- Выберите «Мышь » для параметра «Объект изображения». В разделе «Параметры экспозиции» убедитесь, что установлен флажок «Автоматические настройки » и выбраны параметры «Флуоресцентный » и «Фотография ». Выберите D-22,6 см в контрольном списке «Поле зрения». Нажмите кнопку Далее.
- Настройки изображения можно просмотреть и изменить на правой панели «Панели управления сбором данных». Убедитесь, что все настройки верны, и нажмите кнопку «Получить последовательность ». После того, как изображение появится, убедитесь, что изображение имеет достаточную экспозицию. Если нет, измените настройку времени экспозиции и снова нажмите «Получить последовательность ».
- Чтобы проанализировать изображение, расположите круг области интереса (ROI) с одинаковым размером над каждым коленным суставом на черно-белом изображении (это предотвратит смещение позиционирования на основе областей флуоресцентного сигнала).
- Рассчитайте общую эффективность излучения и/или среднюю эффективность излучения для каждого коленного сустава. Если эффективность излучения также рассчитывается на контралатеральных участках, нормализуйте данные, разделив измерение эффективности излучения для поврежденной ноги на измерение эффективности излучения контралатерального участка.
ПРИМЕЧАНИЕ: Если исследуемая область с одинаковой площадью используется для всех коленей, то как общая эффективность излучения, так и средняя эффективность излучения будут давать одинаковые результаты. Использование средней эффективности излучения рекомендуется, если используются интересующие области с разными размерами. Нормализация данных об эффективности излучения из поврежденного сустава с данными из неповрежденного контралатерального колена обеспечит внутренний контроль для учета любых различий в количестве введенного зонда и эффективности доставки у разных животных.
Результаты
После приложения однократного сжимающего усилия (1 мм/с до травмы) к голеням 3-месячных самцов мышей C57BL/6J повреждение передней крестообразной связки последовательно индуцировалось у всех мышей. Средняя сжимающая сила при травме коленного сустава составила примерно 10 Н (рис. 1).
Анализ FRI показал значительно большую активность протеазы в поврежденных суставах мышей, подвергшихся неинвазивному повреждению передней крестообразной связки, через 7 дней после травмы (рис. 2). FRI-анализ коленных суставов также был проведен на мышах, которым была проведена хирургическая рестабилизация коленного сустава сразу после неинвазивной травмы передней крестообразной связки, аналогично тому, что было ранее описано у крыс 35,36,38. Этот анализ показал значительно больший флуоресцентный сигнал у мышей, подвергшихся операции по рестабилизации, чем у мышей, которые не подвергались хирургическому вмешательству, через 2 и 4 недели после травмы. Эти данные свидетельствуют о том, что инвазивные хирургические процедуры могут запутать анализ активности протеазы в суставе.
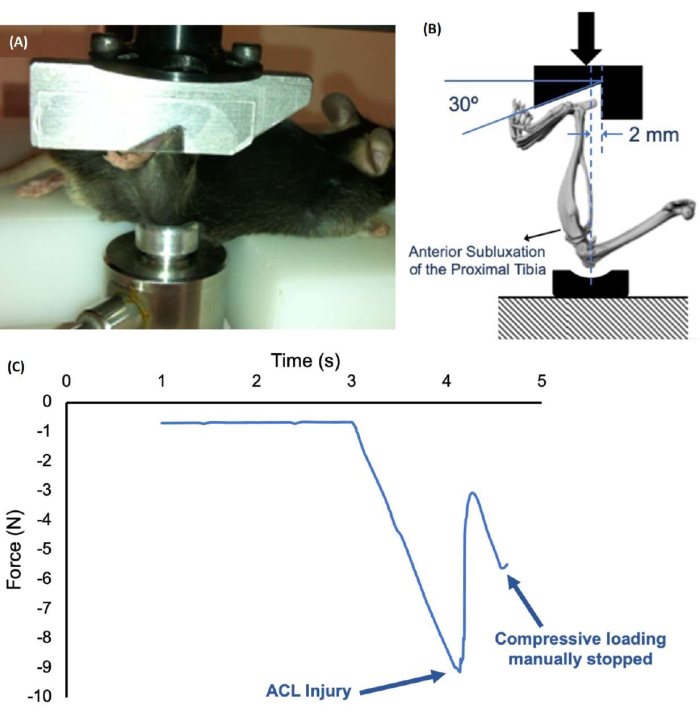
Рисунок 1: Неинвазивная настройка травмы передней крестообразной связки и график «сила-время» во время травмы. (А,Б) Голень мыши расположена вертикально в системе, лодыжка находится в выемке верхнего приспособления, а коленный сустав помещается в неглубокую чашку на нижнем приспособлении. Нижнее приспособление фиксируется на месте установочным винтом после ручного приложения предварительного натяга 1-2 Н. (C) График смещения силы, который показывает повреждение передней крестообразной связки примерно при 9 Н. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Флуоресцентная отражательная визуализация, обнаруживающая активность протеазы в коленных суставах мышей. (A,B) Репрезентативные изображения нетравмированных (A) и травмированных (B) мышей после травмы. (C) Средняя эффективность излучения обоих коленных суставов у нетравмированных и травмированных мышей через неделю после неинвазивной травмы передней крестообразной связки. Поврежденные суставы показали на 43% большую среднюю эффективность излучения по сравнению с контралатеральными суставами и суставами нетравмированных мышей. (D) Нормализованная общая эффективность излучения (R/L) для неинвазивно травмированных мышей и травмированных мышей, которые также были подвергнуты операции по рестабилизации суставов. Через 1-4 недели после травмы наблюдалось на ~30%-80% более высокая эффективность излучения в поврежденных суставах по сравнению с контралатеральными суставами. Напротив, хирургически оперированные суставы показали на ~300% большую эффективность излучения на 4-й неделе по сравнению с контралатеральными суставами, что свидетельствует о заметном искажающем эффекте хирургического вмешательства. **P < 0,01. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Этот протокол установил и строго описал воспроизводимый, неинвазивный метод индуцирования повреждения передней крестообразной связки у мышей 20,21,24,33. Этот простой и эффективный метод травматизации может быть выполнен всего за несколько минут, что облегчает высокопроизводительные исследования ПТОА. Этот метод травмы также точно повторяет состояния травмы, относящиеся к травме передней крестообразной связки человека. Хирургические методы, используемые для индуцирования ОА у мышей, могут препятствовать использованию методов визуализации in vivo для измерения временного хода и величины активности протеазы в суставе после травмы. Напротив, неинвазивные модели мышей с ОА (рассмотрены в20 статьях) в сочетании с FRI обеспечивают уникальную возможность визуализации in vivo активности протеазы в коленных суставах мышей после травмы.
Воспалительная реакция после травмы имеет решающее значение при прогрессировании ОА. Однако методы, используемые для анализа воспаления в суставе, как правило, являются дорогостоящими, трудоемкими и разрушительными. Например, такие методы, как полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) или РНК-секвенирование, могут быть использованы для количественного определения широкого спектра генов в целых суставах, отдельных тканях или отдельных клетках. Однако этот метод требует эвтаназии мышей, чтобы получить поврежденные и неповрежденные коленные суставы. Эти мыши не могут быть проанализированы в нескольких временных точках, таких как ранняя временная точка во время пикового ответа протеазы (т.е. 3-14 дней после травмы) и более поздняя точка времени, когда ОА более тяжелая (т.е. 4-6 недель после травмы). Напротив, FRI в сочетании с неинвазивным повреждением суставов дает возможность анализировать активность протеазы в нескольких временных точках в коленных суставах мышей in vivo39. Это позволяет проводить лонгитюдный анализ одних и тех же мышей и делает FRI относительно менее затратным результатом, чем ОТ-ПЦР или РНК-секвенирование. Кроме того, несколько зондов или целей могут быть изображены одновременно на разных длинах волн, что может дать несколько результатов для различных целей. Измерение активности протеазы в суставе с помощью FRI не обеспечивает строгой количественной оценки всех воспалительных процессов, возникающих во время прогрессирования ОА, но данные in vivo и лонгитюдные данные, предоставленные этим методом, все же могут быть полезны для отслеживания величины и временного течения активности воспалительной протеазы после повреждения сустава.
Раствор флуоресцентного активируемого зонда, используемый для FRI-визуализации активности протеазы, должен вводиться внутривенно (внутривенно). Наиболее распространенными способами проведения внутривенной инъекции у мышей являются инъекция в хвостовую вену и ретроорбитальная инъекция. Ретроорбитальная инъекция часто проще в выполнении и облегчает необходимый объем инъекции, чем инъекция в хвостовую вену. В литературе также указывается, что ретроорбитальная доставка может вызвать меньший стресс у мышей без разницы в доставке лекарства или эффективности по сравнению с инъекцией в хвостовую вену. Эти результаты свидетельствуют о том, что ретроорбитальная инъекция подходит для введения раствора флуоресцентного активируемого зонда для визуализации FRI.
Разрешение FRI относительно низкое по сравнению с некоторыми другими методами визуализации, но количественные результаты могут предоставить достаточную информацию о временном ходе и величине воспалительного реакции протеазы во время прогрессирования ОА. Ограничением этой методики является то, что тканевая автофлуоресценция может повлиять на результаты, но эта проблема может быть решена при тщательном планировании до эксперимента (тип зонда, штамм мышей, позиционирование животного и т. д.). В отличие от других методов доклинической визуализации (например, microPET, microSPECT, microCT, MRI), FRI не может быть напрямую переведен в метод клинической визуализации из-за резких различий в размерах между мышами и людьми, поскольку глубина проникновения света ограничена. Однако в доклинических исследованиях на моделях грызунов коленный сустав находится близко к коже с минимальным покрытием мягких тканей. Следовательно, FRI является эффективным инструментом для определения активности протеазы в коленном суставе мышей.
В заключение, неинвазивное повреждение передней крестообразной связки обеспечивает простой и воспроизводимый метод инициирования ПТА у мышей. Этот метод также облегчает использование зондов, активируемых протеазой, и флуоресцентной отражательной визуализации для измерения in vivo временного хода и величины активности воспалительной протеазы в суставах мышей во время прогрессирования ОА. В будущих исследованиях эти методы и многочисленные коммерчески доступные флуоресцентные зонды ближнего инфракрасного диапазона могут быть использованы для изучения механизмов прогрессирования ОА у мышей разного возраста, пола и генетического происхождения или для оценки потенциальных методов лечения для замедления или предотвращения прогрессирования ОА после травмы сустава.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Исследование, представленное в этой публикации, было поддержано Национальным институтом артрита, заболеваний опорно-двигательного аппарата и кожи, входящим в состав Национальных институтов здоровья, под номером R01 AR075013.
Материалы
| Name | Company | Catalog Number | Comments |
| 10x Phosphate-Buffered Saline | Tissue Protech | PBS01-32R | or equivalent |
| Air Anesthetia System | Isoflurane vaporizor with induction chamber and nose cone | ||
| Buprenorphine | Analgesic post-injury | ||
| Depilatory Cream | Veet | B001KYPZ4G | or equivalent |
| Fixtures | Custom-made knee fixture, ankle fixture, and platform | ||
| IVIS Spectrum | Perkin Elmer | 124262 | Can also use comparable optical imaging system |
| Kimwipes | Kimberly-Clark Corporation | 06-666 | or equivalent |
| Living Image software | Perkin Elmer | ||
| Materials testing systems | TA Instruments | Electroforce 3200 or equivalent | |
| ProSense680 | Perkin Elmer | NEV10003 | Can also use other probes such as OsteoSense, MMPSense, Cat K, AngioSense, etc. |
| Sterile Syringe with Needle | Spectrum Chemical Mfg. Corp. | 550-82231-CS | Covidien 1 mL TB Syringe with 28 G x 1/2 in. Needle, Sterile or equivalent |
| Uniaxial load cell | TA Instruments | 20 N capacity | |
| Vortex-Genie 2 | Scientific Industries, Inc. | SI-0236 | or equivalent |
| WinTest software | TA Instruments | compatible with Electroforce 3200 |
Ссылки
- Deshpande, B. R., et al. Number of persons with symptomatic knee osteoarthritis in the us: impact of race and ethnicity, age, sex, and obesity. Arthritis Care & Research (Hoboken. 68 (12), 1743-1750 (2016).
- Carbone, A., Rodeo, S. Review of current understanding of post-traumatic osteoarthritis resulting from sports injuries. Journal of Orthopaedic Research. 35 (3), 397-405 (2017).
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Wang, L. J., Zeng, N., Yan, Z. P., Li, J. T., Ni, G. X. Post-traumatic osteoarthritis following ACL injury. Arthritis Research & Therapy. 22 (1), 57(2020).
- Glasson, S. S., Blanchet, T. J., Morris, E. A. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse. Osteoarthritis Cartilage. 15 (9), 1061-1069 (2007).
- Kamekura, S. Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis Cartilage. 13 (7), 632-641 (2005).
- Ma, H. L., et al. Osteoarthritis severity is sex dependent in a surgical mouse model. Osteoarthritis Cartilage. 15 (6), 695-700 (2007).
- Malfait, A. M., et al. ADAMTS-5 deficient mice do not develop mechanical allodynia associated with osteoarthritis following medial meniscal destabilization. Osteoarthritis Cartilage. 18 (4), 572-580 (2010).
- Yang, S., et al. Hypoxia-inducible factor-2alpha is a catabolic regulator of osteoarthritic cartilage destruction. Nature Medicine. 16 (6), 687-693 (2010).
- Moodie, J. P., Stok, K. S., Muller, R., Vincent, T. L., Shefelbine, S. J. Multimodal imaging demonstrates concomitant changes in bone and cartilage after destabilisation of the medial meniscus and increased joint laxity. Osteoarthritis Cartilage. 19 (2), 163-170 (2011).
- Li, J., et al. Knockout of ADAMTS5 does not eliminate cartilage aggrecanase activity but abrogates joint fibrosis and promotes cartilage aggrecan deposition in murine osteoarthritis models. Journal of Orthopaedic Research. 29 (4), 516-522 (2011).
- Shapiro, F., Glimcher, M. J. Induction of osteoarthrosis in the rabbit knee joint. Clinical Orthopaedics and Related Research. 147, 287-295 (1980).
- Meacock, S. C., Bodmer, J. L., Billingham, M. E. Experimental osteoarthritis in guinea-pigs. Journal of Experimental Pathology (Oxford). 71 (2), 279-293 (1990).
- Armstrong, S. J., Read, R. A., Ghosh, P., Wilson, D. M. Moderate exercise exacerbates the osteoarthritic lesions produced in cartilage by meniscectomy: a morphological study. Osteoarthritis Cartilage. 1 (2), 89-96 (1993).
- Pastoureau, P., Leduc, S., Chomel, A., De Ceuninck, F. Quantitative assessment of articular cartilage and subchondral bone histology in the meniscectomized guinea pig model of osteoarthritis. Osteoarthritis Cartilage. 11 (6), 412-423 (2003).
- Wancket, L. M., et al. Anatomical localization of cartilage degradation markers in a surgically induced rat osteoarthritis model. Toxicologic Pathology. 33 (4), 484-489 (2005).
- Karahan, S., Kincaid, S. A., Kammermann, J. R., Wright, J. C. Evaluation of the rat stifle joint after transection of the cranial cruciate ligament and partial medial meniscectomy. Comparative Medicine. 51 (6), 504-512 (2001).
- Kamekura, S., et al. Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 13 (7), 632-641 (2005).
- Jones, M. D., et al. In vivo microfocal computed tomography and micro-magnetic resonance imaging evaluation of antiresorptive and antiinflammatory drugs as preventive treatments of osteoarthritis in the rat. Arthritis & Rheumatology. 62 (9), 2726-2735 (2010).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Christiansen, B. A., et al. Musculoskeletal changes following non-invasive knee injury using a novel mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 20 (7), 773-782 (2012).
- Lockwood, K. A., Chu, B. T., Anderson, M. J., Haudenschild, D. R., Christiansen, B. A. Comparison of loading rate-dependent injury modes in a murine model of post-traumatic osteoarthritis. Journal of Orthopaedic Research. 32 (1), 79-88 (2014).
- Satkunananthan, P. B., et al. In vivo fluorescence reflectance imaging of protease activity in a mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 22 (10), 1461-1469 (2014).
- Hsia, A. W., et al. Post-traumatic osteoarthritis progression is diminished by early mechanical unloading and anti-inflammatory treatment in mice. Osteoarthritis Cartilage. 29 (12), 1709-1719 (2021).
- Zhang, H., et al. Biochromoendoscopy: molecular imaging with capsule endoscopy for detection of adenomas of the GI tract. Gastrointestinal Endoscopy. 68 (3), 520-527 (2008).
- Gounaris, E., et al. Live imaging of cysteine-cathepsin activity reveals dynamics of focal inflammation, angiogenesis, and polyp growth. PLoS One. 3 (8), e2916(2008).
- Sheth, R. A., Mahmood, U. Optical molecular imaging and its emerging role in colorectal cancer. American Journal of Physiology-Gastrointestinal and Liver Physiology. 299 (4), G807-G820 (2010).
- Clapper, M. L., et al. Detection of colorectal adenomas using a bioactivatable probe specific for matrix metalloproteinase activity. Neoplasia. 13 (8), 685-691 (2011).
- Nahrendorf, M., et al. Dual channel optical tomographic imaging of leukocyte recruitment and protease activity in the healing myocardial infarct. Circulation Research. 100 (8), 1218-1225 (2007).
- Jaffer, F. A., et al. Optical visualization of cathepsin K activity in atherosclerosis with a novel, protease-activatable fluorescence sensor. Circulation. 115 (17), 2292-2298 (2007).
- Jaffer, F. A., Libby, P., Weissleder, R. Optical and multimodality molecular imaging: insights into atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (7), 1017-1024 (2009).
- Razansky, D., et al. Multispectral optoacoustic tomography of matrix metalloproteinase activity in vulnerable human carotid plaques. Molecular Imaging and Biology. 14 (3), 277-285 (2012).
- Hsia, A. W., et al. Osteophytes and fracture calluses share developmental milestones and are diminished by unloading. Journal of Orthopaedic Research. 36 (2), 699-710 (2018).
- Blaker, C. L., Little, C. B., Clarke, E. C. Joint loads resulting in ACL rupture: Effects of age, sex, and body mass on injury load and mode of failure in a mouse model. Journal of Orthopaedic Research. 35 (8), 1754-1763 (2017).
- Murata, K., et al. Controlling joint instability delays the degeneration of articular cartilage in a rat model. Osteoarthritis Cartilage. 25 (2), 297-308 (2017).
- Murata, K., et al. Controlling Abnormal joint movement inhibits response of osteophyte formation. Cartilage. 9 (4), 391-401 (2018).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Laboratory Animals (NY). 40 (5), 155-160 (2011).
- Kokubun, T., et al. Effect of changing the joint kinematics of knees with a ruptured anterior cruciate ligament on the molecular biological responses and spontaneous healing in a rat model. The American Journal of Sports Medicine. 44 (11), 2900-2910 (2016).
- Bhatti, F. U., et al. Characterization of non-invasively induced post-traumatic osteoarthritis in mice. Antioxidants (Basel). 11 (9), 1783(2022).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Laboratory Animals (NY). 37 (1), 26-32 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены