Method Article
비침습적 압박 유도 전방 십자인대(ACL) 손상 및 생쥐의 프로테아제 활성에 대한 생체 내 이미징
요약
비침습적 전방십자인대 손상은 마우스에서 외상 후 골관절염(PTOA)을 시작하기 위한 신뢰할 수 있고 임상적으로 관련된 방법입니다. 이 손상 방법은 또한 프로테아제 활성화 가능한 근적외선 프로브 및 형광 반사 이미징을 사용하여 손상 후 초기 시점에서 관절의 프로테아제 활성을 생체 내에서 정량화할 수 있습니다.
초록
전방십자인대(ACL) 파열 또는 반월상 연골 파열과 같은 외상성 관절 손상은 일반적으로 부상 후 10-20년 이내에 외상 후 골관절염(PTOA)으로 이어집니다. 관절 손상에 의해 시작되는 초기 생물학적 과정(예: 염증, 기질 금속단백분해효소(MMP), 카텝신 프로테아제, 골 흡수)을 이해하는 것은 PTOA의 원인을 이해하는 데 매우 중요합니다. 그러나 이러한 생물학적 과정의 생체 내 측정을 위한 옵션은 거의 없으며, 골관절염을 시작하기 위해 침습적 수술 기술이나 주사를 사용하는 경우 초기 생물학적 반응이 혼란스러울 수 있습니다. PTOA에 대한 연구에서는 형광 반사 이미징(FRI)과 결합된 상업적으로 이용 가능한 근적외선 프로테아제 활성화 가능한 프로브를 사용하여 마우스의 비침습적 압박 유도 ACL 손상 후 생체 내 프로테아제 활성을 정량화했습니다. 이 비침습적 전방십자인대 손상 방법은 임상적으로 관련된 손상 상태를 면밀히 요약하고 피부나 관절낭을 파괴하지 않기 때문에 완전히 무균입니다. 이러한 손상과 이미징 방법의 조합을 통해 외상성 관절 손상 후 여러 시점에서 단백질 분해 효소 활동의 시간 경과를 연구할 수 있습니다.
서문
골관절염은 미국에서 수백만 명의 사람들에게 영향을 미치는 만연한 건강 문제입니다1. 외상 후 골관절염(Post-traumatic osteoarthritis, PTOA)은 전방십자인대(ACL) 파열, 반월상 연골 손상 또는 관절 내 골절과 같은 관절 손상에 의해 시작되는 골관절염의 하위 집합이다2. 증상이 있는 골관절염 환자 중 PTOA로 분류될 수 있는 비율은 최소 12%3이며, 이 병인은 일반적으로 특발성 골관절염보다 젊은 집단에 영향을 미친다4. 골관절염 마우스 모델은 훨씬 더 짧은 기간(인간의 경우 10-20년, 마우스 모델의 경우 4-12주)에 질병 병인과 잠재적인 골관절염 치료를 조사하는 데 중요한 도구입니다. 그러나, 마우스에서 골관절염을 유발하는 방법은 일반적으로 전방십자인대 절개(5,6), 내측 반월상 연골판(5,7,8,9,10,11,12,13,14,15,16)의 제거 또는 불안정화와 같은 침습적 수술 기법을 포함한다 17,18,19, 임상적으로 관련된 부상 상태를 재현하지 않습니다. 수술 모델은 또한 관절낭의 파괴로 인해 관절의 염증을 악화시켜 골관절염 진행을 가속화할 수 있습니다.
비침습적 무릎 부상 마우스 모델은 부상 후 초기 시점에서 생물학적 및 생체역학적 변화를 연구할 수 있는 기회를 제공하며 임상적으로 더 관련성 있는 결과를 얻을 수 있습니다20. 우리 연구실은 마우스 21,22,23,24에서 전방십자인대(ACL) 파열을 유도하기 위해 단일 외부 적용 경골 압박 과부하를 사용하는 비침습적 손상 모델을 확립했습니다. 이 비침습적 손상 방법은 피부나 관절낭을 방해하지 않고 무균성 관절 손상을 일으킬 수 있습니다.
형광 반사율 이미징(FRI)은 특정 파장에서 적외선으로 대상을 여기시키고 다른 파장에서 방출되는 반사광을 정량화하는 광학 이미징 방법입니다. 상업적으로 이용 가능한 프로테아제 특이적 프로브를 동물 모델에 주입할 수 있으며, FRI를 사용하여 무릎 관절과 같은 특정 부위에서 프로테아제 활성을 정량화할 수 있습니다. 이 방법은 염증과 같은 생물학적 활성의 생체 내 검출에 널리 사용되었습니다. 이 응용 분야에 사용되는 프로브는 관련 프로테아제를 만날 때까지 형광 담금질됩니다. 그런 다음 이러한 프로테아제는 프로브의 효소 절단 부위를 파괴한 후 근적외선 형광 신호를 생성합니다. 이러한 프로브와 이미징 방법은 암25,26,27,28 및 죽상 경화증 29,30,31,32 연구에서 광범위하게 검증되고 사용되었으며, 우리 그룹은 염증 및 매트릭스 분해 마커를 측정하기 위해 근골격 계 연구에 사용했습니다 23,24,33.
생체 내 FRI 및 프로테아제 활성화 가능한 프로브와 결합된 비침습적 관절 손상은 외상성 관절 손상 후 염증 및 프로테아제 활성을 추적하는 고유한 기능을 제공합니다. 이 분석은 부상 후 몇 시간 또는 몇 분 후에 수행할 수 있으며, 동일한 동물을 여러 번 평가하여 관절에서 단백질 분해 효소 활성의 시간 경과를 연구할 수 있습니다. 중요한 것은 이 이미징 방법을 골관절염의 수술 모델과 결합할 때 피부와 관절낭이 파괴되면 관절 내에서 신호를 혼동할 수 있는 형광 신호가 발생하기 때문에 실현 가능하지 않을 수 있다는 것입니다.
프로토콜
설명된 모든 절차는 University of California Davis의 Institutional Animal Care and Use Committee의 승인을 받았습니다. 본 연구에는 3개월 된 수컷 C57BL/6J 마우스가 사용되었습니다.
1. 비침습적 전방십자인대 부상
알림: 외부에서 가해지는 압축 하중에 의해 발생하는 전방십자인대 손상은 인간의 전방십자인대 손상 상태를 면밀히 요약하는 간단하고 재현 가능한 방법입니다. 이 프로토콜은 상업적으로 이용 가능한 하중 프레임 기기( 재료 표 참조)용으로 작성되었지만 유사한 시스템에 적용할 수 있습니다.
- 하중 프레임 기기와 호환되는 소프트웨어를 열고( 재료 표 참조) 기존 제어 파일을 선택하거나 새 파일을 생성합니다.
- 액츄에이터의 전원을 켭니다.
- 캘리브레이션 메뉴에서, 로드셀의 힘 판독값을 측정하고 액츄에이터의 변위를 0으로 설정합니다.
- 산소에 1%-4% 흡입 이소플루란을 사용하여 마우스를 마취하고 발가락 꼬집기 및/또는 꼬리 꼬집음으로 동물이 완전히 마취되도록 합니다.
- 마우스를 플랫폼의 엎드린 위치에 놓습니다. 두 개의 하중 고정 장치 사이에 아래쪽 다리를 수직으로 배치합니다(그림 1)( 재료 표 참조). 발을 상단 고정 장치의 컷아웃에 맞추고 무릎을 하단 고정 장치의 컵에 맞춥니다.
- 하단 고정 장치의 높이를 수동으로 조정하여 1-2N의 예압을 적용하고(컴퓨터 화면에서 실시간으로 모니터링됨) 고정 나사를 조여 위치를 고정합니다. 예압은 부상 하중을 가하기 전에 다리를 올바른 위치에 고정하는 데 필요합니다.
- 목표 하중(~12-15 N) 또는 목표 변위(~1.5-2.0 mm)에 단일 압축 하중을 가합니다.
알림: 더 느린 로딩 속도(~1mm/s)로 로드를 적용하면 더 높은 수준의 실시간 모니터링 및 제어가 제공되지만 ACL의 경련 실패가 발생할 수 있습니다. 더 빠른 하중 속도(~200mm/s)를 적용하면 중간 물질 전방십자인대 손상이 발생할 가능성이 더 높다22. 경골 골절 또는 기타 과도한 부상이 발생한 것으로 판단되면 동물이 마취에서 회복되기 전에 IACUC에서 승인한 방법을 사용하여 동물을 안락사시킵니다.- 소프트웨어 제어 파일에서 로딩 속도를 설정하고 힘 변위 데이터를 사용하여 확인합니다.
알림: 경골 압박 하중 중 골절은 일반적으로 골절력(~20N)이 전방십자인대 손상력보다 상당히 높기 때문에 문제가 되지 않습니다. 그러나 이는 촉진으로 모니터링해야 하며 영상(즉, X-ray)을 사용하여 경골 골절이 발생하지 않았는지 확인할 수 있습니다.
- 소프트웨어 제어 파일에서 로딩 속도를 설정하고 힘 변위 데이터를 사용하여 확인합니다.
- 부상은 일반적으로 소리("딸깍" 또는 "크런치")와 힘-변위 플롯에서 식별할 수 있는 힘의 방출로 표시됩니다(그림 1C). 더 느린 하중 속도를 사용하는 경우 부상 직후 압축 하중을 중지하여 추가 하중과 다른 관절 조직의 손상을 방지하십시오.
알림: 전방십자인대 손상은 일반적으로 체질량34에 따라 8-15N에서 발생합니다. 예상 전방십자인대 부상 힘보다 더 큰 목표 힘을 설정하는 것이 중요합니다. - 전방-후방 서랍 검사35,36 또는 관절 불안정성에 대한 유사한 평가를 사용하여 전방십자인대 손상을 확인합니다.
- 동물 체중 의존적 용량(예: 0.05-0.1mg/kg SC 또는 부프레노르핀의 IP, 재료 표 참조)을 가정 기관 IACUC에서 권장하고 승인한 기간 및 용량으로 부상 후 마우스에 투여합니다.
참고: NSAIDs는 부상 후 PTOA의 진행을 변경할 수 있으므로 연구의 특정 목적이 아닌 한 이 부상 모델에서 NSAIDs를 통증 관리에 사용하지 않는 것이 좋습니다.
2. FRI 이미징을 위한 동물 준비
알림: 광학 이미징의 경우 동물의 털(특히 어두운 털)은 빛을 차단, 흡수 및 산란시키는 데 매우 효과적이므로 이미징 전에 무릎 관절 주변 영역에서 털을 최대한 제거해야 합니다. 제모 크림은 일반적으로 클리퍼보다 털 제거에 더 효과적입니다. 벌거벗은 쥐나 털이 없는 쥐는 털을 제거할 필요가 없습니다. 그러나 가장 일반적으로 사용되는 마우스 균주(예: C57BL/6)의 경우 털 제거가 필요합니다. 가능하면 이미징 전에 생쥐에게 저형광 정제 식품을 먹이십시오. 표준 마우스 차우에는 약 700nm의 파장으로 자동 형광을 발하는 엽록소가 포함되어 있으며 근적외선 FRI 시스템의 데이터 수집에 영향을 미칠 수 있습니다.
- 산소에서 1%-4% 흡입된 이소플루란으로 마우스를 마취합니다. 가능한 한 발열 패드에 쥐를 두고 눈의 자극을 방지하기 위해 눈 연고를 바르십시오.
- 면봉을 사용하여 무릎 관절 주위 쥐 다리의 앞쪽(두개골) 측면에 제모 크림( 재료 표 참조)을 바릅니다.
- 크림을 ~1분 동안 그대로 둔 다음 물티슈를 사용하여 다리에서 크림과 털을 제거합니다. 필요한 경우 반복합니다.
- 무릎 관절이 완전히 노출되면 해당 부위를 덮는 털이 없어지면 알코올 물티슈로 다리를 닦아 남아 있는 제모 크림을 제거합니다.
참고: 제모 크림은 연구 기간 동안 동일한 마우스에 여러 번 사용할 수 있지만 피부의 불필요한 자극을 방지하기 위해 최소 1주일 간격으로 사용해야 합니다.
3. 프로브 용액의 준비
- 필요한 경우 제조업체의 지침에 따라 형광 활성 프로브를 멸균 1x 인산염 완충 식염수(PBS)로 희석합니다. 시판되는 프로브( 재료 표 참조)의 바이알 1개에는 일반적으로 1x PBS의 0.15mL에 20nmol이 포함되어 있습니다. 바이알에 있는 해결책을 묽게 하기 위하여는, 1x PBS의 1.5 mL에 있는 20 nmol를 만들기 위하여 1x PBS의 1.35 mL를 추가하십시오.
참고: 희석 후 마우스당 0.15mL를 주입할 때 하나의 바이알을 사용하여 10마리의 마우스를 이미징할 수 있습니다. - 최소 속도(~2000rpm)로 용액을 30초 동안 소용돌이쳐 프로브가 용액에 용해되도록 한 다음 모든 액체가 뚜껑에서 나오도록 잠시 원심분리합니다.
알림: 용액은 최대 2개월 동안 빛으로부터 보호되는 위치에 8-12°C에서 보관할 수 있습니다.
4. 역궤도 주입
참고: 이 절차의 세부 사항에 대해서는 Yardeni et al.참조 37.
- 산소에 1%-4% 흡입 이소플루란을 사용하여 쥐를 마취하고 주둥이를 코뿔에 대고 쥐를 옆으로 눕힙니다.
- 프로브 용액 주입을 위해 ~29G 인슐린 주사기를 사용합니다(3단계에서 준비).
- 빛에 노출되지 않도록 사용하기 전에 주사기를 덮어 두십시오.
- 주사를 투여할 때:
- 눈 안쪽(눈물샘)에 주사하고 주사기의 경사가 눈 쪽으로 기울어지도록 합니다. 오른손잡이의 경우 동물이 오른쪽을 향하도록 마우스의 오른쪽 눈에 주사하는 것이 좋습니다.
- 주사를 맞지 않는 손으로 눈 주위의 피부를 부드럽게 뒤로 당겨 머리를 안정시키고 눈을 돌출시킵니다.
- 주사기를 마우스 몸체와 평행하게 기울입니다.
- 주사기가 단단한 저항에 부딪힐 때까지 눈을 지나 주사기를 부드럽게 전진시킵니다. 이 지점을 지나치려고 하지 마십시오.
- 프로브 용액을 후안와 부비동에 천천히 주입한 다음 바늘을 안와에서 천천히 빼냅니다. 바늘로 용액이 나오지 않으면 주사가 성공한 것입니다.
- 주사한 눈에 식염수나 눈 연고를 바릅니다.
참고: 이미징 프로브와 함께 제공된 문서에 따르면 최적의 이미징 시간은 일반적으로 프로브 용액 주입 후 1일에서 2일 사이입니다. 가능하면 각 특정 응용 분야에 대한 최적의 이미징 시간을 결정하기 위해 초기 시간 스크리닝을 수행하는 것이 좋습니다. 마우스는 약 7일 이내에 주입된 프로브를 대사하며, 그 후 추가 시점이 필요한 경우 새로운 용량의 프로브 용액을 주입해야 합니다.
5. 형광 반사율 이미징
참고: 이 섹션의 절차는 상업적으로 이용 가능한 광학 이미징 시스템에만 해당됩니다( 재료 표 참조). 유사한 시스템을 사용하여 유사한 이미징을 수행할 수 있습니다.
- 산소에 1%-4% 흡입된 이소플루란으로 쥐를 마취하고 주둥이가 코콘에 있는 이미징 시스템에 동물을 앙와위 상태로 놓습니다.
- 무릎이 공중에서 약간 뾰족하도록 다리를 쭉 뻗은 상태에서 마우스를 배치합니다(발을 테이프로 감아야 할 수도 있음). 모든 동물에 대해 일관된 위치를 사용하는 것이 중요합니다.
- 이미징 시스템 컴퓨터에서 호환되는 소프트웨어( 재료 표 참조)를 엽니다. "Acquisition Control Panel"이 나타납니다.
- 시스템을 워밍업하려면 초기화 를 클릭하고 온도 표시등이 녹색으로 바뀔 때까지 기다립니다.
- 이미징 마법사를 클릭하고 "이미징 마법사" 창이 나타나는지 확인합니다.
- Filter Pair(필터 페어링)를 클릭하고 설정이 'Epi-Illumination'(에피 일루미네이션)인지 확인한 후 Next(다음)를 누릅니다.
- 올바른 여기/방출 설정을 선택하려면 풀다운 목록에서 관심 프로브를 찾으십시오. 올바른 프로브를 찾을 수 없는 경우 'Input Ex/Em'이라는 이름을 찾아 사용할 프로브의 속성에 따라 Excitation Peak 및 Emission Peak 값을 수동으로 입력합니다(예: Excitation Peak의 경우 675 입력, Emission Peak의 경우 720 입력). Next( 다음)를 클릭합니다.
- "Imaging Subject(이미징 피사체)"에서 Mouse(마우스 )를 선택합니다. "노출 매개변수"에서 자동 설정이 선택되어 있고 형광등 및 사진 옵션이 선택되어 있는지 확인합니다. "시야각"의 체크리스트에서 D-22.6 cm 를 선택합니다. 다음을 누릅니다.
- 이미징 설정은 "Acquisition Control Panel"의 오른쪽 패널에서 보고 수정할 수 있습니다. 모든 설정이 올바른지 확인하고 Acquire Sequence 버튼을 누릅니다. 이미지가 나타나면 이미지의 노출이 적절한지 확인합니다. 그렇지 않은 경우 노출 시간 설정을 변경하고 시퀀스 획득 을 다시 클릭합니다.
- 영상을 분석하려면 흑백 영상의 각 무릎 관절에 일정한 크기의 관심 영역(ROI) 원을 배치합니다(이렇게 하면 형광 신호 영역에 따라 편향된 위치 지정을 방지할 수 있음).
- 각 무릎 관절에 대한 총 복사 효율 및/또는 평균 복사 효율을 계산합니다. 복사 효율이 반대쪽 다리에서도 계산되는 경우 손상된 다리에 대한 복사 효율 측정값을 반대쪽 다리의 복사 효율 측정값으로 나누어 데이터를 정규화합니다.
알림: 모든 무릎에 일관된 면적을 가진 관심 영역을 사용하는 경우 총 복사 효율과 평균 복사 효율 모두 유사한 결과를 산출합니다. 크기가 다른 관심 영역을 사용하는 경우 평균 복사 효율을 사용하는 것이 좋습니다. 손상된 관절의 복사 효율 데이터를 손상되지 않은 반대쪽 무릎의 데이터와 정규화하면 주입된 프로브의 양과 서로 다른 동물 간의 전달 효율의 차이를 설명할 수 있는 내부 통제가 제공됩니다.
결과
3개월 된 수컷 C57BL/6J 마우스의 다리에 단일 압축력(손상될 때까지 1mm/s)을 가한 후, 모든 마우스에서 전방십자인대 손상이 일관되게 유발되었습니다. 무릎 부상 시 평균 압축력은 약 10N이었습니다(그림 1).
FRI 분석은 손상 후 7일에 비침습적 ACL 손상을 입은 마우스의 손상된 관절에서 프로테아제 활성이 유의하게 더 큰 것으로 나타났습니다(그림 2). 무릎 관절의 FRI 분석은 또한 비침습적 ACL 손상 직후 무릎 관절의 외과적 재안정화를 받은 마우스에 대해 수행되었으며, 이는 이전에 쥐35,36,38에서 기술된 것과 유사하다. 이 분석은 부상 후 2주 및 4주 동안 수술을 받지 않은 쥐보다 재안정화 수술을 받은 쥐에서 훨씬 더 큰 형광 신호를 보여주었습니다. 이러한 데이터는 침습적 수술 절차가 관절의 프로테아제 활성 분석을 혼란스럽게 할 수 있음을 시사합니다.
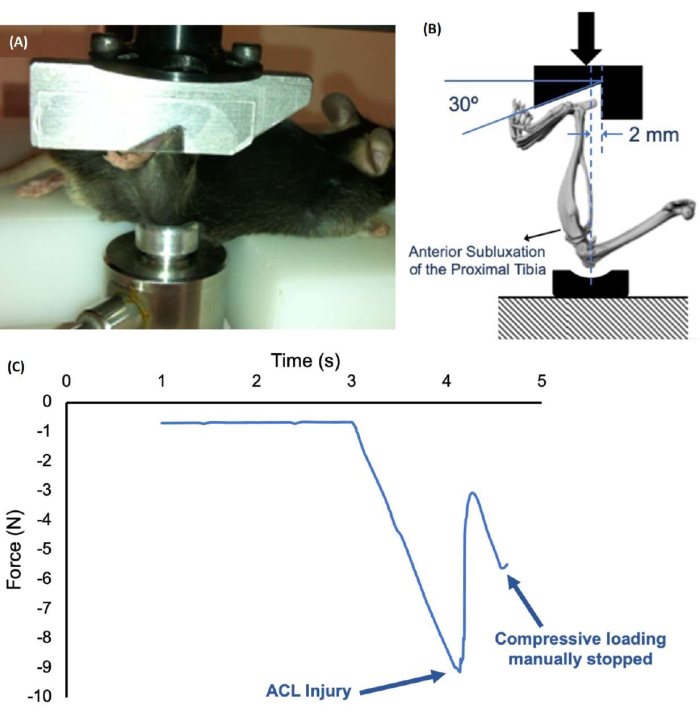
그림 1: 비침습적 전방십자인대 손상 설정 및 부상 중 힘-시간 플롯. (A,B) 마우스의 아래쪽 다리는 시스템에서 수직으로 위치하며, 발목은 상단 고정 장치의 노치에 배치되고 무릎 관절은 하단 고정 장치의 얕은 컵에 배치됩니다. 하단 고정 장치는 1-2N의 예압을 수동으로 적용한 후 고정 나사로 제자리에 고정됩니다. (C) 약 9N에서 ACL 손상을 보여주는 힘-변위 플롯. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 쥐 무릎 관절에서 프로테아제 활성을 감지하는 형광 반사 이미징. (A,B) 부상 후 다치지 않은(A) 마우스와 부상당한(B) 마우스의 대표 이미지. (C) 비침습적 전방십자인대 손상 후 1주일 동안 손상되지 않은 쥐와 부상당한 쥐에 대한 양쪽 무릎 관절의 평균 복사 효율. 손상된 관절은 반대쪽 관절 및 다치지 않은 쥐의 관절에 비해 평균 복사 효율이 43% 더 높았습니다. (D) 관절 재안정화 수술을 받은 비침습적으로 손상된 마우스 및 손상된 마우스에 대한 정규화된 총 복사 효율(R/L). ~30%-80% 더 큰 복사 효율은 부상 후 1-4주에 반대쪽 관절에 비해 손상된 관절에서 관찰되었습니다. 대조적으로, 외과적으로 수술된 관절은 반대쪽 관절에 비해 4주차에 ~300% 더 큰 복사 효율을 보였으며, 이는 수술의 현저한 교란 효과를 시사합니다. **P < 0.01. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 마우스20,21,24,33에서 ACL 손상을 유도하기 위한 재현 가능한, 비침습적 방법을 확립하고 엄격하게 기술하였다. 이 간단하고 효율적인 손상 분석법은 단 몇 분 만에 수행할 수 있어 PTOA의 고처리량 연구를 용이하게 합니다. 이 부상 방법은 또한 인간의 전방십자인대 손상과 관련된 부상 상태를 면밀히 요약합니다. 마우스에서 골관절염을 유도하기 위해 사용되는 수술적 방법은 손상 후 관절에서 프로테아제 활성의 시간 경과 및 크기를 측정하기 위한 생체 내 이미징 방법의 사용을 배제할 수 있습니다. 대조적으로, FRI와 결합된 비침습적 OA 마우스 모델(20년 검토)은 부상 후 마우스 무릎 관절에서 프로테아제 활성의 생체 내 이미징을 위한 고유한 기능을 제공합니다.
부상 후 염증 반응은 골관절염 진행에 매우 중요합니다. 그러나 관절의 염증을 분석하는 데 사용되는 방법은 일반적으로 비용이 많이 들고 시간이 많이 걸리며 파괴적입니다. 예를 들어, 역전사 중합효소 연쇄 반응(RT-PCR) 또는 RNAseq와 같은 기술을 사용하여 전체 관절, 개별 조직 또는 단일 세포에서 다양한 유전자를 정량화할 수 있습니다. 그러나 이 방법은 부상 및 손상되지 않은 무릎 관절을 얻기 위해 쥐를 안락사시켜야 합니다. 이러한 마우스는 프로테아제 반응이 최고조에 달한 초기 시점(즉, 손상 후 3-14일)과 골관절염이 더 심한 후기 시점(즉, 손상 후 4-6주)과 같은 여러 시점에서 분석할 수 없습니다. 대조적으로, 비침습적 관절 손상과 결합된 FRI는 생체내 마우스의 무릎 관절 내 여러 시점에서의 프로테아제 활성을 분석할 수 있는 능력을 제공한다 39. 이를 통해 동일한 마우스에 대한 종단 분석이 가능하며 FRI는 RT-PCR 또는 RNAseq보다 상대적으로 저렴한 결과입니다. 또한 여러 프로브 또는 타겟을 서로 다른 파장에서 동시에 이미징할 수 있으므로 다양한 목적에 대해 여러 결과를 제공할 수 있습니다. FRI를 사용하여 관절의 프로테아제 활성을 측정하는 것이 골관절염 진행 중에 발생하는 모든 염증 과정에 대한 엄격한 정량화를 제공하지는 않지만, 이 방법에 의해 제공되는 생체 내 및 종단 데이터는 관절 손상 후 염증성 프로테아제 활성의 크기 및 시간 경과를 추적하는 데 여전히 유용할 수 있습니다.
단백질 분해 효소 활성의 FRI 이미징에 사용되는 형광 활성화 프로브 용액은 정맥 주사(IV)로 전달되어야 합니다. 마우스에서 IV 주입을 수행하는 가장 일반적인 방법은 꼬리 정맥 주입과 역궤도 주입입니다. 후안와 주사는 종종 꼬리 정맥 주사보다 수행하기가 더 쉽고 필요한 주입량을 더 쉽게 촉진합니다. 문헌은 또한 후-안와 전달이 꼬리 정맥 주입(40)과 비교하여 약물 전달 또는 효능의 차이가 없이 마우스에게 스트레스를 덜 유발할 수 있음을 나타낸다. 이러한 결과는 역궤도 주입이 FRI 이미징을 위한 형광 활성화 프로브 용액을 주입하는 데 적합하다는 것을 시사합니다.
FRI의 해상도는 다른 이미징 기술에 비해 상대적으로 낮지만 정량적 결과는 골관절염 진행 중 염증성 단백질 분해 효소 반응의 시간 경과 및 크기에 대한 충분한 정보를 제공할 수 있습니다. 이 기술의 한계는 조직 자가형광이 결과에 영향을 미칠 수 있다는 것이지만 이 문제는 실험 전에 철저한 계획(프로브 유형, 마우스 변형, 동물 위치 등)으로 해결할 수 있습니다. 다른 전임상 이미징 방법(예: microPET, microSPECT, microCT, MRI)과 달리 FRI는 빛 투과 깊이가 제한되어 있기 때문에 마우스와 사람 간의 크기 차이로 인해 임상 이미징 방식으로 직접 변환할 수 없습니다. 그러나 설치류 모델을 사용한 전임상 연구에서는 무릎 관절이 피부에 밀착되어 연조직 커버리지가 최소화되었습니다. 결과적으로, FRI는 쥐의 무릎 관절에서 단백질 분해 효소 활성을 검출하는 데 효과적인 도구입니다.
결론적으로, 비침습적 전방십자인대 손상은 마우스에서 PTOA를 시작하는 간단하고 재현 가능한 방법을 제공합니다. 이 손상 방법은 또한 OA 진행 중 마우스 관절에서 염증성 프로테아제 활성의 시간 경과 및 크기를 생체 내에서 측정하기 위해 프로테아제 활성화 프로브 및 형광 반사 이미징의 사용을 용이하게 합니다. 향후 연구에서는 이러한 기술과 상업적으로 이용 가능한 여러 근적외선 형광 활성화 프로브를 사용하여 다양한 연령, 성별 및 유전적 배경을 가진 마우스의 OA 진행 메커니즘을 조사하거나 관절 손상 후 OA 진행을 늦추거나 예방하기 위한 잠재적 치료법을 평가할 수 있습니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 간행물에 보고된 연구는 미국 국립보건원(National Institutes of Health) 산하 국립관절염 및 근골격계 및 피부질환 연구소(National Institute of Arthritis and Musculoskeletal and Skin Diseases)의 지원을 받아 수상 번호 R01 AR075013에 따라 수행되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10x Phosphate-Buffered Saline | Tissue Protech | PBS01-32R | or equivalent |
| Air Anesthetia System | Isoflurane vaporizor with induction chamber and nose cone | ||
| Buprenorphine | Analgesic post-injury | ||
| Depilatory Cream | Veet | B001KYPZ4G | or equivalent |
| Fixtures | Custom-made knee fixture, ankle fixture, and platform | ||
| IVIS Spectrum | Perkin Elmer | 124262 | Can also use comparable optical imaging system |
| Kimwipes | Kimberly-Clark Corporation | 06-666 | or equivalent |
| Living Image software | Perkin Elmer | ||
| Materials testing systems | TA Instruments | Electroforce 3200 or equivalent | |
| ProSense680 | Perkin Elmer | NEV10003 | Can also use other probes such as OsteoSense, MMPSense, Cat K, AngioSense, etc. |
| Sterile Syringe with Needle | Spectrum Chemical Mfg. Corp. | 550-82231-CS | Covidien 1 mL TB Syringe with 28 G x 1/2 in. Needle, Sterile or equivalent |
| Uniaxial load cell | TA Instruments | 20 N capacity | |
| Vortex-Genie 2 | Scientific Industries, Inc. | SI-0236 | or equivalent |
| WinTest software | TA Instruments | compatible with Electroforce 3200 |
참고문헌
- Deshpande, B. R., et al. Number of persons with symptomatic knee osteoarthritis in the us: impact of race and ethnicity, age, sex, and obesity. Arthritis Care & Research (Hoboken. 68 (12), 1743-1750 (2016).
- Carbone, A., Rodeo, S. Review of current understanding of post-traumatic osteoarthritis resulting from sports injuries. Journal of Orthopaedic Research. 35 (3), 397-405 (2017).
- Thomas, A. C., Hubbard-Turner, T., Wikstrom, E. A., Palmieri-Smith, R. M. Epidemiology of posttraumatic osteoarthritis. Journal of Athletic Training. 52 (6), 491-496 (2017).
- Wang, L. J., Zeng, N., Yan, Z. P., Li, J. T., Ni, G. X. Post-traumatic osteoarthritis following ACL injury. Arthritis Research & Therapy. 22 (1), 57 (2020).
- Glasson, S. S., Blanchet, T. J., Morris, E. A. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse. Osteoarthritis Cartilage. 15 (9), 1061-1069 (2007).
- Kamekura, S. Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis Cartilage. 13 (7), 632-641 (2005).
- Ma, H. L., et al. Osteoarthritis severity is sex dependent in a surgical mouse model. Osteoarthritis Cartilage. 15 (6), 695-700 (2007).
- Malfait, A. M., et al. ADAMTS-5 deficient mice do not develop mechanical allodynia associated with osteoarthritis following medial meniscal destabilization. Osteoarthritis Cartilage. 18 (4), 572-580 (2010).
- Yang, S., et al. Hypoxia-inducible factor-2alpha is a catabolic regulator of osteoarthritic cartilage destruction. Nature Medicine. 16 (6), 687-693 (2010).
- Moodie, J. P., Stok, K. S., Muller, R., Vincent, T. L., Shefelbine, S. J. Multimodal imaging demonstrates concomitant changes in bone and cartilage after destabilisation of the medial meniscus and increased joint laxity. Osteoarthritis Cartilage. 19 (2), 163-170 (2011).
- Li, J., et al. Knockout of ADAMTS5 does not eliminate cartilage aggrecanase activity but abrogates joint fibrosis and promotes cartilage aggrecan deposition in murine osteoarthritis models. Journal of Orthopaedic Research. 29 (4), 516-522 (2011).
- Shapiro, F., Glimcher, M. J. Induction of osteoarthrosis in the rabbit knee joint. Clinical Orthopaedics and Related Research. 147, 287-295 (1980).
- Meacock, S. C., Bodmer, J. L., Billingham, M. E. Experimental osteoarthritis in guinea-pigs. Journal of Experimental Pathology (Oxford). 71 (2), 279-293 (1990).
- Armstrong, S. J., Read, R. A., Ghosh, P., Wilson, D. M. Moderate exercise exacerbates the osteoarthritic lesions produced in cartilage by meniscectomy: a morphological study. Osteoarthritis Cartilage. 1 (2), 89-96 (1993).
- Pastoureau, P., Leduc, S., Chomel, A., De Ceuninck, F. Quantitative assessment of articular cartilage and subchondral bone histology in the meniscectomized guinea pig model of osteoarthritis. Osteoarthritis Cartilage. 11 (6), 412-423 (2003).
- Wancket, L. M., et al. Anatomical localization of cartilage degradation markers in a surgically induced rat osteoarthritis model. Toxicologic Pathology. 33 (4), 484-489 (2005).
- Karahan, S., Kincaid, S. A., Kammermann, J. R., Wright, J. C. Evaluation of the rat stifle joint after transection of the cranial cruciate ligament and partial medial meniscectomy. Comparative Medicine. 51 (6), 504-512 (2001).
- Kamekura, S., et al. Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 13 (7), 632-641 (2005).
- Jones, M. D., et al. In vivo microfocal computed tomography and micro-magnetic resonance imaging evaluation of antiresorptive and antiinflammatory drugs as preventive treatments of osteoarthritis in the rat. Arthritis & Rheumatology. 62 (9), 2726-2735 (2010).
- Christiansen, B. A., et al. Non-invasive mouse models of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 23 (10), 1627-1638 (2015).
- Christiansen, B. A., et al. Musculoskeletal changes following non-invasive knee injury using a novel mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 20 (7), 773-782 (2012).
- Lockwood, K. A., Chu, B. T., Anderson, M. J., Haudenschild, D. R., Christiansen, B. A. Comparison of loading rate-dependent injury modes in a murine model of post-traumatic osteoarthritis. Journal of Orthopaedic Research. 32 (1), 79-88 (2014).
- Satkunananthan, P. B., et al. In vivo fluorescence reflectance imaging of protease activity in a mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 22 (10), 1461-1469 (2014).
- Hsia, A. W., et al. Post-traumatic osteoarthritis progression is diminished by early mechanical unloading and anti-inflammatory treatment in mice. Osteoarthritis Cartilage. 29 (12), 1709-1719 (2021).
- Zhang, H., et al. Biochromoendoscopy: molecular imaging with capsule endoscopy for detection of adenomas of the GI tract. Gastrointestinal Endoscopy. 68 (3), 520-527 (2008).
- Gounaris, E., et al. Live imaging of cysteine-cathepsin activity reveals dynamics of focal inflammation, angiogenesis, and polyp growth. PLoS One. 3 (8), e2916 (2008).
- Sheth, R. A., Mahmood, U. Optical molecular imaging and its emerging role in colorectal cancer. American Journal of Physiology-Gastrointestinal and Liver Physiology. 299 (4), G807-G820 (2010).
- Clapper, M. L., et al. Detection of colorectal adenomas using a bioactivatable probe specific for matrix metalloproteinase activity. Neoplasia. 13 (8), 685-691 (2011).
- Nahrendorf, M., et al. Dual channel optical tomographic imaging of leukocyte recruitment and protease activity in the healing myocardial infarct. Circulation Research. 100 (8), 1218-1225 (2007).
- Jaffer, F. A., et al. Optical visualization of cathepsin K activity in atherosclerosis with a novel, protease-activatable fluorescence sensor. Circulation. 115 (17), 2292-2298 (2007).
- Jaffer, F. A., Libby, P., Weissleder, R. Optical and multimodality molecular imaging: insights into atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (7), 1017-1024 (2009).
- Razansky, D., et al. Multispectral optoacoustic tomography of matrix metalloproteinase activity in vulnerable human carotid plaques. Molecular Imaging and Biology. 14 (3), 277-285 (2012).
- Hsia, A. W., et al. Osteophytes and fracture calluses share developmental milestones and are diminished by unloading. Journal of Orthopaedic Research. 36 (2), 699-710 (2018).
- Blaker, C. L., Little, C. B., Clarke, E. C. Joint loads resulting in ACL rupture: Effects of age, sex, and body mass on injury load and mode of failure in a mouse model. Journal of Orthopaedic Research. 35 (8), 1754-1763 (2017).
- Murata, K., et al. Controlling joint instability delays the degeneration of articular cartilage in a rat model. Osteoarthritis Cartilage. 25 (2), 297-308 (2017).
- Murata, K., et al. Controlling Abnormal joint movement inhibits response of osteophyte formation. Cartilage. 9 (4), 391-401 (2018).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Laboratory Animals (NY). 40 (5), 155-160 (2011).
- Kokubun, T., et al. Effect of changing the joint kinematics of knees with a ruptured anterior cruciate ligament on the molecular biological responses and spontaneous healing in a rat model. The American Journal of Sports Medicine. 44 (11), 2900-2910 (2016).
- Bhatti, F. U., et al. Characterization of non-invasively induced post-traumatic osteoarthritis in mice. Antioxidants (Basel). 11 (9), 1783 (2022).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Laboratory Animals (NY). 37 (1), 26-32 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유