Method Article
Анализ флуоресцентно окрашенных липидных капель с 3D-реконструкцией для оценки стеатоза печени
В этой статье
Резюме
Здесь мы демонстрируем оптимизированный протокол на основе флуоресценции BODIPY 493/503 для характеристики липидных капель в ткани печени. Благодаря использованию ортогональных проекций и 3D-реконструкций флуорофор позволяет успешно различать микровезикулярный и макровезикулярный стеатоз и может представлять собой дополнительный подход к классическим гистологическим протоколам оценки стеатоза печени.
Аннотация
Липидные капли (LD) представляют собой специализированные органеллы, которые опосредуют накопление липидов и играют очень важную роль в подавлении липотоксичности и предотвращении дисфункции, вызванной свободными жирными кислотами (FA). Печени, учитывая ее критическую роль в жировом обмене организма, постоянно угрожает внутриклеточное накопление ЛД в виде как микровезикулярного, так и макровезикулярного стеатоза печени. Гистологическая характеристика LD обычно основана на жирорастворимых диазокрасителях, таких как окрашивание Oil Red O (ORO), но ряд недостатков постоянно препятствует использованию этого анализа с образцами печени. Совсем недавно липофильные флуорофоры 493/503 стали популярными для визуализации и определения местоположения LD из-за их быстрого поглощения и накопления в нейтральном ядре липидных капель. Несмотря на то, что большинство применений хорошо описаны в клеточных культурах, существует меньше доказательств, демонстрирующих надежное использование липофильных флуорофорных зондов в качестве инструмента визуализации LD в образцах тканей. Здесь мы предлагаем оптимизированный протокол на основе дипиррометена бора (BODIPY) 493/503 для оценки LD в образцах печени из животной модели стеатоза печени, вызванного диетой с высоким содержанием жиров (HFD). Этот протокол охватывает подготовку образцов печени, срезы тканей, окрашивание BODIPY 493/503, получение изображений и анализ данных. Мы демонстрируем увеличение количества, интенсивности, соотношения площадей и диаметра печеночных ЛД при кормлении HFD. Используя ортогональные проекции и 3D-реконструкции, можно было наблюдать полное содержание нейтральных липидов в ядре LD, которые выглядели почти сферическими каплями. Кроме того, с помощью флуорофора BODIPY 493/503 мы смогли различить микровезикулы (1 мкм < d ≤ 3 мкм), промежуточные везикулы (3 мкм < d ≤ 9 мкм) и макровезикулы (d > 9 мкм), что позволило успешно различать микровезикулярный и макровезикулярный стеатоз. В целом, этот протокол BODIPY 493/503 на основе флуоресценции является надежным и простым инструментом для характеристики ЛД печени и может представлять собой дополнительный подход к классическим гистологическим протоколам.
Введение
Липидные капли (ЛД), классически рассматриваемые как энергетические депо, представляют собой специализированные клеточные органеллы, которые опосредуют накопление липидов, и они составляют гидрофобное нейтральное липидное ядро, которое в основном содержит сложные эфиры холестерина и триглицериды (ТГ), инкапсулированные фосфолипидным монослоем 1,2,3.
Биогенез ЛД происходит в эндоплазматическом ретикулуме (ЭР), начиная с синтеза триацилглицерина (ТАГ) и эфиров стерола. Нейтральные липиды диффундируют между листочками бислоя ER в низких концентрациях, но сливаются в масляные линзы, которые растут и превращаются в почти сферические капли из мембраны ER, когда их внутриклеточная концентрация увеличивается4. Впоследствии белки из бислоя ER и цитозоля, особенно семейства белков перилипина (PLIN), перемещаются на поверхности LD, чтобы облегчить почкование 5,6,7,8,9.
Благодаря синтезу новых жирных кислот и слиянию или слиянию LD LD вырастают до разных размеров. Соответственно, размер и количество LD значительно различаются в разных типах клеток. Мелкие капли (диаметром 300-800 нм), известные как начальные LD (iLDs), могут образовываться почти всеми клетками4. Позже при образовании LD большинство клеток способны превращать некоторые iLD в более крупные, расширяющиеся LD (eLDs >1 мкм в диаметре). Тем не менее, только определенные типы клеток, такие как адипоциты и гепатоциты, обладают способностью образовывать гигантские или сверхбольшие LD (до десятков микрон в диаметре)4,10.
ЛД играют очень важную роль в регуляции клеточного липидного обмена, подавляя липотоксичность и предотвращая стресс ER, митохондриальную дисфункцию и, в конечном итоге, гибель клеток, вызванную свободными жирными кислотами (ЖК)11,12,13,14. Кроме того, LD также участвуют в регуляции экспрессии генов, секвестрации белка репликации вируса, а также мембранного трафика и передачи сигналов15,16,17. Таким образом, нарушение регуляции биогенеза ЛД является отличительной чертой хронических заболеваний, связанных с метаболическим синдромом, ожирением, сахарным диабетом 2 типа (СД2) и/или атеросклерозом, и это лишь некоторые из них18,19,20.
Печень, как метаболический центр, в основном отвечает за липидный обмен путем хранения и переработки липидов, и, следовательно, ей постоянно угрожает липотоксичность21. Стеатоз печени (ГС) является общим признаком ряда прогрессирующих заболеваний печени и характеризуется чрезмерным внутриклеточным накоплением липидов в виде цитозольных ЛД, что, в конечном итоге, может привести к метаболической дисфункции печени, воспалению и запущенным формам неалкогольной жировой болезни печени22,23,24,25. HS возникает, когда скорость окисления и экспорта жирных кислот в виде триглицеридов в липопротеинах очень низкой плотности (ЛПОНП) ниже, чем скорость поглощения жирных кислот печенью из плазмы и синтеза жирных кислот de novo 26. Накопление липидов в печени часто происходит в двух формах - микровезикулярном и макровезикулярном стеатозе - и они проявляют различные цитоархитектонические характеристики27. Как правило, микровезикулярный стеатоз характеризуется наличием небольших ЛД, рассеянных по всему гепатоциту с центральным расположением ядра, тогда как макровезикулярный стеатоз характеризуется наличием одного большого ЛД, который занимает большую часть гепатоцита, выталкивая ядро на периферию28,29. Примечательно, что эти два типа стеатоза часто встречаются вместе, и остается неясным, как эти два паттерна LD влияют на патогенез заболевания, поскольку доказательства все еще противоречивы31,32,33,34. Тем не менее, такой тип анализа часто используется в качестве «эталонного стандарта» в доклинических и клинических исследованиях для понимания динамического поведения LD и характеристики стеатоза печени 29,34,35,36.
Биопсия печени, золотой стандарт диагностики и классификации ГС, обычно оценивается с помощью гистологического анализа гематоксилина и эозина (H & E), где липидные капли оцениваются как неокрашенные вакуоли в окрашенных H&E срезахпечени 37. Хотя этот тип окрашивания приемлем для оценки макровезикулярного стеатоза, он обычно сужает оценку микровезикулярного стеатоза38. Жирорастворимые диазокрасители, такие как Oil Red O (ORO), классически комбинируют с светлопольной микроскопией для анализа внутриклеточных запасов липидов, но они все еще имеют ряд недостатков: (i) использование этанола или изопропанола в процессе окрашивания, что часто вызывает разрушение нативных LD и случайное слияние, несмотря на то, что клетки фиксируются39; (ii) трудоемкий характер, поскольку раствор ORO требует растворения и фильтрации свежего порошка из-за ограниченного срока годности, что способствует менее стабильным результатам; (iii) и тот факт, что ORO окрашивает не только липидные капли, но и часто переоценивает стеатоз печени38.
Следовательно, проницаемые для клеток липофильные флуорофоры, такие как нильский красный, использовались либо в живых, либо в фиксированных образцах для преодоления некоторых из вышеупомянутых ограничений. Однако неспецифический характер маркировки клеточных липидных органелл неоднократно сужает оценки ЛД40. Кроме того, спектральные свойства Nile Red изменяются в зависимости от полярности окружающей среды, что часто может приводить к спектральным сдвигам41.
Липофильный флуоресцентный зонд 1,3,5,7,8-пентаметил-4-бора-3а,4адиаза-с-индацен (длина волны возбуждения: 480 нм; максимум излучения: 515 нм; BODIPY 493/503) проявляет характеристики гидрофобности, которые позволяют быстро поглощать его внутриклеточными ЛД, накапливается в ядре липидных капель и, впоследствии, испускает ярко-зеленую флуоресценцию12. В отличие от Nile Red, BODIPY 493/503 нечувствителен к полярности окружающей среды и, как было показано, более селективен, поскольку он демонстрирует высокую яркость для визуализации LD. Для окрашивания нейтральных LD этот краситель можно использовать в живых или фиксированных клетках и успешно сочетать с другими методами окрашивания и/или маркировки42. Еще одним преимуществом красителя является то, что он не требует особых усилий для помещения в раствор и является стабильным, что устраняет необходимость в его свежем приготовлении для каждого эксперимента42. Несмотря на то, что зонд BODIPY 493/503 был успешно использован для визуализации локализации и динамики LD в клеточных культурах, в некоторых отчетах также продемонстрировано надежное использование этого красителя в качестве инструмента визуализации LD в тканях, включая латеральную мышцу43 человека, камбаловидную мышцу 42 крысы и кишечник44 мыши.
Здесь мы предлагаем оптимизированный протокол на основе BODIPY 493/503 в качестве альтернативного аналитического подхода для оценки числа, площади и диаметра LD в образцах печени из животной модели стеатоза печени. Эта процедура охватывает подготовку образцов печени, срез тканей, условия окрашивания, получение изображений и анализ данных.
протокол
Все процедуры на животных, выполненные в этом исследовании, были одобрены Коимбрским институтом клинических и биомедицинских исследований (iCBR) и Органом по защите животных (ORBEA, #9/2018) и соответствовали национальным и европейским директивам по уходу за животными, а также рекомендациям ARRIVE.
1. Экспериментальный дизайн
- Парные 13-недельные самцы крыс Вистар в вентилируемых клетках в контролируемых условиях окружающей среды: температура (22 °C ± 1 °C), влажность (50% -60%) и свет (12 часов свет-темнота) и с свободным доступом к водопроводной воде и стандартному корму для грызунов.
- После 2-недельного периода акклиматизации произвольно распределяют крыс на две группы.
- Кормите контрольную (CTRL, n = 6) и группы с высоким содержанием жиров (HFD, n = 6) стандартным кормом и диетой с высоким содержанием жиров (45% ккал/жир) соответственно в течение 24 недель.
- Контролируйте массу тела (МТ) еженедельно. Записывайте ежедневное потребление еды и напитков на клетку.
2. Подготовка образцов печени
- Рассечение печени
- Подготовьте перистальтический насос: пропустите 70% этанола через трубку, подсоедините иглу 27 G к выходному концу трубки и заправьте трубку ледяным (4 °C) физиологическим раствором с фосфатным буфером (PBS, pH ~ 7,4) (например, 200 об/мин на перистальтическом насосе с внутренней силиконовой трубкой 1,6 мм, мини-капельный набор IV). Скорректируйте массу тела (например, для крысы весом 100-150 г используйте скорость потока примерно 10-12 мл / мин).
- Обезболивают крысу внутрибрюшинной инъекцией по протоколу анестезии (конечная концентрация кетамина = 75 мг/кг, конечная концентрация медетомидина = 1 мг/кг).
ПРИМЕЧАНИЕ: Убедитесь, что крыса полностью обезболена, используя метод реакции на ущипывание пальцев ног. - Поместите крысу на лоток для вскрытия.
- Тщательно продезинфицируйте мех 70% этанолом и высушите бумажным полотенцем.
- С помощью ножниц сделайте U-образный разрез через кожу и разрежьте ниже диафрагмы. Затем разрежьте грудную клетку рострально по краям, чтобы обнажить сердце.
- Во время работы 1x PBS пропустите иглу через левый желудочек в восходящую аорту и зажмите. Затем правое предсердие разрезают, чтобы обеспечить дренаж после начала перфузии.
ПРИМЕЧАНИЕ: Печень должна начать бледнеть, так как кровь заменяется PBS. - Используя ножницы и щипцы Дюмона, осторожно удалите печень и промойте 1x PBS.
- Переложите печень на чашку Петри и взвесьте ее.
- С помощью скальпеля соберите образцы печеночной ткани толщиной 5 мм с боковой стороны (1 см от края) левой доли печени для процесса встраивания.
ПРИМЕЧАНИЕ: Оставшуюся ткань можно хранить при температуре -80 °C для длительного хранения.
- Встраивание тканей печени
- Подготовьте контейнер для сухого льда и правильно маркируйте криоформы идентификатором образца и ориентацией.
- Поместите несколько капель матрицы для заделки крио в центр криомолда, чтобы обеспечить оптимальную температуру резки (OCT).
- Убедитесь, что образец ткани правильно ориентирован на поперечный срез.
ПРИМЕЧАНИЕ: Убедитесь, что сторона, касающаяся нижней части криомолда, является стороной, которая будет разделена первой. - Осторожно капните больше ОКТ на криомолд, пока он полностью не покроется. Старайтесь избегать образования пузырьков воздуха. При необходимости простыми щипцами удалите пузырьки внутри ОКТ.
- Быстро поместите криомолд с образцом, покрытым ОКТ, в контейнер с сухим льдом.
ПРИМЕЧАНИЕ: Ткани можно хранить при температуре -80 °C в течение 3 лет.
3. Секция замороженных тканей
- Отрегулируйте температуру криостата (камера: −21 °C; образец: −18 °C) и вставьте новое стерильное лезвие.
- Поместите образцы в криостат на 30 минут, прежде чем дать температуре уравновеситься.
- Нанесите один слой ОКТ на диск образца, чтобы обеспечить адгезию образца. Дайте ОКТ замерзнуть и установите образец ткани в желаемой ориентации.
ПРИМЕЧАНИЕ: Режущая поверхность должна быть параллельна лезвию. Чтобы сохранить хорошую адгезию, поместите тепловытяжку на верхнюю часть образца. Предыдущие шаги также можно выполнить в емкости с сухим льдом с сухим льдом. - Поместите образец в головку образца и обрежьте поверхность ткани (несколько участков образца ткани размером 30 мкм).
- Как только интересующая область станет доступной для секционирования, отрежьте срезы толщиной 12 мкм и поместите их на меченые предметные стекла микроскопа, хранящиеся при комнатной температуре (RT).
ПРИМЕЧАНИЕ: Чтобы собрать срез, медленно переместите слайд к срезу ткани. На каждом предметном стекле можно собрать два участка печени. - Дайте предметным стеклам высохнуть в течение 10 минут при RT.
ПРИМЕЧАНИЕ: Предметные стекла можно хранить при температуре -20 °C в течение 6-12 месяцев или при -80 °C до 3 лет.
4. Окрашивание BODIPY
- Разморозьте предметные стекла в системе окрашивания предметных стекол при RT в течение 30 минут.
- Стирайте 1x PBS (3x по 5 мин каждый).
- Обведите участок гидрофобным слоем с помощью барьерной ручки.
- Приготовьте исходный раствор BODIPY 493/503 500 мкг / мл: растворите 1 мг BODIPY 493/503 в 2 мл растворителя (90% ДМСО; 10% 1x PBS). Беречь от света. Ультразвук в ультразвуковой ванне в течение 1 ч (9,5-10 Вт) при 37 °C.
ПРИМЕЧАНИЕ: Раствор можно хранить при температуре -20 °C не менее 30 дней. - Приготовьте окрашивающий раствор BODIPY (1 мкг/мл), добавив 2 мкл исходного раствора BODIPY 493/503 и 0,1 мкл исходного раствора DAPI (5 мг/мл) к 997,9 мкл 1x PBS.
- Инкубируйте предметные стекла (75 мкл / предметное стекло) с BODIPY 493/503 (1 мкг / мл) и DAPI (0,1 мкг / мл) при RT в течение 40 минут.
ПРИМЕЧАНИЕ: С этого шага держите слайды в темноте. - Промойте предметные стекла 1x PBS (3x по 5 мин каждый).
- Установите слайды на покровные стекла с помощью флуоресцентной монтажной среды, дайте им высохнуть в течение 30 минут и запечатайте их лаком для ногтей.
ПРИМЕЧАНИЕ: Предметные стекла можно хранить при температуре 4 °C до получения изображения.
5. Количественная оценка липидов
- Измерьте уровень общего холестерина и ТГ в сыворотке крови с помощью автоматического, проверенного метода и оборудования.
- Измерьте уровень ТГ в печени с помощью набора для колориметрического анализа триглицеридов (таблица материалов) в соответствии с протоколом производителя.
6. Получение изображения
- Поместите предметное стекло на держатель предметного стекла конфокального микроскопа с лазерным сканированием.
- Для визуализации и получения изображений используйте конфокальный микроскоп с 20-кратным объективом (план-апохромат: 20x/0,8).
- Чтобы избежать перекрестных помех между BODIPY 493/503 и DAPI, используйте режим последовательного сканирования (наилучший сигнал) в конфокальном программном обеспечении.
- Возбудите BODIPY 593/503 с помощью линейки аргонового лазера с длиной волны 488 нм и DAPI с помощью лазерной линии с длиной волны 405 нм. Установите диапазоны излучения на 493-589 нм для BODIPY 493/503 и на 410-464 нм для DAPI.
- Используйте следующие настройки: точечное отверстие: 1 а.е., разрешение: 1,024 пикселей x 1,024 пикселя, битовая глубина: 12, размер пикселя: 0.415 мкм, двунаправленный режим, скорость сканирования: 7 (~1.58 мкс / пиксель для 20-кратного объектива), усреднение линии: 2x и цифровой зум: 1.
ПРИМЕЧАНИЕ: Вышеупомянутые параметры сканирования должны быть оптимизированы для каждого используемого конфокального микроскопа и объектива. - Установите усиление и цифровое усиление соответствующим образом, чтобы на индикаторе диапазона не обнаруживались насыщенные пиксели.
ПРИМЕЧАНИЕ: Исправьте фоновый сигнал, отрегулировав смещение. - После того, как LD будут правильно идентифицированы, получите изображение с помощью каналов BODIPY и DAPI.
ПРИМЕЧАНИЕ: Все снимки должны быть получены в одинаковых условиях (экспозиция и общие настройки) для каждого цветового канала. - Для создания широкоугольных изображений (рис. 2) измените объектив на объектив a10x (plan-neofluar: 10x/0.3).
- Выберите режим «Сканирование плиток» и сделайте мозаику из 5 на 5 изображений.
ПРИМЕЧАНИЕ: В этой работе каждая плитка имела перекрытие 10%, чтобы соответствующим образом объединить плитки для анализа. - Для создания 3D- и ортогональных видов (рис. 3A) нанесите каплю иммерсионного масла на верхнюю часть покровного стекла и замените объектив на 40-кратный объектив (план-неофлуар: 40x/1,30 масло).
- Выберите режим Z-Stack и, отрегулировав плоскость Z, определите первую и последнюю позиции для сбора данных с помощью оптического среза оптимальной толщины (~0,5 мкм), чтобы обеспечить захват всех капель.
ПРИМЕЧАНИЕ: Чтобы ускорить получение изображения и избежать обесцвечивания, оптический срез можно отрегулировать до неоптимального размера, обеспечивая передискретизацию не менее чем на 30% для хорошей 3D-реконструкции. - Выберите модуль «Орто » и создайте ортогональные виды.
- Получайте 3D-изображения, выбрав 3D-модуль в режиме прозрачного рендеринга с помощью программного обеспечения конфокального микроскопа.
7. Анализ изображений
- Обрабатывайте и анализируйте одноплоскостные изображения (20-кратное увеличение) с помощью CellProfiler (версия 4.2.5).
ПРИМЕЧАНИЕ: Конвейер, использованный в этой работе, был адаптирован из Adomshick et al.45. - Нажмите на модуль «Изображения» в верхнем левом углу окна CellProfiler и загрузите изображения в виде .tiff файлов.
- Используйте модуль NamesAndTypes для сортировки изображений, окрашенных BODIPY- (капля) и DAPI- (ядра) на основе имен файлов. Выполняйте анализ LD только с изображениями, окрашенными BODIPY.
- Чтобы начать построение конвейера, нажмите « Настроить модули» и выберите модуль ColorToGray , чтобы преобразовать изображения в изображения в оттенках серого.
ПРИМЕЧАНИЕ: Для идентификации объектов требуются изображения в оттенках серого. - Идентификация капель с помощью модуля IdentifyPrimaryObjects с использованием изображения в оттенках серого.
ПРИМЕЧАНИЕ: Параметры в этом модуле должны быть скорректированы для достижения хорошей идентификации LD. В этой работе определение LD размером от 6 до 300 пикселей и пороговым поправочным коэффициентом 1,0 привело к наиболее точной идентификации. - Чтобы измерить интенсивность пикселей идентифицированных липидных капель, добавьте модуль MeasureObjectIntensity .
- Добавьте дополнительный модуль FilterObjects , чтобы гарантировать, что количественно оцениваются только самые сильные сигналы, в то время как менее интенсивные сигналы исключаются из окончательного анализа липидных капель (минимальная интенсивность: 0,15; максимальная интенсивность: 1 произвольная единица).
- Чтобы измерить LD, связанные с выходными данными, добавьте модуль MeasureObjectSizeShape .
- На этом этапе добавьте модуль OverlayOutlines , чтобы наложить идентифицированную каплю на исходное изображение и, таким образом, обеспечить точное отображение сегментации и на необработанном изображении.
ПРИМЕЧАНИЕ: Это необязательный шаг (контроль качества). - Добавьте модуль ExportToSpreadsheet в конце и нажмите кнопку «Анализ изображений » в левом нижнем углу.
8. Статистический анализ
- Выразите результаты как среднее ± стандартную ошибку среднего значения (S.E.M.) с помощью любого программного обеспечения для статистического анализа.
ПРИМЕЧАНИЕ: В этом исследовании для статистического анализа использовалось программное обеспечение GraphPad. - Проанализируйте распределение значений с помощью критерия Колмогорова-Смирнова для оценки значимых отклонений от нормы. Проанализируйте параметрические данные с помощью непарного t-критерия Стьюдента.
ПРИМЕЧАНИЕ: Значения p < 0,05 считались статистически значимыми.
Результаты
Успешное выполнение этого метода должно привести к четкому окрашиванию липидных капель для одновременной характеристики морфологии LD (форма и плотность липидного ядра на основе 3D-реконструкции) вместе с их пространственным распределением, количеством на общую площадь и средним размером (оценивается с помощью описанного выше конвейера, рис. 1).
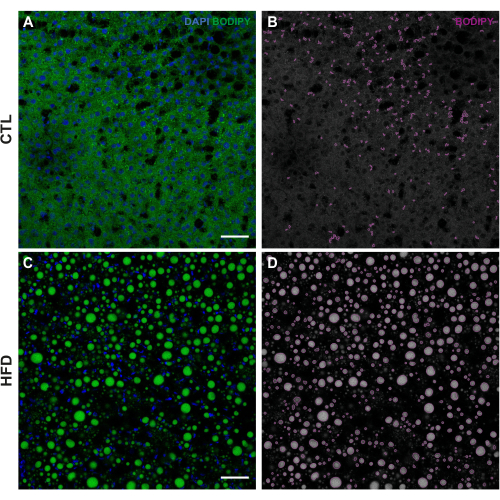
Рисунок 1: Пример обработки изображений с помощью CellProfiler . (A) Исходное изображение LD, окрашенных BODIPY 493/503 (зеленый), и ядер, окрашенных DAPI (синий), в группе CTL. (B) Дифференцированные LD (пурпурные) группы CTL были наложены с помощью модуля OverlayOutlines . (C) Исходное изображение LD, окрашенных BODIPY 493/503 (зеленый), и ядер, окрашенных DAPI (синий) в группе HFD. (D) Дифференцированные LD (пурпурные) группы HFD были наложены с помощью модуля OverlayOutlines . Изображения были получены с 20-кратным увеличением с помощью лазерного сканирующего конфокального микроскопа. Масштабные линейки = 50 мкм. Сокращения: CTL = контрольная группа; HFD = группа диеты с высоким содержанием жиров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Оценивали сывороточные ТГ, общий холестерин, ХС-ЛПНП, ХС-ЛПВП, а также содержание ТГ в печени (табл. 1). У животных, получавших HFD, наблюдался выраженный дислипидемический профиль, характеризующийся акцентированным накоплением печеночных ТГ (345% по сравнению с CTL, p < 0,001), а также незначительным увеличением уровня циркулирующих TG (129% по сравнению с CTL, p > 0,05).
| Параметр | CTL | ВЧД | |
| Сыворотка | |||
| Общий холестерин (мг / дл) | 56.67 ± 9.35 | 80.40 ± 7.45 | |
| ЛПНП (мг/дл) | 7.66 ± 0.84 | 7.40 ± 1.03 | |
| ЛПВП (мг/дл) | 17.83 ± 2.93 | 28.40 ± 2.40 * | |
| Триглицериды (мг/дл) | 154,8 ± 40,17 | 201,2 ± 38,12 | |
| Печень | |||
| Триглицериды (мг/г) | 15.29 ± 1.31 | 52.83 ± 6.73 *** |
Таблица 1: Сывороточные ТГ, общий холестерин, ХС-ЛПНП, ХС-ЛПВП и содержание ТГ в печени. Данные выражаются как среднее ± SEM (n = 5-6 на группу). p < 0,001 против CTL. Статистический анализ проводился с использованием непарного t-критерия Стьюдента. Сокращения: CTL = контрольная группа; HFD = группа диеты с высоким содержанием жиров.
На рисунке 2 показаны репрезентативные изображения с большой площадью (сканирование плиток с 10-кратным объективом) срезов печени, в которых LD окрашены BODIPY 493/503 (зеленый), а ядра окрашены DAPI (синий). Отдельные LD различных размеров были успешно визуализированы с помощью окрашивания BODIPY 493/503, которое показало широко распространенную картину распределения среди животных, которых кормили HFD.
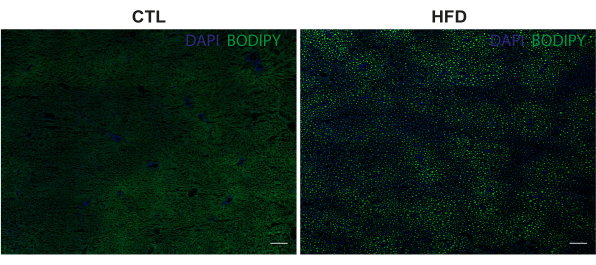
Рисунок 2: Репрезентативные изображения накопления LD в печеночной ткани. LD, окрашенные BODIPY 493/503 (зеленый), и ядра, окрашенные DAPI (синий). Изображения были получены с 10-кратным увеличением с помощью конфокального микроскопа с лазерной точечной сканировкой. Масштабные линейки = 200 мкм. Сокращения: CTL = контрольная группа; HFD = группа диеты с высоким содержанием жиров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На рисунке 3A показаны репрезентативные ортогональные проекции с 20-кратным объективом и 3D-изображения с 40-кратным объективом печеночных LD. Одноплоскостные изображения были обработаны и проанализированы с помощью CellProfiler (версия 4.2.5) для оценки интенсивности флуоресценции, количества, площади и диаметра LC (рис. 3B-E). Удалось подтвердить, что у животных, получавших HFD, наблюдалось повышенное количество печеночных LD (151% по сравнению с CTL, рис. 3B), и это было подтверждено увеличенной интенсивностью флуоресценции BODIPY 493/503 (182% по сравнению с CTL, p < 0,001, рис. 3C). Более того, отношение площадей LD почти утроилось (360% по сравнению с CTL, p < 0,0001, рис. 3D), поскольку они имели больший диаметр (182% по сравнению с CTL, рис. 3E) у животных, которых кормили HFD. Чтобы оценить распределение по размерам, LD были разделены на три группы в соответствии с диапазонами диаметров: 1 мкм < d ≤ 3 мкм, 3 мкм < d ≤ 9 мкм и d > 9 мкм (рис. 3F). У животных, получавших HFD, наблюдалось увеличение более чем на 20% количества сверхразмерных макровезикулярных LD в печени (d > 9 мкм, p < 0,0001), а также почти трехкратное сокращение количества микровезикул диаметром менее 3 мкм (1 мкм < d ≤ 3 мкм, p < 0,0001).
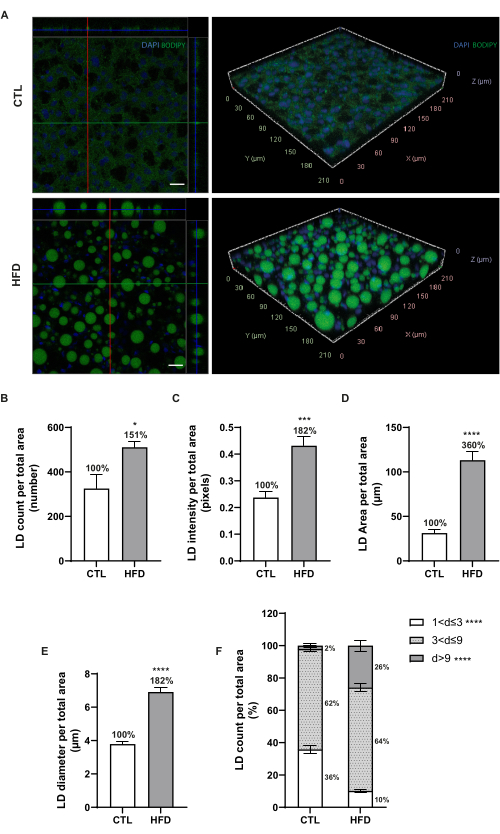
Рисунок 3: Ортогональные/3D-виды LD и анализ данных. (A) Репрезентативные ортогональные проекции и 3D-визуализационные изображения капель липидов печени (зеленый, BODIPY 493/503) и ядер (синий, DAPI) в печени мышей, получавших нормальную диету или HFD. Изображения были получены с 20-кратным (слева) и 40-кратным (справа) увеличением с помощью лазерного сканирующего конфокального микроскопа. Масштабные линейки = 20 мкм. (B) Количество печеночных LD. (C) Интенсивность флуоресценции печеночных LD. (D) Соотношение площадей печеночных LD. (E) Диаметры липидных капель. (F) Фракционные соотношения групп печеночных липидных капель разного диаметра: 1 мкм < d ≤ 3 мкм, 3 мкм < d ≤ 9 мкм и d > 9 мкм. Данные представлены в виде средних ± SEM. n = 5-6 мышей на группу; * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001. Статистический анализ проводился с использованием непарного t-критерия Стьюдента. Сокращения: CTL = контрольная группа; HFD = группа диеты с высоким содержанием жиров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол BODIPY 493/503 на основе флуоресценции для оценки LD был направлен на разработку нового подхода к визуализации для оценки стеатоза печени. Учитывая сильную корреляцию между ожирением и жировой болезнью печени, диета с высоким содержанием жиров в западном стиле была использована для создания животной модели стеатоза печени26. Устойчивое увеличение содержания ТГ в печени было подтверждено набором для количественного колориметрического анализа триглицеридов, который предполагал сценарий повышенного липидоза печени у животных, получавших HFD. В дальнейшем степень накопления ЛД визуализировалась флуоресцентным зондом BODIPY 493/503 при малом увеличении. Как и ожидалось, окрашивание BODIPY 493/503 выявило широкое распределение везикулярных структур по ткани печени в группе HFD. Прибегая к ортогональным проекциям и 3D-реконструкциям, можно было наблюдать, что ядро LD представляло полное содержание нейтральных липидов, которые выглядели как почти сферические капли. Кроме того, было отчетливо видно устойчивое увеличение площади ЛД на общую площадь (360% по сравнению с группой СТЛ), и эта область, скорее всего, была заполнена нейтральными ТГ, учитывая их количественный балл в группе ВЧУ (52,83 мг/г ± 6,73 мг/г; 346% по сравнению с группой СТЛ). Для дальнейшей характеристики динамики ЛД при кормлении HFD был проанализирован микро- или макровезикулярный характер стеатоза печени. Используя диапазоны диаметров LD, ранее описанные в литературе 4,46,47, можно было различить значительное снижение количества микровезикулярных LD (1 мкм < d ≤ 3 мкм), которое соответствовало пропорциональному увеличению макровезикул LD (d > 9 мкм). В нескольких исследованиях сообщалось, что ЛД в гепатоцитах могут образовывать ЛД большого размера (до десятков микрон в диаметре)4,46,47, что соответствует настоящим результатам.
В последние годы классические липидные красители постепенно заменяются новым набором флуоресцентных липофильных зондов, таких как BODIPY, учитывая их нейтральную и плоскую структуру, стабилизированную дифторборным комплексом48; Было показано, что эти зонды очень эффективны при маркировке LD для изучения их морфологии, динамики и взаимодействия с другими органеллами в живых клетках и некоторых фиксированных тканях49,50. В рамках протокола флуоресцентных липидных капель, представленного здесь для оценки стеатоза печени, есть несколько критических шагов для успеха метода, которые в основном полагаются на подготовку ткани и получение изображения. Поскольку сигнал BODIPY может быть обесцвечен ультрафиолетовым светом51, получение изображения LD должно происходить перед визуализацией других флуоресцентных красителей, которые возбуждаются ультрафиолетовым светом, таких как широко известные флуоресцентные красители ДНК. Кроме того, настоятельно рекомендуется защищать предметные стекла микроскопа от воздействия света, чтобы предотвратить гашение флуоресценции BODIPY перед визуализацией. Несмотря на то, что 3D-реконструкция LD очень полезна для изучения их морфологии, она занимает чрезвычайно много времени, поскольку 3D-реконструированные изображения состоят из нескольких независимых 2D-изображений. Поэтому исследователям следует избегать этого шага, когда основной целью эксперимента является исключительно оценка микро- и макровезикулярного стеатоза печени. Чтобы избежать предвзятости, два независимых наблюдателя, слепых к группе лечения, должны провести сбор и анализ данных. Полуавтоматическое программное обеспечение для обработки изображений (конвейер Cell Profiler) также способствует полуслепой количественной оценке и преодолевает увеличенное время обработки, постоянно наблюдаемое при ручном анализе.
Этот метод может быть распространен на более широкие применения в сочетании с иммуногистохимическим окрашиванием других тканей и видов, при условии, что оптимальные концентрации BODIPY и настройки получения изображений были определены для максимизации соотношения сигнал/фон. Такие экспериментальные установки могут позволить одновременное обнаружение других антигенов при условии, что второй используемый флуорофор не перекрывается со спектрами возбуждения/излучения БОДИПИ.
В целом, оптимизированный протокол на основе флуоресценции BODIPY 493/503, представленный в настоящем документе, является надежным и простым инструментом для характеристики ЛД и может представлять собой дополнительный подход к классическим гистологическим протоколам, часто используемым для подтверждения и классификации стеатоза печени.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Это исследование финансировалось национальными и европейскими фондами через Португальский научно-технический фонд (FCT), Европейский фонд регионального развития (FEDER) и Programa Operacional Factores de Competitividade (COMPETE): 2020.09481.BD, UIDP/04539/2020 (CIBB) и POCI-01-0145-FEDER-007440. Авторы хотели бы поблагодарить за поддержку iLAB - Лабораторию микроскопии и биовизуализации, учреждение медицинского факультета Университета Коимбры и члена национальной инфраструктуры PPBI-Португальская платформа биовизуализации (POCI-01-0145-FEDER-022122), а также поддержку со стороны FSE CENTRO-04-3559-FSE-000142.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.6 mm I.D. silicone tubing, I.V mini drip set | Fisher Scientific | ||
| 4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno (BODIPY 493/503) | Sigma-Aldrich, Lyon, France | D3922 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes Inc, Invitrogen, Eugene, OR | D1306 | |
| 70% ethanol | Honeywell | 10191455 | |
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Automatic analyzer Hitachi 717 | Roche Diagnostics Inc., Mannheim, Germany | 8177-30-0010 | |
| Barrier pen (Liquid blocker super pap pen) | Daido Sangyo Co., Ltd, Japon | _ | |
| Blade | Leica | 221052145 | Used in the cryostat |
| Cell Profiler version 4.2.5 | https://cellprofiler.org/releases/ | Used to analyse the acquired images | |
| Coverslips | Menzel-Glaser, Germany | _ | |
| Cryomolds | Tissue-Tek | _ | |
| Cryostat (including specimen disc and heat extractor) CM3050 S | Leica Biosystems | _ | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich, Lyon, France | D-8418 | Used to dissolve Bodipy for the 5 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Dry ice container (styrofoam cooler) | Novolab | A26742 | |
| Dumont forceps | Fine Science Tools, Germany | 11295-10 | |
| Glass Petri dish (H 25 mm, ø 150 mm) | Thermo Scientific | 150318 | Used to weigh the liver after dissection |
| Glycergel | DAKO Omnis | S303023 | |
| GraphPad Prism software, version 9.3.1 | GraphPad Software, Inc., La Jolla, CA, USA | ||
| High-fat diet | Envigo, Barcelona, Spain | MD.08811 | |
| Ketamine (Nimatek 100 mg/mL) | Dechra | 791/01/14DFVPT | Used at a final concentration of 75 mg/kg |
| Laser scanning confocal microscope (QUASAR detection unit; ) | Carl Zeiss, germany | LSM 710 Axio Observer Z1 microscope | |
| Medetomidine (Sedator 1 mg/mL) | Dechra | 1838 ESP / 020/01/07RFVPT | Used at a final concentration of 1 mg/kg |
| Needle | BD microlance | 300635 | |
| No 15 Sterile carbon steel scalpel Blade | Swann-Morton | 205 | |
| Objectives 10x (Plan-Neofluar 10x/0.3), 20x (Plan-Apochromat 20x/0.8) and 40x (Plan-Neofluar 40x/1.30 Oil) | Carl Zeiss, Germany | ||
| Paint brushes | Van Bleiswijck Amazon B07W7KJQ2X | Used to handle cryosections | |
| Peristaltic pump (Minipuls 3) | Gilson | 1004170 | |
| Phosphate-buffered saline (PBS, pH ~ 7.4) | Sigma-Aldrich, Lyon, France | P3813 | |
| Scalpel handle, 125 mm (5"), No. 3 | Swann-Morton | 0208 | |
| Slide staining system StainTray | Simport Scientific | M920 | |
| Standard diet | Mucedola | 4RF21 | |
| Superfrost Plus microscope slides | Menzel-Glaser, Germany | J1800AMNZ | |
| Tissue-Tek OCT mounting media | VWR CHEMICALS | 361603E | |
| Triglycerides colorimetric assay kit | Cayman Chemical | 10010303 | |
| Ultrasonic bath | Bandelin Sonorex | TK 52 | |
| Vannas spring scissors - 3 mm cutting edge | Fine Science Tools, Germany | 15000-00 | |
| ZEN Black software | Zeiss |
Ссылки
- Klemm, R. W., Ikonen, E. The cell biology of lipid droplets: More than just a phase. Seminars in Cell & Developmental Biology. 108, 1-3 (2020).
- Martin, S., Parton, R. G. Lipid droplets: A unified view of a dynamic organelle. Nature Reviews Molecular Cell Biology. 7 (5), 373-378 (2006).
- Thiele, C., Penno, A., Bradshaw, R. A., Stahl, P. D. Lipid droplets. Encyclopedia of Cell Biology. , 273-278 (2016).
- Gluchowski, N. L., Becuwe, M., Walther, T. C., Farese, R. V. Lipid droplets and liver disease: From basic biology to clinical implications. Nature Reviews Gastroenterology & Hepatology. 14 (6), 343-355 (2017).
- Bickel, P. E., Tansey, J. T., Welte, M. A. PAT proteins, an ancient family of lipid droplet proteins that regulate cellular lipid stores. Biochimica et Biophysica Acta. 1791 (6), 419-440 (2009).
- Olzmann, J. A., Carvalho, P. Dynamics and functions of lipid droplets. Nature Reviews. Molecular Cell Biology. 20 (3), 137-155 (2019).
- Wang, L., Liu, J., Miao, Z., Pan, Q., Cao, W. Lipid droplets and their interactions with other organelles in liver diseases. The International Journal of Biochemistry & Cell Biology. 133, 105937 (2021).
- Carr, R. M., Ahima, R. S. Pathophysiology of lipid droplet proteins in liver diseases. Experimental Cell Research. 340 (2), 187-192 (2016).
- Jackson, C. L. Lipid droplet biogenesis. Current Opinion in Cell Biology. 59, 88-96 (2019).
- Onal, G., Kutlu, O., Gozuacik, D., Dokmeci Emre, S. Lipid droplets in health and disease. Lipids in Health and Disease. 16 (1), 128 (2017).
- Wang, H., Quiroga, A. D., Lehner, R., Yang, H., Li, P. Lipid Droplets. Methods in Cell Biology. , 107-127 (2013).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Welte, M. A., Gould, A. P. Lipid droplet functions beyond energy storage. Biochimica et Biophysica Acta. Molecular and Cell Biology of Lipids. 1862 (10), 1260-1272 (2017).
- Roberts, M. A., Olzmann, J. A. Protein quality control and lipid droplet metabolism). Annual Review of Cell and Developmental Biology. 36, 115-139 (2020).
- Filali-Mouncef, Y., et al. The ménage à trois of autophagy, lipid droplets and liver disease. Autophagy. 18 (1), 50-72 (2022).
- Bandyopadhyay, D., et al. Lipid droplets promote phase separation of Ago2 to accelerate Dicer1 loss and decelerate miRNA activity in lipid exposed hepatic cells. bioRxiv. , (2020).
- Farías, M. A., Diethelm-Varela, B., Navarro, A. J., Kalergis, A. M., González, P. A. Interplay between lipid metabolism, lipid droplets, and DNA virus infections. Cells. 11 (14), 2224 (2022).
- Krahmer, N., Farese, R. V., Walther, T. C. Balancing the fat: Lipid droplets and human disease. EMBO Molecular Medicine. 5 (7), 973-983 (2013).
- Greenberg, A. S., et al. The role of lipid droplets in metabolic disease in rodents and humans. The Journal of Clinical Investigation. 121 (6), 2102-2110 (2011).
- Xu, S., Zhang, X., Liu, P. Lipid droplet proteins and metabolic diseases. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1864 (5), 1968-1983 (2018).
- Herms, A., et al. Cell-to-cell heterogeneity in lipid droplets suggests a mechanism to reduce lipotoxicity. Current Biology. 23 (15), 1489-1496 (2013).
- Hooper, A. J., Adams, L. A., Burnett, J. R. Genetic determinants of hepatic steatosis in man. Journal of Lipid Research. 52 (4), 593-617 (2011).
- Parafati, M., Kirby, R. J., Khorasanizadeh, S., Rastinejad, F., Malany, S. A nonalcoholic fatty liver disease model in human induced pluripotent stem cell-derived hepatocytes, created by endoplasmic reticulum stress-induced steatosis. Disease Models & Mechanisms. 11 (9), (2018).
- Nassir, F., Rector, R. S., Hammoud, G. M., Ibdah, J. A. Pathogenesis and prevention of hepatic steatosis. Gastroenterology & Hepatology. 11 (3), 167-175 (2015).
- Starekova, J., Reeder, S. B. Liver fat quantification: Where do we stand. Abdominal Radiology. 45 (11), 3386-3399 (2020).
- Fabbrini, E., Sullivan, S., Klein, S. Obesity and nonalcoholic fatty liver disease: Biochemical, metabolic, and clinical implications. Hepatology. 51 (2), 679-689 (2010).
- Kristiansen, M. N. B., Veidal, S. S., Christoffersen, C., Jelsing, J., Rigbolt, K. T. G. Molecular characterization of microvesicular and macrovesicular steatosis shows widespread differences in metabolic pathways. Lipids. 54 (1), 109-115 (2019).
- Tsutsumi, V., Nakamura, T., Ueno, T., Torimura, T., Aguirre-García, J., Muriel, P. Chapter 2: Structure and ultrastructure of the normal and diseased liver. Liver Pathophysiology. , 23-44 (2017).
- Tandra, S., et al. Presence and significance of microvesicular steatosis in nonalcoholic fatty liver disease. Journal of Hepatology. 55 (3), 654-659 (2011).
- Nascimbeni, F., et al. Clinical relevance of liver histopathology and different histological classifications of NASH in adults. Expert Review of Gastroenterology & Hepatology. 12 (4), 351-367 (2018).
- Yerian, L. Histopathological evaluation of fatty and alcoholic liver diseases. Journal of Digestive Diseases. 12 (1), 17-24 (2011).
- Stöppeler, S., et al. Gender and strain-specific differences in the development of steatosis in rats. Laboratory Animals. 47 (1), 43-52 (2013).
- Hübscher, S. G., Saxena, R. Alcohol-induced liver disease. Practical Hepatic Pathology: A Diagnostic Approach (Second Edition). , 371-390 (2018).
- Sethunath, D., et al. Automated assessment of steatosis in murine fatty liver. PLoS One. 13 (5), e0197242 (2018).
- Sinton, M. C., et al. Macrovesicular steatosis in nonalcoholic fatty liver disease is a consequence of purine nucleotide cycle driven fumarate accumulation. bioRxiv. , (2020).
- de Conti, A., et al. Characterization of the variability in the extent of nonalcoholic fatty liver induced by a high-fat diet in the genetically diverse collaborative cross mouse model. The FASEB Journal. 34 (6), 7773-7785 (2020).
- Virarkar, M., Szklaruk, J., Jensen, C. T., Taggart, M. W., Bhosale, P. What's new in hepatic steatosis. Seminars in Ultrasound, CT and MRI. 42 (4), 405-415 (2021).
- Le, T. T., Ziemba, A., Urasaki, Y., Brotman, S., Pizzorno, G. Label-free evaluation of hepatic microvesicular steatosis with multimodal coherent anti-Stokes Raman scattering microscopy. PLoS One. 7 (11), e51092 (2012).
- Fam, T. K., Klymchenko, A. S., Collot, M. Recent advances in fluorescent probes for lipid droplets. Materials. 11 (9), 1768 (2018).
- Rumin, J., et al. The use of fluorescent Nile red and BODIPY for lipid measurement in microalgae. Biotechnology for Biofuels. 8 (1), 42 (2015).
- Daemen, S., van Zandvoort, M. A. M. J., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2015).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine & Biotechnology. 2011, 598358 (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), e77774 (2013).
- Nakano, T., et al. Ezetimibe impairs transcellular lipid trafficking and induces large lipid droplet formation in intestinal absorptive epithelial cells. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1865 (12), 158808 (2020).
- Adomshick, V., Pu, Y., Veiga-Lopez, A. Automated lipid droplet quantification system for phenotypic analysis of adipocytes using CellProfiler. Toxicology Mechanisms and Methods. 30 (5), 378-387 (2020).
- Moon, J., et al. Intravital longitudinal imaging of hepatic lipid droplet accumulation in a murine model for nonalcoholic fatty liver disease. Biomedical Optics Express. 11 (9), 5132-5146 (2020).
- Martinez-Lopez, N., Singh, R. Autophagy and lipid droplets in the liver. Annual Review of Nutrition. 35, 215-237 (2015).
- Collot, M., et al. Ultrabright and fluorogenic probes for multicolor imaging and tracking of lipid droplets in cells and tissues. Journal of the American Chemical Society. 140 (16), 5401-5411 (2018).
- Selvais, C. M., De Cock, L. L., Brichard, S. M., Davis-Lopez de Carrizosa, M. A. Fiber type and subcellular-specific analysis of lipid droplet content in skeletal muscle. Journal of Visualized Experiments: Jove. (184), e63718 (2022).
- Zhuang, H., et al. Long-term high-fat diet consumption by mice throughout adulthood induces neurobehavioral alterations and hippocampal neuronal remodeling accompanied by augmented microglial lipid accumulation. Brain, Behavior, and Immunity. 100, 155-171 (2022).
- Chen, J., Yue, F., Kuang, S. Labeling and analyzing lipid droplets in mouse muscle stem cells. STAR Protocols. 3 (4), 101849 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены