Method Article
Analyse de gouttelettes lipidiques colorées par fluorescence avec reconstruction 3D pour l’évaluation de la stéatose hépatique
Dans cet article
Résumé
Ici, nous démontrons un protocole optimisé basé sur la fluorescence BODIPY 493/503 pour la caractérisation des gouttelettes lipidiques dans le tissu hépatique. Grâce à l’utilisation de projections orthogonales et de reconstructions 3D, le fluorophore permet une discrimination réussie entre la stéatose microvésiculeuse et macrovésiculeuse et peut représenter une approche complémentaire aux protocoles histologiques classiques pour l’évaluation de la stéatose hépatique.
Résumé
Les gouttelettes lipidiques (LD) sont des organites spécialisés qui interviennent dans le stockage des lipides et jouent un rôle très important dans la suppression de la lipotoxicité et la prévention du dysfonctionnement causé par les acides gras libres (AG). Le foie, compte tenu de son rôle essentiel dans le métabolisme des graisses du corps, est constamment menacé par l’accumulation intracellulaire de LD sous forme de stéatose hépatique microvésiculaire et macrovésiculaire. La caractérisation histologique des LD est généralement basée sur des colorants diazoélectriques liposolubles, tels que la coloration Oil Red O (ORO), mais un certain nombre d’inconvénients entravent systématiquement l’utilisation de cette analyse avec des échantillons de foie. Plus récemment, les fluorophores lipophiles 493/503 sont devenus populaires pour visualiser et localiser les LD en raison de leur absorption et de leur accumulation rapides dans le noyau de gouttelettes lipidiques neutres. Même si la plupart des applications sont bien décrites dans les cultures cellulaires, il y a moins de preuves démontrant l’utilisation fiable des sondes fluorophores lipophiles comme outil d’imagerie LD dans les échantillons de tissus. Nous proposons ici un protocole optimisé basé sur le dipyrrométène de bore (BODIPY) 493/503 pour l’évaluation des LD dans des échantillons de foie à partir d’un modèle animal de stéatose hépatique induite par un régime riche en graisses (HFD). Ce protocole couvre la préparation des échantillons de foie, la section des tissus, la coloration BODIPY 493/503, l’acquisition d’images et l’analyse des données. Nous démontrons une augmentation du nombre, de l’intensité, du rapport de surface et du diamètre des LD hépatiques lors de l’alimentation HFD. En utilisant des projections orthogonales et des reconstructions 3D, il a été possible d’observer la teneur complète en lipides neutres dans le noyau LD, qui apparaissait comme des gouttelettes presque sphériques. De plus, avec le fluorophore BODIPY 493/503, nous avons pu distinguer des microvésicules (1 μm < j ≤ 3 μm), des vésicules intermédiaires (3 μm < d ≤ 9 μm) et des macrovésicules (d > 9 μm), permettant la discrimination réussie de la stéatose microvésiculaire et macrovésiculaire. Dans l’ensemble, ce protocole basé sur la fluorescence BODIPY 493/503 est un outil fiable et simple pour la caractérisation hépatique de la LD et peut représenter une approche complémentaire aux protocoles histologiques classiques.
Introduction
Les gouttelettes lipidiques (LD), classiquement considérées comme des dépôts d’énergie, sont des organites cellulaires spécialisés qui interviennent dans le stockage des lipides, et elles comprennent un noyau lipidique neutre hydrophobe, qui contient principalement des esters de cholestérol et des triglycérides (TG), encapsulés par une monocouche phospholipide 1,2,3.
La biogenèse de la LD se produit dans le réticulum endoplasmique (RE), en commençant par la synthèse du triacylglycérol (TAG) et des esters stéroliques. Les lipides neutres sont diffusés entre les folioles de la bicouche ER à de faibles concentrations, mais fusionnent en lentilles d’huile qui se développent et bourgeonnent en gouttelettes presque sphériques de la membrane ER lorsque leur concentration intracellulaire augmente4. Par la suite, les protéines de la bicouche ER et du cytosol, en particulier la famille des protéines perilipin (PLIN), se transloquent à la surface des LD pour faciliter le bourgeonnement 5,6,7,8,9.
Grâce à la synthèse de nouveaux acides gras et à la fusion ou à la coalescence des LD, les LD atteignent différentes tailles. Par conséquent, la taille et le nombre de TA diffèrent considérablement d’un type de cellules à l’autre. De petites gouttelettes (300-800 nm de diamètre), connues sous le nom de LD initiales (iLD), peuvent être formées par presque toutes les cellules4. Plus tard dans la formation de LD, la plupart des cellules sont capables de convertir certaines iLD en LD plus grandes en expansion (eLDs >1 μm de diamètre). Pourtant, seuls des types cellulaires spécifiques, tels que les adipocytes et les hépatocytes, ont la capacité de former des LD géantes ou surdimensionnées (jusqu’à des dizaines de microns de diamètre)4,10.
Les LD jouent un rôle très important dans la régulation du métabolisme des lipides cellulaires, la suppression de la lipotoxicité et la prévention du stress des urgences, du dysfonctionnement mitochondrial et, finalement, de la mort cellulaire causée par les acides gras libres (AG)11,12,13,14. En outre, les LD ont également été impliqués dans la régulation de l’expression génique, la séquestration des protéines de réplication virale et le trafic et la signalisationmembranaires 15,16,17. Par conséquent, la mauvaise régulation de la biogenèse de la ML est une caractéristique des maladies chroniques associées au syndrome métabolique, à l’obésité, au diabète sucré de type 2 (DT2) et / ou à l’artériosclérose, pour n’en nommer quequelques-unes 18,19,20.
Le foie, en tant que plaque tournante métabolique, est principalement responsable du métabolisme des lipides en stockant et en traitant les lipides et, par conséquent, il est constamment menacé par la lipotoxicité21. La stéatose hépatique (SH) est une caractéristique commune d’une série de maladies hépatiques progressives et se caractérise par une accumulation excessive de lipides intracellulaires sous forme de LD cytosoliques qui, en fin de compte, peuvent entraîner un dysfonctionnement métabolique hépatique, une inflammation et des formes avancées de stéatose hépatique non alcoolique22,23,24,25. L’HS se produit lorsque le taux d’oxydation et d’exportation des acides gras sous forme de triglycérides dans les lipoprotéines de très basse densité (VLDL) est inférieur au taux d’absorption hépatique des acides gras par le plasma et la synthèse de novo des acides gras26. L’accumulation hépatique de lipides se produit souvent sous deux formes - stéatose microvésiculeuse et macrovésiculeuse - et celles-ci présentent des caractéristiques cytoarchitectoniques distinctes27. Typiquement, la stéatose microvésiculeuse est caractérisée par la présence de petites LD dispersées dans tout l’hépatocytes avec le noyau placé au centre, tandis que la stéatose macrovésiculeuse est caractérisée par la présence d’une seule grande LD qui occupe la plus grande partie de l’hépatocytes, poussant le noyau vers la périphérie28,29. Notamment, ces deux types de stéatose sont souvent trouvés ensemble, et on ne sait toujours pas comment ces deux modèles de LD influencent la pathogenèse de la maladie, car les preuves sont encore incohérentes 31,32,33,34. Pourtant, ce type d’analyse est souvent utilisé comme « norme de référence » dans les études précliniques et cliniques pour comprendre le comportement dynamique des TA et caractériser la stéatose hépatique 29,34,35,36.
Les biopsies hépatiques, l’étalon-or pour le diagnostic et le classement de l’HS, sont systématiquement évaluées par analyse histologique de l’hématoxyline et de l’éosine (H & E), où les gouttelettes lipidiques sont évaluées comme des vacuoles non colorées dans les sections hépatiques colorées H & E37. Bien qu’acceptable pour l’évaluation de la stéatose macrovésiculaire, ce type de coloration restreint généralement l’évaluation de la stéatose microvésiculeuse38. Les colorants diazoélectriques liposolubles, tels que l’Oil Red O (ORO), sont classiquement combinés à la microscopie à fond clair pour analyser les réserves lipidiques intracellulaires, mais ceux-ci présentent encore un certain nombre d’inconvénients: (i) l’utilisation d’éthanol ou d’isopropanol dans le processus de coloration, ce qui provoque souvent la perturbation des LD natives et une fusion occasionnelle malgré la fixation des cellules39; ii) la nature longue, car la solution ORO nécessite la dissolution et la filtration de la poudre fraîche en raison de la durée de conservation limitée, ce qui contribue à des résultats moins cohérents; (iii) et le fait que l’ORO colore plus que de simples gouttelettes lipidiques et surestime souvent la stéatose hépatique38.
Par conséquent, des fluorophores lipophiles perméables aux cellules, tels que le rouge du Nil, ont été utilisés dans des échantillons vivants ou fixes pour surmonter certaines des limitations susmentionnées. Cependant, la nature non spécifique du marquage des organites lipidiques cellulaires rétrécit à plusieurs reprises les évaluations de la LD40. De plus, les propriétés spectrales du Rouge du Nil varient en fonction de la polarité de l’environnement, ce qui peut souvent conduire à des décalagesspectraux41.
La sonde fluorescente lipophile 1,3,5,7,8-pentaméthyl-4-bora-3a,4adiaza-s-indacene (longueur d’onde d’excitation : 480 nm ; émission maximale : 515 nm ; BODIPY 493/503) présente des caractéristiques d’hydrophobicité qui permettent son absorption rapide par les LD intracellulaires, s’accumule dans le noyau des gouttelettes lipidiques et, par la suite, émet une fluorescence vert vif12. Contrairement au Nile Red, BODIPY 493/503 est insensible à la polarité de l’environnement et s’est avéré plus sélectif, car il affiche une luminosité élevée pour l’imagerie LD. Afin de colorer les LD neutres, ce colorant peut être utilisé dans des cellules vivantes ou fixes et couplé avec succès à d’autres méthodes de coloration et/ou d’étiquetage42. Un autre avantage du colorant est qu’il nécessite peu d’effort pour être placé dans une solution et qu’il est stable, éliminant ainsi le besoin de le préparer fraîchement pour chaque expérience42. Même si la sonde BODIPY 493/503 a été utilisée avec succès pour visualiser la localisation et la dynamique des TA dans les cultures cellulaires, certains rapports ont également démontré l’utilisation fiable de ce colorant comme outil d’imagerie des LD dans les tissus, y compris le muscle vastus lateralis humain43, le muscle soléaire du rat 42 et l’intestin de souris44.
Ici, nous proposons un protocole optimisé basé sur BODIPY 493/503 comme approche analytique alternative pour l’évaluation du nombre de DL, de la surface et du diamètre dans des échantillons de foie à partir d’un modèle animal de stéatose hépatique. Cette procédure couvre la préparation des échantillons de foie, la section des tissus, les conditions de coloration, l’acquisition d’images et l’analyse des données.
Protocole
Toutes les procédures animales effectuées dans cette étude ont été approuvées par l’organisme de protection des animaux de l’Institut de recherche clinique et biomédicale de Coimbra (IBRC) (ORBEA, #9/2018) et étaient conformes aux directives nationales et européennes sur les soins aux animaux et aux directives ARRIVE.
1. Conception expérimentale
- Couple de rats Wistar mâles âgés de 13 semaines dans des cages ventilées dans des conditions environnementales contrôlées de température (22 °C ± 1 °C), d’humidité (50 % à 60 %) et de lumière (cycle lumière-obscurité de 12 h) et avec accès ad libitum à l’eau du robinet et à la nourriture standard pour rongeurs.
- Après une période d’acclimatation de 2 semaines, assignez arbitrairement les rats en deux groupes.
- Nourrissez les groupes témoins (CTRL, n = 6) et riches en graisses (HFD, n = 6) avec un régime standard et un régime riche en graisses (45% kcal / gras), respectivement, pendant 24 semaines.
- Surveillez le poids corporel (PC) chaque semaine. Consigner la consommation quotidienne d’aliments et de boissons par cage.
2. Préparation de l’échantillon de foie
- Curage hépatique
- Préparez la pompe péristaltique : Faites passer de l’éthanol à 70 % dans le tube, connectez une aiguille de 27 G à l’extrémité de sortie du tube et amorcez le tube avec une solution saline glacée (4 °C) 1x tamponnée au phosphate (PBS, pH ~ 7,4 ) (p. ex., 200 tr/min sur une pompe péristaltique avec un tube en silicium I.D. de 1,6 mm, un mini jeu de perfusion IV). Ajuster en fonction du poids corporel (p. ex., pour un rat de 100 à 150 g, utiliser un débit d’environ 10 à 12 mL/min).
- Anesthésier le rat par injection intrapéritonéale à l’aide d’un protocole d’anesthésie (concentration finale de kétamine = 75 mg/kg, et concentration finale de médétomidine = 1 mg/kg).
REMARQUE: Assurez-vous que le rat est complètement anesthésié à l’aide de la méthode de réponse par pincement des orteils. - Placez le rat sur le plateau de dissection.
- Désinfectez soigneusement la fourrure avec de l’éthanol à 70% et séchez-la avec une serviette en papier.
- À l’aide de ciseaux, faites une incision en forme de « U » à travers la peau et coupez sous le diaphragme. Ensuite, coupez la cage thoracique rostralement sur les bords pour exposer le cœur.
- Pendant que le PBS 1x fonctionne, passez l’aiguille à travers le ventricule gauche dans l’aorte ascendante et serrez. Ensuite, l’oreillette droite est coupée pour permettre le drainage une fois la perfusion commencée.
REMARQUE: Le foie devrait commencer à blanchir car le sang est remplacé par du PBS. - À l’aide de ciseaux et de pinces Dumont, retirez soigneusement le foie et rincez avec 1x PBS.
- Transférer le foie sur une boîte de Petri et peser.
- À l’aide d’un scalpel, prélever des échantillons de tissu hépatique de 5 mm d’épaisseur du côté latéral (1 cm du bord) du lobe gauche du foie pour le processus d’enrobage.
NOTE Les tissus restants peuvent être conservés à −80 °C pour un stockage à long terme.
- Intégration du tissu hépatique
- Préparez un récipient de glace carbonique et étiquetez correctement les cryomoules avec l’ID et l’orientation de l’échantillon.
- Placez quelques gouttes de cryo-matrice d’incorporation sur le centre du cryomoule pour obtenir la température de coupe optimale (OCT).
- Assurez-vous que l’échantillon de tissu est correctement orienté pour une section transversale.
REMARQUE: Assurez-vous que le côté touchant le fond du cryomoule est le côté qui sera sectionné en premier. - Déposez délicatement plus d’OCT sur le cryomoule jusqu’à ce qu’il soit complètement recouvert. Essayez d’éviter la formation de bulles d’air. Si nécessaire, à l’aide d’une pince ordinaire, retirez les bulles à l’intérieur de l’OCT.
- Placez rapidement le cryomoule avec l’échantillon recouvert d’OCT dans un récipient de glace carbonique.
REMARQUE: Les tissus peuvent être conservés à -80 ° C pendant 3 ans.
3. Sectionnement de tissus congelés
- Ajustez la température du cryostat (chambre : −21 °C ; échantillon : −18 °C) et insérez une nouvelle lame stérile.
- Placez les échantillons dans le cryostat pendant 30 minutes avant de laisser la température s’équilibrer.
- Faire une seule couche de TCO sur le disque de l’échantillon pour permettre l’adhésion de l’échantillon. Laissez l’OCT geler et montez l’échantillon de tissu dans l’orientation souhaitée.
REMARQUE: La surface de coupe doit être parallèle à la lame. Pour maintenir une bonne adhérence, placez l’extracteur de chaleur sur le dessus de l’échantillon. Les étapes précédentes peuvent également être effectuées dans un récipient de glace carbonique avec de la glace sèche. - Placez l’échantillon dans la tête de l’échantillon et coupez la surface du tissu (quelques sections d’échantillon de tissu de 30 μm).
- Une fois que la région d’intérêt est accessible pour le sectionnement, coupez des sections de 12 μm d’épaisseur et placez-les sur des lames de microscope étiquetées conservées à température ambiante (RT).
REMARQUE: Pour recueillir la section, déplacez lentement la lame vers la section de tissu. Chaque lame peut recueillir deux sections de foie. - Laisser sécher les lames pendant 10 min à la RT.
REMARQUE: Les lames peuvent être conservées à -20 ° C pendant 6 à 12 mois ou à -80 ° C pendant 3 ans maximum.
4. Coloration BODIPY
- Décongeler les lames dans un système de coloration de glissière à TA pendant 30 min.
- Laver avec 1x PBS (3x pendant 5 min chacun).
- Encerclez la section avec une couche hydrophobe à l’aide d’un stylo-barrière.
- Préparer 500 μg/mL de solution mère BODIPY 493/503 : Dissoudre 1 mg de BODIPY 493/503 dans 2 mL de solvant (90 % de DMSO; 10 % 1x PBS). Protéger de la lumière. Sonifier dans un bain à ultrasons pendant 1 h (9,5-10 W) à 37 °C.
REMARQUE: La solution peut être conservée à -20 ° C pendant au moins 30 jours. - Préparer la solution de coloration BODIPY (1 μg/mL) en ajoutant 2 μL de solution mère BODIPY 493/503 et 0,1 μL de solution mère DAPI (5 mg/mL) à 997,9 μL de 1x PBS.
- Incuber les lames (75 μL/lame) avec BODIPY 493/503 (1 μg/mL) et DAPI (0,1 μg/mL) à TA pendant 40 min.
REMARQUE: Gardez les diapositives dans l’obscurité à partir de cette étape. - Lavez les lames avec 1x PBS (3x pendant 5 min chacune).
- Montez les lames avec des lamelles de couverture à l’aide d’un support de montage à fluorescence, laissez-les sécher pendant 30 minutes et scellez-les avec du vernis à ongles.
REMARQUE: Les diapositives peuvent être stockées à 4 ° C jusqu’à l’imagerie.
5. Quantification des lipides
- Mesurer les taux sériques de cholestérol total et de TG à l’aide d’une méthode et d’un équipement automatiques et validés.
- Mesurer les taux de TG hépatiques à l’aide d’un kit de dosage colorimétrique des triglycérides (Tableau des matériaux) selon le protocole du fabricant.
6. Acquisition d’images
- Placez la lame sur le support de lame de microscope confocal à balayage laser.
- Pour la visualisation et l’acquisition d’images, utilisez un microscope confocal avec une lentille d’objectif 20x (plan-apochromate : 20x/0,8).
- Pour éviter la diaphonie entre le BODIPY 493/503 et le DAPI, utilisez le mode de balayage séquentiel (meilleur signal) sur le logiciel confocale.
- Excitez le BODIPY 593/503 en utilisant la ligne laser argon 488 nm et le DAPI en utilisant la ligne laser 405 nm. Définissez les plages d’émission à 493-589 nm pour BODIPY 493/503 et à 410-464 nm pour DAPI.
- Utilisez les paramètres suivants : sténopé : 1 UA, résolution : 1 024 pixels x 1 024 pixels, profondeur de bits : 12, taille des pixels : 0,415 μm, mode bidirectionnel, vitesse de balayage : 7 (~1,58 μs/pixel pour un objectif 20x), moyenne linéaire : 2x et zoom numérique : 1.
NOTE: Les paramètres de balayage mentionnés ci-dessus doivent être optimisés pour chaque microscope confocal et objectif utilisé. - Réglez le gain et le gain numérique de manière appropriée afin qu’aucun pixel saturé ne soit détecté sur l’indicateur de portée.
REMARQUE: Corrigez le signal d’arrière-plan en ajustant le décalage. - Une fois les LD correctement identifiés, acquérir l’image avec les canaux BODIPY et DAPI.
REMARQUE: Toutes les images doivent être acquises dans les mêmes conditions (exposition et paramètres généraux) pour chaque canal de couleur. - Pour créer des images grand angle (Figure 2), remplacez l’objectif par un objectif a10x (plan-neofluar : 10x/0,3).
- Sélectionnez le mode Mosaïque et créez des mosaïques de 5 images pour 5.
REMARQUE: Dans ce travail, chaque tuile avait un chevauchement de 10% afin de fusionner correctement les tuiles pour l’analyse. - Pour créer des vues 3D et orthogonales (Figure 3A), placez une goutte d’huile d’immersion sur le dessus du verre de couverture et changez l’objectif pour une lentille d’objectif 40x (plan-neofluar : huile 40x/1,30).
- Sélectionnez le mode Z-Stack et, en ajustant le plan Z, définissez la première et la dernière position pour l’acquisition avec une tranche optique à une épaisseur optimale (~0,5 μm) pour vous assurer que toutes les gouttelettes sont capturées.
REMARQUE: Pour accélérer l’acquisition de l’image et éviter le blanchiment, la tranche optique peut être ajustée à une taille sous-optimale, assurant un suréchantillonnage d’au moins 30% pour une bonne reconstruction 3D. - Sélectionnez le module Ortho et créez des vues orthogonales.
- Acquérir des images 3D en sélectionnant le module 3D en suivant le mode de rendu de transparence avec le logiciel de microscope confocal.
7. Analyse des images
- Traitez et analysez les images monoplan (grossissement 20x) avec CellProfiler (version 4.2.5).
REMARQUE : Le pipeline utilisé dans ce travail a été adapté d’Adomshick et al.45. - Cliquez sur le module Images dans le coin supérieur gauche de la fenêtre CellProfiler et téléchargez les images sous forme de fichiers .tiff.
- Utilisez le module NamesAndTypes pour trier les images colorées BODIPY- (gouttelettes) et DAPI- (noyaux) en fonction des noms de fichiers. Effectuez l’analyse LD uniquement avec des images colorées BODIPY.
- Pour démarrer la construction du pipeline, cliquez sur Ajuster les modules et sélectionnez le module ColorToGray pour convertir les images en images en niveaux de gris.
Remarque : Pour identifier les objets, des images en niveaux de gris sont requises. - Identifiez les gouttelettes à l’aide du module IdentifyPrimaryObjects à l’aide de l’image en niveaux de gris.
REMARQUE: Les paramètres de ce module doivent être ajustés pour obtenir une bonne identification LD. Dans ce travail, la définition des LD avec une taille comprise entre 6 pixels et 300 pixels et un facteur de correction de seuil de 1,0 a conduit à l’identification la plus précise. - Pour mesurer l’intensité en pixels des gouttelettes lipidiques identifiées, ajoutez un module MeasureObjectIntensité .
- Ajouter un module FilterObjects supplémentaire pour s’assurer que seuls les signaux les plus forts sont quantifiés tandis que les signaux moins intenses sont exclus de l’analyse finale des gouttelettes lipidiques (intensité minimale : 0,15 ; intensité maximale : 1 unité arbitraire).
- Pour mesurer les LD liées aux données de sortie, ajoutez le module MeasureObjectSizeShape .
- Ajoutez un module OverlayOutline à ce stade pour superposer la gouttelette identifiée sur l’image d’origine et, ainsi, assurez-vous que la segmentation semble précise sur l’image non traitée.
REMARQUE : Il s’agit d’une étape facultative (contrôle qualité). - Ajoutez un module ExportToSpreadsheet à la fin et cliquez sur le bouton Analyser les images dans le coin inférieur gauche.
8. Analyse statistique
- Exprimer les résultats sous forme de moyenne ± d’erreur-type de la moyenne (S.E.M.) à l’aide de n’importe quel logiciel d’analyse statistique.
REMARQUE: Dans cette étude, le logiciel GraphPad a été utilisé pour l’analyse statistique. - Analyser la distribution des valeurs à l’aide du test de Kolmogorov-Smirnov pour évaluer les écarts significatifs par rapport à la normalité. Analysez les données paramétriques à l’aide du test t non apparié du étudiant.
REMARQUE : Les valeurs de p < 0,05 ont été considérées comme statistiquement significatives.
Résultats
L’exécution réussie de cette technique devrait entraîner une coloration claire des gouttelettes lipidiques pour la caractérisation simultanée de la morphologie LD (forme et densité du noyau lipidique basée sur la reconstruction 3D) ainsi que de leur distribution spatiale, de leur nombre par surface totale et de leur taille moyenne (évaluée avec le pipeline décrit ci-dessus, Figure 1).
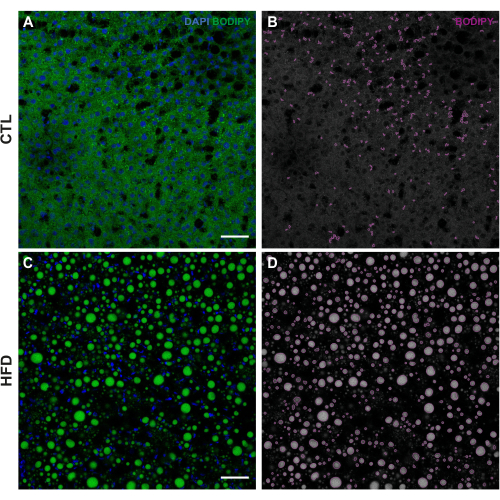
Figure 1 : Exemple de traitement d’image à l’aide de CellProfiler. (A) Image originale des LD colorés avec BODIPY 493/503 (vert) et des noyaux colorés avec DAPI (bleu) dans le groupe CTL. (B) Les LD différenciés (magenta) du groupe CTL ont été superposés à l’aide du module OverlayOutline (OverlayOutline ). (C) Image originale des LD colorées avec BODIPY 493/503 (vert) et des noyaux colorés avec DAPI (bleu) dans le groupe HFD. (D) Les LD différenciées (magenta) du groupe HFD ont été superposées à l’aide du module OverlayOutline (OverlayOutline (en anglais). Les images ont été prises à un grossissement de 20x à l’aide d’un microscope confocal à balayage laser ponctuel. Barres d’échelle = 50 μm. Abréviations : CTL = groupe témoin; HFD = groupe de régime riche en graisses. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les TG sériques, le cholestérol total, le LDL-c, le HDL-c, ainsi que le contenu hépatique en TG ont été évalués (tableau 1). Les animaux nourris à HFD présentaient un profil dyslipidémique prononcé, caractérisé par une accumulation accentuée de TG hépatiques (345% par rapport à CTL, p < 0,001), ainsi qu’une augmentation subtile des taux de TG circulants (129% par rapport à CTL, p > 0,05).
| Paramètre | CTL | HFD | |
| Sérum | |||
| Cholestérol total (mg/dL) | 56,67 ± 9,35 | 80,40 ± 7,45 | |
| LDL (mg/dL) | 7,66 ± 0,84 | 7,40 ± 1,03 | |
| HDL (mg/dL) | 17,83 ± 2,93 | 28,40 ± 2,40 * | |
| Triglycérides (mg/dL) | 154,8 ± 40,17 | 201,2 ± 38,12 | |
| Foie | |||
| Triglycérides (mg/g) | 15,29 ± 1,31 | 52,83 ± 6,73 *** |
Tableau 1 : TG sériques, cholestérol total, LDL-c, HDL-c et contenu hépatique en TG. Les données sont exprimées en moyenne ± SEM (n = 5-6 par groupe). p < 0,001 par rapport à CTL. L’analyse statistique a été effectuée à l’aide du test t non apparié d’un étudiant. Abréviations : CTL = groupe témoin; HFD = groupe de régime riche en graisses.
La figure 2 montre des images représentatives de vastes zones (balayages de tuiles avec un objectif 10x) de coupes hépatiques dans lesquelles les TA sont colorés avec BODIPY 493/503 (vert) et les noyaux sont colorés avec DAPI (bleu). Des LD individuelles de différentes tailles ont été visualisées avec succès avec une coloration BODIPY 493/503, qui a montré un schéma de distribution étendu chez les animaux nourris HFD.
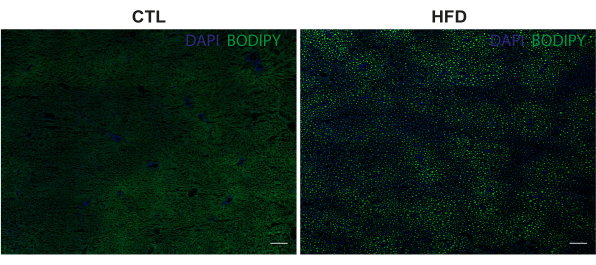
Figure 2 : Images représentatives de l’accumulation de LD dans le tissu hépatique. LDs colorés avec BODIPY 493/503 (vert), et noyaux colorés avec DAPI (bleu). Les images ont été prises à un grossissement de 10x à l’aide d’un microscope confocal à balayage laser ponctuel. Barres d’échelle = 200 μm. Abréviations : CTL = groupe témoin; HFD = groupe de régime riche en graisses. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 3A montre des projections orthogonales représentatives avec un objectif 20x et des images 3D avec un objectif 40x de LD hépatiques. Des images monoplan ont été traitées et analysées par CellProfiler (version 4.2.5) pour évaluer l’intensité de fluorescence, le nombre, la surface et le diamètre des LC (Figure 3B-E). Il a été possible de confirmer que les animaux nourris au HFD présentaient un nombre accru de LD hépatiques (151% vs CTL, Figure 3B), ce qui a été corroboré par l’intensité de fluorescence BODIPY 493/503 augmentée (182% vs CTL, p < 0,001, Figure 3C). De plus, le rapport de surface des LD a presque triplé (360 % par rapport à CTL, p < 0,0001, figure 3D) car ils présentaient des diamètres plus importants (182 % par rapport au CTL, figure 3E) chez les animaux nourris à HFD. Pour évaluer la distribution granulométrique, les LD ont été classées en trois groupes selon les gammes de diamètres : 1 μm < j ≤ 3 μm, 3 μm < d ≤ 9 μm et d > 9 μm (figure 3F). Les animaux nourris avec le HFD ont montré une augmentation de plus de 20% du nombre de LD hépatiques macrovésiculaires surdimensionnées (j > 9 μm, p < 0,0001) ainsi qu’une réduction de près de trois fois du nombre de microvésicules de moins de 3 μm de diamètre (1 μm < j ≤ 3 μm, p < 0,0001).
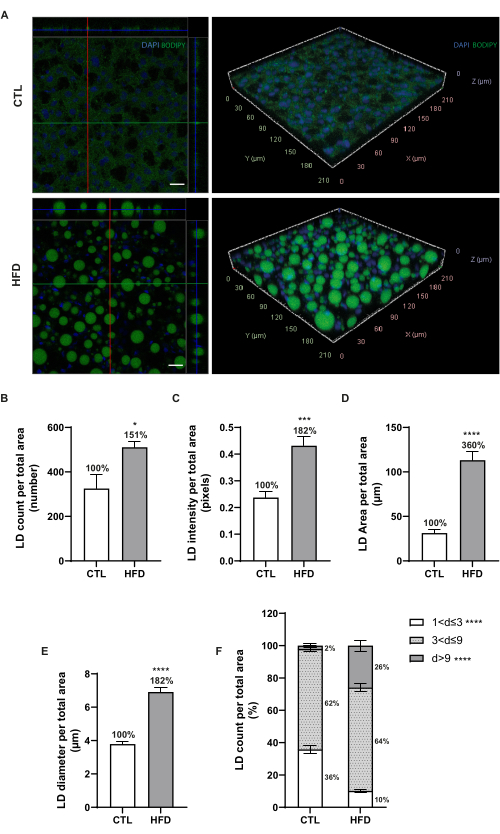
Figure 3 : Vues orthogonales/3D des TA et analyse des données. (A) Projections orthogonales représentatives et images 3D rendues de gouttelettes lipidiques hépatiques (vert, BODIPY 493/503) et de noyaux (bleu, DAPI) dans le foie de souris nourries avec un régime normal ou HFD. Les images ont été prises à un grossissement de 20x (à gauche) et de 40x (à droite) à l’aide d’un microscope confocal à balayage laser ponctuel. Barres d’échelle = 20 μm. (B) Nombre de LD hépatiques. (C) Intensité de fluorescence des LD hépatiques. (D) Rapport de surface des LD hépatiques. (E) Diamètres des gouttelettes lipidiques. (F) Rapports fractionnaires de groupes de gouttelettes lipidiques hépatiques de diamètres différents: 1 μm < j ≤ 3 μm, 3 μm < j ≤ 9 μm et d > 9 μm. Les données sont présentées sous forme de moyenne ± MEB. n = 5-6 souris/groupe; * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001. L’analyse statistique a été effectuée à l’aide du test t non apparié d’un étudiant. Abréviations : CTL = groupe témoin; HFD = groupe de régime riche en graisses. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole BODIPY 493/503 basé sur la fluorescence pour l’évaluation de la LD visait à développer une nouvelle approche d’imagerie pour l’évaluation de la stéatose hépatique. Compte tenu de la forte corrélation entre l’obésité et la stéatose hépatique, le régime alimentaire riche en graisses de style occidental a été utilisé pour établir un modèle animal de stéatosehépatique 26. Une forte augmentation de la teneur en TG hépatique a été confirmée par un kit de dosage colorimétrique quantitatif des triglycérides, qui a suggéré un scénario de lipidose hépatique accrue chez les animaux nourris à HFD. Par la suite, le degré d’accumulation de LD a été visualisé par la sonde fluorescente BODIPY 493/503 sous faible grossissement. Comme prévu, la coloration BODIPY 493/503 a révélé une distribution étendue des structures vésiculeuses à travers le tissu hépatique dans le groupe HFD. En recourant à des projections orthogonales et à des reconstructions 3D, il a été possible d’observer que le noyau LD présentait une teneur complète en lipides neutres, qui apparaissaient sous forme de gouttelettes presque sphériques. De plus, la forte augmentation de la surface de LD par surface totale était clairement évidente (360% vs groupe CTL), et cette zone était très probablement remplie de TG neutres compte tenu de leur score quantitatif dans le groupe HFD (52,83 mg / g ± 6,73 mg / g; 346% par rapport au groupe CTL). Pour caractériser davantage la dynamique de la LD lors de l’alimentation HFD, la nature micro ou macrovésiculeuse de la stéatose hépatique a été analysée. En utilisant les plages de diamètres DL décrites précédemment dans la littérature 4,46,47, il a été possible de distinguer une baisse significative du nombre de LD microvésiculaires (1 μm < j ≤ 3 μm), qui correspondait à une augmentation proportionnelle des macrovésicules LD (d > 9 μm). Plusieurs études ont rapporté que les LD dans les hépatocytes peuvent former des LD surdimensionnées (jusqu’à des dizaines de microns de diamètre)4,46,47, ce qui est conforme aux résultats actuels.
Au cours des dernières années, les colorants lipidiques classiques ont été progressivement remplacés par une nouvelle gamme de sondes lipophiles fluorescentes, telles que BODIPY, compte tenu de leur structure neutre et plane stabilisée par un complexe difluorobore48 ; ces sondes se sont révélées très efficaces pour marquer les TA afin d’étudier leur morphologie, leur dynamique et leur interaction avec d’autres organites dans les cellules vivantes et certains tissus fixes49,50. Dans le cadre du protocole de gouttelettes lipidiques colorées par fluorescence présenté ici pour l’évaluation de la stéatose hépatique, certaines étapes critiques pour le succès de la technique reposent principalement sur la préparation des tissus et l’acquisition d’images. Étant donné que le signal BODIPY peut être blanchi par la lumière UV51, l’acquisition de l’imagerie LD doit avoir lieu avant l’imagerie d’autres colorants fluorescents excités par la lumière UV, tels que les colorants fluorescents à ADN communément connus. De plus, il est fortement recommandé de protéger les lames de microscope de l’exposition à la lumière afin d’éviter l’extinction de fluorescence BODIPY avant l’imagerie. Même si la reconstruction 3D des LD est très utile pour l’étude de leur morphologie, elle prend énormément de temps, car les images reconstruites en 3D sont composées de plusieurs images 2D indépendantes. Par conséquent, les chercheurs devraient envisager d’éviter cette étape lorsque l’objectif principal de l’expérience est uniquement l’évaluation de la stéatose hépatique micro et macrovésiculaire. Pour éviter tout biais, deux observateurs indépendants aveugles au groupe de traitement doivent effectuer l’acquisition et l’analyse des données. Le logiciel de traitement d’image semi-automatisé (pipeline Cell Profiler) contribue en outre à une quantification semi-aveugle et surmonte l’augmentation du temps de traitement constamment observée dans l’analyse manuelle.
Cette technique peut être étendue à des applications plus larges en combinaison avec la coloration immunohistochimique d’autres tissus et espèces, à condition que les concentrations optimales de BODIPY et les paramètres d’acquisition d’images aient été déterminés pour maximiser le rapport signal/bruit de fond. De tels contextes expérimentaux peuvent permettre la détection simultanée d’autres antigènes à condition que le second fluorophore utilisé ne chevauche pas les spectres d’excitation/émission BODIPY.
Dans l’ensemble, le protocole optimisé basé sur la fluorescence BODIPY 493/503 présenté ici est un outil fiable et simple pour la caractérisation de la LD et peut représenter une approche complémentaire aux protocoles histologiques classiques souvent utilisés pour confirmer et classer la stéatose hépatique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par des fonds nationaux et européens via la Fondation portugaise pour la science et la technologie (FCT), le Fonds européen de développement régional (FEDER) et le Programa Operacional Factores de Competitividade (COMPETE): 2020.09481.BD, UIDP/04539/2020 (CIBB) et POCI-01-0145-FEDER-007440. Les auteurs tiennent à remercier iLAB - Microscopy and Bioimaging Lab, une installation de la Faculté de médecine de l’Université de Coimbra et membre de l’infrastructure nationale PPBI-Plateforme portugaise de bioimagerie (POCI-01-0145-FEDER-022122), ainsi que le soutien de FSE CENTRO-04-3559-FSE-000142.
matériels
| Name | Company | Catalog Number | Comments |
| 1.6 mm I.D. silicone tubing, I.V mini drip set | Fisher Scientific | ||
| 4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno (BODIPY 493/503) | Sigma-Aldrich, Lyon, France | D3922 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes Inc, Invitrogen, Eugene, OR | D1306 | |
| 70% ethanol | Honeywell | 10191455 | |
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Automatic analyzer Hitachi 717 | Roche Diagnostics Inc., Mannheim, Germany | 8177-30-0010 | |
| Barrier pen (Liquid blocker super pap pen) | Daido Sangyo Co., Ltd, Japon | _ | |
| Blade | Leica | 221052145 | Used in the cryostat |
| Cell Profiler version 4.2.5 | https://cellprofiler.org/releases/ | Used to analyse the acquired images | |
| Coverslips | Menzel-Glaser, Germany | _ | |
| Cryomolds | Tissue-Tek | _ | |
| Cryostat (including specimen disc and heat extractor) CM3050 S | Leica Biosystems | _ | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich, Lyon, France | D-8418 | Used to dissolve Bodipy for the 5 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Dry ice container (styrofoam cooler) | Novolab | A26742 | |
| Dumont forceps | Fine Science Tools, Germany | 11295-10 | |
| Glass Petri dish (H 25 mm, ø 150 mm) | Thermo Scientific | 150318 | Used to weigh the liver after dissection |
| Glycergel | DAKO Omnis | S303023 | |
| GraphPad Prism software, version 9.3.1 | GraphPad Software, Inc., La Jolla, CA, USA | ||
| High-fat diet | Envigo, Barcelona, Spain | MD.08811 | |
| Ketamine (Nimatek 100 mg/mL) | Dechra | 791/01/14DFVPT | Used at a final concentration of 75 mg/kg |
| Laser scanning confocal microscope (QUASAR detection unit; ) | Carl Zeiss, germany | LSM 710 Axio Observer Z1 microscope | |
| Medetomidine (Sedator 1 mg/mL) | Dechra | 1838 ESP / 020/01/07RFVPT | Used at a final concentration of 1 mg/kg |
| Needle | BD microlance | 300635 | |
| No 15 Sterile carbon steel scalpel Blade | Swann-Morton | 205 | |
| Objectives 10x (Plan-Neofluar 10x/0.3), 20x (Plan-Apochromat 20x/0.8) and 40x (Plan-Neofluar 40x/1.30 Oil) | Carl Zeiss, Germany | ||
| Paint brushes | Van Bleiswijck Amazon B07W7KJQ2X | Used to handle cryosections | |
| Peristaltic pump (Minipuls 3) | Gilson | 1004170 | |
| Phosphate-buffered saline (PBS, pH ~ 7.4) | Sigma-Aldrich, Lyon, France | P3813 | |
| Scalpel handle, 125 mm (5"), No. 3 | Swann-Morton | 0208 | |
| Slide staining system StainTray | Simport Scientific | M920 | |
| Standard diet | Mucedola | 4RF21 | |
| Superfrost Plus microscope slides | Menzel-Glaser, Germany | J1800AMNZ | |
| Tissue-Tek OCT mounting media | VWR CHEMICALS | 361603E | |
| Triglycerides colorimetric assay kit | Cayman Chemical | 10010303 | |
| Ultrasonic bath | Bandelin Sonorex | TK 52 | |
| Vannas spring scissors - 3 mm cutting edge | Fine Science Tools, Germany | 15000-00 | |
| ZEN Black software | Zeiss |
Références
- Klemm, R. W., Ikonen, E. The cell biology of lipid droplets: More than just a phase. Seminars in Cell & Developmental Biology. 108, 1-3 (2020).
- Martin, S., Parton, R. G. Lipid droplets: A unified view of a dynamic organelle. Nature Reviews Molecular Cell Biology. 7 (5), 373-378 (2006).
- Thiele, C., Penno, A., Bradshaw, R. A., Stahl, P. D. Lipid droplets. Encyclopedia of Cell Biology. , 273-278 (2016).
- Gluchowski, N. L., Becuwe, M., Walther, T. C., Farese, R. V. Lipid droplets and liver disease: From basic biology to clinical implications. Nature Reviews Gastroenterology & Hepatology. 14 (6), 343-355 (2017).
- Bickel, P. E., Tansey, J. T., Welte, M. A. PAT proteins, an ancient family of lipid droplet proteins that regulate cellular lipid stores. Biochimica et Biophysica Acta. 1791 (6), 419-440 (2009).
- Olzmann, J. A., Carvalho, P. Dynamics and functions of lipid droplets. Nature Reviews. Molecular Cell Biology. 20 (3), 137-155 (2019).
- Wang, L., Liu, J., Miao, Z., Pan, Q., Cao, W. Lipid droplets and their interactions with other organelles in liver diseases. The International Journal of Biochemistry & Cell Biology. 133, 105937 (2021).
- Carr, R. M., Ahima, R. S. Pathophysiology of lipid droplet proteins in liver diseases. Experimental Cell Research. 340 (2), 187-192 (2016).
- Jackson, C. L. Lipid droplet biogenesis. Current Opinion in Cell Biology. 59, 88-96 (2019).
- Onal, G., Kutlu, O., Gozuacik, D., Dokmeci Emre, S. Lipid droplets in health and disease. Lipids in Health and Disease. 16 (1), 128 (2017).
- Wang, H., Quiroga, A. D., Lehner, R., Yang, H., Li, P. Lipid Droplets. Methods in Cell Biology. , 107-127 (2013).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Welte, M. A., Gould, A. P. Lipid droplet functions beyond energy storage. Biochimica et Biophysica Acta. Molecular and Cell Biology of Lipids. 1862 (10), 1260-1272 (2017).
- Roberts, M. A., Olzmann, J. A. Protein quality control and lipid droplet metabolism). Annual Review of Cell and Developmental Biology. 36, 115-139 (2020).
- Filali-Mouncef, Y., et al. The ménage à trois of autophagy, lipid droplets and liver disease. Autophagy. 18 (1), 50-72 (2022).
- Bandyopadhyay, D., et al. Lipid droplets promote phase separation of Ago2 to accelerate Dicer1 loss and decelerate miRNA activity in lipid exposed hepatic cells. bioRxiv. , (2020).
- Farías, M. A., Diethelm-Varela, B., Navarro, A. J., Kalergis, A. M., González, P. A. Interplay between lipid metabolism, lipid droplets, and DNA virus infections. Cells. 11 (14), 2224 (2022).
- Krahmer, N., Farese, R. V., Walther, T. C. Balancing the fat: Lipid droplets and human disease. EMBO Molecular Medicine. 5 (7), 973-983 (2013).
- Greenberg, A. S., et al. The role of lipid droplets in metabolic disease in rodents and humans. The Journal of Clinical Investigation. 121 (6), 2102-2110 (2011).
- Xu, S., Zhang, X., Liu, P. Lipid droplet proteins and metabolic diseases. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1864 (5), 1968-1983 (2018).
- Herms, A., et al. Cell-to-cell heterogeneity in lipid droplets suggests a mechanism to reduce lipotoxicity. Current Biology. 23 (15), 1489-1496 (2013).
- Hooper, A. J., Adams, L. A., Burnett, J. R. Genetic determinants of hepatic steatosis in man. Journal of Lipid Research. 52 (4), 593-617 (2011).
- Parafati, M., Kirby, R. J., Khorasanizadeh, S., Rastinejad, F., Malany, S. A nonalcoholic fatty liver disease model in human induced pluripotent stem cell-derived hepatocytes, created by endoplasmic reticulum stress-induced steatosis. Disease Models & Mechanisms. 11 (9), (2018).
- Nassir, F., Rector, R. S., Hammoud, G. M., Ibdah, J. A. Pathogenesis and prevention of hepatic steatosis. Gastroenterology & Hepatology. 11 (3), 167-175 (2015).
- Starekova, J., Reeder, S. B. Liver fat quantification: Where do we stand. Abdominal Radiology. 45 (11), 3386-3399 (2020).
- Fabbrini, E., Sullivan, S., Klein, S. Obesity and nonalcoholic fatty liver disease: Biochemical, metabolic, and clinical implications. Hepatology. 51 (2), 679-689 (2010).
- Kristiansen, M. N. B., Veidal, S. S., Christoffersen, C., Jelsing, J., Rigbolt, K. T. G. Molecular characterization of microvesicular and macrovesicular steatosis shows widespread differences in metabolic pathways. Lipids. 54 (1), 109-115 (2019).
- Tsutsumi, V., Nakamura, T., Ueno, T., Torimura, T., Aguirre-García, J., Muriel, P. Chapter 2: Structure and ultrastructure of the normal and diseased liver. Liver Pathophysiology. , 23-44 (2017).
- Tandra, S., et al. Presence and significance of microvesicular steatosis in nonalcoholic fatty liver disease. Journal of Hepatology. 55 (3), 654-659 (2011).
- Nascimbeni, F., et al. Clinical relevance of liver histopathology and different histological classifications of NASH in adults. Expert Review of Gastroenterology & Hepatology. 12 (4), 351-367 (2018).
- Yerian, L. Histopathological evaluation of fatty and alcoholic liver diseases. Journal of Digestive Diseases. 12 (1), 17-24 (2011).
- Stöppeler, S., et al. Gender and strain-specific differences in the development of steatosis in rats. Laboratory Animals. 47 (1), 43-52 (2013).
- Hübscher, S. G., Saxena, R. Alcohol-induced liver disease. Practical Hepatic Pathology: A Diagnostic Approach (Second Edition). , 371-390 (2018).
- Sethunath, D., et al. Automated assessment of steatosis in murine fatty liver. PLoS One. 13 (5), e0197242 (2018).
- Sinton, M. C., et al. Macrovesicular steatosis in nonalcoholic fatty liver disease is a consequence of purine nucleotide cycle driven fumarate accumulation. bioRxiv. , (2020).
- de Conti, A., et al. Characterization of the variability in the extent of nonalcoholic fatty liver induced by a high-fat diet in the genetically diverse collaborative cross mouse model. The FASEB Journal. 34 (6), 7773-7785 (2020).
- Virarkar, M., Szklaruk, J., Jensen, C. T., Taggart, M. W., Bhosale, P. What's new in hepatic steatosis. Seminars in Ultrasound, CT and MRI. 42 (4), 405-415 (2021).
- Le, T. T., Ziemba, A., Urasaki, Y., Brotman, S., Pizzorno, G. Label-free evaluation of hepatic microvesicular steatosis with multimodal coherent anti-Stokes Raman scattering microscopy. PLoS One. 7 (11), e51092 (2012).
- Fam, T. K., Klymchenko, A. S., Collot, M. Recent advances in fluorescent probes for lipid droplets. Materials. 11 (9), 1768 (2018).
- Rumin, J., et al. The use of fluorescent Nile red and BODIPY for lipid measurement in microalgae. Biotechnology for Biofuels. 8 (1), 42 (2015).
- Daemen, S., van Zandvoort, M. A. M. J., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2015).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine & Biotechnology. 2011, 598358 (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), e77774 (2013).
- Nakano, T., et al. Ezetimibe impairs transcellular lipid trafficking and induces large lipid droplet formation in intestinal absorptive epithelial cells. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1865 (12), 158808 (2020).
- Adomshick, V., Pu, Y., Veiga-Lopez, A. Automated lipid droplet quantification system for phenotypic analysis of adipocytes using CellProfiler. Toxicology Mechanisms and Methods. 30 (5), 378-387 (2020).
- Moon, J., et al. Intravital longitudinal imaging of hepatic lipid droplet accumulation in a murine model for nonalcoholic fatty liver disease. Biomedical Optics Express. 11 (9), 5132-5146 (2020).
- Martinez-Lopez, N., Singh, R. Autophagy and lipid droplets in the liver. Annual Review of Nutrition. 35, 215-237 (2015).
- Collot, M., et al. Ultrabright and fluorogenic probes for multicolor imaging and tracking of lipid droplets in cells and tissues. Journal of the American Chemical Society. 140 (16), 5401-5411 (2018).
- Selvais, C. M., De Cock, L. L., Brichard, S. M., Davis-Lopez de Carrizosa, M. A. Fiber type and subcellular-specific analysis of lipid droplet content in skeletal muscle. Journal of Visualized Experiments: Jove. (184), e63718 (2022).
- Zhuang, H., et al. Long-term high-fat diet consumption by mice throughout adulthood induces neurobehavioral alterations and hippocampal neuronal remodeling accompanied by augmented microglial lipid accumulation. Brain, Behavior, and Immunity. 100, 155-171 (2022).
- Chen, J., Yue, F., Kuang, S. Labeling and analyzing lipid droplets in mouse muscle stem cells. STAR Protocols. 3 (4), 101849 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon