Method Article
Микрофлюидный синтез микрогелевых строительных блоков для микропористых отожженных частиц
В этой статье
Резюме
Этот протокол описывает набор методов синтеза микрогелевых строительных блоков для микропористых отожженных частиц каркаса, которые могут быть использованы для различных применений регенеративной медицины.
Аннотация
Платформа каркасов микропористых отожженных частиц (MAP) представляет собой подкласс гранулированных гидрогелей. Он состоит из инъекционной суспензии микрогелей, которая может образовывать структурно устойчивый каркас с пористостью клеточного масштаба in situ после вторичной стадии химического сшивания на основе света (т.е. отжига). Каркас MAP показал успех в различных применениях регенеративной медицины, включая заживление кожных ран, увеличение голосовых складок и доставку стволовых клеток. В данной работе описаны методы синтеза и характеристики микрогелей поли(этиленгликоля) (ПЭГ) в качестве строительных блоков для формирования каркаса MAP. Эти методы включают синтез пользовательского макромера отжига (MethMAL), определение кинетики гелирования предшественника микрогеля, изготовление микрофлюидного устройства, микрофлюидную генерацию микрогелей, очистку микрогелей и базовую характеристику каркаса, включая калибровку микрогелей и отжиг каркаса. В частности, высокопроизводительные микрофлюидные способы, описанные в настоящем описании, могут производить большие объемы микрогелей, которые могут быть использованы для получения каркасов MAP для любого желаемого применения, особенно в области регенеративной медицины.
Введение
Платформа каркаса MAP представляет собой инъекционный биоматериал, состоящий полностью из микрочастиц гидрогеля (микрогелей), которые обеспечивают микропористость клеточного масштаба при сшивании друг с другом, что позволяет осуществлять независимую от деградации миграцию клеток и интеграцию объемных тканей1. Благодаря своей способности быстро интегрироваться с тканью хозяина и по своей сути низкой иммуногенности, платформа MAP scaffold продемонстрировала доклиническую применимость для широкого спектра методов лечения регенеративной медицины 2,3,4,5,6,7,8,9,10, включая ускорение заживления кожных ран 1,3 ,11, реваскуляризация полости инсульта головного мозга7, доставка мезенхимальных стволовых клеток2 и обеспечение набухания тканей для лечения глоттической недостаточности6. Было также показано, что MAP передает противовоспалительные эффекты в ткани хозяина посредством набора макрофагов M23 и даже может быть настроен для содействия иммунному ответу Th2 «восстановления тканей»8. Эти благоприятные свойства платформы КАРКАСОВ MAP позволяют расширить ее на широкий спектр клинических применений.
Ранее опубликованные методы получения микрогелей для формирования каркасов MAP включали ориентированность потока капель-микрофлюидику 1,4,7,9, электромолие 5,12 и верхнее вращение с периодической эмульсией 6,10. Капельный микрофлюидный метод может производить частицы с высокой монодисперсностью, но использует очень медленные скорости потока, которые производят низкий выход частиц (мкл / ч). Альтернативно, методы электромолования и периодической эмульсии могут производить большой объем частиц, но с высокой полидисперсностью частиц. Этот протокол использует высокопроизводительный микрофлюидный метод для получения микрогелей с монодисперсной популяцией, основанный на работе де Рютте и др.13. Этот метод использует методы мягкой литографии для изготовления микрофлюидного устройства полидиметилсилоксана (PDMS) из фотомаски, которое затем связывается со стеклянным слайдом. Конструкция устройства основана на ступенчатой эмульгации для получения большого объема микрогелевых частиц (мл / ч). Монодисперсность, которая может быть достигнута с помощью этого метода, обеспечивает превосходный контроль пористости по сравнению с другими методами, поскольку монодисперсные микрогели могут образовывать каркасы с более однородными размерами пор2.
Методы синтеза и характеристики отдельных микрогелей, которые могут выступать в качестве строительных блоков для каркасов MAP, изложены в этой рукописи, в частности, с точки зрения создания микрогелей, которые состоят из основы ПЭГ с группой малеимида (MAL), которая легко участвует в эффективном добавлении типа Майкла с тиол-функционализированными сшиваниями для микрогелеобразования. Чтобы отделить микрогелеобразование от отжига каркасов MAP, в этой рукописи также описывается, как синтезировать опубликованный14 пользовательских макромеров отжига, MethMAL, который представляет собой гетерофункциональный метакриламид / малеимид 4-рукий макромер PEG. Функциональные группы метакриламидов легко участвуют в свободнорадикальной фотополимеризации (для микрогелевого отжига), оставаясь при этом относительно инертными к условиям, способствующим добавлению типа Майкла для функциональных групп ТЗА.
Кроме того, в этой рукописи описываются протоколы создания микрофлюидных устройств PDMS, определения кинетики микрогелеобразования и характеристики размера микрогеля. В заключительной части рукописи подробно описывается отжиг каркаса MAP, когда микрогели переходят in situ в объемный каркас через вторичный, фото-инициированный этап сшивания, который ковалентно связывает поверхности микрогелей вместе. Важно отметить, что существуют и другие методы отжига, которые могут быть реализованы в каркасных системах MAP, которые не полагаются на химические вещества на основе света, такие как ферментопосредованный отжиг, как описано ранее1. В целом, эти методы могут быть использованы непосредственно или использованы с различными химическими веществами гидрогелевой композиции (например, на основе гиалуроновой кислоты) для создания каркасов MAP для любого применения.
протокол
1. Синтез макромеров отжига MethMAL
ПРИМЕЧАНИЕ: Этот протокол предназначен специально для модификации 1 г ПЭГ-малеимида, но может быть увеличен для создания более крупных партий.
- Добавьте 1 г 4-армечного ПЭГ-малеймида 20 кДа-малеимида к 10 мл 1x фосфатно-буферного физиологического раствора (PBS, рН 7,4) в небольшой стеклянный стакан с перемешивающим батончиком. Перемешайте раствор со скоростью 300 об/мин до полного растворения ПЭГ (~30 мин).
- Добавьте 14,65 мг 2-аминоэтантиола (0,67:1 тиола [SH] к молярному соотношению малеимида [MAL]) к реакции с перемешиванием при 300 об/мин.
ПРИМЕЧАНИЕ: Тиоловые группы на 2-аминоэтантиоле будут добавлены примерно к трем плечам PEG-MAL через добавление типа Майкла, оставляя конечные группы аминов.- Обратите внимание на следующий пример расчета количества 2-аминоэтантиола для добавления:
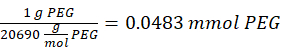


ПРИМЕЧАНИЕ: Чтобы избежать измерения очень небольшого количества, растворите 100 мг 2-аминоэтантиола в 1 мл 1x PBS (рН 7,4) и добавьте 146,5 мкл этого раствора в реакцию.
- Обратите внимание на следующий пример расчета количества 2-аминоэтантиола для добавления:
- Подождите 1 ч и 10 мин после стадии 1.2., затем смешайте 160,1 мг 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорида (DMTMM, 12:1 молярное отношение к ПЭГ) и 32,77 мкл метакриловой кислоты (8:1 молярное отношение к ПЭГ) в 5 мл 1x PBS (рН 7,4) в новом стеклянном стакане и реагируйте в течение 50 мин с перемешиванием при 300 об/мин.
ПРИМЕЧАНИЕ: На этом этапе метакриловая кислота реагирует с DMTMM с образованием высокореакционноспособного эфира, который затем может быть соединен с доступными аминными группами на ПЭГ.- Обратите внимание на следующий пример расчета для вычисления количества DMTMM для сложения:



- Обратите внимание на следующий пример расчета для расчета количества метакриловой кислоты для добавления:

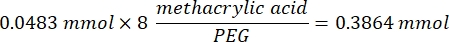


- Обратите внимание на следующий пример расчета для вычисления количества DMTMM для сложения:
- Добавьте раствор метакриловой кислоты/ДМТММ в стакан с раствором ПЭГ-МАЛ/2-аминоэтантиола 20 кДа.
- Добавьте в стакан 53,56 мкл триэтиламина (молярное отношение 1:1 к метакриловой кислоте) и дайте вступить в реакцию в течение ночи с перемешиванием при 300 об/мин. Накройте стакан фольгой, чтобы предотвратить попадание пыли и других загрязнений в стакан.
- Обратите внимание на следующий пример расчета количества триэтиламина для добавления:


- Обратите внимание на следующий пример расчета количества триэтиламина для добавления:
- Перенос реакции на диализную трубку змеиной кожи (отсечение молекулярной массы: 3 500 Да).
- Поместите диализную трубку в большой стакан с 1 M NaCl в деионизированной (DI) воде (объем должен полностью покрывать трубку) в течение 3 дней с перемешиванием при 300 об/мин. Меняйте раствор 1 M NaCl 2 раза в день в общей сложности шесть стирок.
- Диализ в течение 6 ч в ДИ воде. Меняйте воду DI каждый час в общей сложности на шесть стирок.
- Переложить реакцию в коническую трубку объемом 50 мл и заморозить при −80 °C.
- Лиофилизируют трубку в течение не менее 72 ч при начальной температуре −70 °C и температурной рампе 0,01 °C/мин до 0 °C.
- Подготовьте образец для 1H-ЯМР, растворив 25 мг MethMAL в 700 мкл хлороформа-d и переместив в ЯМР-трубку.
- Приобретите 1спектр H-ЯМР.
ПРИМЕЧАНИЕ: Спектры в этом протоколе были получены с помощью спектрометра 500 МГц со следующими параметрами: ширина развертки = 6 467,3 Гц, временная задержка = 13,1 с, время захвата = 5,1 с, время импульса = 5,1 мкс и количество сканирований = 8. - Для анализа интегрируйте пик малеимида в качестве эталона (~ 6,76 ppm), а затем интегрируйте два пика метакриламида (~ 5,35 ppm и 5,6 ppm). Разделите отношение пиковых областей метакриламида на общую площадь всех трех пиков, чтобы получить процент рукавов, модифицированных метакриламидом.
ПРИМЕЧАНИЕ: Допустимой модификацией является 67%-75% замещение функциональной группы метакриламидов. Пример 1спектра H-ЯМР для MethMAL показан на рисунке 1.- Используйте уравнение (1) в качестве уравнения степени замещения:
 (1)
(1)
- Используйте уравнение (1) в качестве уравнения степени замещения:

Рисунок 1: Химическая структура и 1H-ЯМР спектр MethMAL. (A) Химическая структура: макромер отжига MethMAL состоит из 20 кДа 4-рычажного поли(этиленгликоля), модифицированного тремя метакриламидными рукавами. (B) Эта структура генерирует пики при 5,36 ppm (3) и 5,76 ppm (2), отсутствующие в спектрах PEG-MAL, и один малеимидный рычаг, который генерирует пик при 6,71 ppm (1). Растворитель, хлороформ, генерировал пик в 7,26 ppm, а остаточная вода в этом образце генерировала пик в 2,2 ppm (помеченный по спектрам). В спектрах MethMAL пик малеимида имел интегрированную площадь 0,27, а сумма площадей пиков метакриламида составляла 0,73 (0,37 + 0,36). Процент модификации метакриламида составил 73% (0,73/(0,27 + 0,73)). Эта цифра взята из Pfaff et al.14. Авторское право (2021) Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Кинетика гелеобразования предшественника микрогеля
ПРИМЕЧАНИЕ: Время гелеобразования может быть изменено путем регулировки рН буфера, используемого для растворения компонентов предшественника геля. Для гидрогелей ПЭГ-малеимид более кислый рН обычно соответствует более медленному времени гелеобразования, поскольку концентрация тиолата снижается при более низком рН15.
- Предопределить желаемые концентрации полимера, сшивателя и других компонентов-предшественников геля (т.е. пептидов, гликозаминогликанов). Растворите PEG-MAL, RGD и MethMAL (PEG-магистраль) в 10x PBS (pH 1,5) и сшивающий MMP-2 в 1x PBS (pH 7,4).
ПРИМЕЧАНИЕ: В настоящем протоколе раствор-предшественник геля представляет собой опубликованную формулу3, которая состоит из 45,88 мг/мл 4-армеевого ПЭГ-МАЛ (10 кДа), 0,82 мг/мл RGD, 8,06 мг/мл MethMAL и 4,62 мг/мл сшивки MMP-2 (ферментативно разлагаемый сшиватель). - Подготовьте вискозиметр или эквивалентный прибор для мониторинга модулей хранения и потерь, используя размер зазора 0,4 мм, деформацию сдвига 1,0, частоту 1,0 Гц и продолжительность 10 800 с.
- Прикрепите пластинчатый ротор диаметром 35 мм (P35/Ti). Используйте увлажненную камеру или влажную губку вокруг геометрии для поддержания увлажненной среды.
- Смешайте PEG-магистраль и MMP-сшивку в объемном соотношении 1:1.
- Пипетка 400 мкл раствора предшественника геля на центр ступени вискозиметра.
- Медленно опустите геометрию на ступеньку до тех пор, пока она не достигнет заданного размера зазора 0,4 мм, и немедленно начните мониторинг модулей хранения (G') и потерь (G'') в течение 6 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Считается, что гелеобразование начинается, когда модуль хранения становится больше модуля потерь, а гелеобразование считается завершенным, когда модуль хранения плато. Репрезентативная кривая кинетики гелеобразования показана на рисунке 2.
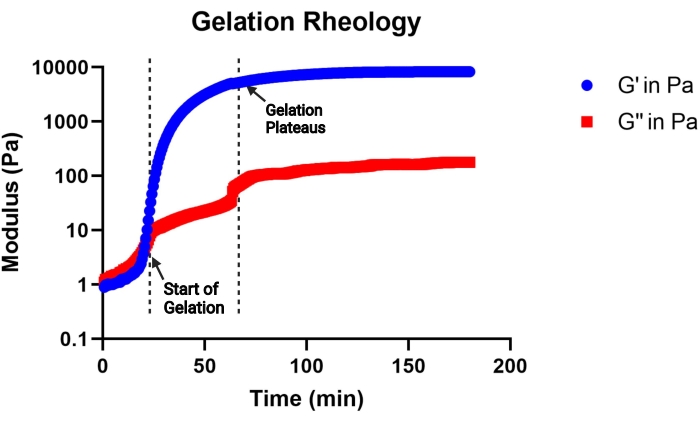
Рисунок 2: Репрезентативная кривая кинетики гелеобразования раствора предшественника геля MAP (рН 4,5), определяемая вискозиметром. Гелеобразование начинается с быстрого увеличения модуля хранения (G'), а гелеобразование завершается, когда кривая G' плато. G'' указывает на модуль потерь. Эта цифра взята из Pruett et al.3. Copyright (2021) Wiley-VCH GmBH. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Изготовление микрофлюидных устройств
ПРИМЕЧАНИЕ: Этот протокол описывает изготовление устройства микрофлюидной конструкции устройства ступенчатой эмульгирования, адаптированной из de Rutte et al.13, которую можно увидеть на рисунке 3A. Однако этот протокол можно использовать с любой конструкцией устройства, которое выгравировано в пластине SU-8. Рекомендуется передать на аутсорсинг изготовление мастеров по изготовлению кремниевых пластин SU-8, если для изготовления не имеются соответствующие помещения для чистых помещений.
- Создайте первое микрофлюидное устройство полидиметилсилоксана (PDMS) из фотомаски с пластиной SU-8.
- Приготовьте ~200 г PDMS путем смешивания основы и отверждающего агента в соотношении 10:1 мас/вес (см. Таблицу материалов).
- Поместите СУ-8 в культурную посуду (приклейте края к блюду) микрофлюидной конструкцией вверх.
- Вылейте PDMS в блюдо, чтобы над вафлей образовался слой толщиной 1-1,5 см. Поместите посуду под вакуум, чтобы удалить пузырьки.
- Дайте PDMS отверждаться до затвердевания (24 ч при комнатной температуре или ~2 ч при 60 °C).
- После того, как PDMS отверждается, осторожно используйте лезвие бритвы или скальпель, чтобы разрезать прямоугольник через PDMS, так что на пластине есть поле 0,5-1 см вокруг конструкции.
ПРИМЕЧАНИЕ: Не используйте слишком большое давление и будьте очень осторожны, чтобы избежать повреждения (например, растрескивания, царапин) пластины. - Вклините шпатель в один из разрезов и проведите им вдоль разрезов, чтобы отделить PDMS от пластины.
ПРИМЕЧАНИЕ: Когда PDMS отделяется от пластины, под PDMS начнет образовываться воздушный пузырь (см. Рисунок 3B). - Используйте шпатель, чтобы осторожно поднять прямоугольник PDMS из тарелки.
ПРИМЕЧАНИЕ: Результирующим зазором в PDMS над пластиной будет форма для микрофлюидных устройств.
- Создание последующих микрофлюидных устройств PDMS из фотомаски СУ-8.
- Приготовьте ~15-20 г PDMS на форму, смешивая основу и отверждающий агент в соотношении 10:1.
- Вылейте PDMS в прямоугольный зазор в пресс-форме, чтобы создать слой PDMS 5 мм над пластиной. Поместите форму под вакуум, чтобы удалить пузырьки.
- Дайте PDMS отверждаться до полного затвердевания (24 ч при комнатной температуре или 2 ч при 60 °C).
- После того, как PDMS отверждается, используйте лезвие бритвы или скальпель, чтобы разрезать PDMS по краям прямоугольника.
ПРИМЕЧАНИЕ: Не используйте слишком большое давление и будьте очень осторожны, чтобы избежать повреждения (т. Е. растрескивания) пластины. - Вклините шпатель в один из разрезов и проведите им вдоль разрезов, чтобы отделить PDMS от пластины.
ПРИМЕЧАНИЕ: Когда PDMS отделяется от пластины, под PDMS начнет образовываться воздушный пузырь. - Используйте 1,5 мм биопсийный перфоратор для создания отверстий через прямоугольник PDMS на двух входах и выходе (см. Рисунок 3B).
- Если на одной пластине есть несколько устройств, используйте шпатель или лезвие бритвы, чтобы слегка оценить PDMS между каждым устройством, а затем аккуратно сложите PDMS вдоль забитых линий, чтобы PDMS отделялся очень четко сам по себе.
- Храните устройства PDMS в беспылевом контейнере.
- Прикрепите микрофлюидные устройства PDMS к стеклянным слайдам.
- Подготовьте один стеклянный слайд на микрофлюидное устройство PDMS. Используйте ленту, фильтрованный воздух или изопропиловый спирт (IPA), чтобы удалить пыль с слайда. Убедитесь, что слайды полностью высохли, прежде чем переходить к следующему шагу.
- Поместите стеклянную горку и устройство PDMS, конструктивно вверх, рядом друг с другом на небольшой пластиковый лоток (для этого хорошо подходит крышка пластины на 96 лунок) и поместите его в плазменный очиститель. Закройте дверцу и клапан воздушного потока и включите вакуумный насос. Дайте ему работать не менее 30 с, затем выключите его.
- Подключите газовую трубку кислородного баллона к клапану воздушного потока. Дайте плазменной камере заполниться кислородом на 30 с, затем выключите кислород и закройте клапан воздушного потока.
- Включите вакуумный насос и установите уровень радиочастоты (RF) на высокий. Подождите, пока камера приобретет фиолетово-розовый цвет (см. рисунок 3B). Дайте пройти 30 с.
- Когда таймер погаснет, выключите плазму и вакуум. Затем медленно откройте клапан воздушного потока, чтобы освободить вакуум. Извлеките лоток из плазменного очистителя.
- Осторожно переверните устройство PDMS на стеклянный слайд, чтобы связать их. По мере того, как происходит склеивание, обратите внимание на небольшую разницу в прозрачности PDMS.
ПРИМЕЧАНИЕ: Для достижения наилучших результатов храните склеенные устройства при температуре 60 °C непосредственно перед использованием.
- Обработка поверхности микрофлюидных устройств PDMS
- Подготовьте обработку поверхности путем разбавления PFOCTS (трихлор(1H,1H,2H,2H-перфтороктил)силан) в масло Novec (1:50). Используйте 1 мл для 3-4 устройств. Переведите объем на шприц объемом 1 мл и прикрепите иглу весом 25 г.
ПРИМЕЧАНИЕ: Иглы, используемые в этом протоколе, скошены, поэтому будьте осторожны при обращении с острыми предметами. Тупые иглы также могут быть использованы при желании. - Вырежьте кусок трубки Tygon размером 10-12 см на устройство, которое будет обработано.
- Вырежьте кусок трубки PEEK, ~7 см в длину. Вставьте пару миллиметров трубки PEEK в конец трубки Tygon, как показано на рисунке 4A, чтобы предотвратить прокалывание иглой входных отверстий трубки Tygon.
- Выньте устройство (устройства) из нагреваемой камеры и вставьте не-PEEK конец трубки Tygon в водное входное отверстие.
- Вставьте иглу шприца для обработки поверхности в трубку PEEK и закройте выходное отверстие масляной камеры (см. рисунок 3B).
- Вводите обработку в устройство медленно и убедитесь, что оно заполняет устройство, без пузырьков. Подождите, пока сначала заполнятся водные камеры, затем меньшие каналы, а затем масляная камера. Снимите трубку Tygon с устройства. После того, как устройство будет заполнено, дайте ему отдохнуть в течение 10 минут при комнатной температуре.
- Наполните шприц объемом 5 мл только маслом (без силана) и прикрепите иглу весом 25 г.
- Аспирировать обработку поверхности из устройства через входные и выходные отверстия. Вставьте трубку Tygon в водное входное отверстие, вставьте шприц с маслом в трубку PEEK и промывайте каждое устройство маслом. Аспирируйте масло из устройства.
- Повторите промывку масла еще в 2 раза. Снимите трубку Tygon.
ПРИМЕЧАНИЕ: Устройство готово к использованию.
- Подготовьте обработку поверхности путем разбавления PFOCTS (трихлор(1H,1H,2H,2H-перфтороктил)силан) в масло Novec (1:50). Используйте 1 мл для 3-4 устройств. Переведите объем на шприц объемом 1 мл и прикрепите иглу весом 25 г.

Рисунок 3: Микрофлюидное PDMS-устройство. (A) Чертеж микрофлюидного устройства с помощью компьютерного проектирования (AutoCAD). Образование микрогелевых капель происходит в каналах по обе стороны от масляного канала, как видно по увеличенному обнажению. (B) Обзор изготовления устройств PDMS. Аббревиатура: PDMS = полидиметилсилоксан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Микрофлюидная генерация микрогелей
- Предопределить желаемые концентрации полимера, сшивателя и других компонентов-предшественников геля (т.е. пептидов, гликозаминогликанов). Растворите PEG-MAL, RGD и MethMAL (PEG-основа) в 10x PBS (pH 1,5) и сшивающем MMP-2 вместе с 5 мкМ биотин-малеимида в 1x PBS (pH 7,4).
ПРИМЕЧАНИЕ: В настоящем протоколе раствор-предшественник геля представляет собой опубликованную композицию3 , состоящую из 45,88 мг/мл 4-армеевого ПЭГ-МАЛ (10 кДа), 0,82 мг/мл RGD, 8,06 мг/мл MethMAL и 4,62 мг/мл сшивки MMP-2 (ферментативно разлагаемый сшиватель). Методы, описанные ниже, дадут ~ 3 мл микрогелей. - Приготовьте 6 мл раствора поверхностно-активного вещества, разбавляя запас 5% FluoroSurfactant до не менее 1% в масло Novec. Добавьте этот раствор в шприц объемом 10 мл.
ПРИМЕЧАНИЕ: Фторированное поверхностно-активное вещество не смешивается с водой, что позволяет легко удалять его во время перехода геля в водную фазу во время промывок PBS на стадии очистки. - Вырежьте три куска трубки Tygon, которые имеют подходящую длину для высоты шприцевого насоса.
- Вырежьте два куска трубки PEEK, ~ 1 дюйм в длину. Вставьте пару миллиметров трубки PEEK в конец двух частей трубки Tygon, как показано на рисунке 4A, чтобы предотвратить прокалывание иглой входных отверстий трубки Tygon.
- Вставьте не-PEEK конец трубки Tygon во входные отверстия микрофлюидных устройств. Вставьте оставшийся кусок трубки Tygon (без трубки PEEK на конце) в розетку микрофлюидного устройства, как показано на рисунке 4C.
- Добавьте не менее 3 мл масла в пластиковый шприц объемом 5 мл и прикрепите его к игле весом 25 г. Осторожно вставьте иглу в трубку PEEK на одном из входов Tygon. Аккуратно промойте трубку и устройство маслом. Соберите масло с выходного отверстия в коническую трубку. Повторите промывку маслом на другом входе Tygon.
- Установите шприцевые насосы на желаемые скорости потока.
ПРИМЕЧАНИЕ: Этот протокол использует 3 мл/ч для водного расхода и 6 мл/ч для расхода масла. Может потребоваться использование двух отдельных шприцевых насосов. - Подключите шприц, содержащий поверхностно-активное вещество, к входному отверстию масла с помощью иглы 25 Г (см. фиг.4А) и осторожно дозируйте достаточно масла для грунтовки трубки и масляного канала микрофлюидного устройства.
- После того, как устройство и масляные входы будут установлены, добавьте 0,5 мл масла в новый шприц объемом 5 мл, который будет содержать предшественник геля. Цель этого небольшого количества масла состоит в том, чтобы помочь промыть раствор предшественника через микрофуилидное устройство к концу пробега.
- В конической трубке смешайте 1,5 мл основного раствора ПЭГ и 1,5 мл раствора сшивателя. Вихрь в течение 30 с и быстро переносят комбинированный раствор предшественника геля на шприц объемом 5 мл.
- Соедините шприц с раствором-предшественником геля с водным входом с помощью иглы 25 г. Аккуратно дозируйте достаточное количество раствора, чтобы загрунтовать трубку и водный канал.
- Зажмите шприцы на соответствующих шприцевых насосах и нажмите нажим (см. рисунок 4B). Убедитесь, что жидкость течет как через водный, так и через масляный каналы.
ПРИМЕЧАНИЕ: Рекомендуется использовать микроскоп для визуализации образования микрогелей в устройстве PDMS. - Ищите частицы одинакового размера из каналов (см. рисунок 4D). Соберите микрогели с выходного отверстия в коническую трубку.

Рисунок 4: Микрофлюидная установка. (A) Описание способа соединения трубки PEEK (вверху) и трубки Tygon к игле 25 G на шприце (снизу). (B) Микрофлюидная установка со шприцевыми насосами, трубками, устройством и микроскопом. (C) Изображение установки микрофлюидного устройства с двумя входами (водным и масляным) и одним выходом. (D) Схема микрофлюидного устройства и репрезентативное изображение яркого поля ожидаемого образования микрогелей из каналов в устройстве ступенчатой эмульгации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Очистка и стерилизация микрогелей
- После того, как гелеобразование завершено (определяется как время до плато модуля хранения в характеристике кинетики гелеобразования), используйте пипетку, чтобы аккуратно удалить масляную фазу со дна трубки (см. Рисунок 5). Поместите его в соответствующий контейнер для отходов для фторированных отходов.
ПРИМЕЧАНИЕ: Время гелеобразования может быть ускорено путем добавления органического растворимого основания в коллекторную трубку (например, триэтиламин), но важно отметить, что добавление сильного основания может гидролизовать любые непрореагировавшие малеимиды. Если желательно функционализировать микрогели за счет избытка малеимидов после гелеобразования, пропустите добавление триэтиламина. - Добавьте больше масла в пробирку для сбора микрогелей в соотношении 1:1. Перемешайте, аккуратно перевернув коллекционный тюбик. Не вихрь.
- Дайте коллекционной трубке отстояться в течение ~ 5 минут, чтобы фазы разделились. Обратите внимание на масляную фазу внизу и водную фазу (микрогели) сверху (см. рисунок 5).
- Повторите промывку маслом как минимум в 2 раза больше.
- Добавьте больше масла в соотношении 1:1 с гелем и добавьте 1 pBS в соотношении 4:1 PBS к гелю. Инвертировать, чтобы перемешать несколько раз. Чтобы разделить слои, центрифугируйте трубку при ~2000 х г в течение ~30 с. Обратите внимание на масляную фазу в нижней части трубки, гель в середине и PBS сверху (см. рисунок 5).
- Удалите масляную фазу с помощью пипетки и выбросьте в контейнер для отходов.
ПРИМЕЧАНИЕ: Не удаляйте PBS. Используйте большую коническую трубку для продолжения промывки, если первоначальная сборная трубка была 15 мл. - Повторите промывки маслом и PBS еще в 2 раза. Ищите гель, чтобы перейти от непрозрачного к прозрачному к окончательной промывке, как показано на рисунке 5, что указывает на то, что поверхностно-активное вещество было удалено, а гель находится в фазе PBS.
- Удалите все масло. Не удаляйте PBS из конической трубки.
- В химическом вытяжном шкафу используйте стеклянную пипетку, чтобы добавить гексаны в трубку в объеме, равном PBS. Вихрь конической трубки в течение 30 с или до полного перемешивания. Центрифуга при 4,696 х г в течение 5 мин.
- После разделения ищите гексаны в верхнем слое, PBS в середине и гель внизу (см. рисунок 5). Снимите слой гексана и выбросьте его в контейнер для органических отходов. Аспирировать PBS.
- Повторный гексан и PBS смывает по меньшей мере в 2 раза больше или до тех пор, пока гель не станет почти полупрозрачным (см. Рисунок 5). Промыть гель PBS в 1 раз больше, чтобы все оставшиеся гексаны были удалены. Центрифуга при 4,696 х г в течение 5 мин. Аспирация слоя PBS. Позаботьтесь о том, чтобы не потревожить гелевую гранулу.
- Чтобы закрыть или погасить любые непрореагировавшие малеимиды в микрогелях, приготовьте раствор N-ацетил-L-цистеина в 1x PBS и добавьте этот раствор в гель. Поместите на трубчатый ротатор при 37 °C на ночь, после чего последует много промывок PBS для удаления непрореагировавшего N-ацетил-L-цистеина.
- Для длительного хранения (до 1 года) повторно суспендируют микрогели в 70% IPA и хранят при 4 °C, чтобы предотвратить рост бактерий на микрогелях.
- Чтобы стерилизовать микрогели, добавьте 70% IPA к гелю в соотношении 4:1 v/v в вытяжке биобезопасности. Вращайте трубку в течение 30 с, затем центрифугируйте при 4,696 × г в течение 5 мин. Аспирировать супернатант IPA из гелевой гранулы в вытяжке биобезопасности. Выполните еще 2 стирки IPA, а затем 3 стирки со стерильным 1x PBS.
ПРИМЕЧАНИЕ: Все IPA должны быть удалены перед использованием геля с клетками или животными.
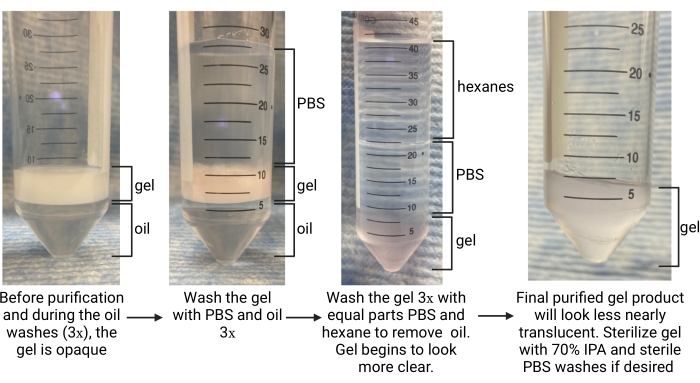
Рисунок 5: Обзор процедуры очистки микрогелей. Сокращения: PBS = фосфатно-буферный физиологический раствор; IPA = изопропиловый спирт. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Характеристика размера микрогеля
ПРИМЕЧАНИЕ: Рекомендуется позволить микрогелевым частицам уравновешиваться в 1x PBS в течение ночи при 37 °C, чтобы набухнуть до их конечного диаметра перед калибровкой.
- Изображение частиц геля.
- Раскрутите гель MAP при 4,696 × г в течение 5 мин и аспирируйте супернатант.
- Используя пипетку с положительным смещением, удалите 5 мкл микрогелей из гелевой гранулы и разведите в 1 мл PBS в микроцентрифужной трубке (разведение 1:200). Отрегулируйте это разбавление по мере необходимости.
ПРИМЕЧАНИЕ: Во время приготовления раствора-предшественника геля можно добавлять 5 мкМ биотин-малеимида и использовать в качестве альтернативы маркировке микрогелей флуорофором. В этом случае стрептавидин-флуорофор можно добавлять в разведении 1:300 (из запаса 1 мг/мл). Разрешите инкубацию со стрептавидином в течение не менее 15 мин перед визуализацией. - Используя пипетку с положительным смещением, перенесите 100 мкл разбавленных микрогелей в скважины прозрачной 96-луночной плиты.
- Используйте широкоугольный или конфокальный микроскоп для визуализации микрогелей с 10-кратным объективом. Получение изображений микрогелей для анализа.
- См. рисунок 6 для репрезентативных конфокальных изображений микрогелей.
- Определение размеров частиц с помощью ImageJ
- Откройте файлы изображений из микроскопа в ImageJ.
- Выберите Анализ | Установите Масштаб и установите масштаб изображения в соответствии с целью микроскопа.
- Выберите | изображений Тип | 8-бит.
- Выберите | изображений Отрегулируйте | Порог , а затем выберите опцию автоматического порога "Otsu" в раскрывающемся списке.
- Нажмите на Анализ | Установите измерения и выберите Диаметр Ферета и предел до порога.
- Нажмите на Анализ | Анализируйте частицы и вводите диапазон размеров области (в пикселях^2), ожидаемый для микрогелей (чтобы исключить мелкий мусор из анализа). Измените цикличность на 0,75-1,00 и выберите Показать | Контуры. Установите флажок Отображаемые результаты и Исключить по краям.
ПРИМЕЧАНИЕ: Фильтр формы окружности исключает микрогели на границе изображения, которые могут привести к неточному измерению диаметра. - Запустите модуль Анализ частиц .
- Дождитесь выходных данных, которые представляют собой диаметр Ферета каждой частицы, и экспортируйте эти результаты в электронную таблицу.
- В этом протоколе рассчитывают индекс полидисперсности (PDI) для определения неоднородности размера микрогеля. Проанализируйте не менее 100 микрогелей для определения популяции: диапазон PDI 1,00-1,05 определяет монодисперсную популяцию, а PDI больше 1,05 определяет полидисперсную популяцию. Используйте уравнение (2), уравнение (3) и уравнение (4) для вычисления PDI, как описано ниже.
 (2)
(2) (3)
(3)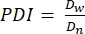 (4)
(4)

Рисунок 6: Репрезентативные изображения микрогелей. (A) Флуоресцентное конфокальное изображение микрогелевой популяции A, (B) изображение пороговых микрогелей и (C) контуров частиц после анализа ImageJ. (D) Флуоресцентное конфокальное изображение микрогелевой популяции B и (E) пропускаемое световое изображение микрогелей (микрогели почти полупрозрачные). (F) Отображение репрезентативных результатов анализа ImageJ, изложенного в настоящем протоколе. Обе популяции микрогелей имеют относительно монодисперсные PDI. Обе популяции микрогелей были синтезированы со скоростью водного потока 3 мл/ч и расходом масла 6 мл/ч. Однако разница в размере микрогеля обусловлена различиями в размере шага микрофлюидного устройства. Например, микрогелевую популяцию А синтезировали с помощью микрофлюидного устройства с размером шага канала 11 мкм, а микрогелевую популяцию В синтезировали в устройстве с размером шага 40 мкм. Шкала стержней = 100 мкм. Аббревиатура: PDI = индекс полидисперсности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Микропористый отжиг частиц (MAP) отжиг леса
- Создают запасной раствор из 2 мМ лития фенил-2,4,6-триметилбензоилфосфината (LAP) в 1x PBS (рН 7,4).
- Разбавьте раствор LAP до 0,2 мМ в объеме 1x PBS, эквивалентном объему геля. Если вы используете фотоинициатор LAP для клеточных исследований или исследований на животных, обязательно стерилизуйте раствор перед использованием.
- Раскрутите гель MAP при 4,696 × г в течение 5 мин и аспирируйте супернатант.
- Используя пипетку с положительным смещением, перенесите нужный объем геля в микроцентрифужную трубку.
- Добавьте 0,2 мМ LAP к гелю в объемном соотношении 1:1 (конечная концентрация LAP составляет 0,1 мМ).
- Вращайте смесь и инкубируйте в течение не менее 15 мин в темноте.
- Центрифугируйте смесь при 18 000 × г в течение 5 мин, чтобы гранулировать гель.
- Осторожно удалите супернатант из гелевой гранулы.
- Перенесите гель MAP в целевое место с помощью пипетки с положительным смещением.
- Примените сфокусированный свет (365 нм, 8,66 мВт/см2) к образцу в течение 113 с для отжига каркаса.
ПРИМЕЧАНИЕ: Время отжига 113 с было оптимизировано, как было ранее опубликовано для концентрации LAP 0,1 мМ14, но может потребоваться дополнительная оптимизация для различных концентраций фотоинициаторов.
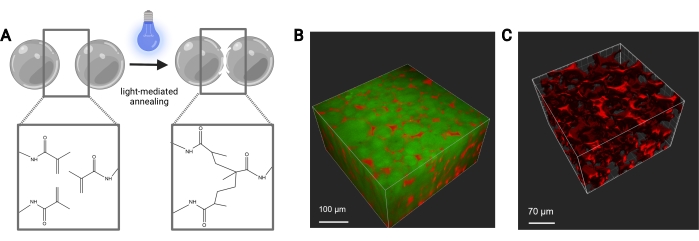
Рисунок 7: Отжиг строительных лесов MAP. (A) Схема отжига каркасов MAP. При воздействии фотоинициатора и света функциональные группы метакриламидов на макромере MethMAL подвергаются реакции фотополимеризации щелчка, которая связывает поверхности микрогелей вместе. (B) Изображение 3D-рендеринга (Imaris) двухфотонного микроскопического изображения микрогелей MAP (зеленый), отожженных вместе в форме 3D-шайбы, с декстраном (красным) в порах. (C) Изображение 3D-рендеринга (Imaris) изображения двухфотонного микроскопа, показывающего пористость каркаса MAP, который был перфузирован флуоресцентным декстраном 70 кДа (красный). Шкала стержней = (B) 100 мкм, (C) 70 мкм. Сокращения: MAP = микропористая отожженная частица; MethMAL = пользовательский макромер отжига. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Целью этого протокола является описание всех шагов, необходимых для синтеза микрогелевых строительных блоков, которые будут использоваться в каркасе MAP. Макромер отжига MethMAL является высокоселективным и эффективным и совместим с несколькими полимерными магистралями14. Важно, чтобы не менее 67%-75% 20 кДа ПЭГ-малеимида модифицировали с помощью метакриламидов функциональных групп для обеспечения высокой эффективности отжига. Процент модификации может быть наиболее легко определен путем анализа 1пиков спектров H-ЯМР, как показано на рисунке 1. Кинетика гелеобразования, определяемая вискозиметром, является важным показателем, который следует учитывать для каждого состава геля. В этом протоколе используется раствор-предшественник геля, состоящий из основы ПЭГ с группой MAL, который эффективно реагирует с тиол-функционализированными сшивающими для микрогелеобразования. Однако многие химические гидрогели могут быть использованы для изготовления микрогелей с помощью высокопроизводительного микрофлюидного способа, описанного в настоящем описании. Время до начала гелеобразования даст представление о продолжительности генерации микрофлюидных микрогелей. Рекомендуется выбирать рН предшественника геля, который может инициировать гелеобразование между 30 мин (рисунок 2) и 2 ч.
Если время гелеобразования слишком быстрое, раствор предшественника геля начнет полимеризоваться внутри микрофлюидного устройства и закупорить каналы. Кроме того, важно отметить, что изменение концентраций тиолированных лигандов (например, RGD) может оказывать влияние на образование сети во время гелеобразования и, возможно, потребуется учитывать путем корректировки состава. Этапы изготовления микрофлюидного устройства могут быть утомительными, но репрезентативные результаты успешно связанного устройства показаны на рисунке 3. Этот протокол использует высокопроизводительное, параллельное, ступенчатое эмульгированное микрофлюидное устройство, которое было адаптировано из дизайна de Rutte et al.13, а производство кремниевых пластин было передано на аутсорсинг компании по микрофлюидным технологиям. Тем не менее, шаги, описанные в этом протоколе, могут быть использованы с любой конструкцией устройства, выгравированной на фотомаске с кремниевой пластиной SU-8. Важно отметить, что размер шага каналов на фотомаске должен быть оптимизирован во время изготовления устройства, так как это повлияет на размер частиц микрогеля.
Скорость потока для микрофлюидной генерации микрогелей должна быть оптимизирована для каждого состава геля на основе таких факторов, как время гелеобразования, желаемый размер частиц и конструкция микрофлюидного устройства. При использовании высокопроизводительного устройства скорость потока для водной фазы может достигать 5 мл/ч. На рисунке 4B показана настройка для высокопроизводительных устройств, используемых в этом протоколе. Если устройство работает правильно, образование микрогелей должно выглядеть аналогично тому, что показано на рисунке 4D. Перед очисткой микрогели будут непрозрачными. После завершения различных промывок маслом, PBS и гексаном гель должен выглядеть прозрачным, как репрезентативное изображение на рисунке 5. При включении флуорофора в микрогели очищенный продукт может иметь легкий цветной оттенок, но все же должен быть близок к полупрозрачному. После очищения и отека микрогели должны быть очень однородными по размеру и иметь PDI между 1,00 и 1,05, как показано на рисунке 6. Различные фотоинициаторы могут быть использованы для фотопареления каркасов MAP. При использовании альтернативы LAP, описанной в настоящем описании, необходимо определить кинетику отжига, какописано ранее 14. Кроме того, для фотоаннелирования могут использоваться различные источники света, если источник света соответствует фотоинициатору. Необходимо обязательно откалибровать и сфокусировать источник света. Время отжига и интенсивность света, возможно, потребуется оптимизировать на основе состава геля и концентрации фотоинициатора. Метод отжига, описанный в этом протоколе, может быть использован для исследований in vitro и in vivo. После отжига микрогели образуют пористый каркас, который можно визуализировать с помощью двухфотонной микроскопии (рисунок 7B-C).
Обсуждение
Этот протокол описывает методы синтеза и характеристики микрогелей, которые служат строительными блоками для каркасов микропористых отожженных частиц (MAP). Этот протокол использует высокопроизводительный микрофлюидный подход для генерации больших объемов однородных микрогелей, что не может быть достигнуто с помощью других методов, таких как микрофлюидика с фокусировкой потока 1,4,7,9 (высокая монодисперистика, низкий выход), серийная эмульсия 6,10 и электромостановка 5,12 (низкая монодисперсность, высокая урожайность). С помощью способов, описанных в настоящем описании, монодисперсные микрогели могут быть изготовлены для использования в каркасах MAP, которые могут быть использованы для различных применений регенеративной медицины (например, доставка клеток, заживление ран).
Критическим этапом этого протокола является создание микрофлюидных устройств PDMS. Если устройства сделаны неправильно, это может оказать негативное влияние на образование микрогелей и монодисперсность. Важно предотвратить введение артефактов (т.е. пузырьков, пыли) в PDMS до того, как она затвердеет, так как это может закупорить каналы и значительно повлиять на образование микрогелей. Чтобы максимально смягчить это, следует использовать ленту для удаления пыли, хранить устройства в беспылевом контейнере и работать в беспыльной вытяжке, если это возможно. Также рекомендуется хранить устройства при температуре 60 °C для достижения наилучших результатов при обработке поверхности.
При заливке устройств PDMS важно поддерживать равномерную толщину, которая примерно равна или меньше длины биопсийного перфоратора. Если устройство слишком толстое, биопсийный удар не сможет проникнуть до конца. Также важно не разрывать входные отверстия / выходы устройства PDMS во время пробивки с помощью биопсийного перфоратора и / или вставки трубки. Разрыв в устройстве PDMS вызовет утечку из входных /выходных отверстий, что может привести к потере раствора предшественника геля. Если в устройстве PDMS произошла утечка, лучшим решением будет заменить его новым устройством как можно быстрее.
При плазменной обработке устройства использование чистого кислорода и плазменная обработка в течение 30 с дали наилучшие результаты для прилипания PDMS к стеклянной горке. Если устройство не склеивается правильно (т.е. PDMS все еще может быть поднята со стеклянного слайда после плазменной обработки), следует дважды проверить, что плазменный очиститель работает правильно и что устройство и слайды были тщательно очищены. Также важно использовать правильную обработку поверхности силана, и для достижения наилучших результатов устройства PDMS должны быть обработаны непосредственно перед использованием. Можно также использовать другие методы обработки поверхности, такие как химическое осаждение из паровой фазы.
Другим важным шагом является правильное использование микрофлюидных устройств PDMS для образования микрогелей. Рекомендуется использовать коэффициент расхода не менее 2:1 (в этом протоколе используется расход масла 6 мл/ч и водный расход 3 мл/ч), но это может быть настроено для достижения желаемого размера микрогеля. pH раствора предшественника микрогеля также является важным показателем для оптимизации для предотвращения засорения устройства. Фосфат-буферный физиологический раствор (PBS) ускоряет образование тиолата в химии добавок типа Майкла, а концентрации PBS, используемые в этом протоколе, дают наилучшие результаты для микрогелеобразования в микрофлюидных устройствах. Как только шприцевые насосы запущены, в микрофлюидных каналах могут быть некоторые пузырьки, но это должно уравновеситься через несколько минут. Рекомендуется контролировать образование микрогелей с помощью микроскопа. Если поток не выглядит похожим, как в этом видео, и / или есть несколько каналов, производящих крупные частицы, это, вероятно, связано с проблемами со стадией обработки поверхности. Лучшим решением является замена устройства на тот, который был недавно обработан поверхностью.
Если микрогели кажутся сливающимися, это может быть связано с недостаточной концентрацией FluoroSurfactant. Рекомендуемым решением является увеличение мас.% поверхностно-активного вещества в масляной фазе. Однако одним из ограничений использования высоких концентраций поверхностно-активного вещества является то, что его может быть труднее удалить на этапе очистки. Рекомендуется использовать микрофлюидные устройства только один раз, но устройства могут быть повторно использованы при промывке маслом Novec сразу после использования для удаления любого водного раствора, который может залить гель в устройстве и закупорить каналы. В то время как одно микрофлюидное устройство может производить высокопроизводительный объем микрогелей (мл / ч), эта скорость производства может быть масштабирована с использованием нескольких микрофлюидных устройств параллельно.
Этап отжига сборки каркаса MAP основан на использовании светоактивированного фотоинициатора радикальной полимеризации, и фотоинициатор может быть выбран на основе желаемого применения. Например, фотоинициатор LAP имеет быстрое время отжига (<30 с) при использовании длинноволнового ультрафиолетового света, что оказывает минимальное влияние на жизнеспособность клеток in vitro14. Однако эта длина волны сильно поглощается тканью16 и может не иметь такой высокой эффективности отжига in vivo , как in vitro.
Eosin Y является еще одним фотоинициатором, активируемым видимыми длинами волн (505 нм) и имеет более глубокое проникновение в ткань, что повышает способность каркаса MAP отжигаться под тканью. Однако длительное время воздействия света, необходимое для отжига Eosin Y, может продлить воздействие свободных радикалов на клетки и повлиять на жизнеспособность клеток in vitro14. Использование этих методов для высокопроизводительной генерации высокооднородных микрогелевых строительных блоков ускорит исследования MAP, ориентированные на строительные леса, и расширит знания в области инъекционных пористых материалов для регенеративной медицины.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Авторы хотели бы поблагодарить Джо де Рютте и лабораторию Ди Карло в Калифорнийском университете в Лос-Анджелесе за их помощь в оригинальном дизайне микрофлюидного устройства, на основе которого было разработано указанное устройство, а также за их раннее руководство по изготовлению устройств PDMS и устранению неполадок. Схемы рисунков были созданы с помощью Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-aminoethanethiol hydrochloride | Acros Organics | AC153770250 | For MethMal Synthesis MW: 113.61 Da |
| 35 mm plate rotor | HAAKE | P35/Ti | Geometry for HAAKE viscometer |
| 4-arm PEG-Maleimide (10 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-100MA | For microgel precursor solution |
| 4-arm PEG-Maleimide (20 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-200MA | For MethMal Synthesis Molecular weight specific to each batch |
| BD Syringe with Luer-Lok Tips | Becton Dickinson | Disposable plastic syringes | |
| Biopsy punch | Mitex | MLTX33-31A-P/25 | 1.5 mm diameter |
| Chloroform-d | Acros Organics | AC209561000 | For MethMal Synthesis |
| Collimated LED Light Source | ThorLabs | M365LP1-C1 | 365 nm |
| Culture dish (15 cm) | Corning | CLS430599 | 150 mm x 25 mm |
| DMTMM(4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride) | Oakwood Chemical | 151882 | For MethMal Synthesis MW: 276.72 Da |
| Fluorosurfactant | Ran Technologies | 008-Flurosurfactant-5wtH-200G | 5 weight percent of 008-Flurosurfactant in HFE7500 |
| FreeZone Triad Freeze Dry System | Labconco | 7400000 Series | For MethMal Synthesis Lyophilizer |
| Glass slides | Fisher Scientific | 12-550-A3 | Plain glass slides, uncoated |
| HAAKE Rheowin viscometer | HAAKE | ||
| ImageJ | version 1.8.0_172 | ||
| KDS Legato 210 Dual Prong Syringe Pump | Kd Scientific | ||
| LED Driver | ThorLabs | DC2200 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | Photoinitiator |
| Methacrylic Acid | Sigma Aldrich | 155721 | For MethMal Synthesis MW: 86.09 Da Density: 1.015g/mL |
| Microfluidic device SU8-Si master wafer | FlowJem | N/A | Custom-made, with silanization |
| MMP-2 degradable crosslinker | FlowJem | Sequence: Ac-GCGPQGIAGQDGCG-NH2 | |
| Needles (25 G, beveled) | BD | 305122 | Length: 15.88 mm Gauge: 0.5 mm |
| Novec 7500 | 3M | 7100025016 | Fluorinated oil |
| Oxygen | Praxair | UN1072 | Compressed |
| Peek tubing | Trajan Scientific | 03-350-523 | 1/32" Outer Diameter; 0.02" Inner Diameter; 10' Length |
| PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) | Sigma-Aldrich | 448931 | For surface treatment |
| Phosphate Buffered Saline | Fisher BioReagants | BP3994 | Diluted to 1x in ultrapure water, pH = 7.4 |
| Plasma cleaner | Harrick Plasma | PDC-001-HP | |
| Razor blade | Fisher Scientific | 12-640 | |
| RGD cell adhesive peptide | WatsonBio Sciences | Sequence: Ac-RGDSPGGC-NH2 | |
| Rheowin software | HAAKE | Software compatible with HAAKE viscometer | |
| Scalpel blade | Bard-Parker | 371210 | Size: #10 |
| Scalpel handle | Bard-Parker | 371030 | Size: #3 |
| Sodium Chloride | Fisher BioReagents | BP358-1 | For MethMal Synthesis MW: 58.44 Da |
| Sylgard 184 silicone elastomer kit | DOW Chemical | 2065622 | Base and curing agent |
| Triethylamine | Fisher Scientific | O4884-100 | For MethMal Synthesis MW: 101.19 Da Density: 0.73g/mL |
| Tygon tubing | Saint Gobain Performance Plastics | AAD04103 | ID: 0.51 mm OD: 1.52 mm |
| Varian Inova 500 Spectrometer | Varian | NMR Located in the UVA Biomolecular Magnetic Resonance Facility |
Ссылки
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Advanced Functional Materials. 31 (35), 2104337 (2021).
- Darling, N. J., Sideris, E., Hamada, N., Carmichael, S. T., Segura, T. Injectable and spatially patterned microporous annealed particle (MAP) hydrogels for tissue repair applications. Advanced Science. 5 (11), 1801046 (2018).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science and Engineering. 5 (12), 6395-6404 (2019).
- Pruett, L., et al. Development of a microporous annealed particle hydrogel for long-term vocal fold augmentation. Laryngoscope. 130 (10), 2432-2441 (2020).
- Nih, L. R., Sideris, E., Carmichael, S. T., Segura, T. Injection of microporous annealing particle (MAP) hydrogels in the stroke cavity reduces gliosis and inflammation and promotes NPC migration to the lesion. Advanced Materials. 29 (32), (2017).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Schaeffer, C., et al. Injectable microannealed porous scaffold for articular cartilage regeneration. Annals of Plastic Surgery. 84, 446-450 (2020).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Jivan, F., Alge, D. L. Bio-orthogonal, site-selective conjugation of recombinant proteins to microporous annealed particle hydrogels for tissue engineering. Advanced Therapeutics. 3 (1), 1900148 (2020).
- de Rutte, J. M., Koh, J., di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071 (2019).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomaterials Science and Engineering. 7 (2), 422-427 (2021).
- Darling, N. J., Hung, Y. S., Sharma, S., Segura, T. Controlling the kinetics of thiol-maleimide Michael-type addition gelation kinetics for the generation of homogenous poly(ethylene glycol) hydrogels. Biomaterials. 101, 199-206 (2016).
- Sandell, J. L., Zhu, T. C. A review of in-vivo optical properties of human tissues and its impact on PDT. Journal of Biophotonics. 4 (11-12), 773-787 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены