Method Article
Sintesi microfluidica di blocchi costitutivi in microgel per scaffold di particelle ricotto microporose
In questo articolo
Riepilogo
Questo protocollo descrive una serie di metodi per sintetizzare i mattoni del microgel per lo scaffold di particelle ricotto microporoso, che possono essere utilizzati per una varietà di applicazioni di medicina rigenerativa.
Abstract
La piattaforma di scaffold a particelle ricotto microporose (MAP) è una sottoclasse di idrogel granulari. È composto da un impasto iniettabile di microgel che può formare un'impalcatura strutturalmente stabile con porosità su scala cellulare in situ seguendo una fase di reticolazione chimica secondaria basata sulla luce (cioè ricottura). Lo scaffold MAP ha dimostrato il successo in una varietà di applicazioni di medicina rigenerativa, tra cui la guarigione delle ferite dermiche, l'aumento delle corde vocali e la somministrazione di cellule staminali. Questo articolo descrive i metodi per la sintesi e la caratterizzazione dei microgel di poli(glicole etilenico) (PEG) come elementi costitutivi per formare un'impalcatura MAP. Questi metodi includono la sintesi di un macromero di ricottura personalizzato (MethMAL), la determinazione della cinetica di gelificazione del precursore del microgel, la fabbricazione di dispositivi microfluidici, la generazione microfluidica di microgel, la purificazione del microgel e la caratterizzazione di base dello scaffold, incluso il dimensionamento del microgel e la ricottura dello scaffold. In particolare, i metodi microfluidici ad alta produttività descritti nel presente documento possono produrre grandi volumi di microgel che possono essere utilizzati per generare scaffold MAP per qualsiasi applicazione desiderata, specialmente nel campo della medicina rigenerativa.
Introduzione
La piattaforma di scaffold MAP è un biomateriale iniettabile composto interamente da microparticelle di idrogel (microgel) che forniscono microporosità su scala cellulare quando reticolate insieme, consentendo la migrazione cellulare indipendente dalla degradazione e l'integrazione di tessuti sfusi1. Grazie alla sua capacità di integrarsi rapidamente con il tessuto ospite e all'immunogenicità intrinsecamente bassa, la piattaforma di scaffold MAP ha dimostrato l'applicabilità preclinica per un'ampia varietà di terapie di medicina rigenerativa 2,3,4,5,6,7,8,9,10, inclusa l'accelerazione della guarigione delle ferite dermiche 1,3 ,11, rivascolarizzando la cavità cerebrale7, fornendo cellule staminali mesenchimali2 e fornendo bulking tissutale per trattare l'insufficienza glottica6. È stato anche dimostrato che la MAP trasmette effetti antinfiammatori al tessuto ospite attraverso il reclutamento di macrofagi M23 e può anche essere sintonizzata per promuovere una risposta immunitaria di "riparazione tissutale" Th28. Queste proprietà favorevoli della piattaforma di scaffold MAP consentono di espanderla a una vasta gamma di applicazioni cliniche.
I metodi precedentemente pubblicati per generare microgel per la formazione di scaffold MAP hanno incluso la microfluidica a goccia di focalizzazione del flusso 1,4,7,9, l'elettrospruzzatura 5,12 e la filatura aerea con emulsione batch 6,10. Il metodo microfluidico a goccia può produrre particelle con elevata monodispersità ma utilizza portate molto lente che producono basse rese di particelle (μL / h). In alternativa, i metodi di elettrospruzzatura e di emulsione batch possono produrre un elevato volume di particelle, ma con elevata polidispersità delle particelle. Questo protocollo utilizza un metodo microfluidico ad alto rendimento per produrre microgel con una popolazione monodispersa, basato sul lavoro di de Rutte et al13. Questo metodo utilizza tecniche di litografia morbida per realizzare un dispositivo microfluidico di polidimetilsilossano (PDMS) da una fotomaschera, che viene poi incollata a un vetrino. Il design del dispositivo si basa sull'emulsificazione a gradini per generare un elevato volume di particelle di microgel (mL/h). La monodispersità che può essere raggiunta con questo metodo fornisce un controllo superiore della porosità rispetto ad altre tecniche, poiché i microgel monodispersi possono formare scaffold con dimensioni dei pori più uniformi2.
I metodi per sintetizzare e caratterizzare i singoli microgel che possono fungere da elementi costitutivi per gli scaffold MAP sono delineati all'interno di questo manoscritto, in particolare in termini di creazione di microgel costituiti da una spina dorsale PEG con un gruppo maleimmide (MAL), che partecipa prontamente all'efficiente aggiunta di tipo Michael con reticolanti funzionalizzati tioli per la gelificazione di microgel. Per disaccoppiare la gelificazione del microgel dalla ricottura dello scaffold MAP, questo manoscritto descrive anche come sintetizzare un macromero di ricotturapersonalizzato pubblicato su 14 , MethMAL, che è un macromero PEG eterofunzionale a 4 bracci metacrilammide / maleimmide. I gruppi funzionali di metacrilammide partecipano prontamente alla fotopolimerizzazione dei radicali liberi (per la ricottura di microgel), pur rimanendo relativamente inerti alle condizioni che promuovono l'aggiunta di tipo Michael per i gruppi funzionali MAL.
Inoltre, questo manoscritto delinea i protocolli per la creazione di dispositivi microfluidici PDMS, la determinazione della cinetica di gelificazione del microgel e la caratterizzazione delle dimensioni del microgel. La parte finale del manoscritto descrive in dettaglio la ricottura dello scaffold MAP, che è quando i microgel vengono trasferiti in situ in un'impalcatura di massa attraverso una fase secondaria di reticolazione avviata dalla foto che lega covalentemente le superfici dei microgel. È importante notare che esistono altri metodi di ricottura che possono essere implementati nei sistemi di scaffold MAP che non si basano su sostanze chimiche basate sulla luce, come la ricottura mediata da enzimi, come descritto in precedenza1. Nel complesso, questi metodi possono essere utilizzati direttamente o utilizzati con diverse sostanze chimiche di formulazione di idrogel (ad esempio, a base di acido ialuronico) per generare scaffold MAP per qualsiasi applicazione.
Protocollo
1. Sintesi dei macromeri di ricottura MethMAL
NOTA: Questo protocollo è specifico per modificare 1 g di PEG-maleimide, ma può essere scalato per creare lotti più grandi.
- Aggiungere 1 g di PEG-maleimmide a 4 bracci da 20 kDa a 10 mL di soluzione salina tamponata con fosfato 1x (PBS, pH 7,4) in un piccolo becher di vetro con un agitatore. Mescolare la soluzione a 300 giri/min fino a completa dissoluzione del PEG (~30 min).
- Aggiungere 14,65 mg di 2-amminoetantiolo (rapporto molare da 0,67:1 tiolo [SH] a maleimmide [MAL]) alla reazione agitando a 300 giri/min.
NOTA: I gruppi tiolici sul 2-amminoetantiolo saranno aggiunti a circa tre bracci del PEG-MAL tramite addizione di tipo Michael, lasciando i gruppi terminali amminici.- Osservare il seguente esempio di calcolo per la quantità di 2-amminoetantiolo da aggiungere:
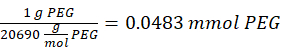


NOTA: Per evitare di misurare una quantità molto piccola, sciogliere 100 mg di 2-amminoetantiolo in 1 mL di 1x PBS (pH 7,4) e aggiungere 146,5 μL di tale soluzione alla reazione.
- Osservare il seguente esempio di calcolo per la quantità di 2-amminoetantiolo da aggiungere:
- Attendere 1 ora e 10 minuti dopo il punto 1.2., quindi mescolare 160,1 mg di 4-(4,6-dimetossi-1,3,5-triazin-2-il)-4-metilmorfolinio cloruro (DMTMM, rapporto molare 12:1 a PEG) e 32,77 μL di acido metacrilico (rapporto molare 8:1 a PEG) in 5 ml di 1x PBS (pH 7,4) in un nuovo becher di vetro e reagire per 50 minuti agitando a 300 giri/min.
NOTA: In questa fase, l'acido metacrilico reagisce con DMTMM per formare un estere altamente reattivo che può quindi essere accoppiato ai gruppi amminici disponibili sul PEG.- Osservare il seguente esempio di calcolo per calcolare la quantità di DMTMM da aggiungere:



- Osservare il seguente esempio di calcolo per calcolare la quantità di acido metacrilico da aggiungere:

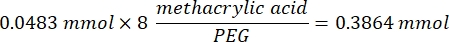


- Osservare il seguente esempio di calcolo per calcolare la quantità di DMTMM da aggiungere:
- Aggiungere la soluzione di acido metacrilico/DMTMM al becher con la soluzione di 20 kDa PEG-MAL/2-amminoetantiolo.
- Aggiungere 53,56 μL di trietilammina (rapporto molare 1:1 all'acido metacrilico) al becher e lasciare reagire per una notte agitando a 300 giri/min. Coprire il becher con un foglio per evitare che polvere e altri contaminanti entrino nel becher.
- Osservare il seguente esempio di calcolo per la quantità di trietilammina da aggiungere:


- Osservare il seguente esempio di calcolo per la quantità di trietilammina da aggiungere:
- Trasferire la reazione al tubo di dialisi in pelle di serpente (limite di peso molecolare: 3.500 Da).
- Posizionare il tubo di dialisi in un becher grande con 1 M NaCl in acqua deionizzata (DI) (il volume deve coprire interamente il tubo) per 3 giorni agitando a 300 giri / min. Cambiare la soluzione 1 M NaCl 2 volte al giorno per un totale di sei lavaggi.
- Dialyze per 6 h in acqua DI. Cambiare l'acqua DI ogni ora per un totale di sei lavaggi.
- Trasferire la reazione in un tubo conico da 50 mL e congelare a -80 °C.
- Liofilizzare il tubo per almeno 72 ore ad una temperatura iniziale di -70 °C e una rampa di temperatura di 0,01 °C/min fino a 0 °C.
- Preparare il campione per 1H-NMR sciogliendo 25 mg di MethMAL in 700 μL di cloroformio-d e trasferirlo in una provetta NMR.
- Acquisire gli spettri 1H-NMR.
NOTA: Gli spettri in questo protocollo sono stati acquisiti utilizzando uno spettrometro a 500 MHz con i seguenti parametri: larghezza di scansione = 6.467,3 Hz, ritardo = 13,1 s, tempo di acquisizione = 5,1 s, tempo di impulso = 5,1 μs e numero di scansioni = 8. - Per l'analisi, integrare il picco di maleimmide come riferimento (~6,76 ppm) e quindi integrare i due picchi di metacrilammide (~5,35 ppm e 5,6 ppm). Dividere il rapporto delle aree dei picchi di metacrilammide per l'area totale di tutti e tre i picchi per ottenere la percentuale di bracci modificati con metacrilammide.
NOTA: Una modifica accettabile è la sostituzione del gruppo funzionale di metacrilammide del 67%-75%. Un esempio di spettro H-NMR1 per MethMAL è mostrato nella Figura 1.- Usa l'equazione (1) come equazione del grado di sostituzione:
 (1)
(1)
- Usa l'equazione (1) come equazione del grado di sostituzione:

Figura 1: Struttura chimica e 1spettro H-NMR di MethMAL. (A) Struttura chimica: il macromero di ricottura MethMAL è composto da 20 kDa a 4 bracci di poli(glicole etilenico) modificato con tre bracci di metacrilammide. (B) Questa struttura genera picchi a 5,36 ppm (3) e 5,76 ppm (2) non presenti negli spettri PEG-MAL, e un braccio maleimmide, che genera un picco a 6,71 ppm (1). Il solvente, il cloroformio, ha generato un picco a 7,26 ppm e l'acqua residua in questo campione ha generato un picco a 2,2 ppm (etichettato sugli spettri). Negli spettri MethMAL, il picco della maleimmide aveva un'area integrata di 0,27 e la somma delle aree dei picchi di metacrilammide era 0,73 (0,37 + 0,36). La variazione percentuale di metacrilammide è stata del 73% (0,73/(0,27 + 0,73)). Questa figura è tratta da Pfaff et al.14. Diritto d'autore (2021) American Chemical Society. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Cinetica di gelificazione del precursore del microgel
NOTA: Il tempo di gelificazione può essere modificato regolando il pH del tampone utilizzato per sciogliere i componenti precursori del gel. Per gli idrogel PEG-maleimmide, un pH più acido corrisponde tipicamente a un tempo di gelificazione più lento poiché la concentrazione di tiolato è diminuita a pH15 inferiore.
- Predeterminare le concentrazioni desiderate di polimero, reticolante e altri componenti precursori del gel (cioè peptidi, glicosaminoglicani). Sciogliere PEG-MAL, RGD e MethMAL (PEG-backbone) in 10x PBS (pH 1,5) e il reticolante MMP-2 in 1x PBS (pH 7,4).
NOTA: In questo protocollo, la soluzione precursore del gel è una formulazione pubblicata3, che consiste di 45,88 mg / ml PEG-MAL a 4 bracci (10 kDa), 0,82 mg / mL RGD, 8,06 mg / mL MethMAL e 4,62 mg / mL MMP-2 crosslinker (reticolante enzimaticamente degradabile). - Preparare un viscosimetro, o uno strumento equivalente, per monitorare i moduli di stoccaggio e perdita utilizzando una dimensione dello spazio di 0,4 mm, una deformazione di taglio di 1,0, una frequenza di 1,0 Hz e una durata di 10.800 s.
- Collegare una geometria del rotore a piastre da 35 mm (P35/Ti). Utilizzare una camera umidificata o una spugna umida attorno alla geometria per mantenere un ambiente umidificato.
- Mescolare la spina dorsale PEG e il reticolante MMP in un rapporto volumetrico 1:1.
- Pipettare 400 μL della soluzione precursore del gel al centro dello stadio viscosimetrico.
- Abbassare lentamente la geometria sul palco fino a raggiungere la dimensione predeterminata dello spazio di 0,4 mm e iniziare immediatamente a monitorare i moduli di stoccaggio (G') e perdita (G'') fino a 6 ore a temperatura ambiente.
NOTA: La gelificazione è considerata iniziare quando il modulo di stoccaggio diventa maggiore del modulo di perdita e la gelificazione è considerata completa quando il modulo di stoccaggio si stabilizza. Una curva cinetica di gelificazione rappresentativa è mostrata nella Figura 2.
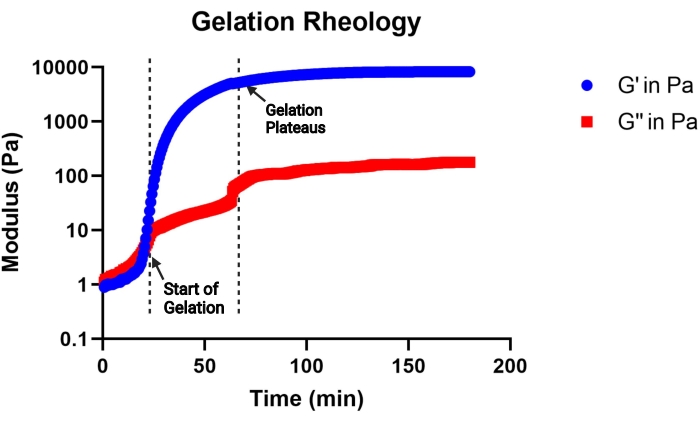
Figura 2: Curva rappresentativa della cinetica di gelificazione di una soluzione precursore di gel MAP (pH 4,5) determinata da un viscosimetro. La gelificazione inizia al rapido aumento del modulo di stoccaggio (G') e la gelificazione si completa quando la curva G' si stabilizza. G'' indica il modulo di perdita. Questa figura è tratta da Pruett et al.3. Diritto d'autore (2021) Wiley-VCH GmBH. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Fabbricazione di dispositivi microfluidici
NOTA: Questo protocollo descrive la fabbricazione di un dispositivo di emulsificazione microfluidica adattato da de Rutte et al.13, che può essere visto in Figura 3A. Tuttavia, questo protocollo può essere utilizzato con qualsiasi progetto di dispositivo inciso in un wafer SU-8. Si consiglia di esternalizzare la fabbricazione master del wafer di silicio SU-8, a meno che non siano disponibili le strutture appropriate per la fabbricazione.
- Creare il primo dispositivo microfluidico di polidimetilsilossano (PDMS) da una fotomaschera per wafer SU-8.
- Preparare ~200 g di PDMS mescolando la base e l'agente di polimerizzazione in un rapporto di 10:1 p/p (vedere la tabella dei materiali).
- Posizionare il wafer SU-8 in un piatto di coltura (fissare i bordi del wafer al piatto), con il design microfluidico rivolto verso l'alto.
- Versare PDMS nel piatto per creare uno strato di 1-1,5 cm di spessore sul wafer. Posizionare il piatto sotto vuoto per rimuovere eventuali bolle.
- Lasciare polimerizzare il PDMS fino a solidificazione (24 h a temperatura ambiente o ~2 h a 60 °C).
- Una volta che il PDMS si è indurito, utilizzare con attenzione una lama di rasoio o un bisturi per tagliare un rettangolo attraverso il PDMS, in modo tale che ci sia un margine di 0,5-1 cm attorno al disegno sul wafer.
NOTA: Non usare troppa pressione ed essere molto delicato per evitare di danneggiare (ad esempio, screpolature, graffi) il wafer. - Incuneare una spatola in uno dei tagli e farla scorrere lungo i tagli per separare il PDMS dal wafer.
NOTA: quando il PDMS si separa dal wafer, una bolla d'aria inizierà a formarsi sotto il PDMS (fare riferimento alla Figura 3B). - Utilizzare la spatola per sollevare delicatamente il rettangolo di PDMS dal piatto.
NOTA: Lo spazio risultante nel PDMS sopra il wafer sarà lo stampo per i dispositivi microfluidici.
- Creare dispositivi microfluidici PDMS successivi dalla fotomaschera del wafer SU-8.
- Preparare ~ 15-20 g di PDMS per stampo mescolando la base e l'agente polimerizzante in un rapporto 10: 1.
- Versare PDMS nello spazio rettangolare nello stampo per creare uno strato di 5 mm di PDMS sopra il wafer. Mettere lo stampo sotto vuoto per rimuovere eventuali bolle.
- Lasciare polimerizzare il PDMS fino a completa solidificazione (24 h a temperatura ambiente o 2 h a 60 °C).
- Una volta che il PDMS si è indurito, utilizzare una lama di rasoio o un bisturi per tagliare il PDMS attorno ai bordi del rettangolo.
NOTA: Non usare troppa pressione ed essere molto delicato per evitare di danneggiare (cioè rompere) il wafer. - Incuneare una spatola in uno dei tagli e farla scorrere lungo i tagli per separare il PDMS dal wafer.
NOTA: quando il PDMS si separa dal wafer, una bolla d'aria inizierà a formarsi sotto il PDMS. - Utilizzare un punzone bioptico da 1,5 mm per creare fori attraverso il rettangolo PDMS alle due prese e alle uscite (fare riferimento alla Figura 3B).
- Se ci sono più dispositivi su un singolo wafer, utilizzare una spatola o una lametta per segnare leggermente il PDMS tra ciascun dispositivo, quindi piegare delicatamente il PDMS lungo le linee segnate in modo che il PDMS si separi in modo molto pulito da solo.
- Conservare i dispositivi PDMS in un contenitore privo di polvere.
- Incollare i dispositivi microfluidici PDMS ai vetrini.
- Preparare un vetrino per ogni dispositivo microfluidico PDMS. Utilizzare nastri a nastro, aria filtrata o lavaggi con alcool isopropilico (IPA) per rimuovere la polvere dal vetrino. Assicurati che le diapositive siano completamente asciutte prima di passare al passaggio successivo.
- Posizionare un vetrino e un dispositivo PDMS, con il lato rivolto verso l'alto, uno accanto all'altro su un piccolo vassoio di plastica (un coperchio a piastra a 96 pozzetti funziona bene per questo) e metterlo in un detergente al plasma. Chiudere la porta e la valvola del flusso d'aria e accendere la pompa per vuoto. Lasciarlo funzionare per almeno 30 secondi, quindi spegnerlo.
- Collegare il tubo del gas del serbatoio dell'ossigeno alla valvola del flusso d'aria. Lasciare che la camera al plasma si riempia di ossigeno per 30 s, quindi spegnere l'ossigeno e chiudere la valvola del flusso d'aria.
- Accendere la pompa per vuoto e impostare il livello di radiofrequenza (RF) su alto. Attendere che la camera diventi di colore rosa-violaceo (fare riferimento alla Figura 3B). Lasciare passare 30 s.
- Quando il timer si spegne, spegnere il plasma e aspirare. Quindi, aprire lentamente la valvola del flusso d'aria per rilasciare il vuoto. Rimuovere il vassoio dal detergente al plasma.
- Capovolgere delicatamente il dispositivo PDMS sul vetrino per incollarli. Mentre avviene l'incollaggio, osservare la leggera differenza nella trasparenza del PDMS.
NOTA: Per ottenere risultati ottimali, conservare i dispositivi incollati a 60 °C fino a immediatamente prima dell'uso.
- Trattamento superficiale dei dispositivi microfluidici PDMS
- Preparare il trattamento superficiale diluendo i PFOCT (tricloro(1H,1H,2H,2H-perfluoroottil)silano) in olio di Novec (1:50). Utilizzare 1 mL per 3-4 dispositivi. Trasferire il volume in una siringa da 1 mL e inserire un ago da 25 G.
NOTA: Gli aghi utilizzati in questo protocollo sono smussati, quindi prestare attenzione quando si maneggiano oggetti taglienti. Gli aghi smussati possono anche essere utilizzati se lo si desidera. - Tagliare un pezzo di tubo Tygon di 10-12 cm per dispositivo che verrà trattato.
- Tagliare un pezzo di tubo PEEK, ~ 7 cm di lunghezza. Inserire un paio di millimetri del tubo in PEEK all'estremità del tubo Tygon, come mostrato nella Figura 4A, per evitare che l'ago fori le prese dei tubi Tygon.
- Estrarre il/i dispositivo/i dalla camera riscaldata e inserire l'estremità non PEEK del tubo Tygon nel foro acquoso di ingresso.
- Inserire l'ago della siringa per il trattamento superficiale nel tubo in PEEK e coprire il foro di uscita della camera dell'olio (fare riferimento alla Figura 3B).
- Iniettare lentamente il trattamento nel dispositivo e assicurarsi che riempia il dispositivo, senza bolle. Attendere che le camere acquose si riempiano prima, seguite dai canali più piccoli e quindi dalla camera dell'olio. Rimuovere il tubo Tygon dal dispositivo. Una volta riempito il dispositivo, lasciarlo riposare per 10 minuti a temperatura ambiente.
- Riempire una siringa da 5 mL solo con olio (senza silano) e inserire un ago da 25 G.
- Aspirare il trattamento superficiale dal dispositivo attraverso gli ingressi e l'uscita. Inserire il tubo Tygon nell'ingresso acquoso, inserire la siringa con olio nel tubo PEEK e lavare ogni dispositivo con olio. Aspirare l'olio dal dispositivo.
- Ripetere il lavaggio dell'olio 2 volte di più. Rimuovere il tubo Tygon.
NOTA: il dispositivo è pronto per essere utilizzato.
- Preparare il trattamento superficiale diluendo i PFOCT (tricloro(1H,1H,2H,2H-perfluoroottil)silano) in olio di Novec (1:50). Utilizzare 1 mL per 3-4 dispositivi. Trasferire il volume in una siringa da 1 mL e inserire un ago da 25 G.

Figura 3: Dispositivo PDMS microfluidico . (A) Disegno di progettazione assistita da computer (AutoCAD) del progetto di dispositivi microfluidici. La formazione di goccioline di microgel si verifica nei canali su entrambi i lati del canale dell'olio, come si vede nell'affioramento ingrandito. (B) Panoramica della fabbricazione dei dispositivi PDMS. Abbreviazione: PDMS = polidimetilsilossano. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Generazione microfluidica di microgel
- Predeterminare le concentrazioni desiderate di polimero, reticolante e altri componenti precursori del gel (cioè peptidi, glicosaminoglicani). Sciogliere PEG-MAL, RGD e MethMAL (PEG-backbone) in 10x PBS (pH 1,5) e il reticolante MMP-2 insieme a 5 μM di biotina-maleimmide in 1x PBS (pH 7,4).
NOTA: In questo protocollo, la soluzione precursore del gel è una formulazione pubblicata3 composta da 45,88 mg/mL di PEG-MAL a 4 bracci (10 kDa), 0,82 mg/mL RGD, 8,06 mg/mL di MethMAL e 4,62 mg/mL di reticolante MMP-2 (reticolante enzimaticamente degradabile). I metodi descritti di seguito produrranno ~ 3 ml di microgel. - Preparare 6 mL di soluzione di tensioattivo diluendo il brodo 5% di FluoroSurfactant ad almeno l'1% in olio di Novec. Aggiungere questa soluzione a una siringa da 10 ml.
NOTA: Il tensioattivo fluorurato è immiscibile con acqua, il che consente di essere facilmente rimosso durante la transizione del gel alla fase acquosa durante i lavaggi PBS nella fase di purificazione. - Tagliare tre pezzi di tubi Tygon di lunghezza appropriata per l'altezza della pompa della siringa.
- Tagliare due pezzi di tubo PEEK, ~ 1 pollice di lunghezza. Inserire un paio di millimetri del tubo in PEEK all'estremità di due pezzi di tubi Tygon, come mostrato nella Figura 4A, per evitare che l'ago fori gli ingressi dei tubi Tygon.
- Inserire l'estremità non PEEK del tubo Tygon negli ingressi dei dispositivi microfluidici. Inserire il pezzo rimanente del tubo Tygon (senza tubo PEEK all'estremità) nell'uscita del dispositivo microfluidico, come mostrato nella Figura 4C.
- Aggiungere almeno 3 ml di olio a una siringa di plastica da 5 ml e collegarla a un ago da 25 G. Inserire con cautela l'ago nel tubo in PEEK su una delle prese Tygon. Lavare delicatamente il tubo e il dispositivo con olio. Raccogliere l'olio dall'uscita in un tubo conico. Ripetere il flusso dell'olio sull'altra entrata di Tygon.
- Impostare le pompe a siringa sulle portate desiderate.
NOTA: Questo protocollo utilizza 3 mL/h per la portata acquosa e 6 mL/h per la portata dell'olio. Potrebbe essere necessario utilizzare due pompe a siringa separate. - Collegare la siringa contenente il tensioattivo all'ingresso dell'olio tramite un ago da 25 G (fare riferimento alla Figura 4A) ed erogare delicatamente abbastanza olio per innescare il tubo e il canale dell'olio del dispositivo microfluidico.
- Una volta installato il dispositivo e gli ingressi dell'olio, aggiungere 0,5 ml di olio a una nuova siringa da 5 ml, che conterrà il precursore del gel. Lo scopo di questa piccola quantità di olio è quello di aiutare a lavare la soluzione precursore attraverso il dispositivo microfuilidico verso la fine della corsa.
- In un tubo conico, combinare 1,5 mL della soluzione PEG-backbone e 1,5 mL della soluzione reticolante. Vortex per 30 s e trasferire rapidamente la soluzione combinata di precursori del gel alla siringa da 5 ml.
- Collegare la siringa con la soluzione precursore del gel all'ingresso acquoso tramite un ago da 25 G. Erogare delicatamente una soluzione sufficiente per innescare il tubo e il canale acquoso.
- Fissare le siringhe sulle rispettive pompe a siringa e premere ( fare riferimento alla Figura 4B). Assicurarsi che ci sia liquido che scorre attraverso entrambi i canali acquosi e dell'olio.
NOTA: Si consiglia di utilizzare un microscopio per visualizzare la formazione di microgel all'interno del dispositivo PDMS. - Cercare particelle di dimensioni uniformi dai canali (fare riferimento alla Figura 4D). Raccogliere i microgel dalla presa in un tubo conico.

Figura 4: Configurazione microfluidica. (A) Rappresentazione del metodo per collegare il tubo PEEK (in alto) e il tubo Tygon a un ago da 25 G su una siringa (in basso). (B) Configurazione microfluidica con pompe a siringa, tubi, dispositivi e microscopio. (C) Immagine della configurazione del dispositivo microfluidico, con due ingressi (acquoso e olio) e un'uscita. (D) Schema del dispositivo microfluidico e immagine rappresentativa in campo chiaro della formazione prevista di microgel dai canali in un dispositivo di emulsificazione a gradini. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Purificazione e sterilizzazione dei microgel
- Una volta completata la gelificazione (determinata come plateau del modulo di conservazione nel tempo di conservazione nella caratterizzazione della cinetica di gelificazione), utilizzare una pipetta per rimuovere con attenzione la fase dell'olio dal fondo del tubo (fare riferimento alla Figura 5). Depositarlo in un contenitore appropriato per i rifiuti fluorurati.
NOTA: Il tempo di gelificazione può essere accelerato aggiungendo una base solubile organica al tubo di raccolta (ad esempio, trietilammina), ma è importante notare che l'aggiunta di una base forte può idrolizzare qualsiasi maleimide non reagita. Se si desidera funzionalizzare i microgel attraverso l'eccesso di maleimidi dopo la gelificazione, saltare l'aggiunta di trietilammina. - Aggiungere altro olio nel tubo di raccolta del microgel in un rapporto 1: 1. Mescolare capovolgendo delicatamente il tubo di raccolta. Non vortice.
- Lasciare che il tubo di raccolta si depositi per ~ 5 minuti per consentire alle fasi di separarsi. Cercare la fase oleosa in basso e la fase acquosa (i microgel) in alto (fare riferimento alla Figura 5).
- Ripetere i lavaggi con olio almeno altre 2 volte.
- Aggiungi più olio in un rapporto 1: 1 con il gel e aggiungi 1x PBS in un rapporto PBS / gel 4: 1. Capovolgere per mescolare più volte. Per separare gli strati, centrifugare il tubo a ~ 2.000 x g per ~ 30 s. Cercare la fase dell'olio nella parte inferiore del tubo, il gel al centro e il PBS in alto (fare riferimento alla Figura 5).
- Rimuovere la fase olio con una pipetta e gettarla in un contenitore per rifiuti.
NOTA: non rimuovere il PBS. Utilizzare un tubo conico più grande per continuare i lavaggi se il tubo di raccolta originale era di 15 ml. - Ripeti l'olio e il PBS lava 2 volte di più. Cercare che il gel passi da opaco a trasparente entro il lavaggio finale, come mostrato nella Figura 5, indicando che il tensioattivo è stato rimosso e il gel è nella fase PBS.
- Rimuovere tutto l'olio. Non rimuovere PBS dal tubo conico.
- In una cappa aspirante chimica, utilizzare una pipetta di vetro per aggiungere esano al tubo con un volume uguale al PBS. Vortice il tubo conico per 30 s o fino a quando non mescolato accuratamente. Centrifugare a 4.696 x g per 5 min.
- Dopo la separazione, cercare esani nello strato superiore, PBS nel mezzo e gel nella parte inferiore (fare riferimento alla Figura 5). Rimuovere lo strato di esano e gettarlo in un contenitore per rifiuti organici. Aspirare il PBS.
- Ripetere l'esano e il PBS lava almeno altre 2 volte o fino a quando il gel appare quasi traslucido (fare riferimento alla Figura 5). Lavare il gel con PBS 1 volte di più in modo da rimuovere eventuali esani rimanenti. Centrifugare a 4.696 x g per 5 min. Aspirare il livello PBS. Fare attenzione a non disturbare il pellet di gel.
- Per coprire, o estinguere, qualsiasi maleimidi non reagito nei microgel, preparare una soluzione 100 mM di N-acetil-L-cisteina in 1x PBS e aggiungere questa soluzione al gel. Porre su un rotatore a tubo a 37 ° C durante la notte, seguito da molti lavaggi con PBS per rimuovere N-acetil-L-cisteina non reagita.
- Per la conservazione a lungo termine (fino a 1 anno), risospendere i microgel in alcool isopropilico al 70% e conservare a 4 °C per aiutare a prevenire la crescita di batteri sui microgel.
- Per sterilizzare i microgel, aggiungere il 70% di alcool isopropilico al gel in un rapporto 4: 1 v / v in una cappa di biosicurezza. Vortice il tubo per 30 s, quindi centrifugare a 4.696 × g per 5 min. Aspirare il surnatante IPA dal pellet di gel in una cappa di biosicurezza. Eseguire 2 volte più lavaggi IPA seguiti da 3 lavaggi con 1x PBS sterile.
NOTA: Tutto l'alcool isopropilico deve essere rimosso prima di utilizzare il gel con cellule o animali.
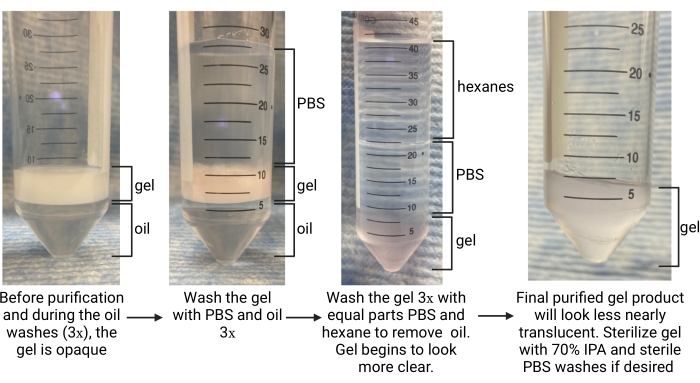
Figura 5: Panoramica della procedura di purificazione del microgel. Abbreviazioni: PBS = soluzione salina tamponata con fosfato; IPA = alcool isopropilico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Caratterizzazione delle dimensioni dei microgel
NOTA: Si raccomanda di lasciare che le particelle di microgel si equilibrino in 1x PBS durante la notte a 37 °C per gonfiarsi al loro diametro finale prima del dimensionamento.
- Particelle di gel immagine.
- Ruotare il gel MAP a 4.696 × g per 5 minuti e aspirare il surnatante.
- Utilizzando una pipetta volumetrica, rimuovere 5 μL di microgel dal pellet di gel e diluire in 1 mL di PBS in una provetta per microcentrifuga (diluizione 1:200). Regolare questa diluizione secondo necessità.
NOTA: Durante la formulazione della soluzione precursore del gel, 5 μM di biotina-maleimmide possono essere aggiunti e utilizzati come alternativa alla marcatura di microgel con un fluoroforo. In questo caso, è possibile aggiungere uno streptavidina-fluoroforo ad una diluizione 1:300 (da 1 mg/mL di stock). Consentire l'incubazione con streptavidina per almeno 15 minuti prima dell'imaging. - Utilizzando una pipetta a spostamento positivo, trasferire 100 μL dei microgel diluiti ai pozzetti di una piastra trasparente da 96 pozzetti.
- Utilizzare un microscopio a campo largo o confocale per visualizzare i microgel con un obiettivo 10x. Acquisire immagini dei microgel per l'analisi.
- Vedere la Figura 6 per le immagini confocali rappresentative dei microgel.
- Dimensionamento delle particelle con ImageJ
- Aprire i file di immagine dal microscopio in ImageJ.
- Seleziona Analizza | Impostare Scala e impostare la scala dell'immagine in base all'obiettivo del microscopio.
- Seleziona immagine | Tipo | 8 bit.
- Seleziona immagine | Regolare | Soglia, quindi selezionare l'opzione di soglia automatica "Otsu" dalla casella a discesa.
- Clicca su Analizza | Impostate Misure e selezionate Diametro di Feret e limite alla soglia.
- Clicca su Analizza | Analizzare le particelle e inserire l'intervallo di dimensioni dell'area (in pixel ^ 2) previsto per i microgel (per escludere piccoli detriti dall'analisi). Modificare la circolarità in 0,75-1,00 e selezionare Mostra | Contorni. Controllare Visualizza risultati ed Escludi sui bordi.
NOTA: il filtro a forma di circolarità esclude i microgel sul bordo dell'immagine che potrebbero produrre una misurazione del diametro imprecisa. - Eseguire il modulo Analizza particelle .
- Attendi l'output, che è il diametro di Faret di ogni particella, ed esporta questi risultati in un foglio di calcolo.
- In questo protocollo, calcolare l'indice di polidispersione (PDI) per determinare l'eterogeneità nella dimensione del microgel. Analizzare almeno 100 microgel per definire una popolazione: un intervallo PDI di 1,00-1,05 definisce una popolazione monodispersa e un PDI maggiore di 1,05 definisce una popolazione polidispersa. Utilizzare l'equazione (2), l'equazione (3) e l'equazione (4) per calcolare il PDI, come descritto di seguito.
 (2)
(2) (3)
(3)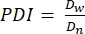 (4)
(4)

Figura 6: Immagini rappresentative dei microgel. (A) Immagine confocale fluorescente della popolazione di microgel A, (B) immagine dei microgel sospesi e (C) contorni delle particelle dopo l'analisi ImageJ. (D) Immagine confocale fluorescente della popolazione di microgel B e (E) immagine a luce trasmessa dei microgel (i microgel sono quasi traslucidi). (F) Rappresentazione dei risultati rappresentativi dell'analisi ImageJ delineata nel presente protocollo. Entrambe le popolazioni di microgel hanno PDI relativamente monodispersi. Entrambe le popolazioni di microgel sono state sintetizzate con una portata acquosa di 3 mL/h e una portata d'olio di 6 mL/h. Tuttavia, la differenza nella dimensione del microgel è dovuta alle differenze nelle dimensioni del passo del dispositivo microfluidico. Ad esempio, la popolazione di microgel A è stata sintetizzata con un dispositivo microfluidico con una dimensione del passo del canale di 11 μm e la popolazione di microgel B è stata sintetizzata in un dispositivo con una dimensione del passo di 40 μm. Barre della scala = 100 μm. Abbreviazione: PDI = indice di polidispersità. Fare clic qui per visualizzare una versione ingrandita di questa figura.
7. Ricottura dell'impalcatura di particelle ricotto microporose (MAP)
- Creare una soluzione madre di 2 mM di litio fenil-2,4,6-trimetilbenzoilfosfinato (LAP) in 1x PBS (pH 7,4).
- Diluire la soluzione madre LAP a 0,2 mM in un volume di 1x PBS equivalente al volume del gel. Se si utilizza il fotoiniziatore LAP per studi cellulari o studi su animali, assicurarsi di sterilizzare la soluzione prima dell'uso.
- Ruotare il gel MAP a 4.696 × g per 5 minuti e aspirare il surnatante.
- Utilizzando una pipetta volumetrica, trasferire il volume desiderato di gel in una provetta per microcentrifuga.
- Aggiungere 0,2 mM LAP al gel in un rapporto volumetrico 1:1 (la concentrazione finale di LAP è 0,1 mM).
- Vortice la miscela e incubare per almeno 15 minuti al buio.
- Centrifugare la miscela a 18.000 × g per 5 minuti per pellettare il gel.
- Rimuovere con attenzione il surnatante dal pellet di gel.
- Trasferire il gel MAP nella posizione di destinazione con una pipetta a spostamento positivo.
- Applicare luce focalizzata (365 nm, 8,66 mW/cm2) al campione per 113 s per ricottura dello scaffold.
NOTA: Il tempo di ricottura di 113 s è stato ottimizzato come precedentemente pubblicato per una concentrazione LAP di 0,1 mM14, ma potrebbe essere necessaria un'ulteriore ottimizzazione per diverse concentrazioni di fotoiniziatori.
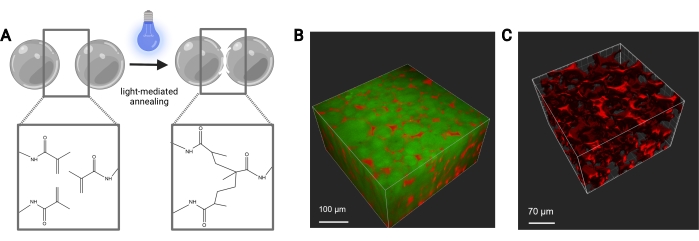
Figura 7: Ricottura delle impalcature MAP. (A) Schema della ricottura delle impalcature MAP. Quando esposti a un fotoiniziatore e alla luce, i gruppi funzionali di metacrilammide sul macromero MethMAL subiscono una reazione di fotopolimerizzazione a clic, che lega insieme le superfici dei microgel. (B) Rappresentazione di un rendering 3D (Imaris) di un'immagine al microscopio a due fotoni di microgel MAP (verde) ricotti insieme in una forma di disco 3D, con destrano (rosso) nei pori. (C) Rappresentazione di un rendering 3D (Imaris) di un'immagine al microscopio a due fotoni che mostra la porosità di un'impalcatura MAP che è stata perfusa con destrano fluorescente da 70 kDa (rosso). Barre della scala = (B) 100 μm, (C) 70 μm. Abbreviazioni: MAP = particella ricotto microporosa; MethMAL = macromero di ricottura personalizzato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Lo scopo di questo protocollo è quello di delineare tutti i passaggi necessari per sintetizzare i mattoni del microgel da utilizzare in uno scaffold MAP. Il macromero di ricottura MethMAL è altamente selettivo ed efficiente ed è compatibile con più dorsali polimeriche14. È importante che almeno il 67%-75% dei 20 kDa PEG-maleimmide sia modificato con gruppi funzionali di metacrilammide per garantire un'elevata efficienza di ricottura. La variazione percentuale può essere determinata più facilmente analizzando 1 picco spettrale H-NMR, come mostrato in Figura 1. La cinetica di gelificazione, determinata da un viscosimetro, è una metrica importante da considerare per ogni formulazione di gel. Questo protocollo utilizza una soluzione precursore del gel costituita da una spina dorsale PEG con un gruppo MAL, che reagisce efficacemente con reticolanti funzionalizzati al tiolo per la gelificazione del microgel. Tuttavia, molte sostanze chimiche dell'idrogel possono essere utilizzate per fabbricare microgel tramite il metodo microfluidico ad alta produttività descritto nel presente documento. Il tempo di inizio della gelificazione fornirà informazioni sulla durata della generazione di microgel microfluidici. Si raccomanda di scegliere un pH precursore del gel che possa iniziare la gelificazione tra 30 minuti (Figura 2) e 2 ore.
Se il tempo di gelificazione è troppo veloce, la soluzione precursore del gel inizierà a polimerizzare all'interno del dispositivo microfluidico e ostruirà i canali. Inoltre, è importante notare che la variazione delle concentrazioni di ligando tiolato (ad esempio, RGD) può avere impatti sulla formazione della rete durante la gelificazione e potrebbe essere necessario tenere conto regolando la formulazione. Le fasi di fabbricazione del dispositivo microfluidico possono essere noiose, ma i risultati rappresentativi di un dispositivo legato con successo sono mostrati nella Figura 3. Questo protocollo utilizza un dispositivo microfluidico ad alta produttività, parallelizzato, ad emulsificazione a gradini che è stato adattato da un progetto di de Rutte et al.13, e la fabbricazione di wafer di silicio è stata esternalizzata a una società di tecnologia microfluidica. Tuttavia, i passaggi descritti in questo protocollo possono essere utilizzati con qualsiasi design del dispositivo inciso su una fotomaschera di wafer di silicio SU-8. È importante notare che la dimensione del passo dei canali sulla fotomaschera deve essere ottimizzata durante la fabbricazione del dispositivo, poiché avrà un impatto sulla dimensione delle particelle di microgel.
Le portate per la generazione microfluidica di microgel devono essere ottimizzate per ogni formulazione di gel in base a fattori quali il tempo di gelificazione, la dimensione delle particelle desiderata e il design del dispositivo microfluidico. Se si utilizza il dispositivo ad alta produttività, le portate per la fase acquosa possono arrivare fino a 5 ml/h. La figura 4B mostra la configurazione per i dispositivi ad alta produttività utilizzati in questo protocollo. Se il dispositivo funziona correttamente, la formazione di microgel dovrebbe apparire simile a quella mostrata nella Figura 4D. Prima della purificazione, i microgel saranno opachi. Dopo aver completato i vari lavaggi con olio, PBS ed esano, il gel dovrebbe apparire chiaro come l'immagine rappresentativa nella Figura 5. Se si incorpora un fluoroforo nei microgel, il prodotto purificato può avere una leggera tinta colorata ma dovrebbe comunque essere vicino al traslucido. Dopo la purificazione e il gonfiore, i microgel dovrebbero essere di dimensioni molto uniformi e avere un PDI compreso tra 1,00 e 1,05, come mostrato in Figura 6. Vari fotoiniziatori possono essere utilizzati per la fotoricottura degli scaffold MAP. Se si utilizza un'alternativa al LAP, descritta nel presente documento, è necessario determinare la cinetica di ricottura come descritto in precedenza14. Inoltre, varie sorgenti luminose possono essere utilizzate per la fotoricottura, purché la sorgente luminosa corrisponda al fotoiniziatore. Bisogna essere sicuri di calibrare e focalizzare la sorgente luminosa. Potrebbe essere necessario ottimizzare il tempo di ricottura e l'intensità della luce in base alla formulazione del gel e alla concentrazione del fotoiniziatore. Il metodo di ricottura descritto in questo protocollo può essere utilizzato per studi in vitro e in vivo. Dopo la ricottura, i microgel formeranno un'impalcatura porosa che può essere visualizzata con microscopia a due fotoni (Figura 7B-C).
Discussione
Questo protocollo descrive i metodi per sintetizzare e caratterizzare i microgel, che fungono da elementi costitutivi per gli scaffold di particelle ricotto microporose (MAP). Questo protocollo utilizza un approccio microfluidico ad alto rendimento per generare grandi volumi di microgel uniformi, che non possono essere raggiunti con altri metodi come la microfluidica a focalizzazione del flusso 1,4,7,9 (alta monodisperistia, bassa resa), emulsione batch 6,10 e elettrospruzzatura 5,12 (bassa monodispersità, alto rendimento). Con i metodi descritti nel presente documento, i microgel monodispersi possono essere realizzati per l'uso in scaffold MAP che possono essere utilizzati per una varietà di applicazioni di medicina rigenerativa (ad esempio, consegna cellulare, guarigione delle ferite).
Un passaggio critico di questo protocollo è la creazione dei dispositivi microfluidici PDMS. Se i dispositivi non sono realizzati correttamente, ciò potrebbe avere effetti negativi a valle sulla formazione di microgel e sulla monodispersità. È importante prevenire l'introduzione di artefatti (ad esempio, bolle, polvere) nel PDMS prima che si polimerizzi, poiché ciò potrebbe ostruire i canali e influire significativamente sulla formazione di microgel. Per mitigare il più possibile questo problema, è necessario utilizzare del nastro adesivo per rimuovere la polvere, conservare i dispositivi in un contenitore privo di polvere e lavorare in un cappuccio privo di polvere, se possibile. Si consiglia inoltre di conservare i dispositivi a 60 °C per ottenere i migliori risultati con il trattamento superficiale.
Quando si versano i dispositivi PDMS, è importante mantenere uno spessore uniforme che sia circa uguale o inferiore alla lunghezza del punch bioptico. Se il dispositivo è troppo spesso, il pugno della biopsia non sarà in grado di penetrare fino in fondo. È inoltre fondamentale non strappare gli ingressi/uscite del dispositivo PDMS durante la punzonatura con il punzone bioptico e/o l'inserimento del tubo. Uno strappo nel dispositivo PDMS causerà perdite dagli ingressi / uscite, che possono causare la perdita della soluzione precursore del gel. Se c'è una perdita in un dispositivo PDMS, la soluzione migliore è sostituirlo con un nuovo dispositivo il più rapidamente possibile.
Durante il trattamento al plasma del dispositivo, l'uso di ossigeno puro e il trattamento al plasma per 30 secondi hanno prodotto i migliori risultati per l'adesione del PDMS al vetrino. Se il dispositivo non si lega correttamente (ad esempio, il PDMS può ancora essere sollevato dal vetrino dopo il trattamento al plasma), è necessario verificare che il trattamento al plasma funzioni correttamente e che il dispositivo e i vetrini siano stati puliti accuratamente. È anche importante utilizzare il corretto trattamento superficiale silano e, per ottenere i migliori risultati, i dispositivi PDMS devono essere trattati direttamente prima dell'uso. Altri metodi di trattamento superficiale, come la deposizione chimica da vapore, potrebbero anche essere utilizzati.
Un altro passo cruciale è l'uso corretto dei dispositivi microfluidici PDMS per la formazione di microgel. Si consiglia di utilizzare un rapporto di portata di almeno 2:1 (questo protocollo utilizza una portata d'olio di 6 mL/h e una portata acquosa di 3 mL/h), ma questo può essere regolato per ottenere la dimensione desiderata del microgel. Il pH della soluzione precursore del microgel è anche una metrica importante da ottimizzare per prevenire l'intasamento del dispositivo. La soluzione salina tamponata con fosfato (PBS) accelera la formazione di tiolato nella chimica di addizione di tipo Michael e le concentrazioni di PBS utilizzate in questo protocollo producono i migliori risultati per la gelificazione del microgel nei dispositivi microfluidici. Una volta avviate le pompe a siringa, potrebbero esserci alcune bolle nei canali microfluidici, ma questo dovrebbe equilibrarsi dopo pochi minuti. Si raccomanda di monitorare la formazione di microgel con un microscopio. Se il flusso non sembra simile a quello di questo video e/o ci sono alcuni canali che producono particelle di grandi dimensioni, ciò è probabilmente dovuto a problemi con la fase di trattamento superficiale. La soluzione migliore è sostituire il dispositivo con uno appena trattato in superficie.
Se i microgel sembrano essere in coalescenza, ciò può essere dovuto a una concentrazione insufficiente di FluoroTensioattivo. La soluzione consigliata è quella di aumentare la percentuale in peso del tensioattivo in fase oleosa. Tuttavia, una limitazione all'uso di alte concentrazioni di tensioattivi è che può essere più difficile da rimuovere durante la fase di purificazione. Si consiglia di utilizzare dispositivi microfluidici una sola volta, ma i dispositivi possono essere riutilizzati se lavati con olio Novec immediatamente dopo l'uso per rimuovere qualsiasi soluzione acquosa che potrebbe gelificare nel dispositivo e ostruire i canali. Mentre un dispositivo microfluidico può produrre un volume ad alta produttività di microgel (mL / h), questa velocità di produzione può essere scalata utilizzando più dispositivi microfluidici in parallelo.
La fase di ricottura dell'assemblaggio dello scaffold MAP si basa sull'uso di un fotoiniziatore di polimerizzazione radicalica attivato dalla luce e il fotoiniziatore può essere selezionato in base all'applicazione desiderata. Ad esempio, il fotoiniziatore LAP ha tempi di ricottura rapidi (<30 s) quando si utilizza la luce UV a onde lunghe, che ha un impatto minimo sulla vitalità cellulare in vitro14. Tuttavia, questa lunghezza d'onda è altamente assorbita dal tessuto16 e potrebbe non avere un'elevata efficacia di ricottura in vivo come in vitro.
Eosin Y è un altro fotoiniziatore attivato da lunghezze d'onda visibili (505 nm) e ha una penetrazione più profonda nel tessuto, che migliora la capacità dello scaffold MAP di essere ricotto sotto il tessuto. Tuttavia, i lunghi tempi di esposizione alla luce necessari per la ricottura di Eosin Y possono prolungare l'esposizione cellulare ai radicali liberi e influire sulla vitalità cellulare in vitro14. L'utilizzo di questi metodi per la generazione ad alta produttività di blocchi di microgel altamente uniformi accelererà la ricerca focalizzata sugli scaffold MAP e farà progredire le conoscenze nel campo dei materiali porosi iniettabili per la medicina rigenerativa.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Joe de Rutte e il Di Carlo Lab dell'Università della California, Los Angeles, per la loro assistenza con il design originale del dispositivo microfluidico da cui è stato sviluppato il dispositivo segnalato, nonché la loro guida iniziale nella fabbricazione e risoluzione dei problemi dei dispositivi PDMS. Gli schemi delle figure sono stati creati con Biorender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-aminoethanethiol hydrochloride | Acros Organics | AC153770250 | For MethMal Synthesis MW: 113.61 Da |
| 35 mm plate rotor | HAAKE | P35/Ti | Geometry for HAAKE viscometer |
| 4-arm PEG-Maleimide (10 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-100MA | For microgel precursor solution |
| 4-arm PEG-Maleimide (20 kDa) | NOF AMERICA Corporation | SUNBRIGHT PTE-200MA | For MethMal Synthesis Molecular weight specific to each batch |
| BD Syringe with Luer-Lok Tips | Becton Dickinson | Disposable plastic syringes | |
| Biopsy punch | Mitex | MLTX33-31A-P/25 | 1.5 mm diameter |
| Chloroform-d | Acros Organics | AC209561000 | For MethMal Synthesis |
| Collimated LED Light Source | ThorLabs | M365LP1-C1 | 365 nm |
| Culture dish (15 cm) | Corning | CLS430599 | 150 mm x 25 mm |
| DMTMM(4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methyl-morpholinium chloride) | Oakwood Chemical | 151882 | For MethMal Synthesis MW: 276.72 Da |
| Fluorosurfactant | Ran Technologies | 008-Flurosurfactant-5wtH-200G | 5 weight percent of 008-Flurosurfactant in HFE7500 |
| FreeZone Triad Freeze Dry System | Labconco | 7400000 Series | For MethMal Synthesis Lyophilizer |
| Glass slides | Fisher Scientific | 12-550-A3 | Plain glass slides, uncoated |
| HAAKE Rheowin viscometer | HAAKE | ||
| ImageJ | version 1.8.0_172 | ||
| KDS Legato 210 Dual Prong Syringe Pump | Kd Scientific | ||
| LED Driver | ThorLabs | DC2200 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | Photoinitiator |
| Methacrylic Acid | Sigma Aldrich | 155721 | For MethMal Synthesis MW: 86.09 Da Density: 1.015g/mL |
| Microfluidic device SU8-Si master wafer | FlowJem | N/A | Custom-made, with silanization |
| MMP-2 degradable crosslinker | FlowJem | Sequence: Ac-GCGPQGIAGQDGCG-NH2 | |
| Needles (25 G, beveled) | BD | 305122 | Length: 15.88 mm Gauge: 0.5 mm |
| Novec 7500 | 3M | 7100025016 | Fluorinated oil |
| Oxygen | Praxair | UN1072 | Compressed |
| Peek tubing | Trajan Scientific | 03-350-523 | 1/32" Outer Diameter; 0.02" Inner Diameter; 10' Length |
| PFOCTS (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) | Sigma-Aldrich | 448931 | For surface treatment |
| Phosphate Buffered Saline | Fisher BioReagants | BP3994 | Diluted to 1x in ultrapure water, pH = 7.4 |
| Plasma cleaner | Harrick Plasma | PDC-001-HP | |
| Razor blade | Fisher Scientific | 12-640 | |
| RGD cell adhesive peptide | WatsonBio Sciences | Sequence: Ac-RGDSPGGC-NH2 | |
| Rheowin software | HAAKE | Software compatible with HAAKE viscometer | |
| Scalpel blade | Bard-Parker | 371210 | Size: #10 |
| Scalpel handle | Bard-Parker | 371030 | Size: #3 |
| Sodium Chloride | Fisher BioReagents | BP358-1 | For MethMal Synthesis MW: 58.44 Da |
| Sylgard 184 silicone elastomer kit | DOW Chemical | 2065622 | Base and curing agent |
| Triethylamine | Fisher Scientific | O4884-100 | For MethMal Synthesis MW: 101.19 Da Density: 0.73g/mL |
| Tygon tubing | Saint Gobain Performance Plastics | AAD04103 | ID: 0.51 mm OD: 1.52 mm |
| Varian Inova 500 Spectrometer | Varian | NMR Located in the UVA Biomolecular Magnetic Resonance Facility |
Riferimenti
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Pruett, L. J., Jenkins, C. H., Singh, N. S., Catallo, K. J., Griffin, D. R. Heparin microislands in microporous annealed particle scaffolds for accelerated diabetic wound healing. Advanced Functional Materials. 31 (35), 2104337 (2021).
- Darling, N. J., Sideris, E., Hamada, N., Carmichael, S. T., Segura, T. Injectable and spatially patterned microporous annealed particle (MAP) hydrogels for tissue repair applications. Advanced Science. 5 (11), 1801046 (2018).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science and Engineering. 5 (12), 6395-6404 (2019).
- Pruett, L., et al. Development of a microporous annealed particle hydrogel for long-term vocal fold augmentation. Laryngoscope. 130 (10), 2432-2441 (2020).
- Nih, L. R., Sideris, E., Carmichael, S. T., Segura, T. Injection of microporous annealing particle (MAP) hydrogels in the stroke cavity reduces gliosis and inflammation and promotes NPC migration to the lesion. Advanced Materials. 29 (32), (2017).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Schaeffer, C., et al. Injectable microannealed porous scaffold for articular cartilage regeneration. Annals of Plastic Surgery. 84, 446-450 (2020).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Jivan, F., Alge, D. L. Bio-orthogonal, site-selective conjugation of recombinant proteins to microporous annealed particle hydrogels for tissue engineering. Advanced Therapeutics. 3 (1), 1900148 (2020).
- de Rutte, J. M., Koh, J., di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071 (2019).
- Pfaff, B. N., et al. Selective and improved photoannealing of microporous annealed particle (MAP) scaffolds. ACS Biomaterials Science and Engineering. 7 (2), 422-427 (2021).
- Darling, N. J., Hung, Y. S., Sharma, S., Segura, T. Controlling the kinetics of thiol-maleimide Michael-type addition gelation kinetics for the generation of homogenous poly(ethylene glycol) hydrogels. Biomaterials. 101, 199-206 (2016).
- Sandell, J. L., Zhu, T. C. A review of in-vivo optical properties of human tissues and its impact on PDT. Journal of Biophotonics. 4 (11-12), 773-787 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon