Method Article
Визуализация дрожжевых органелл с помощью флуоресцентных белковых маркеров
В этой статье
Резюме
Здесь мы описываем использование набора маркеров органелл на основе флуоресцентных белков для визуализации живых клеток почковающихся дрожжей Saccharomyces cerevisiae.
Аннотация
Почковающиеся дрожжи, Saccharomyces cerevisiae, являются классической модельной системой для изучения функции и динамики органелл. В наших предыдущих работах мы конструировали флуоресцентные белковые маркеры для основных органелл и эндомембранных структур, включая ядро, эндоплазматический ретикулум (ЭР), аппарат Гольджи, эндосомы, вакуоли, митохондрии, пероксисомы, липидные капли и аутофагосомы. Представленный здесь протокол описывает процедуры использования этих маркеров в дрожжах, включая подготовку ДНК для трансформации дрожжей, выбор и оценку трансформантов, флуоресцентное микроскопическое наблюдение и ожидаемые результаты. Текст ориентирован на исследователей, которые вступают в область изучения органелл дрожжей из других областей. В нем рассматриваются основные шаги, а также технические примечания об аппаратном обеспечении микроскопа и нескольких распространенных ошибках. Он дает людям отправную точку для наблюдения за дрожжевыми субклеточными образованиями с помощью флуоресцентной микроскопии живых клеток. Эти инструменты и методы могут быть использованы для определения субклеточной локализации белка и отслеживания органелл, представляющих интерес при покадровой визуализации.
Введение
Субклеточная компартментализация на мембраносвязанные органеллы является общим принципом в организации эукариотических клеток. Каждая органелла выполняет определенные функции. Как и во многих других аспектах эукариотической биологии, почковающиеся дрожжи, Saccharomyces cerevisiae, были классической модельной системой для разъяснения основных принципов организации и динамики органелл. Примеры включают в себя основополагающие открытия в пути секреции белка, пути импорта пероксисомального белка и пути аутофагии 1,2,3.
В типичных условиях, богатых питательными веществами, быстрорастущие дрожжевые клетки содержат эндоплазматический ретикулум (ER), раннюю Гольджи, позднюю Гольджи/ранние эндосомы, поздние эндосомы, вакуоли и митохондрии. Некоторые пероксисомы, липидные капли и аутофагосомы (даже меньше, чем первые две, в основном типа пузырьков Cvt, которые присутствуют в богатых питательными веществами условиях4) также присутствуют, но не так заметно, как это было бы в определенных условиях культивирования (богатые липидами среды, среды голодания и т. д.). По сравнению с другими распространенными эукариотическими моделями, дрожжевые клетки довольно малы; Диаметр типичной дрожжевой клетки составляет около 5 мкм, по сравнению с десятками микрометров для большинства животных и растительных клеток. В результате, в том же поле визуализации, которое обычно содержит одну адгезивную клетку животного, обычно можно увидеть десятки дрожжевых клеток на различных стадиях клеточного цикла. Помимо разницы в размерах, морфология органелл дрожжей также имеет некоторые специфические особенности. На ультраструктурном уровне дрожжевые ER состоят из листов и трубочек, как и в других системах. При флуоресцентной микроскопии ER дрожжей проявляется в виде двух колец с некоторыми взаимосвязанными структурами между ними. Внутреннее кольцо представляет собой ядерную ЭР, которая непрерывна с ядерной оболочкой, а внешнее кольцо представляет собой периферическую ЭР, которая представляет собой трубчатую сеть, лежащую под плазматической мембраной5. Подобно растительным клеткам, но отличается от клеток животных, гибридная органелла, поздняя эндосома Гольджи/ранняя эндосома, находится на пересечении секреторного пути и эндоцитарного пути 6,7. Морфологически дрожжевые аппараты Гольджи диспергируются в цитоплазме. Вакуоли функционально аналогичны лизосомам в клетках животных. Они часто занимают большие участки цитоплазмы и подвергаются частому делению и слиянию. Помимо использования флуоресцентных маркеров колокализации, вакуолярную мембрану можно отличить от ядерной ЭР, по крайней мере, по двум критериям: вакуолярная мембрана, как правило, более округлая, чем ядерная ЭР, и обивочный вид вакуоли при ДВС-синдроме также более выражен, чем у ядра.
Как правило, мы используем набор маркеров на основе флуоресцентных белков для визуализации вышеупомянутых органелл в живых дрожжевых клетках (табл. 1). Точность и функциональность этих маркеров органелл были экспериментально проверены 7,8. Эти маркерные конструкции предназначены для введения в геном дрожжей кассет с флуоресцентными белками-химерами. Как указано ниже, при подготовке к трансформации дрожжей линейные фрагменты ДНК генерируются либо путем ферментативного расщепления, либо путем амплификации ПЦР 7,8. Линейные фрагменты ДНК интегрируются в геном посредством гомологичной рекомбинации. Для плазмид, описанных в этом протоколе, используются три типа дизайна. В первом типе, охватывающем большую часть плазмид, часто можно получить трансформаторы, несущие несколько копий конструкции. Обычно это нежелательно, потому что это приводит к экспрессивным и, возможно, функциональным вариациям у трансформантов. Трансформанты с одной копией должны быть идентифицированы с помощью визуализации, как описано в этом протоколе, с помощью иммуноблоттинга или тщательно разработанных ПЦР-тестов. Во втором типе, охватывающем GFP-Sed5, GFP-Pep12 и GFP-Atg8, в гаплоидных дрожжевых клетках происходит только интеграция с одной копией. Как первый, так и второй тип сохраняют эндогенную копию маркерного гена нетронутой в геноме. Третий тип плазмидного дизайна, охватывающий Sec7-2GFP и Vph1-2GFP, предназначен для введения С-концевых ударов, что приводит к тому, что химеры являются единственной копией соответствующего маркерного гена.
В этой статье мы опишем процедуру использования этих маркеров органелл, предоставим образцовые микроскопические изображения и обсудим меры предосторожности, предназначенные для исследователей, не знакомых с визуализацией органелл дрожжей.
протокол
1. Конструкция штамма дрожжей
- Получите маркерные плазмиды и подходящий штамм дрожжей.
ПРИМЕЧАНИЕ: Плазмиды можно приобрести в компании Addgene. В качестве примеров в этом протоколе используются TN124 (MATa ura3 trp1 pho8Δ60 pho13Δ::LEU2), BY4741 (MATa leu2Δ0 ura3Δ his3Δ1 met15Δ0) и DJ03 (BY4741 trp1Δ::MET15). Одним из важных соображений при выборе штамма, помимо характера научного вопроса, является совместимость селекционных маркеров. Описанные здесь плазмиды маркеров органелл используют URA3 и TRP1 в качестве маркеров отбора. Следовательно, генотип штамма-реципиента должен быть ura3 и trp1. В противном случае необходимо модифицировать штамм или плазмиды. - Готовят дрожжевые среды по следующим рецептам.
ПРИМЕЧАНИЕ: СМД (синтетический минимум декстрозы; 2% глюкозы, 0,67% дрожжевого азотного основания (YNB) без аминокислот, 30 мг/л аденина, 30 мг/л лизина, 30 мг/л метионина, 20 мг/л гистидина, 20 мг/л урацила, 50 мг/л триптофана, 50 мг/л лейцина). SMD+CA (SMD с добавлением 0,5% казаминокислот). YPD (Дрожжевой экстракт пептона декстроза; 1% экстракт дрожжей, 2% пептон, 2% глюкоза). SD-N (синтетическая декстроза без азота; 0,17% YNB без аминокислот и сульфата аммония, 2% глюкозы). Пожалуйста, обратитесь к разделу «Обсуждение» для рассмотрения вопроса о выборе носителя. - Перед этапом трансформации необходимо получить линеаризованные фрагменты ДНК путем ферментативного расщепления или ПЦР-амплификации плазмиды маркера органелл.
Примечание: В таблице 1 перечислены сайты фермента рестрикции и праймеры ПЦР для получения линейных фрагментов из плазмид маркеров органелл. - Культивирование дрожжевых клеток в жидкой среде YPD и трансформация дрожжей с линейным фрагментом ДНК.
Примечание: Дрожжевая трансформация может быть выполнена с использованием традиционного метода на основе LiAc9 или других методов по выбору. Целесообразно включать соответствующие элементы контроля для трансформации, в частности, отрицательный контроль без плазмиды или плазмидной ДНК. - Инкубируйте на подходящей селекционной тарелке (например, для отбора URA3 используйте среду SMD-URA) при температуре 30 °C в течение 2-3 дней.
ПРИМЕЧАНИЕ: Для появления одиночных колоний требуется около 2 дней. - Чтобы проверить экспрессию флуоресцентной химеры и количество экземпляров интеграции, выберите восемь колоний из селекционной пластины, повторно нанесите полосы на свежие селекционные пластины и инкубируйте при 30 °C.
2. Флуоресцентная микроскопия: общие процедуры и визуализация в одной временной точке
- Культивировать дрожжевые клетки в течение ночи в жидкой среде SMD при 30 °С с встряхиванием.
- На следующее утро измерьте оптическую плотность культуры дрожжей при длине волны 600 нм (далее OD600) с помощью спектрофотометра или планшетного ридера.
ПРИМЕЧАНИЕ: Имея некоторую практику в области инокуляции дрожжей, обычно можно убедиться, что OD600 всех образцов ниже 2 на этом этапе. Если он оказывается выше, рекомендуется разбавить больше на следующем этапе и дать больше времени для восстановления дрожжевых клеток. - Разбавьте культуру дрожжей примерно до 0,2 OD600 с использованием свежей среды.
- Продолжайте культивирование до тех пор, пока внешний диаметр600 не достигнет примерно 0,8-1,0.
ПРИМЕЧАНИЕ: Время удвоения дрожжей составляет около 1,5-2 часов. - Положите покровное стекло поверх папиросной бумаги на плоскую поверхность, нанесите 5 мкл 1 мг/мл конканавалина А на верхнюю сторону покровного стекла и подождите 5 минут (Рисунок 1А)10.
ПРИМЕЧАНИЕ: Этот подготовительный этап можно выполнить заранее. - Перелейте 100 μл дрожжевой культуры на верхнюю сторону покровного стекла и подождите 5 минут.
- Соедините покровное стекло с поддерживающим стеклянным предметным стеколом, между которыми находятся дрожжевые клетки; Нажмите с соответствующим усилием, чтобы зафиксировать крепление.
ПРИМЕЧАНИЕ: Требуется некоторая практика, чтобы найти правильное давление, чтобы дрожжевые клетки образовывали неподвижный одиночный слой, но не раздавливались (Рисунок 1B). На этом этапе жидкая среда будет выталкиваться и поглощаться нижележащей папиросной бумагой. - Установите предметное стекло на предметный столик микроскопа. Найдите участок дрожжевых клеток и сфокусируйтесь на нем с помощью дифференциально-интерференционно-контрастного (DIC) или фазово-контрастного (PC) освещения.
ПРИМЕЧАНИЕ: Не используйте флуоресценцию для определения местоположения клеток; В противном случае сигнал может потускнеть до начала сбора данных. - Вручную настройте три набора параметров для сбора z-стеков изображений: z-секция, каналы изображения и параметры экспозиции.
ПРИМЕЧАНИЕ: На дополнительном рисунке 1 приведены примеры настроек параметров графического интерфейса пользователя в одном коммерческом программном обеспечении. Точный внешний вид отличается на разных программных платформах, но варианты более или менее одинаковы.- Z-секция: Соберите срезы с шагом 0,5 мкм в течение 15 срезов (глубина 7 мкм, как правило, достаточна для нормальных гаплоидных дрожжевых клеток).
- Каналы визуализации: Выберите DIC или PC для контуров клеток и соответствующие флуоресцентные каналы по мере необходимости.
- Интенсивность возбуждающего света и время воздействия: Установите интенсивность возбуждающего света и время воздействия в соответствии с образцом.
ПРИМЕЧАНИЕ: В качестве отправной точки используйте 100% для интенсивности возбуждающего света и 100 мс для времени воздействия; уменьшить интенсивность света, если фотообесцвечивание становится очевидным по мере накопления z-стека или если сигнал превышает пропускную способность камеры (т.е. насыщенность сигнала); Увеличьте интенсивность света, если отношение сигнал/шум низкое.
- Запишите настройки изображения и используйте одни и те же настройки для всех сравниваемых образцов.
ПРИМЕЧАНИЕ: Не используйте настройку «авто» для сбора данных и визуализации изображений. Важно записать настройки в лабораторную заметку, чтобы точно такие же параметры можно было повторно применить в будущих экспериментальных повторах. Некоторые программные приложения для управления микроскопом имеют возможность сохранять и повторно применять настройки; Тем не менее, рекомендуется записывать настройки независимо, потому что профили программного обеспечения могут быть непреднамеренно удалены или изменены коллегами. - Сохраняйте данные в 16-битном формате многоканального стека.
ПРИМЕЧАНИЕ: Не сохраняйте изображения в формате 8 бит RGB (или 24 бит, если считать все три цвета). Ограничения 8-битного формата см. в разделе визуализации изображений (раздел 4). - Перейдите в совершенно другую область для следующей коллекции стека изображений.
ПРИМЕЧАНИЕ: Соседние участки могут подвергаться фотообесцвечиванию и фототоксичности. В результате стек изображений, собранный из этих областей, может вводить в заблуждение.
3. Покадровая съемка
ПРИМЕЧАНИЕ: Процедура покадровой съемки отличается от процедуры покадровой съемки в одной временной точке в двух областях: подготовка образца и параметры визуализации.
- Подготовка образцов
- Смажьте чашку со стеклянным дном диаметром 35 мм конканавалином 1 мг/мл и подождите 5 минут или более.
- Добавьте в чашку 1,5 мл жидкой культуры дрожжей и подождите 5 минут, чтобы дрожжевые клетки осядли на поверхности стекла.
- С помощью пипетки отсадите жидкую среду от края посуды, затем аккуратно промойте участок дрожжевого осадка примерно 1 мл свежей среды, чтобы удалить ненадежно прикрепленные клетки.
- Повторите полоскание 2-3 раза. Отсадите с помощью пипетки, затем аккуратно добавьте 2 мл свежей питательной среды.
- Параметры визуализации
- Z-секция: Соберите ломтики с шагом 0,5 мкм на 15 срезов.
- Каналы визуализации: выберите по мере необходимости.
- Интенсивность возбуждения света и время воздействия: Используйте минимум, необходимый для различения исследуемой субклеточной структуры.
ПРИМЕЧАНИЕ: Для покадровой съемки фотообесцвечивание и фототоксичность от повторного освещения ограничивают общее количество временных точек, которые могут быть собраны. Таким образом, интенсивность возбуждения и время экспозиции обычно устанавливаются на низкие значения, чтобы можно было получить изображение большего количества временных точек. - Интервал визуализации: Установите временные интервалы, соответствующие исследуемому биологическому процессу.
ПРИМЕЧАНИЕ: Например, образование аутофагосомы в условиях голодания занимает около 5-10 минут; Для отслеживания его динамики предпочтителен интервал в 1 минуту и менее. В условиях, богатых питательными веществами, клеточный цикл дрожжей происходит по часовой шкале; Можно использовать более длительный интервал, например, 10-20 минут.
- Если есть подходящее оборудование, поддерживайте температуру тарелки на уровне 30 °C.
Примечание: Большинство биологических процессов в дрожжевых клетках также могут быть визуализированы при комнатной температуре (RT), за исключением более медленных темпов в целом.
4. Визуализация стеков изображений и оценка количества экземпляров интеграции
- Установите программное обеспечение Fiji или ImageJ для визуализации и анализа изображений11,12.
ПРИМЕЧАНИЕ: Фиджи - это набор инструментов на основе ImageJ, подходящий для визуализации и обработки данных биологических изображений общего назначения. Для обработки изображений, перечисленных в этом протоколе, достаточно ImageJ без дополнительных плагинов. - Выберите подходящие параметры для отображения и сравнения изображений.
- На Фиджи откройте пару изображений z-stack.
- Перетащите z-позицию в каждой стопке в среднюю часть (или в другие позиции, если исследуемая структура лучше визуализируется там).
- Перейдите в раздел «Изображение» > «Настроить яркость/контрастность» > и нажмите « Сброс».
- В окне Яркость/Контрастность (B&C) используйте полосы прокрутки для изменения двух параметров, Минимального и Максимального , чтобы четко различить исследуемую структуру.
ПРИМЕЧАНИЕ: Как правило, Минимальное значение устанавливается близким к среднему значению в пустых областях, а Максимальное устанавливается близким к максимальному значению на изображении. Эти значения можно вывести из отображаемой гистограммы (рисунок 2A). Если рабочая станция обработки изображений откалибрована по цвету, минимальное значение можно установить немного выше, чтобы скрыть больше фоновых сигналов. - В окне «Яркость/контрастность» нажмите « Установить » и установите флажок « Распространить на все остальные открытые изображения » во всплывающем окне «Установить диапазон отображения».
ПРИМЕЧАНИЕ: Эта операция применяет одни и те же настройки яркости/контрастности (включая минимальные и максимальные значения) ко всем открытым изображениям, чтобы изображения можно было сравнивать. - Просматривайте разные изображения и прокручивайте z-стек в каждом из них. Если изображения хорошо смотрятся с правильным темным фоном и немного раздутой насыщенностью, запишите Минимальные и Максимальные настройки.
- Для многоканальных изображений выберите настройки отображения изображений для каждого канала:
- Перейдите в Изображение > Инструмент «Цвет > каналы», выберите режим «Оттенки серого » во всплывающем окне «Каналы».
- Пройдитесь по каждому каналу, выберите подходящую яркость/контрастность для этого канала и запишите настройки.
- Настроив параметры Яркость/Контрастность , вернитесь в окно Каналы и переключитесь на Композитный режим для одновременной визуализации нескольких каналов.
ПРИМЕЧАНИЕ: Псевдоцвет для каждого канала может быть вручную изменен в разделе Каналы в соответствии с личными предпочтениями. Галочки предназначены для отображения/скрытия определенных каналов.
- При необходимости используйте флажки в окне Каналы , чтобы показать или скрыть определенные каналы.
- При необходимости сгенерируйте стековые проекции, перейдя в раздел Изображение > Стеки > Проект Z.
ПРИМЕЧАНИЕ: Доступно несколько режимов проекции. Максимальная интенсивность — хороший выбор для быстрой оценки. Характер исследования следует учитывать, чтобы определить, следует ли использовать конкретный режим проекции или отдельные срезы для количественной оценки. Проекция также может быть ограничена выбранными z-срезами, чтобы уменьшить интерференцию расфокусированного света. - Экран для преобразователей с однократной копией и интеграцией.
- После того как одинаковые настройки яркости/контрастности будут применены ко всем открытым изображениям, сравните интенсивность изображения в образцах, чтобы получить число интеграции плазмиды.
ПРИМЕЧАНИЕ: Изображения должны быть получены в соответствии с общей процедурой получения изображений в одной временной точке, начиная с ночного культивирования в жидкой среде. Интеграции с несколькими копиями (см. примеры колоний 2 и 3 на рисунке 2B ) выглядят значительно ярче, чем интеграции с одной копией (колония 1 на рисунке 2B). В отличие от них, одиночные экземпляры выглядят похожими друг на друга (рис. 2B). - Изучите изображения с восьми трансформантов для каждого штамма, убедившись, что используются одни и те же настройки яркости/контрастности .
- Повторное прогон и сохранение трех или более преобразователей в одной копии для последующего изучения.
- После того как одинаковые настройки яркости/контрастности будут применены ко всем открытым изображениям, сравните интенсивность изображения в образцах, чтобы получить число интеграции плазмиды.
- Экспортируйте изображения для презентации.
- Перейдите в раздел Изображение > Дублировать , чтобы сделать копию интересующего изображения, и дайте ему имя по выбору.
- Перейдите в раздел Изображение > введите > 8-битный , чтобы преобразовать дубликат копии с 16-битного на 8-битный и сохранить его по мере необходимости.
ПРИМЕЧАНИЕ: Имейте в виду, что после применения этого параметра, если настройки яркости/контрастности не были записаны ранее, не будет простого способа получить эту информацию, и, следовательно, не будет простого способа повторно применить ту же настройку в последующих визуализациях изображений. По этой же причине рекомендуется выполнить предыдущую операцию дублирования. - Чтобы разделить стек z на коллекцию отдельных изображений, перейдите в раздел Изображения > Стеки > Стек в изображения и сохраните их по мере необходимости.
ПРИМЕЧАНИЕ: Изображения также могут быть обрезаны до меньшей площади на Фиджи.
Результаты
Морфология и динамика органелл подвержены изменениям, поскольку дрожжевые клетки реагируют на внешние и внутренние сигналы. Здесь мы приводим репрезентативные изображения дрожжевых органелл в средней логарифмической фазе (рис. 3A, B). Как упоминалось ранее, некоторые органеллы имеют свои отличительные морфологические особенности, поэтому их легко распознать без обширного сравнения с другими маркерами органелл. К ним относятся ER, митохондрии и вакуоли. Обратите внимание, что в некоторых лабораторных штаммах, в том числе и в тех, которые мы здесь показываем, баланс деления и синтеза вакуолей искажен до такой степени, что многие логарифмические ячейки содержат одну вакуоль. Аппараты Гольджи, эндосомы, липидные капли и пероксисомы, как правило, слишком малы для того, чтобы обычная световая микроскопия могла разглядеть их контуры. Таким образом, все они проявляются в виде цитоплазматических точек. Установление их идентичности требует перекрестного сравнения с другими маркерами органелл, что мы и выполнили для данного набора маркеров в логарифмических клетках7.
Как показано во введении, большинство наших маркерных конструкций могут быть интегрированы в геном несколько раз. Чтобы избежать ненужных осложнений, трансформанты с интегрированием в одну копию могут быть обследованы при проверке экспрессии их маркеров с помощью флуоресцентной микроскопии (рис. 2B). Сигнал флуоресценции в трансформаторах с несколькими копиями намного ярче, чем в трансформаторах с одной копией.
Подготовка предметных стекол микроскопа, содержащих живые дрожжевые клетки, является простой процедурой, которую можно быстро проделать для отбора десятков образцов в одном эксперименте. Тем не менее, требуется некоторая практика, чтобы найти «правильное» давление, которое обеспечивает защиту одного слоя клеток на предметных стеклах, не раздавливая их (рисунок 1B). Слишком малая сила, клетки остаются в нескольких слоях и, вероятно, плавают вокруг; Слишком большая сила, клетки по существу механически лизируются. С опытом можно также обнаружить мертвые клетки и старые клетки, которые редко должны появляться в популяциях логарифмической фазы дикого типа.
Покадровая съемка — это мощный метод исследования динамики мембран. Здесь мы демонстрируем частое образование и потребление аутофагосом в истощенных дрожжевых клетках, меченных GFP-Atg8 (рис. 4). В литературе есть утверждения, что дрожжевая клетка имеет только один субклеточный участок, который генерирует аутофагосомы. Это звучит правильно, если проверять только снимки с одной временной точкой, так как в среднем на ячейку приходится около одной точки. Тем не менее, с помощью покадровой визуализации можно легко увидеть, что в одной дрожжевой клетке различные случаи биогенеза аутофагосом могут происходить независимо друг от друга в разных субклеточных местах с течением времени.
Помимо отслеживания динамики каждой органеллы, еще одним распространенным применением маркеров органелл является определение субклеточной локализации интересующего белка. На практике белки в клетках часто локализуются более чем в одной органелле. Здесь мы используем Sft1 в качестве примера; Sft1 представляет собой v-SNARE, функционирующую во внутриклеточном транспорте13. Меченный GFP Sft1 проявляется в виде множественных цитоплазматических точек (рис. 5). Путем перекрестного сравнения с коэкспрессированными красными создателями органелл можно увидеть, что Sft1 частично колокализуется с ранними маркерами Гольджи и поздними маркерами Гольджи/ранними эндосомами, что дает важные ключи к пониманию функции Sft1.

Рисунок 1: Подготовка образца предметного стекла. (A) Картонная иллюстрация препарата. (1) Поместите покровное стекло на папиросную бумагу, распределите раствор конканавалина А по верхней стороне покровного стекла и подождите 5 минут или дольше. (2) Добавьте ~100 мкл дрожжевой питательной среды на верхнюю сторону покровного стекла и подождите 5 минут, пока клетки осядут. (3) Накройте покровное стекло предметным стеклом и нажмите, чтобы соединить его с покровным стеклом. Лишняя жидкость поглощается подлежащей папиросной бумагой. (Б) Появление дрожжевых клеток в нежелательных ситуациях. Слева направо: образование слоев клеток при недостаточном усилии при подготовке предметного стекла; измельченные дрожжевые клетки при приложении чрезмерного усилия в препарате предметного стекла; две потенциально мертвые клетки, отмеченные стрелками; Старая клетка с очень большой вакуолью, отмеченной стрелками. Масштабная линейка: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Настройка отображения изображения и идентификация преобразователей интегрирования в одной копии. (A) Эффект от настройки минимального значения отображения. Внешний вид 16-битного изображения в ImageJ/Fiji зависит от диапазона отображения, определенного пользователем. Здесь показано влияние корректировки минимального значения на внешний вид эндоплазматического ретикулума. Значение можно задать в окне Яркость и контрастность (B&C). Внешний вид одного и того же 16-битного изображения изменяется при изменении этого параметра. Слева, при значении 0, контраст низкий, при этом фоновый сигнал виден в областях, лишенных ячеек. Справа значение 400 значительно выше фона; В результате периферический эндоплазматический ретикулум (т.е. сеть под плазматической мембраной) становится затемненной. Гистограмма в окне Яркость и контрастность (B&C) предоставляет информацию о распределении интенсивности сигнала по изображению, которую можно использовать в качестве ориентира при выборе подходящего диапазона отображения. Масштабная линейка: 2 мкм. (B) Вывод числа интегрирования конструкций между трансформаторами путем сравнения интенсивности флуоресцентного сигнала. Обратите внимание, что при съемке изображений должны использоваться одни и те же параметры экспозиции. В этом примере сравниваются изображения от трех разных трансформантов. Колония 1 представляет собой трансформант с одной копией и интеграцией; Колония 2 и колония 3 являются преобразователями с множественной интеграцией копий. В верхнем ряду к каждому изображению были применены разные минимальные и максимальные пороги (80-1400, 80-3000, 80-4000 соответственно), при этом более высокие максимальные значения применялись к более ярким образцам. С этой точки зрения, сходные субклеточные модели распределения можно увидеть во всех трех образцах. В нижнем ряду ко всем трем изображениям были применены одинаковые минимальные и максимальные пороги (80-2000). С этой точки зрения, более высокие уровни сигнала в колониях 2 и 3 очевидны, что отражает тот факт, что они несут в своих геномах множественные копии конструкции Rtn1-msGFP. Масштабная линейка: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Типичная морфология основных дрожжевых органелл. (A) Репрезентативные моментальные изображения. Конструкции флуоресцентных белков и органеллы, которые они представляют, обозначены слева от изображений. DIC: дифференциальный интерференционный контраст, один срез. Срез: Один срез в z-стеке флуоресцентного канала. Проекция: проекция максимальной интенсивности флуоресцентного канала. Обратите внимание, что здесь сопоставление 16-битных и 8-битных срезов было сделано по-разному для срезов и проекций, чтобы улучшить видимость органелл в срезах. Масштабная линейка: 2 мкм. (B) Морфологические различия между ядерным эндоплазматическим ретикулумом/ядерной оболочкой и вакуолью. Как ядерный эндоплазматический ретикулум, так и вакуоли проявляются как круглые структуры при визуализации в центре клетки. По сравнению с вакуолями, ядерный эндоплазматический ретикулум, как правило, менее округлый, и соответствующая область при ДВС-синдроме также менее выражена. Масштабная линейка: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
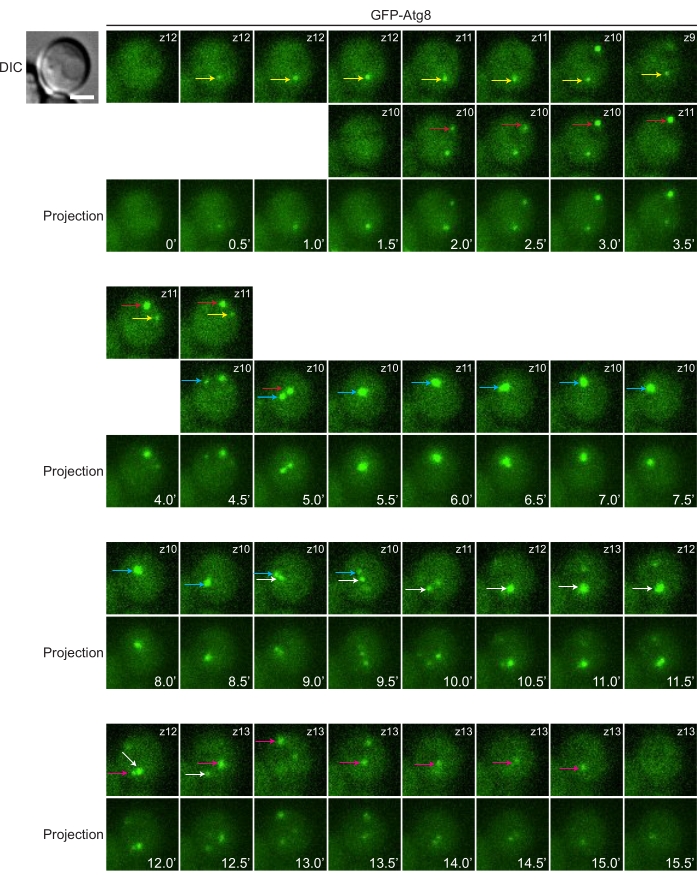
Рисунок 4: Наблюдение за динамикой аутофагосом с помощью покадровой визуализации. Дрожжевые клетки, экспрессирующие GFP-Atg8, выращивали до среднелогарифмической фазы в среде YPD, а затем перемещали в среду SD-N для голодания. Через 45 минут после переключения среды дрожжевые клетки устанавливали на чашки со стеклянным дном и инкубировали с SD-N для покадровой визуализации. Стеки изображений собирались с интервалом в 30 с. В этом примере можно увидеть пять раундов образования и исчезновения аутофагосом. Точки, представляющие Atg8-положительные аутофагические структуры, были вручную отслежены с течением времени и помечены стрелками другого цвета (т.е. стрелки одного и того же цвета обозначают одну и ту же точку, за которой следят). Обратите внимание, что в любой конкретный момент времени разные точки (если их несколько) могут появиться в разных z-позициях. Отдельные срезы, содержащие отслеживаемые точки в фокусе, отображаются в одном или двух верхних рядах, а z-позиция указана в правом верхнем углу (т.е. z10 обозначает10-й срез, а z12 —12-й ). Использование проекции максимальной интенсивности является удобным подходом для просмотра всех конструкций. Однако контур каждой отдельной структуры не такой четкий, как в одиночных срезах. Проекции максимальной интенсивности показаны в строке под срезами. Масштабная линейка: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Использование маркеров органелл для определения субклеточной локализации белка. Репрезентативные срезы дрожжевых клеток, совместно экспрессирующие GFP-Sft1 либо с Sec2-DuDre (поздний маркер Гольджи/ранний эндосомный маркер), либо Anp1-mCherry (ранний маркер Гольджи). Sft1 продемонстрировал частичную колокализацию с обоими маркерами органелл. Белые стрелки, частота колокализации; Красные стрелки, частота отсутствия колокализации. Масштабная линейка: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Скриншоты, показывающие выбор параметров визуализации в программном обеспечении VisiView. (А) Настройка интенсивности возбуждающего света. В качестве отправной точки установите 100% для всех каналов. Общие соображения по регулировке параметров возбуждения см. в тексте. (B) Выбор световых каналов для визуализации. В этом примере был продемонстрирован выбор двух флуоресцентных каналов: GFP и mCherry. В VisiView каждый канал должен быть выбран из выпадающего меню. Во многих других программных приложениях все каналы могут быть сконфигурированы в едином графическом интерфейсе, похожем на электронную таблицу. Обратите внимание, что в этом конкретном программном обеспечении есть флажок Одинаковая экспозиция/Усиление для всех длин волн, который необходимо снять, чтобы разрешить уникальную продолжительность экспозиции для каждого канала. (C) Установка количества срезов и шагов для сбора z-стеков. 3,5 мкм в каждом направлении, покрывая глубину 7 мкм с шагом 0,5 мкм. (D) Выбор порядка переключения каналов и прогрессии z-стека в многоканальной визуализации. В большинстве программ для управления микроскопом можно выбрать завершение всех каналов в z-положении перед переходом к следующему срезу или завершение полного z-стека в каждом канале перед переходом к следующему каналу. Этот выбор влияет как на затраты времени на получение изображений, так и на точность колокализации движущихся объектов. (E) Установка количества временных точек и интервалов для покадровой съемки. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Таблица 1: Список плазмид маркеров органелл. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Описанный здесь протокол обеспечивает простое начало для людей, поступающих из других областей исследований, для изучения визуализации дрожжевых органелл. Прежде чем перейти к конкретным темам, мы хотели бы еще раз подчеркнуть, что необходимо воздерживаться от чрезмерного использования автоматических функций в программах для работы с изображениями. Микроскопические изображения – это не просто красивые картинки, это научные данные, и поэтому к их получению и интерпретации следует относиться соответственно. Особенно важно, чтобы параметры коллекции изображений были выбраны добросовестно, а также были ознакомлены с понятиями 16-битных и 8-битных изображений.
В этом протоколе перечислены четыре различные дрожжевые среды: SMD, SMD+CA, YPD и SD-N. SMD расшифровывается как «синтетическая минимальная декстроза». Преимущество SMD заключается в том, что он обеспечивает низкую автофлуоресценцию. Таким образом, SMD является предпочтительной средой для флуоресцентной визуализации. SMD+CA содержит казаминокислоты, которые обеспечивают более богатое питание, чем SMD, с ограничением, заключающимся в том, что он больше не является чисто синтетическим. Будучи богатым питательными веществами, YPD хорош в качестве общей среды для культивирования дрожжевых клеток, но он менее идеален для визуализации из-за высокой автофлуоресценции, которую он обеспечивает. SD-N представляет собой среду для азотного голодания, которая может быть использована для индуцирования аутофагии и пролиферации липидных капель. SD-N также является синтетическим и генерирует низкую автофлуоресценцию.
Обратите внимание, что добавка аминокислот и нуклеиновых оснований в рецептуре SMD, используемая в этом протоколе, подходит для многих распространенных лабораторных штаммов, но не для всех. SMD должен обеспечивать организм необходимыми питательными веществами, объем которых зависит от генотипа штамма. При отборе трансформантов с комплементарным аллелем ауксотрофного гена соответствующий питательный ингредиент опускается для создания выпадающей среды (т.е. урацил не учитывается для отбора для клеток Ura+). Для получения дополнительной информации, пожалуйста, обратитесь к другим публикациям по этой теме14. Также обратите внимание, что для стерилизации среды добавки аминокислот и нуклеиновых оснований не должны подвергаться автоклавированию. Его нужно отфильтровать. Глюкоза темнеет при длительном автоклавировании, чего также следует избегать.
При изучении динамики органелл и внутриклеточного переноса белков важно избегать чрезмерной экспрессии флуоресцентных белковых конструкций. Сверхэкспрессия имеет тенденцию нарушать стехиометрию белковых комплексов и приводить к неожиданным последствиям для усиления функции, которые могут либо скрывать, либо устранять исходный изучаемый паттерн субклеточного распределения.
Учитывая это, мы рекомендуем использовать хороший инвертированный широкопольный флуоресцентный микроскоп для наблюдения за белками, экспрессирующимися на их эндогенном уровне. Рабочая среда должна быть темной, а все освещение на потолке должно быть выключено. Избегайте использования точечных лазерных конфокальных микроскопов. На момент написания этой статьи большинство точечных лазерных конфокальных микроскопов не так чувствительны к обнаружению слабых флуоресцентных сигналов, как высококлассные широкопольные флуоресцентные микроскопы. Среди доступных широкоугольных флуоресцентных микроскопов выберите тот, который оснащен хорошей КМОП-камерой и объективом с высокой числовой апертурой. Объективы с большим увеличением (например, 100x) предпочтительнее, в основном потому, что дрожжевые клетки малы. В идеале шаг пикселя камеры должен удовлетворять частоте дискретизации Найквиста при сопряжении с выбранной целью. Если вместо этого микроскоп оснащен камерой с большим шагом пикселя для обнаружения чрезвычайно слабых сигналов,стоит попробовать восстановление пространственных деталей с помощью вычислительной обработки. Расходные материалы для этой процедуры микроскопии являются универсальными по своей природе. Одна из потенциальных проблем заключается в том, что покровное стекло некоторых поставщиков не очищается в соответствии с высокими стандартами, поэтому может производить флуоресценцию, которая мешает наблюдению за образцом. Переход к другому поставщику — простое решение.
Важно, чтобы дрожжевые клетки поддерживались в здоровом состоянии для визуализации. Дрожжи на агаровых пластинах могут выживать в течение нескольких месяцев при 4 °C. Однако, если для инокуляции жидкой культуры используется старая пластина, в поле зрения часто будут появляться уродливые стареющие клетки. Этого можно избежать, используя только что прорезанную тарелку.
Если вы не можете обнаружить флуоресцентный сигнал химеры, проверьте его экспрессию с помощью иммуноблоттинга. Если конструкция выражена и молекулярная масса выглядит разумной, то, скорее всего, это проблема с конфигурацией оборудования. Проконсультируйтесь со специалистом по микроскопу. Если выражение не обнаружено, проблема, скорее всего, связана с ошибкой в построении деформации. Убедитесь, что плазмида верна и используется по назначению (т.е. фермент расщеплен или амплифицирован методом ПЦР).
Когда дрожжевые клетки прикрепляются к стеклянным поверхностям для микроскопического наблюдения, даже если присутствует жидкая среда и поддерживается температура, окружающая среда не идентична той, что находится в пробирке при встряхивании. Доступ к воздуху ограничен, да и механическая подсказка тоже другая. Существует вероятность того, что эти различия могутизменить исследуемый биологический процесс. В таких редких ситуациях нужно найти более изобретательные способы продолжения конкретного процесса.
Благодарности
Авторы хотели бы поблагодарить сотрудников лаборатории Се за их щедрую помощь в подготовке рукописи. Работа выполнена при поддержке Национального фонда естественных наук Китая (грант 91957104), Шанхайской муниципальной комиссии по образованию (грант 2017-01-07-00-02-E00035) и Шанхайской муниципальной комиссии по науке и технике (грант 22ZR1433800).
Материалы
| Name | Company | Catalog Number | Comments |
| Adenine | Sangon Biotech | A600013 | |
| Casaminoacid | Sangon Biotech | A603060 | |
| Concanavalin A from canavalia ensiformis (Jack bean) | Sigma Aldrich | L7647 | |
| D-Glucose | Sangon Biotech | A501991 | |
| Fiji | https://fiji.sc/ | ||
| Glass-bottom petri dish | NEST | 706001 | Φ35 mm |
| ImajeJ | https://imagej.net/ | ||
| Inverted florescence microscope | Olympus | IX83 equipped with UPLXAPO 100X oil immersion objective, Lumencor Spectra X light source, and Hamamatsu Orca Flash4.0 LT camera. | |
| L-Histidine | Sangon Biotech | A604351 | |
| L-Leucine | Sangon Biotech | A100811 | |
| L-Lysine | Sangon Biotech | A602759 | |
| L-Methionine | Sangon Biotech | A100801 | |
| L-Tryptophan | Sangon Biotech | A601911 | |
| Microscope cover glass | CITOTEST | 10222222C | 22 mm x 22 mm, 0.16–0.19 mm |
| Microscope slides | CITOTEST | 1A5101 | 25 mm x 75 mm, 1–1.2 mm |
| Peptone | Sangon Biotech | A505247 | |
| Uracil | Sangon Biotech | A610564 | |
| Visiview | Visitron System GmbH | https://www.visitron.de/products/visiviewr-software.html | |
| Yeast extract | Sangon Biotech | A100850 | |
| Yeast nitrogen base without amino acids | Sangon Biotech | A610507 | |
| YNB without amino acids and ammonium sulfate | Sangon Biotech | A600505 |
Ссылки
- Levine, B., Klionsky, D. J. Autophagy wins the 2016 Nobel prize in physiology or medicine: Breakthroughs in baker's yeast fuel advances in biomedical research. Proceedings of the National Academy of Sciences of the United States of America. 114 (2), 201-205 (2017).
- Spang, A. Anniversary of the discovery of sec mutants by Novick and Schekman. Molecular Biology of the Cell. 26 (10), 1783-1785 (2015).
- Walter, T., Erdmann, R. Current advances in protein import into peroxisomes. The Protein Journal. 38 (3), 351-362 (2019).
- Farre, J. C., Subramani, S. Mechanistic insights into selective autophagy pathways: lessons from yeast. Nature Reviews. Molecular Cell Biology. 17 (9), 537-552 (2016).
- West, M., Zurek, N., Hoenger, A., Voeltz, G. K. A 3D analysis of yeast ER structure reveals how ER domains are organized by membrane curvature. Journal of Cell Biology. 193 (2), 333-346 (2011).
- Day, K. J., Casler, J. C., Glick, B. S. Budding yeast has a minimal endomembrane system. Developmental Cell. 44 (1), 56-72 (2018).
- Zhu, J., et al. A validated set of fluorescent-protein-based markers for major organelles in yeast (Saccharomyces cerevisiae). mBio. 10 (5), 19(2019).
- Li, D., et al. A fluorescent tool set for yeast Atg proteins. Autophagy. 11 (6), 954-960 (2015).
- Gietz, R. D., Woods, R. A. Yeast transformation by the LiAc/SS Carrier DNA/PEG method. Methods in Molecular Biology. 313, Clifton, N.J. 107-120 (2006).
- Caloca, B., et al. Comparison of concanavalin A and poly-l-lysine as cell adhesives for routine yeast microscopy applications. Yeast. , (2021).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Banfield, D. K., Lewis, M. J., Pelham, H. R. B. A SNARE-like protein required for traffic through the Golgi complex. Nature (London). 375 (6534), 806-809 (1995).
- Curran, B. P., Bugeja, V. Basic investigations in Saccharomyces cerevisiae. Methods in Molecular Biology. 1163, Clifton, N.J. 1-14 (2014).
- Zhao, W., et al. Sparse deconvolution improves the resolution of live-cell super-resolution fluorescence microscopy. Nature Biotechnology. , (2021).
- He, C. W., et al. Membrane recruitment of Atg8 by Hfl1 facilitates turnover of vacuolar membrane proteins in yeast cells approaching stationary phase. BMC Biology. 19 (1), 117(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены