Method Article
Облегчение диабетического повреждения сухожилий за счет активации аутофагии сухожильных фибробластов на фоне лечения берберином
* Эти авторы внесли равный вклад
В этой статье
Аннотация
Берберин (BBR) является изохинолиновым алкалоидом, выделенным из Coptis chinensis и обладающим ценными фармакологическими свойствами, включая противовоспалительное, противоопухолевое и облегчающее некоторые осложнения сахарного диабета 2 типа (СД2). Тем не менее, роль BBR в регулировании диабетического повреждения сухожилий остается плохо изученной. В этом исследовании была построена модель СД2 на крысе, а апоптоз и аутофагия клеток были оценены в тканях сухожилий после лечения BBR с помощью TdT-опосредованного мечения dUTP ник-энда (TUNEL) и иммуногистохимического анализа. Сухожильные фибробласты были получены из ахиллова сухожилия крысы, а роль BBR в регуляции клеточного апоптоза, продукции воспалительных цитокинов и активации аутофагии оценивали с помощью проточной цитометрии, количественной ПЦР в реальном времени (qRT-PCR) и вестерн-блоттинга. Показано, что лечение BBR достоверно повышает активацию аутофагии и снижает апоптоз клеток в сухожильных тканях крыс с СД2. В сухожильных фибробластах BBR подавляет индуцированный высоким содержанием глюкозы (HG) апоптоз клеток и продукцию провоспалительных цитокинов. Лечение ГГ приводило к снижению активации аутофагии в сухожильных фибробластах, в то время как BBR восстанавливал активацию аутофагии. Что еще более важно, фармакологическое ингибирование аутофагии с помощью 3-MA ослабляло защитные эффекты BBR против индуцированного HG повреждения сухожильных фибробластов. В совокупности текущие результаты демонстрируют, что BBR помогает облегчить диабетическое повреждение сухожилий, активируя аутофагию сухожильных фибробластов.
Введение
Сахарный диабет (сахарный диабет, СД) – системное нарушение обмена веществ, характеризующееся гипергликемией1. В настоящее время сахарный диабет стал одним из основных заболеваний, угрожающих здоровью и продолжительности жизни человека2. Более 90% случаев приходится на диабет 2типа, метаболическое заболевание, характеризующееся хроническимвоспалением3, резистентностью к инсулину4 и повреждением островковых клеток β 5, и распространенность этого заболевания растет с каждым годом во всем мире.
Диабет 2 типа приводит к ряду серьезных осложнений, которые оказывают серьезное воздействие на сердечно-сосудистуюсистему, глаза7, почки 7 и нервы8, подвергая пациентов с диабетом риску множественных нарушений и даже опасным для жизни рискам для здоровья. Было проведено мало исследований опорно-двигательного аппарата, особенно патологических изменений в диабетических сухожилиях. В последние годы заболеваемость хронической тендинопатией значительно возросла. Сухожилия могут динамически регулировать свою способность накапливать и отдавать энергию 9,10. В тканях сухожилий сухожильные фибробласты играют важную роль в модуляции адаптации сухожилий и восстановлении сухожилий после травмы 9,11. В настоящее время функция сухожильных фибробластов при повреждении сухожилий остается неясной.
Являясь изохинолиновым алкалоидом, BBR оказывает фармакологическое действие в различных физиологических процессах, включая снижение уровня глюкозы в крови, снижение уровня липидов, снижение уровня холестерина, противовоспалительное действие, антибактериальное действие, удаление активных форм кислорода и противодействие дисфункции нервной системы12,13. BBR может увеличивать поглощение и использование глюкозы в жировой ткани и клетках скелетных мышц, повышать экспрессию рецептора инсулина в клетках печени и скелетных мышц, увеличивать экспрессию рецептора ЛПНП в печени и снижать уровни холестерина и сахара в плазме14. Несмотря на то, что BBR обладает ценной фармакологической активностью в облегчении некоторых осложнений СД 15,16,17, роль BBR в регулировании диабетического повреждения сухожилий остается плохо изученной.
Аутофагия должна происходить на исходном уровне в большинстве тканей для изъятия поврежденных органелл и обеспечения метаболитов для поддержания метаболического гомеостаза18,19. Аутофагия играет решающую роль в здоровье β-клеток, а нарушение аутофагии коррелирует с дисфункцией β-клеток и прогрессированием диабета20,21. Новые исследования показали, что BBR-индуцированная активация аутофагии способствует улучшению диабетической нефропатии22. Основываясь на вышеизложенных выводах, мы изучили, полезен ли BBR в облегчении повреждения диабетических сухожилий за счет регуляции аутофагии. Текущие результаты показали, что BBR снижает индуцированное HG повреждение сухожильных фибробластов и воспалительную реакцию. ГГ снижал активацию аутофагии сухожильных фибробластов, в то время как лечение BBR восстанавливало активацию аутофагии и приводило к последующему увеличению жизнеспособности сухожильных фибробластов и снижению провоспалительных цитокинов.
протокол
Данное исследование было одобрено Комитетом по этике научных исследований при Юэянской больнице интегрированной традиционной китайской и западной медицины Шанхайского университета традиционной китайской медицины. Все эксперименты на животных были одобрены Этическим комитетом Больницы интегрированной традиционной китайской и западной медицины Юэян Шанхайского университета традиционной китайской медицины (номер IACUC: YYLAC-2019-1). Самцы крыс Wistar (200-240 г, в возрасте 8 недель) были приобретены в Шанхайском центре лабораторных животных SLAC.
1. Крысиная модель СД2
- Содержать самцов крыс линии Wistar (200-240 г, в возрасте 8 недель) в условиях климат-контроля с 12-часовым циклом свет/темнота (20 ± 2 °C и относительная влажность 50%-60%). Обеспечьте пищу и воду в неограниченном количестве в течение экспериментального периода.
- Прилагайте усилия, чтобы свести к минимуму страдания животных, включая бережное обращение, ежедневную чистку клетки и контроль.
- Случайным образом распределите крыс по 3 группам: контрольная группа (n = 5), группа модели DM (n = 5) и группа диабетической модели, получавшей BBR (n = 5).
- Установите модель ДМ крысы в соответствии с предыдущим описанием23.
- Вводите крысам однократное внутривенное введение стрептозотоцина (STZ), растворенного в свежеприготовленном буфере цитрата натрия (w/v: 2%) в дозе 30 мг/кг. Внутрибрюшинно в контрольную группу вводят равный объем цитрата цитрата цитрата буфера без СТЗ.
- Оценивайте уровень глюкозы в крови с помощью газоанализатора крови. Используйте крыс с указанным уровнем глюкозы в крови (≥16,7 ммоль/л, непрерывно в течение 10 дней) для модели СД2.
- Через 1 неделю случайным образом разделите крыс с СД2 на две группы (n = 5 в каждой группе): необработанные крысы или крысы, которым вводили 200 мг/кг/сут ВБР через зонд в течение 4 недель.
2. Первичные сухожильные фибробласты
- Умерщвляйте крыс под наркозом путем внутрибрюшинного введения барбитурата (40 мг/кг) и получайте ахиллово сухожилие, как сообщалось ранее24.
- Выделение сухожильных фибробластов из тканей сухожилий25.
- Измельчите ткани сухожилия вручную и поместите их в DMEM, содержащий 0,2% коллагеназы II типа. Энергично перемешивать в течение 3 ч при 37 °C.
- Удалите среду центрифугированием и добавьте в переваренную ткань DMEM, содержащий 10% FBS и 1% пенициллин/стрептомицин.
- Отфильтруйте ткани сухожилий через ситечко 100 мкм, разлейте отфильтрованный раствор в 6-луночные планшеты и поддерживайте фибробласты сухожилий во влажном инкубаторе при температуре 37 °C с 5%CO2.
3. Анализ жизнеспособности клеток
ПРИМЕЧАНИЕ: Для измерения жизнеспособности клеток использовался набор для подсчета клеток-8 (CCK-8) в соответствии с инструкциями производителя.
- После трипсинизации сухожильные фибробласты помещают в 96-луночные планшеты (4 x 103 клеток/лунку), а затем обрабатывают их различными дозами глюкозы (0, 5, 10, 20, 30 и 50 мМ) в присутствии или отсутствии BBR (0, 5, 10, 20, 40 и 80 мкМ) в течение 48 ч.
Примечание: Глюкоза и BBR растворялись в DMEM. - Добавьте раствор CCK-8 (10 мкл) в каждую лунку и инкубируйте клетки еще 2 ч при 37°С.
- Впоследствии измерьте поглощение каждой лунки с помощью считывателя микропланшетов на длине волны 450 нм.
4. Анализ клеточного апоптоза
Примечание: Для анализа скорости апоптоза сухожильных фибробластов использовали анализ пропидида йодида (PI) и аннексина V-FITC.
- Засейте сухожильные фибробласты (5 x 105 клеток) в 6-луночные планшеты в DMEM на 24 ч.
- Отсадите и выбросьте DMEM из каждой лунки. Обрабатывайте клетки свежим DMEM, содержащим HG (30 мМ) в присутствии или отсутствии BBR (20 μM) в течение 24 ч.
- Отделите клетки с 0,25% трипсином в 1x PBS, соберите клетки с PBS и центрифугируйте при 2000 x g в течение 5 минут.
- Ресуспендировать клетки в связующем буфере (Таблица материалов) и окрасить 10 мкл ФИТК-конъюгированного аннексина V и 5 мкл ПИ в темноте на 15 мин при комнатной температуре (ОТ).
- Затем проанализируйте клетки с помощью проточного цитометра.
5. Количественная полимеразная цепная реакция в реальном времени (qRT-PCR)
- Соберите сухожильные фибробласты и гомогенизируйте с помощью набора для экстракции РНК (Таблица материалов) в соответствии с рекомендациями производителя.
- Проведите обратную транскрипционную ПЦР с обратной транскриптазой вируса лейкоза мышей Молони и праймерами Oligo (dT) (Таблица материалов).
- Проведите qRT-PCR с использованием SYBR green qPCR Mix на системе ПЦР в реальном времени. Условия цикла: денатурация при 95 °C в течение 10 мин и 45 циклов при 95 °C в течение 20 с, 55 °C в течение 20 с и 72 °C в течение 30 с.
ПРИМЕЧАНИЕ: Для получения подробной информации о грунтовках для IL-1β, IL-6 и IL-10 обратитесь к Таблице материалов. В качестве референсного гена использовался β-актин. - Вычислите относительный уровень экспрессии с помощью формулы 2-ΔΔCT , как описано ранее26 .
6. Вестерн-блоттинг
- После обработки HG (30 мМ) в присутствии или отсутствии BBR (20 мкМ) в течение 24 ч лизировать фибробласты сухожилий с помощью буфера RIPA (Таблица материалов) и количественно определить общую концентрацию белка с помощью анализа бицинхониновой кислоты.
- Эквивалентные количества белков (50 мкг) отделяют от каждого образца с помощью 10% SDS-PAGE в режиме RT, а затем переносят на мембраны из поливинилиденфторида (PVDF) при 4 °C в течение 2 ч.
- Заблокируйте мембраны в 5% обезжиренном сухом молоке в TBST, а затем инкубируйте в течение ночи при 4 °C со следующими первичными антителами: антитела против LC3B (1:1500), анти-p62 (1:2000) и антитела против β-актина (1:3500).
- После промывки TBST мембраны инкубировать с козьими антикроличьими H&L HRP-конъюгированными вторичными антителами (1:5000) при RT в течение 1 ч.
- Используйте набор для хемилюминесценции ECL для визуализации конкретных блоттингов и количественного определения авторадиограмм с помощью денситометрии.
7. Иммуногистохимический анализ (ИГХ)
- Разрежьте залитые парафином сухожильные ткани стопы на участки толщиной 6 мкм.
- После фиксации срезов в 4% формалине инкубировать срезы с антителами против LC3 (1:200) в течение ночи при 4 °С.
- После трехкратной промывки с использованием 10 мМ PBS (pH7,4 с Tween 20) инкубируйте все срезы козьим анти-кроличьим HRP-конъюгированным вторичным антителом (1:1000) в течение 1 ч при 37 °C и окрашивайте DAB и гематоксилином в течение 60 мин в режиме RT.
- Визуализируйте окрашенные предметные стекла с 20-кратным увеличением с помощью инвертированного микроскопа.
8. Проба TUNEL
ПРИМЕЧАНИЕ: Клеточный апоптоз в ткани сухожилия анализировали с помощью набора для анализа TUNEL в соответствии с инструкциями производителя.
- Разрежьте залитые парафином сухожильные ткани стопы на участки толщиной 6 мкм.
- Депарафинизируйте срезы в ксилоле и регидратируйте их в виде градуированного ряда этанола.
- После погружения с 3% перекисью водорода в RT инкубируйте секции с реакционной смесью TUNEL в течение 1 ч при 37 °C.
- Контрокрашивание ядер с помощью DAPI. Понаблюдайте за окрашенными клетками под флуоресцентным микроскопом (20x) и определите процент TUNEL-положительных клеток.
9. Статистический анализ
- Используйте соответствующие программные приложения для выполнения статистического анализа
Примечание: Здесь данные представлены в виде среднего значения ± стандартного отклонения (SD) трех независимых экспериментов. Статистический анализ проводился с помощью SPSS 23.0. Для сравнения различий между группами был проведен t-критерий Стьюдента, а для анализа нескольких групп был проведен односторонний дисперсионный анализ (ANOVA). Разница была статистически значимой при p < 0,05.
Результаты
Для оценки фармакологической роли BBR в облегчении диабетического повреждения сухожилий оценивали апоптоз клеток и активацию аутофагии в тканях сухожилий стопы крыс с СД в присутствии или отсутствии BBR. Рисунок 1А показал, что уровень белка LC3 (маркер аутофагии) был снижен в тканях сухожилий крыс с СД по сравнению с контрольными крысами, тогда как лечение BBR значительно восстановило активацию аутофагии. Кроме того, в тканях сухожилий крыс с СД апоптоз был повышен по сравнению с нормальными тканями, в то время как BBR значительно снижал апоптоз клеток (рис. 1В). Эти результаты показывают, что BBR увеличивает активацию аутофагии и снижает апоптоз клеток в сухожильных тканях крыс с СД.
Затем была оценена роль BBR в регуляции жизнеспособности сухожильных фибробластов и апоптоза in vitro. На рисунке 2А показано, что жизнеспособность сухожильных фибробластов снижается дозозависимым образом и что 30 мМ рт. Затем была исследована защитная роль BBR против фибробластов сухожилий в присутствии HG. Как показано на рисунке 2B, предварительная обработка сухожильных фибробластов BBR способствовала увеличению жизнеспособности клеток в присутствии HG (30 мМ) дозозависимым образом. BBR (20 мкМ) использовали для лечения сухожильных фибробластов в последующем исследовании. Кроме того, апоптоз сухожильных фибробластов измеряли в присутствии HG и/или BBR с помощью проточной цитометрии. На рисунках 2C,D показано, что доля апоптотических клеток была значительно увеличена после лечения HG, в то время как BBR снижал индуцированный HG апоптоз сухожильных фибробластов.
Хроническое воспаление является характерной чертой диабета 2 типа, которое связано с диабетическими осложнениями и способствует резистентности к инсулину. Таким образом, для определения влияния BBR на воспалительную реакцию измеряли воспалительные факторы IL-1β, IL-6 и IL-10 в фибробластах сухожилий, обработанных HG. Результаты количественной ОТ-ПЦР показали, что провоспалительные цитокины IL-1β и IL-6 были значительно повышены. Напротив, уровень противовоспалительного цитокина IL-10 был снижен после лечения ГГ (рис. 3A-C), что указывает на то, что ГГ вызывает провоспалительную реакцию в сухожильных фибробластах. Что еще более важно, лечение BBR подавляло HG-индуцированную провоспалительную реакцию в сухожильных фибробластах (рис. 3A-C).
Чтобы изучить роль BBR в регуляции активации аутофагии сухожильных фибробластов, сухожильные фибробласты обрабатывали HG в присутствии или отсутствии BBR, а затем анализировали активацию аутофагии. Как показано на рисунке 4A, лечение HG снижало активацию аутофагии в сухожильных фибробластах, о чем свидетельствует снижение LC3 зеленых точек, в то время как BBR, очевидно, восстанавливал активацию аутофагии в фибробластах сухожилий, обработанных HG. Кроме того, маркер аутофагии LC3-II и субстрат аутофагии p62 оценивали с помощью вестерн-блоттинга. Рисунок 4B,C показал, что HG снижает экспрессию белка LC3  и увеличивает экспрессию белка p62 в сухожильных фибробластах, что указывает на то, что HG инактивирует аутофагию сухожильных фибробластов. Как и ожидалось, BBR восстановил активацию аутофагии в обработанных HG сухожильных фибробластах (рис. 4B, C).
и увеличивает экспрессию белка p62 в сухожильных фибробластах, что указывает на то, что HG инактивирует аутофагию сухожильных фибробластов. Как и ожидалось, BBR восстановил активацию аутофагии в обработанных HG сухожильных фибробластах (рис. 4B, C).
Наконец, было исследовано, опосредована ли аутофагия роль BBR в облегчении HG-индуцированного повреждения сухожильных фибробластов. С этой целью для инактивации аутофагии в присутствии BBR использовали специфический ингибитор аутофагии, 3-MA, а затем оценивали жизнеспособность клеток и провоспалительные цитокины. Как показано на рисунках 5A, B, фармакологическое ингибирование аутофагии увеличивало апоптоз сухожильных фибробластов по сравнению с только лечением BBR. Аналогичным образом, лечение 3-MA привело к значительному снижению жизнеспособности сухожильных фибробластов по сравнению с лечением только BBR (Рисунок 5C). Лечение 3-MA также повышало уровень провоспалительных цитокинов по сравнению с лечением только BBR (Рисунок 5D). В совокупности эти данные демонстрируют, что BBR облегчает диабетическое повреждение сухожилий, активируя аутофагию сухожильных фибробластов.
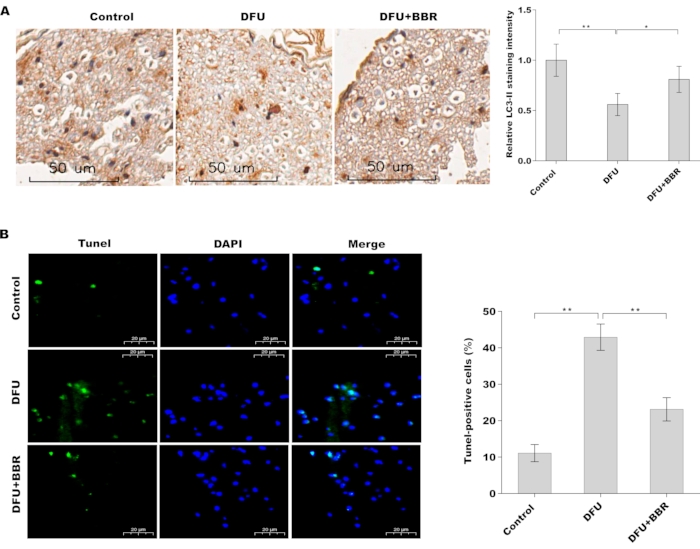
Рисунок 1: BBR увеличивал активацию аутофагии и снижал апоптоз клеток в тканях сухожилий крыс с СД. (A) Иммуногистохимический анализ экспрессии белка LC3 в тканях сухожилий стопы контрольных крыс (n = 5), крыс с СД (n = 5) и крыс с СД, получавших BBR (n = 5). Scan bar = 50 мкм. Увеличение 20x. (B) Апоптоз клеток анализировали с помощью окрашивания TUNEL в тканях сухожилий стопы крыс контрольной группы (n = 5), крыс с СД (n = 5) и крыс с СД, получавших BBR (n = 5). Полоса сканирования = 20 мкм. Увеличение 20x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
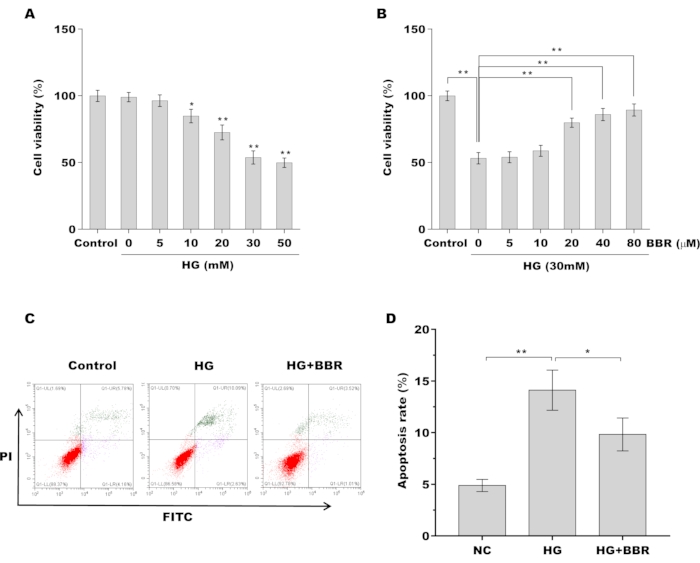
Рисунок 2: BBR снижал HG-индуцированный апоптоз сухожильных фибробластов (А) Жизнеспособность сухожильных фибробластов оценивали с помощью анализа CCK-8 после обработки различными дозами HG (0, 5, 10, 20, 30, 50 мМ). (B) Жизнеспособность сухожильных фибробластов оценивали с помощью анализа CCK-8 после обработки 30 мМ рт.ст. в присутствии BBR (0, 5, 10, 20, 40 и 80 мкМ). (К,Г) Клеточный апоптоз сухожильных фибробластов оценивали с помощью проточной цитометрии после лечения HG (30 мМ) в присутствии или отсутствии BBR (20 μM). * p < 0,05, ** p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: BBR облегчает индуцированную HG воспалительную реакцию в сухожильных фибробластах. (А-С) Уровни мРНК воспалительных факторов (A) IL-1β, (B) IL-6 и (C) IL-10 в сухожильных фибробластах определяли с помощью qRT-PCR после лечения HG (30 мМ) в присутствии или отсутствии BBR (20 мкМ). * p < 0,05, ** p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: BBR восстановил активацию аутофагии в сухожильных фибробластах, обработанных HG. (A) Уровень LC3 оценивали методом иммунофлуоресцентного анализа в сухожильных фибробластах после лечения HG (30 мМ) в присутствии или отсутствии BBR (20 мкМ). Полоса сканирования = 10 нм. Увеличение 60x. (B) Вестерн-блоттинг на определение уровней белка LC3 и P62 в сухожильных фибробластах после лечения HG (30 мМ) в присутствии или отсутствии BBR (20 мкМ). * p < 0,05, ** p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
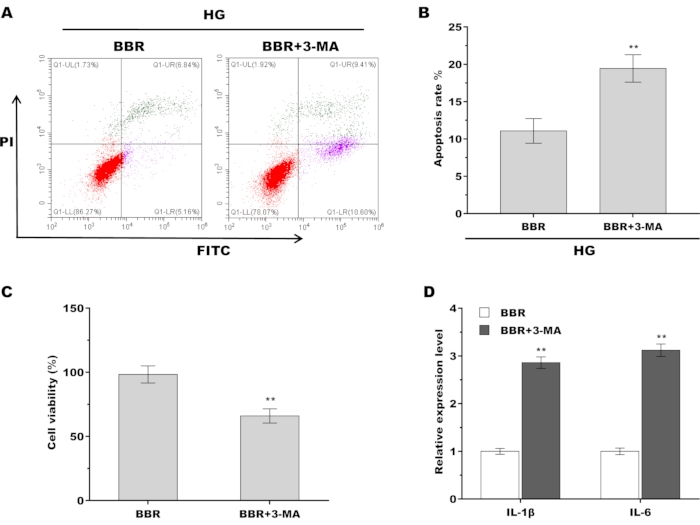
Рисунок 5: BBR облегчал HG-индуцированное повреждение сухожильных фибробластов путем активации аутофагии. (A,B) Клеточный апоптоз сухожильных фибробластов оценивали с помощью проточной цитометрии после лечения только BBR (20 мкМ) или BBR плюс 3-MA (5 Мм) в присутствии HG (30 мМ). (C) Жизнеспособность сухожильных фибробластов оценивали с помощью анализа CCK-8 после лечения только BBR (20 мкМ) или BBR плюс 3-MA (5 мм) в присутствии HG (30 мМ). (D) количественно-ПЦР-анализ уровня мРНК IL-1β и IL-6 в сухожильных фибробластах после обработки только BBR (20 мкМ) или BBR плюс 3-MA (5 мм) в присутствии HG (30 мМ). ** p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Травма сухожилия является распространенным осложнением у пациентов с СД27. Сухожильные фибробласты играют важную роль в процессе заживления ран28,29. Настоящее исследование подтвердило, что i) BBR увеличивал активацию аутофагии и уменьшал апоптоз клеток в сухожильных тканях крыс с СД, ii) BBR уменьшал HG-индуцированный апоптоз сухожильных фибробластов, iii) BBR смягчал индуцированную HG воспалительную реакцию в сухожильных фибробластах, iv) BBR восстанавливал активацию аутофагии в сухожильных фибробластах, обработанных HG, v) BBR облегчал HG-индуцированное повреждение сухожильных фибробластов путем активации аутофагии. Текущие результаты показали важную роль BBR в регуляции аутофагии сухожильных фибробластов при повреждении сухожилий и могут предоставить новую возможность для лечения диабетического повреждения сухожилий.
В исследовании была использована модель СД2 на крысах для изучения защитной роли ВБР против повреждения сухожилий. Модель СД2 была успешно создана путем однократного внутривенного введения СТЗ в дозе 30 мг/кг, как описано ранее23,30. Это важный шаг в оценке влияния BBR на облегчение травмы сухожилия. С целью верификации модели был проведен анализ уровня глюкозы в крови, а для последующего исследования были использованы крысы с указанным уровнем глюкозы в крови (≥16,7 ммоль/л, непрерывно в течение 10 дней). В построение модели Т2ДМ была внесена небольшая модификация. Здесь для лечения крыс применялось 30 мг/кг СТЗ, вместо 40 мг/кг. Несмотря на то, что модель СД2 на крысах широко использовалась в экспериментальных исследованиях, в немногих исследованиях эта модель применялась при травме сухожилий.
Предыдущие исследования показали, что хроническое воспаление низкой степени тяжести (ХКИ) связано с развитием СД2 и способствует резистентности к инсулину. Примечательно, что CLGI является важным фактором, который способствует развитию различных диабетических осложнений, таких как диабетическая болезнь стопы, сердечно-сосудистые повреждения, заболевания почек, ретинопатия и хронические раны. Предыдущее исследование показало, что гомеостаз сухожилий модифицируется HG, который подавляет экспрессию нижестоящих генов пути AMPK/Egr1 в сухожилиях31. Аутофагия является эффективным регулятором врожденных иммунных реакций, и эта аутофагия может подавлять активацию инфламмасом и выработку провоспалительных цитокинов. Hudgens et al. продемонстрировали, что обогащенная тромбоцитами плазма вызывает провоспалительную реакцию в сухожильных фибробластах, что приводит к активации путей окислительного стресса33. Текущее исследование также показало, что лечение HG вызывает провоспалительную реакцию в сухожильных фибробластах, в то время как BBR снижает индуцированную HG секрецию провоспалительных цитокинов. Что еще более важно, BBR подавляет провоспалительную реакцию в сухожильных фибробластах, активируя аутофагию. Кроме того, BBR также подавляет HG-индуцированный апоптоз сухожильных фибробластов путем активации аутофагии.
BBR широко используется в клиническом лечении метаболических заболеваний для повышения резистентности к инсулину и снижения уровня глюкозы и липидов, а также в качестве адъювантной терапии при гипертонии, гиперлипидемии, диабете, ожирении, жировой дистрофии печени и других состояниях. Например, BBR может снижать апоптоз клеток Мюллера на сетчатке в присутствии HG34. При диабетической болезни сердца введение BBR может улучшить сердечный фиброз и дисфункцию за счет ограничения уровней IGF-1R, коллагена I и α-SMA в сердце35. При диабетической периферической нейропатии BBR снижает индуцированное HG нейровоспаление и повреждение нейронов за счет подавления выработки АФК и выработки провоспалительного фактора36,37. BBR также регулирует воспалительную реакцию и ингибирует апоптоз клубочковых клеток, тем самым задерживая развитие диабетической нефропатии38. В настоящем исследовании данные показали, что BBR ослабляет HG-индуцированное повреждение сухожилия, а защитный эффект BBR был опосредован активацией аутофагии сухожильных фибробластов. Несмотря на то, что BBR обладает хорошими терапевтическими функциями при многих заболеваниях, его клиническое применение ограничено плохой абсорбцией при пероральном приеме или серьезными побочными эффектами (снижение артериального давления и прекращение дыхания) при внутривенном введении39,40.
Раскрытие информации
Авторы не имеют конфликта интересов, о котором можно было бы заявить, относящемся к содержанию данной статьи.
Благодарности
Это исследование было профинансировано в рамках Шанхайского проекта трехлетнего плана действий по дальнейшему ускорению развития традиционной китайской медицины [ZY (2018-2020)-CCCX-4005]
Материалы
| Name | Company | Catalog Number | Comments |
| 1% penicillin/streptomycin | Sigma-Aldrich, St. Louis, MO, USA | 516104-M | |
| anti-LC3B | Abcam, CA, USA | ab48394 | |
| anti-p62 | Abcam | ab91526 | |
| anti-β-actin antibody | Abcam | ab8227 | |
| Binding buffer | BD Biosciences | 556454 | |
| DMEM | Thermo Fisher Scientific, Waltham, MA, USA | 11965092 | |
| EVOS XL Core microscope | Thermo Fisher Scientific | AMEX1000 | |
| Goat anti-rabbit H&L HRP-conjugated secondary antibodies | Abcam | ab205718 | |
| Leukemiavirus reverse transcriptase | Clontech | 639574 | |
| Male Wistar rats | Shanghai SLAC Laboratory Animal Co., Ltd | 200–240 g, 8 weeks | |
| Oligo (dT)18 Primer | TaKaRa | 3806 | |
| Primers | Shanghai Sangon Biotech | Synthesized primers for IL-1β, IL-6 and IL-10 | |
| RIPA Lysis Buffer | Thermo Fisher Scientific | 20-188 | |
| RNA extraction kit (Trizol) | TaKaRa | 9108Q | |
| StepOne Realtime PCR System | Thermo Fisher Scientific | 4376357 | |
| TUNEL assay kit | Thermo Fisher Scientific | C10245 |
Ссылки
- Cho, S. B., Kim, S. C., Chung, M. G. Identification of novel population clusters with different susceptibilities to type 2 diabetes and their impact on the prediction of diabetes. Scientific Reports. 9 (1), 3329(2019).
- Diamant, A. L., Babey, S. H., Hastert, T. A., Brown, E. R. Diabetes: the growing epidemic. Policy Brief (UCLA Center for Health Policy Research. , 1-12 (2007).
- Zhang, H., Qi, R., Zeng, Y., Tsao, R., Mine, Y. Chinese sweet leaf tea (Rubus suavissimus) mitigates LPS-induced low-grade chronic inflammation and reduces the risk of metabolic disorders in a C57BL/6J mouse model. Journal of Agricultural and Food Chemistry. 68 (1), 138-146 (2019).
- Tian, S., Wang, M., Liu, C., Zhao, H., Zhao, B. Mulberry leaf reduces inflammation and insulin resistance in type 2 diabetic mice by TLRs and insulin Signalling pathway. BMC Complementary and Alternative Medicine. 19 (1), 326(2019).
- Butler, A. E., Janson, J., Soeller, W. C., Butler, P. C. Increased beta-cell apoptosis prevents adaptive increase in beta-cell mass in mouse model of type 2 diabetes: evidence for role of islet amyloid formation rather than direct action of amyloid. Diabetes. 52 (9), 2304-2314 (2003).
- Ramirez-Farias, C., et al. Effect of inulin on the human gut microbiota: stimulation of Bifidobacterium adolescentis and Faecalibacterium prausnitzii. British Journal of Nutrition. 101 (4), 541-550 (2009).
- Zhang, Y., et al. Treatment of type 2 diabetes and dyslipidemia with the natural plant alkaloid berberine. The Journal of Clinical Endocrinology and Metabolism. 93 (7), 2559-2565 (2008).
- Turnbaugh, P. J., Backhed, F., Fulton, L., Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell Host & Microbe. 3 (4), 213-223 (2008).
- Jamil, S., et al. Angiopoietin-like 4 enhances the proliferation and migration of tendon fibroblasts. Medicine & Science in Sports & Exercise. 49 (9), 1769-1777 (2017).
- Bohm, S., Mersmann, F., Tettke, M., Kraft, M., Arampatzis, A. Human achilles tendon plasticity in response to cyclic strain: effect of rate and duration. Journal of Experimental Biology. 217, 4010-4017 (2014).
- Mousavizadeh, R., et al. Cyclic strain alters the expression and release of angiogenic factors by human tendon cells. PLoS One. 9 (5), 97356(2014).
- Dong, H., Zhao, Y., Zhao, L., Lu, F. The effects of berberine on blood lipids: a systemic review and meta-analysis of randomized controlled trials. Planta Medica. 79 (6), 437-446 (2013).
- Dong, H., Wang, N., Zhao, L., Lu, F. Berberine in the treatment of type 2 diabetes mellitus: a systemic review and meta-analysis. Evidence-Based Complementary and Alternative Medicine. 2012, 591654(2012).
- Pirillo, A., Catapano, A. L. Berberine, a plant alkaloid with lipid- and glucose-lowering properties: From in vitro evidence to clinical studies. Atherosclerosis. 243 (2), 449-461 (2015).
- Sun, S. F., et al. Renoprotective effect of berberine on type 2 diabetic nephropathy in rats. Clinical and Experimental Pharmacology and Physiology. 42 (6), 662-670 (2015).
- Zhai, J., et al. Berberine protects against diabetic retinopathy by inhibiting cell apoptosis via deactivation of the NFkappaB signaling pathway. Molecular Medicine Reports. 22 (5), 4227-4235 (2020).
- Zhang, J. H., et al. Effects of Berberine on diabetes and cognitive impairment in an animal model: The mechanisms of action. The American Journal of Chinese Medicine. 49 (6), 1399-1415 (2021).
- Jandrey, E. H. F., et al. A key pathway to cancer resilience: The role of autophagy in glioblastomas. Frontiers in Oncology. 11, 652133(2021).
- Kroemer, G., Levine, B. Autophagic cell death: the story of a misnomer. Nature Reviews Molecular Cell Biology. 9 (12), 1004-1010 (2008).
- Hoshino, A., et al. Inhibition of p53 preserves Parkin-mediated mitophagy and pancreatic beta-cell function in diabetes. Proceedings of the National Academy of Sciences of the United States of America. 111 (8), 3116-3121 (2014).
- Jung, H. S., et al. Loss of autophagy diminishes pancreatic beta cell mass and function with resultant hyperglycemia. Cell Metabolism. 8 (4), 318-324 (2008).
- Zhang, M., et al. Highly bioavailable berberine formulation ameliorates diabetic nephropathy through the inhibition of glomerular mesangial matrix expansion and the activation of autophagy. European Journal of Pharmacology. 873, 172955(2020).
- Jia, Y., Xu, B., Xu, J. Effects of type 2 diabetes mellitus on the pharmacokinetics of berberine in rats. Pharmaceutical Biology. 55 (1), 510-515 (2017).
- Sakamoto, K., et al. Involvement of Na+/Ca2+ exchanger in migration and contraction of rat cultured tendon fibroblasts. Journal of Physiology. 587, 5345-5359 (2009).
- Mendias, C. L., Gumucio, J. P., Lynch, E. B. Mechanical loading and TGF-beta change the expression of multiple miRNAs in tendon fibroblasts. Journal of Applied Physiology. 113 (1), 56-62 (2012).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Oliver, T. I., Mutluoglu, M. Diabetic Foot Ulcer. Treasure Island (FL): StatPearls Publishing. , (2020).
- Zeng, T., et al. Endothelial cell-derived small extracellular vesicles suppress cutaneous wound healing through regulating fibroblasts autophagy. Clinical science. 133 (9), London, England. (2019).
- Sardone, F., et al. Collagen VI-NG2 axis in human tendon fibroblasts under conditions mimicking injury response. Matrix Biology. 55, 90-105 (2016).
- de Oliveira, A. R., et al. Effect of photobiomodulation and exercise on early remodeling of the Achilles tendon in streptozotocin-induced diabetic rats. PLoS One. 14 (2), 0211643(2019).
- Wu, Y. F., et al. High glucose alters tendon homeostasis through downregulation of the AMPK/Egr1 pathway. Scientific Reports. 7, 44199(2017).
- Garcia-Bailo, B., et al. E in the prevention of type 2 diabetes mellitus: modulation of inflammation and oxidative stress. Biologics. 5, 7-19 (2011).
- Hudgens, J. L., et al. Platelet-rich plasma activates proinflammatory signaling pathways and induces oxidative stress in tendon fibroblasts. American Journal of Sports Medicine. 44 (8), 1931-1940 (2016).
- Chen, H., et al. Berberine attenuates apoptosis in rat retinal Muller cells stimulated with high glucose via enhancing autophagy and the AMPK/mTOR signaling. Biomedicine & Pharmacotherapy. 108, 1201-1207 (2018).
- Li, G., et al. Antifibrotic cardioprotection of berberine via downregulating myocardial IGF-1 receptor-regulated MMP-2/MMP-9 expression in diabetic rats. American Journal of Physiology-Heart and Circulatory Physiology. 315 (4), 802-813 (2018).
- Yerra, V. G., Kalvala, A. K., Sherkhane, B., Areti, A., Kumar, A. Adenosine monophosphate-activated protein kinase modulation by berberine attenuates mitochondrial deficits and redox imbalance in experimental diabetic neuropathy. Neuropharmacology. 131, 256-270 (2018).
- Zhou, G., Yan, M., Guo, G., Tong, N. Ameliorative effect of berberine on neonatally induced type 2 diabetic neuropathy via modulation of BDNF, IGF-1, PPAR-gamma, and AMPK expressions. Dose Response. 17 (3), 1559325819862449(2019).
- Zhu, L., Han, J., Yuan, R., Xue, L., Pang, W. Berberine ameliorates diabetic nephropathy by inhibiting TLR4/NF-kappaB pathway. Biological Research. 51 (1), 9(2018).
- Han, Y., et al. Pharmacokinetics and pharmacological activities of berberine in diabetes mellitus treatment. Evidence-Based Complementary and Alternative Medicine. 2021, 9987097(2021).
- Habtemariam, S. Berberine pharmacology and the gut microbiota: A hidden therapeutic link. Pharmacological Research. 155, 104722(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены