Method Article
Метод недеградативной экстракции для определения молекулярной структуры частиц бактериального гликогена
* Эти авторы внесли равный вклад
В этой статье
Резюме
Методы экстракции сильно влияют на структуру бактериального гликогена, что может привести к молекулярной деградации и/или смещению выборки. Важно разработать методы, позволяющие свести эти проблемы к минимуму. Здесь были сравнены четыре метода экстракции с использованием распределения по размерам и распределения длины цепи в качестве ключевых критериев для минимизации артефактов экстракции.
Аннотация
В настоящее время существует множество методов экстракции гликогена, которые либо повреждают пространственную структуру гликогена, либо лишь частично экстрагируют гликоген, что приводит к смещенной характеристике тонкомолекулярной структуры гликогена. Чтобы понять динамические изменения структуры гликогена и универсальные функции частиц гликогена у бактерий, необходимо изолировать гликоген с минимальной деградацией. В этом исследовании продемонстрирован метод мягкого выделения гликогена с использованием осаждения холодной водой (CW) с помощью ультрацентрифугирования с градиентом плотности сахара (SDGU-CW). Для сравнения также были проведены традиционный метод трихлоруксусной кислоты (ТСА) и метод гидроксида калия (КОН). Широко используемый лабораторный штамм, Escherichia coli BL21(DE3), был использован в качестве модельного организма в этом исследовании в демонстрационных целях. После экстракции частиц гликогена с помощью различных методов их структуры были проанализированы и сравнены с помощью эксклюзионной хроматографии (SEC) для распределения частиц по размерам и флуорофорного капиллярного электрофореза (FACE) для линейного распределения длины цепи. Анализ подтвердил, что гликоген, экстрагированный с помощью SDGU-CW, имеет минимальную деградацию.
Введение
Гликоген представляет собой сильно разветвленный полисахарид, состоящий из глюкозильных остатков, а также небольшого, но значительного количества белков, в котором все глюкозильные остатки связаны между собой α-1,4-гликозидными связями в линейных цепях и α-1,6-гликозидными связями в точках ветвления1. Структура частиц гликогена обычно делится на три иерархии: 1) короткоцепочечные олигомеры, 2) сферические β частицы (~20 нм в диаметре) и 3) крупные розеткообразные α частицы, агрегированные вместе β частицами, диаметр которых колеблется примерно до 300 нм. В последнее время было установлено, что частицы гликогена α имеют у эукариот два структурных состояния: хрупкое состояние и стабильное состояние. В данном случае хрупкость означает диссоциацию более крупных α частиц на более мелкие β частицы в присутствии хаотропного агента, такого как ДМСО2. Дальнейшие анализы показали, что частицы гликогена α в диабетической печени постояннохрупкие3, а хрупкие частицы α разлагаются гораздо быстрее, чем стабильные частицы α4. Таким образом, структурная хрупкость гликогена может усугубить гипергликемические состояния при диабете 2,4, что делает хрупкие α-частицы потенциальным патологическим биомаркером диабета на молекулярном уровне. Тем не менее, о существовании частиц гликогена α у прокариотсообщается лишь эпизодически5, и нет никаких сообщений о двух различных структурных состояниях частиц гликогена α у бактерий.
Для того чтобы понять физиологические функции частиц бактериального гликогена, необходимо определить тонкую структуру молекул гликогена, что требует выделения гликогена с максимальным выходом и минимальной деградацией. До сих пор были разработаны различные методы экстракции гликогеном, включая, помимо прочего, экстракцию горячей водой, экстракцию трихлоруксусной кислотой (ТСА) и экстракцию горячей щелочью (гидроксид калия, KOH)6. Кроме того, сообщалось о другом методе, который обычно используется для выделения эукариотического гликогена, методе ультрацентрифугирования с градиентом плотности сахара (SDGU), для выделения бактериального гликогена у Selenomonas ruminantium и Fibrobacter succinogenes 7,8. Несмотря на то, что плюсы и минусы этих методов широко обсуждались в исследованиях эукариот 9,10, редко проводятся сравнительные исследования тонких структур гликогена, выделенных различными методами экстракции у бактерий с точки зрения структур гликогеновых частиц.
В данном исследовании этот вопрос был решен с использованием Escherichia coli BL21 (DE3) в качестве модельного организма. В общей сложности сравнивались четыре метода экстракции гликогеном, а именно: экстракция горячей водой с осаждением ТСА (TCA-HW), экстракция холодной водой с осаждением TCA (TCA-CW), экстракция горячим 30% раствором KOH (KOH-HW) и экстракция холодной водой с использованием ультрацентрифугирования с градиентом плотности сахарозы (SDGU-CW). Распределение частиц гликогена по размерам затем измеряли с помощью эксклюзионной хроматографии (SEC), а распределение длины цепи определяли с помощью флуорофорного электрофореза углеводов (FACE), оба из которых использовались для оценки качества методов экстракции. Кроме того, стабильность и хрупкость частиц бактериального гликогена α также сравнивались между различными методами экстракции путем сравнения распределения частиц по размерам до и после обработки широко используемым хаотропным агентом, диметилсульфоксидом (ДМСО). Подробные процедуры экстракции гликогена и определения структурных характеристик представлены ниже. Таким образом, метод SDGU-CW имеет наилучший общий эффект с точки зрения структурной целостности гликогена и, следовательно, рекомендуется для экстракции бактериального гликогена в будущих соответствующих исследованиях.
протокол
1. Культивирование и сбор бактерий
- Реанимируйте E. coli BL21(DE3) из бактериального глицеринового сырья (-80 °C) путем инокуляции стерильной агаровой пластины LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl и 15 г/л агара). Поместите планшет в стандартный инкубатор и выращивайте в течение ночи при температуре 37 °C.
- Соберите одну колонию и введите ее в стерильную жидкую среду объемом 10 мл (10 г/л триптона, 5 г/л дрожжевого экстракта и 10 г/л NaCl). Хорошо перемешайте с помощью вортексинга и культуры в течение ночи при 37 °C с встряхиванием при 220 об/мин.
ПРИМЕЧАНИЕ: Если не указано иное, все условия жидкого культивирования составляли 37 °C со скоростью встряхивания 220 об/мин. - Перенесите 1 мл культуры кишечной палочки на ночь в 100 мл стерильной жидкой среды LB и закваливайте культуру на 5 ч. Переведите 50 мл в 1 л 1x M9 минимальной среды (3 г/л KH2PO4, 0,5 г/л NaCl, 6,78 г/л Na2HPO4 и 1 г/л NH4Cl), содержащей 0,8% D-(+)-глюкозы. Хорошо перемешиваем, и заквашиваем в течение 20 ч.
ПРИМЕЧАНИЕ: 1x M9 минимальная среда и глюкоза были стерилизованы отдельно, а затем перемешаны при асептическом охлаждении до комнатной температуры. - После культивирования в течение 20 ч центрифугирует бактериальный раствор при 6 000 x g в течение 15 мин при 4 °C. Выбросьте надосадочную жидкость. Храните гранулы в ячейках при температуре -80 °C в течение ночи, а затем сублимационно высушите гранулы.
- Закройте и храните лиофилизированный бактериальный порошок в холодильнике (-20 °C) для последующего использования.
2. Экстракция гликогена
- Экстракция горячей водой с осаждением трихлоруксусной кислоты (TCA-HW)
- Точно взвесьте 500 мг лиофилизированного порошка E. coli BL21 (DE3) и ресуспендируйте его в 20 мл ледяного 0,05 М триэтаноламина. Используйте ультразвуковую клеточную дробилку (энергия 25%, 4 °C) для разрушения бактериальных клеток в течение 3 минут (рабочие циклы 30 с и интервалы 2 с). Следите за тем, чтобы в растворе не было явных гранул.
ПРИМЕЧАНИЕ: Разрушение клеток проводилось на льду. Отрегулируйте pH буфера TEA до pH 7 путем добавления HCl и храните при комнатной температуре. - Переложите весь бактериальный гомогенат в две ультрацентрифужные пробирки объемом 10,4 мл (10 мл/пробирка). Наполните пробирки деионизированной водой доверху и центрифугируйте при давлении 104 000 x g в ультрацентрифуге при температуре 4 °C в течение 90 минут. Выбросьте надосадочную жидкость.
- Добавьте 2 мл деионизированной воды, чтобы повторно суспендировать гранулу в каждой пробирке. Перенесите суспензию в центрифужную пробирку объемом 50 мл и добавьте деионизированную воду до конечного объема 20 мл. Нагрейте и варите 5 минут, чтобы денатурировать все белки.
- Центрифугируйте суспензию в течение 10 мин при давлении 18 000 x g и удерживайте надосадочную жидкость (S1). Обрабатывайте осадок так же, как и в пункте 2.1.3. Объедините новую надосадочную жидкость (S2) с S1.
- Добавьте 50% ТСА (0,1 объема) в надосадочную жидкость (S1+S2) и поместите смесь на лед на 10 минут для осаждения макромолекул, таких как ДНК, РНК, белки и т. д. Центрифугируйте смесь при давлении 18 000 x g в течение 10 мин и смешайте надосадочную жидкость с 1,5 объемом абсолютного этанола.
ПРИМЕЧАНИЕ: Концентрация ТСА составляет 50% v/v. Для хранения держите его вдали от света. - Осаждать гликоген на льду в течение 20 минут и центрифугировать при давлении 18 000 x g в течение 10 минут. Вылейте надосадочную жидкость.
- Растворите гранулу в 5 мл ddH2O, а затем добавьте 5 мл ледяного абсолютного этанола. Инкубируйте раствор в течение ночи при 4 °C и центрифугируйте при 18 000 x g в течение 10 минут. Выбросьте надосадочную жидкость и оставьте гранулы.
- Повторите шаги «промывка и осаждение», как в пункте 2.1.7, еще два раза.
- Наконец, растворите осажденный гликоген в 400 мкл ddH2O в пробирке объемом 2 мл, предварительно заморозьте при -80 °C и обсушите для получения сухого порошка гликогена.
- Точно взвесьте 500 мг лиофилизированного порошка E. coli BL21 (DE3) и ресуспендируйте его в 20 мл ледяного 0,05 М триэтаноламина. Используйте ультразвуковую клеточную дробилку (энергия 25%, 4 °C) для разрушения бактериальных клеток в течение 3 минут (рабочие циклы 30 с и интервалы 2 с). Следите за тем, чтобы в растворе не было явных гранул.
- Экстракция холодной водой с осаждением трихлоруксусной кислоты (TCA-CW)
Примечание: Метод TCA-CW аналогичен методу TCA-HW, за исключением того, что после удаления надосадочной жидкости обрабатывают гранулу без кипячения (см. шаг 2.1.3) и повторно суспендируют ее в 20 мл ddH2O, содержащем коктейль ингибиторов протеазы 1 мг/мл.- Для приготовления коктейля ингибитора протеазы 1 мг/мл растворить 50 мг коктейля ингибитора протеазы в 1 мл деионизированной воды и развести в соотношении 50:1 (раствор коктейля деионизированная вода: ингибитор протеазы).
- Экстракция холодной водой с использованием ультрацентрифугирования с градиентом плотности сахарозы (SDGU-CW)
- Растворите и гомогенизируйте 1 г лиофилизированного порошка кишечной палочки в 4 мл буфера для экстракции гликогена (GEB) с коктейлем ингибиторов протеазы 1 мг/мл.
ПРИМЕЧАНИЕ: GEB состоит из 50 мМ Tris, 150 мМ NaCl, 2 мМ ЭДТА, 50 мМ NaF и 5 мМ пирофосфата натрия. GEB необходимо отрегулировать до pH 8 с помощью HCl. - Используйте ультразвуковую клеточную дробилку (энергия 25%, 4 °C) для разрушения бактериальных клеток в течение 3 минут (рабочие циклы 8 с и интервалы 9 с). Следите за тем, чтобы весь процесс проводился на льду. После сонификации перенесите бактериальный гомогенат в центрифужную пробирку, заполните ее GEB до конечного объема 10 мл и перемешайте пробирку для перемешивания.
ПРИМЕЧАНИЕ: Не гомогенизируйте слишком долго, так как выделяемое тепло может привести к ухудшению гликогена. - Центрифуга при 6 000 x g в течение 10 мин при 4 °C. Перенесите надосадочную жидкость в ультрацентрифужную пробирку объемом 10,4 мл, заполните пробирку доверху GEB, а затем центрифугируйте при 360 000 x g в течение 2 ч при 4 °C.
ПРИМЕЧАНИЕ: Убедитесь, что трубка заполнена и в ней нет пузырьков воздуха. - После центрифугирования выбросьте надосадочную жидкость и повторно суспендируйте осадок с 2 мл деионизированной воды.
- В новую ультрацентрифужную пробирку медленно нанесите 4 мл 75% раствора сахарозы с 4 мл 37,5% раствора сахарозы. Затем сверху раствор сахарозы насыпьте полученную на шаге 2.3.4 суспензию, а затем долейте деионизированную воду (см. рисунок 1).
ПРИМЕЧАНИЕ: Концентрация сахарозы составляет 75% [v/v] и 37,5% [v/v]. Будьте осторожны при создании градиента плотности сахарозы и убедитесь, что между двумя растворами сахарозы есть заметное наслоение. Также следите за тем, чтобы в ультрацентрифужной пробирке не было пузырьков воздуха. - Центрифугируйте при 360 000 x g в течение 2,5 ч при 4 °C и выбросьте надосадочную жидкость. Растворите гранулу в 200 μл деионизированной воды. Добавьте 800 мкл абсолютного этанола для осаждения гликогена.
- Осадите гликоген до -20 °C в течение ночи. Центрифугируйте при давлении 4 000 x g в течение 10 минут при 4 °C и выбросьте надосадочную жидкость.
- Растворите полученную гранулу в 400 мкл ddH2O в пробирке объемом 2 мл, предварительно заморозьте при -80 °C и обсушите для получения сухого порошка гликогена. Сухой порошок гликогена хранить при температуре 4 °C для структурного анализа.
ПРИМЕЧАНИЕ: Подробная процедура показана на рисунке 1.
- Растворите и гомогенизируйте 1 г лиофилизированного порошка кишечной палочки в 4 мл буфера для экстракции гликогена (GEB) с коктейлем ингибиторов протеазы 1 мг/мл.
- Экстракция горячим 30% раствором гидроксида калия (KOH-HW)
- Кипятить лиофилизированный порошок кишечной палочки (50 мг) в 1 мл 30% [w/v] KOH в течение 1 ч.
- Добавьте 67% [v/v] этанола, содержащего 15 мМ LiCl, для осаждения при температуре -20 °C в течение не менее 1 ч. Центрифугируйте образцы при давлении 16 000 x g при 4 °C в течение 20 минут.
ПРИМЕЧАНИЕ: 67% [v/v] этанола с 15 мМ LiCl содержит 0,6358 г LiCl, 67 мл абсолютного этанола и 33 мл деионизированной воды. - Растворите гранулы в 1 мл ddH2O и нагревайте в течение 10 минут при температуре 95 °C с прерывистым перемешиванием.
- Повторите этап осаждения этанола еще три раза, как описано в пункте 2.4.2. Растворите конечную гранулу в 400 мкл ddH2O в пробирке объемом 2 мл, предварительно заморозьте при -80 °C и обсушите для получения сухого порошка гликогена.
3. Определение структуры гликогена
- Просвечивающая электронная микроскопия (ПЭМ)
- Ресуспендируйте порошок гликогена в 50 мМ трис-буферизованном физрастворе (pH 7) с конечной концентрацией 1 мг/мл.
- Сделайте 10-кратное разбавление суспензии и нанесите разведенную суспензию на тлеющую медную сетку 400 меш.
- Через 2 минуты снимите лишний образец с сетки с помощью фильтровальной бумаги и окрасьте сетку 2-3 каплями 1% уранилацетата.
- Используйте просвечивающий электронный микроскоп, работающий на напряжении 75 кВ, для исследования препаратов.
- Эксклюзионная хроматография (SEC)
- Приготовление подвижной фазы: в деионизированной воде готовят 0,02% (масс./масса) растворы азида натрия и 50 мМ нитрата натрия и фильтруют через фильтрующую мембрану толщиной 0,45 мкм. Используйте ультразвуковую осциллирующую водяную баню для ультразвуковой обработки раствора в течение более 15 минут, чтобы удалить пузырьки воздуха.
- Подготовка образца: Используйте подвижную фазу для растворения порошка гликогена так, чтобы конечная концентрация составила 1 мг/мл. Инкубируйте раствор при температуре 80 °C в течение ночи в термомиксере. Центрифугируйте растворенный образец при давлении 6 000 x g в течение 10 минут при комнатной температуре и перенесите надосадочную жидкость в стандартный флакон SEC.
- Подготовка образцов гликогена, обработанных ДМСО
- Растворите 1 мг порошка гликогена в 300 мкл ДМСО и инкубируйте при 80 °C в течение ночи в термомиксере. Добавьте 4-кратный объем этанола для осаждения гликогена и центрифугируйте раствор при 6000 x г.
- Дважды промойте гранулу с этанолом, растворите гранулу в ddH2O и лиофилизируйте.
- Проанализируйте лиофилизированный порошок гликогена с помощью SEC, подготовив образцы, как описано выше.
- Используйте систему SEC с предколонками, а также 1000 и 10000 колонок для анализа распределения частиц гликогена по размерам. Поддерживайте температуру в колоннах при температуре 80 °C и скорость потока 0,3 мл/мин.
- Флуорофор-ассистированный углеводный электрофорез (FACE)
- Удаление гликогена
ПРИМЕЧАНИЕ: При использовании FACE для определения распределения длины цепи (CLD) все исследуемые образцы должны пройти предварительную обработку от ветвления.- Добавьте в пробирку 0,5 мг порошка гликогена, 90 мкл горячей воды (90 °C), 1,5 мкл раствора NaN3 , 3,5 мкл изоамилазы (200 Ед/мл) и 8 мкл буфера уксусной кислоты и ацетата натрия (pH 3,5).
ПРИМЕЧАНИЕ: Изоамилаза добавляется для того, чтобы специально разрезать разветвленную цепь исследуемого образца. Изоамилаза является ферментом, разрушающим ветвление, который может специфически разрушать связь α-(1-6) без разрушения связи α-(1-4), поэтому он может специфически расщеплять боковую цепь гликогена, не разрушая структуру основной цепи. - Выдержать смесь при температуре 37 °C в течение 3 ч в термомиксере. После получения нейтрального pH с 8 мкл 0,1 М раствора NaOH инкубируйте смесь при 80 °C в течение 1 ч в термомиксере.
- Добавьте в смесь в 4 раза больше абсолютного этанола, чтобы осадить гликоген. Затем центрифугируйте при 6 000 x g в течение 10 минут при комнатной температуре. Дважды промойте гранулу этанолом, растворите гранулу в ddH2O и лиофилизируйте.
- Добавьте в пробирку 0,5 мг порошка гликогена, 90 мкл горячей воды (90 °C), 1,5 мкл раствора NaN3 , 3,5 мкл изоамилазы (200 Ед/мл) и 8 мкл буфера уксусной кислоты и ацетата натрия (pH 3,5).
- Приготовление флуоресцентного раствора
- Центрифугируйте флакон с реагентом APTS (8-аминопирен-1,3,6-трисульфоновая кислота тринатриевая соль) (каждый флакон содержит 5 мг APTS) при 4 000 x g в течение 2 минут. Добавьте 50 μL 15% раствора уксусной кислоты для растворения порошка, хорошо перемешайте и центрифугируйте при 4000 x g в течение 2 минут при комнатной температуре до получения 0,2 М раствора уксусной кислоты APTS.
ПРИМЕЧАНИЕ: Хранить раствор APTS в холодильнике при температуре -20 °C.It необходимо полностью использовать в течение двух недель после открытия. В противном случае он будет деактивирован. APTS — это обычно используемый отрицательно заряженный краситель, который связывается с восстанавливающим концом гликогеновой цепи. Поскольку все цепи с разной степенью полимеризации (DP) несут только один отрицательный заряд, FACE может разделить их на основе их разного соотношения массы к заряду. Таким образом, флуоресцентный детектор обнаруживает сигналы различных значений DP.
- Центрифугируйте флакон с реагентом APTS (8-аминопирен-1,3,6-трисульфоновая кислота тринатриевая соль) (каждый флакон содержит 5 мг APTS) при 4 000 x g в течение 2 минут. Добавьте 50 μL 15% раствора уксусной кислоты для растворения порошка, хорошо перемешайте и центрифугируйте при 4000 x g в течение 2 минут при комнатной температуре до получения 0,2 М раствора уксусной кислоты APTS.
- Перенесите очищенный гликоген в пробирку и добавьте 1,5 мкл раствора APTS и 1,5 мкл раствора цианоборогидрида натрия. Инкубировать при температуре 60 °C в течение 1,5 ч в темноте. Добавьте 80 μL деионизированной воды, центрифугируйте при 4 000 x g в течение 10 минут при комнатной температуре и держите надосадочную жидкость.
- Введите образец в систему капиллярного электрофореза путем инжекции в течение 3 с при давлении 0,5 фунта на квадратный дюйм (на 3,4 кПа выше атмосферного давления).
Примечание: Флуоресцентно меченые линейные глюканы разделяли с помощью приложенного напряжения 30 кВ и приблизительного тока 14 мА при 25 °C. Участки вершин давали относительные количества глюканов с разной массой (степень полимеризации (ДП) глюканов в соседних пиках отличалась на 1 ДП). Температуру образца поддерживали на уровне 18 °C.
- Удаление гликогена
Результаты
Распределение частиц гликогена по размерам
Ряд исследований показал, что частицы гликогена α печени при диабете хрупкие и легко расщепляются в разрушителе водородных связей ДМСО 11,12,13,14. В настоящем исследовании проверялось, как изменяются размер частиц и структурная стабильность бактериального гликогена, экстрагированного четырьмя различными методами. Все образцы гликогена, полученные с помощью четырех методов, были обработаны водой (синие кривые) и ДМСО (красные кривые) соответственно. Распределение веса, w(logRh), приведено на рисунке 2. В обработанном водой гликогене, экстрагированном с помощью TCA-HW (рис. 2A, синие кривые) и TCA-CW (рис. 2B, синие кривые), преобладают более мелкие частицы с пиками на Rh ~ 20 нм. С другой стороны, обработанный водой гликоген, экстрагированный с помощью KOH-HW (рис. 2C, синие кривые) и SDGU-CW (рис. 2D, синие кривые), имеет более крупные размеры частиц с пиками на Rh ~ 40 нм, что указывает на присутствие частиц гликогена α в бактериях. В то время как оба метода KOH-HW и SDGU-CW извлекают α частицы гликогена, методы TCA-HW и TCA-CW либо разлагают более крупные частицы α до β частиц, либо извлекают только более мелкие β частицы.
С точки зрения стабильности и хрупкости гликогена, обработка ДМСО не изменяла распределение массы частиц гликогена, экстрагированных с помощью TCA-HW (рис. 2A, красные кривые), TCA-CW (рис. 2B, красные кривые) и KOH-HW (рис. 2C, красные кривые). Однако гликоген, экстрагированный методом KOH-HW, в основном состоял из стабильных α частиц, в то время как методы TCA в основном генерировались β частицами. Что касается гликогена, выделенного из SDGU-CW, то после обработки ДМСО наблюдалось значительное изменение составов α и β частиц. Из рисунка 2D можно сделать вывод, что часть α частиц (синие кривые) разложилась на β частицы (красные кривые), что привело к наблюдаемой области плато и тем самым позволяет предположить сосуществование как стабильных, так и хрупких α частиц в бактериальном гликогене.
Для подтверждения морфологических структур частиц гликогена, экстрагированных из SDGU-CW, репрезентативные ПЭМ-изображения гликогена представлены на рисунке 3. Морфология частиц гликогена в сыром состоянии из E. coli аналогична таковой в печени здоровой мыши15, демонстрируя присутствие розетообразных частиц α и небольшого количества частиц β, что подтверждает, что частицы гликогена α могут быть экстрагированы из E. coli с помощью мягких методов экстракции.
Распределение длины цепи
Распределение длины цепи (CLD) частиц гликогена, измеренное с помощью FACE, показано на рисунке 4. Средняя длина цепи (ACL) является обратной величиной процента ветвления и может быть рассчитана по формуле Σ (процент DP x количество DP). Согласно полученным результатам, гликоген из SDGU-CW (рис. 4D) и TCA-CW (рис. 4B) имел самые высокие ACL (~14 DP), что указывает на то, что экстракция CW имела наименьшее повреждение CLD. Для гликогена, экстрагированного TCA-HW, цепи были частично разрушены из-за короткой стадии кипячения, о чем свидетельствует небольшое снижение ПКС (рис. 4A). Наконец, CLD для гликогена из KOH-HW сместилась в сторону меньших значений DP, а ACL уменьшилась более чем на 2 DP (рис. 4C), что указывает на то, что кипячение в сильно щелочной среде может повредить первичную структуру частиц гликогена.

Рисунок 1: Схематическая иллюстрация экстракции бактериального гликогена методом SDGU-CW. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Распределение массы SEC [w(log Rh) (a.u)] для частиц гликогена E. coli BL21(DE3), экстрагированных четырьмя методами. (A) TCA-HW, (B) TCA-CW, (C) KOH-HW и (D) SDGU-CW. Кривые распределения по размерам показаны для частиц гликогена, обработанных водой (синий цвет) и ДМСО (красный цвет). Все анализы SEC были выполнены в двух экземплярах. W1: дубликат 1 обработать водой. D1: дубликат 1, обработанный ДМСО. W2: дубликат 2 обработать водой. D2: дубликат 2, обработанный ДМСО. Этот рисунок был воспроизведен из ссылки 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
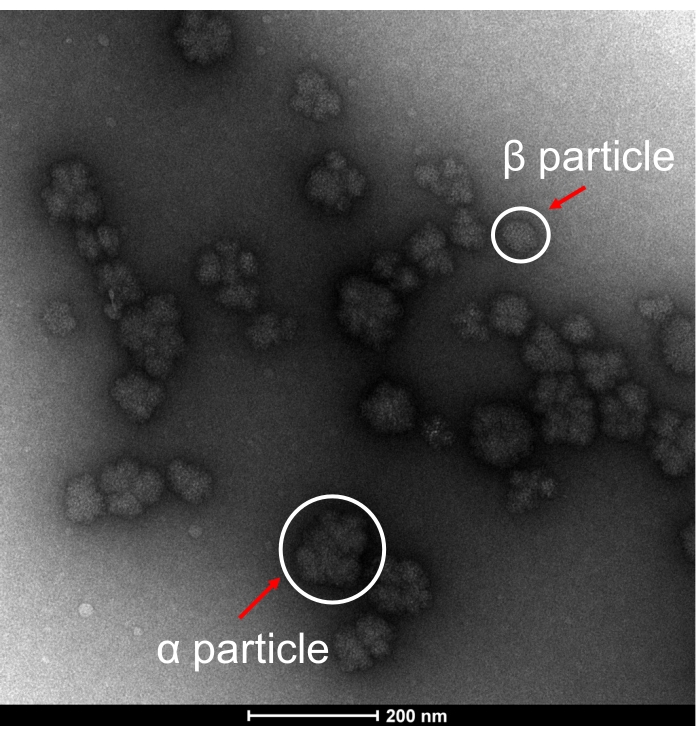
Рисунок 3: Репрезентативное изображение ПЭМ. ПЭМ-изображение частиц бактериального α гликогена и частиц β гликогена, экстрагированных путем экстракции холодной водой методом ультрацентрифугирования с градиентом плотности сахарозы (SDGU-CW). Репрезентативные частицы обозначены красными стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Распределение длины цепи и средняя длина цепи гликогена E. coli , экстрагированного четырьмя различными методами. (A) TCA-HW, (B) TCA-CW, (C) KOH-HW и (D) SDGU-CW. Для каждого метода было выполнено три независимых извлечения и представлены средние распределения длины цепи, а также стандартные средние погрешности. Этот рисунок был адаптирован из данных, опубликованных в ссылке 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Гликоген является важным энергетическим резервом, который был идентифицирован у многих бактерий16. Чтобы проанализировать физиологические функции частиц гликогена, важно лучше понимать тонкую структуру молекул гликогена. На сегодняшний день разработано множество методов извлечения гликогена из бактериальной культуры. Тем не менее, при разных методах экстракции наблюдалось различное распределение частиц гликогена по размерам, что предполагает повреждение структуры гликогена. Таким образом, необходимо сравнивать и стандартизировать процедуры экстракции, чтобы убедиться в сопоставимости структур гликогена из разных исследований. В данном исследовании представлен подробный протокол, описывающий четыре широко используемых метода экстракции гликогена из жидкой культуры E. coli , которые затем оцениваются с помощью структурных характеристик частиц гликогена.
Что касается распределения по размерам, то частицы гликогена как из TCA-CW, так и из TCA-HW демонстрируют распределение веса в сторону частиц меньшего размера с пиками при Rh ≈ 20 нм (β частиц). Таким образом, эти два метода не подходят для извлечения частиц гликогена для определения структурных характеристик. На самом деле, это может быть одной из причин, почему считалось, что в бактериях существует только β частиц, поскольку методы ТСА широко использовались для изучения бактериального гликогена. С другой стороны, частицы гликогена, полученные методами KOH-HW и SDGU-CW, имеют преимущественно более крупные размеры частиц с самыми высокими пиками при Rh ≈ 40 нм (α частиц). Таким образом, методы KOH-HW и SDGU-CW лучше, чем методы TCA-CW и TCA-HW. Однако, поскольку с помощью метода KOH-HW можно извлечь только стабильные α частицы, это указывает на то, что хрупкие α частицы разрушаются из-за суровых условий, используемых в этом методе.
С точки зрения распределения длины цепи (CLD), гликоген из SDGU-CW и TCA-CW имеет более длинные цепи, что подтверждает, что экстракция холодной водой приводит к минимальному повреждению CLD. Длина цепи частиц гликогена, экстрагированных с помощью TCA-HW, была частично уменьшена из-за короткой стадии кипячения в процедуре экстракции, что привело к уменьшению средней длины цепи (ACL). При использовании метода KOH-HW CLD выявляет более короткие цепи гликогена, а ACL уменьшается более чем на 2 DP из-за длительного кипячения в щелочных растворах. Таким образом, на основе этого первичного анализа структуры частиц гликогена подтверждается, что экстракция холодной водой, будучи намного мягче, чем экстракция горячей водой, может экстрагировать частицы гликогена с более длинными цепями и, следовательно, меньшей деградацией.
Таким образом, минимальная деградация имеет важное значение для изучения свойств нативного гликогена. Минимальная деградация частиц гликогена проявляется в тех случаях, когда анализ распределения по размерам показывает более крупные молекулы, а распределение по длине цепи показывает наибольшее число более длинных цепей. Поскольку экстракция холодной водой с помощью ультрацентрифугирования с градиентом плотности сахарозы достигает наилучшего общего эффекта с точки зрения структурной целостности гликогена, этот метод рекомендуется для экстракции бактериального гликогена в будущих соответствующих исследованиях.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы очень благодарны профессору Роберту Г. Гилберту из Университета Квинсленда и Университета Янчжоу, который поделился своими знаниями и опытом, которые в значительной степени помогли завершить это исследование. Мы выражаем признательность за финансовую поддержку Национальному фонду естественных наук Китая (No 31900022, No 32171281), Фонду естественных наук провинции Цзянсу (No . BK20180997), Молодежная команда по инновациям в области науки и техники Медицинского университета Сюйчжоу (No. TD202001) и проект Цзянсу Цинлань (2020).
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Agilent 1260 infinity SEC system | Agilent | 1260 infinity II | Particle size distribution |
| Analytical column | PSS | 10-1000 | - |
| Centrifuge | Eppendorf | 5420 | - |
| Filter membrane | Cambio | Km-0220 | - |
| Fluorescence-assisted capillary electrophoresis system | Beckman Coulter | - | Chain length distribution |
| Freeze dryer | Xinzhi | SCIENTZ-10N | Lyophilization of bacteria and glycogen |
| Freezer | Thermo Fisher | Forma 900 | Sample storage |
| Guard column | PSS | SUPPERMA | - |
| Incubator | Thermo Fisher | PR505750R-CN | - |
| Low-speed large-capacity centrifuge | Hexi | HR/T20MM | Sample centrifugation |
| Multiskan FC microplate reader | Thermo Fisher | 1410101 | - |
| Optima XPN ultracentrifuge | Beckman | XPN-100/90/80 | For glycogen |
| Oscillator | Xinbao | SHZ-82 | - |
| PA-800 Plus System | Beckman Coulter | A66528 | - |
| pH meter | Mettler Toledo | FE28 -TRIS | - |
| Refractive index detector | Wyatt | Optilab T-rEX | - |
| Refrigerator | Haier | BCD-406WDPD | - |
| Thermomixer | Shanghai Jingxin | JXH-100 | Sample incubation |
| Transmission electron microscope | Hitachi Corporation | H-7000 | Glycogen particle morphology |
| Ultracentrifuge tube | Beckman | 355651 | - |
| Ultrasonic cell crusher | Ningbo Xinzhi | Scientz-IID | Bacteria disruptor |
| Ultrasonic oscillating water bath | Jietuo | JT-1027HTD | - |
| Vortex mixer | Tiangen | OSE-VX-01 | - |
| Water system | Merck Millipore | H2O-MM-UV-T | Deionized water |
| Material | |||
| 8-Aminopyrene-1,3,6-Trisulfonic Acid Trisodium Salt | Sigma-Aldrich | 196504-57-1 | - |
| Absolute ethanol | Guoyao | 10009228 | - |
| Agar powder | Solarbio | A1890 | - |
| Alpha-amylase | Megazyme | E-BLAAM-40ML | - |
| Amyloglucosidase | Megazyme | E-AMGDF-40ML | - |
| cOmplete Mini | Roche | 4693159001 | - |
| D-(+)Glucose | Sigma-Aldrich | G8270-1kg | - |
| D-Glucose Assay Kit (GOPOD Format) | Megazyme | K-GLUC | Glycogen quantification |
| Dimethyl sulfoxide | Vicmed | Vic147 | Chaotropic agent |
| E. coli BL21(DE3) | Tiangen | CB105-02 | - |
| Ethylene diamine tetra-acetic acid | Vicmed | Vic1488 | - |
| Glacial acetic acid | Guoyao | 10000218 | - |
| Glycerol | Guoyao | 10010618 | Bacterial storage |
| Hydrochloric acid | Guoyao | 10011008 | - |
| Hydroxymethyl aminomethane | Sigma-Aldrich | V900483-500g | - |
| Isoamylase | MegaZyme | 9067-73-6 | Glycogen debranch |
| Lithium chloride | Sigma-Aldrich | 62476-100g | - |
| M9, Minimal Salts, 5× | Sigma-Aldrich | M6030-1kg | Bacterial culture |
| Potassium hydroxide | Guoyao | 10017008 | - |
| Pullulan standard | PSS | - | - |
| Sodium acetate trihydrate | Guoyao | 10018718 | - |
| Sodium azide | Sigma-Aldrich | 26628-22-8 | - |
| Sodium chloride | Guoyao | 10019318 | Bacterial culture |
| Sodium cyanoborohydride | Huaweiruike | hws001297 | - |
| Sodium diphosphate | Sigma-Aldrich | 71515-250g | - |
| Sodium Fluoride | Macklin | S817988-250g | - |
| Sodium hydroxide | Guoyao | 10019762 | - |
| Sodium nitrate | Guoyao | 10019928 | - |
| Sodium pyrophosphate | Sigma-Aldrich | V900195-500g | - |
| Sucrose | Guoyao | 10021463 | - |
| Trichloroacetic acid | Guoyao | 40091961 | - |
| Tryptone | Oxoid | LP0042 | Bacterial culture |
| Yeast Extract | Oxoid | LP0021 | Bacterial culture |
Ссылки
- Wang, L., et al. Molecular structure of glycogen in Escherichia coli. Biomacromolecules. 20 (7), 2821-2829 (2019).
- Deng, B., et al. Molecular structure of glycogen in diabetic liver. Glycoconjugate Journal. 32 (3-4), 113-118 (2015).
- Hu, Z., et al. Diurnal changes of glycogen molecular structure in healthy and diabetic mice. Carbohydrate Polymers. 185, 145-152 (2018).
- Nawaz, A., Zhang, P., Li, E., Gilbert, R. G., Sullivan, M. A. The importance of glycogen molecular structure for blood glucose control. iScience. 24 (1), 101953(2021).
- Rashid, A. M., et al. Assembly of α-glucan by GlgE and GlgB in mycobacteria and streptomycetes. Biochemistry. 55 (23), 3270-3284 (2016).
- Wang, L., et al. Recent progress in the structure of glycogen serving as a durable energy reserve in bacteria. World Journal of Microbiology and Biotechnology. 36 (1), 14(2020).
- Kamio, Y., Terawaki, Y., Nakajima, T., Matsuda, K. Structure of glycogen produced by Selenomonas ruminantium. Agricultural and Biological Chemistry. 45 (1), 209-216 (1981).
- Gong, J., Forsberg, C. W. Separation of outer and cytoplasmic membranes of Fibrobacter succinogenes and membrane and glycogen granule locations of glycanases and cellobiase. Journal of Bacteriology. 175 (21), 6810-6821 (1993).
- Mojibi, N. Comparison of methods to assay liver glycogen fractions: the effects of starvation. Journal of Clinical and Diagnostic Research. 11 (3), (2017).
- Orrell, S. A., Bueding, E. A comparison of products obtained by various procedures used for the extraction of glycogen. The Journal of Biological Chemistry. 239, 4021-4026 (1964).
- Tan, X., et al. Proteomic investigation of the binding agent between liver glycogen beta particles. ACS Omega. 3 (4), 3640-3645 (2018).
- Hu, Z., et al. Diurnal changes of glycogen molecular structure in healthy and diabetic mice. Carbohydrate Polymers. 185, 145-152 (2018).
- Sullivan, M. A., Harcourt, B. E., Xu, P., Forbes, J. M., Gilbert, R. G. Impairment of liver glycogen storage in the db/db animal model of type 2 diabetes: a potential target for future therapeutics. Current Drug Targets. 16 (10), 1088-1093 (2015).
- Deng, B., et al. Molecular structure of glycogen in diabetic liver. Glycoconjugate Journal. 32 (3-4), 113-118 (2015).
- Sullivan, M. A., et al. Molecular structural differences between type-2-diabetic and healthy glycogen. Biomacromolecules. 12 (6), 1983-1986 (2011).
- Wang, L., et al. Systematic analysis of metabolic pathway distributions of bacterial energy reserves. G3 Genes|Genomes|Genetics. 9 (8), 2489-2496 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены