Method Article
Méthode d’extraction non dégradative pour la caractérisation de la structure moléculaire de particules de glycogène bactérien
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La structure du glycogène bactérien est grandement influencée par les méthodes d’extraction, ce qui peut entraîner une dégradation moléculaire et/ou un échantillonnage biaisé. Il est essentiel de développer des méthodes pour minimiser ces problèmes. Ici, quatre méthodes d’extraction ont été comparées en utilisant la distribution de taille et la distribution de longueur de chaîne comme critères clés pour minimiser les artefacts d’extraction.
Résumé
À l’heure actuelle, il existe une variété de méthodes d’extraction du glycogène, qui endommagent la structure spatiale du glycogène ou n’extraient que partiellement le glycogène, ce qui conduit à une caractérisation biaisée de la structure moléculaire fine du glycogène. Pour comprendre les changements dynamiques des structures du glycogène et les fonctions polyvalentes des particules de glycogène dans les bactéries, il est essentiel d’isoler le glycogène avec une dégradation minimale. Dans cette étude, une méthode d’isolement du glycogène doux est démontrée en utilisant la précipitation d’eau froide (CW) via l’ultra-centrifugation du gradient de densité de sucre (SDGU-CW). La méthode traditionnelle à l’acide trichloracétique (TCA) et la méthode à l’hydroxyde de potassium (KOH) ont également été effectuées à des fins de comparaison. Une souche de laboratoire couramment utilisée, Escherichia coli BL21(DE3), a été utilisée comme organisme modèle dans cette étude à des fins de démonstration. Après avoir extrait des particules de glycogène à l’aide de différentes méthodes, leurs structures ont été analysées et comparées par chromatographie d’exclusion stérique (SEC) pour la distribution granulométrique des particules et par électrophorèse capillaire assistée par fluorophore (FACE) pour les distributions de longueur de chaîne linéaire. L’analyse a confirmé que le glycogène extrait via SDGU-CW présentait une dégradation minimale.
Introduction
Le glycogène est un polysaccharide très ramifié qui se compose de résidus glucosyliques et également d’une quantité petite mais significative de protéines, dans laquelle tous les résidus glucosyles sont liés entre eux par des liaisons α-1,4-glycosidiques en chaînes linéaires et des liaisons α-1,6-glycosidiques aux points de ramification1. La structure des particules de glycogène est généralement divisée en trois hiérarchies : 1) les oligomères à chaîne courte, 2) les particules β sphériques (~20 nm de diamètre) et 3) les grandes particules de α en forme de rosette agrégées par β particules, dont le diamètre varie approximativement jusqu’à 300 nm. Récemment, il a été constaté que les particules de glycogène α ont deux états structurels chez les eucaryotes, c’est-à-dire un état fragile et un état stable. Ici, la fragilité signifie la dissociation de particules de α plus grandes en particules de β plus petites en présence d’un agent chaotrope comme le DMSO2. Des analyses plus approfondies ont révélé que les particules de α de glycogène dans le foie diabétique sont constamment fragiles3 et que les particules α fragiles se dégradent beaucoup plus rapidement que les particules α stables4. Ainsi, la fragilité structurelle du glycogène peut exacerber les états hyperglycémiques dans le diabète 2,4, ce qui fait de la particule α fragile un biomarqueur pathologique potentiel du diabète au niveau moléculaire. Cependant, l’existence de particules de α de glycogène chez les procaryotes n’est signalée que sporadiquement5, et il n’y a pas de rapport sur les deux états structurels différents des particules de glycogène α chez les bactéries.
Afin de comprendre les fonctions physiologiques des particules de glycogène bactérien, il est essentiel de déterminer la structure fine des molécules de glycogène, ce qui nécessite une isolation du glycogène avec un rendement maximal et une dégradation minimale1. Jusqu’à présent, diverses techniques ont été développées pour l’extraction du glycogène, y compris, mais sans s’y limiter, l’extraction à l’eau chaude, l’extraction à l’acide trichloracétique (TCA) et l’extraction alcaline chaude (hydroxyde de potassium, KOH)6. De plus, une autre méthode couramment utilisée pour l’isolement du glycogène eucaryote, la méthode d’ultra-centrifugation par gradient de densité de sucre (SDGU), a également été signalée pour l’isolement du glycogène bactérien chez Selenomonas ruminantium et Fibrobacter succinogenes 7,8. Bien que les avantages et les inconvénients de ces méthodes aient été largement discutés dans les études eucaryotes 9,10, il existe rarement des études comparatives de structures fines de glycogène isolées par différentes méthodes d’extraction chez les bactéries du point de vue des structures des particules de glycogène.
Dans cette étude, cette question a été abordée en utilisant Escherichia coli BL21(DE3) comme organisme modèle. Au total, quatre méthodes d’extraction du glycogène ont été comparées, à savoir l’extraction à l’eau chaude précipitée au TCA (TCA-HW), l’extraction à l’eau froide précipitée au TCA (TCA-CW), l’extraction en solution chaude à 30 % KOH (KOH-HW) et l’extraction à l’eau froide par ultracentrifugation par gradient de densité de saccharose (SDGU-CW). La distribution granulométrique des particules de glycogène a ensuite été mesurée par chromatographie d’exclusion stérique (SEC), tandis que la distribution de la longueur de la chaîne a été détectée par électrophorèse glucidique assistée par fluorophore (FACE), deux méthodes utilisées pour évaluer la qualité des méthodes d’extraction. De plus, la stabilité et la fragilité des particules de glycogène α bactérienne ont également été comparées entre les différentes méthodes d’extraction en comparant la distribution granulométrique avant et après traitement avec l’agent chaotrope couramment utilisé, le diméthylsulfoxyde (DMSO). Les procédures détaillées d’extraction du glycogène et de caractérisation structurale sont présentées ci-dessous. En résumé, la méthode SDGU-CW a le meilleur effet global en termes d’intégrité structurelle du glycogène et est donc recommandée pour l’extraction du glycogène bactérien dans les futures études pertinentes.
Protocole
1. Culture et collecte de bactéries
- Réanimer E. coli BL21(DE3) à partir d’un stock de glycérol bactérien (-80 °C) en inoculant une plaque de gélose LB stérile (10 g/L de tryptone, 5 g/L d’extrait de levure, 10 g/L de NaCl et 15 g/L de gélose). Mettez la plaque dans un incubateur standard et cultivez toute la nuit à 37 °C.
- Prélever une seule colonie et l’inoculer dans un milieu liquide stérile de 10 mL (10 g/L de tryptone, 5 g/L d’extrait de levure et 10 g/L de NaCl). Bien mélanger par vortex et culture pendant la nuit à 37 °C avec agitation à 220 tr/min.
REMARQUE : Sauf indication contraire, toutes les conditions de culture liquide étaient de 37 °C avec un taux d’agitation de 220 tr/min. - Transvaser 1 mL de la culture d’E. coli pendant la nuit dans 100 mL de milieu liquide LB stérile et faire la culture pendant 5 h. Transférer 50 ml dans 1 L de 1x M9 minimal medium (3 g/L KH2PO4, 0,5 g/L de NaCl, 6,78 g/L de Na2HPO4 et 1 g/L de NH4Cl) contenant 0,8 % de D-(+)-glucose. Bien mélanger, et cultiver pendant 20 h.
REMARQUE : 1x M9 minimum et le glucose ont été stérilisés séparément, puis mélangés lors du refroidissement à température ambiante aseptique. - Après 20 h de culture, centrifuger la solution bactérienne à 6 000 x g pendant 15 min à 4 °C. Jetez le surnageant. Conservez la pastille cellulaire à -80 °C pendant la nuit, puis lyophilisez-la.
- Scellez et conservez la poudre bactérienne lyophilisée au réfrigérateur (-20 °C) pour une utilisation ultérieure.
2. Extraction du glycogène
- Extraction à l’eau chaude précipitée à l’acide trichloracétique (TCA-HW)
- Pesez avec précision 500 mg de poudre d’E. coli BL21 (DE3) lyophilisée et mettez-la en suspension dans 20 ml de tampon de triéthanolamine (TEA) 0,05 M glacé. À l’aide d’un broyeur de cellules à ultrasons (25 % d’énergie, 4 °C), perturber les cellules bactériennes pendant 3 min (cycles de travail de 30 s et intervalles de 2 s). Assurez-vous qu’il n’y a pas de granulés évidents dans la solution.
REMARQUE : La rupture cellulaire a été effectuée sur la glace. Ajustez le pH du tampon TEA à pH 7 par ajout de HCl et conservez-le à température ambiante. - Transférez tout l’homogénat bactérien dans deux tubes d’ultracentrifugation de 10,4 mL (10 mL/tube). Remplissez les tubes avec de l’eau désionisée jusqu’en haut, et centrifugez-les à 104 000 x g dans une ultracentrifugeuse à 4 °C pendant 90 min. Jetez le surnageant.
- Ajouter 2 mL d’eau déminéralisée pour remettre la pastille en suspension dans chaque tube. Transférez la suspension dans un tube à centrifuger de 50 mL et ajoutez de l’eau déminéralisée jusqu’à un volume final de 20 mL. Faites chauffer et bouillir pendant 5 min pour dénaturer toutes les protéines.
- Centrifuger la suspension pendant 10 min à 18 000 x g et retenir le surnageant (S1). Traitez le précipité de la même manière qu’à l’étape 2.1.3. Mettez en commun le nouveau surnageant (S2) avec S1.
- Ajouter 50 % de TCA (0,1 volume) au surnageant (S1+S2) et placer le mélange sur de la glace pendant 10 min pour précipiter les macromolécules telles que l’ADN, l’ARN, les protéines, etc. Centrifuger le mélange à 18 000 x g pendant 10 min et mélanger le surnageant avec 1,5 volume d’éthanol absolu.
REMARQUE : La concentration de TCA est de 50 % v/v. Pour le stockage, gardez-le à l’abri de la lumière. - Faites précipiter le glycogène sur de la glace pendant 20 min et centrifugez à 18 000 x g pendant 10 min. Verser le surnageant.
- Dissoudre la pastille dans 5 mL de ddH2O, puis ajouter 5 mL d’éthanol absolu glacé. Incuber la solution pendant la nuit à 4 °C et centrifuger à 18 000 x g pendant 10 min. Jetez le surnageant et conservez la pastille.
- Répétez les étapes « lavage et précipitation » comme à l’étape 2.1.7 deux fois de plus.
- Enfin, dissoudre le glycogène précipité dans 400 μL de ddH2O dans un tube de 2 mL, pré-congeler à -80 °C et lyophiliser pour obtenir de la poudre de glycogène sèche.
- Pesez avec précision 500 mg de poudre d’E. coli BL21 (DE3) lyophilisée et mettez-la en suspension dans 20 ml de tampon de triéthanolamine (TEA) 0,05 M glacé. À l’aide d’un broyeur de cellules à ultrasons (25 % d’énergie, 4 °C), perturber les cellules bactériennes pendant 3 min (cycles de travail de 30 s et intervalles de 2 s). Assurez-vous qu’il n’y a pas de granulés évidents dans la solution.
- Extraction à l’eau froide précipitée par l’acide trichloracétique (TCA-CW)
REMARQUE : La méthode TCA-CW est la même que la méthode TCA-HW, sauf qu’après avoir jeté le surnageant, traiter la pastille sans l’ébullition (voir l’étape 2.1.3) et la remettre en suspension dans 20 mL deddH2O contenant 1 mg/mL de cocktail d’inhibiteurs de protéase.- Pour préparer une solution cocktail d’inhibiteurs de protéase à 1 mg/mL, dissoudre 50 mg de cocktail d’inhibiteurs de protéase dans 1 mL d’eau désionisée et diluer dans un rapport de 50:1 (eau désionisée : solution cocktail d’inhibiteurs de protéase).
- Extraction à l’eau froide par ultracentrifugation par gradient de densité de saccharose (SDGU-CW)
- Dissoudre et homogénéiser 1 g de poudre d’E. coli lyophilisée dans 4 mL de tampon d’extraction de glycogène (GEB) avec un cocktail d’inhibiteurs de protéase de 1 mg/mL.
REMARQUE : Le GEB se compose de 50 mM de Tris, 150 mM de NaCl, 2 mM d’EDTA, 50 mM de NaF et 5 mM de pyrophosphate de sodium. Le GEB doit être ajusté à un pH de 8 avec du HCl. - À l’aide d’un broyeur de cellules à ultrasons (25 % d’énergie, 4 °C), perturber les cellules bactériennes pendant 3 minutes (cycles de travail de 8 s et intervalles de 9 s). Assurez-vous que tout le processus est effectué sur la glace. Après la sonification, transférez l’homogénat bactérien dans un tube à centrifuger, remplissez-le de GEB jusqu’à un volume final de 10 mL et agitez le tube pour mélanger.
REMARQUE : Ne pas homogénéiser trop longtemps car la chaleur générée peut dégrader le glycogène. - Centrifugeuse à 6 000 x g pendant 10 min à 4 °C. Transférez le surnageant dans un tube d’ultracentrifugation de 10,4 mL, remplissez le tube jusqu’en haut avec du GEB, puis centrifugez-le à 360 000 x g pendant 2 h à 4 °C.
REMARQUE : Assurez-vous que le tube est rempli et qu’il n’y a pas de bulles d’air. - Jeter le surnageant après la centrifugation et remettre le précipité en suspension avec 2 mL d’eau désionisée.
- Dans un nouveau tube d’ultracentrifugation, superposer lentement 4 mL de solution de saccharose à 75 % avec 4 mL de solution de saccharose à 37,5 %. Ensuite, superposez la suspension obtenue à l’étape 2.3.4 sur la solution de saccharose et complétez avec de l’eau désionisée (voir figure 1).
REMARQUE : La concentration de saccharose est de 75 % [v/v] et de 37,5 % [v/v]. Soyez prudent lorsque vous faites le gradient de densité du saccharose et assurez-vous qu’il y a une stratification observable entre les deux solutions de saccharose. Assurez-vous également qu’il n’y a pas de bulles d’air dans le tube de l’ultracentrifugeuse. - Centrifuger à 360 000 x g pendant 2,5 h à 4 °C et jeter le surnageant. Dissoudre la pastille dans 200 μL d’eau déminéralisée. Ajouter 800 μL d’éthanol absolu pour la précipitation du glycogène.
- Faites précipiter le glycogène à -20 °C pendant la nuit. Centrifuger à 4 000 x g pendant 10 min à 4 °C et jeter le surnageant.
- Dissoudre la pastille obtenue dans 400 μL de ddH2O dans un tube de 2 mL, pré-congeler à -80 °C et lyophiliser pour obtenir de la poudre de glycogène sèche. Conserver la poudre de glycogène sèche à 4 °C pour l’analyse structurale.
REMARQUE : La procédure détaillée est illustrée à la figure 1.
- Dissoudre et homogénéiser 1 g de poudre d’E. coli lyophilisée dans 4 mL de tampon d’extraction de glycogène (GEB) avec un cocktail d’inhibiteurs de protéase de 1 mg/mL.
- Extraction à chaud d’une solution d’hydroxyde de potassium à 30 % (KOH-HW)
- Faire bouillir de la poudre d’E. coli lyophilisée (50 mg) dans 1 mL de KOH à 30 % [p/v] pendant 1 h.
- Ajouter de l’éthanol à 67 % [v/v] contenant 15 mM de LiCl pour une précipitation à -20 °C pendant au moins 1 h. Centrifuger les échantillons à 16 000 x g à 4 °C pendant 20 min.
REMARQUE : L’éthanol à 67 % [v/v] avec 15 mM de LiCl contient 0,6358 g de LiCl, 67 mL d’éthanol absolu et 33 mL d’eau déminéralisée. - Redissoudre les granulés dans 1 mL de ddH2O et chauffer pendant 10 min à 95 °C avec agitation intermittente.
- Répétez l’étape de précipitation de l’éthanol trois fois de plus, comme décrit à l’étape 2.4.2. Redissoudre la pastille finale dans 400 μL de ddH2O dans un tube de 2 mL, pré-congeler à -80 °C et lyophiliser pour obtenir de la poudre de glycogène sèche.
3. Détermination de la structure du glycogène
- Microscopie électronique à transmission (MET)
- Mettre en suspension la poudre de glycogène dans une solution saline tamponnée au tris de 50 mM (pH 7) avec une concentration finale de 1 mg/mL.
- Effectuez une dilution 10 fois de la suspension et appliquez la suspension diluée sur la grille de cuivre à décharge luminescente de 400 mailles.
- Après 2 min, prélevez l’échantillon excédentaire de la grille à l’aide d’un papier filtre et colorez la grille avec 2-3 gouttes d’acétate d’uranyle à 1 %.
- Utiliser un microscope électronique à transmission fonctionnant à 75 kV pour examiner les préparations.
- Chromatographie d’exclusion stérique (SEC)
- Préparation de la phase mobile : préparer des solutions d’azoture de sodium à 0,02 % (p/p) et de nitrate de sodium à 50 mM dans de l’eau désionisée, et filtrer à travers une membrane filtrante de 0,45 m. Utilisez le bain-marie oscillant à ultrasons pour soniser la solution pendant plus de 15 minutes afin d’éliminer les bulles d’air.
- Préparation de l’échantillon : Utilisez la phase mobile pour dissoudre la poudre de glycogène de sorte que la concentration finale soit de 1 mg/mL. Incuber la solution à 80 °C pendant la nuit dans un thermomixeur. Centrifuger l’échantillon dissous à 6 000 x g pendant 10 min à température ambiante et transférer le surnageant dans un flacon SEC standard.
- Préparation d’échantillons de glycogène traité au DMSO
- Dissoudre 1 mg de glycogène en poudre dans 300 μL de DMSO et l’incuber à 80 °C pendant la nuit dans un thermomélangeur. Ajoutez 4 fois le volume d’éthanol pour précipiter le glycogène et centrifugez la solution à 6 000 x g.
- Lavez le granulé deux fois avec de l’éthanol, dissolvez le granulé dans du ddH2O et lyophilisez.
- Analysez la poudre de glycogène lyophilisée via SEC en préparant des échantillons comme décrit ci-dessus.
- Utilisez le système SEC avec des pré-colonnes, et 1000 et 10000 colonnes pour l’analyse de la distribution granulométrique des particules de glycogène. Maintenez les colonnes à 80 °C et le débit à 0,3 mL/min.
- Électrophorèse des glucides assistée par fluorophore (FACE)
- Débranchage du glycogène
REMARQUE : Lors de l’utilisation de FACE pour détecter la distribution de la longueur de la chaîne (CLD), tous les échantillons à tester doivent subir le prétraitement de débranchage.- Ajoutez 0,5 mg de glycogène en poudre, 90 μL d’eau chaude (90 °C), 1,5 μL de solution de NaN3 , 3,5 μL d’isoamylase (200 U/mL) et 8 μL de tampon d’acide acétique-acétate de sodium (pH 3,5) dans un tube à essai.
REMARQUE : L’isoamylase est ajoutée pour couper spécifiquement la chaîne ramifiée de l’échantillon à tester. L’isoamylase est une enzyme débranchante qui peut détruire spécifiquement la liaison α-(1-6) sans détruire la liaison α-(1-4), de sorte qu’elle peut spécifiquement cliver la chaîne latérale du glycogène sans détruire la structure de la chaîne principale. - Incuber le mélange à 37 °C pendant 3 h dans un thermomixeur. Après avoir préparé le pH neutre avec 8 μL de solution de NaOH 0,1 M, incuber le mélange à 80 °C pendant 1 h dans un thermomélangeur.
- Ajoutez 4 fois plus d’éthanol absolu au mélange pour précipiter le glycogène. Ensuite, centrifuger à 6 000 x g pendant 10 min à température ambiante. Lavez le granulé deux fois avec de l’éthanol, dissolvez le granulé dans du ddH2O et lyophilisez.
- Ajoutez 0,5 mg de glycogène en poudre, 90 μL d’eau chaude (90 °C), 1,5 μL de solution de NaN3 , 3,5 μL d’isoamylase (200 U/mL) et 8 μL de tampon d’acide acétique-acétate de sodium (pH 3,5) dans un tube à essai.
- Préparation de la solution fluorescente
- Centrifugez le flacon de réactif APTS (sel trisodique d’acide 8-aminopyrène-1,3,6-trisulfonique) (chaque flacon contient 5 mg d’APTS) à 4 000 x g pendant 2 min. Ajouter 50 μL de solution d’acide acétique à 15 % pour dissoudre la poudre, bien mélanger et centrifuger à 4 000 x g pendant 2 min à température ambiante pour obtenir une solution d’acide acétique APTS 0,2 M.
REMARQUE : Conservez la solution APTS au réfrigérateur à -20 °C.It doit être utilisée complètement dans les deux semaines suivant son ouverture. Sinon, il sera inactivé. L’APTS est un colorant chargé négativement couramment utilisé qui se lie à l’extrémité réductrice de la chaîne glycogène. Étant donné que les chaînes avec différents degrés de polymérisation (DP) ne portent toutes qu’une seule charge négative, FACE peut les séparer en fonction de leurs différents rapports masse/charge. De cette façon, les signaux de différentes valeurs DP sont détectés par le détecteur de fluorescence.
- Centrifugez le flacon de réactif APTS (sel trisodique d’acide 8-aminopyrène-1,3,6-trisulfonique) (chaque flacon contient 5 mg d’APTS) à 4 000 x g pendant 2 min. Ajouter 50 μL de solution d’acide acétique à 15 % pour dissoudre la poudre, bien mélanger et centrifuger à 4 000 x g pendant 2 min à température ambiante pour obtenir une solution d’acide acétique APTS 0,2 M.
- Transférez le glycogène déramifié dans un tube à essai et ajoutez 1,5 μL de solution d’APTS et 1,5 μL de solution de cyanoborohydrure de sodium. Incuber à 60 °C pendant 1,5 h dans l’obscurité. Ajouter 80 μL d’eau déminéralisée, centrifuger à 4 000 x g pendant 10 min à température ambiante et conserver le surnageant.
- Introduire l’échantillon dans le système d’électrophorèse capillaire en injectant pendant 3 s à 0,5 psi (3,4 kPa au-dessus de la pression atmosphérique).
REMARQUE : Les glucanes linéaires marqués par fluorescence ont été séparés par une tension appliquée de 30 kV et un courant approximatif de 14 mA à 25 °C. Les zones de pics ont donné des quantités relatives de glucanes de masses différentes (degré de polymérisation (DP) des glucanes dans les pics adjacents différait de 1 DP). La température de l’échantillon a été maintenue à 18 °C.
- Débranchage du glycogène
Résultats
Distribution granulométrique des particules de glycogène
Une série d’études ont montré que les particules de α de glycogène dans le foie diabétique sont fragiles et se décomposent facilement dans le perturbateur de liaison hydrogène DMSO 11,12,13,14. La présente étude a testé comment la taille des particules et la stabilité structurelle ont changé pour le glycogène bactérien extrait par quatre méthodes différentes. Tous les échantillons de glycogène des quatre méthodes ont été traités avec de l’eau (courbes bleues) et du DMSO (courbes rouges), respectivement. La répartition du poids, w(logRh), est donnée à la figure 2. Le glycogène traité à l’eau extrait par TCA-HW (Figure 2A, courbes bleues) et TCA-CW (Figure 2B, courbes bleues) est dominé par des particules plus petites avec des pics à Rh ~ 20 nm. D’autre part, le glycogène traité à l’eau extrait par KOH-HW (Figure 2C, courbes bleues) et SDGU-CW (Figure 2D, courbes bleues) présente des particules de plus grande taille avec des pics à Rh ~ 40 nm, indiquant ainsi que des particules de glycogène α sont présentes dans les bactéries. Alors que les méthodes KOH-HW et SDGU-CW extraient les particules de glycogène α, les méthodes TCA-HW et TCA-CW dégradent les particules de α plus grosses en particules β ou n’extraient que les particules de β plus petites.
En ce qui concerne la stabilité et la fragilité du glycogène, le traitement au DMSO n’a pas modifié la distribution du poids des particules de glycogène extraites par TCA-HW (figure 2A, courbes rouges), TCA-CW (figure 2B, courbes rouges) et KOH-HW (figure 2C, courbes rouges). Cependant, le glycogène extrait par la méthode KOH-HW était principalement constitué de particules α stables, tandis que les méthodes TCA généraient principalement des particules β. En ce qui concerne le glycogène extrait du SDGU-CW, une forte modification des compositions en particules α et en particules β a été observée après le traitement au DMSO. On déduit de la figure 2D qu’une fraction des particules α (courbes bleues) s’est dégradée en particules β (courbes rouges), conduisant à la région de plateau observée et suggérant ainsi qu’il existe une coexistence de particules α stables et fragiles dans le glycogène bactérien.
Afin de soutenir les structures morphologiques des particules de glycogène extraites du SDGU-CW, des images TEM représentatives du glycogène sont présentées à la figure 3. La morphologie des particules de glycogène à l’état brut d’E. coli est similaire à celle du foie de souris sain15, montrant la présence de particules de α en forme de rosette et de quelques particules de β, ce qui confirme que les particules de α de glycogène peuvent être extraites d’E . coli par des méthodes d’extraction douces.
Distributions de longueur de chaîne
La figure 4 montre les distributions de longueur de chaîne (CLD) des particules de glycogène mesurées par FACE. La longueur moyenne de la chaîne (ACL) est l’inverse du pourcentage de ramification et peut être calculée à l’aide de la formule Σ (pourcentage DP x nombre de DP). Selon les résultats, le glycogène du SDGU-CW (Figure 4D) et du TCA-CW (Figure 4B) présentait les LCA les plus élevés (~14 DP), ce qui indique que l’extraction par CW présentait le moins de dommages au CLD. Pour le glycogène extrait par TCA-HW, les chaînes ont été partiellement dégradées en raison de la brève étape d’ébullition, comme le montre une légère réduction de l’ACL (Figure 4A). Enfin, la CLD pour le glycogène de KOH-HW s’est déplacée vers des valeurs de DP plus petites et l’ACL a diminué de plus de 2 DP (Figure 4C), ce qui indique que l’ébullition dans un milieu fortement alcalin pourrait endommager la structure primaire des particules de glycogène.

Figure 1 : Une illustration schématique de l’extraction du glycogène bactérien par la méthode SDGU-CW. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Distributions pondérales SEC [w(log Rh) (a.u)] pour les particules de glycogène E. coli BL21(DE3) extraites par quatre méthodes. (A) TCA-HW, (B) TCA-CW, (C) KOH-HW et (D) SDGU-CW. Les courbes de distribution granulométrique sont illustrées pour les particules de glycogène traitées à l’eau (couleur bleue) et au DMSO (couleur rouge). Toutes les analyses SEC ont été effectuées en double. W1 : duplicata 1 traité à l’eau. D1 : duplicata 1 traité au DMSO. W2 : duplicata 2 traités à l’eau. D2 : duplicata 2 traité au DMSO. Cette figure est reproduite à partir de la référence 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
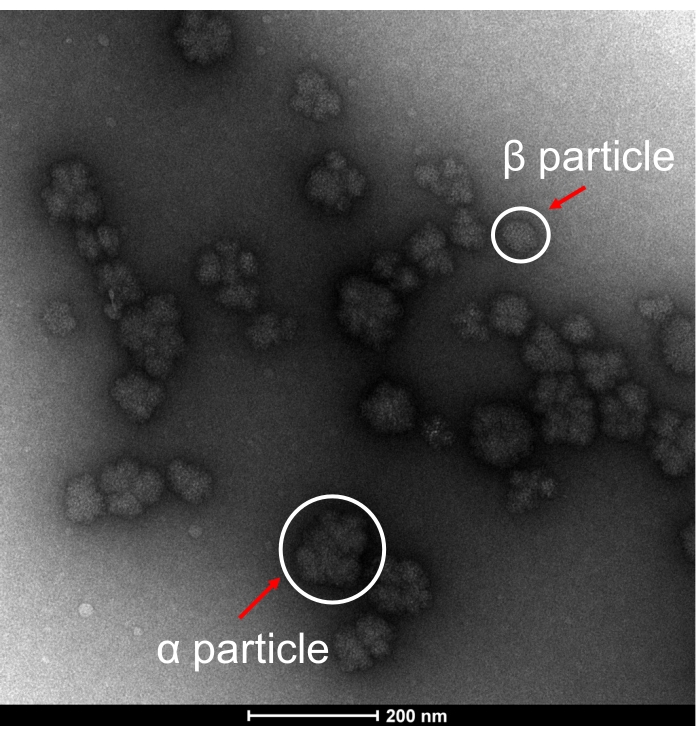
Figure 3 : Image représentative de la GDT. Image TEM de particules de glycogène α bactérienne et de particules de glycogène β extraites par extraction à l’eau froide à l’aide de la méthode d’ultra-centrifugation par gradient de densité de saccharose (SDGU-CW). Les particules représentatives sont signalées par des flèches rouges. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Distributions de la longueur de la chaîne et longueurs moyennes de la chaîne du glycogène E. coli extrait par quatre méthodes différentes. (A) TCA-HW, (B) TCA-CW, (C) KOH-HW et (D) SDGU-CW. Trois extractions indépendantes ont été effectuées pour chaque méthode et les distributions moyennes de la longueur de la chaîne, ainsi que les moyennes d’erreur-type, ont été présentées. Cette figure a été adaptée des données publiées dans la référence 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le glycogène est une réserve d’énergie importante qui a été identifiée chez de nombreuses bactéries16. Pour disséquer les fonctions physiologiques des particules de glycogène, il est essentiel de mieux comprendre la structure fine des molécules de glycogène. Jusqu’à présent, diverses méthodes ont été développées pour extraire le glycogène de la culture bactérienne. Cependant, différentes distributions de taille des particules de glycogène ont été observées à partir de différentes méthodes d’extraction, ce qui suggère une structure du glycogène endommagée. Ainsi, il est nécessaire de comparer et de normaliser les procédures d’extraction afin de s’assurer que les structures du glycogène provenant de différentes études sont comparables. Dans cette étude, un protocole détaillé est présenté décrivant quatre méthodes couramment utilisées pour l’extraction du glycogène à partir de cultures liquides d’E. coli , qui sont ensuite évaluées par des caractérisations structurales des particules de glycogène.
En ce qui concerne la distribution granulométrique, les particules de glycogène du TCA-CW et du TCA-HW présentent une distribution pondérale vers une taille de particule plus petite avec des pics à Rh ≈ 20 nm (β particules). Ainsi, ces deux méthodes ne sont pas adaptées pour extraire des particules de glycogène pour la caractérisation structurale. En fait, cela pourrait être en partie la raison pour laquelle on pensait que seules β particules existaient dans les bactéries, car les méthodes TCA ont été largement utilisées pour l’étude du glycogène bactérien. D’autre part, les particules de glycogène des méthodes KOH-HW et SDGU-CW ont des particules de taille dominante plus grande, les pics les plus élevés se situant à Rh ≈ 40 nm (particules α). Ainsi, les méthodes KOH-HW et SDGU-CW sont meilleures que les méthodes TCA-CW et TCA-HW. Cependant, comme seules les particules α stables peuvent être extraites via la méthode KOH-HW, cela indique que les particules de α fragiles sont perturbées par les conditions difficiles utilisées dans cette méthode.
En termes de distributions de longueur de chaîne (CLD), le glycogène de SDGU-CW et de TCA-CW a des chaînes plus longues, ce qui confirme que l’extraction à l’eau froide entraîne des dommages minimes aux CLD. Les longueurs de chaîne des particules de glycogène extraites via TCA-HW ont été partiellement réduites en raison de la brève étape d’ébullition dans le processus d’extraction, ce qui a conduit à une diminution de la longueur moyenne de la chaîne (LCA). Avec la méthode KOH-HW, le CLD révèle des chaînes plus courtes de glycogène, et le LCA diminue de plus de 2 DP en raison de l’ébullition à long terme dans des solutions alcalines. Ainsi, sur la base de cette analyse de la structure primaire des particules de glycogène, il est confirmé que l’extraction à l’eau froide, étant beaucoup plus douce que l’extraction à l’eau chaude, peut extraire des particules de glycogène avec des chaînes plus longues et donc moins de dégradation.
En résumé, une dégradation minimale est essentielle pour étudier les propriétés du glycogène natif. Une dégradation minimale des particules de glycogène est indiquée lorsque l’analyse de la distribution granulométrique montre des molécules plus grosses et que la distribution de la longueur de la chaîne montre le plus grand nombre de chaînes plus longues. Étant donné que l’extraction à l’eau froide par ultra-centrifugation par gradient de densité de saccharose permet d’obtenir le meilleur effet global du point de vue de l’intégrité structurelle du glycogène, cette méthode est recommandée pour l’extraction du glycogène bactérien dans les futures études pertinentes.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Nous sommes très reconnaissants envers le professeur Robert G. Gilbert de l’Université du Queensland et de l’Université de Yangzhou qui nous a fourni des idées et une expertise qui ont grandement contribué à la réalisation de cette étude. Nous reconnaissons le soutien financier de la Fondation nationale des sciences naturelles de Chine (n° 31900022, n° 32171281), de la Fondation des sciences naturelles de la province du Jiangsu (n°. BK20180997), jeune équipe d’innovation scientifique et technologique de l’Université de médecine de Xuzhou (n°. TD202001) et le Jiangsu Qinglan Project (2020).
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Agilent 1260 infinity SEC system | Agilent | 1260 infinity II | Particle size distribution |
| Analytical column | PSS | 10-1000 | - |
| Centrifuge | Eppendorf | 5420 | - |
| Filter membrane | Cambio | Km-0220 | - |
| Fluorescence-assisted capillary electrophoresis system | Beckman Coulter | - | Chain length distribution |
| Freeze dryer | Xinzhi | SCIENTZ-10N | Lyophilization of bacteria and glycogen |
| Freezer | Thermo Fisher | Forma 900 | Sample storage |
| Guard column | PSS | SUPPERMA | - |
| Incubator | Thermo Fisher | PR505750R-CN | - |
| Low-speed large-capacity centrifuge | Hexi | HR/T20MM | Sample centrifugation |
| Multiskan FC microplate reader | Thermo Fisher | 1410101 | - |
| Optima XPN ultracentrifuge | Beckman | XPN-100/90/80 | For glycogen |
| Oscillator | Xinbao | SHZ-82 | - |
| PA-800 Plus System | Beckman Coulter | A66528 | - |
| pH meter | Mettler Toledo | FE28 -TRIS | - |
| Refractive index detector | Wyatt | Optilab T-rEX | - |
| Refrigerator | Haier | BCD-406WDPD | - |
| Thermomixer | Shanghai Jingxin | JXH-100 | Sample incubation |
| Transmission electron microscope | Hitachi Corporation | H-7000 | Glycogen particle morphology |
| Ultracentrifuge tube | Beckman | 355651 | - |
| Ultrasonic cell crusher | Ningbo Xinzhi | Scientz-IID | Bacteria disruptor |
| Ultrasonic oscillating water bath | Jietuo | JT-1027HTD | - |
| Vortex mixer | Tiangen | OSE-VX-01 | - |
| Water system | Merck Millipore | H2O-MM-UV-T | Deionized water |
| Material | |||
| 8-Aminopyrene-1,3,6-Trisulfonic Acid Trisodium Salt | Sigma-Aldrich | 196504-57-1 | - |
| Absolute ethanol | Guoyao | 10009228 | - |
| Agar powder | Solarbio | A1890 | - |
| Alpha-amylase | Megazyme | E-BLAAM-40ML | - |
| Amyloglucosidase | Megazyme | E-AMGDF-40ML | - |
| cOmplete Mini | Roche | 4693159001 | - |
| D-(+)Glucose | Sigma-Aldrich | G8270-1kg | - |
| D-Glucose Assay Kit (GOPOD Format) | Megazyme | K-GLUC | Glycogen quantification |
| Dimethyl sulfoxide | Vicmed | Vic147 | Chaotropic agent |
| E. coli BL21(DE3) | Tiangen | CB105-02 | - |
| Ethylene diamine tetra-acetic acid | Vicmed | Vic1488 | - |
| Glacial acetic acid | Guoyao | 10000218 | - |
| Glycerol | Guoyao | 10010618 | Bacterial storage |
| Hydrochloric acid | Guoyao | 10011008 | - |
| Hydroxymethyl aminomethane | Sigma-Aldrich | V900483-500g | - |
| Isoamylase | MegaZyme | 9067-73-6 | Glycogen debranch |
| Lithium chloride | Sigma-Aldrich | 62476-100g | - |
| M9, Minimal Salts, 5× | Sigma-Aldrich | M6030-1kg | Bacterial culture |
| Potassium hydroxide | Guoyao | 10017008 | - |
| Pullulan standard | PSS | - | - |
| Sodium acetate trihydrate | Guoyao | 10018718 | - |
| Sodium azide | Sigma-Aldrich | 26628-22-8 | - |
| Sodium chloride | Guoyao | 10019318 | Bacterial culture |
| Sodium cyanoborohydride | Huaweiruike | hws001297 | - |
| Sodium diphosphate | Sigma-Aldrich | 71515-250g | - |
| Sodium Fluoride | Macklin | S817988-250g | - |
| Sodium hydroxide | Guoyao | 10019762 | - |
| Sodium nitrate | Guoyao | 10019928 | - |
| Sodium pyrophosphate | Sigma-Aldrich | V900195-500g | - |
| Sucrose | Guoyao | 10021463 | - |
| Trichloroacetic acid | Guoyao | 40091961 | - |
| Tryptone | Oxoid | LP0042 | Bacterial culture |
| Yeast Extract | Oxoid | LP0021 | Bacterial culture |
Références
- Wang, L., et al. Molecular structure of glycogen in Escherichia coli. Biomacromolecules. 20 (7), 2821-2829 (2019).
- Deng, B., et al. Molecular structure of glycogen in diabetic liver. Glycoconjugate Journal. 32 (3-4), 113-118 (2015).
- Hu, Z., et al. Diurnal changes of glycogen molecular structure in healthy and diabetic mice. Carbohydrate Polymers. 185, 145-152 (2018).
- Nawaz, A., Zhang, P., Li, E., Gilbert, R. G., Sullivan, M. A. The importance of glycogen molecular structure for blood glucose control. iScience. 24 (1), 101953 (2021).
- Rashid, A. M., et al. Assembly of α-glucan by GlgE and GlgB in mycobacteria and streptomycetes. Biochemistry. 55 (23), 3270-3284 (2016).
- Wang, L., et al. Recent progress in the structure of glycogen serving as a durable energy reserve in bacteria. World Journal of Microbiology and Biotechnology. 36 (1), 14 (2020).
- Kamio, Y., Terawaki, Y., Nakajima, T., Matsuda, K. Structure of glycogen produced by Selenomonas ruminantium. Agricultural and Biological Chemistry. 45 (1), 209-216 (1981).
- Gong, J., Forsberg, C. W. Separation of outer and cytoplasmic membranes of Fibrobacter succinogenes and membrane and glycogen granule locations of glycanases and cellobiase. Journal of Bacteriology. 175 (21), 6810-6821 (1993).
- Mojibi, N. Comparison of methods to assay liver glycogen fractions: the effects of starvation. Journal of Clinical and Diagnostic Research. 11 (3), (2017).
- Orrell, S. A., Bueding, E. A comparison of products obtained by various procedures used for the extraction of glycogen. The Journal of Biological Chemistry. 239, 4021-4026 (1964).
- Tan, X., et al. Proteomic investigation of the binding agent between liver glycogen beta particles. ACS Omega. 3 (4), 3640-3645 (2018).
- Hu, Z., et al. Diurnal changes of glycogen molecular structure in healthy and diabetic mice. Carbohydrate Polymers. 185, 145-152 (2018).
- Sullivan, M. A., Harcourt, B. E., Xu, P., Forbes, J. M., Gilbert, R. G. Impairment of liver glycogen storage in the db/db animal model of type 2 diabetes: a potential target for future therapeutics. Current Drug Targets. 16 (10), 1088-1093 (2015).
- Deng, B., et al. Molecular structure of glycogen in diabetic liver. Glycoconjugate Journal. 32 (3-4), 113-118 (2015).
- Sullivan, M. A., et al. Molecular structural differences between type-2-diabetic and healthy glycogen. Biomacromolecules. 12 (6), 1983-1986 (2011).
- Wang, L., et al. Systematic analysis of metabolic pathway distributions of bacterial energy reserves. G3 Genes|Genomes|Genetics. 9 (8), 2489-2496 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.