Method Article
Доступ к цитотоксичности и клеточному ответу на биоматериалы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта методология направлена на оценку цитотоксичности биоматериала путем приготовления растворимых экстрактов с использованием анализов жизнеспособности и фенотипического анализа, включая проточную цитометрию, ОТ-ПЦР, иммуноцитохимию и другие методы клеточной и молекулярной биологии.
Аннотация
Биоматериалы прямо или косвенно контактируют с тканями человека, поэтому важно оценить его цитотоксичность. Эта оценка может быть выполнена несколькими методами, но между используемыми подходами существует большое расхождение, что ставит под угрозу воспроизводимость и сравнение полученных результатов. В данной работе предложен протокол оценки цитотоксичности биоматериалов с использованием растворимых экстрактов, которые мы используем для стоматологических биоматериалов. Приготовление экстрактов детализировано, от производства пеллет до их экстракции в питательной среде. Оценка цитотоксичности биоматериалов основана на метаболической активности с использованием анализа МТТ, жизнеспособности клеток с использованием анализа сульфорходамина B (SBR), профиле гибели клеток с помощью проточной цитометрии и морфологии клеток с использованием Май-Грюнвальд Гимса. В дополнение к оценке цитотоксичности описан протокол для оценки функции клеток, основанный на экспрессии специфических маркеров, оцениваемых с помощью иммуноцитохимии и ПЦР. Этот протокол представляет собой исчерпывающее руководство по оценке цитотоксичности биоматериалов и клеточных эффектов с использованием методологии экстрактов воспроизводимым и надежным образом.
Введение
Биосовместимость может быть определена как способность материала интегрировать ткань и индуцировать благоприятный терапевтический ответ, свободный от местных и системных повреждений 1,2,3. Оценка биосовместимости имеет решающее значение для разработки любого материала, предназначенного для медицинского использования. Таким образом, этот протокол обеспечивает систематический и комплексный подход для каждого исследователя, стремящегося к разработке новых биоматериалов или изучению новых применений существующих биоматериалов.
Тесты на цитотоксичность in vitro широко используются в качестве первого этапа оценки биосовместимости с использованием первичных клеточных культур или клеточных линий. Результаты представляют собой первый показатель потенциального клинического применения. Помимо того, что это тестирование имеет жизненно важное значение для разработки биоматериала, оно является обязательным для соблюдения действующих правил выхода на рынок от регулирующих органов EUA и ЕС (сертификация FDA и CE)4,5,6,7,8. Кроме того, стандартизированное тестирование в биомедицинских исследованиях дает значительное преимущество с точки зрения воспроизводимости и сравнения результатов различных исследований на аналогичных биоматериалах или устройствах9.
Руководящие принципы Международной организации по стандартизации (ISO) широко используются несколькими независимыми коммерческими, нормативными и академическими лабораториями для точного и воспроизводимого тестирования материалов. ISO 10993-5 относится к оценке цитотоксичности in vitro, а ISO 10993-12 - к подготовкеобразцов 10,11. Для тестирования биоматериала предусмотрены три категории, которые должны быть выбраны в соответствии с типом материала, контактирующими тканями и целью лечения: экстракты, прямой контакт и непрямой контакт 8,11,12,13. Экстракты получают путем обогащения питательной среды клеток биоматериалом. Для испытаний прямого контакта биоматериал помещают непосредственно на клеточные культуры, а при непрямом контакте проводят инкубацию с клетками, разделенными барьером, таким как агарозный гель11. Соответствующий контроль является обязательным, и должно быть проведено не менее трех независимых экспериментов 5,8,10,11,14.
Крайне важно моделировать или преувеличивать клинические состояния, чтобы определить цитотоксический потенциал. В случае испытаний экстрактов - площадь поверхности материала; средний объем; рН среды и материала; растворимость материала, осмолярность и коэффициент диффузии; и условия экстракции, такие как перемешивание, температура и время, влияют на обогащающие среды5.
Методология позволяет количественно и качественно оценить цитотоксичность нескольких фармацевтических препаратов, как твердых, так и жидких. Можно провести несколько анализов, таких как тест на нейтральное поглощение красного цвета, тест на образование колоний, анализ MTT и анализ XTT 5,10,14.
В большинстве опубликованных исследований по оценке цитотоксичности используются более простые анализы, а именно МТТ и ХТТ, которые предоставляют ограниченную информацию. Оценка биосовместимости должна включать не только оценку цитотоксичности, но и биологической активности данного испытуемого материала2, как это подтверждается настоящим протоколом. Дополнительные критерии оценки должны использоваться, когда они обоснованы и задокументированы. Таким образом, этот протокол призван предоставить всеобъемлющее руководство, подробно описывающее набор методов оценки цитотоксичности биоматериала. Кроме того, описана оценка различных клеточных процессов, а именно типа гибели клеток, морфологии клеток, функции клеток в синтезе специфических белков и специфической продукции тканей.
протокол
1. Подготовка пеллет
- Подготовьте формы из поливинилхлорида (ПВХ), выполнив отверстия круглой формы известных размеров в пластинах ПВХ.
ПРИМЕЧАНИЕ: Молдинги из ПВХ могут быть разных размеров. Рассчитайте контактную поверхность пресс-форм из ПВХ, используя формулу A= h(2πr)+2πr2 (r: радиус цилиндра; h: высота цилиндра). - Подготовьте биоматериал к тестированию согласно инструкции производителя и как можно ближе к началу эксперимента.
ПРИМЕЧАНИЕ: Для приготовления биоматериалов пасты/пасты достаточное количество базовой пасты и катализатора смешивают вручную с помощью смесительного шпателя. Для других материалов на основе жидких и порошковых составов следует выполнять ручное шпатель или механическое смешивание с вибрацией в соответствии с инструкциями производителя или соответствующими инструкциям для новых материалов. Для жидких материалов этот шаг не является необходимым. Запустите протокол на шаге 2. - Поместите биоматериал на формы с помощью шпателя и дайте им застыть в течение соответствующего времени.
ПРИМЕЧАНИЕ: Время схватывания и условия схватывания биоматериалов должны соответствовать инструкциям производителя или соответствовать инструкциям для новых материалов. - После схватывания извлеките гранулы биоматериала из форм из ПВХ и поместите их в контейнер (можно использовать 6-луночную тарелку или чашку Петри).
- Стерилизуйте гранулы, поместив их под ультрафиолетовую (УФ) лампу на 20 минут с каждой стороны.
2. Получение экстрактов биоматериалов
ПРИМЕЧАНИЕ: Все процедуры должны выполняться в строгих стерильных условиях.
- Определите необходимое количество гранул, рассчитав площадь поверхности гранул по формуле, описанной в 1.1.
ПРИМЕЧАНИЕ: В качестве эталонного значения площадь контактной поверхности 250 мм2/мл11,15 достигается добавлением 9 гранул (r 3 мм x h 1,5 мм) на мл среды. - Приготовьте растворимые экстракты (экстракт, обогащенный биоматериалом).
- Поместите гранулы в пробирку объемом 50 мл и добавьте соответствующую среду для культивирования клеток. Поместите пробирки на 24 часа в инкубатор под углом 37° при постоянном вращении.
ПРИМЕЧАНИЕ: Используйте среду для культивирования клеток, подходящую для клеточных культур. - Через 24 часа извлеките пробирки из инкубатора. На данный момент экстракты соответствуют концентрации 1/1 или 100%.
- Производят разбавления экстракта путем последовательного добавления равных объемов кондиционированной среды в среду для культивирования клеток.
ПРИМЕЧАНИЕ: Не следует корректировать рН среды.- Добавьте 1 мл питательной среды к 1 мл 100% экстракта для получения 50% экстракта. Добавьте 1 мл питательной среды к 1 мл 50% экстракта, чтобы получить 25% экстракт, и так далее (рис. 1).
ПРИМЕЧАНИЕ: Используйте концентрации, относящиеся к каждому соединению.
- Добавьте 1 мл питательной среды к 1 мл 100% экстракта для получения 50% экстракта. Добавьте 1 мл питательной среды к 1 мл 50% экстракта, чтобы получить 25% экстракт, и так далее (рис. 1).
- Поместите гранулы в пробирку объемом 50 мл и добавьте соответствующую среду для культивирования клеток. Поместите пробирки на 24 часа в инкубатор под углом 37° при постоянном вращении.
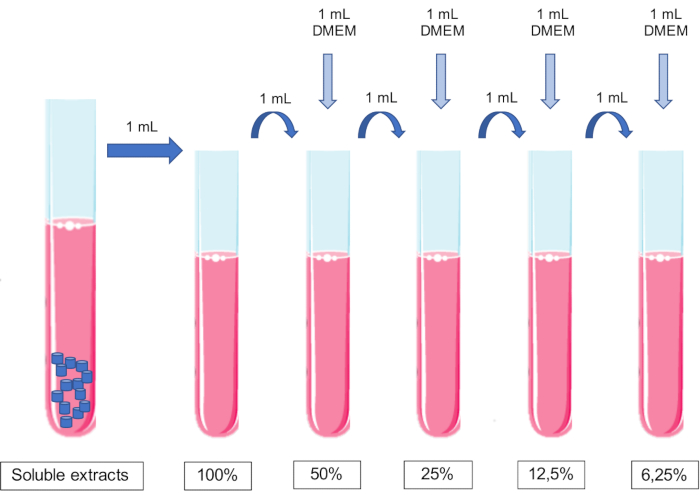
Рисунок 1: Схема приготовления и разведения растворимых экстрактов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Клеточная инкубация с экстрактами биоматериалов
- Подготовьте клеточную суспензию и поместите ее в соответствующий клеточный контейнер, такой как многолуночная пластина, в соответствии с количеством клеток, необходимых для экспериментов.
- Начните с колбы с нужными ячейками со слиянием от 80% до 90%.
- Откажитесь от среды для культивирования клеток, промойте солевым раствором с фосфатным буфером (PBS) и отделите клетки трипсином-ЭДТА (от 1 до 2 мл для колбы для клеточной культуры размером 75 см2 дюйма).
- Добавьте среду для культивирования клеток (от 2 до 4 мл для колбы для культивирования клеток размером 75см2 ), перенесите клеточную суспензию в пробирку и центрифугу при 200 x g в течение 5 мин.
- Суспендируют гранулу в известном объеме среды для культивирования клеток.
ПРИМЕЧАНИЕ: Этот протокол предназначен для использования адгезивных клеточных культур; Тем не менее, простые приспособления могут быть сделаны для работы с суспензионными клеточными культурами. - Подсчитайте клетки в гемоцитометре и рассчитайте клеточную концентрацию клеточной суспензии.
- Суспендировать определенное количество клеточной суспензии в питательной среде и переложить в многолуночную посуду. В качестве эталонного значения плотности посева рассмотрите 5 – 20 х 105 клеток/см2 .
ПРИМЕЧАНИЕ: Присвоенное количество ячеек должно быть рассчитано в соответствии с типом ячейки и характеристиками ячейки, а именно временем удвоения ячейки.
- Инкубируйте клетки в течение 24 часов, чтобы обеспечить адгезию клеток.
- По истечении этого срока вводите растворимые экстракты в культуральные планшеты.
- Аспирируйте среду для культивирования клеток.
- Добавьте экстракты биоматериалов в каждую лунку в соответствии с последовательностью концентраций, как описано ранее. Добавьте свежую среду для культивирования клеток в контрольные лунки.
- Инкубируйте пластины в течение 24 ч или дольше.
ПРИМЕЧАНИЕ: Отрицательный контроль должен быть выполнен в каждом анализе, соответствующем необработанным клеткам, хранящимся в питательной среде. Время инкубации может быть выбрано в соответствии с целями исследования.
4. Оценка метаболической активности
- После инкубации клеток с экстрактами биоматериалов аспирируют среду из пластин и промывают каждую лунку PBS.
- Поместите в каждую лунку достаточный объем 0,5 мг/мл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразола бромида (МТТ), приготовленного в PBS, рН 7,4.
- Выдерживают пластинки в течение 4 ч или ночь в темноте при температуре 37°С.
- Чтобы растворить полученные кристаллы формазана, добавьте в каждую лунку соответствующий объем 0,04 М раствора соляной кислоты в изопропаноле и помешивайте пластины в течение 30 минут.
ПРИМЕЧАНИЕ: Отрегулируйте количество МТТ и изопропанола в соответствии с размером лунок. - При необходимости перемешайте и гомогенизируйте содержимое каждой лунки, пипеткой вверх и вниз до тех пор, пока не исчезнут кристаллы.
- Количественно определите поглощение на длине волны 570 нм с помощью эталонного фильтра 620 нм в спектрофотометре.
- Чтобы рассчитать метаболическую активность, разделите поглощение обработанных клеток на поглощение контрольных культур. Для получения процентных значений умножьте на 100.
5. Оценка гибели клеток
ПРИМЕЧАНИЕ: Для выполнения этой оценки следует использовать не менее 106 ячеек на условие.
- Используйте центрифужные пробирки, правильно идентифицированные в соответствии с оцениваемыми условиями.
- После инкубации клеток с экстрактами биоматериалов собирают питательные среды в соответствующую пробирку.
- Отсоедините ячейки и добавьте клеточную суспензию в соответствующие трубки.
- Сконцентрировайте клеточные суспензии центрифугированием в концентрации 120 x g в течение 5 минут.
- Вымойте гранулы с помощью PBS. Удалите PBS центрифугированием при 1,000 x g в течение 5 минут.
- Добавьте 1 мл PBS и перенесите клеточные гранулы в идентифицированные цитометрические пробирки.
- Удалите PBS центрифугированием при 1,000 x g в течение 5 минут.
- Инкубируют со 100 мкл связывающего буфера (0,01 М HEPES, 0,14 мМ NaCl и 0,25 мМ CaCl2)16 и дают клеткам отдохнуть около 15 минут для восстановления клеточной мембраны.
- Добавьте 2,5 мкл флуоресцентного меченого Annexin-V и 1 мкл йодида пропидия в течение 15 минут при комнатной температуре в темноте.
- После инкубации добавьте 400 мкл PBS и проанализируйте на цитометре. Для анализа и количественной оценки информации используйте соответствующее программное обеспечение.
- Представьте результаты в процентах от живых клеток, апоптоза, позднего апоптоза/некроза и некроза.
6. Оценка морфологии
- Выберите подходящий размер стерилизованных стеклянных покровных стекол, которые помещаются внутри многолуночной пластины.
- Поместите каждое предметное стекло в лунку с помощью стерильного пинцета.
- Распределите клеточную суспензию в адекватной концентрации в лунки и оставьте на ночь в инкубаторе при 37 ° C в увлажненной атмосфере с 95% воздуха и 5% CO2.
- Подвергайте клеточные культуры воздействию экстрактов, как описано ранее.
- Аспирируйте носитель и промойте с помощью PBS.
- Дайте покровным стеклам высохнуть при комнатной температуре, а затем добавьте достаточный объем раствора Майя-Грюнвальда, чтобы покрыть покровные стекла; Выдерживать 3 минуты.
- Удалите краситель и смойте дистиллированной водой в течение 1 минуты.
- Удалите воду и добавьте достаточный объем раствора Giemsa, чтобы покрыть покровные стекла; Выдерживать 15 минут.
- Промойте покровные стекла в проточной воде.
- Перенесите покровные стекла на предметное стекло.
- Посмотрите под микроскопом. Делайте снимки с выбранным увеличением.
7. Оценка функции клеток с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР)
ПРИМЕЧАНИЕ: Для выполнения этой оценки следует использовать не менее 2x106 ячеек на условие. В качестве примера щелочная фосфатаза представлена как ген, представляющий интерес для оценки активности одонтобластов. Другие гены, представляющие интерес, можно увидеть в таблице 1.
- Распределите ячейки, как описано выше.
ПРИМЕЧАНИЕ: Концентрация покрытых клеток, возможно, потребуется скорректировать в соответствии с типом клеток и цитотоксичностью изучаемых биоматериалов. - Инкубировать с растворимыми экстрактами, как описано выше.
- Отделите клетки, чтобы получить суспензию, как описано ранее.
- Дважды промойте клетки с помощью PBS; для этого центрифугу при 200 x g в течение 5 минут при комнатной температуре.
- Лизируют клетки путем суспендирования гранулы в 1 мл раствора для очистки РНК (например,.NZYol), интенсивного перемешивания и последовательного пипетирования.
- Инкубируйте образцы в течение 5 минут при комнатной температуре.
- Добавьте 200 мкл хлороформа и встряхивайте пробирки вручную в течение 15 секунд.
- Выдерживать 3 минуты при комнатной температуре.
- Центрифуга лизирует при 4 ° C в течение 15 мин при 12 000 х г. Во время этого центрифугирования в образце возникают две фазы, оставляя РНК в водной (верхней) фазе.
- Удалите водную фазу в новую пробирку и добавьте 500 мкл холодного изопропанола для осаждения РНК.
- Образцы инкубируют при комнатной температуре в течение 10 минут и центрифугируют при 12 000 x g в течение 10 минут при 4 ° C.
- Удалите надосадочную жидкость и промойте гранулы 1 мл 75% этанола центрифугированием при 7,500 x g в течение 5 минут при 4 ° C.
- Высушите гранулы при комнатной температуре до испарения этанола.
- Суспендировать в воде, не содержащей РНКазы.
- Количественно определить и определить степень чистоты образцов с помощью абсорбционной спектрофотометрии на длинах волн 260 нм и 280 нм. Определите чистоту РНК и используйте образцы с соотношением чистоты (A260/280) около 2,0.
- Храните образцы при температуре -80°С.
- Приступайте к выполнению ОТ-ПЦР в соответствии с протоколомпроизводителя 17.
ПРИМЕЧАНИЕ: В соответствии с целью исследования выберите конкретные маркеры для оценки.
8. Оценка функции клеток с помощью идентификации белка
ПРИМЕЧАНИЕ: В соответствии с целью исследования выберите конкретные белки для оценки. В качестве примера дентин-сиалопротеин (DSP) представлен как белок, представляющий интерес для оценки активности одонтобластов. Другие белки, представляющие интерес, можно увидеть в таблице 1.
- Культивируют клетки в покровных стеклах и подвергают воздействию экстрактов, как описано ранее.
- Промойте клеточные культуры с помощью PBS.
- Зафиксируйте 3,7% параформальдегидом на 30 минут при комнатной температуре.
- Дважды постирайте с помощью PBS.
- Пермеабилизируйте 0,5% Triton в PBS в течение 15 минут.
- Блокируйте пероксидазу 0,3% перекисью водорода в PBS в течение 5 минут.
- Дважды постирайте с помощью PBS.
- Дважды промыть 0,5% бычьим сывороточным альбумином (BSA).
- Блокируйте клеточные культуры 2% BSA в течение 45 минут.
- Стирайте с 0,5% BSA в PBS.
- Инкубируют культуры с первичным антителом в соответствии с выбранным белком в течение 60 минут при комнатной температуре.
ПРИМЕЧАНИЕ: В этом протоколе используются первичные антитела DSP (M20) (1: 100) и вторичные антитела поликлональные кролики против козьих иммуноглобулинов / HRP (1: 100). - Стирайте пять раз с 0,5% BSA в PBS.
- Инкубировать со вторичными антителами в течение 90 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Сделайте разведения антител, используя 0,5% BSA в PBS. - Стирайте пять раз с 0,5% BSA в PBS в течение 1 минуты при каждой стирке.
- Инкубируют культуры со смесью субстрата и хромогена в концентрации 20 мкл хромогена/мл субстрата в течение 25 минут.
- Стирайте дважды с 0,5% BSA в PBS.
- Противопятните гематоксилином в течение 15 минут.
- Промыть нашатырным спиртом 0,037 моль/л и дистиллированной водой в течение 5 минут, чтобы удалить излишки красителя.
- Закрепите покровные стекла на направляющих. Используйте глицерин в качестве монтажной среды.
- Дайте высохнуть в течение ночи.
- Посмотрите под микроскопом. Делайте снимки с выбранным увеличением.
9. Оценка минерализации с помощью анализа Alizarin Red S
- Приготовьте раствор Ализарина Красного S в концентрации 40 мМ18. Размешивайте раствор для гомогенизации в течение 12 часов в темноте.
ПРИМЕЧАНИЕ: Чтобы приготовить 100 мл раствора ализарина красного S, растворите 1,44 г порошка ализарина (молекулярная масса: 360 г / моль) в сверхчистой воде, защищенной от света. Для этого раствора значение рН является критическим и должно составлять от 4,1 до 4,3. - Инкубируют клеточную культуру с растворимыми экстрактами, как описано выше.
- Трижды промойте клеточные культуры с помощью PBS.
- Зафиксируйте 4% параформальдегидом на 15 минут при комнатной температуре.
- Постирайте три раза с помощью PBS.
- Окрашивание раствором Alizarin Red Staining в течение 20 минут при 37 °C в темноте.
- После окрашивания вымойте пластины PBS, чтобы удалить излишки красителя.
- Посмотрите под микроскопом. Делайте снимки с выбранным увеличением.
- Добавьте экстракционный раствор, состоящий из 10% (мас./об.) уксусной кислоты и 20% (мас./об.) метанола, в каждую лунку и дайте помешивать в течение 40 минут при комнатной температуре.
- Измерьте коэффициент поглощения на длине волны 490 нм на спектрофотометре19.
Результаты
Репрезентативные результаты здесь относятся к изучению стоматологических биоматериалов. Методология экстракта позволяет получить профиль цитотоксичности и функцию клеток после воздействия на стоматологические материалы относительно влияния на метаболическую активность (рис. 2), жизнеспособность клеток, профиль клеточной гибели и морфологию клеток (рис. 3), а также экспрессию специфических белков (рис. 4).
Анализ МТТ используется для получения быстрого обзора цитотоксичности материалов простым способом. Можно провести сравнение между двумя или более материалами (рис. 2); резкое снижение метаболической активности, даже при низких (6,25%) и средних концентрациях (50%), указывает на более высокую токсичность (рис. 2а). В то же время меньшие цитотоксические материалы представляют только более легкое восстановление или его отсутствие (рис. 2b). Сравнения между различными временными точками позволяют определить более непосредственные цитотоксические эффекты или на более поздних стадиях.
Влияние на жизнеспособность клеток дает важную информацию о редукции жизнеспособных клеток, что может поставить под угрозу способность тканей восстанавливаться после повреждающего воздействия. Определение процента жизнеспособных клеток позволяет сравнивать цитотоксичность материала; большее количество цитотоксических материалов вызывает более высокую гибель клеток при той же концентрации (рис. 3a и 3b). Сокращения, превышающие 30%, имеют решающее значение и определяют материалы с риском низкой биосовместимости (рис. 3a). Эта информация дополняется профилем гибели клеток (рис. 3a и 3b). В репрезентативных результатах более цитотоксические материалы характеризуются подчеркнутым снижением жизнеспособности клеток и поздним апоптозом и профилем некроза клеточной смерти (рис. 3a), в то время как менее цитотоксические представляют меньшую гибель клеток и более апоптотический и поздний апоптотический профиль (рис. 3b).
Информация, полученная в результате оценки клеточной морфологии (рис. 3c), дополняет оценку жизнеспособности клеток. Изменения типичной морфологии клетки могут указывать на апоптотический или некротический профиль16. Кроме того, из этого протокола можно получить дополнительную информацию, например, наблюдение за материальными частицами (красные стрелки, рис. 3C).
Специфические маркеры, имеющие основополагающее значение для функции клеток, на которые влияет воздействие экстракта, могут быть оценены несколькими методами, такими как иммуногистохимия, ПЦР, проточная цитометрия, блоттинг или колориметрические анализы (таблица 1). Репрезентативные результаты экспрессии DSP после воздействия экстрактов показаны на рисунке 4a, и можно видеть, что некоторые материалы (цементы силикатов трикальция) стимулируют клетки к увеличению экспрессии белка. Напротив, другие (цементы гидроксида кальция) способствуют значительному снижению экспрессии белка, независимо от потери жизнеспособности. В обоих случаях концентрация экстрактов напрямую влияет на экспрессию белка.
В клеточной линии MDPC-23 фенотипа одонтобласта характерно образование минерализационных отложений. Протокол идентификации и количественного определения минерализованных отложений позволяет оценить специфическую функцию этого типа специализированных клеток. В представленном случае было замечено, что помимо того, что трикальциевые силикаты цемента менее цитотоксичны, они стимулируют функцию клеток, как только наблюдалось увеличение минерализованных отложений (рис. 4b). Напротив, более цитотоксичный цемент гидроксида кальция приводил к уменьшению осаждения минералов из-за повреждения и гибели клеток (рис. 4b). В дополнение к качественной оценке может быть выполнено количественное определение (рис. 4c).

Рисунок 2: Метаболическая активность. Метаболическая активность клеток MDPC-23, обработанных растворимыми экстрактами гидроксида кальция [a)] и трикальциевого силикатного цемента [b)] в течение 24, 72 и 120 часов. Результаты нормализуются к контрольным клеточным культурам, со значением 100%. Значимые различия представлены символом *, где * означает p<0,05, ** означает p<0,01, а *** означает p<0,001. Часть этого рисунка была изменена по сравнению с предыдущей публикацией с разрешения издателя20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
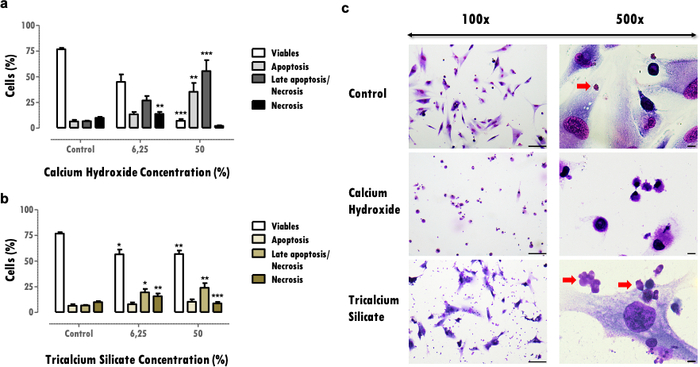
Рисунок 3: Жизнеспособность клеток, профиль смерти и морфология клеток. Жизнеспособность клеток, профиль клеточной смерти и морфология клеток в клетках MDPC-23, подвергнутых обработке гидроксидом кальция и биоматериалами из силиката трикальция в концентрации 6,25% и 50% после 120 часов воздействия. а) и б) Результаты отображаются в виде процента живых клеток в апоптозе, позднем апоптозе или некрозе и некрозе. Значимые различия в отношении контроля или между условиями представлены символом *, где * означает p <0,05, ** означает p <0,01, а *** означает p <0,001. в) Клетки, окрашенные препаратом May-Grünwald Giemsa после обработки 50% растворимыми экстрактами биоматериалов. Контрольная группа представляет клетки в культуре в DMEM с 10% FBS. Изображения в левом столбце были получены с увеличением 100x, а изображения в столбце справа были получены с увеличением 500x. Фигурные столбцы представляют 100 мкм. Часть этого рисунка была изменена по сравнению с предыдущей публикацией с разрешения издателя20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Экспрессия DSP и образование минерализованных конкреций. а) Клетки MDPC-23, меченные иммуноцитохимией для выявления экспрессии DSP при обработке гидроксидом кальция и силикатом трикальция в концентрациях 50% и 6,25% после 96 часов инкубации. б) Изображения культивируемых клеток MDPC-23, окрашенных красителем Alizarin Red S при обработке гидроксидом кальция и биоматериалами из трикальция силиката в концентрациях 50% и 6,25% после 120 часов инкубации. Все фотографии были получены с увеличением в 100 раз. Оба рисунка представляют собой 150 мкм. c) Образование отложений кальция из клеток MDPC-23, обработанных гидроксидом кальция и силикатом трикальция, после 120 часов воздействия. Результатом является соотношение поглощения образцов и контроля. Значимые различия представлены символом *, где * означает p<0,05, ** означает p<0,01, а *** означает p<0,001. Часть этого рисунка была изменена по сравнению с предыдущей публикацией с разрешения издателя20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Список одонтобластической дифференцировки/маркеровфункции 47-79. В этой таблице приведен список одонтобластных маркеров и методов обнаружения; Некоторые из этих маркеров также экспрессируются другими тканями.
| Ген или белок | Метод | Ссылки |
| Щелочная фосфатаза (ЩФ) | Колориметрический | 47 48 |
| Иммуноцитохимия | 20 49 | |
| Северный Блот | 50 | |
| ОТ-ПЦР | 51 52 | |
| Декорин (DCN) | Колориметрический ИФА | 53 |
| Иммуноцитохимия | 54 55 | |
| ОТ-ПЦР | 53 56 | |
| Белок дентинного матрикса 1 (DMP-1) | Проточная цитометрия | 57 |
| Иммуноцитохимия | 58 59 | |
| Северный Блот | 50 60 | |
| ОТ-ПЦР | 47 49 | |
| Вестерн-блоттинг | 50 60 | |
| Матричный белок дентина 2 (DMP-2) | Иммуноцитохимия | 60 61 |
| ОТ-ПЦР | 50 62 | |
| Северный Блот | 60 | |
| Вестерн-блоттинг | 62 | |
| Фосфопротеин дентина (DPP) | Иммуноцитохимия | 63 |
| Северный Блот | 63 | |
| Дентин сиалопротеин (DSP)* | Иммуноцитохимия | 20 60 |
| Северный Блот | 60 63 | |
| ОТ-ПЦР | 50 | |
| Вестерн-блоттинг | 64 65 | |
| Дентин сиалофосфопротеин (DSPP) | Проточная цитометрия | 57 |
| Иммуноцитохимия | 66 54 | |
| ОТ-ПЦР | 47 49 | |
| Северный Блот | 67 68 | |
| Вестерн-блоттинг | 64 62 | |
| Этизезин/матриксная металлопротеиназа-20 (ММП-20) | Северный Блот | 68 |
| ОТ-ПЦР | 49 68 | |
| Нестин | Иммуноцитохимия | 54 69 |
| ОТ-ПЦР | 70 71 | |
| Вестерн-блоттинг | 72 | |
| Остеоадгерин (OSAD) | Иммуноцитохимия | 73 74 |
| Северный Блот | 73 | |
| ОТ-ПЦР | 75 | |
| Вестерн-блоттинг | 73 74 | |
| Остеопонтин (ОПН) | Иммуноцитохимия | 76 |
| Северный Блот | 50 | |
| ОТ-ПЦР | 66 51 | |
| Вестерн-блоттинг | 77 | |
| Остеокальцин (OCN) | Иммуноцитохимия | 52 |
| Северный Блот | 50 | |
| ОТ-ПЦР | 51 52 | |
| Вестерн-блоттинг | 77 78 | |
| Osterix (OSX)/ Транскрипционный фактор Sp7 (Sp7) | Иммуноцитохимия | 54 58 |
| ОТ-ПЦР | 78 | |
| Вестерн-блоттинг | 78 79 | |
| Фосфат-регулирующий ген с гомологиями эндопептидазам на Х-хромосоме (Phex) | Северный Блот | 68 |
| ОТ-ПЦР | 49 68 | |
| Вестерн-блоттинг | 79 | |
| Транскрипционный фактор 2, связанный с Runt (Runx2) | Иммуноцитохимия | 66 52 |
| ОТ-ПЦР | 66 70 | |
| Вестерн-блоттинг | 62 77 | |
| *DPP и DSP являются продуктами расщепления DSPP. | ||
Обсуждение
Этот протокол был разработан с учетом стандарта ISO 10993-5, который относится к оценке цитотоксичности in vitro биоматериалов, контактирующих с тканями, для оценки биосовместимости и содействия воспроизводимости исследований21. Это вызывает растущую озабоченность в науке, и многие авторы уже следуют этим рекомендациям в экспериментальном дизайне своих исследований in vitro 15,22,23,24,25,26,27,28.
Предложенная методология была выбрана для скрининга наиболее актуальных аспектов клеточной биологии. Таким образом, этот протокол выходит за рамки рекомендаций, поскольку он обеспечивает полный подход к оценке цитотоксичности с использованием общих анализов и дополнительной оценки, включая несколько параметров клеток от фенотипа до функции. Эта дополнительная оценка важна для истинной оценки эффекта биоматериала, когда жизнеспособность может не транслировать изменения на уровне экспрессии генов и белков, клеточного цикла или секретома.
Экстракты являются преимущественными, особенно в адгезивных клеточных линиях, поскольку нет вмешательства в прикрепление клеток к субстрату и оптимальные условия культивирования, в отличие от некоторых подходов прямого контакта, когда материалы помещаются на поверхность культуральной пластины22,28.
Кроме того, экстракты позволяют клеткам подвергаться воздействию различных концентраций29, имитируя диффузию веществ в тканях, что имитирует клиренс, который они получают in vivo, особенно когда они применяются в контакте с чрезвычайно орошаемыми тканями. Тесты с прямым контактом могут неточно оценивать различные концентрации, а тесты с непрямым контактом продемонстрировали потенциальные трудности с недиффузией, неполной диффузией через мембраны или реакцией с агаром.
Предпочтительными являются тесты, обеспечивающие количественную оценку, при этом снижение жизнеспособности клеток более чем на 30% считается цитотоксическим11,30. При разработке новых биоматериалов, если такое сокращение происходит, оно определяет необходимость переформулировки или отказа от них. Если будут достигнуты обнадеживающие результаты, следует провести дальнейшие исследования, предусматривающие оценку in vivo29,31.
Тесты in vitro должны имитировать или преувеличивать клинические состояния. Таким образом, определение соответствующих соотношений поверхностного объема для приготовления экстракта имеет решающее значение. Было предложено соотношение поверхности к объему 1,25–6 см2 / мл. В случае материалов с неровностями поверхности, таких как пенопласты, 0,1–0,2 г/мл или6 см2/мл являются отправной точкой 15,20,2. Соотношение 250мм2на мл среды использовалось в репрезентативных результатах, использованных в этом протоколе и других исследованиях15,20.
Даже если образцы не используются таким образом в клиниках, они должны быть стерилизованы методами, которые не изменяют их свойства. УФ-облучение часто является хорошим выбором. Это имеет первостепенное значение для предотвращения микробного загрязнения клеточных культур 11,24,32.
Экстракционные среды включают среду для культивирования клеток с сывороткой или без нее, физиологический раствор физиологического раствора, диметилсульфоксид или очищенную воду, выбранную в соответствии с химическими характеристиками биоматериалов11,33. Для исследований клеточных культур предпочтительным является использование среды для культивирования клеток, поскольку это позволяет избежать дальнейших этапов обработки. Условия экстракции должны быть адаптированы к экспериментальной модели. В репрезентативных результатах, показанных в этом протоколе, питательная среда DMEM с добавлением FBS использовалась в течение 24 ± 2 часов при 37 ± 1 °C.
Некоторые биоматериалы могут оставлять остатки в экстракционных средах, что может негативно повлиять на клеточные культуры. Хотя фильтрации и центрифугирования следует избегать, перед использованием частиц можно дать частицам осаждение. Другой проблемой является рН, который может измениться после экстракции. Поскольку не рекомендуется выполнять дальнейшие корректировки11, рН экстрактов должен быть измерен, зарегистрирован, и при необходимости в экспериментальный план должны быть включены дополнительные средства контроля для выделения эффекта рН.
Хотя этот протокол был описан для адгезивных клеточных культур, простые модификации могут быть выполнены для использования суспензионных культур. Аналогичным образом, помимо использования твердых биоматериалов, можно адаптировать процедуру, по существу этапы экстракции, для изучения жидкостей, гелей или пен34,35,36,37.
Подготовка клеточных культур с соответствующей плотностью имеет решающее значение, особенно на клеточных культурах с высокой скоростью дупликации31. В соответствии с рекомендуемым диапазоном плотности посева используемых клеток, если планируется длительная инкубация, необходимо выполнить снижение начальной плотности посева, чтобы избежать проблем, связанных с чрезмерным слиянием. Кроме того, для высокоцитотоксичных материалов может потребоваться более высокая начальная плотность посева.
Помимо преимуществ методики экстракта, это не лучший выбор для материалов, где актуальна оценка клеточной адгезии. В этом случае необходимо провести исследования прямого контакта 38,39,40,41. Хотя это комплексный подход, важно иметь в виду, что это оценка in vitro, которая не полностью отражает условия in vivo42.
Биоматериал должен не только вызывать повреждение тканей, но и стимулировать некоторые противовоспалительные и иммуномодулирующие процессы43,44,45,46. Таким образом, этот протокол идет дальше, с оценкой клеточных механизмов, включая жизнеспособность клеток и профиль гибели клеток, а также другие механизмы синтеза белка. Проведенная оценка должна позволить сделать вывод о биологической активности биоматериала в живых тканях, помимо цитотоксичности.
С появлением новых материалов для медицинского применения не только в стоматологии, но и в ортопедии, хирургии, офтальмологии, кардиологии и т. д., первоначальные скрининги должны проводиться систематически. Этот протокол может стать важным инструментом для исследователей, стремящихся разработать и охарактеризовать новые биоматериалы.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов или других конфликтов интересов.
Благодарности
Мы благодарим за поддержку: GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); CIBB финансируется из национальных фондов через FCT (Фонд науки и технологий) в рамках стратегических проектов UIDB/04539/2020 и UIDP/04539/2020 (CIBB). Мы благодарим Жака Нёра из стоматологической школы Мичиганского университета за предоставление клеточной линии MDPC-23.
Материалы
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Ссылки
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены