Method Article
Культура и анализ крупномасштабных смешанных популяций Caenorhabditis elegans
В этой статье
Резюме
Чтобы использовать Caenorhabditis elegans (C. elegans)в исследованиях омики, необходим метод генерации больших популяций червей, где один образец может быть измерен на разных платформах для сравнительного анализа. Здесь представлен метод культивирования популяций C. elegans на крупномасштабных культурных пластинах (LSCP) и документирования роста популяции.
Аннотация
Caenorhabditis elegans (C. elegans)был и остается ценным модельным организмом для изучения биологии развития, старения, нейробиологии и генетики. Большой объем работ по C. elegans делает его идеальным кандидатом для интеграции в исследования больших популяций, цельных животных для препария сложных биологических компонентов и их отношений с другим организмом. Чтобы использовать C. elegans в совместных исследованиях омики, необходим метод создания больших популяций животных, где одна выборка может быть разделена и проанализирована на различных платформах для сравнительного анализа.
Здесь представлен способ культивирования и сбора обильной смешанной популяции C. elegans на крупномасштабной культурной пластине (LSCP) и последующие фенотипические данные. Этот конвейер дает достаточное количество животных для сбора фенотипических и популяционных данных, а также любых данных, необходимых для экспериментов по омике (т. Е. Геномика, транскриптомика, протеомика и метаболомика). Кроме того, метод LSCP требует минимальных манипуляций с самими животными, меньшего времени на подготовку пользователя, обеспечивает жесткий экологический контроль и гарантирует, что обработка каждого образца последовательна на протяжении всего исследования для общей воспроизводимости. Наконец, представлены методы документирования размера популяции и распределения популяции стадий жизни C. elegans в данном LSCP.
Введение
C. elegans — небольшая свободноживущая нематода, которая встречается по всему миру в различных природных местахобитания 1. Его относительная легкость роста, быстрое время генерации, система размножения и прозрачное тело делают его мощным модельным организмом, который широко изучался в биологии развития, старении, нейробиологии и генетике2,3. Обильная работа над C. elegans делает его основным кандидатом для использования в исследованиях -омики для всесторонней связи фенотипов со сложными биологическими компонентами и их взаимоотношениями в данном организме.
Чтобы использовать C. elegans в совместных исследованиях омики, необходим метод создания больших смешанных популяций животных, где один образец может быть разделен и использован на различных платформах и инструментах для сравнительного анализа. Создание конвейера для создания такой выборки требует глубокой осведомленности о диете, окружающей среде, стрессе, структуре популяции, а также обработке и сборе образцов. Поэтому крайне важно, чтобы стандартные и воспроизводимые условия культивирования были интегрированы в крупномасштабные трубопроводы. В исследованиях C. elegans для культивирования червей используются два традиционных метода – чашка агара Петри и жидкая культура4.
Исторически сложилось так, что когда требовалось большое количество C. elegans, их выращивали в жидкой культуре4. Этапы, связанные с созданием большой популяции червей в жидкой культуре, требуют нескольких этапов обработки, которые часто включают синхронизацию отбеливателя для разрыва гравидной кутикулы взрослого человека, высвобождения эмбрионов для достижения желаемого размера популяции. Однако при использовании синхронизации отбеливателя рост численности населения зависит от начального размера переписи и, следовательно, влияет на последующий рост и численность населения. Кроме того, штаммы C. elegans различаются по чувствительности кутикулы, времени воздействия и реакции на стресс на синхронизацию отбеливателя, что затрудняет анализ многих штаммов одновременно5,6,7,8,9.
Кроме того, рост червей в жидкой культуре требует нескольких этапов переноса, так как часто рекомендуется выращивать только одно поколение червей перед сбором урожая, потому что перенаселенность может легко произойти, если выращивать в течение нескольких поколений и привести к образованию дауэра, несмотря на наличие пищи10. Образование Дауэра происходит через небольшие сигнальные молекулы, такие как аскарозиды, часто называемые «феромонами Дауэра»11,12,13,14,высвобождаются в жидкие среды и влияют на рост популяции. Кроме того, выращивание больших популяций червей в жидкой культуре приводит к избыточному накоплению бактерий в культуре, создавая трудности, когда требуется чистый образец для последующего фенотипического анализа. Наконец, когда жидкая культура загрязняется, ее труднее поддерживать, так как споры грибов или бактериальные клетки легко рассеиваются по всей среде15.
Другим традиционным методом выращивания C. elegans является чашка агара Петри. Коммерчески доступные чашки Петри позволяют легко выращивать несколько поколений червей смешанной стадии без быстрых последствий перенаселенности и высокой формации дауэра, как это видно в жидких культурах. Тем не менее, недостатком роста червей на традиционных чашках Из агара Петри является то, что самая большая коммерчески доступная чашка Петри не дает больших популяций червей для исследования -omics без добавления этапа синхронизации отбеливателя. Таким образом, культивирование смешанных популяций C. elegans на чашках агара Петри больше подходит для сбора данных о омиксе, но нам потребовался метод генерации очень больших размеров популяции без культивирования жидкости.
Здесь мы представляем способ культивирования и сбора больших смешанных популяций C. elegans на крупномасштабных культурных пластинах (LSCP). Сбор образцов через этот конвейер дает достаточно образцов для сбора фенотипических и популяционных данных, а также любых данных, необходимых для экспериментов с омикой(т.е.геномики, транскриптомики, протеомики и метаболомики). Кроме того, метод LSCP требует минимальных манипуляций с животными, меньшего времени на подготовку пользователя, обеспечивает жесткий экологический контроль и гарантирует, что обработка каждого образца согласована на протяжении всего исследования для общей воспроизводимости.
протокол
1. Стерилизуйте LSCP и оборудование
- Подготовьте стеклянные ЛСМП путем мытья рук, а затем мытья посуды и последующего автоклавирования, чтобы убедиться, что стеклянная посуда не содержит загрязнений перед началом эксперимента. Храните автоклавные ЛССП в чистом сухом месте до тех пор, пока они не будут использоваться.
ПРИМЕЧАНИЕ: Убедитесь, что ЛССП безопасны для посудомоечной машины и автоклава. Убедитесь, что крышки LSCP безопасны для посудомоечной машины. - Приготовьте крышки LSCP путем мытья рук с последующим мытьем посуды. Храните крышки LSCP в чистом бункере до тех пор, пока это не понадобится.
- В день подготовки Nematode Growth Media Agarose (NGMA) дважды протрите крышки LSCP 10% раствором отбеливателя, а затем 70% этанолом. После протирания 10% отбеливателем и 70% этанолом храните крышки LSCP в чистом бункере в ламинарном вытяжке, где будет подготовлен NGMA.
2. Подготовьте нематодные среды роста агарозы (НГМА)
- Приготовьте NGMA, соединив следующие реагенты в автоклавную колбу Эрленмейера 2 л с перемешиванием на перемешиваемой пластине: 2,5 г пептона, 3 г NaCl, 7 г агарозы, 10 г агара и 975 мл стерильнойводы 16. Убедитесь, что общий объем равен 1 л. Приклеите к колбе крышку из фольги.
ПРИМЕЧАНИЕ: Этапы подготовки к NGMA, как описано здесь, дадут достаточно материала для 2,5 ЛССП. Протокол может быть адаптирован к необходимому размеру пакета LSCP в данном эксперименте. - Автоклав на жидком цикле при 121 °C и 21 p.s.i. в течение 45 мин.
- Включите водяную баню и установите на 50 °C. Поднесите автоклавную NGMA на водяную баню, чтобы остыть до 50 °C.
- Возьмите с собой в вытяжку или очищенное пространство 2 л колбы Erlenmeyer NGMA и установите на перемешиваемую пластину. Используйте термометр для отслеживания температуры NGMA.
- После того, как НГМА достигнет 50 °C, добавьте следующее в порядке, указанном со стерильной одноразовой пипеткой внутри капота или очищенного пространства: 25 мл 1 M KH2PO4 (K-фосфатный буфер), 1 мл холестерина (5 мг / мл в этаноле), 1 мл 1 M CaCl2,1 мл 1 M MgSO4,1 мл нистатина (10 мг / мл) и 1 мл стрептомицина (100 мг / мл)16.
- Налейте 400 мл NGMA в стерильное стекло LSCP, глубиной около 1,3 см, позвольте LSCP затвердеть на плоской поверхности в капоте и поместите крышку автоклавной фольги обратно на LSCP.
- После того, как агар установлен, снимите фольгу, поместите чистую воздухонепроницаемую крышку на LSCP и переместите до 4 ° C для хранения. Храните NGMA в ЛСКП при 4 °C до использования и в течение 5 дней.
3. Генерация пищи E. coli для NGMA на LSCP
- Чтобы генерировать стабильный источник пищи, генерируйте партии HT115 (DE3) E. coli, используя концепцию усреднения небольших партий, согласующуюся с центральной предельной теоремой17. Хранить при -80 °C. При необходимости вытяните бактериальный запас (стаи) E. coli от -80 °C до оттаивания18.
ПРИМЕЧАНИЕ: В этом протоколе бактериальные запасы E. coli выращивались в биореакторе. В конце роста культуры культуру разбавляли 1:50, а измеренный OD600 составлял 0,4. Таким образом, культура имела эффективный OD600 из 20. Бактерии гранулировали, взвешивали и повторно суспендировали в К-среде в концентрации 0,5 г/мл (живой вес), переносили в 2 мл аликвоты и замораживали19.
4. Бактериальный газон на NGMA
- Доведите NGMA LSCP от 4 ° C до комнатной температуры (RT) в течение нескольких часов перед распространением бактериального газона, чтобы весь LSCP достиг RT.
- Вытащите необходимый бактериальный запас (ы) E. coli от -80 °C до оттаивания18.
- Разбавить бактериальный запас (бактерии) E. coli 2 мл стерильной K-среды для достижения 0,5 г E. coli в 4 мл на NGMA LSCP. Осторожно пипетку 4 мл E. coli в середине NGMA LSCP.
- Используйте стерильный разбрасыватель для распространения бактерий в прямоугольник, оставляя примерно 3,8 см пространства по краям NGMA E. coli без.
- Оставьте NGMA LSCP с E. coli в капоте с вентилятором в течение 1 ч, чтобы убедиться, что суспензия E. coli полностью высохнет.
- Как только бактериальный газон высохнет, плотно надавите на крышку и храните при 4 °C до использования.
5. Кусковые черви для снижения стресса и возрастной изменчивости в разных образцах
- Полосы червей от замороженного червячного бульона до вновь посеянных 6 см пластины4. Эта тарелка будет служить в качестве тарелки «мастер-кусок».
ПРИМЕЧАНИЕ: Дробление является оптимальным методом переноса червей из гомозиготного штамма20. Если штамм гетерозиготный или нуждается в поддержании путем сбора и спаривания, дробление не рекомендуется. Частота дробления, возможно, потребуется оптимизировать в зависимости от используемых генотипов червей, температуры, выбранной для роста, и последующих шагов. - После того, как главная тарелка куска будет заполнена здоровыми взрослыми гравидами (примерно 3 дня) с большим количеством газона E. coli, следуйте стандартным рекомендациям по дроблке C. elegans, как описано в WormBook, чтобы произвести четыре общие кусковые пластины4.
- Храните все кусковые пластины в помещении с контролируемой температурой (КТ) при температуре 20 °C, если не указано иное для роста.
ПРИМЕЧАНИЕ: Если пользователи этого протокола не имеют доступа к кабинету КТ, как описано здесь, рекомендуется использовать либо небольшой инкубатор, где можно контролировать температуру, либо специально отведенное помещение, где условия окружающей среды могут контролироваться максимально. Если ни один из этих альтернативных вариантов недоступен, обратите внимание, что вариации в росте выборки могут быть больше. - Как только в4-й пластине будет наблюдаться много гравидных взрослых особей, перейдите к шагу 6.
6. Пятнистое отбеливание взрослых на LSCP
ПРИМЕЧАНИЕ: Этот метод отбеливания используется для уничтожения большинства загрязняющих веществ и растворения кутикулы гермафродитов, высвобождающих эмбрионы от взрослого червя. Раствор отбеливателя будет впитываться в NGMA до вылупления эмбрионов.
- Выведите LSCP на RT в течение нескольких часов, прежде чем пятно отбеливать червей.
- Приготовьте соотношение 7:2:1 ddH2O : отбеливатель: 5 M NaOH. Сделайте этот щелочной раствор гипохлорита свежим непосредственно перед использованием.
ПРИМЕЧАНИЕ: Используйте один и тот же запас отбеливателя и NaOH в течение всего периода эксперимента, чтобы избежать воздействия партии отбеливателя. Отбеливатель, используемый в этом протоколе, представлял 5-10% гипохлорита натрия. - Зажгите горелку Бунзена и зажгите червячок, прежде чем продолжить. Зачерпните свежую кишечную палочку на стерильную кирку с края бактериального газона на LSCP.
- Выберите одну взрослую особь из4-й пластины для точечного отбеливания.
- Пипетка 5 мкл раствора щелочного гипохлорита в один угол LSCP вдали от газона E. coli.
- Поместите отобранную взрослую особь в раствор щелочного гипохлорита 5 мкл. Постучите по нематоде, чтобы помочь разрушить кутикулу и выпустить яйца.
- Повторите шаги 6,4 – 6,6 в общей сложности 4 раза и равномерно разместите 5 взрослых особей вокруг газона E. coli. Выберите всех 5 взрослых гравидов из одной и той же4-й пластины, чтобы убедиться, что почти генетически изогенные особи добавлены к данному образцу.
- Поместите крышку обратно на LSCP.
- Повторите шаги для всех ЛССП.
7. Рост червей в помещении с контролируемой температурой (КТ)
- После точечного отбеливания плотно поместите крышку на LSCP и поместите в комнату КТ, установленную на 20 ° C с постоянным воздушным потоком и фотопериодом 12L: 12D (12-часовый свет и 12-ч темнота).
- Обратите внимание на время и положение, когда образец был помещен в кабинет КТ.
ПРИМЕЧАНИЕ: Положение в помещении всегда должно быть задокументировано для регистрации любых различий в окружающей среде, с которыми могут столкнуться образцы, которые потенциально могут возникнуть во время роста. Как только образец находится в кабинете КТ, он должен оставаться в назначенном месте нетронутым. Не открывайте крышку LSCP в комнате КТ, чтобы уменьшить вероятность загрязнения. - Отнесем LSCP к микроскопу, за пределами КТ-зала, чтобы наблюдать за ростом и плотностью населения.
ПРИМЕЧАНИЕ: Каждый штамм и образец C. elegans будут различаться по своему росту, поэтому внимательно следите за образцами. Хотя рекомендуется не нарушать рост LSCP во время пребывания в кабинете КТ, ЛСКП транспортировались из комнаты КТ, а крышки открывались каждые 2 дня для мониторинга роста образца. Снятие герметичных крышек с ЛСКП каждые 2 дня также позволяет O2 поступать в LSCP. - Перед сбором урожая убедитесь, что LSCP стал полон большой популяции червей. Используйте следующие критерии, чтобы решить, готов ли LSCP к сбору.
- Убедитесь, что LSCP полон гравидных взрослых червей.
- Убедитесь, что пластина содержит большой размер популяции (т.е. черви покрывают всю поверхность агара).
- Убедитесь, что на пластине не так много яиц на поверхности агара(т.е.должно было вылупиться максимальное количество червей).
- Убедитесь, что на пластине не осталось ни кишечной палочки, что указывает на то, что черви будут голодать и генерировать личинок дауэра, если их оставить на пластине еще на два дня.
ПРИМЕЧАНИЕ: Хотя большинство ЛСКП готовы к сбору урожая от 10 до 20 дней, в зависимости от штамма и образца, часто проверяйте каждый LSCP после установления этого протокола, чтобы определить нормальное время сбора урожая.
- Очистите перчатки и область с 70% этанолом между обработкой ЛССП, чтобы избежать перекрестного загрязнения между штаммами.
8. Сбор образца LSCP
- Включите и дайте центрифуге остыть до 4 °C перед сбором образцов.
- Подготовьте три конические трубки по 50 мл с 50 мл раствора M9 на LSCP для сбора.
- Наклеить одну коническую трубку 15 мл на LSCP.
ПРИМЕЧАНИЕ: Все этапы центрифугирования выполняются в конической трубке 15 мл, потому что черви, как правило, хорошо гранулируются в этих трубах. - Вылейте 50 мл раствора M9 (из одной конической трубки объемом 50 мл на шаге 8.2) на поверхность LSCP и закрутите вокруг, чтобы гарантировать, что M9 покрывает всю поверхность NGMA.
- В то время как M9 сидит на поверхности LSCP, загрунтуют стерильную серологическую пипетку M9.
ПРИМЕЧАНИЕ: Заправляя стерильную серологическую пипетку M9, это гарантирует, что меньше червей прилипнет к внутренней части пластиковой пипетки, предотвращая потерю образца. - Наклоните LSCP так, чтобы M9 и популяция червей собрались в одном углу LSCP.
ПРИМЕЧАНИЕ: Смесь раствора M9 и червей из LSCP будет называться "суспензией червя" на последующих этапах. - Используя загрунтованную серологическую пипетку с автоматическим пипеттором, пипетку суспензию червя и поместите в оригинальную коническую трубку 50 мл. После того, как собрано 50 мл суспензии червя, поместите коническую трубку на коромысло, чтобы разрушить скопления бактерий и мусор.
- Повторите шаги 8.4 - 8.7, собирая 150 мл суспензии червя на LSCP.
- Переложите 15 мл суспензии червя из одной из трех конических трубок по 50 мл, путем заливки в меченую коническую трубку размером 15 мл, отведенную на этапе 8.3. Центрифугировать коническую трубку 15 мл при 884 х г в течение 1 мин при 4 °C. Большинство червей будут гранулированы в нижней части трубки.
- Аспирировать супернатант, чтобы не потревожить гранулу червя.
- Продолжайте добавлять приблизительно 13 мл червячной суспензии в ту же 15 мл коническую трубку, повторяя шаги 8,9 и 8,10 до тех пор, пока не будут израсходованы все 150 мл суспензии червя. Перевернуть трубку и потревожить гранулу между центрифугациями, чтобы смыть и аспирировать как можно больше бактерий и мусора.
ПРИМЕЧАНИЕ: На этом этапе содержимое всех трех конических трубок объемом 50 мл конденсируется в одной трубке объемом 15 мл. - Добавьте 10 мл чистого M9 в коническую трубку 15 мл и перемешайте гранулу червя путем инвертирования. Центрифугировать коническую трубку 15 мл при 884 х г в течение 1 мин при 4 °C. Аспирировать супернатант, чтобы не потревожить гранулу червя. Повторите дважды.
ПРИМЕЧАНИЕ: Если в образце находится большое количество мусора или бактерий, повторяйте шаг 8.12 до тех пор, пока образец не будет очищен. - Как только образец будет очищен, добавьте ddH2O к грануле червя, в общей сложности 10 мл ddH2O и червей. Перемешиваем гранулы червя путем инвертирования. Быстро переходите к шагу 9.1, так как черви должны оставаться в ddH2O в течение 5 мин или менее, чтобы избежать осмотического напряжения.
ПРИМЕЧАНИЕ: Суспендирование гранул червя в ddH2O является предпочтительным растворителем для последующих этапов омики. Черви могут быть суспендированы в других растворителях или буферах, если они совместимы с данным экспериментальным рабочим процессом.
9. Оценка численности населения
ПРИМЕЧАНИЕ: Быстрое прохождение шагов 9.1 – 9.7. Смесь ddH2O и червей на этапе 8.13 называется «образцом червя» на последующих этапах.
- Перед пипеткой образца червя необходимо использовать основной наконечник пипетки с M9, чтобы избежать прилипания червей к внутренней части пластиковой пипетки, предотвращая потерю образца и уменьшая вариации количества.
- Возьмите 100 мкл аликвоты образца червя и разбавьте его в 900 мкл M9. Хорошо перемешать и сделать последовательное разведение (1:10, 1:100, 1:1000). Повторите этот шаг дважды, чтобы получить в общей сложности три набора аликвотных реплик.
ПРИМЕЧАНИЕ: Пипетирование червей может вызвать высокую изменчивость в подсчете выборки популяций. Убедитесь, что образец червя однородный, прежде чем пипетировать нужную аликвоту. - Установите коническую трубку 15 мл на коромысле, чтобы продолжить перемещение культуры, пока аликвоты подсчитываются.
- Убедитесь, что образец червя хорошо перемешан и однородн. Пипетка 5 мкл из образца червя 1:10, дозируют его на слайд микроскопии и подсчитывают количество червей. Если это число меньше примерно 50 червей, то также посчитайте 1:100 и 1:1000 разведения. Если она больше 50, переходите к следующему серийному разведению.
ПРИМЕЧАНИЕ: Если слишком много червей не может быть точно подсчитано, используйте следующее последовательное разбавление для подсчета. - Подсчитайте каждую аликвотную реплику каждого разведения в 3 раза. В конце подсчета для большинства культур будет задокументировано 9 общих подсчетов(т.е.3 общих подсчета для каждой аликвотной репликации).
- Усреднение количества разбавления для определения предполагаемого размера популяции образца червя. Эти подсчеты разбавления будут определять объем образца червя, необходимый для создания желаемого размера аликвоты для шагов -omics.
ПРИМЕЧАНИЕ: В этом эксперименте были сгенерированы аликвоты примерно 200 000 червей смешанной стадии. Кроме того, одна аликвота из примерно 50 000 червей смешанной стадии была отведена для сортировки в цитометре с большим потоком частиц (описанном на этапе 10). - После того, как образец червя был разделен на соответствующие аликвоты, мгновенно заморозьте в жидком азоте и храните образец при -80 °C.
ПРИМЕЧАНИЕ: Не замораживайте аликвоту, предназначенную для цитометрии потока крупных частиц.
10. (Опционально) Подготовка образца для цитометрии потока крупных частиц
ПРИМЕЧАНИЕ: Шаги 10, 11 и 12 являются предпочтительным методом авторов для регистрации роста выборки(т.е.размера популяции и распределения популяции стадий жизненного цикла C. elegans) и определения успеха культуры. Пользователи этого протокола могут заменить дополнительные шаги 10, 11 и 12 своими собственными показателями успеха роста. Шаги 10, 11 и 12 описаны здесь по двум причинам; Во-первых, чтобы пользователи, у которых есть оборудование, используемое на шагах 10, 11 и 12, могли воспроизвести эти шаги, а во-вторых, чтобы показать проверку этого метода роста. Шаг 9 выше обеспечивает хорошую оценку общего числа червей для определения размеров аликвоты, а шаг 10 является более количественной метрикой для оценки количества и распределения червей в популяции в данной выборке.
- Доведите аликвоту приблизительно 50 000 червей смешанной стадии (отложенных на шаге 9.6) до 10 мл общего объема в растворе M9.
- Делают раствор, состоящий из 1 мг/мл E. coli и разбавления 1:50 0,5 мкМ красных флуоресцентных микросфер19.
- Добавьте 200 мкл этого раствора к 10 мл червей смешанной стадии в M9 и инкубировать во время раскачивания в течение 20 мин.
- Через 20 мин центрифугируют коническую трубку 15 мл при 884 х г в течение 1 мин при 4 °C.
- Аспирировать супернатант, чтобы не потревожить гранулу червя.
- Дважды промыть гранулу червя раствором М9 для устранения избытка бактерий и красных флуоресцентных микросфер.
- Добавьте 5 мл M9 в червячную гранулу и убедитесь, что гранула выглядит чистой. Если гранула чистая, добавьте 5 мл M9 с 50 мМ азида натрия, чтобы выпрямить и убить червей для точного подсчета и определения размера21.
- Документируйте время и дату добавления азида натрия в образец.
- Отложите образец в сторону на коромысле до тех пор, пока это не понадобится для цитометрии потока крупных частиц.
ПРИМЕЧАНИЕ: Известно, что азид натрия влияет на физиологию нематод(т.е.на длину тела, метаболизм и термотолерантность). Поэтому важно отметить время, в течение которого черви подвергаются воздействию азида натрия, так как многие из этих физиологических воздействий происходят в течение нескольких минут22. Из-за известных физиологических эффектов азида натрия на червей, это лечение повлияет на качество изображения и должно быть рассмотрено.
11. (Необязательно) Документирование распределения популяции и подготовка 384-скважинной пластины для визуализации
ПРИМЕЧАНИЕ: На этапе 11 используется цитометр потока больших частиц (LPFC). Базовые знания LPFC предполагаются в этом протоколе. Другие методы могут быть заменены для документирования роста и распределения выборок населения. Шаги, описанные здесь, предназначены для пользователей, которые планируют использовать LPFC в своем конвейере23.
- Включите, очистите и загрунтуйте LPFC, а также дайте лазеру (лазерам) нагреться в течение 1 часа перед сортировкой образцов.
- После того, как лазер нагреется, откройте профиль и шкалу«Гистограмма»до времени полета (TOF) 2050 года.
- Добавьте область бара в"Гистограмму",охватывающую диапазон TOF 100. Первая область бара охватывает TOF 50-150.
- Продолжайте создавать двадцать областей бара, каждая из которых охватывает диапазон TOF 100. Эти барные области будут охватывать весь диапазон TOF от 50 до 2050 года. В дополнительной таблице 1 приведены точные закрытые регионы, используемые в распределении TOF.
- Сохраните эту гистограмму, настроенную как«Эксперимент»для использования в будущих запусках LPFC.
- Выберите калиброванную 384-скважинную пластину или калибруйте прибор на пластину с 384 скважинами для дозирования объектов.
- После того, как вы попали в калиброванный шаблон пластины на 384 скважины, установите шаблон для распределения 20 закрытых объектов в четыре скважины (четыре технические копии каждой закрытой области) для каждой из областей 20 бар, созданных на этапах 11.3-4. В дополнительной таблице 2 приведен пример того, как дозировать червей в 384-скважинную пластину.
- Перенесите образец со ступени 10.9 в коническую пробирку объемом 50 мл и добавьте дополнительный раствор M9 для достижения общего объема примерно 40 мл.
- Начните автоматическую сортировку образца по параметрам, заданным на шаге 11.7, при этом непрерывно перемешивая образец, чтобы предотвратить осаждение и одновременное дозирование объектов из образца в калиброванную пластину из 384 скважин.
ПРИМЕЧАНИЕ: Убедитесь, что расход LPFC работает в диапазоне от 15 до 20 объектов в секунду, и укажите отсутствие двойников для сортировки. - После того, как весь образец был отсортирован и максимальное количество закрытых областей было распределено в пластину с 384 скважинами, сняйте образец с LPFC и очистите инструмент.
ПРИМЕЧАНИЕ: Когда достигаются более крупные регионы TOF, может возникнуть проблема с продолжением заполнения плиты из 384 скважин из-за низкого количества событий в этом регионе TOF. Заполните как можно больше закрытых областей, чтобы получить лучшее представление о том, где жизненные стадии C. elegans попадают в распределение LPFC до того, как иссякнуть образец. - Поместите уплотнителяющую пленку поверх пластины из 384 скважин до получения изображения.
ПРИМЕЧАНИЕ: Изображение пластины как можно быстрее после сортировки, потому что образцы обрабатываются азидом натрия22. Красные флуоресцентные микросферы можно увидеть в собранных файлах данных LPFC(т.е. данные PH Red в выходном текстовом файле) на основе уровня красной флуоресценции, испускаемой в каждом отсортированном объекте, чтобы помочь определить, какие объекты являются живыми червями, мертвыми червями, дауэрами или мусором24.
12. (Опционально) Визуализационные 384-скважинные пластины
ПРИМЕЧАНИЕ: На шаге 12 используется микроконфокальный микроскоп с пластинчатым считыванием. Базовые знания микроконфокального микроскопа предполагаются в этом протоколе. Другие методы могут быть заменены для документирования роста и распределения выборок населения.
- Использование микроконфокального микроскопа с пластинчатым чтением с 20-кратным объективом.
- Откройте вкладку«Объектив и камера»и установите режим«10x Plan ApoLambda».
- Откройте вкладку"Биннинг камеры"и установите значение "2".
- Откройте вкладку«Сайты для посещения на тарелке»и установите«4»сайтов на скважину и«Перекрывающие сайты 10%»,чтобы позже сшить вместе изображения.
- Откройте вкладку«Длина волны»и установите значение«Брайтфилд 1».
- Откройте вкладку«Освещение»и установите значение«Пропускаемый свет, яркий образец».
- Поместите 384-скважинную пластину в микроскоп и установите«Z Stack»на«Calculate Offset»и найдите правильную фокальную плоскость для образцов в пластине с 384 скважинами.
- Запустите 384-скважинную пластину на микроконфокальном микроскопе, собирая четыре изображения на скважину.
- Монтаж четырех изображений вместе, чтобы создать одно изображение на скважину.
Результаты
Рост C. elegans с использованием метода LSCP дает в среднем около 2,4 миллиона червей смешанной стадии на образец в течение 12,2 дней. Рост C. elegans с использованием метода LSCP позволяет пользователям генерировать большие смешанные популяции C. elegans с небольшим обращением и манипулированием животными, что идеально подходит для крупномасштабных исследований омики(рисунок 1). Как только LSCP наполняется взрослыми червями, достигает большого размера популяции и имеет минимальное количество оставшихся бактерий, пользователи могут собирать и оценивать размер популяции. Эта точка также может служить контролем качества, оценивая, достаточно ли популяции для использования в конвейере -omics(рисунок 2). Динамика популяции зависит от самого штамма, поведения штамма(т.е.роющие штаммы, как правило, имеют более низкое восстановление червей) и успеха роста(т.е.загрязнение). Метод LSCP был протестирован на 15 штаммах C. elegans, содержащих смесь мутантов Caenorhabditis Genetics Center (CGC) и Caenorhabditis elegans Natural Diversity Resource (CeNDR) диких штаммов25. Генотипы штаммов описаны в Дополнительной таблице 3.
Метод LSCP дал размеры популяции от примерно 94 500 до 9 290 000. Средний размер популяции в пределах эталонного штамма PD1074 и по всем штаммам составлял примерно 2,4 миллиона червей(рисунок 3). Не было обнаружено существенных различий в предполагаемых размерах популяции между штаммами C. elegans в течение в среднем 12,2 дней роста LSCP(рисунок 4). PD1074 LSCP потребовалось от 10 до 14 дней, чтобы вырасти до полной смешанной популяции. Среднее время роста PD1074 составило 10 дней. Самый медленно растущий штамм рос максимум 20 дней, а самый быстрорастущий штамм рос минимум 10 дней(рисунок 4).
Поэтому, используя этот метод LSCP, пользователи могут легко интегрировать новые штаммы, представляющие интерес, в исследование с небольшим знанием сроков развития и фонового опыта. Обратите внимание, что штаммы и фенотипы, которые должны поддерживаться путем сбора, имеют дефекты плодовитости, являются гетерозиготными или имеют дефекты роста, могут не работать хорошо в этом конвейере.
Цитометрия потока больших частиц и визуализация образцов позволяет пользователям документировать распределение популяций. Для измерения успешного роста населения можно использовать широкий спектр платформ.
Для воспроизводимых измерений -омики важно выращивать последовательные культуры. Метриками воспроизводимости культуры являются количество червей и последовательное распределение размеров для данного штамма. Мы показываем распределение образцов для эталонного штамма PD1074 – варианта оригинального штамма N2 Bristol, используя изображения LPFC23,26 и микроконфокального микроскопа в качестве прокси для успеха роста. Поскольку черви были измерены от стадии L1 через гравидную взрослую особь на распределении LPFC(рисунок 5),последующую визуализацию(рисунок 6)и вариацию распределения популяции пообразцам (рисунок 7),мы можем видеть, что этот конвейер генерировал смешанно-стадийную популяцию C. elegans.
Чтобы более подробно рассмотреть распределение популяций наших образцов смешанной стадии, мы рассмотрели распределение 35 PD1074 LSCP, посмотрев на процент червей, которые попадают в каждую область за все время полета (TOF)(т.е.длина тела)(рисунок 7A, B).
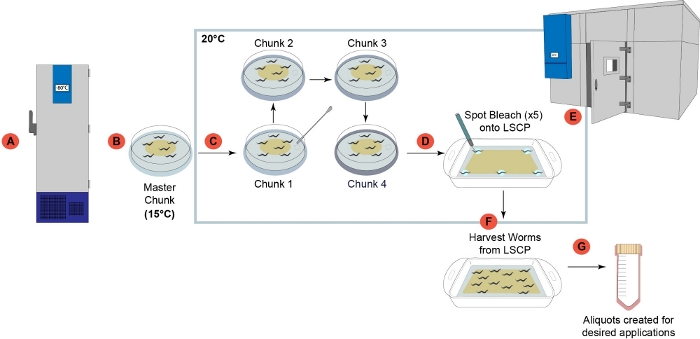
Рисунок 1: Обзор конвейера роста червей LSCP. (A) После получения в лаборатории все штаммы готовили и замораживать для длительного хранения при -80°C2. (B)Пластину "основного куска" готовили из замороженного червячного запаса и хранили при 15°С для использования не более одного месяца. (C)Каждый образец прошел четыре последовательных этапа дробления, чтобы уменьшить нагрузку поколений до роста на LSCP. (D)5 отдельных взрослых особей были отобраны из «куска 4» 6 см пластины на шаге (D) и пятно отбелено на пяти заданных участках LSCP. LSCP помещали в комнату с контролируемой температурой и выращивали при 20 ° C до тех пор, пока LSCP не был полон взрослых червей, не достиг большого размера популяции и не оставил минимальное количество бактерий. (F) Популяция червей была собрана и собрана для последующих шагов. (G) Aliquots были созданы из LSCP и были заморожены для последующих желаемых приложений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
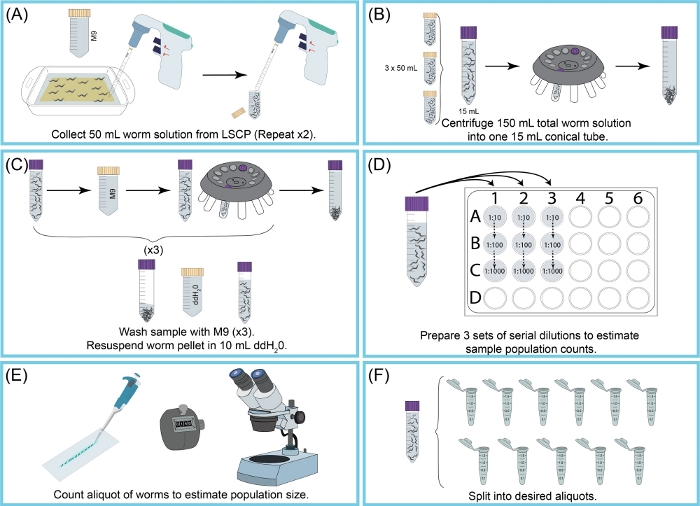
Рисунок 2: Обзор сбора и оценки численности популяции LSCP. (A)50 мл M9 использовались для смывания червей с поверхности NGMA. Червячная суспензия была пипетирована в коническую трубку 50 мл. Шаг (А) был повторен дважды. (B)15 мл червячной суспензии заливали в новую коническую трубку размером 15 мл. Червей гранулировали центрифугированием. Обломки М9 + были аспирированы, не потревожив червячные гранулы. Шаг (B) повторяли до тех пор, пока не были собраны все 150 мл суспензии червя. (C)Червячную гранулу промывали и центрифугировали три раза с помощью M9 для удаления оставшегося мусора. После того, как образец был очищен, гранулу червя повторно суспендировали в 10 мл ddH2O.(D)Было создано последовательное разбавление образца для оценки размера популяции червей. Был использован коэффициент (коэффициенты) разбавления, который позволял точно подсчитывать червей. Используемый коэффициент (коэффициенты) разбавления изменялся в зависимости от размера популяции LSCP. (E)После того, как коэффициент (коэффициенты) разбавления был выбран, все черви из всех трех аликвотных реплик этого разведения были пипетированы на чистый слайд, и черви были подсчитаны под рассекающим микроскопом. (F) Образец был разделен на аликвоты соответствующего размера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
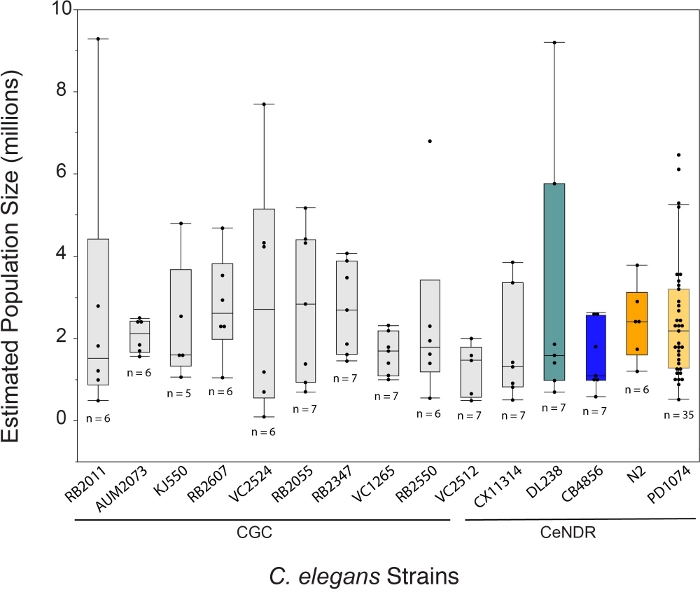
Рисунок 3: Метод LSCP сгенерировал в среднем популяцию из 2,4 миллиона червей смешанной стадии. LSCP дает размеры населения при наименьшем приросте населения около 94 500 и при наибольшем приросте населения около 9 290 000. Средний размер популяции по всем штаммам составил 2,4 миллиона червей. Полосы под названиями штаммов C. elegans указывают, является ли штамм мутантом CGC или природным изолятом CeNDR. Размер выборки LSCP отображается для каждого штамма. Были проведены сравнения для всех пар с использованием теста HSD Tukey. Существенных различий между оценочными размерами популяции по штаммам C. elegans не наблюдалось (F(14,108) = 0,7, p = 0,77). Цветные полосы обозначают стандартные цветные дисплеи для соответствующего представления деформации C. elegans. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
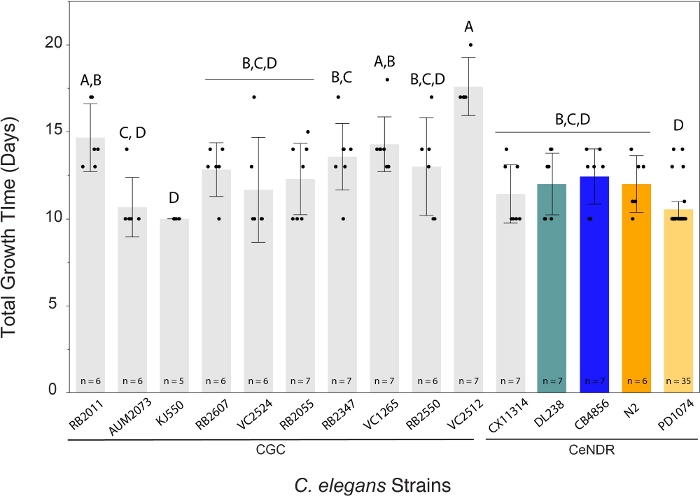
Рисунок 4: Метод LSCP генерировал большие смешанные популяции червей за 10 – 20 дней. Данный C. elegans LSCP рос до тех пор, пока образец не был полон взрослых червей, не достиг большого размера популяции и не остался минимальный бактериальный газон. ЛСМП потребовалось от 10 до 20 дней, чтобы вырасти до полной смешанной популяции, в зависимости от штамма. Среднее время роста по штаммам составило 12,2 дня. Размер выборки LSCP отображается для каждого штамма. Каждая полоса ошибок была построена с использованием 1 стандартного отклонения от среднего значения. Уровни, не связанные одной буквой, существенно отличаются. Сравнение для всех пар с помощью теста HSD Tukey. Была обнаружена существенная разница в количестве времени роста LSCP, необходимого для штаммов C. elegans (F(14,108) = 8,8, p < 0,0001*). Цветные полосы обозначают стандартные цветные дисплеи для соответствующего представления деформации C. elegans. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
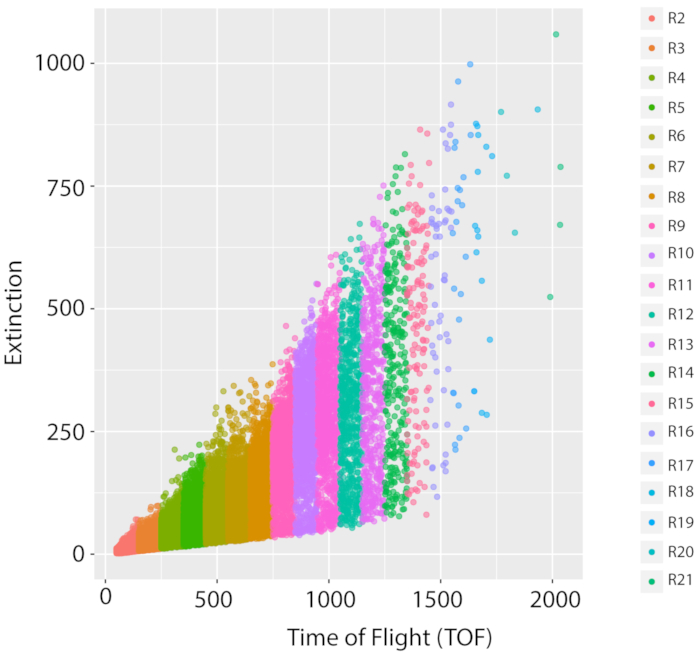
Рисунок 5: Измерение смешанной популяции и роста эталонного штамма дикого типа, PD1074. Репрезентативное распределение LPFC одного роста LSCP эталонного штамма дикого типа, варианта исходного штамма N2 Bristol (PD1074), документирует распределение размеров и количество событий смешанной популяции. Ось X отображает длину (Time of Flight, TOF) отсортированных червей. Ось Y отображает оптическую плотность (оптическое вымирание, EXT) отсортированных червей. Каждая точка данных является червем, который был задокументироваен в образце. Каждая область TOF, которая использовалась для анализа изображений, отображается другим цветом. Было создано двадцать регионов TOF (R2 – R21) в диапазоне от TOF 50 до 2050 года. Подробную информацию о каждом регионе TOF можно найти в дополнительной таблице 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
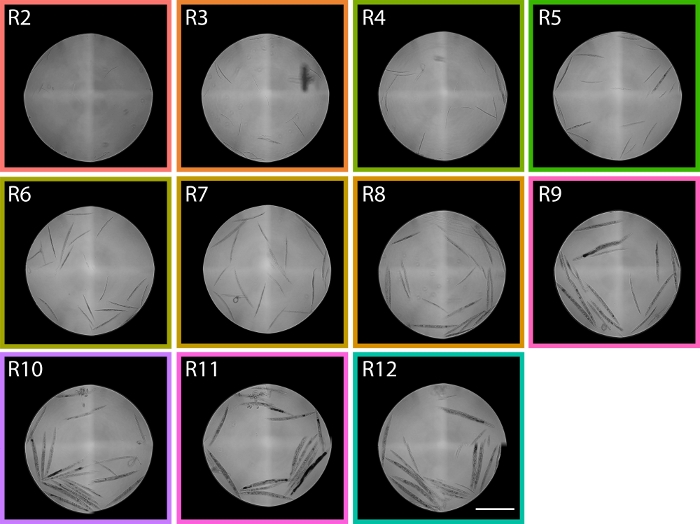
Рисунок 6: Изображения червей, отсортированные из областей TOF в диапазоне от R2 до R12, показывают распределение PD1074 LPFC. В области R2 черви L1 могут быть идентифицированы, а в области R9 преимущественно гравидные взрослые особи идентифицируются, охватывая две крайности личинок развития, давая нам приблизительные области в пределах распределения проточного цитометра, где ожидаются стадии в распределении. Шкала представляет собой 1 мм. Репрезентативные изображения были взяты из распределения LPFC, показанного на рисунке 5,а цветные поля соответствуют областям из рисунка 5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
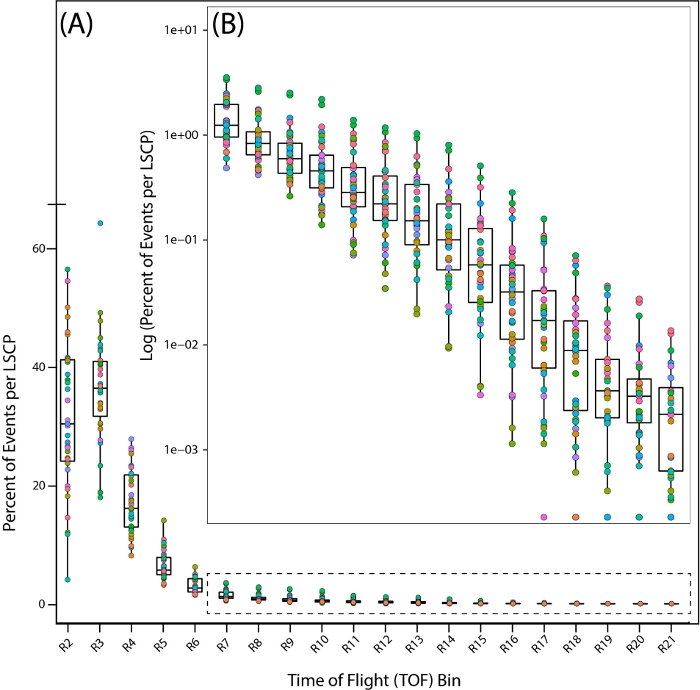
Рисунок 7: Распределение популяции по регионам времени полета (TOF) в эталонном штамме дикого типа PD1074. Распределение червей по всему региону TOF показывает регионы, где были обнаружены черви. Каждый PD1074 LSCP представлен в виде индивидуального цвета. (A) Ось X показывает двадцать областей TOF (R2 - R21), наблюдаемых и подсчитанных для LSCP, отображая все распределение размеров. Ось Y показывает процент червей из данного LSCP, которые имели размер тела, который упал в данную область TOF. Посколькуменьшая часть популяции червей попадает между регионами R7-R21, для отображения распределения популяции был взят журнал процента червей, которые попали в каждый регион. Ось X отображает области TOF R7-R21. Ось Y отображает журнал процента червей из данного LSCP, которые имели размер тела, попав в данную область TOF. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Среднесуточная температура (°C) условий роста, при которых LSCP выращивался и обрабатывался. Зарегистрированные температуры в помещении с контролируемой температурой (КТ) были задокументировано и собраны в течение шестимесячного периода роста и сбора проб. Здесь сообщается среднесуточная температура. Существенных различий между температурой, при которой LCSP рос в течение всего срока действия проекта, не наблюдалось (F(5,24) = 2,59, p = 0,0524). Вся разница температур охватывала не более 0,003 °C в течение шестимесячной продолжительности роста и генерации образца. Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
Дополнительная таблица 1: Закрытые области TOF, используемые для сортировки червей на 384-скважинные пластины для визуализации. Бинненые регионы были созданы для охвата TOF 100 по всему распределению TOF с 50 по 2050 год. Закрытые регионы могут быть изменены и оптимизированы в соответствии с вашими потребностями. Каждая область TOF, которая использовалась для анализа изображений, отображается другим цветом. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 2: Шаблон плиты на 384 скважины областей TOF и макет реплики. Каждый образец был отсортирован в 384-скважинную пластину для визуализации. Для каждого региона, выбранного для сортировки, было создано четыре реплики. Закрытые регионы могут быть изменены и оптимизированы в соответствии с вашими потребностями. Конкретные закрытые регионы, созданные и используемые в этом протоколе, см. в дополнительной таблице 1. Каждая область TOF, которая использовалась для анализа изображений, отображается другим цветом. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 3: Штаммы C. elegans, используемые в настоящем протоколе, содержат смесь штаммов CGC и CeNDR. Штамм, генотип, источник штамма и подробности описаны в этой таблице. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В качестве LSCP могут использоваться различные сосуды. В этом протоколе использовалась стандартная стеклянная противень. Используемые LSPC имели внешние размеры 35,56 x 20,32 см, внутренние размеры 27,94 x 17,78 см и глубину около 4,45 см и поставлялись с установленной крышкой. Таким образом, количество бактерий, используемых здесь, было оптимизировано для LSCP с вышеуказанными размерами, чтобы получить большую популяцию червей смешанной стадии. Объем и концентрация бактерий могут быть отрегулированы в соответствии с экспериментальными потребностями.
Загрязнение плесенью, грибками или другими бактериальными источниками может произойти на любом этапе метода LSCP, поэтому обрабатывайте образцы с осторожностью. Перед началом любого шага в протоколе убедитесь, что рабочее пространство очищено 70% этанолом и 10% отбеливателем. При наличии, обработайте использованные участки ультрафиолетовым светом в течение 30 минут и включите воздушный фильтр HEPA за 30 минут до начала каждого этапа.
Выращивая LSCP в контролируемых условиях(т.е.в комнате КТ, установленной при 20 °C), пользователь может легче отслеживать рост образца и документировать потенциальное загрязнение. Если поверхность LSCP загрязняется, либо вырежьте загрязнение, когда это возможно, и позвольте образцу продолжать расти, либо выбросьте образец, если загрязнение невозможно контролировать. Крайне важно быстро устранить загрязнение, чтобы уменьшить нежелательный рост и убедиться, что оно не конкурирует с червями за ресурсы.
Этот метод предназначен для тех, кто хочет выращивать крупномасштабные смешанные популяционные культуры C. elegans. Хотя может быть возможно выращивать синхронизированные популяции червей на LSCP, как это делается на коммерчески доступных чашках Петри и в жидкой культуре, авторы не тестировали этот вариант. Кроме того, если пользователи хотят вырастить более 2,4 миллиона червей в среднем в данной выборке, рекомендуется другой метод4. Успех роста зависит от штамма, обрабатываемого в конвейере. Авторы смогли успешно вырастить популяции примерно из 2,4 миллиона червей, по крайней мере, в пяти биологических репликах 15 штаммов C. elegans, что указывает на то, что метод является надежным.
Перед началом эксперимента обратите внимание, что возраст и здоровье данного червя могут влиять на плодовитость и последующее время роста популяции. Убедитесь, что черви поддерживаются в здоровых условиях с минимальным стрессом перед использованием в этом конвейере. Предполагается, что образцы запасов были созданы, заморожены и сохранены при -80 ° C, чтобы уменьшить генетический дрейф с течением времени.
В зависимости от потребностей данного эксперимента количество стартовых гравидных взрослых на LSCP может быть изменено. Изменение количества стартовых взрослых особей на LSCP изменит скорость роста и, следовательно, время сбора урожая. Пять взрослых особей используются для посева каждого LSCP по следующим причинам: (1) был необходим простой, быстрый и эффективный способ засеять много штаммов C. elegans на LSCP за один раз и (2) уменьшить возрастные различия среди отобранных взрослых особей, которые могут привести к гетерогенности роста.
Этот метод позволяет пользователю собирать большие популяции червей со всеми стадиями жизненного цикла. При наличии современных методов сбор крупномасштабных образцов C. elegans требует синхронизации отбеливателя для получения количества червей, необходимого для последующей работы. Учитывая этот подход, теперь можно выращивать как можно больше червей, сколько ранее было возможно в ферментах или крупномасштабных жидких культурах без трудностей, связанных с синхронизацией отбеливателя и несколькими этапами обработки. Наш протокол позволяет эффективно нацеливаться на интересующие штаммы, использовать минимальное время обработки при выращивании самого образца и изолировать стадии червей или популяции по мере необходимости в трубопроводах.
LPFC использовался в качестве инструмента для документирования распределения и размера популяции в данном LSCP. Используемая LPFC представляет собой систему непрерывного потока, которая анализирует, сортирует и дозирует червей на основе их размера (TOF) и оптической плотности. Когда данный червь проходит через проточную ячейку, осевой детектор потерь света захватывает количество сигнального света, заблокированного твердотельным лазером 488 нм, в течение времени, которое требуется червю для прохождения, давая пользователю TOF и оптическую плотность червя. Оптика и детекторы флуоресцентного сбора также могут быть использованы для максимизации чувствительности флуоресценции и сбора на каждом образце. Параметры сбора LPFC зависят от инструмента. Пользователи могут использовать различные платформы для захвата размера червя и не ограничиваются использованием этого протокола, если LPFC недоступен.
Авторы используют образцы, выращенные методом, описанным здесь, для идентификации неизвестных метаболитов в различных штаммах C. elegans с помощью жидкостной хроматографии - масс-спектрометрии, ЯМР-спектроскопии и секвенирования РНК. Авторы планируют продолжать использовать этот метод для роста образцов в этом конвейере с различными штаммами C. elegans, поскольку новые интересующих штаммы могут быть легко обработаны с использованием этого конвейера.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим членов Лаборатории Эдисона за полезные обсуждения и отзывы об этой рукописи; в частности, Б.M. Гарсия. Некоторые штаммы были предоставлены CGC, который финансируется Управлением исследовательских инфраструктурных программ NIH (P40 OD010440), и CeNDR, который финансируется NSF Living Collections CSBR 1930382. Эта работа была поддержана грантом NIH (U2CES030167).
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
Ссылки
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839 (2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117 (2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804 (2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, &. #. 3. 0. 4. ;., Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562 (2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156 (2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R., Strange, K. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. 351, 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены