Method Article
Доклиническая модель совместного культивирования органоидов и иммунных клеток аутологичного рака желудка человеческого происхождения для прогнозирования эффективности таргетной терапии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Цель протокола состоит в том, чтобы использовать этот подход для 1) понимания роли иммуносупрессивного микроокружения опухоли желудка и 2) прогнозирования эффективности ответа пациента, тем самым увеличивая выживаемость пациентов.
Аннотация
Опухоли, экспрессирующие лиганд запрограммированной клеточной смерти 1 (PD-L1), взаимодействуют с белком запрограммированной клеточной смерти 1 (PD-1) на CD8+ цитотоксических Т-лимфоцитах (CTL), уклоняясь от иммунного надзора, что приводит к ингибированию пролиферации, выживаемости и эффекторной функции CTL, а затем к персистенции рака. Примерно 40% случаев рака желудка экспрессируют PD-L1, однако частота ответа на иммунотерапию составляет всего 30%. Мы представляем использование совместной культуры органоидов и иммунных клеток аутологичного рака желудка человеческого происхождения в качестве доклинической модели, которая может предсказать эффективность таргетной терапии для улучшения исхода лечения онкологических больных. Несмотря на то, что сообщалось о кокультурах раковых органоидов с иммунными клетками, этот подход использует опухолевый антиген для импульсного воздействия на антигенпрезентирующие дендритные клетки. Дендритные клетки (ДК) затем культивируются с CD8+ Т-клетками пациента для расширения цитолитической активности и пролиферации этих Т-лимфоцитов перед совместным культивированием. Кроме того, в рамках этой системы совместного культивирования исследуются дифференцировка и иммуносупрессивная функция миелоидных супрессорных клеток (МДСК) в культуре. Этот органоидный подход может представлять широкий интерес и подходить для прогнозирования эффективности терапии и исхода лечения пациентов при других видах рака, включая рак поджелудочной железы.
Введение
Рак желудка занимает пятое место среди наиболее распространенных видов рака во всем мире 1. Эффективная диагностика и лечение Helicobacter pylori (H. pylori) привели к низкой заболеваемости раком желудка в Соединенных Штатах 2. Тем не менее, 5-летняя выживаемость пациентов с диагнозом этого злокачественного новообразования составляет всего 29%, что делает рак желудка важной медицинской проблемой3. Целью представленных здесь методов является разработка подхода к точному прогнозированию ответов иммунотерапии у отдельных пациентов. Солидные опухоли состоят из раковых клеток и различных типов стромальных, эндотелиальных и кроветворных клеток, включая макрофаги, миелоидные супрессорные клетки (МДСК) и лимфоциты (рассмотрено в 4,5). Взаимодействие между раковыми стволовыми клетками и микроокружением опухоли (TME) существенно влияет на характеристики опухоли и реакцию пациента на лечение. Этот подход направлен на то, чтобы позволить исследователям получить знания для доклинической разработки лекарств и открытия биомаркеров для персонализированного лечения рака желудка.
Представленный здесь метод использует аутологичные кокультуры органоидов и иммунных клеток человеческого происхождения, полученные от пациентов с раком желудка, чтобы понять иммуносупрессивную роль MDSC. Представлена доклиническая модель, которая может предсказать эффективность таргетной терапии для улучшения выживаемости пациентов. Кокультуры раковых органоидов с иммунными клетками широко известны в области рака поджелудочной железы 6,7,8,9,10. Тем не менее, о таких кокультурах не сообщалось для изучения рака желудка. В целом, этот метод демонстрирует совместное культивирование аутологичных иммунных клеток человека, полученных от человека, в той же матричной среде, что и раковые органоиды, что позволяет иммунным клеткам находиться в контакте с органоидами-мишенями.
В исследовании Tiriac et al.10 сообщается, что полученные от пациента органоиды рака поджелудочной железы, которые демонстрируют гетерогенные реакции на стандартную химиотерапию, могут быть сгруппированы в органоидные сигнатуры экспрессии генов химиочувствительности, которые могут предсказывать улучшение реакции пациентов на химиотерапию. Исследователи предположили, что комбинированное молекулярное и терапевтическое профилирование органоидов рака поджелудочной железы может предсказывать клинический ответ. Данные совместных клинических исследований Yao et al.11 также показали, что органоиды, полученные из рака прямой кишки, имеют схожие патофизиологию и генетические изменения, аналогичные тканям опухоли пациента в ответ на химиолучевую терапию. Таким образом, крайне важно, чтобы органоидные культуры использовались в контексте иммунных клеток пациента и иммунного фенотипа опухоли при использовании этих культур в качестве прогностических моделей для терапии.
Опухоли, экспрессирующие PD-L1, которые взаимодействуют с PD-1, ингибируют пролиферацию, выживаемость и эффекторную функцию CD8+ цитотоксических Т-лимфоцитов 12,13,14. В то время как примерно 40% случаев рака желудка экспрессируют PD-L1, только 30% этих пациентов реагируют на иммунотерапию 15,16,17. Антитела к PD1 используются в клинических испытаниях для лечения рака желудка 18,19,20. Однако в настоящее время не существует доклинических моделей, позволяющих проверить терапевтическую эффективность для каждого пациента. Оптимизация органоидной культуры таким образом, чтобы иммунные клетки пациента были включены в систему, потенциально позволила бы индивидуализированную идентификацию эффективности иммунотерапии.
протокол
Получено одобрение на сбор биопсийных тканей человека из опухолей пациентов (1912208231R001, Программа защиты человека Университета Аризоны; Номер протокола IRB: 1099985869R001, Программа защиты человека Аризонского университета TARGHETS).
1. Получение органоидов желудка от пациента из биопсии
- Соберите 1-2 мм биопсированных тканей человека из области опухоли у пациентов с раком желудка, которым проводили пищеводную гастродуоденоскопию в 1x фосфат-буферном растворе (PBS) (Таблица 1).
ПРИМЕЧАНИЕ: В дальнейшем все процедуры должны проводиться в асептической среде с использованием стерильных материалов и реагентов. - Измельчите биопсированные ткани с помощью лезвий скальпеля на чашке Петри. Переложите измельченные салфетки в коническую пробирку объемом 15 мл и добавьте 5-10 мл 1x PBS.
- Центрифугировать при 300 × г в течение 5 мин при комнатной температуре. Выбросьте надосадочную жидкость. Добавьте 1-2 мл предварительно подогретого буфера для пищеварения (Таблица 1) в гранулированные ткани.
- Инкубировать при температуре 37 °C в течение 15-30 минут, в зависимости от размера измельченных тканей. Следите за состоянием пищеварения, заглядывая под микроскоп на мелкие клеточные кластеры каждые 5-10 минут.
- Остановите пищеварение, разбавив в 5 раз холодным Advanced Dulbecco's Modified Eagle Medium/Ham's F-12 medium (Advanced DMEM/F-12). Если видны комки непереваренного материала, отфильтруйте ткани через фильтры 30 мкм. Соберите протекание.
- Центрифугируйте проточный поток при 300 × г в течение 5 минут при комнатной температуре для гранулирования ячеек. Выбросьте надосадочную жидкость.
- Ресуспендировать гранулированные элементы (10 000-100 000) в соответствующем объеме (2-4 мл) матрицы талой базальной мембраны (см. Таблицу материалов) на льду. Затравка в виде 30-50 мкл клеточно-базальной мембраны капает в 24-луночные культуральные планшеты.
- Инкубируйте планшеты при температуре 37 °C в течение 15 минут, чтобы капли матрицы клеточно-базальной мембраны затвердели. Капли матрикса клеточно-базальной мембраны наложить на предварительно подогретую питательную среду для органоидов желудка (табл. 1).
- Поддерживайте органоидные культуры при температуре 37 °C при 5%CO2. Заменяйте питательную среду свежей средой каждые 3-4 дня, в зависимости от роста органоидов. Пропускайте органоиды один раз в 7-10 дней в соотношении 1:3.
2. Создание органоидов желудка, полученных от пациента, из хирургических образцов
- Соберите ткани рака желудка человека из резецированных образцов пациентов с раком желудка во время хирургических процедур в 1x фосфатно-солевом буфере Дульбекко (DPBS) с добавлением антибиотиков (Таблица 1).
ПРИМЕЧАНИЕ: Все последующие процедуры должны проводиться в шкафу биобезопасности, в асептической среде и с использованием стерильных материалов и реагентов. - Измельчите резецированные ткани с помощью лезвий хирургического скальпеля на чашке Петри. Промойте измельченные салфетки 5-10 мл 1x DPBS, содержащего антибиотики.
- Переложите ткань в коническую трубку объемом 50 мл. Добавьте 10 мл предварительно подогретого этилендиаминатетрауксусной кислоты (ЭДТА) в измельченные салфетки. Следите за состоянием пищеварения каждые 5-10 минут. Выдержите пробирку в шейкере при температуре 37 °C в течение 10 минут.
- Дайте тканям осесть на дне пробирки, удалите буфер ЭДТА, не потревожив ткани, и добавьте 10 мл свежего буфера ЭДТА. Инкубируйте пробирку в шейкере при температуре 37 °C в течение 5 минут.
- Дайте тканям осесть на дне трубки. Удалите буфер ЭДТА и дважды промойте ткани (выполните шаг 2.4) 10 мл усовершенствованного DMEM/F-12 с добавлением антибиотиков (без центрифуги) (Таблица 1).
- Добавьте в ткани 5-10 мл предварительно подогретого буфера для пищеварения (табл. 1), в зависимости от размера ткани. Инкубируйте пробирку при температуре 37 °C в течение 15-30 минут с легким перемешиванием, в зависимости от размера и текстуры тканей. Проверяйте на внешний вид клеточных кластеров под микроскопом каждые 10 минут.
- Остановите пищеварение, разбавив в два раза холодным Advanced DMEM/F-12 плюс антибиотики. Отфильтруйте непереваренные ткани через фильтры 40 μм и соберите проточные.
- Центрифугируйте проточный поток при 400 × г в течение 5 минут при 4 °C для гранулирования клеток. Выбросьте надосадочную жидкость и промойте клетки холодным 1x DPBS плюс антибиотики в дозе 400 × г в течение 5 минут при температуре 4 °C. Аккуратно выбросьте надосадочную жидкость, а клетки храните на льду.
- Ресуспендировать гранулированные клетки в соответствующем объеме матрицы базальной мембраны на льду. Затравите 30-50 мкл клеточно-базальной мембраны каплями в 24- или 12-луночные планшеты, обработанные клеточными культурами.
- Инкубируйте планшеты при температуре 37 °C в течение 15 минут, чтобы капли матрицы клеточной базальной мембраны затвердели в виде купола. Наложите на купол матрицы клеточно-базальной мембраны предварительно подогретую питательную среду для органоидов желудка (табл. 1).
- Поддерживайте органоидные культуры при температуре 37 °C при 5%CO2. Заменяйте питательную среду свежей средой каждые 3-4 дня, в зависимости от роста органоидов. Пропускайте органоиды один раз в 7-10 дней в соотношении 1:2 или 1:3, в зависимости от плотности органоидов.
3. Поддержание и размножение органоидных культур
ПРИМЕЧАНИЕ: Все процедуры должны проводиться в асептической среде с использованием стерильных материалов и реагентов.
- Обслуживание и расширение
- Сохраняйте органоидные культуры в течение 7-10 дней, пока они не станут слитыми на 70-80%. Соберите органоиды в ледяной DMEM. Перенесите органоиды в полистирольные пробирки объемом 5 мл с круглым дном.
- Центрифугируйте органоиды при 400 × г в течение 5 мин при 4 °C в грануляционные ячейки. Осторожно удалите надосадочную жидкость и повторно суспендируйте гранулу в 1 мл предварительно подогретого раствора реагента для диссоциации клеток. Инкубируйте органоиды при 37 °C в течение 6 минут.
- Аккуратно пропустите органоиды через иглу 26 G 4 раза. Добавьте 2 мл DMEM, чтобы остановить действие реагента для диссоциации клеток.
- Центрифугируйте органоиды при 400 × г в течение 5 минут при 4 °C для гранулирования клеток. Аккуратно выбросьте надосадочную жидкость и храните клетки на льду.
- Ресуспендировать гранулированные клетки в соответствующем объеме матрицы базальной мембраны на льду. Затравку 30-50 мкл матрицы клеточно-базальной мембраны капают в 24- или 12-луночные обработанные клеточные культуры планшеты.
- Инкубируйте планшеты при температуре 37 °C в течение 15 минут, чтобы капли матрицы клеточной базальной мембраны затвердели в виде купола. Наложите купол матрикса клетка-базальная мембрана с предварительно подогретой средой для культуры органоидов желудка (см. табл. 1).
- Поддерживайте органоидные культуры при температуре 37 °C при 5%CO2. Заменяйте питательную среду свежей средой каждые 3-4 дня, в зависимости от роста органоидов. Повторяйте пассаж органоидов один раз в 7-10 дней в соотношении 1:2 или 1:3, в зависимости от плотности органоидов.
- Экспансия клеточных линий, полученных из органоидов
- Собирайте органоиды, когда они сливаются на 70-80%. Скармливайте клетки, прикрепленные к пластиковым планшетам, питательной средой для органоидов желудка и поддерживайте культуру, подкармливая их каждые 3-4 дня в зависимости от роста клеток.
- Пропускайте клетки, когда они достигнут 80-90% слияния.
- Извлеките питательную среду и аккуратно промойте пластину с предварительно подогретым DPBS. Добавьте 1 мл предварительно разогретого реагента для диссоциации клеток.
- Инкубируйте клетки в течение 5 минут при 37 °C. Соберите клетки в 2 мл DMEM.
- Центрифугируйте клетки при 400 × г в течение 5 мин при 4 °C. Удалите надосадочную жидкость и ресуспендируйте гранулу в питательной среде для органоидов желудка или в культуре эпителиальных клеток желудка человека (табл. 1).
- Пластины из пункта 3.2.2.3 помещают либо в пластины с базальной мембраной, покрытой матрицей, либо с желатиновым покрытием. Поддерживайте органоидные культуры при температуре 37 °C при 5%CO2. Заменяйте среду свежей средой через день в зависимости от роста клеток. Повторяйте пассацию клеток один раз в 7-10 дней в соотношении 1:2 или 1:3, в зависимости от плотности клеток.
- Чтобы покрыть планшеты матрицей базальной мембраны, разведите матрицу в ледяной воде для клеточных культур в соотношении 1:10. Равномерно покройте планшет 1 мл ледяного разбавленного матричного раствора с помощью разбрасывателя ячеек и инкубируйте покрытый планшет при 37 °C в течение 2 часов. Удалите остатки раствора покрытия и дайте пластине высохнуть без крышки внутри биозащитного колпака в течение 30 минут, непосредственно перед покрытием ячеек.
- Чтобы покрыть пластины желатином, равномерно покройте пластину 1 мл ледяного раствора на основе желатина. Инкубируйте покрытую покрытием пластину при комнатной температуре в течение 5 минут. Удалите оставшийся желатиновый раствор и проложите пластину для ресуспендированных клеток.
4. Культивирование иммунных клеток из мононуклеарных клеток периферической крови (ПМЦ)
ПРИМЕЧАНИЕ: Все процедуры должны проводиться в асептической среде с использованием стерильных материалов и реагентов.
- Изоляция PBMC
- Разбавьте цельную кровь равным объемом 1x PBS.
- В зависимости от общего объема разбавленной пробы крови нанесите соответствующий объем градиентной среды плотности (см. Таблицу материалов) в пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: Рекомендуемое соотношение составляет 3 мл градиентной среды плотности на 4 мл разбавленного образца крови. - Осторожно нанесите разбавленный образец крови на среду с градиентом плотности. Центрифуга при 400 × г в течение 30 мин-1 ч без тормоза.
- После центрифугирования осторожно перенесите мононуклеарные ячейки на границе раздела в новую коническую пробирку объемом 15 мл. Разбавьте мононуклеарные ячейки 3 объемами 1x PBS.
- Центрифугировать при 400 × г в течение 10 мин. Выбросьте надосадочную жидкость. Повторите один раз.
- Ресуспендируйте гранулированные элементы в подходящей среде для последующего применения или криоконсервации в виде замороженных материалов.
- При необходимости определите выход и жизнеспособность клеток PBMC с помощью анализа исключения трипанового синего красителя.
- Культивирование дендритных клеток человека
- Ресуспендируйте выделенные PBMC в среде PBMC (см. Таблицу материалов и Таблицу 1) и поместите их в 24-луночный планшет для культуры тканей на 1-2 ч при 37 °C и 5%CO2.
- Сильно постучите по культуральной пластине и выбросьте отработанную питательную среду, содержащую неадгезивные клетки.
- Добавьте питательную среду ДК (табл. 1) к адгезивным клеткам. Выдержите культуры в течение 3 дней при температуре 37 °C при 5% CO2. Заменяйте надосадочную жидкость свежей питательной средой через день.
- На 3-й день замените отработанную среду свежей средой для созревания DC (Таблица 1). Выдерживайте культуры в течение 24 часов при температуре 37 °C при 5%CO2.
- Культура цитотоксических Т-лимфоцитов человека (CTL)
- Перелейте 1 мл PBMC в полистирольную пробирку с круглым дном объемом 5 мл.
- Добавьте 50 μл коктейля для обогащения (см. Таблицу материалов) в PBMC. Инкубируйте в течение 10 минут при комнатной температуре.
- Добавьте в образец 150 мкл магнитных частиц (Таблица материалов). Выдерживать 5 минут при комнатной температуре.
- Увеличьте объем образца до 2,5 мл с помощью буфера для разделения клеток (Таблица материалов). Поместите полистирольную трубку с круглым дном в магнит для разделения ячеек (Таблица материалов) на 5 минут, чтобы обеспечить разделение ячеек.
- Налейте обогащенную клеточную суспензию в новую коническую пробирку объемом 15 мл. Центрифугируйте при 300 × г в течение 5 мин. Выбросьте надосадочную жидкость.
- Ресуспендируйте гранулированные клетки и культуру в питательной среде CTL (табл. 1) в течение 24 ч при 37 °C при 5%CO2.
- Культивирование клеток-супрессоров миелоидного происхождения человека (МДСК)
- Культивируйте PBMC в питательной среде MDSC (Таблица 1) в течение 7 дней при 37 °C при 5% CO2 для обогащения MDSC. Замените надосадочную среду свежей питательной средой через день.
- Кокультура распределительных центров и CTL
- Соберите кондиционированную среду из органоидных культур.
- Аккуратно удалите 50% среды из созревшей культуры DC и замените ее кондиционированной средой, полученной из органоидов.
- Инкубируйте ДК с кондиционированной средой, полученной из органоидов, в течение 2 ч при 37 °C и 5%CO2.
- Соберите слабо адгезивные ДК и центрифугируйте их при 300 × г в течение 5 мин при 4 °C. Удалите надосадочную жидкость, повторно суспендируйте гранулу в среде для совместной культуры RPMI и добавьте эту клеточную суспензию обратно в ту же лунку.
- Соберите CTL из той же линии пациента и перенесите их к созревшим DC. Продолжайте совместное культивирование DC-CTL (Таблица 1) в течение 72 ч при 37 °C в 5% CO2.
5. Создание кокультур органоидных/иммунных клеток
- Выделите CTL из сокультур DC и CTL с помощью набора (см. Таблицу материалов), как описано ранее в разделе 4.3.
- Инкубируйте CTL с 5 мкМ карбоксифлуоресцеином диацетата сукцинимидилового эфира (CFSE) при 37 °C в течение 20 мин.
ПРИМЕЧАНИЕ: CFSE — это синий лазер, возбуждаемый красителем, используемый для проточного цитометрического мониторинга делений клеток. - Соберите органоиды и смешайте их с CTL, меченными CFSE. Поддерживая соотношение CTL/органоид на уровне 50 000 CTL на 200 органоидов, ресуспендируйте органоиды в соответствующем объеме размороженной матрицы базальной мембраны на льду. Затравка в виде 25 мкл матрицы клеточно-базальной мембраны капает в 24-луночные планшеты для культивирования тканей.
ПРИМЕЧАНИЕ: Для экспериментальных условий, требующих MDSC, смешайте MDSC с органоидами и CTL, меченными CFSE, перед посевом. Соотношение MDSC/CTL должно быть 4:1. - Инкубируйте планшеты при температуре 37 °C в течение 15 минут, чтобы капли матрицы клеточно-базальной мембраны затвердели.
- Капли матрикса клеточно-базальной мембраны покрыть предварительно подогретой органоидной питательной средой.
- Поддерживайте кокультуры органоидов/иммунных клеток при температуре 37 °C при 5%CO2 до проведения анализа.
Результаты
После завершения работы желудочные органоиды появляются в виде сфер внутри лунки, как правило, в течение 2-4 дней после заделки (Рисунок 1). На рисунке 1А показана процветающая культура органоидов желудка с регулярной мембраной. Опухолевые органоиды часто демонстрируют дивергентную морфологию, которая уникальна для образца пациента. Неудачные культуры будут казаться плотными или не демонстрировать никакого роста от первоначального переваривания тканей (рисунок 1B). Устойчивые и активно растущие культуры будут успешно пройдены и расширены, как подробно описано в протоколе. Мы часто наблюдали миграцию и прикрепление субпопуляции клеток к основанию культуральной пластины (рисунок 1C). Следуя протоколу, эти прикрепленные клетки могут быть пассированы и расширены на покрытые желатином клеточные культуральные планшеты (рисунок 1D).
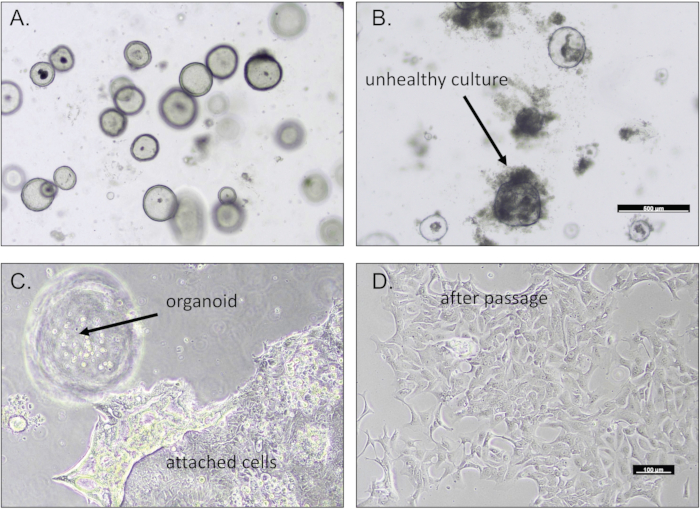
Рисунок 1: Органоиды желудка, полученные в результате биопсии. Репрезентативные изображения (А) устойчивой культуры органоидов желудка и (Б) нездоровой культуры умирающих органоидов. (C) Желудочные клетки часто мигрируют и прикрепляются к основанию чашки для культивирования. (D) Эти желудочные клетки могут быть пропущены. Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В этом протоколе описан метод культивирования ДК, МДСК и КЛЛ из ПМК пациента. На рисунке 2 представлена морфология культур иммунных клеток, полученных из ПБМК. ДК в культуре демонстрировали неправильную форму с обширными и удлиненными дендритными процессами (рисунок 2А). МДСК выглядят как типичные крупные мононуклеарные клетки с базофильной зернистой цитоплазмой (рис. 2B). Морфология CTL в культуре показана на рисунке 2C. Гранулоцитарные МДСК могут быть дополнительно охарактеризованы с помощью проточной цитометрии с использованием стратегии гейтирования, идентифицирующей клетки HLA-DR/CD14-, CD33/CD11b/CD15+ .
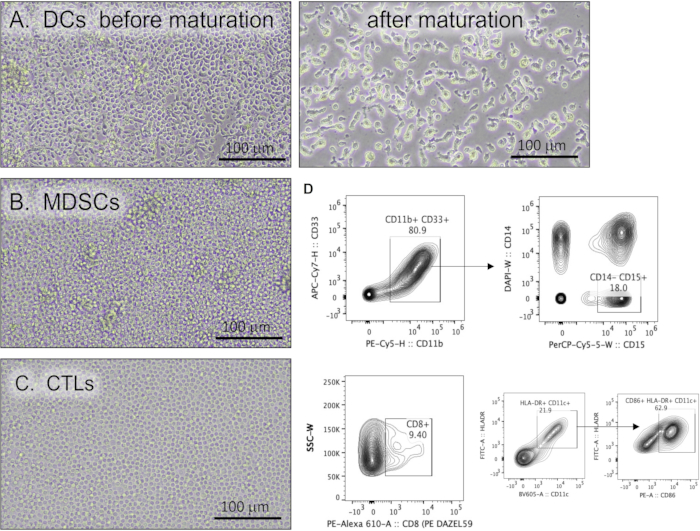
Рисунок 2: Иммунные клетки человека, культивируемые из PBMC. Репрезентативные световые микрофотографии (А) дендритных клеток до и после протокола созревания, (В) миелоидных супрессорных клеток и (В) цитотоксических Т-лимфоцитов. Масштабные линейки = 100 мкм. (D) Репрезентативные проточные цитометрические контурные графики, демонстрирующие маркеры иммунных клеток. Сокращения: PBMCs = мононуклеарные клетки периферической крови; DCs = дендритные клетки; MDSCs = клетки-супрессоры миелоидного происхождения; CTL = цитотоксические Т-лимфоциты; APC = аллофикоцианин; CD = кластер дифференцировки; ПЭ = фикоэритрин; H = высота вершины; W = ширина вершины; PerCP = Перидинин-хлорофилл-белок; DAPI = 4',6-диамидино-2-фенилиндол; FITC = флуоресцеин изотиоцианат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Иммунофлюоресценция кокультуры органоидов и иммунных клеток демонстрирует наличие CTL (CD8+, зеленый) с опухолевыми органоидами (PD-L1+, красный) (рис. 3A-D). Трехмерное изображение показано на видео 1. Покадровая микроскопия демонстрирует миграцию MDSC и CTL в сторону органоидов желудка (видео 2) и гибель органоидов в культурах, обработанных ингибитором контрольных точек (видео 3).

Рисунок 3: Кокультуры органоидов и иммунных клеток рака желудка. Иммунофлуоресцентное окрашивание репрезентативной кокультуры органоид/иммунных клеток, показывающее экспрессию (A) CD8+ (зеленый), (B) PD-L1 (красный) и (C) Hoechst (синий) окрашенных клеток. Объединенное изображение показано на рисунке (D). (E) Иммунофлуоресцентное окрашивание репрезентативной культуры органоидных/иммунных клеток, показывающее экспрессию MDSCs (CD11b, зеленый) и E-кадгерин (красный). Масштабные линейки = 50 μм. Сокращения: CD = кластер дифференцировки; PD-L1 = лиганд запрограммированной клеточной смерти 1; MDSCs = клетки-супрессоры миелоидного происхождения; Hoechst = Hoechst 33258. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Видео 1: Трехмерное визуализированное изображение совместной культуры органоидов и иммунных клеток рака желудка, содержащей опухолевые клетки PD-L1+ (красные) и CD8+ лимфоциты (зеленые). Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2: Покадровая микроскопия кокультуры органоидов и иммунных клеток, устойчивых к лечению ингибиторами контрольных точек. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 3: Покадровая микроскопия кокультуры органоидов и иммунных клеток, чувствительных к лечению ингибиторами контрольных точек. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Таблица 1: Состав сред и растворов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Мы представляем использование аутологичной культуры органоида и иммунных клеток рака желудка человеческого происхождения, которая может быть использована в качестве доклинической модели для прогнозирования эффективности таргетной терапии для конечного улучшения результатов лечения и прогноза для пациента. Несмотря на то, что сообщалось о кокультурах органоидов рака с иммунными клетками, это первое сообщение о такой системе совместного культивирования для изучения рака желудка. Множество других усилий по профилированию пациентов на основе органоидов хорошо развиты во многих учреждениях, включая модели совместного культивирования. Насколько нам известно, были разработаны три основные системы совместного культивирования, которые имеют следующие особенности: 1) органоиды рака поджелудочной железы, культивируемые совместно с иммунными клетками за пределами купола матрицы базальной мембраны6. Адгезия иммунных/опухолевых клеток будет иметь важное значение в системе, изучающей взаимодействие между PD-L1 и PD-1. 2) Совместное культивирование органоидов органоидов и лимфоцитов периферической крови с аутологичным немелкоклеточным раком и колоректальным раком21.
Все эксперименты, проведенные в этом исследовании, проводились с использованием пластин, покрытых анти-CD28, для активации Т-клеток, а совместные культуры проводились в присутствии интерлейкина (IL)-2 для поддержания пролиферации Т-клеток. Несмотря на то, что все культуры in vitro имеют ограничения и не полностью отражают физиологические условия, CD8+ Т-клетки в этих культурах активируются с использованием опухолевого антигена пациента и дендритных антигенпрезентирующих клеток для активации Т-клеток. Этот подход можно считать более близким к тому, что происходит в TME. 3) Метод воздушно-жидкостного интерфейса (ALI) для размножения органоидов, полученных от пациента22. Исследователи утверждают, что органоиды проходили каждые 14-30 дней, а в некоторых случаях в среду добавляли рекомбинантный человеческий IL-2. Во-первых, поддержание и размножение цитотоксических CD8+ Т-лимфоцитов требует большего, чем просто добавление IL-2 в среду ex vivo. Во-вторых, для долгосрочного культивирования CD8+ Т-клеток требуется исходное исследование CD3/CD28 с последующей поддержкой в IL-2 в течение 2-3 недель. Это можно считать искусственным подходом к активации Т-клеток и не иметь отношения к ТМЭ.
Существующие ограничения органоидных культур, полученных из опухолевой ткани, обусловливают необходимость доработки этих культур иммунными клетками. Например, вероятность инвазии опухоли значительно увеличивается у пациентов с плотным стромальным компартментом, как это наблюдается при инвазивном раке желудка23. Таким образом, может быть затруднено выделение и культивирование органоидов иммунных клеток из нативной опухолевой ткани пациента с плотным стромальным компартментом, особенно у пациентов с плохим прогнозом. Важно отметить, что опубликованные данные секвенирования РНК показали, что, несмотря на фенотипическое сходство между органоидами и опухолевой тканью пациента, иммунный компартмент посуществу отсутствует. Таким образом, ограничением современных культур органоидов и клеточных линий является недостаток иммунного компонента, обнаруженного в ТМЭ пациента.
Важнейшие шаги в протоколе включают в себя создание устойчивой органоидной культуры и иммунных клеток. Наиболее распространенной проблемой, наблюдаемой при выращивании органоидных культур, полученных от пациентов, является бактериальное или грибковое загрязнение. Таким образом, также крайне важно включать противогрибковые препараты и антибиотики при промывании тканей перед пищеварением. Существуют также ограничения культуры, которые будут рассмотрены в будущих экспериментах. Во-первых, гетерогенность органоидных культур может рассматриваться как ограничение при исследовании конкретной клеточной популяции, на которую нацелены иммунотерапия и химиотерапия. Часто бывает трудно определить по этим культурам, является ли один органоид клональным и полученным из одной клетки. В будущем подход может заключаться в использовании аналитического подхода на основе одиночных клеток в дополнение к экспериментам in vitro , в которых проверяются таргетные методы лечения. Во-вторых, гетерогенность клеток в культуре может не отражать точное микроокружение опухоли пациента. Сложность этих культур может быть увеличена за счет включения дополнительных фундаментальных клеток, включая макрофаги и ассоциированные с раком фибробласты. Тем не менее, совместное культивирование органоидов и иммунных клеток было использовано здесь для изучения сфокусированного исследовательского вопроса, касающегося фундаментальных взаимодействий опухоли и иммунных клеток, имеющих отношение к роли МДСК в качестве иммуносупрессивных клеток. В-третьих, образцы собираются из первичного участка опухоли. Забор ткани производится на основании решения патологоанатома. Будущие исследования будут сосредоточены на органоидах, полученных из метастатических участков, что может позволить нам расшифровать различия в раковых органоидах в зависимости от места, откуда была собрана ткань. В целом, эта система культивирования может представлять широкий интерес и подходить для прогнозирования эффективности терапии и исхода пациента при других видах рака желудочно-кишечного тракта, включая рак толстой кишки и поджелудочной железы.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом NIH (NIAID) 5U19AI11649105 (PIs: Weiss and Wells, Project Leader 1: Zavros) и NIH (NIDDK) 2 R01 DK083402-06A1 (PI: Zavros). Этот проект был частично поддержан грантом PHS P30 DK078392 (Integrative Morphology Core) Исследовательского центра заболеваний пищеварительной системы в Цинциннати и 5P30CA023074 ОНКОЛОГИЧЕСКОГО ЦЕНТРА УНИВЕРСИТЕТА АРИЗОНЫ – ГРАНТ ПОДДЕРЖКИ ОНКОЛОГИЧЕСКОГО ЦЕНТРА (PI: Sweasy). Мы хотели бы выразить признательность Чету Клоссону (Центр живой микроскопии, Университет Цинциннати) и бывшим сотрудникам лаборатории Завроса, докторам Нине Стил и Лорин Холокай, за их вклад в развитие системы органоидных культур. Мы искренне благодарим пациентов, которые согласились сдавать ткани и кровь для разработки совместных культур органоидов желудка и иммунных клеток. Без их желания участвовать в исследовании эта работа была бы невозможна.
Материалы
| Name | Company | Catalog Number | Comments |
| 12 well plate | Midwest Scientific | 92012 | |
| 15 mL Falcon tube | Fisher scientific | 12-565-269 | |
| 24 well plate | Midwest Scientific | 92024 | |
| 30 μm filters | Miltenyi Biotec | 130-041-407 | |
| 40 μm filters (Fisher Scientific) | Fisher scientific | 352340 | |
| 5 mL round bottom polystyrene tubes | Fisher scientific | 14956-3C | |
| 50 mL Falcon tube | Fisher scientific | 12-565-271 | |
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634010 | |
| AIMV | Thermo Fisher Scientific | 12055091 | Basal medium for PBMCs and DCs |
| Amphotericin B/ Gentamicin | Thermo Fisher Scientific | R-01510 | |
| B-27 supplement | Thermo Fisher Scientific | 12587010 | |
| β-mercaptoethanol | Thermo Fisher Scientific | 800-120 | |
| Bone morphogenetic protein inhibitor (Noggin) | Peprotech | 250-38 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A7906 | |
| Cabozantinib | Selleckchem | S1119 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | Biolegend | 423801 | |
| Collagenase A | Sigma Aldrich | C9891 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Fisher scientific | 14190-144 | cell separation buffer |
| EasySep Buffer | Stem Cell Technologies | 20144 | Contains Enrichment Cocktail and Magnetic Particles used in CTL culture |
| EasySep Human CD8+ T Cell Enrichment Kit | Stem Cell Technologies | 19053 | cell separation magnet |
| EasySep Magnet | Stem Cell Technologies | SN12580 | |
| EDTA | Sigma Aldrich | E6758 | |
| Epidermal Growth Factor (EGF) | Peprotech | 315-09 | |
| Farma Series 3 Water Jacketed Incubator | Thermo Fisher Scientific | 4120 | |
| Fetal Calf Serum (FCS) | Atlanta Biologicals | SI2450H | |
| Fibroblast growth factor 10 (FGF-10) | Peprotech | 100-26 | density gradient medium |
| Ficoll-Paque | GE Healthcare | 171440-02 | |
| Gastrin 1 | Tocris | 30061 | |
| Gelatin | Cell Biologics | 6950 | |
| GM-CSF | Thermo Fisher Scientific | PHC6025 | |
| Hank's Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175095 | |
| HEPES (2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid) | Fisher scientific | BP299-100 | |
| Human Epithelial Cell Basal Medium | Cell Biologics | H6621 | |
| human serum AB | Gemini Bioscience | 21985023 | |
| Hyaluronidase Type IV-S | Sigma Aldrich | H3884 | |
| Insulin-Transferrin-Selenium | Thermo Fisher Scientific | 41400045 | |
| Interleukin 1β (IL-1β) | Thermo Fisher Scientific | RIL1BI | |
| Interleukin 6 (IL-6) | Thermo Fisher Scientific | RIL6I | |
| Interleukin 7 (IL-7) | Thermo Fisher Scientific | RP-8645 | |
| Kanamycin | Thermo Fisher Scientific | 11815024 | |
| L-glutamine | Fisher scientific | 350-50-061 | basement membrane matrix |
| Matrigel (Corning Life Sciences, Corning, NY) | Fisher scientific | CB40230C | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | |
| N-acetyl-L-cysteine | Sigma Aldrich | A7250 | |
| Nicotinamide (Nicotinamide) | Sigma Aldrich | N0636 | |
| PD-L1 inhibitor | Selleckchem | A2002 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | SV3000 | |
| Petridish | Fisher scientific | 07-202-030 | |
| Potassium chloride (KCl) | Fisher scientific | 18-605-517 | |
| Potassium dihydrogenphosphate (KH2PO4) | Fisher scientific | NC0229895 | |
| prostaglandin E2 (PGE2) | Sigma Aldrich | P0409 | |
| RPMI 1640 | Thermo Fisher Scientific | 11875119 | |
| Sodium chloride (NaCl) | Fisher scientific | 18-606-419 | |
| Sodium hydrogen phosphate (Na2HPO4) | Fisher scientific | NC0229893 | cell dissociation reagent |
| StemPro Accutase solution | Thermo Fisher Scientific | A1110501 | |
| Transforming growth factor beta 1 (TGF-β1) | Thermo Fisher Scientific | 7754-BH-005/CF | |
| Tumor necrosis factor α (TNF-α) | Thermo Fisher Scientific | PHC3015 | |
| Vascular endothelial growth factor (VEGF) | Thermo Fisher Scientific | RVGEFI | |
| Y-27632 ROCK inhibitor | Sigma Aldrich | Y0350 |
Ссылки
- Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), 359-386 (2015).
- Piazuelo, M. B., Epplein, M., Correa, P. Gastric cancer: an infectious disease. Infectious Disease Clinics of North America. 24 (4), 853-869 (2010).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 63 (1), 11-30 (2013).
- Quante, M., Wang, T. C. Inflammation and stem cells in gastrointestinal carcinogenesis. Physiology. 23, 350-359 (2008).
- Quante, M., Varga, J., Wang, T. C., Greten, F. R. The gastrointestinal tumor microenvironment. Gastroenterology. 145 (1), 63-78 (2013).
- Tsai, S., et al. Development of primary human pancreatic cancer organoids, matched stromal and immune cells and 3D tumor microenvironment models. BMC Cancer. 18 (1), 335 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Tiriac, H., et al. Successful creation of pancreatic cancer organoids by means of EUS-guided fine-needle biopsy sampling for personalized cancer treatment. Gastrointestinal Endoscopy. 87 (6), 1474-1480 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Yao, Y., et al. Patient-derived organoids predict chemoradiation responses of locally advanced rectal cancer. Cell Stem Cell. 26 (1), 17-26 (2020).
- Ahmadzadeh, M., et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood. 114 (8), 1537-1544 (2009).
- Chen, Z., et al. Intratumoral CD8(+) cytotoxic lymphocyte is a favorable prognostic marker in node-negative breast cancer. PLoS One. 9 (4), 95475 (2014).
- Reissfelder, C., et al. Tumor-specific cytotoxic T lymphocyte activity determines colorectal cancer patient prognosis. Journal of Clinical Investigation. 125 (2), 739-751 (2015).
- Muro, K., et al. Pan-Asian adapted ESMO Clinical Practice Guidelines for the management of patients with metastatic gastric cancer: a JSMO-ESMO initiative endorsed by CSCO, KSMO, MOS, SSO and TOS. Annals of Oncology. 30 (1), 19-33 (2019).
- Subhash, V. V., Yeo, M. S., Tan, W. L., Yong, W. P. Strategies and advancements in harnessing the immune system for gastric cancer immunotherapy. Journal of Immunology Research. 2015, 308574 (2015).
- Muro, K., et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncology. 17 (6), 717-726 (2016).
- Abdel-Rahman, O. PD-L1 expression and outcome of advanced melanoma patients treated with anti-PD-1/PD-L1 agents: a meta-analysis. Immunotherapy. 8 (9), 1081-1089 (2016).
- Abdel-Rahman, O. Correlation between PD-L1 expression and outcome of NSCLC patients treated with anti-PD-1/PD-L1 agents: A meta-analysis. Critical Reviews in Oncology/Hematology. 101, 75-85 (2016).
- Abdel-Rahman, O. Immune checkpoints aberrations and gastric cancer; assessment of prognostic value and evaluation of therapeutic potentials. Critical Reviews in Oncology/Hematology. 97, 65-71 (2016).
- Dijkstra, K. K., et al. Generation of tumor-reactive T cells by co-culture of peripheral blood lymphocytes and tumor organoids. Cell. 174 (6), 1586-1598 (2018).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Peng, C., Liu, J., Yang, G., Li, Y. The tumor-stromal ratio as a strong prognosticator for advanced gastric cancer patients: proposal of a new TSNM staging system. Journal of Gastroenterology. 53 (5), 606-617 (2018).
- Steele, N. G., et al. An organoid-based preclinical model of human gastric cancer. Cellular and Molecular Gastroenterology and Hepatology. 7 (1), 161-184 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены