Method Article
מודל תרבית משותפת של סרטן קיבה אוטולוגי שמקורו בבני אדם כדי לחזות את היעילות של טיפולים ממוקדים
* These authors contributed equally
In This Article
Summary
מטרות הפרוטוקול הן להשתמש בגישה זו כדי 1) להבין את תפקידה של מיקרו-סביבת גידול הקיבה המדכאת את מערכת החיסון ו-2) לחזות את יעילות תגובת החולה, ובכך להגדיל את שיעור ההישרדות של החולים.
Abstract
גידולים המבטאים ליגנד מוות תאי מתוכנת 1 (PD-L1) מקיימים אינטראקציה עם חלבון מוות תאי מתוכנת 1 (PD-1) על לימפוציטים T ציטוטוקסיים CD8+ (CTLs) כדי להתחמק ממעקב חיסוני המוביל לעיכוב התפשטות CTL, הישרדות ותפקוד אפקטור, וכתוצאה מכך התמדה בסרטן. כ-40% מסרטן הקיבה מבטא PD-L1, אך שיעור התגובה לאימונותרפיה הוא 30% בלבד. אנו מציגים את השימוש בתרבית משותפת של אורגנואידים / תאים חיסוניים של סרטן קיבה אוטולוגי שמקורו בבני אדם כמודל פרה-קליני שעשוי לחזות את יעילותם של טיפולים ממוקדים לשיפור התוצאות של חולי סרטן. למרות שדווח על תרביות אורגנואידים סרטניות עם תאים חיסוניים, גישת קו-תרבית זו משתמשת באנטיגן גידול כדי לדופק את התאים הדנדריטים המציגים אנטיגן. לאחר מכן מתרבית תאים דנדריטיים (DCs) עם תאי CD8+ T של המטופל כדי להרחיב את הפעילות הציטוליטית וההתפשטות של לימפוציטים מסוג T אלה לפני תרבית משותפת. בנוסף, ההתמיינות והתפקוד המדכא של תאים מדכאים שמקורם במיאלואיד (MDSCs) בתרבית נחקרים בתוך מערכת תרבית משותפת זו. גישה אורגנואידית זו עשויה להיות בעלת עניין רחב ומתאימה לניבוי יעילות הטיפול ותוצאות המטופל בסוגי סרטן אחרים, כולל סרטן הלבלב.
Introduction
סרטן הקיבה הוא הסרטן החמישי בשכיחותו בעולם 1. האבחון והטיפול היעילים בהליקובקטר פילורי (H. pylori) הביאו לשכיחות נמוכה של סרטן הקיבה בארצות הברית 2. עם זאת, שיעור ההישרדות ל-5 שנים עבור חולים המאובחנים עם ממאירות זו הוא רק 29%, מה שהופך את סרטן הקיבה לאתגר רפואי חשוב3. מטרת השיטות המוצגות כאן היא לפתח גישה לחיזוי מדויק של תגובות אימונותרפיות בחולים בודדים. גידולים מוצקים מורכבים מתאי סרטן וסוגים שונים של תאים סטרומליים, אנדותליים והמטופויאטיים, כולל מקרופאגים, תאים מדכאים שמקורם במיאלואיד (MDSCs) ולימפוציטים (נסקר ב-4,5). אינטראקציות בין תאי גזע סרטניים למיקרו-סביבת הגידול (TME) משפיעות באופן מהותי על מאפייני הגידול ועל תגובת המטופל לטיפול. גישה זו שואפת לאפשר לחוקרים לרכוש ידע לפיתוח תרופות פרה-קליניות וגילוי סמנים ביולוגיים לטיפול מותאם אישית בסרטן הקיבה.
השיטה המוצגת כאן משתמשת בתרביות אורגנואידים/תאים חיסוניים אוטולוגיים שמקורם בבני אדם שנוצרו מחולי סרטן הקיבה כדי להבין את התפקיד המדכא את מערכת החיסון של MDSCs. מוצג מודל פרה-קליני שעשוי לחזות את היעילות של טיפולים ממוקדים לשיפור ההישרדות של חולים. תרביות אורגנואידים סרטניות עם תאים חיסוניים דווחו בהרחבה בתחום סרטן הלבלב 6,7,8,9,10. עם זאת, תרביות משותפות כאלה לא דווחו לחקר סרטן הקיבה. בסך הכל, שיטה זו מדגימה את התרבות המשותפת של תאים חיסוניים אוטולוגיים שמקורם בבני אדם באותה סביבת מטריצה כמו האורגנואידים הסרטניים, ובכך מאפשרת לתאי החיסון להיות במגע עם האורגנואידים המטרה.
המחקר של Tiriac et al.10 דיווח כי ניתן לקבץ אורגנואידים של סרטן הלבלב שמקורם בחולה, שהפגינו תגובות הטרוגניות לכימותרפיה סטנדרטית, לחתימות ביטוי גנים מבוססות אורגנואידים של רגישות לכימותרפיה שיכולות לחזות תגובות משופרות של המטופלים לכימותרפיה. החוקרים הציעו כי פרופיל מולקולרי וטיפולי משולב של אורגנואידים של סרטן הלבלב עשוי לחזות תגובה קלינית10. נתוני ניסויים קליניים מ-Yao et al.11 הראו גם כי אורגנואידים שמקורם בסרטן פי הטבעת מייצגים פתופיזיולוגיה ושינויים גנטיים דומים לרקמות הגידול של המטופל בתגובה לכימותרפיה. לפיכך, חיוני להשתמש בתרביות אורגנואידים בהקשר של תאי החיסון של המטופל ופנוטיפ חיסוני של הגידול בעת שימוש בתרבויות אלו כמודלים לחיזוי לטיפול.
גידולים המבטאים PD-L1 המקיימים אינטראקציה עם PD-1 מעכבים את התפשטות לימפוציטים T ציטוטוקסיים CD8+, הישרדות ותפקוד אפקטור 12,13,14. בעוד שכ-40% מסרטן הקיבה מבטא PD-L1, רק 30% מהחולים הללו מגיבים לאימונותרפיה 15,16,17. נוגדנים נגד PD1 משמשים בניסויים קליניים לטיפול בסרטן הקיבה 18,19,20. עם זאת, אין כיום מודלים פרה-קליניים המאפשרים בדיקת יעילות טיפולית לכל מטופל. אופטימיזציה של תרבית האורגנואידים כך שתאי החיסון של המטופל ייכללו במערכת תאפשר זיהוי אינדיבידואלי של יעילות האימונותרפיה.
Protocol
התקבל אישור לאיסוף רקמות שנלקחו בביופסיה אנושית מגידולים של חולים (1912208231R001, התוכנית להגנה על נבדקים אנושיים של אוניברסיטת אריזונה; מספר פרוטוקול IRB: 1099985869R001 , התוכנית להגנה על נבדקים אנושיים של אוניברסיטת אריזונה TARGHETS).
1. קביעת אורגנואידים בקיבה שמקורם בחולה מביופסיות
- אסוף 1-2 מ"מ של רקמות ביופסיה אנושיות מאזור הגידול של חולי סרטן קיבה העוברים גסטרו-תריסריון בוושט בתמיסת מלח 1x חוצץ פוספט (PBS) (טבלה 1).
הערה: כל ההליכים מעתה ואילך צריכים להתבצע בסביבה אספטית באמצעות חומרים סטריליים וריאגנטים. - טוחנים את הרקמות שנלקחו באמצעות להבי אזמל על צלחת פטרי. מעבירים את הרקמות הטחונות לצינור חרוטי של 15 מ"ל ומוסיפים 5-10 מ"ל של 1x PBS.
- צנטריפוגה בחום של 300 × גרם למשך 5 דקות בטמפרטורת החדר. השליכו את הסופרנטנט. הוסף 1-2 מ"ל של מאגר עיכול מחומם מראש (טבלה 1) לרקמות הגלולות.
- דגירה בחום של 37 מעלות צלזיוס למשך 15-30 דקות, תלוי בגודל הרקמות הטחונות. עקוב אחר מצב העיכול על ידי התבוננות מתחת למיקרוסקופ אחר אשכולות תאים קטנים כל 5-10 דקות.
- עצרו את העיכול על ידי דילול פי 5 עם מדיום הנשר המותאם של Advanced Dulbecco / מדיום F-12 של Ham (Advanced DMEM/F-12). אם נראים גושים של חומר לא מעוכל, סנן את הרקמות דרך מסננים של 30 מיקרומטר. אסוף את הזרימה.
- צנטריפוגה את הזרימה ב-300 × גרם למשך 5 דקות בטמפרטורת החדר כדי לגלול את התאים. השליכו את הסופרנטנט.
- השעו מחדש את התאים הגלולים (10,000-100,000) בנפח מתאים (2-4 מ"ל) של מטריצת קרום הבסיס המופשרת (ראה טבלת החומרים) על קרח. זרע כמטריצת קרום תא 30-50 מיקרוליטר טיפות בלוחות תרבית של 24 בארות.
- דגרו את הלוחות בטמפרטורה של 37 מעלות צלזיוס למשך 15 דקות כדי לאפשר לטיפות מטריצת קרום התא-מרתף להתמצק. שכבו את טיפות מטריצת הממברנה של מרתף התא עם מדיום תרבית אורגנואיד בקיבה שחומם מראש (טבלה 1).
- שמור על תרביות אורגנואידים ב-37 מעלות צלזיוס ב-5% CO2. החלף את מדיום התרבות במדיום טרי כל 3-4 ימים, תלוי בגידול האורגנואיד. העבירו את האורגנואידים אחת ל-7-10 ימים ביחס של 1:3.
2. הקמת אורגנואידים בקיבה שמקורם בחולה מדגימות כירורגיות
- אסוף רקמות סרטן קיבה אנושיות מדגימות שנכרתו של חולי סרטן קיבה במהלך פרוצדורות כירורגיות בתמיסת מלח פוספט (DPBS) של Dulbecco בתוספת אנטיביוטיקה (טבלה 1).
הערה: יש לעבד את כל ההליכים להלן בארון בטיחות ביולוגית, תוך שמירה על סביבה אספטית ושימוש בחומרים סטריליים וריאגנטים. - טוחנים את הרקמות שנכרתו בעזרת להבי אזמל כירורגיים על צלחת פטרי. שוטפים את הרקמות הטחונות עם 5-10 מ"ל של 1x DPBS המכיל אנטיביוטיקה.
- העבירו את הרקמה לצינור חרוטי של 50 מ"ל. הוסף 10 מ"ל של חוצץ הפשטה של חומצה אתילנדיאמין טטראצטית (EDTA) שחומם מראש לרקמות הטחונות. עקוב אחר מצב העיכול כל 5-10 דקות. דגרו את הצינור בשייקר של 37 מעלות צלזיוס למשך 10 דקות.
- תן לרקמות להתיישב בתחתית הצינור, הסר את מאגר ה-EDTA מבלי להפריע לרקמות, והוסף 10 מ"ל של מאגר EDTA טרי. דגרו את הצינור בשייקר של 37 מעלות צלזיוס למשך 5 דקות.
- תן לרקמות להתיישב בתחתית הצינור. הסר את מאגר ה-EDTA ושטוף את הרקמות פעמיים (בצע את שלב 2.4) עם 10 מ"ל של DMEM/F-12 מתקדם בתוספת אנטיביוטיקה (ללא צנטריפוגה) (טבלה 1).
- הוסף 5-10 מ"ל של מאגר עיכול מחומם מראש (טבלה 1) לרקמות, תלוי בגודל הרקמה. דגרו את הצינור בטמפרטורה של 37 מעלות צלזיוס למשך 15-30 דקות עם תסיסה קלה, תלוי בגודל ובמרקם הרקמות. בדוק אם יש מראה של אשכולות תאים במיקרוסקופ כל 10 דקות.
- עצור את העיכול על ידי דילול כפול עם DMEM/F-12 מתקדם קר בתוספת אנטיביוטיקה. סנן את הרקמות הלא מעוכלות דרך מסננים של 40 מיקרומטר ואסוף את הזרימה.
- צנטריפוגה את הזרימה ב-400 × גרם למשך 5 דקות ב-4 מעלות צלזיוס כדי לגלול את התאים. השליכו את הסופרנטנט ושטפו את התאים ב-1x DPBS קר בתוספת אנטיביוטיקה ב-400 × גרם למשך 5 דקות ב-4 מעלות צלזיוס. השליכו בזהירות את הסופרנטנט ואחסנו את התאים על קרח.
- השעו מחדש את התאים הגלולים בנפח מתאים של מטריצת קרום הבסיס על קרח. זרעים 30-50 מיקרוליטר מטריצת קרום תאים-מרתף טיפות בצלחות שטופלו בתרבית תאים של 24 או 12 בארות.
- דגרו את הלוחות בטמפרטורה של 37 מעלות צלזיוס למשך 15 דקות כדי לאפשר לטיפות מטריצת קרום התא-מרתף להתמצק ככיפה. שכבו את כיפת מטריצת הממברנה של מרתף התא עם מדיום תרבית אורגנואיד בקיבה שחומם מראש (טבלה 1).
- שמור על תרביות האורגנואידים ב-37 מעלות צלזיוס ב-5% CO2. החלף את מדיום התרבות במדיום טרי כל 3-4 ימים, תלוי בגידול האורגנואיד. העבירו את האורגנואידים אחת ל-7-10 ימים ביחס של 1:2 או 1:3, בהתבסס על צפיפות האורגנואידים.
3. תחזוקה והרחבה של תרביות אורגנואידים
הערה: כל ההליכים צריכים להתבצע בסביבה אספטית באמצעות חומרים סטריליים וריאגנטים.
- תחזוקה והרחבה
- שמור על תרביות האורגנואידים במשך 7-10 ימים עד שהן מתכנסות 70-80%. קצרו את האורגנואידים ב-DMEM קר כקרח. העבירו את האורגנואידים לצינורות פוליסטירן תחתונים עגולים בנפח 5 מ"ל.
- צנטריפוגה את האורגנואידים ב-400 × גרם למשך 5 דקות ב-4 מעלות צלזיוס לתאי גלולה. הסר בזהירות את הסופרנטנט והשהה מחדש את הגלולה ב-1 מ"ל של תמיסת ריאגנט דיסוציאציה של תאים שחוממה מראש. דגרו על האורגנואידים בטמפרטורה של 37 מעלות צלזיוס למשך 6 דקות.
- העבירו בעדינות את האורגנואידים דרך מחט של 26 גרם 4 פעמים. הוסף 2 מ"ל של DMEM כדי לעצור את פעולת מגיב הדיסוציאציה של התאים.
- צנטריפוגה את האורגנואידים ב-400 × גרם למשך 5 דקות ב-4 מעלות צלזיוס כדי לגלול את התאים. השליכו בזהירות את הסופרנטנט ואחסנו את התאים על קרח.
- השעו מחדש את התאים הגלולים בנפח מתאים של מטריצת קרום הבסיס על קרח. זרע 30-50 מיקרוליטר של מטריצת קרום מרתף התא נופל בצלחות שטופלו בתרבית תאים של 24 או 12 בארות.
- דגרו את הלוחות בטמפרטורה של 37 מעלות צלזיוס למשך 15 דקות כדי לאפשר לטיפות מטריצת קרום התא-מרתף להתמצק ככיפה. שכבו את כיפת מטריצת הממברנה של התא-תא-בסיס עם מדיום תרבית אורגנואיד בקיבה שחומם מראש (ראה טבלה 1).
- שמור על תרביות האורגנואידים ב-37 מעלות צלזיוס ב-5% CO2. החלף את מדיום התרבות במדיום טרי כל 3-4 ימים, תלוי בגידול האורגנואיד. חזור על מעבר האורגנואידים אחת ל-7-10 ימים ביחס של 1:2 או 1:3, בהתבסס על צפיפות האורגנואידים.
- הרחבת קווי תאים שמקורם באורגנואידים
- קצרו את האורגנואידים כשהם מתכנסים 70-80%. האכילו את התאים הנצמדים לצלחות הפלסטיק במדיום תרבית אורגנואיד בקיבה ושמרו על התרבות על ידי האכלתם כל 3-4 ימים בהתאם לצמיחת התאים.
- עוברים את התאים כשהם מגיעים למפגש של 80-90%.
- הסר את מדיום התרבות ושטוף בעדינות את הצלחת עם DPBS מחומם מראש. הוסף 1 מ"ל של מגיב דיסוציאציה של תאים שחומם מראש.
- דגרו על התאים למשך 5 דקות בטמפרטורה של 37 מעלות צלזיוס. קצרו את התאים ב -2 מ"ל של DMEM.
- צנטריפוגה של התאים בטמפרטורה של 400 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס. הסר את הסופרנטנט והשהה מחדש את הגלולה במדיום תרבית אורגנואידים בקיבה או במדיום תרבית תאי אפיתל קיבה אנושיים (טבלה 1).
- צלחת את התאים מ- 3.2.2.3 בלוחות מצופים מטריצת קרום מרתף או מצופים ג'לטין. שמור על תרביות האורגנואידים ב-37 מעלות צלזיוס ב-5% CO2. החלף את המדיום במדיום טרי כל יום לסירוגין בהתאם לצמיחת התאים. חזור על מעבר התאים אחת ל- 7-10 ימים ביחס של 1:2 או 1:3, בהתבסס על צפיפות התאים.
- כדי לצפות את הלוחות במטריצת קרום מרתף, יש לדלל את המטריצה במים בדרגת תרבית תאים קרים כקרח ביחס של 1:10. מצפים את הצלחת באופן אחיד ב-1 מ"ל של תמיסת מטריצה מדוללת קרה כקרח באמצעות מפזר תאים, ודוגרים את הצלחת המצופה ב-37 מעלות צלזיוס למשך שעתיים. הסר את תמיסת הציפוי שנותרה ותן לצלחת להתייבש ללא המכסה בתוך מכסה המנוע למשך 30 דקות, ממש לפני ציפוי התאים.
- כדי לצפות את הצלחות בג'לטין, יש לצפות את הצלחת באופן אחיד ב -1 מ"ל של תמיסת ציפוי על בסיס ג'לטין קר כקרח. דגרו את הצלחת המצופה בטמפרטורת החדר למשך 5 דקות. הסר את תמיסת הג'לטין שנותרה וצלח את התאים התלויים.
4. תרבית תאים חיסוניים מתאים חד-גרעיניים בדם היקפי (PBMCs)
הערה: כל ההליכים צריכים להתבצע בסביבה אספטית באמצעות חומרים סטריליים וריאגנטים.
- בידוד PBMC
- לדלל דם מלא בנפח שווה של 1x PBS.
- בהתאם לנפח הכולל של דגימת הדם המדוללת, הוצא נפח מתאים של מדיום שיפוע צפיפות (ראה טבלת החומרים) לתוך צינור של 15 מ"ל.
הערה: היחס המומלץ הוא 3 מ"ל ממדיום שיפוע הצפיפות ל-4 מ"ל מדגימת הדם המדוללת. - שכב בזהירות את דגימת הדם המדוללת על מדיום שיפוע הצפיפות. צנטריפוגה ב-400 × גרם למשך 30 דקות-שעה ללא בלם.
- לאחר צנטריפוגה, העבירו בזהירות את התאים החד-גרעיניים בממשק לצינור חרוטי חדש של 15 מ"ל. מדללים את התאים החד-גרעיניים עם 3 נפחים של 1x PBS.
- צנטריפוגה בחום של 400 × גרם למשך 10 דקות. השליכו את הסופרנטנט. חזור על הפעולה פעם אחת.
- השעו מחדש את התאים הגלולים במדיום מתאים ליישומים במורד הזרם או שימור בהקפאה כמלאי קפוא.
- במידת הצורך, קבע את התפוקה ואת כדאיות התאים של PBMCs באמצעות מבחן אי הכללת הצבע הכחול של טריפאן.
- תרבית של תאים דנדריטיים אנושיים
- השעו מחדש את ה-PBMCs המבודדים במדיום PBMC (ראה טבלת החומרים וטבלה 1) וצלחו אותם בצלחת תרבית רקמה של 24 בארות למשך 1-2 שעות ב-37 מעלות צלזיוס ב-5% CO2.
- הקש בחוזקה על צלחת התרבות והשליך את מדיום התרבות המושקע המכיל תאים שאינם נדבקים.
- הוסף את מדיום תרבית DC (טבלה 1) לתאים הדבקים. שמרו על התרביות במשך 3 ימים בטמפרטורה של 37 מעלות צלזיוס ב-5% CO2. החלף את המדיום הסופרנטנט במדיום תרבית טרי בימים לסירוגין.
- ביום השלישי, החלף את המדיום המותש במדיום התבגרות DC טרי (טבלה 1). שמרו על התרביות למשך 24 שעות בטמפרטורה של 37 מעלות צלזיוס ב-5% CO2.
- תרבית של לימפוציטים T ציטוטוקסיים אנושיים (CTLs)
- העבירו 1 מ"ל של PBMCs לצינור תחתון עגול מפוליסטירן בנפח 5 מ"ל.
- הוסף 50 מיקרוליטר של קוקטייל העשרה (ראה טבלת החומרים) ל-PBMCs. דגירה למשך 10 דקות בטמפרטורת החדר.
- הוסף 150 מיקרוליטר של חלקיקים מגנטיים (טבלת חומרים) לדגימה. דוגרים למשך 5 דקות בטמפרטורת החדר.
- הגדל את נפח הדגימה ל-2.5 מ"ל עם מאגר הפרדת התאים (טבלת חומרים). הנח את הצינור התחתון העגול מפוליסטירן לתוך מגנט להפרדת תאים (טבלת חומרים) למשך 5 דקות כדי לאפשר הפרדת תאים.
- יוצקים את תרחיף התאים המועשר לצינור חרוטי חדש של 15 מ"ל. צנטריפוגה בחום של 300 × גרם למשך 5 דקות. השליכו את הסופרנטנט.
- השעו מחדש את התאים הגלולים והתרבית במדיום תרבית CTL (טבלה 1) למשך 24 שעות ב-37 מעלות צלזיוס ב-5% CO2.
- תרבית של תאים מדכאים שמקורם במיאלואיד אנושי (MDSCs)
- תרבית PBMCs במדיום תרבית MDSC (טבלה 1) למשך 7 ימים ב-37 מעלות צלזיוס ב-5% CO2 להעשרה עבור MDSCs. החלף את המדיום הסופרנטנטי במדיום תרבית טרי בימים לסירוגין.
- תרבית משותפת של DCs ו-CTLs
- אסוף מדיום מותנה מתרביות האורגנואידים.
- הסר בעדינות 50% מהמדיום מתרבית ה-DC הבשלה והחלף אותו במדיום מותנה שמקורו באורגנואיד.
- דגרו את ה-DCs עם המדיום המותנה שמקורו באורגנואיד למשך שעתיים ב-37 מעלות צלזיוס ב-5% CO2.
- קצרו את ה-DCs הדבקים באופן רופף וצנטריפוגה אותם ב-300 × גרם למשך 5 דקות ב-4 מעלות צלזיוס. הסר את הסופרנטנט, השהה מחדש את הגלולה במדיום תרבית משותפת RPMI, והוסף את תרחיף התאים הזה בחזרה לאותה באר.
- קצרו את ה-CTLs מאותו קו מטופלים והעבירו אותם ל-DCs הבוגרים. המשיכו בתרבית משותפת DC-CTL (טבלה 1) במשך 72 שעות ב-37 מעלות צלזיוס ב-5% CO2.
5. הקמת תרביות משותפות של תאים אורגנואידים/חיסוניים
- בודד CTLs מתרביות משותפות של DCs ו-CTLs באמצעות ערכה (ראה טבלת החומרים) כמתואר קודם לכן בסעיף 4.3.
- דגרו את ה-CTLs עם 5 מיקרומטר קרבוקסיפלואורסצאין דיאצטט אסתר סוקסינימידיל (CFSE) ב-37 מעלות צלזיוס למשך 20 דקות.
הערה: CFSE הוא צבע מעורר לייזר כחול המשמש לניטור זרימה ציטומטרית של חלוקות תאים. - קצרו את האורגנואידים וערבבו אותם עם CTLs המסומנים ב-CFSE. שמירה על יחס CTL/אורגנואידים על 50,000 CTLs לכל 200 אורגנואידים, השעו מחדש את האורגנואידים בנפח מתאים של מטריצת קרום הבסיס המופשרת על קרח. זרעים כמטריצת קרום תא 25 מיקרוליטר טיפות בלוחות תרבית רקמות של 24 בארות.
הערה: בתנאי ניסוי הדורשים MDSCs, ערבב את ה-MDSCs עם האורגנואידים ו-CTLs המסומנים ב-CFSE לפני הזריעה. יחס MDSC/CTL צריך להיות 4:1. - דגרו את הלוחות בטמפרטורה של 37 מעלות צלזיוס למשך 15 דקות כדי לאפשר לטיפות מטריצת קרום התא-מרתף להתמצק.
- שכבו את טיפות מטריצת הממברנה של מרתף התא עם מדיום תרבית אורגנואיד שחומם מראש.
- שמור על תרביות האורגנואידים/תאי החיסון ב-37 מעלות צלזיוס ב-5% CO2 עד לניתוח.
תוצאות
לאחר השלמתם, אורגנואידים בקיבה מופיעים ככדורים בתוך הבאר, בדרך כלל תוך 2-4 ימים לאחר ההטבעה (איור 1). איור 1A מדגים תרבית אורגנואיד קיבה משגשגת המציגה קרום רגיל. אורגנואידים של גידול יציגו לרוב מורפולוגיה שונה הייחודית לדגימת המטופל. תרביות לא מוצלחות ייראו צפופות או לא יציגו שום צמיחה מהעיכול הראשוני של הרקמה (איור 1B). תרבויות חזקות וצומחות באופן פעיל יעברו בהצלחה ויורחבו כמפורט בפרוטוקול. לעתים קרובות צפינו בנדידה ובהיצמדות של תת-אוכלוסייה של תאים לבסיס לוחית התרבית (איור 1C). בעקבות הפרוטוקול, התאים המחוברים האלה עשויים לעבור ולהרחיב אותם על לוחות תרבית תאים מצופים ג'לטין (איור 1D).
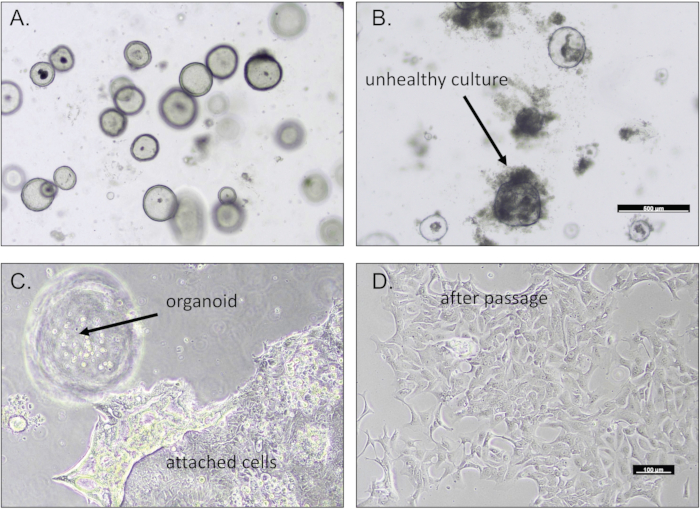
איור 1: אורגנואידים בקיבה שמקורם בביופסיות. תמונות מייצגות של (A) תרבית אורגנואידים חזקה בקיבה ו-(B) תרבית לא בריאה של אורגנואידים גוססים. (C) תאי קיבה לעיתים קרובות נודדים ונצמדים לבסיס צלחת התרבית. (D) תאי הקיבה האלה עשויים לעבור מעבר. פסי קנה מידה = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
פרוטוקול זה מתאר שיטה לתרבית DCs, MDSCs ו-CTLs מ-PBMCs של מטופלים. איור 2 מייצג את המורפולוגיה של תרביות תאי החיסון שמקורן ב-PBMCs. DCs בתרבית הראו צורה לא סדירה עם תהליכים דנדריטיים נרחבים ומוארכים (איור 2A). MDSCs מופיעים כתאים חד-גרעיניים גדולים בדרך כלל עם ציטופלזמה בזופילית וגרגירית (איור 2B). המורפולוגיה של CTLs בתרבית מוצגת באיור 2C. MDSCs גרנולוציטים עשויים להיות מאופיינים עוד יותר על ידי זרימה ציטומטרית באמצעות אסטרטגיית שער המזהה תאי HLA-DR/CD14-, CD33/CD11b/CD15+ .
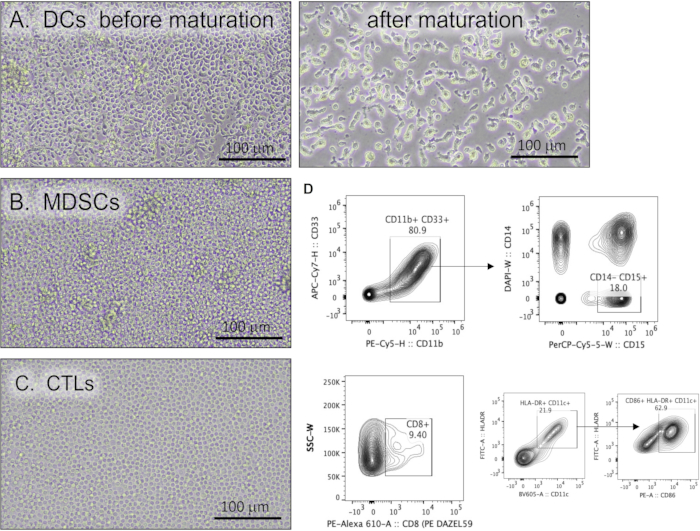
איור 2: תאי חיסון אנושיים שגודלו מ-PBMCs. מיקרוגרפי אור מייצגים של (A) תאים דנדריטיים לפני ואחרי פרוטוקול ההתבגרות, (B) תאים מדכאים שמקורם במיאלואיד, ו-(C) לימפוציטים T ציטוטוקסיים. פסי קנה מידה = 100 מיקרומטר. (D) עלילות מתאר ציטומטריות של זרימה מייצגת המדגימות סמני תאי חיסון. קיצורים: PBMCs = תאים חד-גרעיניים בדם היקפי; DCs = תאים דנדריטיים; MDSCs = תאים מדכאים שמקורם במיאלואיד; CTLs = לימפוציטים T ציטוטוקסיים; APC = אלופיקוציאנין; CD = אשכול התמיינות; PE = פיקואריתרין; H = גובה השיא; W = רוחב השיא; PerCP = חלבון פרידינין-כלורופיל; DAPI = 4′,6-דיאמידינו-2-פנילינדול; FITC = פלואורסצאין איזותיוציאנט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
אימונופלואורסצנציה של תרבית משותפת של תאים אורגנואידים/חיסוניים מדגימה את נוכחותם של CTLs (CD8+, ירוק) עם אורגנואידים של גידול (PD-L1+, אדום) (איור 3A-D). תמונה מעובדת בתלת מימד מוצגת בסרטון 1. מיקרוסקופ זמן-lapse מדגים את הנדידה של MDSCs ו-CTL לעבר האורגנואידים בקיבה (וידאו 2) ומוות אורגנואידים בתרביות שטופלו במעכב מחסום (וידאו 3).

איור 3: תרביות משותפות של תאים אורגנואידים/תאי חיסון של סרטן הקיבה. צביעה אימונופלואורסצנטית של תרבית משותפת מייצגת של אורגנואידים/תאים חיסוניים המראה ביטוי של (A) CD8+ (ירוק), (B) PD-L1 (אדום) ו-(C) Hoechst (כחול). תמונה ממוזגת מוצגת ב-(D). (E) צביעה אימונופלואורסצנטית של תרבית משותפת מייצגת של אורגנואידים/תאים חיסוניים המראה את הביטוי של MDSCs (CD11b, ירוק) ו-E cadherin (אדום). פסי קנה מידה = 50 מיקרומטר. קיצורים: CD = אשכול התמיינות; PD-L1 = ליגנד מוות תאי מתוכנת 1; MDSCs = תאים מדכאים שמקורם במיאלואיד; Hoechst = Hoechst 33258. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון 1: תמונה תלת מימדית מעובדת של תרבית משותפת של אורגנואידים/תאי חיסון של סרטן הקיבה המכילה תאי גידול PD-L1+ (אדום) ולימפוציטים CD8+ (ירוק). אנא לחץ כאן להורדת סרטון זה.
סרטון 2: מיקרוסקופ זמן-lapse של תרבית משותפת של תאים אורגנואידים/חיסוניים עמידים לטיפול במעכבי מחסום. אנא לחץ כאן להורדת סרטון זה.
סרטון 3: מיקרוסקופ זמן-lapse של תרבית משותפת של תאים אורגנואידים/חיסונים הרגישים לטיפול במעכבי מחסום. אנא לחץ כאן להורדת סרטון זה.
טבלה 1: הרכב המדיה ופתרונות. אנא לחץ כאן להורדת טבלה זו.
Discussion
אנו מציגים את השימוש בתרבית משותפת של סרטן קיבה אוטולוגי של סרטן קיבה / תאים חיסוניים שמקורם בבני אדם, שעשויה לשמש כמודל פרה-קליני לחיזוי היעילות של טיפולים ממוקדים כדי לשפר בסופו של דבר את תוצאות הטיפול ואת הפרוגנוזה של המטופל. למרות שדווח על תרביות משותפות של אורגנואידים סרטניים עם תאים חיסוניים, זהו הדיווח הראשון על מערכת תרבית משותפת כזו לחקר סרטן הקיבה. מאמצי פרופיל מטופלים רבים אחרים מבוססי אורגנואידים מפותחים היטב במספר מוסדות, כולל מודלים של תרבות משותפת. ישנן שלוש מערכות תרבית משותפת עיקריות, למיטב ידיעתנו, שפותחו, שיש להן את התכונות הבאות: 1) אורגנואידים של סרטן הלבלב שגודלו בתרבית משותפת עם תאים חיסוניים מחוץ לכיפת מטריצת קרום הבסיס6. הידבקות של תאי חיסון/גידול תהיה חשובה במערכת החוקרת את האינטראקציה בין PD-L1 ל-PD-1. 2) תרביות אוטולוגיות של תאים לא קטנים של ריאות וסרטן המעי הגס אורגנואידים/לימפוציטים בדם היקפי21.
כל הניסויים שבוצעו במחקר זה נערכו באמצעות לוחות מצופים נגד CD28 להפעלת תאי T, ותרביות משותפות בוצעו בנוכחות אינטרלוקין (IL)-2 כדי לשמור על התפשטות תאי T. למרות שלכל תרביות המבחנה יש מגבלות ואינן מייצגות לחלוטין תנאים פיזיולוגיים, תאי CD8+ T בתרביות אלה מופעלים באמצעות אנטיגן הגידול של המטופל ותאים מציגי אנטיגן דנדריטיים כדי להפעיל את תאי ה-T. גישה זו עשויה להיחשב קרובה יותר למה שמתרחש בתוך ה-TME. 3) שיטת ממשק אוויר-נוזל (ALI) להפצת אורגנואידים שמקורם בחולה22. החוקרים מציינים כי אורגנואידים הועברו כל 14-30 יום, ובמקרים מסוימים, המדיום הוסיף IL-2 אנושי רקומביננטי. ראשית, תחזוקה והרחבה של לימפוציטים ציטוטוקסיים CD8+ T דורשים יותר מסתם הוספת IL-2 למדיה ex vivo. שנית, עבור תרבית ארוכת טווח של תאי CD8+ T, נדרשת CD3/CD28 ראשונית ואחריה תחזוקה ב-IL-2 למשך 2-3 שבועות. גישה זו עשויה להיחשב כגישה מלאכותית להפעלת תאי T ואינה רלוונטית בתוך ה-TME.
המגבלות הנוכחיות של תרביות אורגנואידים שמקורן ברקמת הגידול הצדיקו את חידוד התרביות הללו עם תאים חיסוניים. לדוגמה, הסבירות לפלישת גידול מוגברת באופן משמעותי בחולים המציגים תא סטרומה צפוף, כמו זה שנצפה בסרטן קיבה פולשני23. לפיכך, זה עשוי להיות קשה לבידוד ולתרבית אורגנואידית של תאים חיסוניים מרקמת גידול חולה מקומית עם תא סטרומה צפוף, במיוחד בחולים עם פרוגנוזה גרועה. חשוב לציין, נתוני ריצוף RNA שפורסמו הראו שלמרות שיש דמיון פנוטיפי בין האורגנואידים לרקמת הגידול של המטופל, התא החיסוני חסרלמעשה 24. לפיכך, מגבלה של תרביות האורגנואידים וקו התאים הנוכחיות היא היעדר המרכיב החיסוני שנמצא בתוך ה-TME של המטופל.
השלבים הקריטיים בפרוטוקול כוללים יצירת תרבית אורגנואידים חזקה ותאי חיסון. הבעיה הנפוצה ביותר שנצפתה בתרביות אורגנואידים שמקורן בחולה היא זיהום חיידקי או פטרייתי. לפיכך, חשוב גם לכלול חומרים אנטי פטרייתיים ואנטיביוטיקה בעת שטיפת הרקמה לפני העיכול. ישנן גם מגבלות של התרבות שיטופלו בניסויים עתידיים. ראשית, ההטרוגניות של תרביות האורגנואידים עשויה להיחשב כמגבלה בעת חקירת אוכלוסיית התאים הספציפית אליה מכוונות אימונותרפיות וכימותרפיות. לעתים קרובות קשה לקבוע מתרביות אלה אם אורגנואיד בודד הוא משובט ונגזר מתא בודד. גישה עתידית עשויה להיות שימוש בגישה אנליטית של תא בודד כדי להשלים ניסויים במבחנה הבודקים טיפולים ממוקדים. שנית, ההטרוגניות של התאים בתוך התרבית עשויה שלא לשקף את המיקרו-סביבה המדויקת של הגידול של המטופל. ניתן להגדיל את המורכבות של תרביות אלו על ידי שילוב תאים בסיסיים נוספים, כולל מקרופאגים ופיברובלסטים הקשורים לסרטן. עם זאת, נעשה כאן שימוש בתרבית משותפת של תאים אורגנואידים/חיסוניים כדי לחקור שאלת מחקר ממוקדת לגבי האינטראקציות הבסיסיות של הגידול ותאי החיסון הרלוונטיות לתפקידם של MDSCs כתאים מדכאי חיסון. שלישית, דגימות נאספות מאתר הגידול הראשוני. הרקמה נאספת על פי החלטת הפתולוג. מחקר עתידי יתמקד באורגנואידים שמקורם באתרים גרורתיים, מה שעשוי לאפשר לנו לפענח את ההבדלים באורגנואידים הסרטניים על סמך המיקום ממנו נאספה הרקמה. בסך הכל, מערכת תרבית זו עשויה להיות בעלת עניין רחב ומתאימה לחיזוי יעילות הטיפול ותוצאות המטופל בסרטן אחר במערכת העיכול, כולל המעי הגס והלבלב.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק NIH (NIAID) 5U19AI11649105 (PIs: Weiss and Wells, Project Leader 1: Zavros) ו-NIH (NIDDK) 2 R01 DK083402-06A1 (PI: Zavros). פרויקט זה נתמך בחלקו על ידי מענק PHS P30 DK078392 (ליבת מורפולוגיה אינטגרטיבית) של מרכז הליבה לחקר מחלות העיכול בסינסינטי ו-5P30CA023074 מרכז הסרטן של אוניברסיטת אריזונה - מענק תמיכה במרכז הסרטן (PI: Sweasy). ברצוננו להודות לעזרתם של צ'ט קלוסון (ליבת מיקרוסקופיה חיה, אוניברסיטת סינסינטי) וחברי מעבדת זאברוס לשעבר, ד"ר נינה סטיל ולורין הולוקאי, על תרומתם לפיתוח מערכת התרבית האורגנואידית. אנו מודים מקרב לב למטופלים שהסכימו לתרום רקמות ודם לפיתוח תרביות האורגנואידים בקיבה/תאי מערכת החיסון. ללא נכונותם להשתתף במחקר, עבודה זו לא הייתה אפשרית.
Materials
| Name | Company | Catalog Number | Comments |
| 12 well plate | Midwest Scientific | 92012 | |
| 15 mL Falcon tube | Fisher scientific | 12-565-269 | |
| 24 well plate | Midwest Scientific | 92024 | |
| 30 μm filters | Miltenyi Biotec | 130-041-407 | |
| 40 μm filters (Fisher Scientific) | Fisher scientific | 352340 | |
| 5 mL round bottom polystyrene tubes | Fisher scientific | 14956-3C | |
| 50 mL Falcon tube | Fisher scientific | 12-565-271 | |
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634010 | |
| AIMV | Thermo Fisher Scientific | 12055091 | Basal medium for PBMCs and DCs |
| Amphotericin B/ Gentamicin | Thermo Fisher Scientific | R-01510 | |
| B-27 supplement | Thermo Fisher Scientific | 12587010 | |
| β-mercaptoethanol | Thermo Fisher Scientific | 800-120 | |
| Bone morphogenetic protein inhibitor (Noggin) | Peprotech | 250-38 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A7906 | |
| Cabozantinib | Selleckchem | S1119 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | Biolegend | 423801 | |
| Collagenase A | Sigma Aldrich | C9891 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Fisher scientific | 14190-144 | cell separation buffer |
| EasySep Buffer | Stem Cell Technologies | 20144 | Contains Enrichment Cocktail and Magnetic Particles used in CTL culture |
| EasySep Human CD8+ T Cell Enrichment Kit | Stem Cell Technologies | 19053 | cell separation magnet |
| EasySep Magnet | Stem Cell Technologies | SN12580 | |
| EDTA | Sigma Aldrich | E6758 | |
| Epidermal Growth Factor (EGF) | Peprotech | 315-09 | |
| Farma Series 3 Water Jacketed Incubator | Thermo Fisher Scientific | 4120 | |
| Fetal Calf Serum (FCS) | Atlanta Biologicals | SI2450H | |
| Fibroblast growth factor 10 (FGF-10) | Peprotech | 100-26 | density gradient medium |
| Ficoll-Paque | GE Healthcare | 171440-02 | |
| Gastrin 1 | Tocris | 30061 | |
| Gelatin | Cell Biologics | 6950 | |
| GM-CSF | Thermo Fisher Scientific | PHC6025 | |
| Hank's Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175095 | |
| HEPES (2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid) | Fisher scientific | BP299-100 | |
| Human Epithelial Cell Basal Medium | Cell Biologics | H6621 | |
| human serum AB | Gemini Bioscience | 21985023 | |
| Hyaluronidase Type IV-S | Sigma Aldrich | H3884 | |
| Insulin-Transferrin-Selenium | Thermo Fisher Scientific | 41400045 | |
| Interleukin 1β (IL-1β) | Thermo Fisher Scientific | RIL1BI | |
| Interleukin 6 (IL-6) | Thermo Fisher Scientific | RIL6I | |
| Interleukin 7 (IL-7) | Thermo Fisher Scientific | RP-8645 | |
| Kanamycin | Thermo Fisher Scientific | 11815024 | |
| L-glutamine | Fisher scientific | 350-50-061 | basement membrane matrix |
| Matrigel (Corning Life Sciences, Corning, NY) | Fisher scientific | CB40230C | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | |
| N-acetyl-L-cysteine | Sigma Aldrich | A7250 | |
| Nicotinamide (Nicotinamide) | Sigma Aldrich | N0636 | |
| PD-L1 inhibitor | Selleckchem | A2002 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | SV3000 | |
| Petridish | Fisher scientific | 07-202-030 | |
| Potassium chloride (KCl) | Fisher scientific | 18-605-517 | |
| Potassium dihydrogenphosphate (KH2PO4) | Fisher scientific | NC0229895 | |
| prostaglandin E2 (PGE2) | Sigma Aldrich | P0409 | |
| RPMI 1640 | Thermo Fisher Scientific | 11875119 | |
| Sodium chloride (NaCl) | Fisher scientific | 18-606-419 | |
| Sodium hydrogen phosphate (Na2HPO4) | Fisher scientific | NC0229893 | cell dissociation reagent |
| StemPro Accutase solution | Thermo Fisher Scientific | A1110501 | |
| Transforming growth factor beta 1 (TGF-β1) | Thermo Fisher Scientific | 7754-BH-005/CF | |
| Tumor necrosis factor α (TNF-α) | Thermo Fisher Scientific | PHC3015 | |
| Vascular endothelial growth factor (VEGF) | Thermo Fisher Scientific | RVGEFI | |
| Y-27632 ROCK inhibitor | Sigma Aldrich | Y0350 |
References
- Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), 359-386 (2015).
- Piazuelo, M. B., Epplein, M., Correa, P. Gastric cancer: an infectious disease. Infectious Disease Clinics of North America. 24 (4), 853-869 (2010).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 63 (1), 11-30 (2013).
- Quante, M., Wang, T. C. Inflammation and stem cells in gastrointestinal carcinogenesis. Physiology. 23, 350-359 (2008).
- Quante, M., Varga, J., Wang, T. C., Greten, F. R. The gastrointestinal tumor microenvironment. Gastroenterology. 145 (1), 63-78 (2013).
- Tsai, S., et al. Development of primary human pancreatic cancer organoids, matched stromal and immune cells and 3D tumor microenvironment models. BMC Cancer. 18 (1), 335 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Tiriac, H., et al. Successful creation of pancreatic cancer organoids by means of EUS-guided fine-needle biopsy sampling for personalized cancer treatment. Gastrointestinal Endoscopy. 87 (6), 1474-1480 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Yao, Y., et al. Patient-derived organoids predict chemoradiation responses of locally advanced rectal cancer. Cell Stem Cell. 26 (1), 17-26 (2020).
- Ahmadzadeh, M., et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood. 114 (8), 1537-1544 (2009).
- Chen, Z., et al. Intratumoral CD8(+) cytotoxic lymphocyte is a favorable prognostic marker in node-negative breast cancer. PLoS One. 9 (4), 95475 (2014).
- Reissfelder, C., et al. Tumor-specific cytotoxic T lymphocyte activity determines colorectal cancer patient prognosis. Journal of Clinical Investigation. 125 (2), 739-751 (2015).
- Muro, K., et al. Pan-Asian adapted ESMO Clinical Practice Guidelines for the management of patients with metastatic gastric cancer: a JSMO-ESMO initiative endorsed by CSCO, KSMO, MOS, SSO and TOS. Annals of Oncology. 30 (1), 19-33 (2019).
- Subhash, V. V., Yeo, M. S., Tan, W. L., Yong, W. P. Strategies and advancements in harnessing the immune system for gastric cancer immunotherapy. Journal of Immunology Research. 2015, 308574 (2015).
- Muro, K., et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncology. 17 (6), 717-726 (2016).
- Abdel-Rahman, O. PD-L1 expression and outcome of advanced melanoma patients treated with anti-PD-1/PD-L1 agents: a meta-analysis. Immunotherapy. 8 (9), 1081-1089 (2016).
- Abdel-Rahman, O. Correlation between PD-L1 expression and outcome of NSCLC patients treated with anti-PD-1/PD-L1 agents: A meta-analysis. Critical Reviews in Oncology/Hematology. 101, 75-85 (2016).
- Abdel-Rahman, O. Immune checkpoints aberrations and gastric cancer; assessment of prognostic value and evaluation of therapeutic potentials. Critical Reviews in Oncology/Hematology. 97, 65-71 (2016).
- Dijkstra, K. K., et al. Generation of tumor-reactive T cells by co-culture of peripheral blood lymphocytes and tumor organoids. Cell. 174 (6), 1586-1598 (2018).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Peng, C., Liu, J., Yang, G., Li, Y. The tumor-stromal ratio as a strong prognosticator for advanced gastric cancer patients: proposal of a new TSNM staging system. Journal of Gastroenterology. 53 (5), 606-617 (2018).
- Steele, N. G., et al. An organoid-based preclinical model of human gastric cancer. Cellular and Molecular Gastroenterology and Hepatology. 7 (1), 161-184 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved