Method Article
Визуализация, количественная оценка и картирование популяций иммунных клеток в микроокружении опухолей
В этой статье
Резюме
Здесь мы описываем простую и доступную стратегию визуализации, количественной оценки и картирования иммунных клеток в формалина-фиксированных парафин-встроенных секций опухолевых тканей. Эта методология сочетает в себе существующие методы визуализации и цифрового анализа с целью расширения возможностей мультиплексирования и многопарамесного анализа анализов изображений.
Аннотация
Иммунный ландшафт микроокружения опухоли (TME) является определяющим фактором в прогрессии рака и ответ на терапию. В частности, плотность и расположение иммунных клеток в TME имеют важные диагностические и прогноститические значения. Мультитомическое профилирование TME экспоненциально увеличило наше понимание многочисленных клеточных и молекулярных сетей, регулирующих инициацию и прогрессирование опухоли. Однако эти методы не дают информации о пространственной организации взаимодействий клеток или клеток. Доступные, доступные и простые в исполнении методы мультиплексирования, позволяющие пространственное разрешение иммунных клеток в сечениях тканей, необходимы для дополнения технологий высокой пропускной связи на основе одной клетки. Здесь мы описываем стратегию, которая интегрирует серийную визуализацию, последовательное обозначение и выравнивание изображения для создания виртуальных многопаративных слайдов целых секций ткани. Виртуальные слайды впоследствии анализируются автоматически с помощью пользовательских протоколов, которые позволяют идентифицировать, количественно и картографировать группы клеток, представляющие интерес. Анализ изображений выполняется, в данном случае с помощью аналитических модулей Tissuealign, Author и HISTOmap. Мы представляем пример, когда мы успешно применили эту стратегию к одному клиническому образцу, максимизируя информацию, которую можно получить из ограниченных образцов тканей, и обеспечивая объективное представление о TME во всей секции тканей.
Введение
Развитие рака является результатом многоступенчатого процесса, включающегося в взаимные взаимодействия между злокачественными клетками и ТМЭ. Помимо опухолевых клеток, TME состоит из незлокачественных клеток, стромальных клеток, популяций иммунных клеток и внеклеточной матрицы (ECM)1. Пространственная организация различных клеточных и структурных компонентов опухолевой ткани и динамический обмен между раком и соседними нераковыми клетками в конечном счете модулируют прогрессирование опухоли и ответ на терапию2,3,4. Было показано, что иммунный ответ при раке пространственно регулируется5,,6. Различные популяции иммунных клеток, проникающие в неопластическое повреждение и прилегающие ткани, обладают отличительными пространственными структурами распределения и разнообразными состояниями активации и дифференциации, связанными с различными функциями (например, про-против противоопухолевых). Эти различные иммунные популяции и их параметры coevolve сверхурочно с опухолью и стромальных отсеков.
Появление технологий, позволяющих профилировать одноклеточную мультиомику, экспоненциально повысило наше понимание многочисленных клеточных и молекулярных сетей, регулирующих канцерогенез и прогрессирование опухоли. Тем не менее, большинство одноклеточных высокопроизводительных аналитических инструментов требуют нарушения тканей и изоляции одноклеточных клеток, что приводит к потере информации о пространственной организации клеток и взаимодействий клеток7. Поскольку расположение и расположение конкретных иммунных клеток в TME имеют диагностическое и прогностическое значение, технологии, позволяющие пространственное разрешение являются важным дополнением методов иммунного профилирования на основе одной клетки.
Традиционно методы визуализации, такие как иммуногистохимия (IHC) и мультиплекс иммунофлуоресценция (mIF) были ограничены небольшим количеством биомаркеров, которые могут быть визуализированы одновременно. Это ограничение препятствует изучению пространственно-временной динамики инфильтрационных иммунных клеток, которые обычно определяются несколькими фенотипическими маркерами. Последние достижения в области визуализации и аналитических инструментов расширили возможности мультиплексирования. Новые антитела на основе технологий маркировки, как гисто-цитометрия и визуализации массы цитометрии были использованы для пространственно отделить до 12 и 32 биомаркеров, соответственно8,9. Масс-спектрометрия изображения, техника, не требующая маркировки, имеет потенциал для изображения тысячи биомаркеров одновременно в одной ткани раздел10,11. Хотя эти методы уже показали большой потенциал для вскрытия иммунного ландшафта тканей при раке, они используют очень сложное и дорогостоящее оборудование и программное обеспечение и не легко доступны для большинства исследователей.
Кроме того, мультиплексирование возможности традиционных IHC и mIF была расширена за счет использования серийных изображений, последовательных раундов маркировки, и спектральной визуализации7,12,13,14,15,16. Эти методы генерируют несколько изображений из одних и тех же или из последовательных секций тканей, которые могут быть объединены в виртуальные многопаративные слайды с помощью программного обеспечения для анализа изображений. В результате одновременно увеличивается количество маркеров, которые можно визуализировать и анализировать.
Здесь мы предлагаем стратегию рационального проектирования анализов мультиплексов тканей с использованием коммерчески доступных реагентов, доступного оборудования для микроскопии и удобного программного обеспечения(рисунок 1). Эта методология интегрирует серийную визуализацию, последовательное мультиплексное обозначение, визуализацию целых тканей и выравнивание тканей для создания виртуальных многопаративных слайдов, которые могут быть использованы для автоматической количественной оценки и картирования иммунных клеток в сечениях тканей. Используя эту стратегию, мы создали один виртуальный слайд, состоящий из 11 биомаркеров плюс два часто используемых гистологических пятен: гематоксилин и эосин (H и E) и picrosirius красный (PSR). Несколько популяций иммунных клеток были определены, расположены и количественно в различных отсеках ткани и их пространственное распределение решена с помощью тканях тепловых карт. Эта стратегия максимизирует информацию, которая может быть получена из ограниченных клинических образцов и применима к формалин-фиксированной парафина встроенных (FFPE) архивные образцы тканей, в том числе целые ткани, биопсии основных игл, и ткани microarrays. Мы предлагаем эту методологию в качестве полезного руководства для разработки пользовательских анализов для идентификации, количественной оценки и картирования популяций иммунных клеток в TME.
протокол
Три серийных раздела FFPE от резецированного вируса гепатита В (HBV), связанного с гепатоцеллюлярной карциномой человека, были получены в Центре госпитальера Монреаля (CHUM) Гепатопанкратобилиарного рака клинической базы данных и биологических образцов Репозиторий (HBP Biobank). Пациенты, участвующие в этом банке тканей, предоставили информированное согласие. Это исследование было одобрено институциональным комитетом по этике (Протокол No 09.237) и проведено в соответствии с Хельсинкской декларацией.
1. Протокол окрашивания гематоксилина и эозина (Н и Е)
ПРИМЕЧАНИЕ: Н И E окрашивания была выполнена молекулярной патологии основной объект Центра де Recherches дю Центр hospitalier де l'Университет Монреаля (CRCHUM) с использованием Shandon многопрограммного робота слайд пятно с использованием следующей программы.
- Для депарафинизации, погрузить слайды 3x для 2,5 мин каждый в заменители ксилена.
ВНИМАНИЕ: Заменители ксилена легковоспламеняющиеся, раздражители кожи, и вредны при вдыхании. - Для регидратации погрузите слайды в 100% этанол 3x по 2,5 мин каждый. Вымойте в течение 1 мин в двойной дистиллированной воды (ddH2O) для регидратации.
- Инкубировать 1 мин в гематоксилин. Вымойте 3x в течение 1 мин каждый в ddH2O.
- Инкубировать в течение 5 с эозином. Вымойте 30 с 95% этанола. Вымойте 2x в течение 1 мин со 100% этанолом.
ВНИМАНИЕ: Этанол является легковоспламеняющимся и глаз раздражает. Эозин является раздражающим глаз. - Для обезвоживания погрузите 3x на 1,5 мин каждый в заменитель ксилена. Монтировать слайды вручную.
ПРИМЕЧАНИЕ: Предполагаемое время выполнения этой части протокола составляет 30 минут.
2. Протокол окрашивания иммунофлюоресценции multiplex для разделов FFPE
ПРИМЕЧАНИЕ: Этот протокол был адаптирован из Робертсон и др.17.
- Депараффинизация и регидратация
ПРИМЕЧАНИЕ: Перед антителами опосредованного маркировки разделов FFPE IHC или mIF, парафин должен быть удален. Неспособность эффективно удалить парафин приводит к неоптимальным окрашивания.- Поместите 4 мкм раздел ткани FFPE слайды в стеклянные держатели слайд. Под капотом дыма, погрузите горки в банку Коплин, содержащий 37 градусов по Цельсию предварительно разогретый ксилен в течение 10 минут.
ВНИМАНИЕ: Ксилен является легковоспламеняющимся, раздражает кожу, и вредно при вдыхании. - Вручную агитировать слайды в течение 10 с каждые 2 мин. Повторите 1x в свежем ксилене еще 5 мин.
- В химическом капоте, погрузить горки последовательно в течение 5 минут в каждом из следующих решений: 1) ксилен : этанол (1:1 v/v); 2) 100% этанол; 3) 70% этанола; 4) 50% этанола; 5) 30% этанола; 6) фосфат-буферный солен (PBS).
ПРИМЕЧАНИЕ: Держите слайды в PBS до готовности к выполнению поиска антигена. Держите dewaxed разделы гидратированных во все времена. Высыхание вызовет неспецифические связывания антител и, следовательно, высокий фон окрашивания.
- Поместите 4 мкм раздел ткани FFPE слайды в стеклянные держатели слайд. Под капотом дыма, погрузите горки в банку Коплин, содержащий 37 градусов по Цельсию предварительно разогретый ксилен в течение 10 минут.
- Тепло-индуцированный антиген поиска
ПРИМЕЧАНИЕ: Антигены могут быть замаскированы при формалино-фиксации, предотвращая связывание антител и, следовательно, визуализацию. Использование антигенных буферов и процедур частично восстанавливает родную конформацию эпитопов и тем самым восстанавливает распознавание антител. Тип буфера поиска антигена и продолжительность должны быть оптимизированы для конкретных условий асссе (например, целевой, антител, тканей и т.д.).- Погружение dewaxed слайды в банку Коплин, содержащий антигена извлечения решения (рецепт в таблице материалов).
- Поместите закрытую банку Коплин в электрическую скороварку с водопроводной водой. Уровень воды не должен превышать половину высоты банки, чтобы вода не смешивается с раствором извлечения антигена.
- Закройте крышку и клапан давления плиты. Выберите высокое давление в течение 10 минут и начните. После этого отключите плиту, отпустите давление, откройте крышку и держите банку внутри плиты в течение 30 минут, что позволяет слайдам остыть.
- Блокирование неспецифической привязки
- Перенесите стойку со слайдами в банку Коплин, наполненную PBS. Снимите буфер поиска антигена с PBS 2x в течение 5 минут каждый.
- Окружите секции тканей пером PAP, чтобы создать гидрофобный барьер. Погрузите слайды в банку Коплина, содержащую 0,1 м глицина в PBS. Инкубировать в течение 15 минут при комнатной температуре (RT).
ПРИМЕЧАНИЕ: Глицин насыщает группы альдегидов, генерируемые во время поиска антигена. Эти группы могут связывать первичные и вторичные антитела неспецифически. - Смойте раствор глицина путем мытья 2x с PBS в течение 5 мин. Поместите слайды в камеру влажности и добавьте достаточно блокирующий раствор, чтобы покрыть все участки ткани. Избегайте переполнения гидрофобного барьера. Инкубировать в течение 30 минут на RT.
ПРИМЕЧАНИЕ: Рецепт решения для блокировки можно найти в таблице материалов. Блокирующий раствор должен содержать белок (например, BSA) для блокирования неспецифических узлов. Он также может включать моющие средства, такие как Triton X-100 или Tween 20, которые уменьшают гидрофобные взаимодействия между антителами и тканевыми целями, тем самым делая распознавание антигена более избирательным. Добавление 10% общей сыворотки от видов, где ткань приходит из будет блокировать fc рецепторов, и, таким образом, уменьшить неспецифические связывания антител. Наконец, добавление 10% сыворотки от вида вторичные антитела были подняты в бы свести к минимуму прямое неспецифическое присоединение вторичных антител к разделу ткани.
- Маркировка иммунофлюоресценции
- Промыть PBS-Tween (0,1% v/v) 2x на 5 минут каждый и поместите горки обратно в камеру влажности.
- Добавьте коктейль из первичных антител, переплета в блокирующий раствор. Инкубировать на ночь при 4 градусах Цельсия. Первичные и вторичные антитела, используемые для этого исследования, перечислены в таблице материалов.
ПРИМЕЧАНИЕ: Коктейль первичных антител должен содержать либо антитела, выращенные у разных видов, либо от одного и того же вида, но разных изотипов. Для списка первично-вторичных пар антител, используемых в этом исследовании проконсультироваться Таблица 2. Подробная информация обо всех используемых антителах в таблице материалов и таблице 2. - Промыть PBS-Tween (0,1% v/v) 3x на 5 мин и поместите слайды обратно в камеру влажности. В темноте добавьте коктейль из вторичных антител и инкубировать по 1 ч на RT.
ПРИМЕЧАНИЕ: Когда первичные антитела от различных видов, вторичные антитела должны быть выбраны так, что каждое из них только связывается с одним из первичных антител, а не друг с другом. Это обычно достигается с помощью вторичных антител все поднятые в том же виде до тех пор, как этот вид отличается от видов, где первичные антитела были созданы. В тех случаях, когда первичные антитела были подняты в том же виде, но имеют различные изотипы, изотип конкретных вторичных антител должны быть использованы. - Промыть pbS-Tween (0,1% v/v) 3x на 5 мин каждый. Промыть с ddH2O. Удалить лишнюю жидкость и смонтировать в монтаже носителя с DAPI. Используемый объем зависит от размера раздела. Обычно 40 зЛ достаточно, чтобы покрыть поверхность обычной микроскопии слайда.
- Поместите крышку слайд на секцию и осторожно выжать избыток монтажа средств избежать образования пузыря. Пусть слайды высохнут в течение 20 минут на RT в темноте и хранить при 4 кв С до тех пор, пока готовы к приобретению.
- Приобретайте изображения для всех каналов с помощью всего слайд-сканера (см. Таблица Материалов).
ПРИМЕЧАНИЕ: Антитела были проверены с использованием ткани гепатоцеллюлярной карциномы человека в качестве положительного контроля. Для каждого основного антитела, три серийных раздела были окрашены либо первичного антитела, изотип управления, или только блокирование решения, соответственно, без каких-либо изменений в остальной части протокола окрашивания. Приобретенные изображения были сопоставлены для установления специфики окрашивания. Окрашивание считалось специфическим, когда сигнал в секции, инкубированный первичным антителом, имел ожидаемый узор и легко отличался от фона. Первичные антитела, дающие высокий фоновый сигнал или маркировки компонентов ткани в изотипе и не первичные секции антител считались неспецифическими. Ориентировочное время для завершения этой части протокола составляет 2 дня. Необходимые меры контроля включают: (1) изотипный контроль для установления вклада неспецифической связывания первичного антитела к фоновому сигналу. Один раздел окрашен таким же образом, как и другие ткани образца, за исключением того, что он инкубируется с антителом с тем же изотипом и происхождение первичного антитела, но специфические для цели, которая отсутствует в разделе ткани. Если соответствующее антитело контроля изотипа не доступно, его можно заменить общим IgG из того же вида, где было поднято первичное антитело; (2) Нет первичного контроля антител (т.е. отрицательного контроля), чтобы установить специфику окрашивания и оценить вклад неспецифической связывания вторичных антител в фоновый сигнал. В этом случае контрольная секция запятнана так же, как и другие разделы, за исключением того, что первичное антитело не добавляется; (3) Положительный контроль, чтобы установить, что окрашивание работает. В этом случае, окрашивание выполняется на секции ткани, которая, как известно, выразить маркер, признанный первичным антителом.
3. Picro-sirius красный (PSR)/быстрый зеленый протокол окрашивания
ПРИМЕЧАНИЕ: Цель этого окрашивания заключается в том, чтобы визуализировать фибриллярные коллагены I и III в разделах ткани FFPE. Этот протокол был адаптирован из Segnani et al.18. Все шаги выполняются химическим капотом.
- Выполните депарафинизацию и регидратацию секций тканей, сходных с протоколом окрашивания мультиплекса иммунофлюоресценции для секций FFPE (раздел 2.1).
ПРИМЕЧАНИЕ: Если раздел, который будет окрашен ранее был использован для маркировки иммунофлюоресценции и парафин уже удалены, депарафинизации регидратации шаги полезны для удаления монтажа средств массовой информации. DAPI не удаляется с помощью этой процедуры, но он не восспринимаю вмешивается в окрашивание PSR. - Погрузите слайды в банку, содержащую picro-sirius красный/быстрый зеленый раствор (рецепт в таблице материалов)и инкубировать в течение 30 минут на RT (более 30 минут приводит к неспецифическому окрашиванию ядер гепатоцитов).
- Вымойте слайды быстро в ddH2O (5 провалов). Затем быстро промыть в этаноле 100% (5 провалов). Вымойте на 30 с ксилена-100% этанола (1:1 v/v). Вымойте на 30 с ксилена. Гора с монтажом средств (см. Таблица материалов) до ксилена полностью испарился (это помогает с монтажом).
ПРИМЕЧАНИЕ: Предполагаемое время выполнения этой части протокола составляет 1 ч.
4. Вырабатывание антител из секций тканей
ПРИМЕЧАНИЕ: Для повторного использования разделов тканей в последовательных анализов маркировки, полное удаление первичных и вторичных антител не требуется. Связанные антитела были лишены, как ранее описано13.
Разогреть водяную баню до 56 градусов по Цельсию. Положите разделы внутри банки, содержащей зачистки буфера (рецепт в таблице материалов),закрыть крышку, и запечатать его с парафина ленты пленки для предотвращения утечки во время встряхивания.
- Положите банку внутри водяной бани и инкубировать в течение 30 минут с возбуждением.
- Вымойте 4x для 15 мин каждый в ddH2O на RT. Промыть с PBS-Tween (0,1% v/v).
- Держите разделы гидратированных в PBS-Tween или воды до готовности к повторному зонду раздела со вторым раундом первичных антител.
ПРИМЕЧАНИЕ: Предполагаемое время выполнения этой части протокола составляет 2 ч. - Проверьте эффективность процедуры элюции антител.
ПРИМЕЧАНИЕ: Перед использованием протокола для выравнивания антител в последовательной проверки маркировки, эффективность удаления первичных и вторичных антител должны быть проверены.- Выполните окрашивание и приобретение изображения раздела с данной первичной вторичной пары антител интерес, как указано в мультиплекс иммунофлуоресцентного окрашивания протокол для разделов FFPE (разделы 2.1-2.4.6).
- При приобретении изображения выполните элявизию связанных с тканью первичных вторичных комплексов антител, указанных в разделах 4.1-4.3.
- Инкубировать секцию теми же вторичными антителами и теми же условиями, используемыми в шаге 2.4.3.
- Выполните шаги по мытью, монтажу и приобретению изображения, указанные в 2.4.4-2.4.6.
- Сравните бок о бок изображения, приобретенные до и после зачистки, чтобы установить, действительно ли конкретный сигнал исчез.
ПРИМЕЧАНИЕ: Сравнение изображений до и после удаления антител подтвердит эффективность процедуры elution. Тем не менее, это нормально, чтобы увидеть увеличение фонового сигнала во всех каналах, а также диффузии DAPI. Это ограничивает количество раундов зачистки, которые могут быть выполнены на той же секции ткани. Три раунда зачистки, кажется, максимум.
5. Приобретение изображения
- Создание изображений с помощью целого слайд-сканера.
- Используйте объектив объективного объектива 20x 0.75NA и разрешение 0.3225 мкм/пиксель.
6. Анализ изображений
ПРИМЕЧАНИЕ: Метод, описанный здесь, относится к текущему примеру. Пожалуйста, обратитесь к таблице 1 и тексту, чтобы адаптироваться к другим конкретным примерам.
- Выполните выравнивание тканей с помощью модуля Tissualign программного обеспечения для анализа изображений (VIS в этом протоколе, см. Таблица материалов).
- Откройте программное обеспечение для анализа изображений и нажмите на вкладку Tissuealign.
- Импорт изображения, которые будут выровнены в слайд Трей, перейдя в файл (ru) База данных и выберите первое изображение, подавнее. Вернитесь к вкладке Tissuealign и загрузите изображение, нажав кнопку Нагрузка в Slide Tray. Изображение будет отображаться в Slide Tray и в рабочем пространстве.
ПРИМЕЧАНИЕ: Только стопка интересов должна быть загружена в лоток слайда. - Повторите шаг 6.1.2 для всех изображений в порядке выравнивания, загружая их по одному. После того, как все изображения интереса загружаются на слайд лоток приступить к ссылке изображения, нажав Далее в рабочего процесса Шаги в ленте.
- Затем перетащите и удалите второе изображение поверх первого изображения. Первое и второе изображения теперь связаны между собой. Повторите этот шаг для других изображений, которые будут выровнены, один за другим, в упорядоченной форме. Имя первого изображения будет меняться, что указывает на то, что оно было связано с другими изображениями. Одновременно связанные изображения будут отображаться в рабочей области справа от лотка слайда.
- На этом этапе выравнивать изображения либо с помощью автоматического выравнивания, полуавтоматического выравнивания, либо ручного выравнивания. Это всегда предпочтительнее, чтобы попробовать автоматическое выравнивание в первую очередь. Для автоматического выравнивания нажмите кнопку «Следующая» в шагах рабочего процесса (шаг 3) в ленте.
- Просмотрите автоматическое выравнивание путем навигации по различным местоположениям ткани и визуально проверяя, что соответствующие структуры в разных изображениях расположены одинаково в двух измерениях изображения.
- Если результат автоматического выравнивания не является удовлетворительным, улучшайте его с помощью контактов (использовать минимум три контакта на изображение), указывающих на гомологичные особенности ткани в связанных изображениях. После того, как контакты размещаются в гомологичных местах в связанных изображениях, пользователь имеет два варианта: полуавтоматическое выравнивание или ручное выравнивание. Для полуавтоматического выравнивания нажмите на кнопку Автовыравнивание на основе текущих точек в ленте. Для ручного выравнивания нажмите кнопку Apply Pins на ленте.
- При удовлетворенности выравниванием нажмите на кнопку Next в шагах рабочего процесса и сохраните композитное изображение в базе данных.
ПРИМЕЧАНИЕ: Выравнивание шести слайдов, охватывающих 11 маркеров плюс H и E и PSR изображения приняли 15 минут в анализе представлены.
- Выполните обнаружение тканей с помощью пользовательского протокола Анализ протокола Пакет 1 (APP 1, таблица 1).
- Откройте модуль анализа изображений программного обеспечения, нажав на вкладку анализа изображений в ленте.
- Импортируйте композитное (выровненое) изображение, перейдя в Файл База данных и выбор изображения интереса и нажатие назад вкладке анализа изображений.
- Откройте диалог выбора APP, нажав на значок Open APP и выберите, какой пакет протокола анализа (APP) использовать. В этом случае выберите APP 1 для обнаружения тканей.
- Как только APP 1 открыт, подтвердите, что APP1 работает должным образом, перейдя в выбранное место ткани и нажав на кнопку Preview. Если результаты являются удовлетворительными, перейдите к следующему шагу.
- Нажмите, чтобы запустить APP 1 и обработать изображение с помощью выбранного ПРИЛОЖЕНИЯ.
- Экспортданные данные (например, изображения, измерения и т.д.), когда анализ выполняется, нажав файл/экспорт.
ПРИМЕЧАНИЕ: APP 1 создает область интереса (ROI) очерчивая ткани (ROI Ткань) и вычисляет область ткани. - Сохранить измененное изображение с недавно созданной рентабельностью инвестиций, перейдя в файл Сохранить.
ПРИМЕЧАНИЕ: Обнаружение ткани и создание рентабельности инвестиций с помощью APP 1 в приведенном примере заняло 5 минут в описанной станции анализа изображений. Площадь обработанной ткани составила 3,2 см2.
- Выполните сегментацию тканей в Строму и Паренхиму с помощью APP 2(Таблица 1).
ПРИМЕЧАНИЕ: APP 2 работает на предопределенных ROI ткани. APP 2 сегментирует ткани в ROIs Stroma и Parenchyma.- Откройте модуль анализа изображений, нажав на вкладку «Анализ изображений» в ленте.
- Импортируйте изображение, содержащее ткани roI, перейдя в файл База данных и выбор изображения сохранены в шаге 6.2.7. Вернитесь к вкладке «Анализ изображений» и загрузите изображение, нажав кнопку «Нагрузка» в Slide Tray. Изображение будет отображаться в Slide Tray и в рабочем пространстве.
- Открыть APP 2 с использованием диалога выбора APP как в 6.2.3.
- Предварительный просмотр APP 2 путем обработки в выбранном поле зрения. Если результаты удовлетворительны, запустите APP 2 на полном изображении, нажав кнопку Run. Как выход APP 2, roI ткани сегментированы в ROIs Строма и Parenchyma и их соответствующих областях определяется. Результатэкспорта - 6.2,6. Сохранить измененное изображение, как в 6.2.7.
ПРИМЕЧАНИЕ: Сегментация ткани в Строма и Паренхима с помощью APP 2 взял 4 ч в анализ станции представлены. Площадь обработанной ткани составила 3,2 см2.
- Определите и количественно определите ячейки FoxP3hiCD4 с помощью пользовательского протокола APP 3(таблица 1).
ПРИМЕЧАНИЕ: APP 3 работает на предопределенных ROIs Строма и Parenchyma.- Откройте модуль анализа изображений и импортируйте изображение, содержащее ROIs Stroma и Parenchyma как в 6.3.1 и 6.3.2. Открыть APP 3 с использованием диалога выбора APP как в 6.2.3.
- Предварительный просмотр обработки APP 3 в выбранном поле зрения, обогащенном в клетках FoxP3hiCD4. Если результаты являются удовлетворительными, запустите APP 3 на полном изображении. Как выход APP 3, все отдельные объекты FoxP3приветCD4 "будут помечены и их ткани координаты хранятся. Будут определены плотности объектов FoxP3hiCD4 в ROIs Stroma и Parenchyma. Экспорт результатов как в 6.2.6.
- Выполните ткани heatmapping FoxP3приветCD4 "помечены объекты.
- Откройте пользовательский протокол FoxP3приветCD4 "MAP с помощью диалога выбора APP, как в 6.2.3.
ПРИМЕЧАНИЕ: FoxP3приветCD4 "MAP использует координаты FoxP3приветCD4" помечены объекты для генерации тепловых карт плотности. Выявление и подсчет FoxP3приветCD4 "помеченных объектов с помощью APP 3 занимает 25 минут в изображении анализа станции описано. Площадь обработанной ткани составила 3,2 см2. - Выполнить FoxP3приветCD4 "MAP, нажав кнопку Run. Экспорт ткани тепловой карты, нажав файл (ru) Экспорт (англ.) Рабочая зона.
ПРИМЕЧАНИЕ: Картирование FoxP3приветCD4 "помечены объекты с помощью FoxP3приветCD4" MAP взял 5 минут в изображении анализа станции описаны.
- Откройте пользовательский протокол FoxP3приветCD4 "MAP с помощью диалога выбора APP, как в 6.2.3.
- Определите и количественно определите объекты CD8, CD68, MPO, «SMA» и CD34 с использованием пользовательских протоколов APP 4, APP5, APP6, APP7 и APP 8, соответственно(таблица 1), как это делается в разделе 6.4 до 6.4.3.2 загрузки APP интереса в каждом случае.
ПРИМЕЧАНИЕ: ApPs от 4 до 8 работы по заранее ROIs Строма и Parenchyma.
Результаты
Обзор стратегии визуализации, количественной оценки и картирования групп ячеек, представляющих интерес для ТМЕ
Для количественной оценки групповых популяций, представляющих интерес (COIs) в различных отсеках тканей (ТС) и для характеристики их пространственной организации, мы разработали рабочий процесс, который интегрирует доступные и простые в использовании методы и максимизирует позиционную информацию, которую можно получить из драгоценных клинических образцов FFPE (Рисунок 1). Во-первых, серийные разделы цельной ткани FFPE были окрашены для визуализации COIs (например, иммунные клетки) и ТК (например, строма против паренхимы) (Рисунок 1, шаг 1). Количество последовательных разделов, которые должны быть окрашены должны быть сведены к минимуму, что позволяет визуализации клеток, представляющих интерес или ткани особенности, необходимые для решения исследовательского вопроса. Чем меньше количество серийных секций, тем выше сходство и согласованность архитектуры тканей между смежными секциями. Кроме того, мультиплексирование возможность может быть расширена за счет повторного использования флуоресцентно окрашенных разделов путем зачистки и reprobing методы19.
После того, как шаги окрашивания были сделаны, целый слайд сканер был использован для оцифровки изображений. Изображения, полученные из серийных разделов, были выровнены и объединены в виртуальный мультиплекс слайд в автоматизированном режиме(Рисунок 1, раздел 2). Далее рентабельность инвестиций для ткани была очерчена с помощью пользовательского протокола, который идентифицировал связанные с тканью пиксели (TAPs)(рисунок 1,шаг 3). Впоследствии, ткань рентабельности инвестиций была сегментирована в ТК, определяемые как дополнительные рентабельность инвестиций. (Рисунок 1,шаг 4). Далее, пользовательские протоколы обнаружены и количественно COIs в различных ТК(рисунок 1,шаг 5). Наконец, ткани тепловые карты COIs были созданы на основе их плотности и их координаты тканей(Рисунок 1, шаг 6).

Рисунок 1: Схематическое представление стратегии визуализации, количественной оценки и картирования иммунных клеток в ТМЕ. (1) Серийные целые разделы ткани были окрашены для маркировки COIs и TCs. Окрашенные целые разделы ткани были оцифрованы с помощью целого слайд-сканера. (2) Изображения, полученные из серийных разделов, были связаны, выровнены и зарегистрированы в автоматическом режиме с помощью модуля анализа Tissuealign. Композитное изображение было получено из высокоточного выравнивания отдельных изображений. (3)Пользовательский протокол был использован для автоматического обнаружения связанных с тканью пикселей (TAPs) в композитном изображении. (4)Ткань была сегментирована в ТК (например, строма и паренхима), определяемые как ROIs. (5) Пользовательские определенные протоколы были использованы для автоматизированного обнаружения и количественной оценки COИ в различных ТК. (6) Ткани тепловые карты COIs были созданы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Изображение COIs и ТК
Три серийных раздела всей ткани FFPE резекционированной опухоли от предмета с HBV-ассоциированной гепатоцеллюлярной карциномы были окрашены в один или несколько раундов окрашивания, как на рисунке 2A. Раздел i был запятнан с H и E для того чтобы показать зодчество ткани, морфологию клетки, и обусловить клинически уместные параметры such as тип злокачественности, ранг опухоли, и общая оценка иммунной инфильтрации (Рисунок 2C). В смежных раздел II, два раунда MIF были использованы для маркировки печени parenchymal и не-паранхимальных клеток(рисунок 2A). В первом раунде, нормальные и опухолевые сосуды были визуализированы с помощью CD34 окрашивания эндотелиальных клеток. Кроме того, эпителиальные клетки (гепатоциты и холангиоциты) были выявлены с помощью цитокератина 8/18, а фиброгенные активированные печеночные клетки были определены как альфа-гладкие мышечные актины положительные (ЗСМАЗ) клетки(Рисунок 2C). После приобретения изображения, участки тканей были раздели и reprobed с антителами против макрофагов (CD68), и myofibroblasts (desmin). Чтобы лучше охарактеризовать опухоль иммунной инфильтрации, смежный серийный раздел III был окрашен с помощью двух раундов mIF для клеточных маркеров CD3, CD4, CD8, вилочная коробка P3 (FoxP3), и миелопероксидаза (MPO). Во всех случаях DAPI использовался в качестве ядерного противоядерного пятна. Наконец, раздел III был окрашен PSR пятно и counterstained с быстрым зеленым, чтобы визуализировать фибриллярный коллаген и сегмент ткани в стромы и паренхимы(Рисунок 2C).
Для оцифровки окрашенных секций и создания виртуальных слайдов использовался целый слайд-сканер, оснащенный объективом 20X объективной линзы. Шесть изображений были получены из трех серийных разделов(рисунок 2B) и виртуальные слайды впоследствии проанализированы с помощью программного обеспечения VIS в соответствии с схематическим представлением на рисунке 1.
Анализ изображений
Анализ изображений состоял из пяти этапов: 1) выравнивание тканей; 2) обнаружение тканей; 3) сегментация тканей; 4) автоматизированная количественная оценка ИИ; и 5) отображение тепла тканей. Все протоколы для анализа изображений были разработаны с использованием авторского модуля программного обеспечения для анализа изображений и упоминаются в тексте как APP.
Выравнивание тканей
Шесть виртуальных слайдов из трех серийных разделов, охватывающих 11 маркеров плюс Пятна Н и Е и PSR, были загружены в модуль Tissualign программного обеспечения для анализа изображений. Далее, изображения были связаны, выровнены, и корегистрированы в автоматизированной моды, генерации 11-plex плюс Н И Е и PSR виртуальный композитный образ, содержащий все слои отдельных изображений (Рисунки 2A-C). Выравнивание было точным в случае изображений, происходящих из соседних серийных разделов, показывая соответствующие структуры ткани расположены и расположены в гомологичной моды на выравнивание(Рисунок 2C и рисунок S1A). Кроме того, выравнивание было точным на уровне отдельных клеток для изображений, происходящих из того же раздела(рисунок S1B). Время автоматического выравнивания зависит от количества, размера, сложности и сходства изображений, которые должны быть выровнены. Выравнивание вышеупомянутых шести виртуальных слайдов заняло 15 минут на нашей станции VIS.
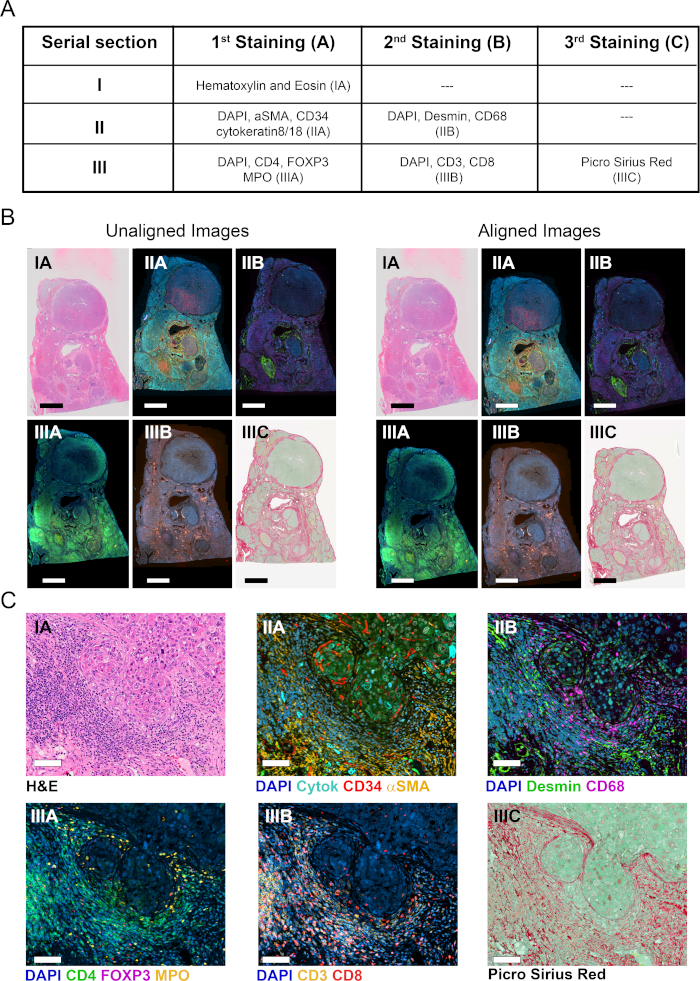
Рисунок 2: Окрашивание серийных секций тканей и выравнивание изображения. (A) Резюме окрафини, сделанные на трех последовательных разделах для визуализации COИ и TCs. Числа в скобках указывают на обозначение изображения. Для разделов II и III ткани были раздели и повторно с помощью второго коктейля антител. (B) Обзор шести отдельных изображений целой ткани до и после выравнивания тканей (слева и справа, соответственно). Шкала бар No 3500 мкм. (C) Увеличенный вид выровненных изображений. Шкала бар 80 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обнаружение тканей
После того, как изображения были связаны и выровнены, мы стремились определить TAPs(Рисунок 3A). Для разработки APP для автоматизированного обнаружения TAPs (APP 1, таблица 1),мы воспользовались двумя свойствами, которые отличают TAPs от пикселей, не связанных с тканью. Во-первых, сигнал DAPI (синяя полоса) ограничен ядрами, которые расположены исключительно в ткани, что означает, что все пиксели DAPI являются подмножеством TAPs. Во-вторых, TAPs имеют более высокий сигнал автофлюоресценции в зеленых и желтых диапазонах по сравнению с пикселями, не связанными с тканью. Следовательно, мы разработали APP 1 для обнаружения тканей (Таблица 1), который обнаруживает TAPs на основе исходного сигнала в этих каналах с помощью простых методов порога. Пороги для синих, зеленых и желтых полос были установлены таким образом, чтобы TAPs имели значения фоновой интенсивности выше порогов, в то время как пиксели, не связанные с тканью, имели значения ниже. APP 1 для обнаружения тканей был применен к изображению IIA, которое содержит слои в синих, зеленых и желтых каналах(рисунок 3A). По мере выхода APP 1, ярко-зеленая маска была заложена на верхней части TAPs, и рентабельность инвестиций под названием "Ткань" была очертана (выход, Рисунок 3A). Кроме того, область ткани была определена как количественную переменную вывода. Поскольку APP 1 не включает пиксели, не связанные с тканью, в ткани ROI, они были исключены из последующего анализа на основе этой рентабельности инвестиций(рисунок 3A). Точность APP 1 при выявлении TAPs показана на рисунке 3A.
Сегментация тканей и разграничение ROIs для ТЦ
Затем мы приступили к определению различных отсеков внутри ткани рентабельности инвестиций путем сегментирования ткани в стромы против паренхимы. Мы использовали PSR окрашенных изображения (IIIC, Рисунок 2C), где строма может быть определена как область, связанная с осаждением фибриллярных коллагенов (красная полоса), parenchyma как область, где фибриллярные коллагены отсутствуют, и быстро зеленый контрпятно красителя преобладает (зеленая полоса) (Рисунок 3B). Мы создали APP 2(Таблица 1) для цифрового разграничения ТС Строма и Parenchyma. Это приложение работает на предопределенных ROI Ткани (выход, Рисунок 3A) и использует репрезентативные области стромы и паренхимы для обучения инструмент классификатора, интегрированного в модуль анализа изображений. Обученный классификатор присваивает пикселии либо строму, либо этикетке паренхимы (лосось и зеленый, соответственно, рисунок 3B). После классификации пикселей, APP 2 выполняется морфологических операций, направленных на определение ROIs Строма и Parenchyma(Рисунок 3B и таблица 1). Производительность APP 2 при классификации пикселей и генерации соответствующих рентабельности инвестиций отображается на рисунке 3B. Кроме того, APP 2 количественно области стромы и parenchyma. Наконец, даже если сегментация осуществляется с использованием psR окрашенных разделе, изложенные стромы и parenchyma регионах могут быть переданы на любое изображение выровнены с изображением PSR.

Рисунок 3: Автоматизированное обнаружение/сегментация тканей и генерация соответствующих рентабельностей инвестиций. (A) Изображение IIA было использовано для идентификации TAPs (левое изображение, панель масштаба 6,000 мкм). Ярко-зеленая маска была назначена TAPs с помощью APP 1 (Таблица 1) генерации рентабельности инвестиций под названием Ткань (выход 1). Справа, всет показывает увеличенное представление, демонстрирующее точность APP 1 при обнаружении TAPs. Шкала бар 350 мкм. (B) ROI Ткань (выход 1) сегментирована на стромы и паренхимы с помощью APP 2. На рисунке слева показан вид ткани ROI, сегментированной на ROI stroma (лосось) и рентабельность паренхимы (зеленый). Шкала бар 4500 мкм. Справа увеличены виды всета для ROI Tissue, оригинального окрашивания PSR (изображение IIIC) и ROIs stroma и parenchyma. Шкала бар 250 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Автоматизированная количественная оценка COIs
Затем мы приступили к выявлению, поиску и количественной оценке COIs в ROIs Stroma и Parenchyma. ПпА от 3 до 8(Таблица 1) были созданы для поиска и подсчета следующих COIs: CD4'FoxP3, CD8, CD68, MPO, SMA и CD34 "клетки, соответственно. APP 3 был разработан для обнаружения и подсчета клеток CD4'FoxP3 (изображение IIIA, Рисунок 2C) в качестве суррогатных маркеров регуляторных Т-клеток (Tregs). Этот протокол обнаруживает колокализацию сигнала от ядерного транскрипционного фактора FoxP3 (красная полоса) и ДНК маркировки красителя DAPI (синяя полоса). Учитывая, что недавно активированные Т-клетки upregulate FoxP3, чтобы обогатить для Tregs мы установили пороги для предварительного выбора только яркие клетки FoxP3 "(FoxP3привет). Далее, из всех предварительно выбранных DAPI-FoxP3привет клетки, только те, которые были окружены яркими кольцеобразными сигналами CD4 (зеленая полоса) были помечены и учитываются как FoxP3приветCD4 "клетки (розовый ярлык, Рисунок 4A). Плотность клеток FoxP3приветCD4 в ROIs Stroma и Parenchyma были определены как количественные переменные вывода APP 3(Рисунок 4A).
Аналогичным образом, АПП от 4 до 6 были разработаны для обнаружения клеток CD8, CD68 и MPO. Эти АПП имеют одинаковую базовую конструкцию для обнаружения и количественной оценки COИ. В частности, COIs идентифицируются на основе интенсивности сигнала от конкретных биомаркеров популяции клеток, а затем выполняются несколько постобработкных морфологических шагов для разграничения отдельных клеток(таблица 1). Отдельные клетки или COIs помечены, подсчитаны, и их координаты ткани зарегистрированы. ППС от 4 до 6 также определить плотность COIs в ROIs Строма и Parenchyma(Рисунок 4B-D).
Качество нашего dAPI окрашивания не было достаточно хорошим для интеграции сегментации ядер в APPs от 3 до 6, поэтому мы не можем гарантировать, что все индивидуально обозначенные объекты являются отдельными ячейками. По этой причине мы выразили плотность клеток в графах помеченных объектов/мм2 (рисунок 4). Тем не менее, агрегаты клеток были успешно разделены на отдельные ячейки в постобработкных шагах, встроенных в Ппа от 3 до 6, и обширный визуальный осмотр показал, что большинство помеченных объектов соответствуют одиночным ячейкам.
Для обнаружения зоны «SMA» и CD34 мы разработали АПП 7 и 8, соответственно(таблица 1). Оба АПП обнаруживают конкретный сигнал на основе пороговых значений и определяют процент положительной области в ROIs Stroma и Parenchyma(рисунок 4E-F).
Одной из наиболее интересных возможностей генерации виртуальных мультиплексных слайдов является анализ выражения колокализации. Мы создали APP 10 для обнаружения колокализации между ЗСМА и десмином, двумя маркерами, которые выражаются в миофибробластах в печени. APP 10 использует пороги для нахождения пикселей положительными для ЗСМА, десмин, и SMA плюс desmin (Таблица 1). В качестве количественных переменных вывода, APP 10 определяет область «SMA», область desmin, и область colocalized выражения этих двух маркеров(рисунок S3).

Рисунок 4: Выявление и количественная оценка COИ в ТЦ строма и паранхима. (A-F) Автоматизированное обнаружение и количественная оценка CD4-FoxP3, CD8, CD68, МПОЗ, ЗСМА и CD34 " COIs в ROIs Stroma и Parenchyma с использованием протоколов 3, 4, 5, 6, 7 и 8, соответственно(таблица 1). Слева показаны исходные изображения, в середине обработанные изображения, а справа количественные значения. Для цифр 4A-D,шкала бар 40 мкм. Для рисунков 4E и F,шкала бар 350 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
В качестве альтернативы количественной оценки COIs в ТЦ Строма и Parenchyma, мы определили плотность иммунных клеток в различных злокачественных узелков имени 1 до 4 (Рисунок 5A, H, и I). Рентабельность инвестиций для каждого конкреции была вручную разграничена, как указано на рисунке 5A. Отличительные иммунные сигнатуры ткани характеризовали каждый узел, что еще больше выявило внутреннюю неоднородность ТМЭ.
Ткань Тепловые карты
Как упоминалось выше, АПП от 3 до 8 хранят координаты тканей каждого индивидуально обозначенного объекта. Эта функция позволяет автоматизированное генерирующее карты тканей, где регионы высокой плотности данной популяции клеток отображаются в виде горячих точек (красный), и регионов с относительно низкой плотностью, как холодные пятна (темно-синий). Значения промежуточной плотности присваиваются цветам в соответствии с цветовой шкалой, показанной на рисунке 5. Ткань тепловые карты были созданы APP, которые разделили изображения на круги диаметром 50 мкм и присвоили цвет в соответствии с относительной плотностью данного COI внутри круга. Как показано на рисунке 5B-G, позиционирование моделей и распределения интенсивности различных COIs в TME был весьма разнообразны. Кроме того, на уровне отдельных конкреций, расположение различных популяций в области тканей был уникальным(Рисунок S2A-C). Чтобы дать пример силы этой техники и визуализировать пространственную организацию горячих точек из разных популяций в одном узелке, горячие точки из отдельных типов клеток были вручную извлечены и отображены вместе на контуру конкреции 2 (Рисунок S2, Рисунок D, и рисунок E).

Рисунок 5: Ткань тепловые карты COIs в TME. (A) Picrosirius Красный окрашивание с указанием расположения конкреций 1, 2, 3 и 4. (B-G) Ткань тепловые карты для CD4 »FoxP3" , CD8 , CD68 ", MPO, CD34 " и "SMA" COIs, соответственно. Темно-синий цвет указывает на относительную низкую плотность, а красный - относительно высокую плотность. Значения промежуточной плотности присваиваются цветам в соответствии с показанной цветовой шкалой. (H и I) Количественная оценка COIs в конкрециях 1, 2, и 3 4 организованы на тип ячейки и на конкрецию, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Дополнительная рисунок S1: Проверка выравнивания тканей. (A) CD34 окрашивание (красным цветом) сделано на разделе II (ввод 1) используется для генерации маски CD34 в зеленом цвете (выход 1). Зеленая маска (выход 1) накладывается на изображение Н и Е из выровненного последовательного раздела I (ввод 2). Образ слияния показывает идеальное соответствие сосудистых структур. Шкала бар 50 мкм. (B) Изображение IIIA, показывающее слияние DAPI, CD4 и FoxP3 (ввод 1), было использовано для создания метки для клеток CD4-FoxP3 (выход 1 в пурпурном). Наклейка Выход 1 была переведена на выровненный образ IIIB (ввод 2) и показывает идеальную соответствие между парами FoxP3/DAPI и CD4/CD3 на изображении слияния. Шкала бар 15 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
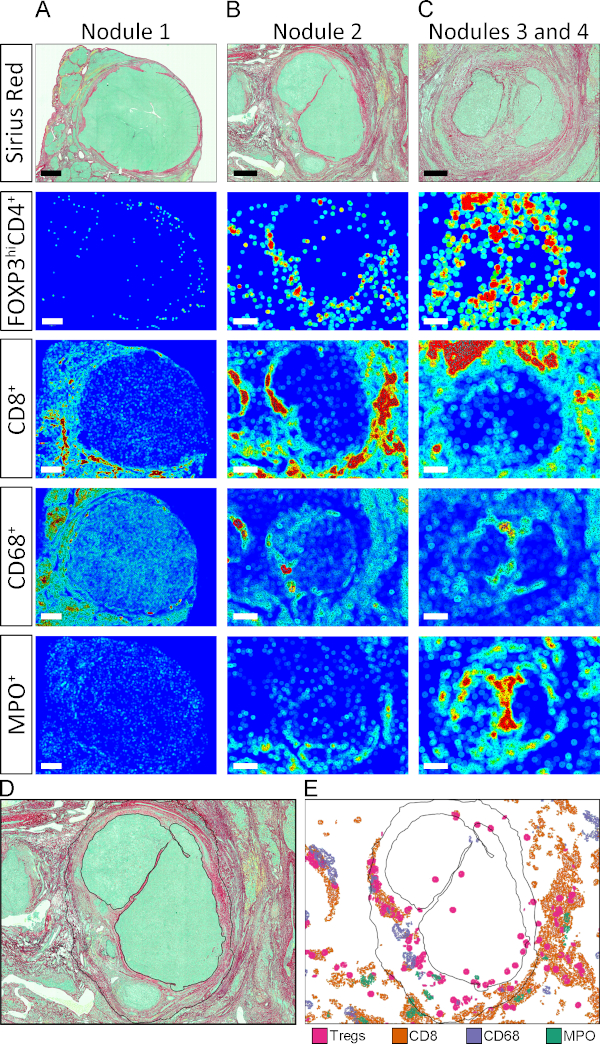
Дополнительная рисунок S2: Увеличенный вид тепловых карт тканей. (A-C) Ткань тепловые карты для CD4 »FoxP3 ", CD8 ", CD68" и MPO' клетки в конкреции 1-4. Шкала баров в конкреции 1, 2 и 3 4 представляют 1500 мкм, 700 мкм, и 500 мкм соответственно. (D) Очертания узел 2 с черной твердой линии. (E) Горячие точки для CD4 »FoxP3», CD8 , CD68 ", и MPO" клетки в конкреции 2 были извлечены и отображены вместе на контур узел 2 определяется в D. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Дополнительная цифра S3: Анализ колокализации. (A) Слева и в середине изображения этикетки ЗСМА в зеленом и desmin этикетке в красном соответственно. Справа находится двойной положительной области в желтом цвете. (B) Количественная оценка области ЗСМАЗ, desmin области, и SMA / desmin двойной положительной области. Шкала бар 150 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Приложение | Цель | Классификации | Классификации | Пост-обработка шагов | Переменные вывода |
| Метод | Функции | ||||
| (значение пикселей) | |||||
| 1 | Обнаружение тканей | Порог | Канал DAPI (150) | o Объекты этикетки с колокализованными значениями выше порога для 3 каналов | o ROI Ткань |
| Канал FITC/A488 (120) | o Закрыть положительный объект 5 пикселей | o Область ткани | |||
| Канал TRITC/A568 (40) | o Создание ткани roI | ||||
| 2 | Сегментация тканей | Решение Лесной | RGB-R медиана | o Заполнить отверстия | o ROI Строма |
| Средняя медиана RGB-G | o Создание ROI Строма | o Район Строма | |||
| Средняя медиана RGB-B | o Создание РЕНТАБЕЛЬНОСТи Поренчима | o ROI Parenchyma | |||
| IHS-S медиана | o Район Паренхимма | ||||
| H и E Eosin медиана | |||||
| 3 | Для поиска и количественной оценки клеток CD4 " FoxP3" | Порог | Канал DAPI (No gt;600) | o Объекты этикетки с колокализацией DAPI и Cy5/A647, окруженные сигналом FITC/A488 | o Графы и плотность клеток CD4'FoxP3 в ROIs Stroma и Parenchyma |
| Канал FITC/A488 полисглабирование (Зgt;850) | o Очистить объекты меньше, чем 7 мкм2 | o Координаты отдельных клеток CD4-FoxP3 | |||
| Канал Cy5/A647 (Зтт;800) | |||||
| 4 | Для обнаружения и количественной оценки клеток CD8 | Порог | Канал DAPI (Злт;1200) | o Очистить положительные объекты меньше, чем 15 мкм2 | o Графы и плотность клеток CD8 в ROIs Строма и Parenchyma |
| Канал Cy5/A647 медиана (No gt;80) | o Закрыть положительные объекты 2 пикселя | o Координаты отдельных ячеек | |||
| o Отдельные объекты | |||||
| 5 | Для обнаружения и количественной оценки клеток CD68 | Порог | Канал FITC/A488 (Nogt;200) | o Очистить положительные объекты меньше, чем 20 мкм2 | o Графы и плотность клеток CD68 в ROIs Строма и Parenchyma |
| o Dilate положительные объекты 3 пикселя | o Координаты отдельных клеток CD68 | ||||
| o Отдельные объекты | |||||
| 6 | Для обнаружения и количественной оценки ячеек MPO | Порог | Канал DAPI (No gt;400) | o Очистить объекты меньше, чем 5 мкм2 | o Графы и плотность ячеек МПОЗ в ROIs Stroma и Parenchyma. |
| Канал TRITC/A568 (900-4000) | o Dilate 3 пикселей положительных объектов | o Координаты отдельных ячеек МПОЗ. | |||
| o Отдельные объекты | |||||
| 7 | Для определения местонахождения и количественной оценки области ЗСМАЗ | Порог | Канал TRITC/CF568 (Nogt;1050) | o Очистить положительные объекты меньше, чем 25 мкм2 | o Графы и плотность площади ЗСМА в ROIs Строма и Паранчима |
| o Dilate 3 пикселей положительных объектов | o Координаты пикселей «SMA» | ||||
| 8 | Для определения местонахождения и количественной оценки области CD34 | Порог | Канал DAPI (Злт;5000) | o Очистить положительные объекты меньше, чем 25 мкм2 | o Графы и плотность площади CD34 в ROIs Строма и Parenchyma |
| Канал Cy5/A647 медиана (Nogt;120) | o Dilate 3 пикселей положительных объектов | o Координаты ПИКселей CD34 | |||
| 9 | Создание тканьковых тепловых карт для данной популяции клеток | Объект Тепловая карта | Объект Тепловая карта | o Тепловая карта | |
| Радиус рисования 50 мкм | --- | ||||
| 10 | Количественная колокализация между ЗСМА и Десмин | Порог | Канал TRITC (CF568) (Nogt;1050) | o Объекты этикетки с вышепороговыми значениями для TRITC (CF568) | o Количественное колокализованное выражение ЗСМА и Десмин |
| Канал Cy5 (A647) (Nogt;1000) | o Объекты этикетки с выше пороговыми значениями для Cy5 (A647) | ||||
| o Объекты этикетки с колокализацией выше пороговых значений для TRITC (CF568) и Cy5 (A647) | |||||
| o Очистить положительные объекты меньше, чем 25 мкм2 |
Таблица 1: Общие параметры, используемые для проектирования АПП, используемых для анализа изображений. Параметры, указанные в этой таблице, корректируются с учетом уникальных характеристик изображений, используемых в этом анализе (например, фон, артефакты и т.д.) и могут быть неприменимы к другим изображениям. Поскольку упомянутые шаги после обработки были определены для конкретных изображений, проанализированных в данном исследовании, они намеренно не детализированы. Пользователь должен настроить APP для анализа изображений.
| Раздел/Пятно | Первичные антитела | Вторичные антитела |
| Раздел II/1ст Окрашивание | Мышь IgG2a анти-человеческий ЗСМА Мышь IgG1 против человека CD34 Кролик анти-человек Цитокератин 8/18 | Коза анти-мышь IgG2a CF568 Крыса анти-мышь IgG1 A647 Осел против кролика A488 |
| Раздел II/2nd Окрашивание | Кролик анти-человек Десмин Мышь против человека CD68 | Осел против кролика A647 Осел анти-мышь DyLight 755 |
| Раздел III/1ст Окрашивание | Мышь против человека CD4 Кролик анти-человек FoxP3 Коза анти-человек МПО | Осел анти-мышь A488 Осел против кролика A647 Ослик против козла A568 |
| Раздел III/2nd Окрашивание | Кролик анти-человек CD3 Мышь против человека CD8 | Осел анти-мышь DyLight 755 Осел против кролика A647 |
Таблица 2: Первичные вторичные пары антител для mIF.
Обсуждение
Простые, доступные и простые в исполнении методы мультиплексирования, которые позволяют пространственное разрешение иммунных клеток в секциях тканей, необходимы для картирования иммунного ландшафта при раке и других иммунологических расстройствах. Здесь мы описываем стратегию, которая интегрирует широко доступные методы маркировки и цифрового анализа для расширения возможностей мультиплексирования и многомерной оценки анализов изображений12,13,17,19. Окрашивание трех серийных секций для различных маркеров, а также повторное использование секций с помощью зачистки и reprobing методы, позволило нам визуализировать 11 параметров в дополнение к Н И Е и PSR пятна. Шесть изображений из этих разделов были выровнены в автоматическом режиме с помощью модуля выравнивания тканей. Выравнивание было точным на уровне отдельных клеток для изображений, происходящих из того же раздела и очень согласующимся для изображений, происходящих из соседних разделов. Виртуальный мультиплексирование позволило нам определить, как маркеры, визуализированные в одном разделе, пространственно соотносятся с маркерами, визуализированными в другом смежном разделе. В то время как некоторые из окрастей помечены COIs, другие помечены ТС, что позволяет нам количественно COIs в различных ТС. Использование программных средств для автоматизированной количественной оценки CoIs значительно упростило и ускорило обработку изображений. Кроме того, цифровой анализ применялся к целым участкам тканей вместо отдельных полей зрения, что привело к объективному представлению ТМЕ. Кроме того, поскольку были зарегистрированы координаты тканей COIs, удалось создать тепловые карты тканей.
В этом протоколе есть несколько областей, где может потребоваться устранение неполадок. Во-первых, плохое извлечение антигена может повлиять на качество mIF, поэтому тип буфера поиска антигена и продолжительность должны быть оптимизированы для конкретных условий проверки/биомаркера. Во-вторых, используемый тип блокирующего раствора должен быть адаптирован к тканям/антигену/видам первичных и вторичных антител. В наших руках, добавление 10% общей сыворотки от видов, где ткань поступает из заблокированных рецепторов Fc, и, таким образом, снижение неспецифических связывания антител. Добавление 10% сыворотки от вида вторичных антител были подняты в бы свести к минимуму прямое неспецифическое вложение вторичных антител к ткани разделе. В-третьих, важное значение имеет проверка специфичности первичных и вторичных антител с использованием надлежащего положительного и отрицательного контроля. В-четвертых, увеличение автофлюоресценции в некоторых каналах и диффузии DAPI на первичных зачистки антител также распространены. Для решения расширенной автофлюоресценции, мы использовали первичные / вторичные пары антител, где конкретный сигнал имел значения интенсивности по крайней мере 5x, что из фона. Наконец, некоторые антитела высокого сродства не могут быть eluted с регулярными процедурами зачистки. В этом случае мы рекомендуем использовать такие антитела в последнем раунде маркировки. Пользователю, возможно, придется попробовать различные последовательности окрашивания, чтобы найти оптимальную конфигурацию для антител, представляющих интерес. Эффективность зачистки должна быть подтверждена до начала второго или третьего раунда маркировки.
Основным ограничением и вызовом этой стратегии является поиск правильных комбинаций первичных и вторичных флуоресцентных антител для маркеров интереса. Поиск первичных антител, выращенных у различных видов или с различными изотипами, которые могут быть использованы одновременно, ограничен тем, что доступно на коммерческой уровне. Большинство целых слайд-сканеров оснащены лампами и фильтрами, которые позволяют изображения максимум пять каналов, и вторичные антитела в нужных видов и право фторфора не всегда доступны. Мы частично преодолели эти ограничения, используя серийные окрашивания и последовательную маркировку. Несколько комбинаций антител, возможно, потребуется проверить, чтобы прийти в наилучшей комбинации для маркеров интереса. Другим ограничением является качество окрашивания DAPI, потому что зачистка и reprobing не всегда может позволить выполнять сегментации ядер.
Модуль выравнивания тканей требует минимальной подготовки и никаких навыков программирования от пользователей. Программное обеспечение теоретически позволяет выравнивание неограниченное количество изображений. Однако точное выравнивание зависит от родственности секций, где более точно выровнены более близкие участки, которые более гистологически согласованы. Мы использовали авторский модуль VIS для генерации АПП. Базовые знания анализа изображений необходимы для создания АПП, но это в равной степени относится и к использованию любого другого программного обеспечения для анализа изображений. Уникальные преимущества VIS по сравнению с другим программным обеспечением анализа изображений включают автоматическое выравнивание изображений из разделов, подготовленных с использованием различных методов (например, IF, гистохимия, IHC). Это позволяет проводить исследования по локализации нескольких маркеров, представляющих интерес с помощью виртуального мультиплексирования. Кроме того, гибкий и удобный дизайн AP позволяет настраивать пользователей. Автоматизированная количественная оценка и картирование, а также возможность обработки целых секций тканей, экономит время и уменьшает предвзятость по сравнению с ручным подсчетом путем визуального осмотра.
Эта стратегия является очень полезным инструментом исследования для иммунологии тканей в контексте рака и аутоиммунных заболеваний, но остается недействительной для клинического использования. С дополнительной стандартизации и проверки, он может быть использован в будущем для нескольких приложений (например, для картирования иммунного ландшафта в раке, чтобы предсказать и контролировать ответ на иммунотерапевтических агентов). Он также может быть адаптирован к различным воспалительным условиям (например, воспалительные заболевания кишечника), чтобы объединить патологические оценки с прогностическими биомаркерами.
Основными важными шагами в этом протоколе являются эффективность/специфичность маркировки и надежность разработанных АПП для предполагаемого использования или биомаркера. Таким образом, регулярная проверка путем визуального осмотра, особенно при проектировании нового APP, имеет важное значение. Эффективное использование нескольких раундов зачистки и reprobing или различных типов пятен на одном и том же разделе являются важнейшими компонентами и могут быть ткани или раздел конкретных. Проверка эффективности таких процессов перед большим пакетным анализом имеет решающее значение.
Таким образом, мы предоставляем стратегию, которая максимизирует количественную и пространственную информацию, которая может быть получена из ценных образцов клинических тканей. Ресурсы, оборудование и знания, необходимые для внедрения этой методологии, широко доступны. Мы предлагаем эту методологию в качестве полезного руководства для планирования анализов, направленных на выявление, количественное определение и отображение популяций иммунных клеток в TME.
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Благодарности
Благодарим участника исследования. Мы благодарим Луизу Руссо, координатора биобанка HBP за восстановление образцов тканей и всей связанной с ними клинической информации. Мы признаем молекулярную патологию и клеточную визуализацию основных средств в CRCHUM и Майкл Перш из Visiopharm за отличную техническую помощь. Финансирование: Это исследование было поддержано грантами Канадского фонда печени, Fonds de recherche du Квебек-Санте (ФРЗС) по СПИДу и Сети инфекционных заболеваний (Reseau SIDA-MI) и Канадской сети по борьбе с гепатитом С (CanHepC). CanHepC финансируется за счет совместной инициативы Канадских институтов исследований в области здравоохранения (CIHR) (NHC-142832) и Агентства общественного здравоохранения Канады. М.Ф.М. получил стипендии от Монреальского университета, Бурса Гавриил маркизия и ФРЗС. Т.Ф. получил докторскую стипендию от CIHR и CanHepC. S.T. имеет кафедру Роджера-Де-Гроузеллерса в гепатобилиарной и онкологической хирургии поджелудочной железы, Монреальский университет.
Автор вкладов: M.F.M. разработан, выполнены эксперименты, и проанализировали данные. Т.Ф. разработал эксперименты. A.C-B. техническое руководство. Г.С. провел всю патологическую оценку испытое и внедвал в исследование всех патологических аспектов. Компания L.M. выполнила окрашивание, оптимизированное и выполненное приобретение изображений. M.N.A. выполнила пятно PSR и предоставила ценный технический вклад. Н.Б. внес свой вклад в анализ изображений. S.T. является главным исследователем биобанка HBP и отвечает за надзор за общей работой биобанка. Он также внедрит неоценимый вклад во все аспекты проекта и его клинические последствия. M.F.M., T.F. и N.H.S. концептуализировали и спроектировали исследование. N.H.S. контролировал работу и получал финансирование. М.Ф.М., Т.Ф., А.К.Б. и Н.Х.С. написали рукопись. Все авторы рассмотрели и утвердили рукопись.
Материалы
| Name | Company | Catalog Number | Comments |
| Antigen Retrieval Solution: Sodium Citrate Buffer (10 mM Sodium Citrate, 0.05% v/v Tween 20, pH 6.0) | |||
| Blocking Solution: 1 % BSA, 10 % filtered human serum, 10 % filtered donkey serum, 0.1 % Tween 20, and 0.3% Triton in PBS | |||
| Bovine serum albumin (BSA) | Multicell | 800-095-EG | |
| Coplin jars (EASYDIP SLIDE STAINING SYSTEM) | Newcomersupply | 5300KIT | |
| Cover slides | Fisherbrand | 12-545E 22*50 | |
| Direct Red 80 | Sigma Aldrich | 365548 | |
| Donkey Serum | Sigma Aldrich | D9663 | |
| Ethanol 100% | |||
| Electric pressure cooker | Salton | ||
| Eosin | Leica Biosystems | 3801600 | CAUTION, eye irritation |
| Fast Green FCF | Sigma Aldrich | F7252 | CAUTION, harmful by inhalation, ingestion and skin absortion |
| FFPE section (4μm) slides | |||
| Glycine 0,1 M in PBS | |||
| Hematoxylin Stain Solution, Gil 1. Formulation, Regular Strength | Ricca Chemical Company | 3535-32 | |
| Holder (EasyDip Staining Jar Holder) | Newcomersupply | 5300RK | |
| Human Serum | Gemini | 22210 | |
| Humidity chamber | Millipore Sigma | Z670138-1EA | |
| Pap pen | abcam | ab2601 | |
| PBS | |||
| PBS-Tween 20 (0.1% v/v) | |||
| Permount Mounting Media | Fisher Chemical | SP15-500 | |
| Picric Acid 1.3 % | Sigma Aldrich | P6744 | CAUTION, skin and eye irritation |
| Picro-Sirius Red/Fast Green solution: Fast Green 0.1 % w/v + Sirius Red 0.2 % w/v in 1,3 % picric acid solution | |||
| Primary Antibody Anti-αSMA | Mouse IgG2a 1A4 | Sigma A2547 | Dilution 1/100 |
| Primary Antibody Anti-CD34 | Mouse IgG1 HPCA1/763 | Novus Biologicals NBP2-44568 | Dilution 1/250 |
| Primary Antibody Anti-Cytokeratin 8/18 | Rabbit EP17/EP30 | Agilent IR09461-2 | Ready to use |
| Primary Antibody Anti-CD68 | Mouse KP1 | Abcam ab955 | Dilution 1/200 |
| Primary Antibody Anti-Desmin | Rabbit Polyclonal | Invitrogen PA5-16705 | Dilution 1/200 |
| Primary Antibody Anti-CD4 | Mouse N1UG0 | Affymetrix 14-2444 | Dilution 1/250 |
| Primary Antibody Anti-FoxP3 | Rabbit 1054C | R & D MAB8214 | Dilution 1/100 |
| Primary Antibody Anti-MPO | Goat Polyclonal | R & D Systems AF3667 | Dilution 1/250 |
| Primary Antibody Anti-CD3 | Rabbit SP7 | Abcam ab16669 | Dilution 1/200 |
| Primary Antibody Anti-CD8 | Mouse C8/144B | Invitrogen 14-0085-80 | Dilution 1/200 |
| Secondary Antibody Donkey anti-mouse A488 | Polyclonal | Invitrogen A-21202 | Dilution 1/500 |
| Secondary Antibody Donkey anti-Rabbit A488 | Polyclonal | Invitrogen A-21206 | Dilution 1/500 |
| Secondary Antibody Donkey anti-goat A568 | Polyclonal | Invitrogen A-11057 | Dilution 1/500 |
| Secondary Antibody Donkey anti-rabbit A647 | Polyclonal | Invitrogen A-31573 | Dilution 1/500 |
| Secondary Antibody Rat anti-mouse IgG1 A647 | RMG1-1 | Biolegend 406618 | Dilution 1/500 |
| Secondary Antibody Goat anti-mouse IgG2a CF568 | Polyclonal | Sigma Aldrich SAB4600315 | Dilution 1/500 |
| Secondary Antibody Donkey anti-mouse DyLight 755 | Polyclonal | Invitrogen SA5-10171 | Dilution 1/500 |
| Secondary Antibody Donkey anti-rabbit DyLight 755 | Polyclonal | Invitrogen SA5-10043 | Dilution 1/500 |
| SDS | BioShop | SDS001,500 | CAUTION, oral skin and eye toxicity |
| Shandon multi-program robotic slide stainer | LabX | 11384903 | |
| Shandon Xylene Substitute, | Thermo Fisher Scientific | CA89413-336 | CAUTION, Flammable, skin and eye irritation, Harmful when inhaled |
| Shaking water bath | |||
| SlowFade Gold antifade reagent with DAPI | Invitrogen | S36938 | |
| Sodium Citrate Dihydrate | Millipore Sigma | 1545801 | CAUTION, eye irritation |
| Stripping Buffer: mix 20 ml 10% w/v SDS with 12.5 ml 0.5 M Tris-HCl (pH 6.8), and 67.5 ml ultra-pure water. Under a fume hood, add 800 uL of 2-mercapto ethanol (114,4 mM final concentration) | |||
| Triton X-100 | Sigma Aldrich | T8787-50ML | |
| Tris-HCl | BioShop | 77-86-1 | |
| Tween 20 | Fisher Scientific | BP337-500 | |
| VIS Software | Visiopharm | ||
| Whole slide scanner Olympus BX61VS | Olympus | Microscope: Olympus Slide Scanner BX61VS, 5 slides scanner, motorized stage, autofocus. Camera: Lightsource: Xcite-120. Filters: BrightLine® Sedat filter set (# LED-DA/FI/TR/Cy5-4X4M-B-000, Semrock) | |
| Xylene | Sigma Aldrich | 214736-4L | CAUTION, Flammable, skin and eye irritation, Harmful when inhaled |
| Xylene : Ethanol solution (1:1 v/v) | |||
| 2-mercaptoethanol | Sigma | M6250 | CAUTION, harmful by ingestion, inhalation, fatal if sking absortion. Eye irritation. Use fume hood |
Ссылки
- Greten, F. R., Grivennikov, S. I. Inflammation and Cancer:Triggers, Mechanisms, and Consequences. Immunity. 51 (1), 27-41 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Binnewies, M., et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nature Medicine. 24 (5), 541-550 (2018).
- Taube, J. M., et al. Implications of the tumor immune microenvironment for staging and therapeutics. Modern Pathology: an official journal of the United States and Canadian Academy of Pathology, Inc. 31 (2), 214-234 (2018).
- Bindea, G., et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer. Immunity. 39 (4), 782-795 (2013).
- Galon, J., et al. Towards the introduction of the 'Immunoscore' in the classification of malignant tumours. The Journal of Pathology. 232 (2), 199-209 (2014).
- Finotello, F., Eduati, F. Multi-Omics Profiling of the Tumor Microenvironment: Paving the Way to Precision Immuno-Oncology. Frontiers in Oncology. 8, 430(2018).
- Gerner, M. Y., Kastenmuller, W., Ifrim, I., Kabat, J., Germain, R. N. Histo-cytometry: a method for highly multiplex quantitative tissue imaging analysis applied to dendritic cell subset microanatomy in lymph nodes. Immunity. 37 (2), 364-376 (2012).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Porta Siegel, T., et al. Mass Spectrometry Imaging and Integration with Other Imaging Modalities for Greater Molecular Understanding of Biological Tissues. Molecular Imaging and Biology : MIB: the official publication of the Academy of Molecular Imaging. 20 (6), 888-901 (2018).
- Buchberger, A. R., DeLaney, K., Johnson, J., Li, L. Mass Spectrometry Imaging: A Review of Emerging Advancements and Future Insights. Analytical Chemistry. 90 (1), 240-265 (2018).
- Pirici, D., et al. Antibody elution method for multiple immunohistochemistry on primary antibodies raised in the same species and of the same subtype. Journal of Histochemistry and Cytochemistry. 57 (6), 567-575 (2009).
- Gendusa, R., Scalia, C. R., Buscone, S., Cattoretti, G. Elution of High-affinity (>10-9 KD) Antibodies from Tissue Sections: Clues to the Molecular Mechanism and Use in Sequential Immunostaining. Journal of Histochemistry and Cytochemistry. 62 (7), 519-531 (2014).
- van der Loos, C. M. Multiple immunoenzyme staining: methods and visualizations for the observation with spectral imaging. Journal of Histochemistry and Cytochemistry. 56 (4), 313-328 (2008).
- Stack, E. C., Wang, C., Roman, K. A., Hoyt, C. C. Multiplexed immunohistochemistry, imaging, and quantitation: a review, with an assessment of Tyramide signal amplification, multispectral imaging and multiplex analysis. Methods. 70 (1), 46-58 (2014).
- Toth, Z. E., Mezey, E. Simultaneous visualization of multiple antigens with tyramide signal amplification using antibodies from the same species. Journal of Histochemistry and Cytochemistry. 55 (6), 545-554 (2007).
- Robertson, D., Savage, K., Reis-Filho, J. S., Isacke, C. M. Multiple immunofluorescence labeling of formalin-fixed paraffin-embedded (FFPE) tissue. BMC Cell Biology. 9, 13(2008).
- Segnani, C., et al. Histochemical Detection of Collagen Fibers by Sirius Red/Fast Green Is More Sensitive than van Gieson or Sirius Red Alone in Normal and Inflamed Rat Colon. PloS One. 10 (12), 0144630(2015).
- Bolognesi, M. M., et al. Multiplex Staining by Sequential Immunostaining and Antibody Removal on Routine Tissue Sections. Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены