Method Article
Оценка T фолликулярных клеток-помощников и реакции гермального центра во время вирусной инфекции гриппа А у мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
В настоящем документе описаны протоколы оценки tfh и GC B ответ в мышиной модели инфекции вируса гриппа.
Аннотация
T Фолликулярный помощник (Tfh) клетки являются независимымиCD4 и Т-клеток подмножество специализируется на оказании помощи для развития гермызного центра (GC) и генерации антител высокого сродства. При инфицировании вирусом гриппа для содействия эффективному искоренению вируса индуцируются надежные ответные меры Tfh и GC B, что дает квалифицированную модель мыши для исследования, связанного с Tfh. В этом документе мы описали протоколы в обнаружении основных Tfh связанных иммунного ответа во время инфекции вируса гриппа у мышей. Эти протоколы включают: интраназальная прививка от вируса гриппа; окрашивание цитометрии потока и анализ поликлональных и антиген-специфических клеток Tfh, клеток GC B и плазменных клеток; иммунофлуоресценция обнаружения ДК; связанный с ферментом иммуносорбентный анализ (ELISA) специфических антител вируса гриппа в сыворотке крови. Эти анализы в основном количественно дифференциации и функции Tfh клеток в инфекции вируса гриппа, тем самым предоставляя помощь для исследований в выяснении механизма дифференциации и стратегии манипуляции.
Введение
В последнее десятилетие, многочисленные исследования были сосредоточены на недавно выявленныхCD4 И Т-клеток подмножество, Tfh ячейки подмножество, за его основные роли в зародышевой центр (GC) B развития. B-клеточная лимфома 6 (Bcl6), которая в основном рассматривается как репрессор генов, является определяющим фактором линии клеток Tfh для доказательстватого,что эктопическое выражение Bcl6достаточно,чтобы управлять дифференциацией Tfh, в то время как дефицит Bcl6 приводит к исчезновению дифференциации Tfh1,2,3. В отличие от другихподмножества CD4 и T-помощников, выполняющих свою функцию эффектора путем миграции в места воспаления, tfh-клетки оказывают помощь клеткам группы В в основном в фолликулярной зоне В-клеточной селезенки и лимфатического узла. Состимуляторные молекулы ICOS и CD40L играют значительную роль во взаимодействии между Tfh и GC B-клеток. Во время дифференциации Tfh, ICOS передает необходимые сигналы от cognate B клеток, а также выступает в качестве рецептора, принимающего миграционные сигналы от случайных прохожих В-клетокдля локализации В-клеточной зоны 4,5. CD40L является посредником сигналов от Tfh клеток для распространения В-клеток и выживания6. Другим фактором, играющим аналогичную роль CD40L, является цитокин IL21, который в основном выделяется клетками Tfh. IL21 непосредственно регулирует развитие клеток GC B и выработку антител высокого сродства, но его роль в дифференциации Tfh по-прежнемупротиворечива 7,8. PD-1 и CXCR5, которые в настоящее время наиболее часто используются при выявлении клеток Tfh в анализе цитометрии потока, также играют значительную роль в дифференциации и функции этого подмножества. CXCR5 является рецептором В-клеточного фолликулярного хемокина и опосредует локализацию клеток Tfh в В-клеточных фолликулах9. PD-1 в настоящее время определены не только имеют фолликулярную функцию наведения, но и передавать критические сигналы в процессе сродства клеток GC Bсозревания 10. Основываясь на этих выводах, оценка экспрессии этих молекул может в основном отражать созревание и функцию клеток Tfh.
GC является индуцированной переходной микроанатомической структуры во вторичных лимфоидных органов и сильно зависит от Tfh клеток, таким образом, является идеальным считывания для оценки Tfh ответ. В GC, после получения сигналов, опосредовающихся цитокинами и состимуляторными молекулами, В-клетки подвержены классу переключения и соматической гипермутации для генерации антителвысокого сродства 11. Переключение дифференциального класса антител происходит в дифференцированной нише цитокинов, в которой IL4 и IL21 индуцирует переключение класса IgG1, в то время как ИФНЗ индуцирует переключениекласса IgG2 12. Плазменные клетки являются производителями секретных антител и являются неизлечимо дифференцированными клетками. Как и tfh клетки, развитие В-клеток в GC связано с динамическим выражением многих значительных молекул. Основываясь на текущем исследовании, клетки GC Bмогут быть идентифицированы как B220 - PNA-Fas- или B220-GL7-Fas- клетки и плазменные клетки, по сравнению с их предшественниками, downregulate выражение B220 и upregulate CD138выражение 13. Более того, обе эти характеристики могут быть обнаружены в цитометрии потока и иммунофторесценции анализа, таким образом, является надлежащей оценкой реакции ГК.
Надежные клеточные и гуморальные реакции индуцируются при заражении вирусом гриппа, с Tfh и Th1 клетки доминирующейCD4 T-клеток ответ 14, что делает его идеальной моделью для Tfh клетки дифференциации исследования. Грипп A/Puerto Rico/8/34 H1N1 (PR8), который является широко используемым штаммом, адаптированным к мыши, часто используется вданном исследовании 14,15,16. Здесь мы описываем некоторые основные протоколы Tfh исследования соответствующих анализ в инфекции вируса гриппа: 1) интраназальной прививки от вируса PR8; 2) антиген-специфические клетки Tfh, клетки GC B и плазмы и обнаружение IL21 с цитометрией потока; 3) гистологическая визуализация ГК; 4) обнаружение антиген-специфических антител титр в сыворотке крови с ELISA. Эти протоколы обеспечивают необходимые методы для новых исследователей в Tfh связанных исследований.
протокол
Эксперименты на животных были одобрены Институциональным комитетом по уходу за животными и использованию Института Пастера Шанхая, Китай. Все эксперименты проводились на основе утвержденных Комитетом по уходу за животными и использованию животных.
ПРИМЕЧАНИЕ: Вирусная инфекция мышей и изоляция органов должны быть выполнены в состоянии ABSL2.
1. Прививка вируса гриппа PR8 и запись веса мышей
- Подготовка 8-недельного самца C57BL/6 мышей для инфекции в комнате ABSL2.
ПРИМЕЧАНИЕ: Этот протокол также подходит для экспериментов с самками мышей. - Разбавление вируса PR8:вынюхив вирус из морозильной камеры -80 градусов по Цельсию и инкубировать на льду, пока он не расплавится в жидкость. Vortex фондовый вирус тщательно и разбавить вирус до 2 ПФУ / Л с стерильным фосфат-буфером солевого раствора (PBS, 135 мММ NaCl, 2,7 мМ ККл, 10 мМ На2HPO4, 1,8 мММ KH2PO4) в предварительно охлажденной трубке 1,5 мл.
-
Мышей анестезии: взвесить каждую мышь и рассчитать объем (4 раза (йл) вес мыши (г)) пентобарбитала натрия (2 мг/мл), которые будут использоваться. Ввините рассчитанный объем пентобарбитала натрия интраперитонно.
ПРИМЕЧАНИЕ: Этот шаг заключается в том, чтобы мышей дышать стабильно и мирно, так что точный titer вируса могут быть привиты интраназально. Слишком быстрое или медленное сердцебиение указывает на ненадлежащую анестезию. Кроме того, рекомендуется использовать ветеринарную мазь, чтобы избежать сухости глаз. - Интраназальная прививка: вихрь разбавленного вируса PR8 тщательно. Pipet 10 L и тщательно выполнять интраназальной прививки с одной стороны капля за каплей. После окончания прививки всех мышей в одной клетке (максимум 5 мышей) на этой стороне, повторите прививку с другой стороны (держать дыхание мыши мирным и устойчивым на всем протяжении прививки). Каждая мышь заражена 40 PFU вируса PR8 в общей сложности.
- Поместите мышей в стернальной лежачих в теплых клетках для лучшего возрождения.
- Мониторинг веса мыши ежедневно в течение 10 дней. (День заражения регистрируется как День 0).
2. Изоляция лимфоцитов от селезенки и медиастинального лимфатического узла (МЛН)
- Мышь эвтанизации: положить мышей в небольшой камере и усытворить мышей путем перекачки в CO2 мирно из нижней части камеры. Возьмите мышей, когда они не двигаются и выполнять дислокации шейки матки, чтобы обеспечить мышей умирают полностью. Опустите мышей с 75% этанола и перенесите на капот биобезопасности.
- Обездвижить мышей с вскрытия иглы на абсорбции бумаги покрытые вскрытия пены пластины. Вырезать кожу вдоль брюшной средней линии и задние ноги с рассечением ножницами и растянуть кожу пинцетом. Обездвижить растянутую кожу иглами для вскрытия.
- Приготовьте две 6-сантиметровые посуды для каждой мыши и держите их на льду. Положите 70-мкм-клеточный ситечко в каждое блюдо и добавьте 5 мл DMEM, дополненного 1% сывороткой крупного рогатого скота плода (DMEM (1% FBS))
- Селезенка изоляции: сократить брюшной полости с рассечением ножницами. Возьмите селезенку и положите ее в приготовленное блюдо.
- mLN изоляции: вырезать диафрагму и нижней части клетки ребра в непосредственной близости от тимуса. Потяните ребро в сторону и прикрепите его иглами для вскрытия грудной полости. Потяните легкое в сторону в правую сторону и используйте пинцет, чтобы взять mLN, под сердцем и вблизи брюшной стороны трахеи.
- Положите mLN в приготовленное блюдо.
- Получить одноклеточные суспензии: сетка селезенки или mLN мягко с поршень 3 мл шприц через 70-мкм клеток ситечко. Промыть клеточный ситечко с 1 мл свежего DMEM (1% FBS). Повторное приостановление подвески клетки и передача в 15 мл центрифуги трубки.
- Центрифуга клеточной суспензии при 350 x g в течение 6 мин при 4 градусах Цельсия. Удалите супернатант и добавьте 1 мл DMEM (1% FBS).
- Повторное высасывка клеточных гранул с 1 мл-пипетки тщательно. Добавьте 4 мл DMEM (1% FBS) в подвески клеток селезенки и держите их на льду для следующих операций.
ПРИМЕЧАНИЕ: Необходимо повторно использовать клеточные гранулы с 1 мл среднего во-первых, а не 5 мл, для полной изоляции одиночных клеток от гранул.
С этого шага все операции могут быть выполнены в обычной лаборатории. -
Подсчет селезенки клеток
- Повторное использование клеток путем поворота труб вверх и вниз в течение нескольких раз. Возьмите 10 л в 90 л буфера лиза красных кровяных телец (РБК) (10 мМ Tris-HCl pH 7.5, 155mM NH4Cl). Инкубировать при комнатной температуре (RT) в течение 3 минут и добавить 900 йл холодного PBS прекратить реакцию.
- Центрифуга при 400 x g в течение 6 мин при 4 градусах Цельсия и удалить супернатант. Resuspend с 100 йл холодного PBS. Возьмите 10 МКЛ клеток в 10 МКЛ 0,4% ж / в трипан синий и принять 10 йл из смеси для подсчета клеток с гемоцитометром.
- Расчет: вычислить ячейки как обычный метод. Короче говоря, подсчитайте количество ячеек в двух диагональных угловых квадратах на гемоцитометре и получите N1, N2 за каждый угловой квадрат. Концентрация клеток подвески 5-мл клеток должна быть рассчитана как (N1'N2)/2 x 104/mL.
3. Иммуностинирование поликлональных клеток Tfh с PD-1 и CXCR5
- Окрашивание антителами биотин-анти-CXCR5.
- Повторное приостановление ячейки путем поворота трубки вверх и вниз. Возьмите 2 x 106 ячеек в трубку FACS и добавьте 2 мл буфера окрашивания (PBS (1% FBS, 1 мМ EDTA)). Вымойте вихрем на вихревом осцилляции устройства.
- Центрифуга при 350 x g в течение 6 мин при 4 градусах Цельсия. Откажитесь от супернатанта, выливая жидкость и окуните трубку в рот на абсорбаторную бумагу дважды.
- Ослабить ячейки гранулы с остатком жидкости, нажав на дно трубки. Положите трубку в держатель трубки на лед.
ПРИМЕЧАНИЕ: Объем остатков жидкости составляет примерно 25 мкл. - Добавьте 0,2 МЛ антимошашки CD16/CD32 (блокатор Fc-рецепторов) для каждой трубки. Vortex, нажав трубку дно мягко и инкубировать на льду в течение 10 минут.
ПРИМЕЧАНИЕ: Подготовка смеси антител для нескольких образцов путем разбавления с 5 мл окрашивания буфера для каждой трубки. Рецепт смеси должен быть подготовлен разбавленным (n/10'1) х 0,2 йл блокатором Fc-рецепторов в (n/10'1) x 5 х L окрашивающий буфер и добавить смесь 5,2 мл в каждую трубку. - Добавьте 0,3 МКЛ биотин-антимошейки CXCR5 в остаток 30 МКЛ буфера окрашивания для каждой трубки и вихря, нажав на дно трубки.
ПРИМЕЧАНИЕ: Подготовка смеси, как описано в шаге 3.1.4. - Инкубировать на льду в течение 1 ч с мягко resuspending клеток, нажав трубку на 30 мин.
ПРИМЕЧАНИЕ: Vortex на 30 мин, чтобы избежать клеточных агрегатов для лучшего окрашивания. - Добавьте 2 мл буфера окрашивания и вихря на устройство колебаний вихря. Центрифуга при 350 х г в течение 6 мин при 4 градусов по Цельсию и отбросить супернатант, как описано в шаге 3.1.2. Vortex, нажав трубку и инкубировать на льду для последующего окрашивания.
- Окрашивание другими поверхностными маркерами.
- Подготовка смеси антител (таблица1), как описано в шаге 3.1.4.
- Добавить смесь антител в каждую трубку. Vortex, нажав на дно трубки и инкубировать на льду в течение 30 минут.
- Вымойте клетки с 2 мл буфера окрашивания. Центрифуга при 350 x g в течение 6 мин при 4 градусах Цельсия.
- Отбросьте супернатант и добавьте 400 МКЛ буфера окрашивания. Вихрь трубки на вихревом устройстве колебания и держать трубку в темноте до потока цитометрии анализа.
4. Иммуностигирование pr8 вируса гриппа NP-специфических клеток Tfh
ПРИМЕЧАНИЕ: Этот протокол окрашивания NP-специфических клеток Tfh из предыдущихисследований 15,17.
- Выполните биотин-CXCR5 окрашивания, как описано в шаге 3.1 за исключением того, что номер клетки, принятых для окрашивания составляет 3 х10 6 для достаточного количества антиген-специфических клеток, которые будут записаны в потоке цитометрии.
- Добавьте 0,3 л тетрамера APC-conjugated-IAbNP311-325 MHC II (NP311-325)в трубку от 3.1.7. Подготовка смеси для нескольких образцов, как в шаге 3.1.4
ПРИМЕЧАНИЕ: Важно, чтобы пятно теттрамера до добавления анти-CD4 антитела, как связывание между CD4 и анти-CD4 антитела будут мешать оптимальной тетрамер окрашивания. - Resuspend клеточной смеси, осторожно нажав трубку и инкубировать в темноте на RT в течение 30 мин.
ПРИМЕЧАНИЕ: Обложка мокрой бумаги на рот труб, чтобы уменьшить испарение - Добавьте смесь других поверхностных маркеров(таблица 1) и продолжайте инкубацию на RT в течение 30 минут.
- Вымойте и повторно помимите клетки, описанные в шагах 3.2.3 и 3.2.4.
5. Иммуностинирование Bcl6 в поликлональных клетках Tfh
- Выполните поверхностные маркеры (Таблица 2) окрашивание, как описано в разделе 3, за исключением того, что последняя стирка с 2 мл PBS, вместо окрашивания буфера.
- Центрифуга при 350 x g в течение 6 мин при 4 градусах Цельсия. Откажитесь от супернатантов и повторно потухите клеточные гранулы, осторожно постукивая по дну трубки.
- Добавьте 300 МКЛ 3,7% раствора формальдегида (разбавленного из 37% формальдегида с PBS) в трубку для фиксации клеток. Вихрь на вихревом осцилляции устройства и инкубировать на RT в течение 20 минут.
- Добавьте 2 мл буфера окрашивания для мытья и центрифуги при 500 x g в течение 6 мин при 4 градусах Цельсия. Откажитесь от сверхнатантных и повторного использования клеток, осторожно нажав на трубку.
- Добавьте 300 МКЛ из 0,2% Triton-X 100 и повторно потухните клетки вихрем на устройстве колебаний вихря. Инкубация на RT в течение 15 мин.
- Добавьте 2 мл буфера окрашивания для мытья. Центрифуга при 500 x g в течение 6 мин при 4 градусах Цельсия. Откажитесь от сверхнатантных и повторного использования клеток, мягко нажав на дно трубки.
- Добавьте 1,5 мл антител PE-anti-Bcl6 для каждой трубки. Аккуратно нажав трубку дно повторного использования смеси и инкубировать на RT в течение 2 ч с мягко нажав трубку каждые 30 минут.
ПРИМЕЧАНИЕ: Обложка мокрой бумаги на рот труб, чтобы уменьшить испарение смеси. - Добавьте 2 мл PBS, дополненные 0,01% Triton-X 100 в трубку. Вихрь и центрифуга при 500 х г в течение 6 мин при 4 градусах Цельсия.
- Повторите стирку в качестве шага 5.8. Resuspend клетки с 400 йл окрашивания буфера. Храните клетки в темноте на льду до анализа цитометрии потока.
6. Внутриклеточное окрашивание IL21
- Стимулировать клетки с PMA (phorbol 12-миритат 13-ацетат) и иономицин.
- Возьмите 2 х 106 клеток из подвески splenic клеток и центрифуги при 350 х г в течение 6 мин при 4 градусов по Цельсию. Откажитесь от супернатантных и повторного перерасхода клеточных гранул с 500 йл полной Т-клеточной среды. Перенесите клетки в пластину из 24 колодец.
- Добавьте 20 нмоль PMA и 2 ммоль иономицина в 500 л полнойсреды 18 и тщательно перемешайте, трубя вверх и вниз.
- Добавить раствор, приготовленный в шаге 6.2 в клеточной подвески в 24-хорошо пластины и перемешать, встряхивая пластины. Настройка нестимулированного контроля путем добавления 500 йл полной Т-клеточной среды без добавления PMA и иономицина в клетки. Инкубация в инкубаторе CO2 при 37 градусов по Цельсию в течение 4 ч.
- Добавьте 10 ммоль BFA (Brefeldin A, растворенный метанолом) в каждую колодец, чтобы заблокировать аппарат Golgi опосредованную белковую транспортировку. Положите пластину обратно в клеточный инкубатор и инкубировать в течение 2 ч.
- Выполните окрашивание маркера поверхности клетки.
- Resuspend клетки, мягко трубы вверх и вниз и передачи клеток в трубку FACS. Добавить 1 мл окрашивания буфера в трубку и центрифугу при 350 х г в течение 6 мин при 4 градусов по Цельсию.
- Выполните Fc-рецептор блокатор окрашивания как шаг 3.1.4.
- Выполните маркеры поверхности клеток окрашивания (Таблица 3), как описано в шагах 3.2.1 до 3.2.3, за исключением стиральных клеток с 2 мл PBS.
- Центрифуга при 350 x g в течение 6 мин при 4 градусах Цельсия. Отбросьте сверхнатантные и повторное использование клеток, нажав на дно трубки.
- Добавьте 0,2 мл реагента из комплекта окрашивания живых/мертвых исправленных клеток Aqua Dead Cell и инкубировать трубку в темноте на RT в течение 10 минут для выполнения окрашивания мертвых клеток.
- Добавьте 2 мл PBS в трубку и вихрь на устройстве колебаний вихря. Центрифуга при 350 х г в течение 6 мин при 4 градусов по Цельсию и отбросить супернатант.
- Выполните фиксацию ячейки, описанную шагами 5.3 и 5.4.
- Добавьте 300 МКЛ буфера окрашивания для повторного перерасхода ячеек и храните трубки в холодильнике 4 градусов по Цельсию на ночь. Центрифуга при 500 х г в течение 6 мин при 4 градусов по Цельсию, чтобы удалить супернатант.
ПРИМЕЧАНИЕ: Этот шаг может быть опущен и продолжать шаг 6.7 непосредственно после шага 6.5. - Добавьте 1 мл буфера сапонина (окрашивающий буфер, дополненный 0,2%(w/v) сапонин) в трубку и вихрь на вихревом устройстве колебания. Инкубировать на льду в течение 20 минут для выполнения проницаемой ячейки.
- Центрифуга при 500 х г в течение 6 мин при 4 градусов по Цельсию и отбросить супернатант.
- Добавьте в каждую трубку 0,5 МЛ рецептора Fc-IL21 человека. Подготовка смеси антител для нескольких как шаг 3.1.4 за исключением того, что разбавить антитела с сапонин буфера вместо окрашивания буфера.
- Инкубировать на RT в течение 1 ч с осторожно нажав трубки дно повторного использования клеток на 30 мин.
- Добавьте 2 мл буфера сапонина для мытья клеток и центрифуги при 500 x g в течение 6 мин. Откажитесь от супернатанта и повторите мыть один раз.
- Добавьте в каждую трубку 0,1 л БТР-анти-человека Ig (H'L). Подготовка смеси для нескольких образцов в качестве шага 3.1.4 за исключением того, что разбавить антитела с сапонин буфера вместо окрашивания буфера.
- Инкубировать образцы на льду в течение 30 мин. и мыть как шаг 6.11.
- Resuspend клетки с 400 йл окрашивания буфера. Держите образец в темноте на льду до анализа цитометрии потока.
7. Окрашивание клеток ГК В и плазмы
- Возьмите клетки и выполнять анти-Fc-рецептор антитела окрашивания в качестве шагов от 3.1.1 до 3.1.4.
- Выполните окрашивание поверхностных маркеров(таблица 4)в качестве шагов от 3,1,5 до 3,1,7, за исключением того, что время инкубации составляет 30 минут вместо 1 ч.
- Resuspend клетки с 400 йл окрашивания буфера. Храните образцы в темноте на льду до анализа цитометрии потока.
8. Изоляция сыворотки от крови
- На 14-й день после заражения (d.p.i 14) собирайте кровь из лицевой вены и храните образцы крови в холодильнике на 4 градуса Цельсия на ночь.
ПРИМЕЧАНИЕ: Выполнить сбор крови в состоянии ABSL2 и с этого шага и далее все процедуры могут быть выполнены в обычной лаборатории. - Центрифуга крови при 400 х г в течение 10 мин при 4 градусах Цельсия. Изолировать сыворотку с 200 МКЛ пипетки тщательно, чтобы избежать загрязнения красных клеток. Aliquot в 3 трубки для каждого образца и хранить их при -80 градусов по Цельсию.
9. Анализ HA-специфических антител титр с ELISA
- Пальто ELISA пластины с 50 МКЛ 2 мкг / мл HA белковый раствор на колодец и инкубировать их в холодильнике 4 КК на ночь.
- Вымойте три раза с 200 йл из PBS разбавленных 0,05% tween (PBST). Добавьте 100 мл разбавленного PBST 5% обезжиренного молока в каждую колодец и инкубировать в RT в течение 2 ч, чтобы заблокировать неспецифический связывание.
- Разбавление и инкубация сыворотки: подготовить 3% BSA в PBS в качестве буфера разбавления. Разбавить сыворотку в буфере разбавления, как 1:50, 1:150, 1:450, ...... до 1:36450 (рекомендуется 3-кратное серийное разбавление). Добавьте 50 мкл разбавленной сыворотки к каждому хорошо и инкубировать в холодильнике 4 градусов на ночь.
- Отбросьте сыворотку и быстро вымойте колодцы один раз, добавив 200 МКЛ ПБСТ в каждую скважину (встряхните ее мягко, затем отбросьте). Затем медленно мыть пластины на шейкере с 200 йл PBST три раза в течение 5 минут каждый.
- Добавьте 100 мкл вторичного антитела, помеченного HRP, специфичного для всего IgG, IgM, IgG1, IgG2b, IgG2c (1:5000, разбавленного PBST) и инкубировать в RT на 1 ч. Вымойте пластины PBST, как описано в 9.4.
- Вывийте равный объем Буфера А и Буфера B (TMB) из хранилища 4 КК и разогрейте в течение по крайней мере 30 минут на RT перед использованием. Смешайте A и B и добавьте 100 МКЛ TMB в каждый колодец и инкубировать их в течение 10-30 минут на RT, встряхивая мягко.
ПРИМЕЧАНИЕ: Это краткое описание руководства TMB Substrate Reagent Set (BD,555214). - Pipette 100 йл 2M H2SO4 в каждую колодец, чтобы прекратить реакцию. Прочитайте значение OD450 с помощью инструмента.
- Анализ данных: получить окончательное значение OD450 путем вычитания фонового сигнала (значение OD450 пустой колодец). Нарисуйте кривую, соответствующую изотипу антитела каждого образца с фактором разбавления на оси X и значением OD450 на оси Y.
10. Гистология
- Изолировать селезенку на d.p.i 10. Исправить их в 3,7% формальдегида раствор для 1 ч на RT. Отбросьте буфер фиксации и мыть с PBS в течение 5 минут на шейкере в течение трех раз.
- Обезвоживание селезенки в PBS (10% сахарозы) при 4 градусов по Цельсию в течение 1 ч, а затем обезвоживать их в PBS (30% сахарозы) при 4 градусов по Цельсию с тряской мягко, пока селезенки опускаются на дно 15 мл трубки.
- Вынул обезвоженные селезенки, встроить их в оптимальное соединение температуры резки и криозиции.
- Предварительно охладите ацетон при -20 градусов по Цельсию. Инкубировать секции тканей с предварительно охлажденным ацетоном в течение 10 мин. Вымойте ткань с PBS в течение трех раз.
- Permeabilize ткани разделов с PBS, содержащие 0,2% Тритон X-100 в течение 20 минут и мыть их в течение трех раз с PBS.
- Блокировать неспецифические связывания с PBS, содержащие 10% нормальной сыворотки козы (блокирующий буфер) в течение 1 ч на RT и мыть ткани разделов с PBS один раз.
- Заблокировыв неспецифическую привязку блокирующим комплектом STREPTAVIDIN/BIOTIN.
ПРИМЕЧАНИЕ: Не позволяйте образцам высохнуть с этого шага вперед. - Окрашивание первичными антителами: добавьте блокирующий буферный биотин-PNA (25 мкг/мл) и крысиный антимоша IgD (2,5 мкг/мл) на секции тканей тщательно. Инкубировать секции тканей во влажной камере в морозильной камере 4 КК на ночь.
- Быстро мыть ткани разделов с PBST один раз. Быстро промыть секции тканей в PBST с встряхивания медленно в течение 5 минут. Повторите мыть в течение трех раз.
- Разбавить Alexa Fluor 488-стрептавидин (1:500) и Alexa Fluor 555-Коза-анти крыса IgG (1:500) антитела с блокирующим буфером и добавить их на части ткани тщательно
- Инкубация на RT в течение 1 ч.
- Вымойте секции тканей как шаг 10.8 и тщательно смонтировать с пролонгировать раствор. Обложка ткани с coverslips тщательно и держать их в темноте при 4 градусов по Цельсию до конфокального анализа.
- Проанализируйте величину реакции GC, подсчитав номера GC на размер области.
Результаты
Характеристика заболеваемости мышей при инфицировании вирусом гриппа
После заражения вирусом гриппа, мыши менее активны и анорексией из-за болезни, которая находит свое отражение в тяжелой потере веса, широко используемый симптом для мониторинга заболеваемостимышей 19. Как показано на рисунке 1a, PR8 вирус-инфицированных мышей начали терять вес на 6-й день, достигли самого высокого уровня потери на 8-й день и вернулся к первоначальному уровню на 10-й день. Как и ожидалось, потеря веса не наблюдалась на протяжении всего периода в PBS-обработанных контрольных мышей. При симптомах in vivo вирусная инфекция приводит к сильному расширению лимфоцитов в дренажных лимфатических узлах, МЛН в этом случае. Таким образом, значительно больший размер mLNs наблюдались у PR8 вирус-инфицированных мышей, чем у контрольных мышей(рисунок 1b). Взятые вместе, все эти мыши показали ожидаемые симптомы и были квалифицированы для последующего Tfh связанных иммунного ответа исследования.
Обнаружение дифференциации Tfh и связанных с функциями молекул
Чтобы проанализировать дифференциацию Tfh, мыши были принесены в жертву на 5, 7, 10 и 14 день после инфекции и mLNs или селезенки были изолированы для анализа цитометрии потока. Рисунок 2a и рисунок 2b показывают Tfh населения gating стратегии, с Tfh закрыты как PD-1привет CXCR5привет клеток и не-Tfh как PD-1низкийCXCR5низких ячеек. С помощью этой стратегии gating, кинетики Tfh дифференциации во время заражения вирусом гриппа были проведены анализы. Как показано на рисунке 2c, Tfh дифференциации инициализированы в день 5 и достиг пика в день 10. Поэтому мы взяли образцы 10-го дня для дальнейшего анализа. Как показано на рисунке 3a, надежная дифференциация клеток Tfh была вызвана у инфицированных вирусом гриппа мышей по сравнению с контрольных мышей. Для анализа специфических клеток Tfh, флюорохром помеченных IAbNP311-325 MHC класса II тетрамеры (NP311-325) были добавлены в поликлональных Tfh клеток окрашивания панели (Таблица 1). Как в mLNs, так и в селезенке от инфицированных вирусом гриппа мышей, NP311-325-специфическиеCD4 и Т-клетки были значительно индуцированы и NP311-325-специфические клетки Tfh могут быть проанализированы путем добавления PD-1 и CXCR5 в анализ(рисунок 3e). Из-за основных ролей Bcl6 в tfh дифференциации,Bcl6и CXCR5клетки могут также представлять население Tfh. Последовательно, Tfh клетки, отождествляемые с этой стратегией были также индуцированы надежно (Рисунок 3b). Мы также проанализировали экспрессию Bcl6 в Tfh и не-Tfh клеток. Как показано на рисунке 3c, более высокое выражение Bcl6 в tfh клеток, чем в не-Tfh клетки указывает на успешное окрашивание Bcl6. С аналогичной стратегией, ICOS, другой Tfh-ассоциированной молекулы также был проанализирован (Рисунок 3d). Из-за специализированной роли tfh клеток в оказании помощи для В-клеток, анализ экспрессии IL21, который выделяется в основном Tfh клеток и продемонстрировали непосредственно регулировать выживание и пролиферацию В-клеток, может выявить Tfh клетки функции в некоторой степени. Как показано на рисунке 3f, внутриклеточное окрашивание IL21 показало, что PR8 инфекции индуцированных значительно более высокое производство этого цитокина, с unstimulated клеток, как gating контроля. Взятые вместе, эти анализы могут отражать основную информацию о дифференциации Tfh и обеспечить понимание способности B-клеточной помощи.
Обнаружение развития GC B и плазменных клеток и специфических антител вируса гриппа в сыворотке крови
Основная функция tfh клеток заключается в том, чтобы обеспечить помощь В-клеток в GCs, в котором антитела класса переключения и сродства созревания происходят. Таким образом, развитие GC B может косвенно отражать дифференциацию и функцию клеток Tfh. Клетки GC B могут быть закрытыв качестве B220 и PNAиFas( Рисунок 2d). В рамках этой стратегии gating, мы анализированы кинетики GC B ответ клеток и обнаружили, что GC B ответ начался в день 10 и продолжал расти в день 14 (Рисунок 2e). Сравнение между PR8 вирус-инфицированных и контрольных мышей показали надежные GC B были вызваны как в mLN и селезенки после заражения вирусом гриппа(рисунок 4a), который согласуется с индуцированной Tfh дифференциации в PRB вирус инфицированных мышей. Кроме того, иммунофлуоресценция окрашивания с IgD и PNA обеспечивает визуализированы изображения, указывающие индуцированной реакции GC (зеленые зоны) в PR8 вирус-инфицированных мышей(рисунок 4d). Плазменные клетки, идентифицированные как IgDнизкийCD138 и клетки(рисунок 2d), также были созданы в PR8 вирус-инфицированных мышей (Рисунок 4b). Предыдущие исследования показали, что IFNƳ и IL21 могут быть секретированы из клеток Th1 и Tfh при вирусной инфекции и вызвать переключение класса IgG2 и IgG1,соответственно 20. Рисунок 4c изображает генерацию вируса гриппа специфических антител ELISA анализ HA-специфических IgM, всего IgG, IgG1, IgG2b и IgG2C. В совокупности все эти анализы отражают связанные с Tfh В-клеточные реакции при инфицировании вирусом гриппа.

Рисунок 1: Характеристика заболеваемости мышей. 8-недельные мыши мужского пола были инфицированы 40 ПФУ вируса гриппа PR8 интраназальной прививкой. Мыши взвешивались ежедневно в течение 10дней (a)и mLNs были изолированы на d.p.i 10 (b). Бары ошибок вa ) представляютсреднее время ± SD. n и 4 мыши на группу. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
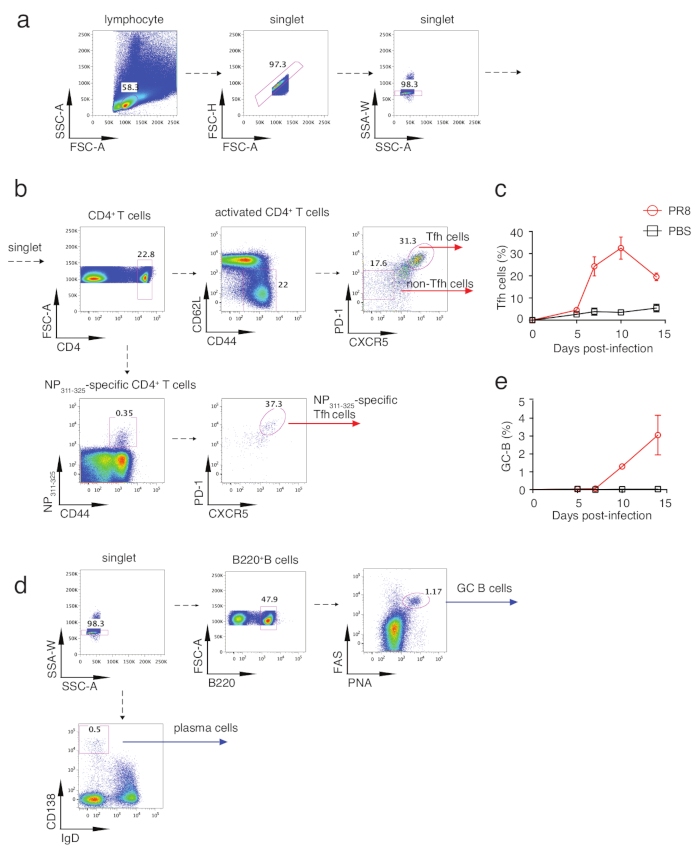
Рисунок 2: Стратегия Гэтинга клеток Tfh и клеток GC B. а)лимфоциты определяются FSC-A и SSC-A, а сотовые синглеты закрыты FSC-A, FSC-H и SSC-A, SSC-W. b)После замыквания в CD4и T-ячейках, поверхностные маркеры CD62L и CD44 используются для различения наивных Т-клеток (CD44loCD62Lhi)и активированных Т-клеток (CD44hiCD62Llo). Поликлональные Tfh клетки могут быть закрыты от активированных Т-клеток, как PD-1привет CXCR5привет населения, наоборот, не Tfh клетки, как PD-1низкийCXCR5низкий. PR8 вирус-специфических Tfh клетки определяются какCD4и CD44 NP311-325 тетрапераи PD-1привет CXCR5 приветклеток. (c,e) Кинетики tfh частоты в активированных клетках (c) и GC B частоты в B220и клеток (e). (d)Клетки GC B закрыты как B220- PNAиFAS -клетки, а плазменные клетки IgD-CD138 -клетки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
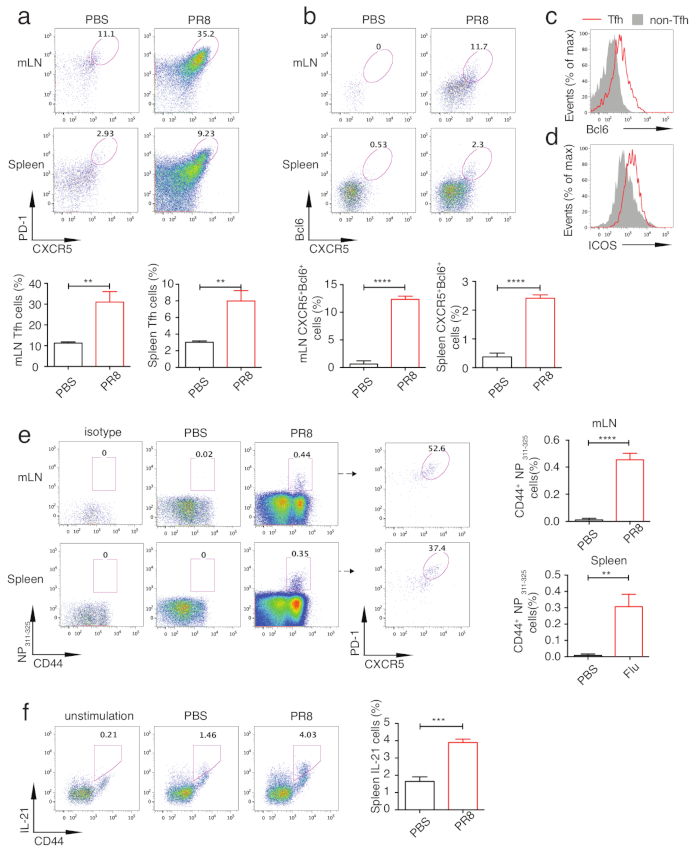
Рисунок 3: Анализ дифференциации Tfh у зараженных вирусом мышей PR8. Мыши были принесены в жертву на d.p.i 10 и mLNs и селезенки были изолированы для анализа дифференциации Tfh. (a) Tfh процент в mLNs и селезенки в PR8 вирус-инфицированных мышей и PBS-обработанных мышей (верхняя панель). Статистика клеток Tfh (нижняя панель). b)внутриклеточное окрашивание Bcl6 в CD4иCD44 приветТ-клеток (верхняя панель). Статистика ячеек Bcl6иCXCR5(нижняя панель). c ) Bcl6и(d) выражениеICOS в Tfh (линии-красный) и не-Tfh клетки (твердо-серый). e)gating NP311-325-специфическихCD4 и Т-клеток в mLNs и селезенках вирус-инфицированных PR8 и PBS-обработанных мышей (левая панель). Процент PR8 вирус-специфических tfh клеток в mLNs и селезенки (средняя панель). "Изотип" указывает на окрашивание с неуместным контролем теттрамера. Статистика NP311-325 -специфическихCD4 иТ-клеток (правая панель). (f)Внутриклеточное окрашивание ИЛ-21 в splenic CD4и Т-клеток от PR8 вирус-инфицированных и PBS-обработанных мышей, нестимуляция показано как контроль (слева). Статистика окрашивания Ил-21 (справа). «P lt; 0.01, «P»lt; 0.001 и P lt; 0.0001 (двуххвостый студенческий т-тест). Бары ошибок представляют среднее ± SD. n 3 мыши на группу. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Анализ реакции, связанной с клетками GC B, у зараженных вирусом мышей PR8. Мыши были принесены в жертву на d.p.i 10 и mLNs и селезенки были изолированы для анализа. a)процент клеток GC B (верхняя панель). Статистика клеток GC B (нижняя панель). b)процент плазменных клеток (верхняя панель). Статистика плазменных клеток (нижняя панель). c)количественная оценка вируса PR8 HA-специфических IgG, IgM, IgG1, IgG2b и IgG2c в сыворотке крови (d.p.i 14) инфицированных вирусом мышей PR8 и мышей, обработанных PBS. d)Конфокальцавная микроскопия В-клеточных фолликулов(IgD, Red) и GCs (PNA, Green) в образцах селезенки зараженных вирусом мышей PR8 и обработанных PBS мышей (d.p.i 10). «P lt; 0.5, хт; 0,01, и 0,001 (двуххвостый студенческий т-тест). Бары ошибок представляют среднее ± SD. n 3 мыши на группу. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| поверхностный маркер | фторхром | клон | объем на образец (ul) |
| CD4 | Перкп-эФлюор 710 | ГК1.5 | 0.2 |
| CD44 | eVolve 605 | IM7 | 0.2 |
| CD62L | FITC | МЕЛ-14 | 0.2 |
| ICOS | BV421 | 7E.17G9 | 0.2 |
| PD1 | PE/Cy7 | 29F.1A12 | 0.3 |
| Стрептавидин | PE | 0.2 |
Таблица 1: Поверхностный маркер (за исключением CXCR5) антител панели для окрашивания Tfh клеток (PD-1приветCXCR5привет).
| поверхностный маркер | фторхром | клон | объем на образец (ul) |
| CD4 | Перкп-эФлюор 710 | ГК1.5 | 0.2 |
| CD44 | FITC | IM7 | 0.2 |
| PD1 | PE/Cy7 | 29F.1A12 | 0.3 |
| Стрептавидин | BV421 | 0.5 |
Таблица 2: Поверхностные маркерные антитела (за исключением CXCR5) панели для окрашивания Bcl6 в клетках Tfh.
| поверхностный маркер | фторхром | клон | объем на образец (ul) |
| CD4 | Перкп-эФлюор 710 | ГК1.5 | 0.2 |
| CD44 | FITC | IM7 | 0.2 |
Таблица 3: Поверхность маркер антител панели для внутриклеточного окрашивания IL21.
| поверхностный маркер | фторхром | клон | объем на образец (ul) |
| B220 | БТР | RA3-6B2 | 0.2 |
| IgD | eФтор 450 | 11-26c | 0.2 |
| CD95 | PE/Cy7 | Jo2 | 0.3 |
| ПНА | FITC | 0.3 | |
| CD138 | PE | 281-2 | 0.2 |
Таблица 4: Поверхность маркер антител панели для окрашивания GC B и плазмы В-клеток.
Обсуждение
Из-за специализированных ролей в предоставлении B-клеточной помощи для генерации антител высокого сродства, Tfh клетки были широко изучены в механизмах дифференциации и манипуляции, чтобы обеспечить новые стратегии для разработки вакцины. Инфекция вирусом гриппа вызывает энергичные ответы Tfh и GC B клеток, таким образом, является подходящей моделью для этой области исследований. В этом документе мы описали протоколы инфицирования вирусом гриппа путем интраназальной прививки, оценки связанных Tfh ответных мер по цитометрии потока, иммунофлюоресценции и ELISA. Эти анализы будут способствовать выявлению tfh дифференциации, развития GC B и гриппа вирус конкретных антител и помочь исследователям изучить и определить новые важные молекулы в иммунном ответе.
В исследованиях с моделями инфицированных вирусом гриппа мышей, потеря веса является широко используемым показателем заболеваемости мышей. Ожидаемое изменение веса кинетики в вирус гриппа инфицированных мышей, как описано на рисунке 1a, который отражает соответствующий иммунный ответ, вызванный у мышей. Тем не менее, ненормальные случаи будут регулярно происходить, в которых мыши теряют вес или не показывают никакого снижения веса на протяжении всего периода наблюдения. Согласно нашему опыту, эти мыши в основном несут ненормальный более низкий или более высокий иммунный ответ, тем самым нарушая результаты эксперимента. Чтобы избежать таких вариаций, во-первых, мыши, используемые в эксперименте, должны быть половых и возрастных, чтобы гарантировать аналогичную способность реагировать на вирус. Последовательный вирус titer для каждой мыши также важно21. Вирус titer используется в этом протоколе 40 ПФУ. Тем не менее, вирус titer, чтобы вызвать соответствующие изменения веса кинетики в каждой лаборатории может быть переменной из-за несоответствия в процедуре оценки вируса titer и штаммов мыши, используемых в эксперименте. Таким образом, мы советуем titration вируса титр для инфекции необходимо до иммунного ответа соответствующих исследований.
В этом протоколе мы определили tfh-клетки с часто используемыми маркерами PD-1, CXCR5 и существенным транскрипционным фактором Bcl6. Несмотря на то, что оба PD-1привет CXCR5 привет и Bcl6 и CXCR5клетки могут быть обозначены как Tfh клетки, они представляют различные группы населения и не имеют отношения предшественника-потомства на основе того факта, что не все PD-1приветCXCR5привет клетки Bcl6 и не все Bcl6 и CXCR5 привет клетки PD-1 привет CXCR5 привет . Этот фенотип может быть объяснен неоднородностью экспрессии Bcl6 в клетках Tfh22. ICOS, важнейшая молекула как для дифференциации Tfh, так и для миграции, также должна быть включена в анализ дифференциации Tfh. Кроме того, другие связанные с функцией состимуляторные молекулы, такие как OX40 и CD40L, также должны быть обнаружены на уровне их экспрессии, хотя и не включены в этот протокол. IL21 и IL4 оба Tfh-секретных цитокинов, играющих роль в стимулировании IgG1 класса переключения. Протокол обнаружения выражения IL21 описан в настоящем документе. Однако, из-за трудностей в обнаружении IL4 в клетках Tfh, IL4-GFP репортер мышей были использованы в предыдущихисследованиях 23. В этом протоколе, мы также использовали фторхром помечены NP тетрамеры для обнаружения NP311-325-специфических tfh клеток. Тем не менее, ограничение в количестве NP311-325-специфическихклеток Tfh дает трудности в дальнейшем анализе. Таким образом, приемный эксперимент передачи гриппа гемагглютинин специфических-TCR трансгенных (Tg)CD4 (TS-1) Т-клеток, которые могут быть изолированы от мышей ЦА-1, является альтернативной стратегией в решении этойпроблемы 24.
Здесь мы определили GC B как B220-PNA и Fas- клеткив окрашивание цитометрии потока. Альтернативная стратегия комбинации маркеров для определения GC B как GL7приветFasпривет клетки также используется в другихдокументах 14,16. Мы также используем иммунофторесценцию для визуализации ДК с сочетанием анти-IgD и PNA. В этом добавлении антитела CD3 может помочь визуализировать клетки Tfh, таким образом позволяющ изучение взаимодействия между этими 2 типамиклетки 10.
Учитывая дифференциацию tfh-клеток является многоступенчатым и многофакторным процессом, дополнительный анализ других значительных молекул в нескольких точках времени необходим для выяснения более детального механизма дифференциации Tfh. Кроме того, параметры, обнаруженные здесь, также широко используются в других моделях18. Поэтому, помимо инфекции, связанной с вирусом гриппа, описанные здесь протоколы, особенно иммуностимуляторная часть, могут также давать инструкции в исследовании, связанном с Tfh, с другими моделями.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Благодарим сотрудников предприятия по цитометрии потока, объекта ABSL2 и животноводского комплекса SPF Института Пастера в Шанхае за техническую помощь и консультации. Эта работа была поддержана следующими грантами: Стратегическая приоритетная исследовательская программа Китайской академии наук (XDB29030103), Национальная ключевая программа НИОКР Китая (2016YFA0502202), Национальный фонд естественных наук Китая (31570886).
Материалы
| Name | Company | Catalog Number | Comments |
| Immunostaining of Tfh cells, NP-specific Tfh cells and Bcl-6 | |||
| 37% formaldehyde | Sigma | F1635 | |
| Anti-CD16/32 mouse | Thermo Fisher Scientific | 14-0161-86 | |
| APC-conjugated-IAbNP311-325 MHC class II tetramer | NIH | ||
| Bcl-6 PE | Biolegend | 358504 | clone:7D1 |
| Biotin-CXCR5 | Thermo Fisher Scientific | 13-7185-82 | clone: SPRCL5 |
| CD4 Percp-eFluor 710 | Thermo Fisher Scientific | 46-0041-82 | clone:GK1.5 |
| CD44 eVolve 605 | Thermo Fisher Scientifi | 83-0441-42 | clone:IM7 |
| CD44 FITC | Thermo Fisher Scientifi | 11-0441-82 | clone:IM7 |
| CD62L FITC | BD Pharmingen | 553150 | clone:MEL-14 |
| ICOS BV421 | Biolegend | 564070 | clone:7E.17G9 |
| PD1 PE/Cy7 | Biolegend | 135216 | clone:29F.1A12 |
| Streptavidin BV421 | BD Pharmingen | 563259 | |
| Streptavidin PE | BD Pharmingen | 554081 | |
| Intracelluar staining of IL21 | |||
| 37% formaldehyde | Sigma | F1635 | |
| anti-human IgG | Jackson ImmunoResearch Laboratories | 109-605-098 | |
| Brefeldin A | Sigma | B6542 | |
| human FCc IL-21 receptor | R&D System | ||
| ionomycin | Sigma | I0634 | |
| Live/Dead Fixable Aqua Dead Cell staining kit | Thermo Fisher Scientific | L34966 | |
| PMA | Sigma | P1585 | |
| Saponin | MP | 102855 | |
| GC B and plasma cells staining | |||
| B220 APC | Thermo Fisher Scientific | 17-0452-81 | clone:RA3-6B2 |
| CD138 PE | BD Pharmingen | 561070 | clone:281-2 |
| CD95 (FAS) PE/Cy7 | BD Pharmingen | 557653 | clone:Jo2 |
| IgD eFluor 450 | Thermo Fisher Scientific | 48-5993-82 | clone:11-26c |
| PNA FITC | Sigma | L7381 | |
| Assay of HA-specific antibody titer with ELISA | |||
| PR8-HA | Sino Biological | 11684-V08H | |
| BSA | SSBC | ||
| Goat anti mouse Ig (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgM (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgG1 (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgG2b (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgG2c (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| TMB Substrate Reagent Set | BD Pharmingen | 555214 | |
| Histology | |||
| Alexa Fluor 555-Goat-anti rat IgG | Life Technology | A21434 | |
| anti-mouse IgD | Biolegend | 405702 | |
| biotinylated PNA | Vector laboratories | B-1075 | |
| dilute Alexa Fluor 488-streptavidin | Life Technology | S11223 | |
| normal goat serum | SouthernBiotech | 0060-01 | |
| Pro-long gold antifade reagent | Thermo Fisher Scientific | P3630 | |
| STREPTAVIDIN/BIOTIN blocking kit | Vector laboratories | SP-2002 |
Ссылки
- Johnston, R. J., et al. Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science. 325 (5943), 1006-1010 (2009).
- Nurieva, R. I., et al. Bcl6 mediates the development of T follicular helper cells. Science. 325 (5943), 1001-1005 (2009).
- Yu, D., et al. The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment. Immunity. 31 (3), 457-468 (2009).
- Pedros, C., et al. A TRAF-like motif of the inducible costimulator ICOS controls development of germinal center TFH cells via the kinase TBK1. Nature Immunology. 17 (7), 825-833 (2016).
- Xu, H., et al. Follicular T-helper cell recruitment governed by bystander B cells and ICOS-driven motility. Nature. 496 (7446), 523-527 (2013).
- Lee, S. K., et al. B cell priming for extrafollicular antibody responses requires Bcl-6 expression by T cells. The Journal of Experimental Medicine. 208 (7), 1377-1388 (2011).
- Zotos, D., et al. IL-21 regulates germinal center B cell differentiation and proliferation through a B cell-intrinsic mechanism. The Journal of Experimental Medicine. 207 (2), 365-378 (2010).
- Vogelzang, A., et al. A fundamental role for interleukin-21 in the generation of T follicular helper cells. Immunity. 29 (1), 127-137 (2008).
- Ansel, K. M., et al. A chemokine-driven positive feedback loop organizes lymphoid follicles. Nature. 406 (6793), 309-314 (2000).
- Shi, J., et al. PD-1 Controls Follicular T Helper Cell Positioning and Function. Immunity. 49 (2), 264-274 (2018).
- Methot, S. P., Di Noia, J. M. Molecular Mechanisms of Somatic Hypermutation and Class Switch Recombination. Advanced ImmunoChemical. 133, 37-87 (2017).
- Crotty, S. Follicular helper CD4 T cells (TFH). Annual Review of Immunology. 29, 621-663 (2011).
- Calame, K. L. Plasma cells: finding new light at the end of B cell development. Nature Immunology. 2 (12), 1103-1108 (2001).
- Yoo, J. K., Fish, E. N., Braciale, T. J. LAPCs promote follicular helper T cell differentiation of Ag-primed CD4+ T cells during respiratory virus infection. The Journal of Experimental Medicine. 209 (10), 1853-1867 (2012).
- Leon, B., Bradley, J. E., Lund, F. E., Randall, T. D., Ballesteros-Tato, A. FoxP3+ regulatory T cells promote influenza-specific Tfh responses by controlling IL-2 availability. Nature Communications. 5, 3495 (2014).
- He, L., et al. Extracellular matrix protein 1 promotes follicular helper T cell differentiation and antibody production. Proceedings of the National Academy of Sciences of the United States of America. 115 (34), 8621-8626 (2018).
- León, B., et al. Regulation of TH2 development by CXCR5+ dendritic cells and lymphotoxin-expressing B cells. Nature Immunology. 13 (7), 681-690 (2012).
- Wang, H., et al. The transcription factor Foxp1 is a critical negative regulator of the differentiation of follicular helper T cells. Nature Immunology. 15 (7), 667-675 (2014).
- Bouvier, N. M., Lowen, A. C. Animal Models for Influenza Virus Pathogenesis and Transmission. Viruses. 2 (8), 1530-1563 (2010).
- Miyauchi, K., et al. Protective neutralizing influenza antibody response in the absence of T follicular helper cells. Nature Immunology. 17 (12), 1447-1458 (2016).
- Rodriguez, L., Nogales, A., Martinez-Sobrido, L. Influenza A Virus Studies in a Mouse Model of Infection. Journal of Visualized Experiments. (127), (2017).
- Kitano, M., et al. Bcl6 protein expression shapes pre-germinal center B cell dynamics and follicular helper T cell heterogeneity. Immunity. 34 (6), 961-972 (2011).
- Yusuf, I., et al. Germinal center T follicular helper cell IL-4 production is dependent on signaling lymphocytic activation molecule receptor (CD150). The Journal of Immunology. 185 (1), 190-202 (2010).
- Sun, J., Dodd, H., Moser, E. K., Sharma, R., Braciale, T. J. CD4+ T cell help and innate-derived IL-27 induce Blimp-1-dependent IL-10 production by antiviral CTLs. Nature Immunology. 12 (4), 327-334 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены