Method Article
인플루엔자 A 바이러스 감염 중 T 여포 도우미 세포 및 발아 센터 반응 평가
* 이 저자들은 동등하게 기여했습니다
요약
이 논문은 인플루엔자 바이러스 감염의 마우스 모형에 있는 Tfh 및 GC B 반응을 평가하는 프로토콜을 기술합니다.
초록
T 여포 도우미 (Tfh) 세포는 발아 센터 (GC) 개발 및 높은 친화도 항체의 생성에 대한 도움을 제공하는 데 전문화 된 독립적 인 CD4+ T 세포 하위 집합이다. 인플루엔자 바이러스 감염에서, 강력한 Tfh 및 GC B 세포 반응은 Tfh 관련 연구를 위한 자격을 갖춘 마우스 모형을 부여하는 효과적인 바이러스 박멸을 촉진하기 위하여 유도됩니다. 이 논문에서, 우리는 마우스에 있는 인플루엔자 바이러스 감염 도중 기본적인 Tfh 관련 면역 반응의 검출에 있는 프로토콜을 기술했습니다. 이러한 프로토콜포함: 인플루엔자 바이러스의 비강 내 접종; 폴리클론 및 항원 특이적 Tfh 세포, GC B 세포 및 혈장 세포의 유동 세포 피진 및 분석; GC의 면역 형광 검출; 혈청에서 인플루엔자 바이러스 특이적 항체의 효소-연결된 면역흡혈구 분석(ELISA). 이러한 분석체는 기본적으로 인플루엔자 바이러스 감염에서 Tfh 세포의 분화 및 기능을 정량화하여 분화 메커니즘 및 조작 전략을 해명하는 연구에 도움을 제공합니다.
서문
최근 10 년 동안, 수많은 연구는 새로 확인 된 CD4+ T 세포 서브 세트에 초점을 맞추고있다, Tfh 세포 하위 집합, 발아 센터 (GC) B 개발에 필수적인 역할에 대한. B세포 림프종 6(Bcl6)은 주로 유전자 억압자로 간주되는, Bcl6의 자궁외 발현이 Tfh 분화를 유도하기에 충분하다는 증거를 위해 Tfh 세포의 계보-정의 인자이며 Bcl6의 결핍으로 인해 Tfh 분화1,2,3이사라졌다. 다른 CD4+ T 도우미 서브세트가 염증 부위로 이동하여 이펙터 기능을 수행하는 것과 달리, Tfh 세포는 주로 비장 및 림프절의 B 세포 여포 영역에서 B 세포 도움을 제공한다. 공동 자극 분자 ICOS 및 CD40L, Tfh와 GC B 세포 사이의 상호 작용에 중요한 역할을한다. Tfh 분화 동안, ICOS는 코그네이트 B 세포로부터 필요한 신호를 전송하고 또한 B 세포 영역국소화4,5에대한 방관자 B 세포로부터 이동 신호를 수신 수용체 역할을한다. CD40L은 B 세포 증식 및 생존6을위한 Tfh 세포로부터의 신호 의 중재자이다. CD40L과 유사한 역할을 하는 또 다른 요인은 주로 Tfh 세포에 의해 분비되는 사이토카인 IL21이다. IL21은 GCB 세포의 개발 및 고친화항체의 생산을 직접 규제하지만 Tfh 분화에서의 역할은 여전히 논란의 여지가있는7,8. 현재 유동 세포 분석에서 Tfh 세포를 식별하는 데 가장 빈번하게 사용되는 PD-1 및 CXCR5는 이 하위 집합의 분화 및 기능에 중요한 역할을 합니다. CXCR5는 B 세포 여포 케모키인의 수용체이며 B 세포 여포9에서Tfh 세포의 국소화를 중재한다. PD-1은 이제 여포 유도 기능을 가질 뿐만 아니라 GC B 세포 친화 성숙 과정에서 중요한 신호를 전송하는 것으로 확인된다10. 이러한 사실 인정에 근거하여, 이 분자의 발현을 평가하는 것은 기본적으로 Tfh 세포의 성숙 그리고 기능을 반영할 수 있었습니다.
GC는 이차 림프구 기관에서 유도된 일시적인 미세 해부학 구조이며 Tfh 세포에 크게 의존하므로 Tfh 반응을 평가하기에 완벽한 판독값입니다. GC에서, 세포사화학 및 공동 자극 분자에 의해 매개되는 신호를 수신한 후, B 세포는고친화항체(11)를생성하기 위해 클래스 스위칭 및 체세포 초열의 대상이 된다. 차동 항체 클래스 스위칭은 INγ가 IgG2 급 스위칭12를유도하는 동안 IL4 및 IL21이 IgG1 급 스위칭을 유도하는 차동 사이토카인 틈새 시장에서 발생한다. 혈장 세포는 분비 항체의 생산자이며 말단 분화 세포입니다. Tfh 세포 같이, GC에 있는 B 세포의 발달은 많은 중요한 분자의 동적 발현과 연관됩니다. 현재 연구에 기초하여, GC B 세포는 B220+PNA+Fas+ 또는 B220+GL7+Fas+ 세포 및 혈장 세포로 식별 될 수있다, 자신의 전구체에 비해, B220의 표현을 다운 조절 및 UPregulate CD138 발현13. 더 구체적으로, 이들 특성은 유동 세포측정 및 면역형광 분석에서 검출될 수 있으므로 GC 반응의 적절한 평가가 된다.
강력한 세포 및 유머 반응은 인플루엔자 바이러스 감염에서 유도되며, Tfh 및 Th1 세포가 CD4+ T 세포 반응14를지배하여 Tfh 세포 분화 연구를위한 완벽한 모델입니다. 인플루엔자 A/푸에르토리코/8/34 H1N1(PR8)은 일반적으로 사용되는 마우스 적응 균주이며, 이 연구에서 자주 사용된다14,15,16. 여기에서, 우리는 인플루엔자 바이러스 감염에 있는 Tfh 연구 관련 분석의 몇몇 기본적인 프로토콜을 기술합니다: 1) PR8 바이러스의 비강 내 접종; 2) 항원 특이적 Tfh 세포, GC B 및 혈장 세포 및 유동 세포측정을 갖는 IL21 검출; 3) GC의 조직학적 시각화; 4) ELISA와 혈청에서 항원 특이적 항체 티터의 검출. 이 프로토콜은 Tfh 관련 연구 결과에 있는 새로운 연구원을 위한 필요한 기술을 제공합니다.
프로토콜
동물 실험은 중국 상하이의 연구소 파스퇴르 의 기관 동물 관리 및 사용 위원회에 의해 승인되었습니다. 모든 실험은 기관 동물 관리 및 사용 위원회가 승인 한 동물 프로토콜에 따라 수행되었다.
참고: 마우스의 바이러스 감염 및 장기의 격리ABSL2 조건 하에서 수행되어야 합니다.
1. PR8 인플루엔자 바이러스의 접종과 마우스 무게기록
- ABSL2 방에서 감염을 위해 8 주 된 남성 C57BL/6 마우스를 준비하십시오.
참고: 이 프로토콜은 또한 여성 마우스를 가진 실험에 적합합니다. - PR8 바이러스의 희석: -80 °C 냉동고에서 바이러스를 꺼내 액체로 녹을 때까지 얼음에 배양하십시오. 스톡 바이러스를 철저히 희석시키고 멸균 인산염 완충식식염(PBS, 135mM NaCl, 2.7m MM KCl, 10mM Na2HPO4,1.8 mM KH2PO4)을사전 냉각된 1.5mL 튜브로 2PFU/μL로 바이러스를 희석시켰다.
-
마우스 마취: 각 마우스의 무게를 측정하고 사용되는 펜토바르비탈 나트륨(2 mg/mL)의 부피(4배(μL)를 계산합니다. 나트륨 펜토바르비탈의 계산된 볼륨을 회고합니다.
참고: 이 단계는 마우스가 바이러스의 정확한 티터가 intranasly 접종될 수 있도록 꾸준히 평화롭게 호흡하도록 하는 것입니다. 너무 빠르거나 느린 심장 박동은 부적절한 마취를 나타냅니다. 또한, 수의사 연고의 사용은 눈 건조를 피하기 위해 권장됩니다. - 비강 내 접종: 희석 된 PR8 바이러스를 철저히 소용돌이. 파이프 10 μL 조심스럽게 드롭에 의해 드롭 한쪽 드롭에 한쪽 비강 접종을 수행합니다. 이 쪽의 한 케이지(최대 5마우스)에서 모든 마우스의 접종을 마친 후, 다른 쪽에서 접종을 반복합니다(접종을 통해 마우스의 호흡을 평화롭고 안정적으로 유지). 각 마우스는 총 PR8 바이러스의 40 PFU에 감염됩니다.
- 더 나은 부흥을 위해 따뜻한 케이지에 흉골 재공간에 마우스를 배치합니다.
- 매일 10일 동안 마우스 무게를 모니터링합니다. (감염일은 0일로 기록됩니다).
2. 비장 및 중질 림프절 (mLN)에서 림프구의 격리
- 마우스 안락사: 마우스를 작은 챔버에 넣고 챔버의 바닥에서 평화롭게 CO2로 펌핑하여 마우스를 안락사시. 마우스가 움직이지 않을 때 마우스를 꺼내 서 자궁 경부 탈구를 수행하여 마우스가 완전히 죽도록 하십시오. 75%의 에탄올로 마우스를 찍어 생물안전 후드로 옮깁니다.
- 흡수성 종이 로 덮인 해부 폼 플레이트에 해부 바늘로 마우스를 고정. 복부 중위및 해부 가위로 뒷다리를 따라 피부를 자르고 핀셋으로 피부를 스트레칭합니다. 해부 바늘로 뻗은 피부를 고정합니다.
- 각 마우스에 6cm 요리 2개를 준비하고 얼음 위에 보관하십시오. 각 접시에 70 μm 세포 스트레이너를 넣고 1 % 태아 소 세럼 (DMEM (1 % FBS)으로 보충 DMEM의 5 mL을 추가)
- 비장 격리: 복막을 잘라 해부 가위로 복강을 노출시합니다. 비장을 가지고 준비 된 요리에 넣어.
- mLN 격리: 다이어프라그마와 케이지 리브의 바닥을 흉골 부근으로 자른다. 갈비뼈를 옆으로 당기고 해부 바늘로 고정하여 흉부 구멍을 노출시십시오. 폐를 오른쪽으로 당기고 핀셋을 사용하여 심장 아래와 기관의 복부 측면 근처에서 mLN을 사용하십시오.
- 준비된 접시에 mLN을 넣습니다.
- 단일 셀 서스펜션 획득: 70 μm 세포 스트레이너를 통해 3mL 주사기의 플런저로 비장 또는 mLN을 부드럽게 메쉬하십시오. 신선한 DMEM (1 % FBS)의 1 mL로 세포 스트레이너를 헹구세요. 세포 현탁액을 다시 중단하고 15mL 원심분리기 튜브로 이송합니다.
- 4°C에서 6분 동안 350 x g의 세포 현탁액을 원심분리합니다. 상체를 제거하고 DMEM (1 % FBS)의 1 mL을 추가합니다.
- 1mL 파이펫으로 셀 펠릿을 완전히 다시 중단합니다. DMEM(1% FBS)을 비장 세포 서스펜션에 넣고 다음 작업을 위해 얼음 위에 보관하십시오.
참고: 펠릿에서 단일 세포를 완전히 격리하기 위해서는 5mL가 아닌 1mL의 중간 체로 세포 펠릿을 다시 분리할 필요가 있습니다.
이 단계부터 는 일반 랩에서 모든 작업을 수행할 수 있습니다. -
비장 세포 계수
- 튜브를 여러 번 위아래로 돌리면 세포를 다시 중단합니다. 적혈구(RBC) 용해 완충제(10m Tris-HCl pH 7.5, 155m NH 4Cl)의90 μL으로 10μL을 섭취하십시오. 실온(RT)에서 3분 동안 배양하고 900 μL의 콜드 PBS를 추가하여 반응을 종료합니다.
- 4°C에서 6분 동안 400 x g의 원심분리기와 상류체제거. 차가운 PBS의 100 μL로 다시 중단합니다. 세포의 10 μL을 10 μL에 넣고 0.4%의 1μL/v 트라이팬 블루를 넣고 혈류계로 셀 계수를 계산하기 위해 혼합물에서 10 μL을 꺼낸다.
- 계산: 셀을 일반 방법으로 계산합니다. 간단히 말해서, 혈종계의 두 대각선 모서리 사각형에서 셀 번호를 계산하고 각 코너 사각형에 대한 N1, N2를 얻습니다. 5mL 세포 현탁액의 세포 농도는 (N1+N2)/2 x 10 4/mL로 계산되어야 한다.
3. PD-1 및 CXCR5를 가진 다각형 Tfh 세포의 면역 염색
- 비오틴 항 CXCR5 항체로 염색.
- 튜브를 위아래로 돌려 세포 현탁액을 다시 중단합니다. FACS 튜브에 2 x 106 셀을 가져 와서 염색 버퍼 (PBS (1 % FBS, 1 mM EDTA)의 2 mL을 추가하십시오. 소용돌이 진동 장치에서 소용돌이에 의해 세척하십시오.
- 4°C에서 6분 동안 350 x g의 원심분리기. 액체를 부어 상체를 버리고 흡수 용지에 튜브 입을 두 번 찍어 두 번 떨어 지십시오.
- 튜브의 바닥을 눌러 잔류물 액체로 세포 펠릿을 풀어 놓습니다. 튜브 홀더에 튜브를 얼음에 넣습니다.
참고: 잔류물 액체의 부피는 약 25 μL입니다. - 각 튜브에 대해 항 마우스 CD16/CD32(Fc 수용체 차단제)의 0.2 μL을 추가합니다. 튜브 바닥을 부드럽게 눌러 소용돌이를 10 분 동안 얼음에 배양합니다.
참고: 각 튜브에 대해 5μL의 염색 버퍼로 희석하여 여러 시료에 대한 항체 혼합물을 준비합니다. 혼합물에 대한 조리법은 희석 (n/10+1) x 0.2 μL Fc 수용체 차단제 (n/10+1) x 5 μL 염색 버퍼로 준비하고 각 튜브에 5.2 μL 혼합물을 추가해야합니다. - 튜브 바닥을 눌러 각 튜브 및 소용돌이에 대한 염색 버퍼의 잔류물 30 μL에 비오틴 방지 마우스 CXCR5의 0.3 μL을 추가합니다.
참고: 3.1.4 단계에서 설명된 바와 같이 혼합물을 준비한다. - 30분 에 튜브를 눌러 부드럽게 다시 중단 세포와 함께 얼음에 1 시간 동안 배양.
참고: 30분 의 소용돌이는 더 나은 염색을 위해 세포 응집체를 피하는 것입니다. - 소용돌이 진동 장치에 2mL의 염색 버퍼와 소용돌이를 추가합니다. 4°C에서 6분 동안 350 x g의 원심분리기와 3.1.2 단계에서 설명된 바와 같이 상체를 폐기한다. 튜브를 눌러 소용돌이와 후속 염색을 위해 얼음에 배양.
- 다른 표면 마커로 염색.
- 3.1.4 단계에서 설명된 바와 같이 항체혼합물(표 1)을준비한다.
- 각 튜브에 항체 혼합물을 추가합니다. 튜브 바닥을 눌러 소용돌이를 30 분 동안 얼음에 배양합니다.
- 염색 버퍼2mL로 셀을 세척합니다. 4°C에서 6분 동안 350 x g의 원심분리기.
- 상체를 버리고 염색 버퍼의 400 μL을 추가합니다. 소용돌이 진동 장치에 튜브를 소용돌이및 흐름 세포 측정 분석까지 어두운에 튜브를 유지.
4. PR8 인플루엔자 바이러스 NP 특이적 Tfh 세포의 면역 염색
참고: NP 특이적 Tfh 세포를 염색하는 이 프로토콜은 이전 연구15,17에서나온 것이다.
- 스테인링을 위해 취한 세포 수가 유동 세포측정에 기록될 충분한 항원 특이적 세포를 위해 3 x 106이라는 점을 제외하면 3.1 단계에서 설명된 바와 같이 비오틴-CXCR5 염색을 수행한다.
- 3.1.7에서 튜브에 APC-컨쥬게이트-IAbNP311-325 MHC 클래스 II(NP311-325)의 0.3μL을 추가합니다. 3.1.4 단계와 같이 여러 샘플에 대한 혼합물 준비
참고: CD4와 항 CD4 항체 사이의 결합이 최적의 테트라머 염색을 방해할 수 있으므로 항 CD4 항체를 첨가하기 전에 테트라머를 염색하는 것이 중요합니다. - 튜브를 부드럽게 두드려 세포 혼합물을 다시 중단하고 RT에서 30 분 동안 어둠 속에서 배양하십시오.
참고: 증발을 줄이기 위해 튜브 입에 젖은 종이를 덮습니다. - 다른 표면마커(표 1)의혼합물을 추가하고 30분 동안 RT에서 인큐베이션을 계속합니다.
- 3.2.3 및 3.2.4 단계에 설명된 바와 같이 세포를 세척하고 다시 중단합니다.
5. 폴리클론 Tfh 세포에서 Bcl6의 면역 염색
- 표면마커(표 2)를3절에 설명한 바와 같이 염색을 수행하며, 마지막 세척은 PBS2mL로 마지막 세척을 제외하고는 버퍼염색 대신.
- 4°C에서 6분 동안 350 x g의 원심분리기. 체퍼넌트와 튜브 바닥을 부드럽게 눌러 셀 펠릿을 다시 중단합니다.
- 세포 고정을 위해 3.7% 포름알데히드 용액(PBS로 37% 포름알데히드에서 희석)의 300 μL을 튜브에 넣습니다. 소용돌이 진동 장치에 소용돌이와 20 분 RT에서 인큐베이션.
- 4°C에서 6분 동안 500 x g에서 세척 및 원심분리기를 위해 염색 버퍼 2mL을 추가합니다. 수퍼넌트와 튜브를 부드럽게 눌러 셀을 다시 중단합니다.
- 0.2% 트리톤-X 100의 300 μL을 추가하고 소용돌이 진동 장치의 소용돌이에 의해 세포를 다시 중단합니다. 15 분 동안 RT에서 인큐베이션.
- 세척을 위해 염색 버퍼 2mL를 추가합니다. 원심분리기는 500 x g에서 6분 동안 4°C에서. 초음파를 버리고 튜브 바닥을 부드럽게 눌러 셀을 다시 중단합니다.
- 각 튜브에 대해 PE-안티-Bcl6 항체의 1.5 μL을 추가합니다. 튜브 바닥을 부드럽게 두드려 혼합물을 다시 중단하고 30분마다 튜브를 부드럽게 두드리며 RT에서 2시간 동안 배양합니다.
참고: 혼합물 증발을 줄이기 위해 튜브 입에 젖은 종이를 덮습니다. - 튜브에 0.01% 트리톤-X 100으로 보충된 PBS 2mL을 추가합니다. 4°C에서 6분 동안 500 x g의 소용돌이 및 원심분리기.
- 5.8 단계로 세척을 반복합니다. 염색 버퍼400μL로 셀을 다시 중단합니다. 유동 세포 분석까지 얼음에 세포를 어둡게 유지합니다.
6. IL21의 세포 내 염색
- PMA (phorbol 12-myristate 13-아세테이트) 및 이오노마이신으로 세포를 자극합니다.
- 비장 세포 현탁액과 원심분리기에서 2 x 106 세포를 350 x g에서 4 °C에서 6 분 동안 복용하십시오. 완전한 T 세포 배지의 500 μL로 상체를 버리고 셀 펠릿을 다시 중단하십시오. 세포를 24웰 플레이트로 옮킨다.
- 완전한 중간18의 500 μL에 20 nmol PMA및 2 μmol 이오노마이신을 추가하고 위아래로 파이펫팅하여 철저히 혼합합니다.
- 24웰 플레이트에서 셀 서스펜션에 6.2 단계에서 제조된 용액을 추가하고 플레이트를 흔들어 혼합한다. PMA 및 이오노마이신을 세포에 첨가하지 않고 500 μL 완전한 T 세포 배지를 추가하여 자극되지 않은 제어를 설정합니다. CO2 인큐베이터에서 37°C에서 4시간 동안 배양합니다.
- 골지 장치를 매개하는 단백질 수송을 차단하기 위해 각 웰에 10 μmol BFA(메탄올로 용해된 브레펠딘 A)를 추가합니다. 플레이트를 셀 인큐베이터에 다시 넣고 2시간 동안 배양합니다.
- 셀 표면 마커 염색을 수행합니다.
- 부드럽게 위아래로 파이프팅하여 세포를 다시 중단하고 세포를 FACS 튜브로 옮기십시오. 튜브에 염색 버퍼 1mL을 넣고 원심분리기는 350 x g에서 4°C에서 6분 동안 추가합니다.
- 3.1.4 단계로 염색하는 Fc 수용체 차단제를 수행합니다.
- PBS의 2mL를 가진 세척 세포를 제외하고 3.2.1 ~ 3.2.3 단계에 설명된 바와 같이 세포 표면 마커염색(표 3)을수행한다.
- 4°C에서 6분 동안 350 x g의 원심분리기. 체퍼를 버리고 튜브 바닥을 눌러 셀을 다시 중단합니다.
- 라이브/데드 픽스블 아쿠아 데드 셀 염색 키트에서 시약0.2 μL을 추가하고 죽은 세포의 염색을 수행하기 위해 RT에서 어두운 튜브를 10 분 동안 배양합니다.
- 소용돌이 진동 장치의 튜브와 소용돌이에 PBS 2 mL을 추가합니다. 4°C에서 6분 동안 350 x g의 원심분리기와 상부포를 폐기하십시오.
- 5.3 및 5.4 단계에 설명된 대로 셀 고정을 수행합니다.
- 300μL의 염색 버퍼를 추가하여 세포를 다시 중단하고 튜브를 4°C 냉장고에 하룻밤 동안 보관합니다. 상류체를 제거하기 위해 4 °C에서 6 분 동안 500 x g의 원심 분리기.
참고: 이 단계는 생략되어 6.5단계 바로 다음 6.7단계를 계속 할 수 있습니다. - 소용돌이 진동 장치의 튜브와 소용돌이에 사포닌 버퍼 1mL(0.2%(w/v) 사포닌으로 보충된 스테인핑 버퍼를 추가합니다. 세포 투과화를 수행하기 위해 20 분 동안 얼음에 배양하십시오.
- 원심분리기는 500 x g에서 6분 동안 4°C에서 폐기하고 상류부를 폐기합니다.
- 각 튜브에 인간 Fc-IL21 수용체의 0.5 μL을 추가합니다. 염색 버퍼 대신 사포닌 버퍼로 항체를 희석시키는 것을 제외하고는 다발으로 항체 혼합물을 3.1.4 단계로 준비한다.
- 30분 에 세포를 다시 중단하기 위해 튜브 바닥을 부드럽게 두드리며 RT에서 1 시간 동안 배양하십시오.
- 세포와 원심분리기를 6분 동안 500xg에 세척하기 위해 사포닌 버퍼 2mL를 추가합니다. 상수 폐기하고 한 번 씻어 내십시오.
- 각 튜브에 APC 안티-휴먼 Ig(H+L)의 0.1 μL을 추가합니다. 스테인닝 버퍼 대신 사포닌 버퍼로 항체를 희석시키는 것을 제외하고는 여러 시료를 3.1.4 단계로 준비합니다.
- 30 분 동안 얼음에 샘플을 배양하고 6.11 단계로 씻어.
- 염색 버퍼400μL로 셀을 다시 중단합니다. 유동 세포측정 분석까지 샘플을 얼음에 어둡게 유지합니다.
7. GC B 및 플라즈마 세포 염색
- 세포를 취하고 3.1.1에서 3.1.4까지의 단계로 서 서 항-Fc 수용체 항체 염색을 수행합니다.
- 잠복 시간이 1h가 아닌 30분이라는 점을 제외하고 표면 마커염색(표 4)을3.1.5 내지 3.1.7단계로 수행한다.
- 염색 버퍼400μL로 셀을 다시 중단합니다. 유동 세포 측정 분석까지 얼음에 어두운 샘플을 유지합니다.
8. 혈액으로부터 혈청의 격리
- 14일째(d.p.i 14)는 안면 정맥에서 혈액을 수집하고 혈액 샘플을 하룻밤 동안 4°C 냉장고에 보관합니다.
참고: ABSL2 조건에서 혈액 수집을 수행하고이 단계에서 모든 절차는 일반 실험실에서 수행 될 수있다. - 4°C에서 10분 동안 400 x g의 혈액 원심 분리. 적혈구의 오염을 피하기 위해 200 μL 파이펫으로 혈청을 조심스럽게 분리합니다. 각 샘플에 대해 3 개의 튜브로 알리쿼트하고 -80 ° C에 저장합니다.
9. ELISA와 HA 특정 항체 티터의 분석
- 웰당 2 μg/mL HA 단백질 용액의 50 μL을 가진 ELISA 플레이트를 코팅하고 하룻밤 동안 4 °C 냉장고에 배양하십시오.
- PBS 희석 0.05% 트위엔(PBST)의 200 μL로 세 번 세척합니다. PBST 희석 5% 탈지 우유의 100 μL을 각 우물에 넣고 RT에서 2h로 배양하여 비특이적 결합을 차단합니다.
- 혈청 희석 및 인큐베이션: 희석 버퍼로서 PBS에서 3% BSA를 준비합니다. 희석 버퍼에 있는 혈청을 1:50, 1:150, 1:450, ...... 1:36450까지(3배 직렬 희석을 권장합니다). 각 우물에 희석 된 혈청 50 μL을 추가하고 하룻밤 동안 4 ° C 냉장고에 인큐베이션하십시오.
- 세럼을 버리고 PBST의 200 μL을 각 우물에 추가하여 한 번 우물을 빠르게 씻으십시오 (부드럽게 흔들어 버린 다음 폐기하십시오). 그런 다음 200 μL의 PBST로 셰이커에서 플레이트를 3회 3회 씩 천천히 씻어 5분 동안 천천히 씻습니다.
- 총 IgG, IgM, IgG1, IgG2b, IgG2b(1:5000, PBST로 희석) 및 RT에서 1h에 대한 인큐베이션에 특정 HRP 라벨이 부착된 이차 항체 100μL을 추가합니다. 9.4에 설명된 대로 PBST에 의해 플레이트를 세척합니다.
- 4°C 스토리지에서 동일한 볼륨의 버퍼 A 및 버퍼 B(TMB)를 꺼내서 사용하기 전에 RT에서 최소 30분 동안 워밍업합니다. A와 B를 혼합하고 각 우물에 100 μL의 TMB를 추가하고 부드럽게 흔들어 RT에서 10-30 분 동안 배양하십시오.
참고: 이것은 TMB 기판 시약 세트(BD,555214) 설명서에 대한 간략한 설명입니다. - 파이펫 100 μL 의 2M H2SO4각 우물에 반응종료. 계측기를 통해 OD450 값을 읽어보십시오.
- 데이터 분석: 배경 신호(빈 음의 OD450 값)를 빼서 최종 OD450 값을 가져옵니다. X 축의 희석 계수와 Y축의 OD450 값을 가진 각 시료의 항체 동종에 대응하는 곡선을 그립니다.
10. 히스토로지
- d.p.i 10에서 비장을 분리합니다. RT에서 1h에 대한 3.7 % 포름 알데히드 용액으로 고정하고 세 번 셰이커에 5 분 동안 PBS로 세척하십시오.
- PBS(10% 자당)에서 비장을 4°C에서 1시간 동안 탈수한 다음 비장이 15mL 튜브 의 바닥으로 가라앉을 때까지 부드럽게 흔들면서 PBS(30% 자당)에서 탈수합니다.
- 탈수된 비장을 꺼내 최적의 절삭 온도 화합물에 포함시키고 냉동 저온을 합니다.
- -20°C에서 아세톤을 미리 식힙니다. 10 분 동안 사전 냉각 아세톤으로 조직 섹션을 배양. PBS로 티슈를 세 번 씻으시면 됩니다.
- PBS를 함유하는 조직 섹션을 20분 동안 0.2% 트리톤 X-100으로 충파하고 PBS로 3회 세척합니다.
- 10% 정상 염소 혈청(blocking buffer)을 포함하는 PBS를 통해 비특이적 결합을 차단하여 RT에서 1h로 세척하고 PBS로 조직 섹션을 한 번 세척한다.
- ST렙타비딘/비오틴 블로킹 키트로 비특이적 결합을 차단합니다.
참고: 이 단계에서 는 샘플을 건조시키지 마십시오. - 1차 항체염색: 블로킹 버퍼 희석 비오틴-PNA(25 μg/mL) 및 쥐 항마우스 IgD(2.5 μg/mL)를 조직 섹션에 조심스럽게 넣습니다. 하룻밤 동안 4°C 냉동실에서 젖은 챔버의 조직 섹션을 배양한다.
- PBST를 한 번 빠르게 세척합니다. PBST의 조직 섹션을 5분 동안 천천히 흔들어 빠르게 씻으시면 됩니다. 세 번 세척을 반복합니다.
- 희석 알렉사 플루오 488-스트렙타비딘 (1:500) 및 알렉사 플루어 555 염소 안티 쥐 IgG (1:500) 차단 버퍼와 항체를 조심스럽게 조직 섹션에 추가
- 1 시간 동안 RT에서 인큐베이션.
- 조직 섹션을 10.8 단계로 세척하고 연장 용액으로 조심스럽게 장착하십시오. 커버립으로 조직을 조심스럽게 덮고 공초점 분석이 될 때까지 4°C에서 어둡게 유지하십시오.
- 영역 크기당 GC 숫자를 계산하여 GC 반응의 크기를 분석합니다.
결과
인플루엔자 바이러스 감염에서 마우스 이환율의 특성화
인플루엔자 바이러스 감염 후, 마우스는 질병으로 인해 덜 활동적이고 식욕 부진이며, 이는 심각한 체중 감소에 의해 반영되며, 마우스 이환율을 모니터링하는 데 일반적으로 사용되는증상(19). 도 1에도시된 바와 같이, PR8 바이러스 감염 마우스는 6일째에 체중 감량을 시작하여 8일째 가장 높은 손실 수준에 도달하고 10일째에 초기 수준으로 돌아왔다. 예상대로, 체중 감소는 PBS 처리된 대조군 마우스에서 의 기간 내내 모두 관찰되지 않았다. 생체 내 증상의 경우, 바이러스 감염은 배수 림프절, mLN에서 강력한 림프구 확장으로 이어집니다. 따라서, MLNs의 크기가 훨씬 큰 크기는 대조군마우스(도 1b)보다PR8 바이러스감염 마우스에서 관찰되었다. 종합하면, 이 마우스는 모두 예상되는 현상을 보여주었고 후속 Tfh 관련 면역 반응 연구 결과를 위해 자격을 얻었습니다.
Tfh 분화 및 기능 관련 분자의 검출
Tfh 분화를 분석하기 위해, 마우스는 혈류 세포측정 분석을 위해 감염 및 mLN 또는 비장 후에 5, 7, 10 및 14일에 희생되었다. 도 2a 및 도 2b는 TFh가 PD-1하이 CXCR5하이 셀로 게이트되고 비-Tfh를 PD-1 저CXCR5저세포로 보여 준다. 이 게이팅 전략으로 인플루엔자 바이러스 감염 중 Tfh 분화의 운동학이 분석되었습니다. 도 2c에 도시된 바와 같이, Tfh 분화는 5일째에 초기화되어 10일째에 정점을 찍었습니다. 그래서 우리는 추가 분석을 위해 10 일의 샘플을 취했습니다. 도 3a에도시된 바와 같이, 견고한 Tfh 세포 분화는 대조군 마우스와 비교하여 인플루엔자 바이러스 감염 마우스에서 유도되었다. 인플루엔자 바이러스 특이적 Tfh 세포를 분석하기 위해, 불소로 표지된 IAbNP311-325 MHC 급 II 테트라머(NP311-325)를폴리클로날 Tfh 세포 염색패널(표 1)에첨가하였다. 인플루엔자 바이러스 감염 마우스로부터의 mLN 및 비장 모두에서 NP311-325-특이적CD4+ T 세포가 현저하게 유도되었고 NP311-325-특이적Tfh 세포는 PD-1 및 CXCR5를 분석에 추가하여 분석될 수있었다(도 3e). Tfh 분화에서 Bcl6의 필수적인 역할 때문에 Bcl6+CXCR5+ 세포는 Tfh 인구를 나타낼 수도 있습니다. 일관되게, 이 전략으로 확인된 Tfh 세포는 또한 강력하게 유도하였다(도 3b). 우리는 Tfh 및 비 Tfh 세포에서 Bcl6의 발현을 추가로 분석했습니다. 도 3c에도시된 바와 같이, Tfh 세포에서 보다 더 높은 Bcl6 발현은 성공적인 Bcl6 염색을 나타낸다. 유사한 전략으로, ICOS, 또 다른 Tfh 관련 분자도 분석되었다(그림 3d). B 세포에 대한 도움을 제공하는 Tfh 세포의 특수한 역할로 인해, TFh 세포에 의해 주로 분비되고 B 세포 생존 및 증식을 직접 조절하는 것으로 입증된 IL21의 발현분석으로 인해 Tfh 세포가 어느 정도 기능임을 드러낼 수 있다. 도 3f에도시된 바와 같이, IL21의 세포내 염색은 PR8 감염이 게이팅 대조군으로서 자극되지 않은 세포와 함께 이 사이토카인의 현저히 높은 생산을 유도한 것으로 나타났습니다. 종합하면, 이 에세이는 Tfh 분화의 기본 정보를 반영하고 B 세포 도움말 능력에 대한 통찰력을 제공할 수 있었습니다.
혈청에서 GC B 및 혈장 세포 개발 및 인플루엔자 바이러스 특이적 항체의 검출
Tfh 세포의 주요 기능은 항체 클래스 스위칭 및 친화성 성숙이 발생하는 GCs에서 B 세포 도움을 제공하는 것입니다. 따라서 GC B 개발은 Tfh 세포의 분화 및 기능을 간접적으로 반영할 수 있습니다. GC B 세포는 B220+PNA+Fas+ 세포(그림 2d)로게이트 될 수 있습니다. 이러한 게이팅 전략을 통해 GC B 세포 반응의 역학을 분석하여 GC B 반응이 10일째에 시작되어 14일째(그림 2e)에서계속 증가하는 것으로 나타났습니다. PR8 바이러스 감염 및 대조마우스 간의 비교는 견고한 GC B가 PRB 바이러스 감염 마우스에서 유도된 Tfh 분화와 일치하는 인플루엔자 바이러스감염(도 4a)에서모두 mLN 및 비장에서 유도되었다는 것을 보여주었다. 또한, IgD 및 PNA를 통한 면역형광 염색은 PR8 바이러스 감염마우스(도 4d)에서유도된 GC 반응(green 영역)을 나타내는 가시화된 이미지를 제공한다. IgD낮은CD138+세포(도 2d)로확인된 혈장 세포는 PR8 바이러스 감염 마우스(도 4b)에서도생성되었다. 이전 연구는 IFNƳ 및 IL21 바이러스 감염에서 Th1 과 Tfh 세포 모두에서 분비 될 수 있음을 확인하고 IgG2와 IgG1 클래스 스위칭을 유도, 각각20. 도 4c는 HA 특이적 IgM, 총 IgG, IgG1, IgG2b 및 IgG2C의 ELISA 분석에 의한 인플루엔자 바이러스 특이적 항체의 생성을 묘사한다. 함께, 이러한 모든 소사는 인플루엔자 바이러스 감염에서 Tfh 관련 B 세포 반응을 반영한다.

그림 1: 마우스 이환율의 특성화. 8주 된 수컷 마우스는 비강 내 접종에 의해 PR8 인플루엔자 바이러스의 40 PFU에 감염되었다. 마우스는 10일 동안 매일계량하였다(a)및 mLN은 d.p.i 10(b)에 격리되었다. (a)의오차 막대는 그룹당 평균 ± SD. n = 4 마우스를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
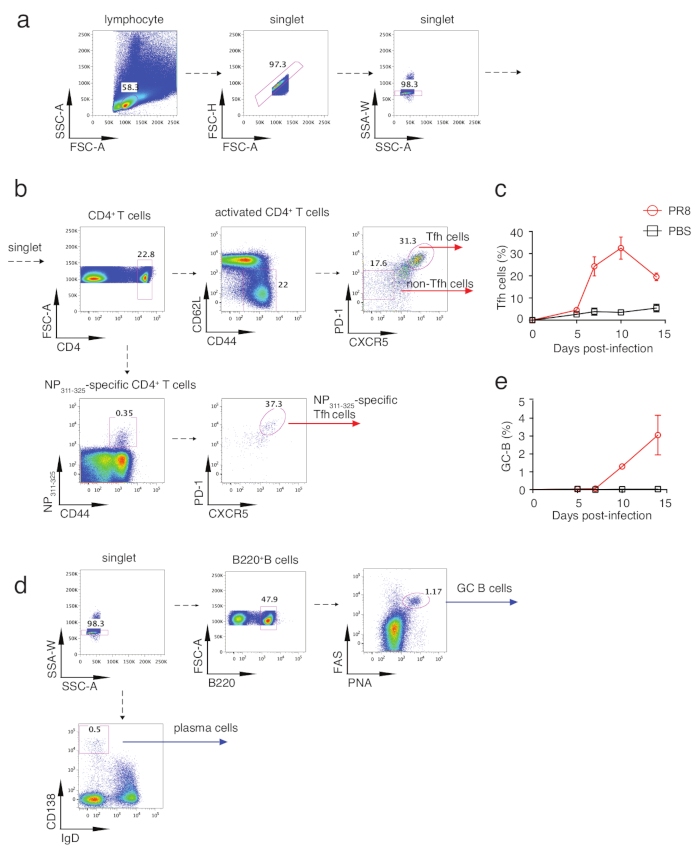
그림 2: Tfh 세포 및 GC B 세포의 게이팅 전략. (a)림프구는 FSC-A 및 SSC-A에 의해 정의되고, 세포 단조는 FSC-A, FSC-H 및 SSC-A, SSC-W로 게이트된다. (b)CD4+ T 셀에서 게이팅 후, 표면 마커 CD62L 및 CD44는 순진한 T 세포(CD44loCD62Lhi)및 활성화된 T 셀(CD44hiCD62Llo)을구별하는 데 사용된다. 다환 Tfh 세포는 PD-1hi CXCR5hi population로 활성화된 T 세포로부터 게이트될 수 있으며, 반대로, 비-Tfh 세포로서 PD-1저CXCR5낮은종구이다. PR8 바이러스 별 Tfh 세포는 CD4+CD44+ NP311-325 테트라머+PD-1hi CXCR5hi 세포로 정의됩니다. (c,e) B220+ 세포(e)에서 활성화된 세포(c) 및 GC B주파수에서 Tfh 주파수의 역학. (d)GC B 세포는 B220+ PNA+FAS+ 세포로 게이트되고, 혈장 세포는 IgD-CD138+ 세포이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
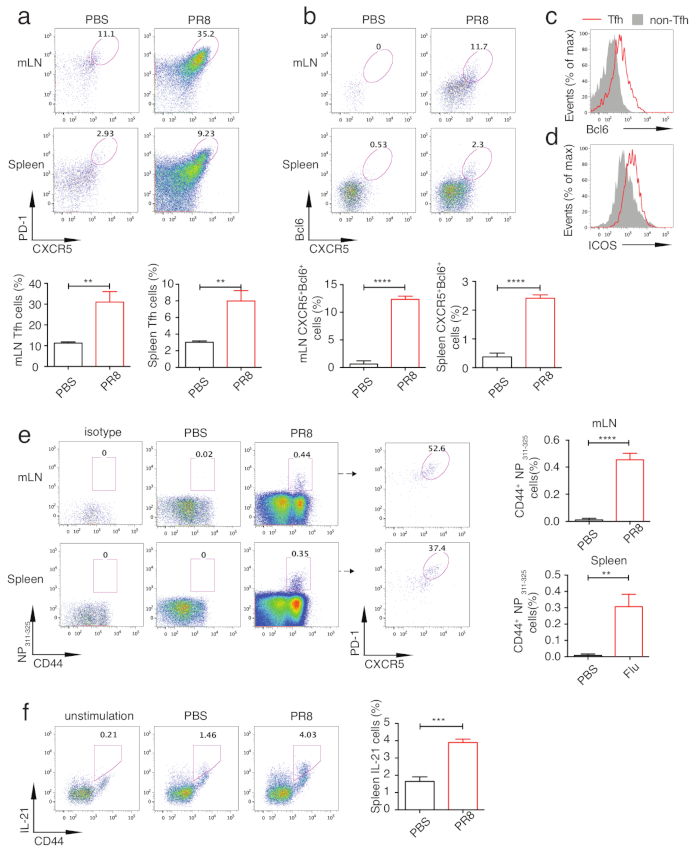
그림 3: PR8 바이러스 감염 마우스에서 Tfh 분화의 분석. 마우스는 d.p.i 10에 희생되었고 mLN 및 비장은 Tfh 분화 분석을 위해 격리되었다. (a)PR8 바이러스 감염 마우스 및 PBS 처리 마우스(상부 패널)에서 mLN 및 비장에서 의태백분율. Tfh 세포의 통계 (낮은 패널). (b)CD4+CD44하이 T 세포(상부 패널)에서 Bcl6의 세포 내 염색. Bcl6+CXCR5+ 셀 (낮은 패널)의 통계. (c)Bcl6 및(d)TFh(라인-레드) 및 비-Tfh 세포(솔리드 그레이)에서 ICOS 발현. (e)NP311-325-특이CD4+T세포의 개팅은 PR8 바이러스 감염 및 PBS 처리 마우스(좌패널)의 mLN 및 비장에서 특이적CD4+ T 세포이다. mLN 및 비장 (중간 패널)에서 PR8 바이러스 특정 Tfh 세포의 백분율. "아이소타입"은 무관한 테트라머 컨트롤로 염색을 나타냅니다. NP311-325-특정CD4+ T 셀(오른쪽 패널)의 통계. (f)비장 CD4+ PR8 바이러스 감염 및 PBS 처리 마우스로부터의 IL-21의 세포 내 염색, 대조군으로 표시된 자극(왼쪽). IL-21 염색의 통계 (오른쪽). ** P < 0.01, ***P<, 0.001 및 **** P & 0.0001 (두 꼬리 학생의 t-테스트). 오류 막대는 그룹당 평균 ± SD. n = 3 마우스를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: PR8 바이러스 감염 마우스에서 GC B 세포 관련 반응의 분석. 마우스는 d.p.i 10에 희생되었고 mLN및 비장은 분석을 위해 격리되었다. (a)GC B 셀(상부 패널)의 백분율. GC B 셀의 통계(하부 패널). (b)혈장 세포의 백분율(상부 패널). 플라즈마 세포의 통계 (낮은 패널). (c)PR8 바이러스 HA 특이적 IgG, IgM, IgG1, IgG2b 및 IgG2c의 정량화는 PR8 바이러스 감염 마우스 및 PBS 처리 마우스의 혈청(d.p.i 14)에서 정량화한다. (d)PR8 바이러스 감염 마우스 및 PBS 처리 마우스 (d.p.i 10)의 비장 샘플에서 B 세포 여포 (IgD+,빨간색) 및 GCs (PNA+,녹색)의 공초점 현미경 검사법. *P&0.5, **P< 0.01, 그리고 ***P< 0.001(두 꼬리 학생의 t-테스트). 오류 막대는 그룹당 평균 ± SD. n = 3 마우스를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 표면 마커 | 플루오로크롬 | 클론 | 샘플당 볼륨(ul) |
| CD4 | 퍼컨스-에플루어 710 | GK1.5 | 0.2 |
| CD44 | eVolve 605 | IM7 | 0.2 |
| CD62L | FITC | 멜-14 | 0.2 |
| ICOS | BV421 | 7E.17G9 | 0.2 |
| PD1 | PE/Cy7 | 29F.1A12 | 0.3 |
| 스트렙타비딘 | PE | 0.2 |
표 1: 표면 마커(CXCR5 제외) 염색 Tfh 세포를 위한 항체 패널(PD-1hiCXCR5hi).
| 표면 마커 | 플루오로크롬 | 클론 | 샘플당 볼륨(ul) |
| CD4 | 퍼컨스-에플루어 710 | GK1.5 | 0.2 |
| CD44 | FITC | IM7 | 0.2 |
| PD1 | PE/Cy7 | 29F.1A12 | 0.3 |
| 스트렙타비딘 | BV421 | 0.5 |
표 2: Tfh 세포에서 Bcl6염색을 위한 표면 마커 항체(CXCR5 제외) 패널.
| 표면 마커 | 플루오로크롬 | 클론 | 샘플당 볼륨(ul) |
| CD4 | 퍼컨스-에플루어 710 | GK1.5 | 0.2 |
| CD44 | FITC | IM7 | 0.2 |
표 3: IL21의 세포 내 염색을 위한 표면 마커 항체 패널.
| 표면 마커 | 플루오로크롬 | 클론 | 샘플당 볼륨(ul) |
| B220 | APC | RA3-6B2 | 0.2 |
| IgD | eFluor 450 | 11-26c | 0.2 |
| CD95 | PE/Cy7 | Jo2 | 0.3 |
| PNA | FITC | 0.3 | |
| CD138 | PE | 281-2 | 0.2 |
표 4: GC B 및 플라즈마 B 세포를 염색하기 위한 표면 마커 항체 패널.
토론
높은 친화성 항체를 생성하기 위한 B 세포 도움을 제공하는 전문화한 역할 때문에 Tfh 세포는 백신 설계를 위한 새로운 전략을 제공하기 위하여 분화 및 조작의 기계장치에서 광범위하게 공부되었습니다. 인플루엔자 바이러스 감염은 활발한 Tfh 및 GC B 세포 반응을 유도하여 이 연구 분야에 적합한 모델이 됩니다. 본 논문에서, 우리는 비강 내 접종에 의한 인플루엔자 바이러스 감염의 프로토콜을 기술했습니다, 유동 세포측정에 의한 Tfh 관련 반응의 평가, 면역 형광 및 ELISA. 이 assays는 Tfh 분화, GC B 발달 및 인플루엔자 바이러스 특정 항체의 검출을 용이하게 하고 연구원이 면역 반응에 있는 새로운 중요한 분자를 탐구하고 확인하는 것을 도울 것입니다.
인플루엔자 바이러스에 감염된 마우스 모형을 가진 연구 결과에서는, 체중 감소는 마우스 이환율의 일반적으로 이용된 표시기입니다. 인플루엔자 바이러스 감염 마우스에서 예상되는 체중 변화 운동학은 마우스에서 유도된 적절한 면역 반응을 반영하는 도 1a에기재된 바와 같이 이다. 그러나, 이상한 케이스는 마우스가 그들의 무게를 분실하거나 관측 기간을 통해 전부 어떤 체중 감소를 보여주지 않는, 정기적으로 생길 것입니다. 우리의 경험에 따르면, 이 마우스는 주로 비정상적인 더 낮거나 더 높은 면역 반응을 견딜 것, 따라서 실험 결과 방해. 이러한 변이를 피하기 위해 실험에 사용되는 마우스는 바이러스에 유사한 반응 능력을 보장하기 위해 섹스와 연령일치여야 합니다. 각 마우스에 대한 일관된 바이러스 티터는 또한 중요한21입니다. 이 프로토콜에 사용되는 바이러스 티터는 40 PFU입니다. 그러나, 각 실험실에서 적절한 체중 변화 운동학을 유도하는 바이러스 티터는 실험에 사용되는 바이러스 티터 평가 절차 및 마우스 균주의 불일치로 인해 변수가 될 수 있다. 그래서 우리는 면역 반응 관련 연구 결과 전에 감염을 위한 바이러스 titer의 적정이 필요하다는 것을 조언합니다.
이 프로토콜에서, 우리는 자주 사용되는 마커 PD-1, CXCR5 및 필수 전사 인자 Bcl6를 가진 Tfh 세포를 확인했습니다. PD-1하이CXCR5hi 및 BCl6+CXCR5+ 세포가 Tfh 세포로 표시 될 수 있지만, 그들은 다른 인구를 나타내고 모든 PD-1 하이 CXCR5하이셀이 Bcl6+ 모든 Bcl6+CXCR5 hi cells가 아니라는 사실에 근거하여 전구체 - 자손 관계가 없습니다. 이러한 표현형은 Tfh세포(22)에서Bcl6 발현의 이질성에 의해 설명될 수 있다. TFh 분화와 마이그레이션 모두에 대한 중요한 분자인 ICOS도 Tfh 분화 분석에 포함되어야 합니다. 또한, OX40 및 CD40L과 같은 다른 기능 관련 공동 자극 분자도 이 프로토콜에 포함되지 는 않지만 발현 수준에 대해 검출되어야 한다. IL21과 IL4는 모두 IgG1 클래스 스위칭을 유도하는 역할을 하는 Tfh 분비 사이토카인입니다. IL21 발현검출 프로토콜은 이 백서에 설명되어 있다. 그러나 Tfh 세포에서 IL4의 검출이 어렵기 때문에 IL4-GFP 기자 마우스는 이전연구(23)에서사용되었다. 이 프로토콜에서, 우리는 또한 NP311-325-특정Tfh 세포를 검출하기 위하여 불소 크롬 표지NP 테트라머를 이용했습니다. 그럼에도 불구하고, NP311-325-특이적Tfh 세포의 양에 있는 한계는 추가 분석에서 어려움을 부여합니다. 따라서, TS-1 마우스로부터 분리될 수 있는 인플루엔자 헤마글루티닌 특이적 TCR 형질화(Tg) CD4 +(TS-1) T 세포의 입양 전달 실험은 이문제점(24)을해결하는 대안전략이다.
여기서 우리는 GC B를 B220+PNA+Fas+ 유동 세포 분석 염색 세포로 확인했습니다. GC B를 GL7하이파스히 셀로 정의하는 대체 마커 조합 전략도 다른논문(14,16)에도사용된다. 우리는 또한 면역 형광을 사용하여 GCs를 안티 IgD 및 PNA의 조합으로 시각화합니다. 본명 CD3 항체를 첨가하면 Tfh 세포를 시각화하는 데 도움이 될 수 있으므로 이들 두 세포유형(10)간의상호작용에 대한 연구가 가능하게 한다.
Tfh 세포의 분화는 다단계 및 다인성 과정이며, Tfh 분화에서 보다 상세한 메커니즘을 해명하기 위해서는 여러 시간 지점에서 다른 중요한 분자의 추가 분석이 필요하다. 또한, 여기서 검출된 파라미터는 다른모델(18)에서도일반적으로 사용된다. 따라서 인플루엔자 바이러스 감염 외에도 여기에 설명된 프로토콜, 특히 면역 염색 부위는 다른 모델과 Tfh 관련 연구에서 지침을 제공할 수도 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 흐름 세포측정 시설, ABSL2 시설 및 상하이 의 SPF 동물 시설의 직원들이 기술적 인 도움과 조언을 주셔서 감사합니다. 이 작품은 중국 과학 아카데미 (XDB29030103), 중국 국립 핵심 R & D 프로그램 (2016YFA0502202), 중국 국립 자연 과학 재단 (31570886)의 전략적 우선 순위 연구 프로그램에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Immunostaining of Tfh cells, NP-specific Tfh cells and Bcl-6 | |||
| 37% formaldehyde | Sigma | F1635 | |
| Anti-CD16/32 mouse | Thermo Fisher Scientific | 14-0161-86 | |
| APC-conjugated-IAbNP311-325 MHC class II tetramer | NIH | ||
| Bcl-6 PE | Biolegend | 358504 | clone:7D1 |
| Biotin-CXCR5 | Thermo Fisher Scientific | 13-7185-82 | clone: SPRCL5 |
| CD4 Percp-eFluor 710 | Thermo Fisher Scientific | 46-0041-82 | clone:GK1.5 |
| CD44 eVolve 605 | Thermo Fisher Scientifi | 83-0441-42 | clone:IM7 |
| CD44 FITC | Thermo Fisher Scientifi | 11-0441-82 | clone:IM7 |
| CD62L FITC | BD Pharmingen | 553150 | clone:MEL-14 |
| ICOS BV421 | Biolegend | 564070 | clone:7E.17G9 |
| PD1 PE/Cy7 | Biolegend | 135216 | clone:29F.1A12 |
| Streptavidin BV421 | BD Pharmingen | 563259 | |
| Streptavidin PE | BD Pharmingen | 554081 | |
| Intracelluar staining of IL21 | |||
| 37% formaldehyde | Sigma | F1635 | |
| anti-human IgG | Jackson ImmunoResearch Laboratories | 109-605-098 | |
| Brefeldin A | Sigma | B6542 | |
| human FCc IL-21 receptor | R&D System | ||
| ionomycin | Sigma | I0634 | |
| Live/Dead Fixable Aqua Dead Cell staining kit | Thermo Fisher Scientific | L34966 | |
| PMA | Sigma | P1585 | |
| Saponin | MP | 102855 | |
| GC B and plasma cells staining | |||
| B220 APC | Thermo Fisher Scientific | 17-0452-81 | clone:RA3-6B2 |
| CD138 PE | BD Pharmingen | 561070 | clone:281-2 |
| CD95 (FAS) PE/Cy7 | BD Pharmingen | 557653 | clone:Jo2 |
| IgD eFluor 450 | Thermo Fisher Scientific | 48-5993-82 | clone:11-26c |
| PNA FITC | Sigma | L7381 | |
| Assay of HA-specific antibody titer with ELISA | |||
| PR8-HA | Sino Biological | 11684-V08H | |
| BSA | SSBC | ||
| Goat anti mouse Ig (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgM (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgG1 (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgG2b (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| Goat anti mouse IgG2c (SBA Clonotyping System-HRP) | SouthernBiotech | 5300-05 | |
| TMB Substrate Reagent Set | BD Pharmingen | 555214 | |
| Histology | |||
| Alexa Fluor 555-Goat-anti rat IgG | Life Technology | A21434 | |
| anti-mouse IgD | Biolegend | 405702 | |
| biotinylated PNA | Vector laboratories | B-1075 | |
| dilute Alexa Fluor 488-streptavidin | Life Technology | S11223 | |
| normal goat serum | SouthernBiotech | 0060-01 | |
| Pro-long gold antifade reagent | Thermo Fisher Scientific | P3630 | |
| STREPTAVIDIN/BIOTIN blocking kit | Vector laboratories | SP-2002 |
참고문헌
- Johnston, R. J., et al. Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science. 325 (5943), 1006-1010 (2009).
- Nurieva, R. I., et al. Bcl6 mediates the development of T follicular helper cells. Science. 325 (5943), 1001-1005 (2009).
- Yu, D., et al. The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment. Immunity. 31 (3), 457-468 (2009).
- Pedros, C., et al. A TRAF-like motif of the inducible costimulator ICOS controls development of germinal center TFH cells via the kinase TBK1. Nature Immunology. 17 (7), 825-833 (2016).
- Xu, H., et al. Follicular T-helper cell recruitment governed by bystander B cells and ICOS-driven motility. Nature. 496 (7446), 523-527 (2013).
- Lee, S. K., et al. B cell priming for extrafollicular antibody responses requires Bcl-6 expression by T cells. The Journal of Experimental Medicine. 208 (7), 1377-1388 (2011).
- Zotos, D., et al. IL-21 regulates germinal center B cell differentiation and proliferation through a B cell-intrinsic mechanism. The Journal of Experimental Medicine. 207 (2), 365-378 (2010).
- Vogelzang, A., et al. A fundamental role for interleukin-21 in the generation of T follicular helper cells. Immunity. 29 (1), 127-137 (2008).
- Ansel, K. M., et al. A chemokine-driven positive feedback loop organizes lymphoid follicles. Nature. 406 (6793), 309-314 (2000).
- Shi, J., et al. PD-1 Controls Follicular T Helper Cell Positioning and Function. Immunity. 49 (2), 264-274 (2018).
- Methot, S. P., Di Noia, J. M. Molecular Mechanisms of Somatic Hypermutation and Class Switch Recombination. Advanced ImmunoChemical. 133, 37-87 (2017).
- Crotty, S. Follicular helper CD4 T cells (TFH). Annual Review of Immunology. 29, 621-663 (2011).
- Calame, K. L. Plasma cells: finding new light at the end of B cell development. Nature Immunology. 2 (12), 1103-1108 (2001).
- Yoo, J. K., Fish, E. N., Braciale, T. J. LAPCs promote follicular helper T cell differentiation of Ag-primed CD4+ T cells during respiratory virus infection. The Journal of Experimental Medicine. 209 (10), 1853-1867 (2012).
- Leon, B., Bradley, J. E., Lund, F. E., Randall, T. D., Ballesteros-Tato, A. FoxP3+ regulatory T cells promote influenza-specific Tfh responses by controlling IL-2 availability. Nature Communications. 5, 3495 (2014).
- He, L., et al. Extracellular matrix protein 1 promotes follicular helper T cell differentiation and antibody production. Proceedings of the National Academy of Sciences of the United States of America. 115 (34), 8621-8626 (2018).
- León, B., et al. Regulation of TH2 development by CXCR5+ dendritic cells and lymphotoxin-expressing B cells. Nature Immunology. 13 (7), 681-690 (2012).
- Wang, H., et al. The transcription factor Foxp1 is a critical negative regulator of the differentiation of follicular helper T cells. Nature Immunology. 15 (7), 667-675 (2014).
- Bouvier, N. M., Lowen, A. C. Animal Models for Influenza Virus Pathogenesis and Transmission. Viruses. 2 (8), 1530-1563 (2010).
- Miyauchi, K., et al. Protective neutralizing influenza antibody response in the absence of T follicular helper cells. Nature Immunology. 17 (12), 1447-1458 (2016).
- Rodriguez, L., Nogales, A., Martinez-Sobrido, L. Influenza A Virus Studies in a Mouse Model of Infection. Journal of Visualized Experiments. (127), (2017).
- Kitano, M., et al. Bcl6 protein expression shapes pre-germinal center B cell dynamics and follicular helper T cell heterogeneity. Immunity. 34 (6), 961-972 (2011).
- Yusuf, I., et al. Germinal center T follicular helper cell IL-4 production is dependent on signaling lymphocytic activation molecule receptor (CD150). The Journal of Immunology. 185 (1), 190-202 (2010).
- Sun, J., Dodd, H., Moser, E. K., Sharma, R., Braciale, T. J. CD4+ T cell help and innate-derived IL-27 induce Blimp-1-dependent IL-10 production by antiviral CTLs. Nature Immunology. 12 (4), 327-334 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유