Method Article
Рассечение, культура и анализ первичных черепных нейронных клеток от мыши для изучения нейронных клеток Креста Delamination и миграции
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает вскрытие и культуру черепных нейронных клеток гребня из моделей мыши, в первую очередь для изучения миграции клеток. Мы описываем используемые методы живой визуализации и анализ изменений скорости и формы клеток.
Аннотация
За последние несколько десятилетий наблюдается увеличение доступности генетически модифицированных моделей мыши, используемых для имитации патологий человека. Тем не менее, способность изучать движения клеток и дифференциации in vivo по-прежнему очень трудно. Нейрокристопатии, или расстройства нейронной линии гребня, особенно сложно изучать из-за отсутствия доступности ключевых эмбриональных этапов и трудности в отделении из нервного гребня мезенхим от соседних мезодермальных мезенхим. Здесь мы намеревались создать четко определенный, рутинный протокол для культуры первичных черепных нейронных клеток гребня. В нашем подходе мы вскрываем границу нейронной пластины мыши на начальном этапе индукции нервного гребня. Область границы нервной пластины эксплуатирована и культивируется. Нейронные клетки гребня образуются в эпителиальном листе, окружающем границу нервной пластины, и к 24 ч после эксплантирования, начинают разделиваться, подвергаясь эпителиально-мезенхимному переходу (EMT), чтобы стать полностью подвижной нейронной клетки гребня. Благодаря нашему двумерному подходу к культивирования, различные популяции тканей (нейронная пластина против премьера и мигрирующих нейронных гребня) могут быть легко различимы. Используя живые подходы к визуализации, мы можем определить изменения в индукции нервного гребня, EMT и миграционного поведения. Сочетание этой техники с генетическими мутантами будет очень мощным подходом для понимания нормальной и патологической нейронной биологии клеток гребня.
Введение
Нейронный гребень (NC) линия является переходной, многопотентной и мигрирующей популяции клеток, которая появляется исключительно у позвоночных во время раннего эмбрионального развития1,2. Нейронные производные гребня чрезвычайно разнообразны, и включают глию, гладкую мышцу, меланоциты, нейроны и черепно-мозговые кости и хрящи3,4. Поскольку нервный гребень способствует функционированию многих систем органов, эта линия имеет важное значение для эмбриогенеза человека. Аномальное развитие NC вовлечено в широкий спектр наиболее распространенных врожденных дефектов человека (т.е. расщелина губы и неба)5, а также расстройства, такие как болезнь Гиршпрунга (HSCR), синдром Варченсбурга (WS), синдром CHARGE и синдром Уильямса6 ,7,8,9.
Разработка NC была исследована в ряде немлекопитающих модельных систем, включая модели Xenopus,chick и zebrafish. У млекопитающих, работа в моделях мыши определила некоторые из ключевых генетических событий, лежащих в основе развития нервного гребня; однако, было труднее следовать клеточной биологии нейронной миграции гребня, из-за недоступности эмбриона мыши (рассмотрено в другом месте10,11). Кроме того, в то время как исследования в цыпленок, Xenopus и зебрафиш создали ген регулятивной сети для NC, потеря функциональных исследований в этих животных моделей иногда не проявляют сопоставимый фенотип в мыши. Например, в Xenopus, зебрафиш и цыпленок, неканонические Wnt сигнализации является одним из клеточных механизмов, что позволяет NC приобрести свою миграционную мощность12,13,14,15 . Однако, в мыши, потеря неканонического Сигналирования Wnt, кажется, не влияет на миграцию16. Поскольку миграцию in vivo NC было трудно отследить в течение длительных периодов времени в мыши, неясно, отражают ли эти видовые различия различные способы миграции или различия в молекулярной регуляции.
Как уже отмечалось, NC исследования в мыши были очень сложными, потому что бывшая утробная культура эмбрионов является трудоемким. Кроме того, NC постоянно находится в тесном контакте с соседними тканями, такими как мезодерм и невректодерм. Недавнее использование нейронных гребня конкретных Cre драйверов или экзогенных красителей позволило нам флуоресцентно этикетки мигрирующих NC; однако эти подходы по-прежнему ограничены. Несмотря на многочисленные отчеты, описывающие различные методы визуализации миграции NC17,18, было трудно решить эти методы в простой и обычной процедуры.
Ясно, что существует необходимость в методах, которые позволяют обработки и характеристики млекопитающих NC. Мы сосредоточили наши усилия на мыши черепных NC, как это основная модель для изучения человеческого черепно-мозгового развития и нейрокристопатий. Мы уточнили наш подход на основе нескольких интересных докладов, описывающих первичную культуру NC-клеток19,20,21. Здесь мы подробно описываем оптимальные методы культуры для экспонирования первичных клеток NC. Мы демонстрируем метод визуализации живых клеток и оптимальное использование различных матриц, чтобы покрыть культурные пластины. Наш протокол описывает, как захватить миграцию живых клеток NC с помощью перевернутого микроскопа, который предназначен в качестве ориентира для использования с другими микроскопами, а также подробное резюме наших клеточных анализов.
Ожидаемым результатом экспланта должно быть красиво выложенное распределение клеток, которые четко различаются под микроскопом, где можно увидеть три различные популяции клеток, которые представляют (i) нейронную пластину, (ii) премьера, и ,iii) мигрирующих нервных гребня клеток. Мы демонстрируем, как анализировать поведение клеток на границе предварительной популяции клеток во время эпителино-мезенхимального перехода. Мы также сосредоточили наши усилия на изучении полностью мигрирующих клеток для скорости клеток, расстояния и морфологии клеток.
протокол
Вся работа на животных прошла этичное одобрение Королевского колледжа Лондона процесс этического обзора и была выполнена в соответствии с Uk Home Office Project License P8D5E2773 (KJL).
1. Подготовка реагентов
- Подготовьте общие решения и инструменты, включая стерильный фосфатный буфер солей (PBS), 70% этанола, инструменты вскрытия (щипцы и диссекционные лезвия или стерильные иглы), пластиковые пластины или стеклянные слайды, покрытые коммерчески доступной внеклеточной матрицей ( ECM) на основе гидрогеля или фибронектина (см. Таблицу Материалов),и нервных носителей гребня (см. ниже).
- Подготовка нейронного гребня базальной среды с использованием Dulbecco в модифицированных Eagle в среде (DMEM, 4500 мг / л глюкозы), 15% плода крупного рогатого скота сыворотки (FBS), 0,1 мм минимального незаменимого несущественных аминокислот (MEM NEAA 100X), 1 мМ натрия пирувате, 55 мкм единицы/мЛ пенициллина, 100 единиц/мл стрептомицина и 2 мМ L-глютамина.
- Состояние средств массовой информации ночь с использованием роста-ингибированных STO фидерных клеток21.
- Подготовьте ячейки STO (см. таблицу материалов)средства массовой информации, содержащие DMEM, дополненные 10% FBS и 100 U/mL пенициллином, 100 u/mL стрептомицин. Выращивайте и расширяйте клетки STO до слияния в 25 см2 колб, покрытых 0,1% желатина. Нанесите 5000 рад гамма-облучения.
- Семя примерно 3 х 106 рост-ингибированных клеток на 10 см2 блюдо или 25 см2 колба (от шага 1.2.1.1). Добавить примерно 10-12 мл нервного гребня базальной среды и инкубировать в одночасье.
ПРИМЕЧАНИЕ: Семенные клетки могут быть использованы для производства условной среды на срок до 10 дней. Регулярно проверяйте внешний вид клеток
- Фильтр среднего (0,22 мкм размер поры), и дополнить 25 нг / мл основной коэффициент роста фибробластов (bFGF) и 1000 U факторингиев лейкемии (LIF).
ПРИМЕЧАНИЕ: Хранить при 4 градусах по Цельсию и использовать в течение месяца или хранить при -20 градусов и использовать в течение 3 месяцев.
- Состояние средств массовой информации ночь с использованием роста-ингибированных STO фидерных клеток21.
- Пальто ткани культуры поверхностей с внеклеточной матрицы.
ПРИМЕЧАНИЕ: В зависимости от биологического вопроса задают, матрицы могут быть покрыты на стеклянные дном культуры блюда, пластиковые ткани культуры блюда или стеклянные крышки скользит. Ниже приведены различные разбавления гидрогеля на основе ECM, зависящие от матричного субстрата. Фибронектин был протестирован на стеклянное дно посуды и крышка скользит только в концентрациях, указанных ниже. Здесь мы будем называть поверхности с покрытием субстрата «покрытыми покрытием».- Пальто ткани культуры поверхностей с ECM на основе гидрогеля.
ПРИМЕЧАНИЕ: Держите субстрат холодным до покрытия, либо путем охлаждения средств массовой информации или поддержания на льду.- Оттепель гидрогель при 4 градусах Цельсия в одночасье. Добавьте 5 мл 10% FBS в DMEM до 5 мл гидрогеля для окончательного объема 10 мл (см. таблицу материалов).
- Сделать 0,5-1 мл aliquots как удобно и хранить при -20 градусов по Цельсию.
- Оттепель гидрогель aliquots на льду.
- Используйте 1:20 разбавления гидрогеля фонда для покрытия пластика.
- Используйте 1:5 разбавления гидрогеля фонда для покрытия стеклянные горки и стеклянные дна ткани культуры пластин.
ПРИМЕЧАНИЕ: Разбавить гидрогель в холодном DMEM. - Нанесите достаточно разбавленного гидрогеля, чтобы покрыть нужную область на тарелки/слайды и инкубировать в течение 30-45 мин при 37 градусах Цельсия.
- Используйте покрытием пластины / слайды немедленно или хранить покрытые слайды на 4 кв к в одночасье.
- Удалите эксцессы и промыть слайды с высоким содержанием глюкозы DMEM (по желанию) перед использованием.
- Пальто ткани культуры поверхностей с фибронектин.
- Сделать aliquots 1 мг /мЛ фибронектин бульон раствор и хранить при -80 градусов по Цельсию. Разбавить фибронектин pbS Dulbecco (dPBS) до конечной концентрации 1 мкг/мл.
- Нанесите достаточное фибронектин, чтобы покрыть нужную площадь и инкубировать при комнатной температуре в течение 15 минут.
- Удалить остаточный фибронектин и дайте стакану высохнуть в течение 30-45 мин.
- Промыть скважины или крышку скользит с высоким содержанием глюкозы DMEM (по желанию) перед использованием.
- Пальто ткани культуры поверхностей с ECM на основе гидрогеля.
2. День 1: Рассечение ранних эмбрионов стадии сомита
ПРИМЕЧАНИЕ: Используйте стерильные инструменты и стерильные растворы. Если генотипирование необходимо, соберите тело эмбриона для извлечения ДНК.
- Рассечение черепной нервной пластины ограничивается эмбрионами при 8,5 днях после прикопритума (dpc). Выберите эмбрионы на стадии 5-8 сомитов. Вскрыть матку в PBS и сократить мезотрия, чтобы отделить каждый эмбрион(Рисунок 1A). Мышечная стенка матки контрактов и листворной ткани станет видимым(рисунок 1B).
ПРИМЕЧАНИЕ: Поддержание эмбрионов в матке в ледяной PBS в то время как вскрытия выполняются один эмбрион за один раз. Перемещение эмбрионов со стеклянной пипеткой Pasteur в свежие стерильные PBS для улучшения видимости и уменьшения загрязнения. - Слайд щипц между мышечным слоем и листующей ткани и удалить мышечный слой со второй парой щипц(рисунок 1C).
- Используя щипцы, прокалывая листвучку по краям полюса месомтрия и со второй парой щипцы слезоточивый открыть перпендикулярно полюса.
- Очистите тучную ткань щипцами, чтобы визуализировать мембрану Райхерта.
- Тщательно удалите мембрану Райхерта. Висцеральный желтковый мешок становится видимым и эмбриона можно увидеть внутри(рисунок 1D).
- Удалите висцеральный желточный мешок и амнион(рисунок 1E) и положение эмбриона для того, чтобы визуализировать голову раза(рисунок 1F).
- Вырезать голову раз над сердцем и соскребать основной мезодерм с помощью щипков и / или ресниц инструменты для получения чистой нервной пластины (NP) (Рисунок 1H).
ПРИМЕЧАНИЕ: NP можно держать в целом или разделить вниз по оси anteroposterior так, что каждая сторона может быть покрыта индивидуально. Нейронная пластина границы могут быть дополнительно обрезается от нервной пластины для того, чтобы свести к минимуму нейронов вклад в explants. - Используйте стеклянную пипетку Pasteur для переноса расчлененных нейронных пластин на блюдо с гидрогелем, наполненное условными нейронными гребнями.
- Аккуратно закружить блюдо, чтобы положение NP в середине колодца. Это важно для максимизации качества фазы для визуализации живых клеток (на второй день).
- Инкубировать на ночь (или в желаемую точку времени) при 37 градусах По Цельсия в 5% CO2. Нейронные клетки гребня должны быть заметно мигрируют из нервной пластины.
ПРИМЕЧАНИЕ: Клетки обычно прикрепляются в пределах 6-8 ч. После explant прикрепляется, дайте больше времени для визуализации мигрирующих клеток. Обычно на 24 ч пост explant, мы можем найти три различимые популяции клеток. Первая популяция, в центре explant, является нейронная пластина (NP). Вторая популяция, премиграторная NC (PNC), окружает НП эпителиальным листом клеток. Третья популяция, навнешнем кольце, формируется из мигрирующих NC (mNC), которые больше по размеру, и появляются полностью мезенхимальной(рисунок 2).
3. День 2: Live клеток изображения морин ы черепных нервных клеток гребня
ПРИМЕЧАНИЕ: Изображение должно быть выполнено на 24 h post explanting для оптимального изображения и количественной обработки нейронных клеток гребня. NC индукции средств массовой информации не должны быть обновлены до живой визуализации клеток. Требуется доступ к перевернутому микроскопу с моторизованной стадией и камерой для окружающей среды. Используйте многофункциональные блюда культуры тканей, подходящие длявизуализации (Таблица Материалов).
-
Настройка микроскопа
- Установите окружающую среду камеры на 37 градусов по Цельсию и 5% CO2.
- Проколите отверстие в крышке крышки пластины культуры ткани, чтобы игла CO2, подключенная к камере увлажнения CO2, сидела внутри пластины.
- Поместите блюдо культуры ткани в держатель образца и ленты вниз пластины крышкой и CO2 иглы для предотвращения встряхивания во время нескольких колодцев приобретения.
- Включите контроллер микроскопа, контроллер сцены и программное обеспечение для визуализации.
- Сосредоточьтесь на черепных клетках NC при 10-кратном увеличении (с соответствующим фазовым кольцом в выбранном конденсаторе).
- Установите высокое качество фазового контраста на микроскопе, регулируя диафрагму радужной оболочки глаза, диафрагму и центрирующего телескопа, как указано в руководстве по настройке микроскопа.
-
Фазовая контрастная живая клеточная визуализация
- Установите местоположение каталога или файла, где будут сохранены файлы замедленного времени.
- Установите время экспозиции, связующие и области камеры.
- Установите количество временных точек, продолжительность изображения и временной интервал между кадрами.
- Для количественной оценки мигрирующих емкости nc-клеток установите микроскоп до 10-кратного увеличения, взяв 1 кадр каждые 5 минут (217 точек времени в течение 18 ч). Для количественной оценки морфологии клеток установите увеличение до 40x, взяв 1 рамку/мин (61 тайм в течение 1 ч). Для количественной оценки динамики ламеллипода, установить увеличение до 40x или 60x увеличение, принимая 1 кадр каждые 10 с (более 10 мин).
- Для многоскважинной визуализации установите механическую стадию перемещения между выбранными позициями XY, представляющими интерес. Подтвердите, что черепные клетки NC находятся в фокусе и сценические позиции верны.
- Используйте команду Acquire для запуска замедленной визуализации.
- После завершения замедленного изображения просмотрите многомерные данные и экспортите файлы .stk для анализа.
ПРИМЕЧАНИЕ: .stk — это файл стека TIFF. - Выйдите из программного обеспечения, выключите компьютер и выключите сцену, контроллеры камеры и микроскопа.
4. Анализ изображений: количественная оценка миграции нервных клеток гребня
ПРИМЕЧАНИЕ: Чтобы лучше определить клеточное поведение, проявляющееся мигрирующими клетками нейронных гребня черепа, мы проанализировали ряд количественных мигрирующих параметров, в частности, с упором на миграционную способность и динамику клеточной формы. (1) Миграция (накопленное расстояние) — общая длина пути, взятая ячейкой (мкм); (2) Миграция (Евклидово расстояние) является прямой линии расстояние между начальной и окончательной позиции ячейки (мкм); (3) Миграция (скорость ячейки) — это расстояние, пройденное ячейкой на единицу времени (мкм/мин); (4) Форма клетки (область клетки) является общей поверхностью, покрытой ячейкой. Установите пиксель в микрон масштабе в соответствии с микроскопом изображения. (Apx x Npx, где областьпикселей px и Npx - количество пикселей. Единицы:мкм 2; (5) Форма клетки (клеточная круговость) — это отклонение формы клетки от идеального круга, которое указывается значением круговой связи 1,0 (A/P2)),где область А и P q периметр.
-
Отслеживание одноклеточных ячеек
ПРИМЕЧАНИЕ: Для измерения миграции ячейки NC генерируются координаты отдельных ячеек XY во всех временных кадрах. Это позволяет последующеманализу показателей расстояния, скорости и сохранения миграции клеток.- Откройте ImageJ и импортируйте данные в виде файлов стека TIFF.
- Нажмите Анализ (ru) Установите шкалу для калибровки файлов .stk в соответствии с настройками микроскопа, работающих в пикселе/мкм.
- Нажмите на плагины Отслеживание (англ.) Ручное отслеживание, чтобы открыть Image J ручной слежения ячейки плагина. Чтобы начать отслеживание ячейки, выберите Добавить трек.
- Отслеживайте ячейки во всех кадрах фильмов замедленного времени, используя ядро в качестве отправной точки.
ПРИМЕЧАНИЕ: 10-20 клеток должны быть отслежены на explant, в общей сложности 60 клеток отслеживается (n No 3). Клетки, которые проходят деление клеток в течение промежуток времени, должны быть исключены из анализа. - Сохранить и экспортировать результаты в виде файла .csv. Результаты представляют отдельный номер клеточного трека, номер среза и координаты XY по всем кадрам.
-
Количественная оценка мигрирующих емкости нервных клеток гребня
- Откройте данные отслеживания одной ячейки (см. выше). Преобразуйте файлы .csv в формат файла .txt.
- Откройте программное обеспечение миграции (Таблица материалов). Нажмите на вкладку «Данные импорта», чтобы импортировать данные отслеживания ячеек в виде файла .txt.
- В соответствии с наборами данных Инициализация,выберите количество срезов или кадров для анализа и установите калибровку XY и временной интервал между кадрами. Выберите настройки применить, чтобы сохранить настройки.
- Выберите символ данных участка для формирования траекторионных участков. Выберите символ Статистического управления для количественной оценки показателей расстояния и скорости.
- Сохранить траектории участков, как bitmap (.bmp) файлы, и расстояние и скорость меры, как .txt файлов. Выберите символ Удаления данных. Повторите для других файлов замедленного времени.
ПРИМЕЧАНИЕ: Траектория участки могут быть использованы для визуализации прямолинейности отдельных клеточных путей для данного состояния клетки или состояние в течение замедленного фильмов (Рисунок 4A). Данные о расстоянии и скорости, хранящиеся в файлах .txt, могут быть использованы для дальнейшего анализа.
-
Количественная оценка области нейронных клеток гребня и круговой связи
- Откройте файлы time-lapse .stk в ImageJ и откалибруйте в соответствии с настройками микроскопа, работая в пикселе/мкм.
- Под анализом Установите измерения,нажмите, чтобы выбрать параметры формы ячейки: область ячейки, периметр и дескриптор формы.
- Используйте инструмент Freehand Selection для ручной рисования вокруг каждой ячейки, используя границы клеточной мембраны в качестве руководства.
- Нажмите клавиши Ctrl и B на клавиатуре для поддержания контура ячейки, наклеемых на изображение. Повторите для ячеек в течение каждого промежуток времени кадра.
- Используйте изображение Наложение Для roI Manager для хранения значений.
- После того, как все ячейки интереса на кадр были изложены, нажмите Мера. Сохранить результаты в виде файла .csv.
ПРИМЕЧАНИЕ: 10-20 ячеек на фильм должны быть изложены, в общей сложности 30-60 клеток, проанализированных на условие (n No 3). Данные формы ячейки (файлы csv) могут быть использованы для количественной оценки изменения динамики клеточной формы с течением времени(рисунок 4C)или как морфология может быть изменена при различных клеточных обработках.
Результаты
Используя продемонстрированные здесь процедуры, эмбрионы мышей были расчленены из матки, а экстраэмбриональные ткани были удалены(рисунок 1A-D). Эмбрионы были сомит поставил (с использованием только эмбрионов на 5-8 сомитов (ss), Рисунок 1E,F). Затем черепная нервная пластина была расчленена, а нейроэпителий был выделен. Мезодермальные клетки, идентифицированные как свободные, круглые, мезенхимальные клетки, были мягко отмахнулись(рисунок 1G-L). Передняя нейронная пластина может быть высажена целиком, и в этом случае нервная ткань гребня появится боково и расширится радиально вокруг экспланта, или каждая граница нервной пластины (справа и слева) может быть высажена отдельно. Это особенно полезно при вытеснении из генетических мутантов.
В течение 24 ч, область premigratory (эпителиальный) черепного нервного гребня можно четко увидеть окружающие нервной пластины explant(рисунок 2B). Кроме того, субпопуляция нервных клеток гребня претерпели эпителии к мезенхимальным перехода и появляются полностью мезенхимальной(Рисунок 2). Таким образом, у нас есть несколько концентрических колец различных клеток, с нервной пластины (NP) в центре, premigratory нейронный гребень (PNC) в промежуточном круге, и популяция мигрирующих нейронных гребень (mNC) во внешнем кольце (Рисунок 2B). Для того, чтобы проследить NC клетки, можно использовать генетически модифицированные модели мыши, как мы показываем на рисунке 2C. В этом случае мы использовали нейронный гребень специфический Wnt1::Cre; РозаmTmG, которая приводит к NC клетки помечены зеленым цветом. У этих мышей, клетки выражают мембраны помидор (mT, в красном цвете), если они не выражают Cre рекомбиназы. Рекомбинация приводит к клеткам, выражающим мембранный зеленый флуоресцентный белок (GFP, зеленым цветом). Красные клетки, показанные в центре экспланта, являются нейронными клетками пластин. Некоторые клетки донецкой нервной пластины также выражают GFP; для долгосрочной культуры, мы бы акциз все клетки в центре. Для наших целей, чистота explant достаточно для того чтобы отслеживать различные нервные популяции клеток гребня. Там, где необходима более высокая чистота нервного гребня, эта стратегия генетической маркировки может быть объединена с флуоресцентной активированной сортировкой клеток (FACS) для обеспечения чистоты популяции. Кроме того, можно исправить explants и определить NC населения с антитела маркировки.
Кроме того, 24 ч было очевидно, что характерные концентрические кольца premigratory и полностью мигрирующих NC клеток explant культур не зависит и не регулируется матричным выбором (Рисунок 3). Экспланткультуры, покрытые как на основе ECM гидрогеля и фибронектина формируется сопоставимых структур эксплант, состоящий из трех популяций клеток, NP, PNC и MNC(Рисунок 3A,C). Нейронная морфология клеток гребня была также сопоставима между теми, покрытые на основе ECM гидрогеля и фибронектина(рисунок 3B,D). Тем не менее, explants покрытием на фибронектин производится клеток с более заметнымла ламеллиподия на переднем краю клетки, казалось бы, более поляризованы в направлении миграции (Рисунок 3B,D).
После того, как популяция мигрирующих нейронных клеток гребня очевидна, живой визуализации клеток может быть завершена. Микроскопия замедленного времени установлена до 10-кратного увеличения (18 ч, 1 рамка/5 мин) для последующего анализа миграции клеток NC(рисунок 4A). ImageJ Ручной отслеживания плагин генерирует XY координаты отдельных ячеек на всех кадрах замедленного фильмов(рисунок 4B). Эти координаты могут быть обработаны с помощью программного обеспечения миграции. Это программное обеспечение позволяет визуализировать отдельные клеточные треки с течением времени(рисунок 4B)и может быть использован для количественной оценки накопленного и евклидного расстояния, а также скорости ячейки.
Данные визуализации по времени также предоставляют огромное количество информации о морфологии клеток во время миграции черепных нервных клеток гребня(рисунок 4C). Путем изложения отдельных клеточных мембран, области клеток и измерения периметра могут быть рассчитаны из всех кадров фильмов(рисунок 4C). Эти измерения позволяют последующую количественную оценку области клеток и круговостью(рисунок 4D). На рисунке 4C показан анализ изменений формы клеток в течение 18 ч. Обратите внимание, что по мере того, как клетки мигрируют от экспланта, область клеток значительно увеличивается, в то время как круговая способность клеток остается относительно постоянной (односторонний тест ANOVA, тест нескольких сравнений Туки) ( Рисунок 4E,F). Это говорит о том, что по мере того, как клетки отходят от эпителиального края и теряют контакты клеток, они показывают увеличение площади распространения клеток. Показатели круговой связи не изменились с течением времени; однако краткосрочные изменения в круговоротах могут быть видны, если будет количественно определено увеличение числа временных точек. Измерения круговой связи клеток могут также предоставлять интересные данные о динамике формы клеток в присутствии химиотаксического сигнала или в ограниченных условиях.

Рисунок 1: Изоляция черепного нервного гребня эксплантов от эмбриона e8.5.
Изображения — это кадры из видео, документирующего технику микрорастчедризации. (A-C) Рассечение эмбриона из матки. (B-C) Используя две острые щипточки, аккуратно разогнай мышечный слой. Панель (D) показывает эмбрион внутри висцерального желтого мешка (желтая линия). Извлеките зародыш из висцерального желткового мешка. (E) Боковые виды эмбриона на стадии 8.5 боковой. (F) Дорсальный вид эмбриона на стадии 8.5. Граф somites (ss) для определения возраста эмбрионов; обычно 5-8 ss (желтые круги в F). (G) Закрыть взгляд на черепной области эмбриона. Удалить экстраэмбриональные мембраны из черепной области; сомиты отмечены желтой линией. (H) Рассеичения передней нервной пластины выполняются под первой ветвянной аркой (желтая линия). (I) Боковой вид вскрытия передней нервной пластины. Нейронные складки, где нейронные клетки гребня возникают, отмечены желтой линией. (J-L) Удалить мезодермальной ткани (пушистые мезенхимальные клетки) основные передние нервные складки как можно больше, прежде чем наклеить NP на подготовленные блюда культуры. Фильм был сделан с помощью стерео-микроскопа с широкоугольным апохроматическим объективом при 3.0X зум (см. таблицу материалов). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
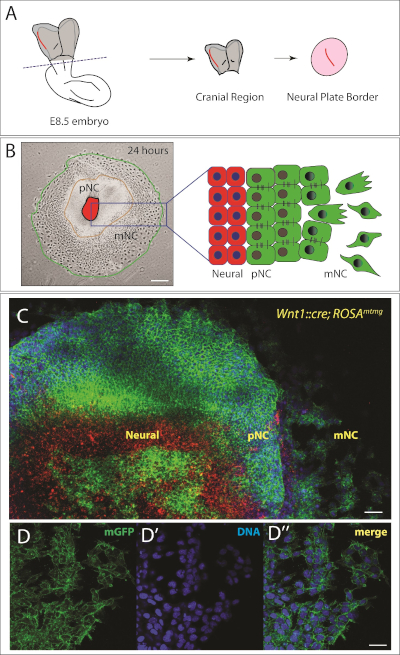
Рисунок 2: Murine черепного нервного гребня explant.
(A) Схематическое представление вдомного вида эмбриона мыши e8.5. Область черепа эмбриона разрезается на линии. Нейронная граница пластины (выделенная красным цветом) изолирована от окружающей мезодермовой ткани и культивируется в течение 24 ч, чтобы позволить черепному нервному гребню эмигрировать. Схема адаптирована от22,23. (B) Слева: Представитель яркое поле изображение черепного нервного гребня explant 24 часов после покрытия. Наблюдаются три популяции клеток, которые также схематизированы справа. NP - нервная пластина, PNC - предмиграционный нервный гребень и мигрирующие нейронные гребни. Шкала бар 250 мкм. (C) Более высокое увеличение изображения explant от генетически маркированной мыши (Wnt1::cre; РозаmTmG). Клетки без драйвера Cre выражают мембранный помидор (mT) в красном цвете. Выражение Cre под контролем нейрогреба специфического промоутера Wnt1 приводит к иссечению кассеты mT и экспрессии мембраны GFP (mG) в зеленом цвете. Ядра окрашены Hoescht (в синий цвет). Шкала бар 200 мкм. (D-D') Высшие изображения увеличения мигрирующих клеток, выражающих мембраны GFP (D). (D') ДНК помечена Hoescht (синий). (D') Слияние D и D'. Шкала бар 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Выслаживание, культивируется на разных субстратах.
(A-B) Фазовые контрастные изображения экс-растений, культивированные на коммерческом ECM-гидрогеле. (C-D) Выделяемые растения культивировались на 1 мкг/мл фибронектина. Нейронную пластину (NP), премигранные (pNC) и мигрирующие (mNC) нейронные клетки гребня можно отличить по их различным клеточным морфологиям. Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Количественная оценка миграции клеток черепного нервного гребня и динамики клеточной формы.
(A) Фазовые контрастные кадры из замедленного изображения экзат-культур, наложенных на один нейронный крест клеток треков, используя ImageJ / Фиджи Ручной сотовый слежения плагин. Десять представительных mNC ячейки были вручную отслеживаются в течение 18 ч (217 кадров) и XY координаты были экспортированы. Данные представлены как точка наложения и линейные участки. Клетки были покрыты на 1 мкг/мл фибронектин. Шкала бар 200 мкм. (B) Представитель траектории участка 10 mNC ячейки, созданные с помощью программного обеспечения миграции. (C) Фазово-контрастные кадры, взятые из замедленного анализа культур эксплантатора. Dashed линии наметить 8 представительных мигрирующих нервных клеток гребня проанализированы для динамики формы клетки, когда покрывало на 1 мкг /мЛ фибронектин. Шкала бар 200 мкм. (D) Схематическое представление расчетов, используемых для количественной оценки области клеток и круговой связи. Клеточная морфология схемы является то, что из клетки выделены синим (C). Областьпикселей px, Npx - пиксельное число, площадь А, P и периметр (1 пиксель no 1.60772 мкм2). (E-F) Количественная оценка площади клеток и измерения круговой связи клеток с течением времени. Данные представляют собой среднее и среднего значения SEM. Каждая точка представляет собой одну ячейку (n no 60), взятую из 3 независимых экспериментов, и анализируемую на 0 ч, 6 ч, 12 ч и 18 ч (нс незначительный, й стр.т;0,05, п.л.; 0,0001 одностороннее ANOVA, тест нескольких сравнений Туки). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Изучение клеток нервного гребня млекопитающих было проблемой для ученых из-за внутриутробного характера развития млекопитающих. In vivo исследования трудно настроить, как эмбрион должен манипулировать в условиях, которые имитируют жизнь в матке. На практике, это почти невозможно воспроцировать культуры этих (E8 ) эмбрионов дольше, чем 24 ч, особенно для живой визуализации. Кроме того, индукция и миграция нервного гребня происходят одновременно с закрытием нервной трубки и эмбриональным поворотом в мыши; это критическое и стрессовое морфогенетическое событие, которое часто терпит неудачу, когда эмбрионы культивируются экс-утробы. Таким образом, уровень успеха подходов к экс-утробе, как правило, низок. Использование увековеченных NC-клеток21 является полезным инструментом для сокращения использования животных и может обеспечить лучший источник нейронных клеток гребня для долгосрочного анализа, трансфекции и обогащения исследований. Тем не менее, существует явно необходимость надежной культуры первичных нейронных клеток гребня. Наш метод применим к мышиным нокаутом или условным генетическим моделям. Сопоставимый метод с нашим был описан для других нейронных популяций гребня20; однако, наш метод тщательно описывает пошаговую изоляцию моринальных черепных клеток NC. Мы также подробно описываем использование различных матриц, а также процедуру анализа миграции.
Для достижения последовательных результатов, мы обнаружили, что особое внимание уделяется постановке во время отбора эмбрионов. Неудивительно, что количество сомитов коррелирует с различными этапами развития черепной NC. Поэтому знание анатомии эмбриона очень важно перед получением каких-либо экспериментальных данных. Этот подход может быть адаптирован к изоляции отдельных популяций нервных клеток гребня, в зависимости от биологического вопроса и целевых клеток.
После того, как эмбрионы выбраны и вскрыты, мезодермальные клетки могут быть легко различимы и должны быть удалены, чтобы лучше визуализации и уменьшить загрязнение. Для более долгосрочных культур, нейронная ткань пластины могут быть удалены на 24 ч покрытия для того, чтобы предотвратить загрязнение нервных тканей. Более последующее уточнение смогло быть пользой флуоресцентной маркировки линии (например, используя Wnt1::cre или Sox10::creERT водители совмещенные с люминесцентными репортерами24,25) для того чтобы различить нервные клетки гребня от другие ткани, как показано на рисунке 2C.
Предыдущие доклады подчеркнули потенциал покрытия мыши NC explant культур на различных матрицах, чаще всего на коммерческих гидрогелей ECM, фибронектин и коллаген I20,21,26. В наших руках мышь черепных NC explant культур успешно выращивается на всех трех матрицах, в концентрациях, указанных в первоначальных отчетах (данные не показаны). Первоначальный изысканный подход, который мы адаптировали для наших культур ЭКСплантирования NC, использовал коммерческий гидрогель в качестве матрицы выбора, которая в основном состояла из ламинина и коллагенов21(Рисунок 3A-B). Однако состав этого гидрогеля четко не определен, с неизвестным фактором роста и содержанием белка. Таким образом, мы с тех пор изменили наш подход к покрытию мыши NC explant культур на фибронектин (Рисунок 3C-D). Фибронектин хорошо определен и высоко выражен в ECM и подвальных мембранах, вдоль которых мигрируют nc-клеткиin vivo28,29,30. Для оптимизации фибронектина матрицы, которая лучше всего реплицирует нейронных гребня клеток миграции и морфологии, как видно с помощью гидрогеля, мы сравнили NC клеточных поведения выставлены на гидрогель против титрования 0,25-30 мкг /мл фибронектин, и определены 1 мкг /мл фибронектин, как предоставление идеальных свойств (данные не показаны). Мы считаем, что эта предварительная работа может помочь создать основу для систематического сравнения матриц, таких как фибронектин, с ранее описанными, а именно коллагеном и ламинином32,33,34. Было бы особенно интересно сравнить мышь NC клеток мигрирующих потенциала на фибронектин по сравнению с коллагеном I, учитывая, что коллаген-IA1 эндогенно выделяется мыши, птичьего и человека NC клеток28,30,31,32. Коллаген I поэтому так же актуален, как фибронектин при рассмотрении выбора матрицы. Также стоит признать, что биодоступность факторов роста в средствах массовой информации может быть изменена различными матричных компонентами, особенно с учетом высокого содержания в сыворотке наших носителях. Чтобы преодолеть это, мы в настоящее время работаем над созданием безсыворотки определенных условий культуры. Эти определенные носители успешно используются в протоколах индукции нервного гребня в плюрипотентном поле стволовых клеток, но требуют дальнейшей оптимизации для нашей системы культуры NC explant33,34. Наша работа может также служить отправной точкой для уточнения условий для других типов NC клеток, таких как сердечный и ствол NC, а также для последующих исследований ДИфференциации NC. Самое главное, этот протокол позволяет изоляции черепных клеток NC для различных приложений. Мы представляем исследования по направленной миграции, трех-D миграции и вторжения. Клетки, изолированные таким образом, можно лечитьin vitroдля проведения ряда анализов. Например, клетки можно легко лечить с помощью различных малых молекул для целевой конкретных белков, они могут рассматриваться в определенных точках времени, и вымывание эксперименты могут быть разработаны для определения восстановления поведения клеток (Рисунок 4). Возможна более долгосрочная культура для трансфекции и дифференциации анализов, а также прохождения клеток (данные не показаны). Однако жизнеспособность, способность к обновлению клеток и многофункциональность должны быть проверены после прохождения. Клетки, покрытые стеклянными крышками, также могут быть использованы в иммунофлуоресцентных протоколах окрашивания, после живой визуализации. Наконец, этот подход представляет собой чрезвычайно мощную систему для изучения миграции NC из генетических моделей мыши22,23,24,25.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы благодарны Отделу биологических услуг Королевского колледжа Лондона, особенно Тиффани Джарвис и Линси Кашнелла за их постоянную поддержку. Мы благодарим Дерека Стэмтемпа, Мамору Исии и Роберта Макссона за советы и помощь с реагентами во время первоначального создания этого протокола. Мы благодарим Dheraj Taheem за помощь в гамма-облучении клеток STO. Мы благодарим лаборатории Лю и Краузе, особенно Томми Паллетт, за большую поддержку. Эта работа финансировалась за счет грантов от BBSRC (BB/R015953/1 для KJL/MK), студентов из MRC Докторская программа обучения (LD), Ньюленд Педли фонд (ALM) и KRIPIS II, Генеральный секретариат исследований и технологий (GSRT), Министерство образования и религии Дела, Греция и Фонд Санте (в SGGM).
Материалы
| Name | Company | Catalog Number | Comments |
| bFGF | R&D systems | 233-FB | |
| b-mercaptoethanol | Gibco | 31350-010 | |
| Tissue culture flasks | Corning | 430639 | 25cm2 culture flasks |
| DMEM (4500 mg/L glucose) | Sigma | D5671 | |
| Dulbecco's phosphate-buffered saline (dPBS) | Sigma | D8537 | |
| Ethanol | Fisher Chemicals | E/0650DF/C17 | |
| Fetal Bovine Serum | Sigma | TFS AA 10-155 | |
| Fetal Bovine Serum (ES Cell FBS) | Gibco | 26140079/16141-079 | |
| Fibronectin bovine plasma | Sigma | F1141 | |
| Gelatin from bovine skin | Sigma | G9382 | |
| L-glutamine | Sigma | G7513 | |
| Glass-bottomed, multi-well 24-well tissue culture plate | Ibidi | 82406 | Glass-bottomed, No 1.5, 24-well tissue culture dish with black sides |
| Cell migration analysis tool | Ibidi | v2.0 | Manuals for this software can be found at: https://ibidi.com/manual-image-analysis/171-chemotaxis-and-migration-tool.html. |
| Circularity Plug-in | ImageJ | v1.29 or later | The circularity plug-in is an extended version of ImageJ/Fiji’s Measure command, designed by Rasband, W., (2000) (wsr@nih.gov). |
| LIF | ESGRO by Millipore | ESG1106 | |
| Manual Cell Tracking Plug-in | ImageJ | v1.34k or later | ref Cordelieres F. Institut Curie, Orsay (France) 2005 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| MEM non-essential aminoacids 100X | Gibco | 11140-050 | |
| Matrigel (ECM-based Hydrogel) | Corning | 356234 | |
| Microscope | Olympus | 1X81 | Olympus 1X81 inverted microscope |
| Microscope camera | Photometrics | 512B | Photometrics Cascadell 512B camera (4x UPlanFL N, 10x UPlanFL N, 20x UPlanFL N, 40x UPlanFL N objectives) |
| Microscope controller | Olympus | 1X2-UCB | Olympus 1X2-UCB microscope controller |
| Microscope temperature controller | Solent Scientific | RS232 | Maintained at 37°C |
| Penicillin/streptomycin | Sigma | A5955 | |
| Sodium Pyruvate | Sigma | S8636 | |
| Statistics software | Graphpad Prism | v7.0 | |
| STO feeder cells | ATCC | CRL-1503 | |
| Stereomicroscope | Nikon | SMZ | |
| XY microscope stage controller | Applied Scientific Instrumentation (ASI) | MS-4400 |
Ссылки
- Duband, J. L. Diversity in the molecular and cellular strategies of epithelium-to-mesenchyme transitions: Insights from the neural crest. Cell Adhesion & Migration. 4, 458-482 (2010).
- Mayor, R., Carmona-Fontaine, C. Keeping in touch with contact inhibition of locomotion. Trends in Cell Biology. 20, 319-328 (2010).
- Le Douarin, N., Kalcheim, C. . The neural crest. 2nd edn. , (1999).
- Trainor, P. A. . Neural Crest Cells : Evolution, Development, and Disease. , (2014).
- Jiang, R., Bush, J. O., Lidral, A. C. Development of the upper lip: morphogenetic and molecular mechanisms. Developmental dynamics : an official publication of the American Association of Anatomists. 235, 1152-1166 (2006).
- Ahola, J. A., et al. Increased incidence of Hirschsprung's disease in patients with hypoplastic left heart syndrome--a common neural crest-derived etiology?. Journal of Pediatric Surgery. 44, 1396-1400 (2009).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463, 958-962 (2010).
- Inoue, K., et al. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation. Annals of Neurology. 52, 836-842 (2002).
- Kim, H., Kang, K., Ekram, M. B., Roh, T. Y., Kim, J. Aebp2 as an epigenetic regulator for neural crest cells. PloS one. 6, e25174 (2011).
- Barriga, E. H., Trainor, P. A., Bronner, M., Mayor, R. Animal models for studying neural crest development: is the mouse different?. Development. 142, 1555-1560 (2015).
- Bronner, M. E., LeDouarin, N. M. Development and evolution of the neural crest: an overview. Developmental Biology. 366, 2-9 (2012).
- De Calisto, J., Araya, C., Marchant, L., Riaz, C. F., Mayor, R. Essential role of non-canonical Wnt signalling in neural crest migration. Development. 132, 2587-2597 (2005).
- Carmona-Fontaine, C., et al. Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature. 456, 957-961 (2008).
- Matthews, H. K., et al. Directional migration of neural crest cells in vivo is regulated by Syndecan-4/Rac1 and non-canonical Wnt signaling/RhoA. Development. 135, 1771-1780 (2008).
- Banerjee, S., et al. A novel role for MuSK and non-canonical Wnt signaling during segmental neural crest cell migration. Development. 138, 3287-3296 (2011).
- Pryor, S. E., et al. Vangl-dependent planar cell polarity signalling is not required for neural crest migration in mammals. Development. 141, 3153-3158 (2014).
- Serbedzija, G. N., Bronner-Fraser, M., Fraser, S. E. Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development. 116, 297-307 (1992).
- Kawakami, M., Umeda, M., Nakagata, N., Takeo, T., Yamamura, K. Novel migrating mouse neural crest cell assay system utilizing P0-Cre/EGFP fluorescent time-lapse imaging. BMC Developmental Biology. 11, 68 (2011).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nature protocols. 6, 1568-1577 (2011).
- Ishii, M., et al. A stable cranial neural crest cell line from mouse. Stem Cells and Development. 21, 3069-3080 (2012).
- Gonzalez Malagon, S. G., Liu, K. J. ALK and GSK3: Shared Features of Neuroblastoma and Neural Crest Cells. Journal of Experimental Neuroscience. 12, 1179069518792499 (2018).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9, 1126 (2018).
- Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K., McMahon, A. P. Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Current Biology : CB. 8, 1323-1326 (1998).
- Laranjeira, C., et al. Glial cells in the mouse enteric nervous system can undergo neurogenesis in response to injury. Journal of Clinical Investigation. 121, 3412-3424 (2011).
- Pfaltzgraff, E. R., Mundell, N. A., Labosky, P. A. Isolation and culture of neural crest cells from embryonic murine neural tube. Journal Of Visualized Experiments : JoVE. , e4134 (2012).
- Sternberg, J., Kimber, S. J. The relationship between emerging neural crest cells and basement membranes in the trunk of the mouse embryo: a TEM and immunocytochemical study. Journal of Embryology and Experimental Morphology. 98, 251-268 (1986).
- Sternberg, J., Kimber, S. J. Distribution of fibronectin, laminin and entactin in the environment of migrating neural crest cells in early mouse embryos. Journal of Embryology and Experimental Morphology. 91, 267-282 (1986).
- George, E. L., Georges-Labouesse, E. N., Patel-King, R. S., Rayburn, H., Hynes, R. O. Defects in mesoderm, neural tube and vascular development in mouse embryos lacking fibronectin. Development. 119, 1079-1091 (1993).
- Henderson, D. J., Copp, A. J. Role of the extracellular matrix in neural crest cell migration. Journal of Anatomy. 191 (Pt 4), 507-515 (1997).
- Thomas, S., et al. Human neural crest cells display molecular and phenotypic hallmarks of stem cells. Human Molecular Genetics. 17 (21), 3411-3425 (2008).
- Greenberg, J. H., Seppa, S., Seppa, H., Hewitt, T. Role of collagen and fibronectin in neural crest cell adhesion and migration. Developmental Biology. 87 (2), 259-266 (1981).
- Leung, A. W., et al. WNT/β-catenin signaling mediates human neural crest induction via a pre-neural border intermediate. Development. 143 (3), 398-410 (2016).
- Zhu, Q., Lu, Q., Gao, R., Cao, T. Prospect of Human Pluripotent Stem Cell-Derived Neural Crest Stem Cells in Clinical Application. Stem Cells International. 2016, 7695836 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены