Method Article
神経クレスト細胞の形成と移動の研究のためのマウスからの原発性頭蓋神経クレスト細胞の解剖、培養および分析
* これらの著者は同等に貢献しました
要約
このプロトコルは、主に細胞移動の研究のために、マウスモデルからの頭蓋神経堤細胞の解剖および培養について説明する。使用されるライブイメージング技術と速度と細胞形状の変化の解析について述べた。
要約
過去数十年にわたり、ヒト病理を模倣するために使用される遺伝子組み換えマウスモデルの利用可能性が増加してきました。しかし、生体内での細胞の動きや分化を研究する能力は依然として非常に困難です。神経クリストア症、または神経堤系統の障害は、主要な胚期のアクセシビリティの欠如と隣接する中皮間葉から神経堤間を分離することの困難のために研究することは特に困難である。ここでは、原発性頭蓋神経堤細胞の培養のための明確に定義された、ルーチンプロトコルを確立することに着手した。我々のアプローチでは、最初の神経堤の誘導段階の間にマウスの神経板の境界線を解剖する。ニューラルプレート境界領域は、移植され、培養される。神経堤細胞は、神経板境界を囲む上皮シートに形成され、そして、植え付け後24時間までに、剥出を開始し、上皮間葉転移(EMT)を経て、完全に動植物性神経紋細胞となる。我々の2次元培養アプローチにより、明確な組織集団(神経板対予見および移動神経紋)を容易に区別することができる。ライブイメージングアプローチを使用して、神経堤誘導、EMTおよび移動行動の変化を特定することができます。この技術と遺伝的変異体の組み合わせは、正常および病理学的神経紋細胞生物学を理解するための非常に強力なアプローチとなります。
概要
神経堤(NC)系統は、初期胚発生時に脊椎動物に排他的に現れる細胞の一過性、多能性および渡り来生集団である1、2である。神経堤誘導体は非常に多様であり、グリア、平滑筋、メラノサイト、ニューロンおよび頭蓋骨骨および軟骨3、4を含む。神経堤は多くの臓器系の機能に寄与するので、この系統はヒトの胚形成に不可欠である。異常なNCの発達は、最も一般的なヒト出生時欠損(すなわち、口唇口蓋裂)5、およびヒルシュスプルング病(HSCR)、ウォーデンスバーグ症候群(WS)、チャージ症候群およびウィリアムズ症候群6などの疾患の広い範囲に関与している。 、7,8,9.
NCの開発は、Xenopus、ひよこおよびゼブラフィッシュモデルを含む非哺乳類モデルシステムの数で探求されてきた。哺乳類では、マウスモデルでの研究は、神経堤の発達の根底にある主要な遺伝的事象のいくつかを同定した。しかし、マウス胚のアクセス不能のために、神経堤移行の細胞生物学に従うことがより困難であった(他の場所で10、11を見直した)。さらに、ひよこ、キセノプスおよびゼブラフィッシュの研究はNCのための遺伝子調節ネットワークを確立しているが、これらの動物モデルにおける機能研究の喪失は、マウスに同等の表現型を示さない場合がある。例えば、ゼマフィッシュとひよこでは、非正規のWntシグナル伝達は、NCが移動能力12、13、14、15を獲得することを可能にする細胞機構の1つである。.ただし、マウスでは、非正規 Wnt シグナリングの損失は移行16に影響を与えないようです。インビボNCの移行はマウスで長期間追跡することが困難であったように、これらの種の違いが異なる移動モードを反映しているのか、分子調節の違いなのかは不明である。
前述の通り、マウスのNC研究は、胚の元子宮培養が面倒であるため、非常に困難であった。さらに、NCは常に中皮や神経rectodermなどの隣接する組織と密接に接触しています。神経堤特異的なCreドライバまたは外因性染料の最近の使用は、私たちが蛍光的に渡りNCを標識することを可能にしました。ただし、これらのアプローチは依然として限られています。NCマイグレーション17、18を可視化する異なる技術を記述する複数のレポートにもかかわらず、これらの技術を簡単で日常的な手順に解決することは困難でした。
哺乳類NCの取り扱いと特徴付けを可能にする技術が必要であることは明らかである。ヒト頭蓋の発達と神経クリストア症を研究するための主要なモデルであるマウス頭蓋NCに焦点を当てた。我々は、NC細胞19、20、21の一次培養を記述するいくつかの興味深いレポートに基づいてアプローチを洗練した。ここでは、一次NC細胞を移植するための最適な培養技術を徹底的に説明する。生細胞イメージング法と異なる行列の最適な使用を示し、培養プレートをコーティングする。私たちのプロトコルは、他の顕微鏡での使用のガイドラインとして意図されている反転顕微鏡を使用して生きているNC細胞の移動を捕捉する方法と、細胞分析の詳細な要約を説明します。
植生からの期待される結果は、顕微鏡下で明確に区別される細胞の分布を美しくレイアウトする必要があり、そこでは(i)神経板、(ii)予見、および(iii)を表す3つの異なる細胞集団を見ることができる。移動性神経堤細胞。上皮間葉転移中の細胞の先経集団の境界における細胞行動を解析する方法を示す。また、細胞速度、距離、細胞形態に関する完全な移動細胞の研究にも力を入れた。
プロトコル
すべての動物の仕事は、キングスカレッジロンドン倫理レビュープロセスによって倫理的な承認を受けており、英国のホームオフィスプロジェクトライセンスP8D5E2773(KJL)に従って行われました。
1. 試薬の調製
- 滅菌リン酸バッファー生理食べ物(PBS)、70%エタノール、解剖ツール(鉗子および解剖ブレードまたは滅菌針)、市販の細胞外マトリックスでコーティングされたプラスチックプレートまたはガラススライドを含む一般的な解決策および用具を準備する(ECM)ベースのヒドロゲルまたはフィブロネクチン(材料表参照)、および神経堤媒体(下記参照)。
- ダルベッコの改変イーグル培地(DMEM、4500mg/Lグルコース)、15%胎児ウシ血清(FBS)、0.1mM最小必須必須非必須アミノ酸(MEM NEAA 100X)、1mMピルビン酸ナトリウム、55μM-βcapeを用いて神経堤基底培地を調製単位/mLペニシリン、100単位/mL連鎖球菌、および2 mM L-グルタミン。
- 増殖阻害STOフィーダー細胞21を用いて一晩培味物を条件付ける。
- 10%FBSおよび100 U/mLペニシリン、100 U/mL連鎖筋マイシンによって補充されたDMEMを含むSTO細胞(材料の表を参照)を調用する。STO細胞を成長させ、0.1%のゼラチンでコーティングした25cm2フラスコで合流するように膨張させる。ガンマ照射の5000ラッドを適用します。
- 種子約3 x 106成長抑制細胞を10cm2皿または25cm2フラスコ(ステップ1.2.1.1から)に付ける。約10-12 mLの神経堤基底培地を加え、一晩インキュベートする。
注:シード細胞は、最大10日間条件付き培地を生成するために使用することができます。定期的にセルの外観を確認する
- 培地(0.22μmの細孔サイズ)を濾過し、25 ng/mLの基本線維芽細胞増殖因子(bFGF)および1000Uの白血病阻害因子(LIF)を補う。
注:4 °Cで保存し、1ヶ月以内に使用するか、-20 °Cで保存し、3ヶ月以内に使用します。
- 増殖阻害STOフィーダー細胞21を用いて一晩培味物を条件付ける。
- 組織培養表面を細胞外マトリックスでコーティングする。
注:尋ねられている生物学的な質問に応じて、マトリックスはガラス底の培養皿、プラスチック組織培養皿またはガラスカバースリップにコーティングすることができます。マトリックス基板に依存する異なるECMベースのヒドロゲル希釈については、以下を参照してください。フィブロネクチンは、ガラス底の皿でテストされており、カバースリップは、以下に指定された濃度でのみ。ここでは、基板被覆面を「被覆プレート」と呼びます。- 組織培養面をECMベースのヒドロゲルでコーティングします。
メモ:メディアを冷却するか、氷の上に保つことによって、メッキまで基板を冷やしてください。- ヒドロゲルを一晩4°Cで解凍する。DMEMで10%FBSの5 mLを10mLの最終体積のために5 mLのヒドロゲルに加えます(材料の表を参照)。
- 0.5~1 mLのアリコートを便利にして-20°Cで保存します。
- 氷の上でヒドロゲルアリコートを解凍します。
- プラスチックをコーティングするためにヒドロゲルストックの1:20希釈を使用してください。
- ヒドロゲルストックの1:5希釈を使用して、ガラススライドとガラス底組織培養プレートをコーティングします。
注:冷たいDMEMでヒドロゲルを希釈します。 - プレート/スライドに所望の領域をカバーするのに十分な希釈ヒドロゲルを適用し、37 °Cで30〜45分間インキュベートします。
- コーティングされたプレート/スライドを直ちに使用するか、一晩4°Cでコーティングされたスライドを保管してください。
- 使用前に過剰を取り除き、高グルコースDMEM(オプション)でスライドをすすいでくしてください。
- 組織培養面をフィブロネクチンでコーティングします。
- 1 mg/mLフィブロネクチンストック溶液のアリコートを作り、-80°Cで保存します。ダルベッコのPBS(dPBS)を使用してフィブロネクチンを希釈し、最終的な濃度を1μg/mLにします。
- 所望の領域をカバーするために十分なフィブロネクチンを適用し、室温で15分間インキュベートします。
- 残留フィブロネクチンを取り除き、ガラスを30〜45分間乾燥させます。
- 使用前に高グルコースDMEM(オプション)でウェルをすすり、またはカバースリップしてください。
- 組織培養面をECMベースのヒドロゲルでコーティングします。
2. 1日目:初期ソミト期胚の解剖
注:滅菌ツールと滅菌液を使用してください。ジェノタイピングが必要な場合は、DNA抽出のために胚の体を採取する。
- 頭蓋神経板の解剖は、8.5日後のコイタム(dpc)で胚に制限される。5~8個のソミテ段階で胚を選択します。子宮をPBSに解剖し、各胚を分離するためにメムトリウムを切断する(図1A)。子宮の筋肉壁が収縮し、デシデュアル組織が見えるようになります(図1B)。
注:解剖が一度に1つの胚を行っている間、氷冷PBSで子宮内の胚を維持する。ガラスのパスツールピペットで胚を新鮮な無菌PBSに移動し、可視性を向上させ、汚染を低減します。 - 筋肉層とデシデュアル組織の間に鉗子をスライドさせ、2番目の鉗子のペアで筋肉層を除去する(図1C)。
- 鉗子を使用して、メソームの極の端に決定機を突き刺し、2番目の鉗子のペアで引き裂いてポールに垂直に開きます。
- 鉗子でデシデュアル組織を剥がし、ライハートの膜を視覚化します。
- ライハートの膜を慎重に取り除きます。内臓黄嚢が見え、胚が内部に見える(図1D)。
- 内臓黄嚢と天文(図1E)を取り除き、頭部の折り目を可視化するために胚を配置する(図1F)。
- 心臓の上に頭を折り、鉗子やまつげツールを使用して基礎となる中皮を削り取り、きれいな神経板(NP)を得ます(図1H)。
注:NPは、各側面が個別にメッキできるように、前部柱軸全体または分割を保持することができます。神経板の境界は、移植片への神経の寄与を最小限に抑えるために、神経板からさらに離れてトリミングすることができます。 - ガラスのパスツールピペットを使用して、解剖された神経板を、条件付きニューラルクレストメディアで満たされたヒドロゲルコーティングされた皿に移します。
- ゆっくりと皿を旋回して、井戸の真ん中にNPを配置します。これは、生細胞イメージングの位相品質を最大化するために重要です(2日目)。
- 5%CO2で37 °Cで一晩(または所望の時間ポイントに)インキュベートする。神経堤細胞は、神経板から目に見えて移動する必要があります。
注:セルは通常6~8時間以内に接続します。引き渡しが取り付けた後、移行セルを視覚化する時間を増やします。通常、24時間後の閉じ植えによって、我々は細胞の3つの区別可能な集団を見つけることができます。最初の母集団は、先実の中心に、神経板(NP)である。第2の集団である予見NC(pNC)は、細胞の上皮シート内のNPを囲む。第3の集団は、外側のリングで、大きさが大きい渡り来性NC(mNC)で形成され、完全に間葉系に見える(図2)。
3. 2日目:マウス頭蓋神経紋細胞の生細胞イメージング
注:画像化は、神経堤細胞の移行を最適に画像化し、定量化するために、移植後24時間で行われるべきである。NC誘導媒体は、生細胞イメージングの前にリフレッシュする必要はありません。モーターを備えた段階および組み込まれた環境部屋が付いている逆顕微鏡へのアクセスは要求される。イメージングに適したマルチウェル組織培養皿を使用してください(材料の表)。
-
顕微鏡セットアップ
- 環境室を37 °Cと5%CO2に設定します。
- 組織培養板蓋の蓋に穴を開けて、CO2加湿室に接続されたCO2針をプレート内に座らせた。
- 組織培養皿を試料ホルダーに入れ、プレート蓋とCO2針をテープで下ろし、マルチウェル獲得時の揺れを防ぎます。
- 顕微鏡コントローラ、ステージコントローラ、イメージングソフトウェアのスイッチを入れましょう。
- 10倍の倍率で頭蓋NC細胞に焦点を当てます(コンデンサーで一致する位相リングを使用)。
- 顕微鏡セットアップマニュアルに記載されているように、フィールドアイリスダイヤフラム、開口アイリスダイヤフラム、センタリング望遠鏡を調整することにより、顕微鏡上で高品質の位相コントラストを設定します。
-
位相コントラストライブセルイメージング
- タイムラプス ファイルを保存するディレクトリまたはファイルの場所を設定します。
- 露出時間、ビニング、カメラエリアを設定します。
- 時間ポイントの数、イメージングの期間、フレーム間の時間間隔を設定します。
- NC細胞の移動能力を定量化するには、顕微鏡を10倍の倍率に設定し、5分毎に1フレーム(18時間以上の217時間のタイムポイント)を取ります。細胞形態を定量化するには、倍率を40倍に設定し、1フレーム/分(1時間以上の61時間の時点)を取ります。ラメリポダイヤルダイナミクスを定量化するには、倍率を40倍または60倍に設定し、10s(10分以上)ごとに1フレームを取ります。
- マルチウェルイメージングの場合は、選択した XY 位置間を移動する機械ステージを設定します。頭蓋NC細胞が焦点を合わせており、ステージの位置が正しいことを確認します。
- [取得]コマンドを使用して、タイムラプス イメージングを開始します。
- タイムラプスイメージングが完了したら、多次元データを確認し、.stkファイルをエクスポートして分析します。
注: .stk は TIFF スタック ファイルです。 - ソフトウェアを終了し、コンピュータをシャットダウンし、ステージ、カメラ、顕微鏡コントローラをオフにします。
4. イメージング解析:神経堤細胞移動の定量化
注:マウス頭蓋神経紋細胞を移動することによって示される細胞行動をより良く定義するために、我々は、特に渡り容量と細胞形状のダイナミクスに焦点を当てて、一連の定量化可能な移行パラメータを分析しました。(1)マイグレーション(累積距離)は、セル(μm)によって撮影されたパスの全長です。(2)マイグレーション(ユークリッド距離)は、セルの初期位置と最終位置(μm)の間の直線距離です。(3)マイグレーション(セル速度)は、時間単位当たりのセル移動距離(μm/min)です。(4)セル形状(セル面積)は、セルで覆われた総表面です。イメージング顕微鏡に従ってピクセルをミクロンスケールに設定します。(A = Apx x Nピクセル、A px = ピクセル領域と Npx = ピクセル数。単位: μm2;(5)細胞形状(細胞円形)は、A=面積及びP=周長である1.0(4π(A/P2))の円数値で示される完全な円からの細胞形状の偏差である。
-
単一セルトラッキング
注: NC セルの移動を測定するために、すべてのタイムラプス フレームにわたって個々のセルの XY 座標が生成されます。これにより、細胞移動の距離、速度、永続性測定の後続の分析が可能になります。- ImageJ を開き、データを TIFF スタック ファイルとしてインポートします。
- [分析] をクリック|スケールを設定して、顕微鏡の設定に従って.stkファイルを調整し、ピクセル/μmで動作します。
- [プラグイン] をクリックします |トラッキング |手動トラッキングは、画像J手動セルトラッキングプラグインを開きます。セルトラッキングを開始するには、[トラックの追加]を選択します。
- 基準点として核を使用して、タイムラプスムービーのすべてのフレームを通してセルを追跡します。
注: 10 ~ 20 個のセルを、合計 60 個のセルを追跡する必要があります (n = 3)。タイムラプスの過程で細胞分裂を受ける細胞は、分析から除外されるべきである。 - 結果を保存して .csv ファイルとしてエクスポートします。結果は、すべてのフレームにわたって個々のセルトラック番号、スライス番号、XY座標を表します。
-
神経堤細胞移動能力の定量化
- 単一セルトラッキングデータを開きます(上記参照)。.csv ファイルを .txt ファイル形式に変換します。
- 移行ソフトウェア (材料の表)を開きます。[データのインポート]タブをクリックして、セル追跡データを .txt ファイルとしてインポートします。
- データセットの下|初期化を行い、解析するスライスまたはフレームの数を選択し、フレーム間の XY キャリブレーションと時間間隔を設定します。[設定を適用]を選択して設定を保存します。
- 軌道プロットを形成するプロットデータシンボルを選択します。距離と速度の測定を定量化するには、統計記号を選択します。
- 軌道プロットをビットマップ (.bmp) ファイルとして保存し、距離と速度の測定を .txt ファイルとして保存します。[データの削除]シンボルを選択します。他のタイムラプス ファイルについても同じ手順を繰り返します。
注: 軌道プロットを使用すると、タイムラプスムービーの過程で、特定のセル条件または状態に対する個々のセルパスの直接性を視覚化できます(図4A)。.txt ファイルに格納されている距離と速度のデータを使用して、さらなる分析を行うことができます。
-
神経堤細胞領域の定量化と円形性
- ImageJ でタイムラプス .stk ファイルを開き、顕微鏡の設定に従って調整し、ピクセル/μm で動作します。
- 分析中|[測定値] を設定し、クリックしてセルシェイプ パラメータ (セル面積、周長、図形記述子) を選択します。
- フリーハンド選択ツールを使用して、細胞膜境界をガイドとして使用して、各セルの周りを手動で描画します。
- キーボードのCtrl キー + Bキーを押して、セルのアウトラインをイメージ上にオーバーレイします。各タイムラプス フレームでセルに対して繰り返します。
- 画像を使用する |オーバーレイ |値を格納するには ROI マネージャにします。
- フレームごとの対象のすべてのセルの概要が表示されたら、[測定]をクリックします。結果を .csv ファイルとして保存します。
注: ムービーごとに 10 ~ 20 個のセルを概説し、条件ごとに合計 30 ~ 60 個のセルを分析する必要があります (n = 3)。細胞形状データ(.csvファイル)を使用して、時間の経過に応えて細胞形状のダイナミクスがどのように変化するか(図4C)、または異なる細胞処理下で形態を変更する方法を定量化できます。
結果
ここで示した手順を用いて、マウス胚を子宮から解剖し、胚外組織を除去した(図1A-D)。胚はソマイトをステージングした(5-8ソミテ(ss)で胚のみを使用して、図1E,F)。その後、頭蓋神経板を解剖し、神経上皮を単離した。中皮細胞は、緩い、円形、間葉系細胞として同定され、穏やかにブラッシングされた(図1G-L)。前神経板は全体に移植することができ、その場合、神経堤組織が横に現れ、移植所の周りに放射状に膨張するか、または各神経板境界(右および左)を別々に移植することができる。これは、遺伝的変異体から移植する場合に特に有用である。
24時間以内に、神経板の切除を取り巻く予感(上皮)頭蓋神経堤の領域がはっきりと見える(図2B)。さらに、神経堤細胞の亜集団は間葉転移に上皮を受け、完全に間葉系に見える(図2)。したがって、我々は、中心に神経板(NP)、中間円の予感神経堤(pNC)、および外側リング内の移動神経堤(mNC)の集団を有する、異なる細胞のいくつかの同心円環を有する(図2B)。NC細胞をトレースするために、図2Cに示すように遺伝子組み換えマウスモデルを使用することができる。この場合、ニューラルクレスト固有の Wnt1::Cre を使用しました。ローザmtmGは、NC細胞が緑色で標識される結果となる。これらのマウスでは、細胞はクレレコンビネーゼを発現しない限り、膜トマト(mT、赤色)を発現する。組み換えは、膜緑色蛍光タンパク質(GFP、緑色)を発現する細胞につながる。引き出しの中心に示される赤色細胞は神経板細胞である。一部の後部神経板細胞もGFPを発現する;長期的な培養のために、我々は中心にあるすべての細胞を取り除くだろう。我々の目的のために、引き倒しの純度は、異なる神経堤細胞集団を追跡するのに十分である。神経堤のより高い純度が必要な場合、この遺伝子標識戦略は、集団の純度を確保するために蛍光活性化細胞選別(FACS)と組み合わせることができます。あるいは、移植を修正し、抗体標識を用いてNC集団を同定することができる。
また、24時間までに、先例培養物の予見および完全に渡り目のNC細胞の特徴的な同心円環が、マトリックス選択によって依存せず、また支配されていないことが明らかになった(図3)。ECMベースのヒドロゲルとフィブロネクチンの両方でめっきされた植物培養物は、3つの細胞集団、NP、pNCおよびmNC(図3A、C)を含む、同等の引き抜き構造を形成した。神経堤細胞形態は、ECMベースのヒドロゲルとフィブロネクチン上でめっきされたものの間でも同等であった(図3B,D)。しかしながら、フィブロネクチン上にめっきされた移植は、細胞の先端でより顕著なラメリポジアを持つ細胞を産生し、一見、遊流の方向により偏光しているように見える(図3B,D)。
移動性神経堤細胞の集団が明らかになると、生細胞イメージングを完了することができます。時間経過顕微鏡検査は、NC細胞移動の後続の分析のために10倍倍倍率(18時間、1フレーム/5分)に設定される(図4A)。ImageJ マニュアルトラッキングプラグインは、タイムラプスムービーのすべてのフレームにわたって個々のセルのXY座標を生成します(図4B)。これらの座標は、移行ソフトウェアを使用して処理できます。このソフトウェアは、時間の経過とともに個々のセルトラックの視覚化を可能にし(図4B)、蓄積された距離とユークリッド距離、ならびに細胞速度を定量化するために使用することができる。
タイムラプスイメージングデータはまた、頭蓋神経堤細胞の移動中の細胞形態に関する豊富な情報を提供する(図4C)。個々の細胞膜を概説することにより、細胞面積および周長の測定値は、ムービーのすべてのフレームから計算することができる(図4C)。これらの測定は、細胞面積および円形のその後の定量を可能にする(図4D)。図4Cは、18時間にわたる細胞形状変化の分析を示し、細胞が植生から離れて移動するにつれて、細胞領域が有意に増加し、細胞の循環は比較的一定のままである(一方通行の分散、Tukeyの多重比較試験)(図 4E,F)これは、細胞が上皮縁から離れ、細胞間接点を失うにつれて、細胞拡散領域の増加を示す。細胞循環測定は時間の経過とともに有意に変化しなかった。ただし、時間ポイントの数が増える場合は、循環の短期的な変化が見られる場合があります。細胞循環測定はまた、化学的キューの存在下で、または限られた条件下で細胞形状のダイナミクスに関する興味深いデータを提供することができます。

図1:e8.5胚からの頭蓋神経堤の移植の分離。
画像は、微小解剖技術を文書化したビデオの静止画です。(A-C)子宮からの胚の解剖。(B-C)2つの鋭い鉗子を使用して、筋肉の層をそっと引き離す。パネル(D)は、内臓黄身嚢(黄色い線)の内側に胚を示す。内臓黄身嚢から胚を抽出する。(E)ステージ8.5横における胚の横観。(F)ステージ8.5における胚のドーサル図。胚の年齢を決定するためにソミテ(ss)を数えます。通常5-8 ss(Fの黄色の円)。(G)胚の頭蓋領域をクローズアップします。頭蓋領域から胚膜を除去します。ソミテは黄色い線でマークされます。(H)前神経板の解剖は、第1分岐アーチ(黄色い線)の下で行われる。(I)前神経板解剖の横図神経堤細胞が生じる神経のひだは、黄色い線でマークされています。(J-L)準備された培養皿にNPをめっきする前に、前神経の折り目の下にある中皮組織(ふわふわ間葉細胞)をできるだけ取り除きます。ムービーは、3.0倍ズームで広視野アポクロマティックレンズを備えたステレオ顕微鏡を使用して撮影されました(材料の表を参照)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
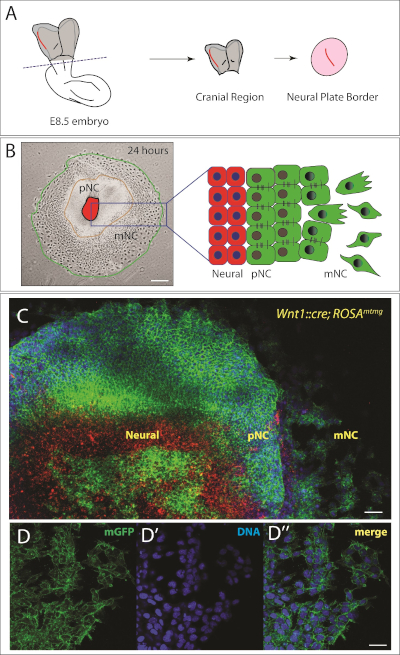
図2:マウス頭蓋神経堤下の外植。
(A) e8.5マウス胚の後視の概略図。胚の頭蓋領域は破線で切断される。神経板境界(赤で強調表示)は、周囲の中皮組織から分離され、頭蓋神経堤が移住できるように24時間培養される。22、23から適応した回路図。(B)左:メッキ後24時間の頭蓋神経堤の代表的明視野画像。細胞の3つの集団が観察され、右側にもスキーマ化されます。NP =神経板、pNC=移動前神経クレストおよびmNC=渡り神経堤。スケールバー = 250 μm.(C)遺伝的に標識されたマウスからの引き裂き物の高い倍率画像 (Wnt1:cre;ローザmTmG)Creドライバのない細胞は、赤色の膜トマト(mT)を発現する。神経堤特異的Wnt1プロモーターの制御下でのCreの発現は、mTカセットの切除および緑色の膜GFP(mG)の発現につながる。核は、(青色で)ホーシュトで染色されています。スケールバー = 200 μm. (D-D')膜GFP(D)を発現する渡り筋細胞の高倍率画像。(D')DNAには、ホーシュト(青色)で標識されています。(D')D と D のマージ。スケールバー = 20 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:異なる基板上で培養した移植物。
(A-B)市販のECM-ヒドロゲル上で培養された移植の相コントラスト画像。(C-D)1 μg/mLフィブロネクチンで培養した移植剤。神経板(NP)、予見(pNC)および移動(mNC)神経紋細胞は、異なる細胞形態によって区別することができる。スケールバー = 100 μm。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:頭蓋神経堤細胞移動と細胞形状ダイナミクスの定量化
(A)単一の神経クレストセルトラックと重ね合わされた離植培養のタイムラプスイメージングからの位相コントラストフレームは、ImageJ/Fiji手動細胞追跡プラグインを使用して、18時間(217フレーム)とXYを手動で追跡した。座標がエクスポートされました。データはオーバーレイドットとラインプロットとして表されます。細胞を1μg/mLフィブロネクチンでめっきした。スケールバー = 200 μm.(B)10mNC細胞の代表的な軌道プロットは、マイグレーションソフトウェアを用いて生成される。(C)植生培養のタイムラプス解析から撮影した位相コントラストフレーム。破線は、1 μg/mLフィブロネクチンでメッキした場合、細胞形状のダイナミクスについて分析された8つの代表的な移動性神経堤細胞の輪郭を描く。スケールバー = 200 μm.(D)セル面積と円弧を定量化するために使用される計算の概略表現。回路図の細胞形態は、青色(C)で強調表示された細胞の形態である。px = ピクセル領域、Npx = ピクセル数、A = 面積、P = 周長 (1 ピクセル = 1.60772 μm2)(E-F)時間の経過に合った細胞領域と細胞循環測定の定量化。データは平均±SEMを表す。各ドットは、3つの独立した実験から採取された1つの細胞(n =60)を表し、0h、6h、12hおよび18hで分析した(ns非有意、*p<0.05、****p<0.001片道ANOVA、Tukeyの多重比較試験)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
哺乳類の神経堤細胞の研究は、哺乳類の発達の子宮の性質のために科学者にとって課題となってきました。生体内研究では、胚は子宮内の生命を模倣する条件下で操作されなければならないので、セットアップすることは困難です。実際には、特にライブイメージングのために、これらの(E8+)胚を24時間より長く再現可能に培養することはほとんど不可能です。さらに、神経堤の誘導と移動は、マウスの神経管閉鎖および胚の回転と同時に起こる。これは、胚が培養ex子宮であるときにしばしば失敗する重要でストレスの多い形態遺伝学的イベントである。したがって、ex子宮アプローチの成功率は一般に低い。不死化NC細胞21の使用は、動物の使用を減らすのに有用なツールであり、長期分析、トランスフェクション、および濃縮研究のための神経堤細胞のより良い供給源を提供しうる。しかし、原発性神経堤細胞を確実に培養する必要があることは明らかに存在する。我々の方法は、マウスノックアウトまたは条件付き遺伝モデルに適用可能である。我々と同等の方法は、他の神経堤集団20について説明されている。しかし、我々の方法は、マウス頭蓋NC細胞の段階的な単離を徹底的に説明する。また、異なる行列の使用と移行分析手順についても詳しく説明します。
一貫した結果を達成するために、胚の選択中にステージングに特別な注意が払われていることがわかりました。当然のことながら、ソミトの数は頭蓋NC発達の異なる段階と相関する。したがって、胚解剖学の知識は、任意の実験データを取得する前に非常に重要です。このアプローチは、生物学的な質問と標的細胞に応じて、神経堤細胞の離散集団を分離する方に適応させることができる。
胚が選択され、解剖されると、中皮細胞は容易に区別することができ、より良い視覚化を可能にし、汚染を減らすために除去する必要があります。長期培養の場合、神経板組織は、神経組織による汚染を防ぐために、めっきの24時間で除去することができる。さらに洗練された方法として、蛍光系統標識(例えば、Wnt1:creまたはSox10::creERTドライバを蛍光レポーター24,25と組み合わせて使用して、神経堤細胞を区別する)を使用することができます。図2Cに示すように他の組織。
以前の報告は、マウスNCの異なるマトリックス上のメッキの可能性を強調しています, 最も一般的に市販のECMヒドロゲルに, フィブロネクチンとコラーゲンI20,21,26.私たちの手の中で、マウス頭蓋NCの外植培養物は、元のレポートで指定された濃度で、3つのマトリックスすべてで正常に成長しています(データは示されていません)。私たちがNCの植生培養に適応した最初の洗練されたアプローチは、主にラミニンとコラーゲンで構成された選択のマトリックスとして商業ヒドロゲルを使用しました21(図 3A-B).しかしながら、このヒドロゲルの組成は明確に定義されず、未知の増殖因子およびタンパク質含有量を有する。そのため、我々はそれ以来、フィブロネクチンにマウスNCの植生培養をめっきするアプローチをシフトしました(図 3C-D).フィブロネクチンは、NC細胞が移動するECMおよび地下膜においてよく定義され、高度に発現されるin vivo28,29,30.ヒドロゲルを用いて見られる神経堤細胞の移動と形態を最もよく複製するフィブロネクチンマトリックスを最適化するために、ヒドロゲルに示されたNC細胞挙動を0.25~30μg/mLフィブロネクチンの滴定と比較し、1 μg/mLフィブロネクチンを定義した。理想的なプロパティを提供します(データは表示されません)。この予備的な研究は、フィブロネクチンのような行列を、以前に説明したもの、すなわちコラーゲンとラミニンと比較するための枠組みを確立するのに役立つと考えています。32,33,34.コラーゲン-IA1がマウス、鳥類およびヒトNC細胞によって内因性分泌されることを考えると、フィブロネクチンとコラーゲンIのマウスNC細胞の渡り容量を比較することは特に興味深いでしょう。28,30,31,32.したがって、コラーゲンIは、マトリックス選択の考慮においてフィブロネクチンと同様に関連する。また、特にメディアの高い血清含有量を考えると、メディアにおける成長因子の生物学的利用可能性が異なるマトリックス成分によって変化する可能性があることを認める価値があります。これを克服するために、現在、無血清定義の培養条件の生産に取り組んでいます。これらの定義された培地は、多能性幹細胞分野の神経堤誘導プロトコルで正常に使用されていますが、NCプラント培養システムのさらなる最適化が必要です。33,34.また、心臓や体幹NCなどの他のタイプのNC細胞の条件を精製し、その後のNC分化の研究の出発点としても役立つ可能性があります。最も重要なことは、このプロトコルは、様々なアプリケーションのための頭蓋NC細胞の分離を可能にします。我々は、指向的な移行、3D移行および侵略に関する研究を想定する。このようにして単離された細胞は治療することができるin vitro多くの分析のために。例えば、細胞は、特定のタンパク質を標的とする異なる低分子を用いて容易に処理することができ、それらは定義された時点で処理することができ、洗い流し実験は細胞行動の回復を決定するように設計することができる(図 4).トランスフェクションおよび分化アッセイのための長期培養は、細胞の通過と同様に可能である(データは示されていない)。しかし、生存率、細胞再生の容量および多能性は、通過後に検証されるべきである。ガラスカバーリップにめっきされた細胞は、ライブイメージングに続いて、免疫蛍光染色プロトコルにも使用できます。最後に、このアプローチは、遺伝的マウスモデルからのNCの移行を研究するための非常に強力なシステムを表します22,23,24,25.
開示事項
著者は利益相反を持っていません。
謝辞
キングス・カレッジ・ロンドン・バイオリバイオサービス・ユニット、特にティファニー・ジャービスとリンジー・カセネラの継続的なサポートに感謝しています。私たちは、このプロトコルの最初の確立時に、デレク・ステンプル、石井守、ロバート・マクソンに助言と試薬の助けに感謝します。我々は、STO細胞のガンマ照射に関する助けをDheraj Taheemに感謝する。Liuとクラウスのラボ、特にトミー・パレットに感謝します。この作品は、BBSRC(BB/R015953/1からKJL/MK)、MRC博士課程研修プログラム(LD)、ニューランド・ペドリー基金(ALM)、KRIPIS II(教育・宗教省)の助成を受けました。事務、ギリシャとフォンダシオンサンテ(SGGMへ)。
資料
| Name | Company | Catalog Number | Comments |
| bFGF | R&D systems | 233-FB | |
| b-mercaptoethanol | Gibco | 31350-010 | |
| Tissue culture flasks | Corning | 430639 | 25cm2 culture flasks |
| DMEM (4500 mg/L glucose) | Sigma | D5671 | |
| Dulbecco's phosphate-buffered saline (dPBS) | Sigma | D8537 | |
| Ethanol | Fisher Chemicals | E/0650DF/C17 | |
| Fetal Bovine Serum | Sigma | TFS AA 10-155 | |
| Fetal Bovine Serum (ES Cell FBS) | Gibco | 26140079/16141-079 | |
| Fibronectin bovine plasma | Sigma | F1141 | |
| Gelatin from bovine skin | Sigma | G9382 | |
| L-glutamine | Sigma | G7513 | |
| Glass-bottomed, multi-well 24-well tissue culture plate | Ibidi | 82406 | Glass-bottomed, No 1.5, 24-well tissue culture dish with black sides |
| Cell migration analysis tool | Ibidi | v2.0 | Manuals for this software can be found at: https://ibidi.com/manual-image-analysis/171-chemotaxis-and-migration-tool.html. |
| Circularity Plug-in | ImageJ | v1.29 or later | The circularity plug-in is an extended version of ImageJ/Fiji’s Measure command, designed by Rasband, W., (2000) (wsr@nih.gov). |
| LIF | ESGRO by Millipore | ESG1106 | |
| Manual Cell Tracking Plug-in | ImageJ | v1.34k or later | ref Cordelieres F. Institut Curie, Orsay (France) 2005 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| MEM non-essential aminoacids 100X | Gibco | 11140-050 | |
| Matrigel (ECM-based Hydrogel) | Corning | 356234 | |
| Microscope | Olympus | 1X81 | Olympus 1X81 inverted microscope |
| Microscope camera | Photometrics | 512B | Photometrics Cascadell 512B camera (4x UPlanFL N, 10x UPlanFL N, 20x UPlanFL N, 40x UPlanFL N objectives) |
| Microscope controller | Olympus | 1X2-UCB | Olympus 1X2-UCB microscope controller |
| Microscope temperature controller | Solent Scientific | RS232 | Maintained at 37°C |
| Penicillin/streptomycin | Sigma | A5955 | |
| Sodium Pyruvate | Sigma | S8636 | |
| Statistics software | Graphpad Prism | v7.0 | |
| STO feeder cells | ATCC | CRL-1503 | |
| Stereomicroscope | Nikon | SMZ | |
| XY microscope stage controller | Applied Scientific Instrumentation (ASI) | MS-4400 |
参考文献
- Duband, J. L. Diversity in the molecular and cellular strategies of epithelium-to-mesenchyme transitions: Insights from the neural crest. Cell Adhesion & Migration. 4, 458-482 (2010).
- Mayor, R., Carmona-Fontaine, C. Keeping in touch with contact inhibition of locomotion. Trends in Cell Biology. 20, 319-328 (2010).
- Le Douarin, N., Kalcheim, C. The neural crest. 2nd edn. , Cambridge University Press. (1999).
- Trainor, P. A. Neural Crest Cells : Evolution, Development, and Disease. , Academic Press. (2014).
- Jiang, R., Bush, J. O., Lidral, A. C. Development of the upper lip: morphogenetic and molecular mechanisms. Developmental dynamics : an official publication of the American Association of Anatomists. 235, 1152-1166 (2006).
- Ahola, J. A., et al. Increased incidence of Hirschsprung's disease in patients with hypoplastic left heart syndrome--a common neural crest-derived etiology? Journal of Pediatric Surgery. 44, 1396-1400 (2009).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463, 958-962 (2010).
- Inoue, K., et al. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation. Annals of Neurology. 52, 836-842 (2002).
- Kim, H., Kang, K., Ekram, M. B., Roh, T. Y., Kim, J. Aebp2 as an epigenetic regulator for neural crest cells. PloS one. 6, e25174(2011).
- Barriga, E. H., Trainor, P. A., Bronner, M., Mayor, R. Animal models for studying neural crest development: is the mouse different? Development. 142, 1555-1560 (2015).
- Bronner, M. E., LeDouarin, N. M. Development and evolution of the neural crest: an overview. Developmental Biology. 366, 2-9 (2012).
- De Calisto, J., Araya, C., Marchant, L., Riaz, C. F., Mayor, R. Essential role of non-canonical Wnt signalling in neural crest migration. Development. 132, 2587-2597 (2005).
- Carmona-Fontaine, C., et al. Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature. 456, 957-961 (2008).
- Matthews, H. K., et al. Directional migration of neural crest cells in vivo is regulated by Syndecan-4/Rac1 and non-canonical Wnt signaling/RhoA. Development. 135, 1771-1780 (2008).
- Banerjee, S., et al. A novel role for MuSK and non-canonical Wnt signaling during segmental neural crest cell migration. Development. 138, 3287-3296 (2011).
- Pryor, S. E., et al. Vangl-dependent planar cell polarity signalling is not required for neural crest migration in mammals. Development. 141, 3153-3158 (2014).
- Serbedzija, G. N., Bronner-Fraser, M., Fraser, S. E. Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development. 116, 297-307 (1992).
- Kawakami, M., Umeda, M., Nakagata, N., Takeo, T., Yamamura, K. Novel migrating mouse neural crest cell assay system utilizing P0-Cre/EGFP fluorescent time-lapse imaging. BMC Developmental Biology. 11, 68(2011).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nature protocols. 6, 1568-1577 (2011).
- Ishii, M., et al. A stable cranial neural crest cell line from mouse. Stem Cells and Development. 21, 3069-3080 (2012).
- Gonzalez Malagon, S. G., Liu, K. J. ALK and GSK3: Shared Features of Neuroblastoma and Neural Crest Cells. Journal of Experimental Neuroscience. 12, 1179069518792499(2018).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9, 1126(2018).
- Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K., McMahon, A. P. Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Current Biology : CB. 8, 1323-1326 (1998).
- Laranjeira, C., et al. Glial cells in the mouse enteric nervous system can undergo neurogenesis in response to injury. Journal of Clinical Investigation. 121, 3412-3424 (2011).
- Pfaltzgraff, E. R., Mundell, N. A., Labosky, P. A. Isolation and culture of neural crest cells from embryonic murine neural tube. Journal Of Visualized Experiments : JoVE. , e4134(2012).
- Sternberg, J., Kimber, S. J. The relationship between emerging neural crest cells and basement membranes in the trunk of the mouse embryo: a TEM and immunocytochemical study. Journal of Embryology and Experimental Morphology. 98, 251-268 (1986).
- Sternberg, J., Kimber, S. J. Distribution of fibronectin, laminin and entactin in the environment of migrating neural crest cells in early mouse embryos. Journal of Embryology and Experimental Morphology. 91, 267-282 (1986).
- George, E. L., Georges-Labouesse, E. N., Patel-King, R. S., Rayburn, H., Hynes, R. O. Defects in mesoderm, neural tube and vascular development in mouse embryos lacking fibronectin. Development. 119, 1079-1091 (1993).
- Henderson, D. J., Copp, A. J. Role of the extracellular matrix in neural crest cell migration. Journal of Anatomy. 191 (Pt 4), 507-515 (1997).
- Thomas, S., et al. Human neural crest cells display molecular and phenotypic hallmarks of stem cells. Human Molecular Genetics. 17 (21), 3411-3425 (2008).
- Greenberg, J. H., Seppa, S., Seppa, H., Hewitt, T. Role of collagen and fibronectin in neural crest cell adhesion and migration. Developmental Biology. 87 (2), 259-266 (1981).
- Leung, A. W., et al. WNT/β-catenin signaling mediates human neural crest induction via a pre-neural border intermediate. Development. 143 (3), 398-410 (2016).
- Zhu, Q., Lu, Q., Gao, R., Cao, T. Prospect of Human Pluripotent Stem Cell-Derived Neural Crest Stem Cells in Clinical Application. Stem Cells International. 2016, 7695836(2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved