Method Article
Человеческие iPSC-производные кардиомиоцитные сети на multiwell микро-электродные массивы для периодических действий Потенциальные записи
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта статья содержит набор протоколов для развития человека индуцированных плюрипотентных стволовых клеток полученных кардиомиоцитов (hiPSC-CM) сетей культивируется на многовеллированных meA пластин для обратимого электропората клеточной мембраны для действия потенциальных измерений. Записи с высокой пропускной прикладом получаются с одних и тех же клеточных сайтов неоднократно в течение нескольких дней.
Аннотация
Скрининг сердечной безопасности имеет первостепенное значение для открытия лекарственных средств и терапии. Таким образом, разработка новых высокопроизводительных электрофизиологических подходов для хиПС-производных кардиомиоцитов (hiPSC-CM) препараты очень необходимы для эффективного тестирования на наркотики. Хотя мультиэлектродные массивы (МЭА) часто используются для полевых потенциальных измерений возбудимых ячеек, недавняя публикация Джоши-Мукерджи и его коллег описала и подтвердила его применение для периодических записей потенциала действий (AP) от той же подготовки hiPSC-CM в течение нескольких дней. Цель здесь заключается в предоставлении подробных пошаговых методов для посева CMs и для измерения волн AP с помощью электропорации с высокой точностью и временным разрешением 1 кв. Этот подход направлен на решение проблемы отсутствия простой в использовании методологии для получения внутриклеточного доступа к измерениям ВЫСОКОй пропускной способности AP для надежных электрофизиологических исследований. Подробное рабочее течение и методы покрытия hiPSC-CMs на многовеллированных пластинах MEA обсуждаются, подчеркивая критические шаги, где это уместно. Кроме того, специально созданный сценарий MATLAB для быстрой обработки данных, извлечения и анализа сообщается для всестороннего исследования анализа формы волны для количественной оценки тонких различий в морфологии для различных параметров продолжительности AP, вовлеченных в аритмии и кардиотоксичности.
Введение
Человеческие индуцированные плюрипотентные кардиомиоциты стволовой клетки (hiPSC-CMs)являются золотым стандартом для все большего числа лабораторий 1,2,3,4,5,6 ,7,8,9,10. Избиение эмбриональных тел11,12,13 и монослой3,7,10,11,12, 13,14,15,16,17 дифференциации являются предпочтительными методами для производства кардиомиоцитов и мультиэлектродный массив (MEA) стал общим модальностью для мониторинга электродинамики этих сетей18,19,20. В то время как параметры, которые могут быть извлечены из полевых потенциалов (FPs), таких как скорость избиения, амплитуда, продолжительность и интервалы RR являются базовыми электрофизиологическими реакциями спонтанно избиение монослой18,21, 22,23, действия потенциал (AP) компонентов, лежащих в основе этих внеклеточных сигналов FP трудно экстраполировать24. Наша недавняя публикация об открытии применения MEAs для прямых периодических измерений AP является доказательством методологии для образцовых внутриклеточных AP с помощью обширного анализа волн на различных фазах реполяризации по нескольким партии hiPSC полученных кардиомиоцитов сетей3. В исследовании мы показали, что доставка электропоравливых импульсов в сети кардиомиоцитов, полученных из hiPSC, обеспечивает внутриклеточный доступ к записям AP. Эти переходные записи AP зависят от трансмембранных потенциальных восстановления наблюдается через травмы сайте3,25,26. Waveforms, записанные через MEA и патч-зажим в нашем исследовании показали аналогичные морфологии AP, таким образом, проверки надежности подхода3.
Несколько лабораторий сообщили измерения APs из различных электрогенных клеток с использованием пользовательских MEAs18,21,26,27,28,29, 30, но надежность использования MEA для последовательных и периодических измерений AP не была оценена. В настоящее время, золотой стандарт патч-зажим техника ограничивается терминалзаписи7,31 в то время как, MEA основе AP измерения являются переходными и, следовательно, может быть проведена несколько раз на той же ячейке. Мы также показываем, что можно легко записывать высококачественные сигналы AP в диапазоне милливольт, требующих минимальной фильтрации. Поэтому исследователи могут проводить не только острые, но и хронические исследования наркотиков в тех же препаратах с использованием MEAs. Кроме того, эта технология позволяет одновременное измерение FP /AP генерации электро-биом библиотек в короткий период времени. Учитывая растущий акцент на прогнозирование аритмии и связанных с наркотиками кардиотоксичности24,32,33,34,35, интеграция AP измерения подходы повысят безопасность лекарственных средств и оценку эффективности.
Здесь мы представляем протоколы для 1) предварительное покрытие криоконсервированных hiPSC-CMs для созревания, 2) диссоциации и покрытия hiPSC-CMs на multiwell MEAs, 3) запись FPs и APs от сетей hiPSC-CM, 4) сегментации и извлечения данных для анализа, и 5) восстановление массивов для многократного повторного использования. Каждый шаг был оптимизирован, подчеркивая критические шаги, где бы это ни было уместно. Обсуждаются требования к клеточной привязанности для обеспечения избиения синцитиального монослойного и процедуры многофункционального восстановления МЕА для повторяющихся электрофизиологических исследований. Наконец, пользовательский графический интерфейс, разработанный в лаборатории, представлен для извлечения сигналов AP, обеспечения качества и обработки рабочего процесса для количественной оценки и анализа параметров AP.
протокол
1. Подготовка решений и материалов (см. Таблицу материалов)
-
6-хорошо ткани-культуры пластины покрытия
- Оттепель покрытие субстрат на льду или при 4 градусах Цельсия.
- Приготовьте 1:100 разбавления субстрата покрытия в холодной среде DMEM/F12. Смешайте раствор медленным пипетки.
- Передача 2 мл раствора подстилки покрытия (шаг 1.1.2) на скважину 6-хорошо ткани культуры пластины.
- Немедленно поместите пластину культуры покрытой тканью в инкубаторе культуры клеток на уровне 37 градусов по Цельсию и 5% CO2 в течение не менее 7 ч и используйте в течение 7 дней.
-
hiPSC-CM культуры среды
- Добавьте 10 мл дополнения CM media, размороженной при 4 кв. м до 500 мл базовой среды CM. Хранить при 4 градусах по Цельсию в течение 2 недель.
- Aliquot требуется количество носителей в течение дня и довести до комнатной температуры перед использованием.
- hiPSC-CM оттаивая среды: Подготовка свежей путем смешивания hiPSC-CM культуры среды (шаг 1.2) с 10% плода крупного рогатого скота сыворотки (FBS). Доведите носители до комнатной температуры до оттаивания CMs для подвески.
- Фибронектин 1 мг/мл бульонного раствора: Aliquot 200 л в 1,5 мл стерильных микрофуговых труб и хранится при 4 градусах По Цельсия для последующего использования. Приготовьте рабочий раствор концентрации 50 мкг/мл на льду.
- Раствор для очистки multiwell: Смешайте 0,5 г ферментативного моющего средства с 50 мл стерильной двойной дистиллированной воды (ddH2O). Вихрь смешать содержимое. Фильтр и хранить при 4 градусах По Цельсию в течение недели.
2. Предварительное покрытие криоконсервированного hiPSC-CM для созревания (рисунок 1)
ПРИМЕЧАНИЕ: Этот раздел предназначен для оттаивания и культивирования hiPSC-CMs,которые были дифференцированы с помощью метода монослойной подачи 3,16 и криоконсервированных в жидком азоте 10 дней после дифференциации на 1-2 миллиона клеток / флакона. Клетки из одного флакона покрываются двумя колодцами с покрытием субстрата 6-ну хорошо. Кардиомиоциты, как правило, оседают в нижней части трубки так нежное смешивание во время предварительного покрытия имеет важное значение для достижения даже плотность клеток через скважины.
- Aliquot 2 мл FBS на флакон hiPSC-CMs время оттаяли в 15 мл конической трубки и довести до комнатной температуры.
- Оттепель флаконы криоконсервированных hiPSC-CMs, поместив их в воду 37 градусов и кружащите осторожно даже для оттаивания не более 3 мин.
- Немедленно перенесите содержимое флакона в трубку, содержащую FBS (см. шаг 2.1), смешайте путем закрученного и центрифуги при 200 х г в течение 5 мин.
- Приготовьте супернатант и resuspend клетки гранулы в 1 мл hiPSC-CM оттаивания среды (см. шаг 1.3) за флакон оттаяли. Используйте передачу пипетки, чтобы приостановить гранулы нежным тритурированием. Оцените жизнеспособность клеток.
- Добавить дополнительные 3 мл оттаивания среды на флакон hiPSC-CM оттаяли в шаге 2.4 и приостановить мягко с помощью передачи пипетки для дальнейшего разъединения ячейки сгустки.
- Распределите 2 мл клеточной подвески мягко в каждый колодец субстрата покрытием 6-колодистые пластины (см. шаг 1.1). Место в инкубаторе культуры клеток при 37 градусах По цельсии и 5% CO2.
- Заменить на свежий hiPSC-CM культивирования среды после 24 ч и 3 раза в неделю после этого в течение 20 дней.
ПРИМЕЧАНИЕ: Клетки должны придерживаться подстратного покрытия на 24 ч и бить спонтанно на 48 ч после покрытия (см. видео 1 и видео 2).
3. Многофункционная стерилизация и покрытие пластины MEA (рисунок 2 и рисунок 3)
ПРИМЕЧАНИЕ: Протокол, описанный здесь для подготовки 24-хорошо MEA пластин с 12 микро-золото PEDOT покрытием электродов на стекле для hiPSC-CM покрытие. Избегайте прикосновения к нижней части пластины, так как это может повредить электроды.
- За два дня до клеточного покрытия добавьте 0,5 мл среды культуры hiPSC-CM (см. шаг 1.2) к каждой скважине и выполните базовую запись для проверки соотношения сигнала к шуму для проверки качества МПС.
- Аспирировать средства массовой информации, промыть стерильным ddH2O и стерилизовать под ультрафиолетовым светом внутри ламинарного потока капот на ночь.
- За день до клеточного покрытия, добавить 0,1 мл FBS к каждой скважине для гидрофильной обработки поверхностей МЭА. Инкубировать в течение 30 минут при комнатной температуре. Этот шаг необходим для вложения ячейки.
- Аспирировать FBS и промыть с 0,5 мл стерильных ddH2O в скважине. Повторите еще раз.
- Оставьте тарелку высохнуть в ламинарном капоте на ночь.
- Подготовьте рабочий разбавление 50 мкг/мл фибронектина в холодном среде DMEM/F12 из запаса (см. шаг 1.4). Держите раствор на льду.
- Пипетка 5 Зл рабочего разбавления фибронектина (см. 3.6) и тщательно распределить капельку в центр каждого колодца, чтобы покрыть все 12 электродов. Важно быстро работать через 24 скважины, чтобы предотвратить высыхание капель.
- Немедленно поместите фибронектин покрытием многовелл MEA пластины на поднятой поверхности внутри увлажняющей камеры, содержащей стерильные ddH2O, чтобы покрыть всю поверхность блюда. Поместите камеру с многослойной пластиной MEA на 3 ч в инкубаторе клеточной культуры.
ПРИМЕЧАНИЕ: Размещение 24 хорошо MEA пластины в увлажняющей камере имеет решающее значение для предотвращения фибронектина капель от высыхания в инкубационный период.
4. hiPSC-CM диссоциации и покрытие на Multiwell MEA пластины (рисунок 3)
ПРИМЕЧАНИЕ: Начните этот шаг около 1 ч до MEA фибронектин инкубации завершена. Убедитесь, что раствор диссоциации ячейки находится на уровне 37 градусов по Цельсию, а среда оттаивания iPSC-CM находится при комнатной температуре. Методы диссоциации были оптимизированы в течение 30 дней после дифференцированного hiPSC-CMs, культивируемого на подложке покрытием 6-ну скважинных пластин (см. шаг 2), чтобы получить около 90% жизнеспособных CMs для покрытия MEA. Следует позаботиться о том, чтобы не вводить пузырьки воздуха при тритурации, чтобы предотвратить гибель клеток.
- Аспирировать культуры среды от каждого колодца из 6-хорошо ткани культуры блюдо с 30 дней после дифференцированного hiPSC-CM культуры (см. шаг 2.7) и мыть с 2 мл стерильных D-PBS в хорошо.
- Добавьте 1 мл предварительно разогретого раствора диссоциации клеток (см. ТаблицуМатериалов) на скважину и инкубацию в течение 4 мин при 37 градусах Цельсия. Используйте передачу пипетты, чтобы аккуратно triturate ослабить клетки для диссоциации. Если большинство клеток все еще придерживаются, инкубировать еще 3 мин при 37 градусов по Цельсию и triturate снова. Эта дополнительная инкубация должна помочь для максимального восстановления клеток. Не инкубировать в течение более 7 минут, как это может привести к низкой жизнеспособности клеток.
- Используя передачу пипетки, объедините все разрозненные ячейки в коническую трубку, содержащую среду оттаивания hiPSC-CM (см. шаг 1.3). Рекомендуется приостанавливать работу клеток в по крайней мере в два раза больше, чем в том, что средства массовой информации (2 мл на хорошо собираются), чтобы заблокировать активность раствора диссоциации клеток.
- Центрифуга при 200 х г в течение 5 мин.
- Тщательно прикрепите раствор, так как гранулы слабо прикрепляются к поверхности и повторно прикрепляются в 0,1 мл оттаивательной среды hiPSC-CM. Используйте передачу пипетки, чтобы приостановить гранулы несколько раз нежной трикуляции.
- Aliquot 2 л диссоциированных клеток и разбавляют 18 л носителей в микрофуговой трубке 1,5 мл. Добавьте 20 зл трипан синий и перемешать для подсчета клеток и оценки жизнеспособности.
- Отрегулируйте плотность клеток до 6000 ячеек/ЗЛ, добавив соответствующий объем среды оттаивания hiPSC-CM. Приостановить гранулы нежным щелкать несколько раз. HIPSC-CMs легко отделить от стеклянных поверхностей особенно когда покрывало на высокой плотности. Мы оптимизировали плотность посева и условия покрытия для достижения 15 дней электрических записей.
- Когда готовы, принести multiwell MEA пластины в ламинарный капот потока для посева клеток. Очень важно выполнить следующие два шага один хорошо в то время, чтобы предотвратить фибронектин от сушки.
- Тщательно удалите капельку фибронектина с помощью пипетки P10, не касаясь электродов.
- Немедленно раздайте капельку клеток 5 л (30 000 клеток) к центру скважины пластины MEA, покрывающей все 12 электродов. Повторите шаг до тех пор, пока все 24 скважины не будут покрыты. Рекомендуется прерывистое смешивание клеточной подвески путем щелчка.
- Поместите многофункциональную пластину MEA обратно в слабо покрытую увлажняющую камеру и вернитесь в инкубатор клеточной культуры при 37 градусах Цельсия и 5% CO2 на 3 ч для вложения клеток.
- Аккуратно добавьте 200 л оттаивания hiPSC-CM среды к каждому колодцу, не нарушая клетки с помощью пипетки P200. Добавить средства массовой информации dropwise в сторону колодца.
- Поместите многофункционтную пластину MEA обратно в инкубатор клеточной культуры.
- Замените свежей средой культуры hiPSC-CM на 24 ч после покрытия. Спонтанное избиение кардиомиоцитов можно наблюдать в этот момент (см. Видео 3).
- Меняйте носители каждые 2 дня до окончания экспериментов.
5. hiPSC-CM электропорации и получения сигнала (рисунки 4 - 6)
ПРИМЕЧАНИЕ: Этот протокол предназначен для одновременной записи сигналов высокой пропускной связи (12 участков для каждой из 24 скважин). 24-хорошо multiwell MEA система используется с приобретением программного обеспечения (см. Таблица материалов). Все записи MEA проводятся при 37 градусах Цельсия.
- Включите доску интерфейса и инициируйте программное обеспечение для приобретения. Разрешить достаточно времени для multiwell MEA headstage, чтобы достичь температуры 37 градусов по Цельсию (см. стрелку No 1 на рисунке 4).
- Вставьте multiwell MEA пластины от шага 4 в multiwell MEA headstage, поместив его покрыты над платформой записи и нажмите кнопку Вставить (см. стрелку No 2 в Рисунок 4). Разрешить для температуры, чтобы стабилизироваться перед началом записи.
-
Отрегулируйте настройки приобретения и электропорации
- Нажмите на значок Define Experimental Flow (см. стрелку No 3 на рисунке 4)и установите время записи до 2 мин или по желанию.
- Нажмите на значок настройки приобретения данных (см. стрелку No 4 на рисунке 4)и установите частоту выборки до 20 кГц, фильтр высокого прохода до 0,1 Гц и фильтр с низким проходом до 3500 Гц.
- Нажмите на значок «Настройки стимулятора» (см. рисунок5). Под вкладкой «Определение стимула» определите стимуляцию как двухфазные симметричные импульсы напряжения 1 мВ, 1 мс и 1 Гц. Под вкладкой Стимуляция Электроды, выберите электропорации сайтов, подчеркнув все соответствующие электроды.
- Нажмите кнопку «Исследуйте», чтобы визуализировать сигналы во всех скважинах. Проверьте качество сигнала и стабильные условия состояния. Делать заметки на электродах с fp-сигналами в диапазоне mV. Нажмите ту же кнопку, чтобы остановить исследование. До этого момента данные не были зарегистрированы.
- Начните запись, нажав на кнопку Go! Электроды в каждой скважине будут отображать fp сигналы в окне необработанных данных(рисунок 6). После 30 с записи, нажмите на кнопку Стимулирование и позволяют электропорации состоится на выбранных участках в течение 30 с; затем нажмите на ту же кнопку, чтобы остановить стимуляцию и продолжить запись для остальных 60 с.
ПРИМЕЧАНИЕ: Записанный файл можно воспроизвести, переключившись на 'Режим переплета' в меню выпадения приложений.
6. Multiwell MEA очистка пластин для повторного использования
- После финальных экспериментов очистите все колодцы в многоцветной пластине, успокоив все содержимое носителя от каждого колодца и тщательно избегая прикосновения к поверхности электрода.
- Добавьте 1 мл стерильных ddH2O в скважину. Аспирируй и повторяй один раз.
- Добавьте 0,3 мл раствора для многоскважинной очистки (см. шаг 1.5) на скважину. Инкубировать ночь при комнатной температуре, чтобы выбить клетки и мусор.
- На следующее утро, аспирировать раствор и промыть 1 мл стерильных ddH2O. Инкубировать в течение 5 - 7 мин и аспирировать. Повторите 5 раз.
- Добавьте 0,5 мл стерильного ddH2O в скважину. Запись базового уровня очищенной многоскважинной пластины для проверки качества очищенных МСП(рисунок 7).
- Хранить при 4 градусах по Цельсию до готовности к использованию.
7. Конверсия и экспорт файлов данных
ПРИМЕЧАНИЕ: Для каждой записи будут созданы четыре файла данных: MWR, MWC, MWD и MWS. Используя преобразовательное программное обеспечение, файл MWD может быть преобразован в файл H5 для последующего анализа с помощью специально созданного скрипта (см. Дополнительный файл1).
- Инициировать преобразователь программного обеспечения (см. Таблица материалов).
- Выберите «Путь ввода набора» из меню файла. Выберите папку, содержащую файлы данных, представляющие интерес.
- Выберите путь вывода набора из меню файла. Выберите папку, в которой должны быть сохранены конвертированные файлы.
- Выделите файл mwD интереса.
- Нажмите на кнопку EXPORT на HDF5.
8. Сегментация и анализ данных (рисунки 8-10)
ПРИМЕЧАНИЕ: Пользовательское программное обеспечение на основе Matlab используется для сегмента и извлечения различных параметров данных FP и AP. Программное обеспечение доступно по запросу.
- Запустите код анализа формы волны с помощью Matlab (см. рисунок 8 для просмотра основного окна GUI).
- Нажмите на файл и выберите Процесс .h5.
- Найти и выбрать файл mwd.h5, созданный в соответствии с шагом 7 выше.
- Нажмите на кнопку Сохранить каталог, чтобы изменить место хранения выходных файлов.
- Создайте очередь обработки сигналов, выбрав комбинации электрода/скважины, представляющие интерес, а затем нажав на кнопку Очередь. Повторите этот шаг, чтобы приложить больше комбинаций электродов/колодцев, которые будут обработаны в очереди.
- Отображите очередь, нажав непосредственно на Med Name / Med Концентрация, если клетки были обработаны с наркотиками (Рисунок8).
- После того, как очередь будет окончательной, нажмите кнопку Инициализация waveforms. Это позволит начать предварительную обработку, в которой сигналы идентифицируются и извлекаются для сегментации.
- Нажмите на кнопку Увеличить в и выберите действия потенциальной области, представляющие интерес с курсором (Рисунок 9).
- Нажмите кнопку Keep и просмотрите панели. Пики (красные 'x') и желоба (желтые круги) обнаруживаются для каждой формы волны и накладываются нормализованные потенциалы действия. Нажмите кнопку Keep и перейдите к следующему следу в очереди (рисунок10).
- Повторите шаги 8.8-8.9 для остальной части сигналов комбинации электрода/скважины в очереди.
ПРИМЕЧАНИЕ: Файл .csv будет сгенерирован с параметрами APD, измеренными для каждой формы волны. Файл .mat для каждого файла .h5 также сохраняется, чтобы обеспечить дополнительную обработку сегментированных данных.
Результаты
Жизнеспособность и плотность покрытия пост-оттепельных hiPSC-CMs имеет решающее значение для многофункциональной культуры MEA. Предварительное покрытие 1-2 миллионов hiPSC-CMs/флакальной в две колодцы 6-ну хорошо ткани культуры пластины с 50% или большей жизнеспособностью будет производить здоровую культуру монослой с спонтанным избиением на 48 ч. Плохая жизнеспособность СМ приведет к культурам с высоким процентом не миоцитных популяций. Эти монослои, когда разъединяются для многообразного покрытия MEA обычно производят противоречивые результаты и сигналы плохого качества и, следовательно, должны быть отброшены. На рисунке 1 показаны примеры оптимальных по сравнению с субоптимальными культурами hiPSC-CMs на 48 ч после покрытия. Таяние CMs на субстрата покрытием ткани культуры пластин, а не непосредственно на multiwell MEAs, позволяет для восстановления клеток и созревания3. Прямое покрытие криоконсервированных CMs на массиве не рекомендуется, поскольку это дало противоречивые результаты.
В дополнение к качеству разъединенных КМ, вложение клеток на multiwell MEA сильно зависит от плотности клеток и техники покрытия фибронектина. Размер капли фибронектина имеет решающее значение, поскольку CMs будут соответствовать границам области с покрытием фибронектина. По этой причине, только 5 зЛ фибронектина раствора распределяются непосредственно над областью электродного массива. Чтобы капля не рассеялась, поверхность колодца должна быть полностью сухой во время покрытия. На рисунке 2 показана планировка многофункциональной пластины MEA со схемами поэтапной предварительной обработки для оптимальной подготовки. Кроме того, для предотвращения фибронектина от сушки многовеллы MEA пластины должны быть помещены в увлажняющую камеру в инкубационный период продолжительностью не более 3 ч (см. шаг 3.8). После того, как инкубационный период завершен, важно, чтобы удалить фибронектин капли из каждого колодца непосредственно перед CM покрытие и только после этого перейти к следующему хорошо покрытие. Быстрая и тщательная работа по распределению CMs является ключом к успешному вложению клеток.
hiPSC-CM культур на 30 дней после дифференциации разобщены для многофункциональных MEA покрытие с использованием метода диссоциации ферментативных клеток (см. шаг 4). CMs будут прикрепляться к фибронектин покрытием MEA поверхностей на 3 ч и монослой, охватывающий массивы будут видны после 24 ч после покрытия(Рисунок 3). Синхронное избиение монослой будет наблюдаться при 24-48 ч. Дисперсия капельной клетки повлияет на плотность культуры или даже приведет к высыханию и гибели клеток. Точное размещение ячейки непосредственно на массиве имеет первостепенное значение, и поэтому метод должен практиковаться для оптимального покрытия. Сливка ячеек к эталонного электрода будет препятствовать выработке электрического сигнала. Смотрите Рисунок 3 для изображений оптимального размещения CM, и культуры после 24 ч.
CMs, культивированные на многофункциональных МЭА, подвергаются проверке качества на электрическую активность при 48 ч после покрытия. Как правило, амплитуда сигнала FP увеличивается от диапазонаЗВ до мВ примерно за 4 дня 3. Если 50% электродов в сети и 70% от общего числа сетей не производят fp сигналов, то сеть или культура являются неоптимальными и должны быть отброшены. Для анализа FP и AP обрабатываются только культуры, которые проходят проверку качества. На рисунке 6 показаны примеры хороших и нестандартных сигналов FP.
Электропорация опосредованных AP записи могут быть получены несколько раз из культур 48 h после MEA покрытие. Используя электропорацию, мы получили внутриклеточный доступ к рекордным АП с высоким разрешением из нескольких сетей кардиомиоцитов, полученных из hiPSC. Низковольтные импульсы (1 В, 1 мс, 1 Гц) на 30 с были доставлены для переходного, обратимого преобразования FP в AP. Электропорация обеспечивает успешный внутриклеточный доступ для измерения AP примерно в 75% электродов. Электрические сигналы регистрируются в течение 2 минут, которые включают 30 с преэлектропорации, 30 с во время и 1 мин постэлектропореации. Поезд 10 s AP waveforms 10 s постэлектропорации оцениваются на всех участках для качества сигнала и анализа. Любые следы, не соответствующие чистому сигналу AP, отбрасываются. Чтобы исследовать, если амплитуды AP коррелируют с fp сигнала мы электропонавсе все 288 сайтов одновременно записывать волны. Представитель FP и AP сигналы, записанные с одного и того же места ячейки из двух различных электродов показаны на рисунке 11A. Мы не наблюдали корреляции между амплитудой FP и пост-электропорация ap амплитуды, записанные из того же места клетки. Кроме того, несколько электропораций одного и того же участка клеток на 0, 24, 48, 72 и 96 ч не оказали существенного влияния на форму AP с течением времени(рисунок 11B).
Учитывая высокопроизводительный характер системы, ручная техника для извлечения и количественной оценки параметров, представляющих интерес, таких как интервал RR, мгновенная частота и потенциальное действие действия неэффективны и отнимают много времени. Специально созданный сценарий MATLAB, доступный научному сообществу по запросу, используется для выполнения измерений формы волны с разрешением 1 х. Точки времени электропорации накладываются извлеченным сигналом для определения 10 с ap постэлектропорации для проведения извлечения сигнала, гарантии качества и процесса сегментации(рисунок 8, Рисунок 9, Рисунок 10). Пользовательский интерфейс позволяет подбирать нужный сегмент с использованием накладных индикаторов электропорации в качестве руководства. Сегментированная волновая форма обрабатывается подпрограммами для дальнейшей идентификации отдельных волн AP. Это завершается за счет обнаружения пика, где для каждого цикла идентифицируется самое высокое и самое низкое напряжение. Как только этот процесс завершен, амплитуды нормализуются, а связывающие сяпереносные векторы времени смещаются, чтобы определить нулевое время при пиковом значении 1. Для определения измерений APD использовалась интерполяция точек пересечения по отдельным циклам. Таким образом, частичный рабочий процесс автоматизации для сегментации волн AP позволяет эффективно анализывать данные для различных параметров APD в нескольких партиях культур в течение короткого периода времени. Продолжается дальнейшая автоматизация критериев включения и исключения для ПП и СП для анализа данных в режиме реального времени.
Существенным преимуществом многофункциональной пластины MEA является то, что она может быть повторно использована несколько раз. Это восстановление позволяет проводить повторяющиеся электрофизиологические исследования для экономически эффективного и последовательного сбора данных. Записи APs из того же массива после 6 реставраций отображаются на рисунке 12. Соотношение сигнала к шуму аналогично во многих повторном использовании. Чтобы продемонстрировать надежность массива для повторяющихся электрофизиологических исследований, в общей сложности 3815 волн AP объединяются из трех серий восстановления и AP данные о продолжительности извлекаются для изучения повторяемости результатов. Распределительные участки для отдельных волновой формы APD30, APD80, триангуляция (APD80-APD30) и дробное сокращение ((APD80-APD30)/(APD80)) отображаются (рисунок13).

Рисунок 1: Предварительное покрытие криоконсервированного hiPSC-CM для созревания. (A) Обработка клетки для pre-plating 1 флакон 10 дней столб-дифференициации криоконсервированный hiPSC-CMs. (B) Фазовые контрастные изображения успешных (слева) и неудачных (справа) культур hiPSC. Шкала бар: 275 мкм. Смотрите видео 1 и видео 2 для успешных примеров культуры 14 и 24 дней после дифференциации. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Multiwell MEA установки пластины и подготовки. (A) Схема пластины Multiwell MEA: Пластина состоит из 24 скважин (A1 через D6), каждая из которых содержит 12 микроэлектродных массивов и 4 периферических эталонных электродов. Диаметр электрода: 30 мкм / Расстояние между электродами: 300 мкм. Записи могут быть получены из 288 электродов одновременно. (B) Стерилизация и гидрофильные меры лечения, которые должны быть проведены до hiPSC-CM покрытие. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: диссоциация hiPSC-CM и покрытие на пластине Multiwell MEA. (A) Схема hiPSC-CM MEA покрытие шаги для каждой скважины. (B) Микроскопическое изображение, иллюстрирующее правильное размещение капель клетки, охватывающих все 12 электродов, не распространяясь на 4 эталонных электрода. (C) Фазовый контраст микроскопических изображений образцового (слева) и субоптимального (справа) hiPSC-CM, плагиат на MEA на 24 ч после покрытия. Шкала бар 275 мкм. Смотрите видео 3 для успешного примера meA покрытия. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
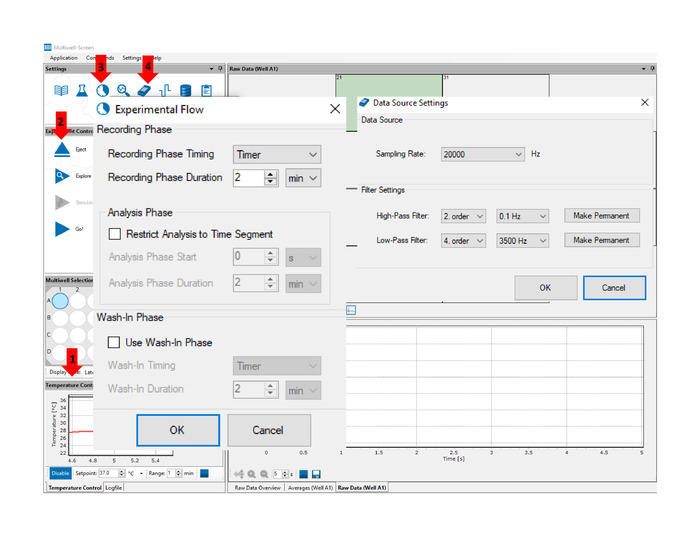
Рисунок 4: Многофункциональный экран приобретения программного обеспечения. Стрелки указывают расположение ключевых объектов и функций, упомянутых в тексте: панель контроля температуры (1) позволяет осуществлять мониторинг температуры в режиме реального времени на протяжении всего эксперимента. Вставьте/Эшутировать (2) кнопку задействовать и освободить Multiwell MEA плиты. Функция Define Experimental Flow (3) позволяет пользователю определить продолжительность записи. Функция настройки обработки данных (4) позволяет пользователю устанавливать настройки скорости выборки и фильтра приобретения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: hiPSC-CM электропорации и приобретения сигнала . Вкладка «Определение стимула» позволяет пользователю определить параметры электропорающего импульса. Вкладка стимуляции Электродов позволяет пользователю выбрать электропоющие электроды. Любая комбинация 288 электродов может быть выбрана. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Проверка качества Мультивелл МЭГ для электрической активности. Multiwell- Программное обеспечение для приобретенияэкрана, показывающее необработанные окна данных с репрезентативными примерами оптимального (A) и нестандартных сигналов FP. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
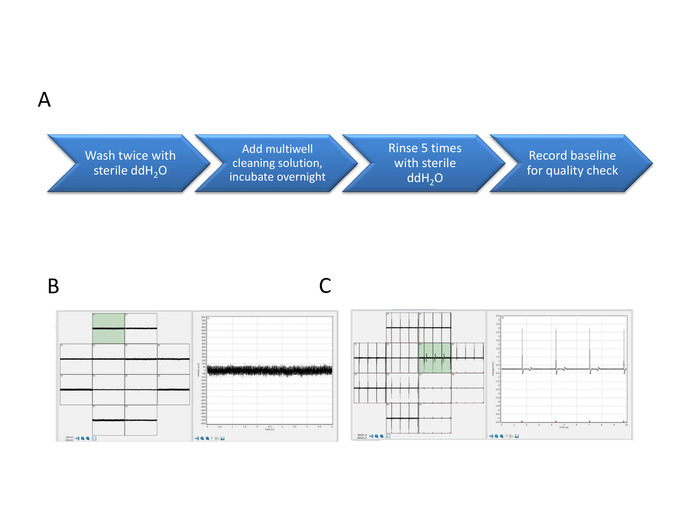
Рисунок 7: FP и AP сигналы от нового и восстановленного массива. Multiwell MEA ферментативнойочистки шаги (A ). Базовый сигнал нового массива показывает минимальноесоотношение сигнала к шуму (B) и FP сигналы показывают электрическую активность сети (C). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
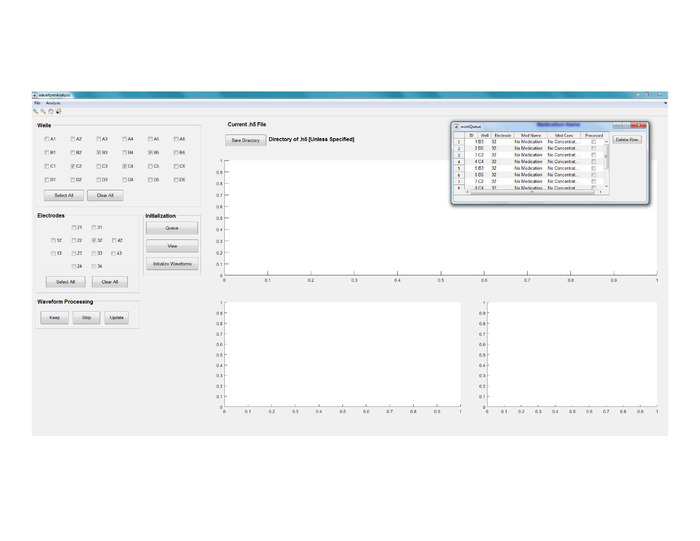
Рисунок 8: сегментация и анализ данных. Вид основного окна GUI для анализаволн. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 9: сегментация и анализ данных. Инициализируйте кнопку Waveforms для выявления и извлечения волнap для сегментации и начала предварительной обработки путем увеличения и выбора потенциальной области действия, представляющих интерес. Красные круги являются индикаторами электропорации. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 10: сегментация и анализ данных. Пики (красные 'x') и желоба (желтые круги) обнаруживаются для каждой формы волны, а нормализованные APs накладываются для проверки качества волновых форм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 11: Зависимость AP Amplitude от сигнала FP для нескольких записей с одного и того же места ячейки. FP амплитуда в диапазонах ЗВ (A, верхняя левая панель) или м. диапазонов (A, верхняя правая панель), записанные из двух независимых электродов производить AP амплитуда в диапазоне м. (A, нижняя левая и правая панели), показывая никакой корреляции между FP амплитуды и постэлектропорации А.П. амплитуда. Нормализованные формы волн AP для каждой записи накладываются, как показано для каждой записи. Множественные электропорации одного и того же участка клеток на 0-96 ч даливысококачественные волны AP, позволяющие отслеживать мембранную электродинамику (B). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
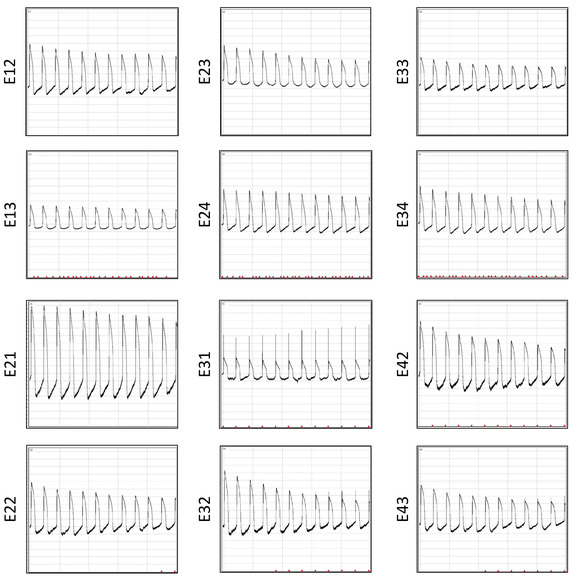
Рисунок 12: ЗАПИСи AP после шести реставраций. Отображаются волны AP, зарегистрированные одновременно 10 с постэлектропорацией через 12 электродов из одного и того же колодца. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
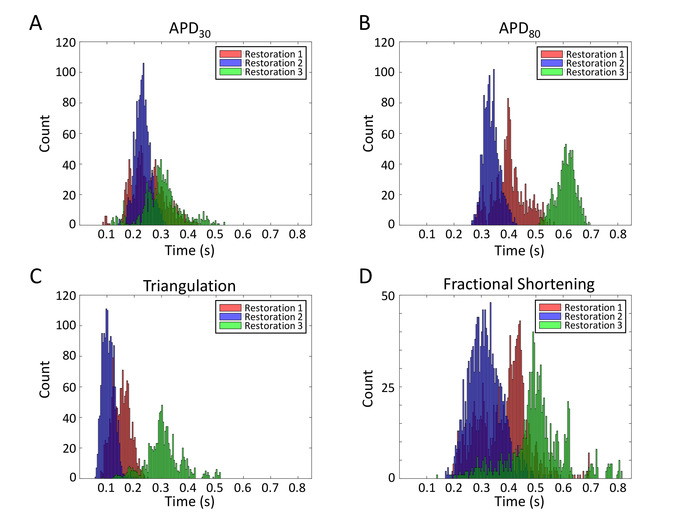
Рисунок 13: гистограммы параметра APD от нескольких реставраций. Распределение участков для индивидуальной формы волныAPD30 (A ), APD80 (B), триангуляция (APD80-APD30) (C) и дробное сокращение (APD80-APD30)/(APD 80 )/(APD80)) (D) отображаются. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительные файлы. Видео 1-3. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
На протяжении многих лет применение МСП ограничивалось проведением измерений FP возбудимых клеток для изучения их электрофизиологических свойств36,37,38,39. Лишь несколько групп сообщили AP следы от электрогенных клеток с использованием пользовательских MEA на основе технологии18,29,30. Однако эти подходы не были исследованы на предмет повторных записей из одних и тех же препаратов. Мы разработали инновационную и точную методологию для изучения APs с одного и того же сайта ячейки в течение нескольких дней в нескольких сетях hiPSC-CM одновременно3. В нашем опубликованном исследовании, многовелл микро-золото MEA платформа была использована для создания AP волновой библиотеки из нескольких партий hiPSC-CM культур с высокой точностью и с временным разрешением 1 х. Описанный здесь протокол объясняет посев hiPSC-CMs на массиве для эффективного развития синцитиальных сетей CM для высокопроизводительных записей AP. Несколько критических шагов в протоколе: 1) производство нескольких высокой чистоты партий качества контролируемых CMs для криоконсервации банковской, 2) весьма жизнеспособным после оттепели CMs для предварительного покрытия и созревания, 3) лечение многоскважины MEA пластины для CM посева, 4) hiPSC-CM культуры диссоциации на 30 дней после дифференциации для MEA покрытие, и 5) восстановление MEAs для многократного повторного использования.
Важно отметить, что разновидность пакетных партий в дифференциации hiPSC может повлиять на экспериментальные результаты. Монослойный метод дифференциации был оптимизирован в доме длявысокопроцентного производства кардиомиоцитов 3,40. Анализ FACS маркеров MLC2v и TNNT2 наших культур демонстрирует 90% желудочково-подобный фенотип3. Эти контролируемые качеством культуры криоконсервированы для экспериментальных исследований. Нынешние подходы дифференциации дают неоднородную смесь узловых, предсердий и желудочков, как клетки3,16,17,41. Таким образом, стратегии, используемые для обогащения популяции подтипа СМ, могут еще больше улучшить специфику культур. Кроме того, для повышения их созревания могут быть использованы подходы к тканевой инженерии. Предложенные здесь методы могут быть легко реализованы для других источников CM.
Волны AP, записанные с помощью MEA, были аналогичны тем, которые были записаны в сетях кардиомиоцитов оптическим картированием42,43, дополнительными оксидами металла полупроводниковой основе MEA18,21, и смоделированные AP с помощью записей FP20. Для решения механизма измерений AP через MEA Hai и Spira25 продемонстрировали, что электропор-электродный интерфейс имитирует установленную острое стекло микроэлектродной техники. Тем не менее, потенциал мембраны покоя и истинные значения амплитуды в нашем исследовании не могут быть установлены, учитывая, что электропор-электродный интерфейс в системах МЦа не откалиброван, и что амплитуда является функцией чувствительности и разрешения Техника. Наш подход разделяет аналогичные ограничения оптического картирования, когда дело доходит до амплитуды AP.
Многофункциональные MEA основе FP / AP чтения сообщили здесь открыть новые возможности для оценки безопасности лекарственных средств. Хотя спонтанно, эти hiPSC-CM монослой бить с постоянной скоростью. Анализ параметров APD в нескольких сетях дает представление об электрической неоднородности(рисунок 13). Тем не менее, всеобъемлющий анализ реституции APD должен включать предыдущие диастолические интервалы. Кроме того, высококачественные волны AP, зарегистрированные с того же места клеток более 96 ч(рисунок 11B) является первым докладом для отслеживания мембранной электродинамики с течением времени, которые будут значения в развитии и в болезни.
Протокол, описанный здесь для количественной оценки параметров AP, может быть использован для генерации кривых реакции дозы для тестирования соединений. Как недавно сообщили Эдвардс и др.3, доза ответ норадреналина, изопротеренола и E 4031 построены для APD на различных фазах реполяризации. Опубликованное исследование продемонстрировал точность и надежность подхода к выявлению зависящих доза тонких изменений в волнах AP в режиме реального времени. Этот метод может быть легко расширен для других соединений или небольших библиотек молекул для понимания различных электрофизиологических реакций.
MeA основанный подход для измерений AP, представленный в этом исследовании, будет интересен не только электрофизиологам, но и клеточным биологам и модельерам в силико. Кроме того, записи FP/AP с одного и того же сайта клеток на hiPSC-CMs позволят исследователям в течение короткого периода времени создавать биоэлектрические библиотеки данных широкого спектра возбудимых сотовых сетей. Наличие этих ресурсов будет иметь важное значение для обнаружения наркотиков и моделирования заболеваний.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Ни один
Материалы
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
Ссылки
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726 (2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100 (2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110 (2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206 (2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены