Method Article
Reti di cardiomiociti derivati da umani da iPSC su array di microelettrodi multiwell per registrazioni di potenziali azioni ricorrenti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo contiene una serie di protocolli per lo sviluppo di reti di cardiomiociti derivate da cellule staminali derivate da cellule staminali derivate dall'uomo (hiPSC-CM) coltivate su piastre MEA multiwell per elettropolarmente la membrana cellulare per misurazioni potenziali di azione. Le registrazioni ad alta velocità vengono ottenute ripetutamente dagli stessi siti cellulari nel corso di giorni.
Abstract
Lo screening della sicurezza cardiaca è di fondamentale importanza per la scoperta di farmaci e le terapie. Pertanto, lo sviluppo di nuovi approcci elettrofisiologici ad alto contenuto di velocità per i preparati hiPSC (hiPSC-CM) derivati da hiPSC è molto necessario per test farmacologici efficienti. Sebbene gli array multielettrodi (MEA) siano spesso impiegati per misurazioni potenziali sul campo di celle eccitabili, una recente pubblicazione di Joshi-Mukherjee e colleghi ha descritto e convalidato la sua domanda di registrazioni di potenziali azioni ricorrenti (AP) dalla stessa preparazione hiPSC-CM per giorni. L'obiettivo qui è quello di fornire metodi dettagliati passo-passo per la seeding di CMs e per misurare le forme d'onda AP tramite elettroporazione con alta precisione e una risoluzione temporale di 1 s. Questo approccio affronta la mancanza di una metodologia facile da usare per ottenere l'accesso intracellulare per misurazioni di AP ad alta velocità effettiva per indagini elettrofisiologiche affidabili. Un flusso di lavoro dettagliato e i metodi per la placcatura di hiPSC-CMs su piastre MEA multiwell sono discussi sottolineando i passaggi critici laddove pertinenti. Inoltre, viene segnalato uno script MATLAB su misura per la gestione, l'estrazione e l'analisi rapida dei dati per un'analisi completa dell'analisi della forma d'onda per quantificare le sottili differenze nella morfologia per vari parametri di durata AP implicati in aritmia e cardiotossicità.
Introduzione
I cardiomiociti derivati da cellule staminali pluripotenti indotte dall'uomo (hiPSC-CMs) sono il gold standard per un numero crescente di laboratori1,2,3,4,5,6 ,7,8,9,10. Battere i corpi embrionali11,12,13 e monostrato3,7,10,11,12, 13,14,15,16,17 differenziazione sono i metodi preferiti per la produzione di cardiomiociti e l'array multielettrodi (MEA) è diventato una modalità comune per monitorare l'elettrodinamica di queste reti18,19,20. Mentre i parametri che possono essere estratti da potenziali di campo (FP) come la velocità di battitura, l'ampiezza, la durata e gli intervalli RR sono risposte elettrofisiologiche di base di battere spontaneamente i monostrati18,21, 22,23, i componenti del potenziale di azione (AP) alla base di questi segnali Extracellular FP sono difficili da estrapolare24. La nostra recente pubblicazione sulla scoperta di un'applicazione di MEA per misurazioni aggegge ratei dirette fornisce una prova di metodologia per letture AP intracellulari esemplari con un'ampia analisi delle forme d'onda in varie fasi di ripolarizzazione in più di reti cardiomiocite derivate da hiPSC3. Nello studio abbiamo dimostrato che la consegna di impulsi elettropotrici alle reti di cardiomiociti derivati da hiPSC consente l'accesso intracellulare per le registrazioni AP. Queste registrazioni AP transitorie dipendono da potenziali recuperi transmembrana osservati attraverso il sito di infortunio3,25,26. Le forme d'onda registrate tramite MEA e patch-clamp nel nostro studio hanno mostrato morphologi AP simili, convalidando così l'affidabilità dell'approccio3.
Alcuni laboratori hanno riferito di misurare i punti di accesso da varie cellule elettrogeniche utilizzando MEA personalizzati18,21,26,27,28,29, 30, ma l'affidabilità dell'utilizzo dei MEA per misurazioni AP coerenti e ricorrenti non è stata valutata. Attualmente, la tecnica patch-clamp standard gold è limitata alle registrazioni terminali7,31 mentre le misurazioni AP basate su MEA sono transitorie e quindi possono essere condotte più volte sulla stessa cella. Dimostriamo anche che si possono facilmente registrare segnali AP di alta qualità nella gamma millivolt che richiedono un filtraggio minimo. I ricercatori possono quindi condurre studi non solo acuti, ma anche su farmaci cronici negli stessi preparati utilizzando MEA. Inoltre, questa tecnologia consente la misurazione simultanea FP/AP di generare librerie di elettrobio in un breve periodo di tempo. Data la crescente enfasi sulla previsione dell'aritmia e sulla cardiotossicità associata ai farmaci24,32,33,34,35, integrazione della misurazione AP miglioreranno la sicurezza e le valutazioni di efficacia dei farmaci.
Qui, presentiamo protocolli per 1) pre-plating di crioconservati hiPSC-CMs per la maturazione, 2) dissociazione e placcatura di hiPSC-CMs su MEA multiwell, 3) registrazione di FPs e AP da reti hiPSC-CM, 4) segmentando ed estraendo i dati per l'analisi, e 5) ripristino delle matrici per il riutilizzo multiplo. Ogni passaggio è stato ottimizzato enfatizzando i passaggi critici laddove pertinenti. Vengono discussi i requisiti per l'attaccamento cellulare per garantire un monostrato sinciziale che batte e vengono spiegate le procedure per il ripristino multiwell di MEA per gli studi elettrofisiologici ripetitivi. Infine, viene presentata una GUI personalizzata sviluppata in laboratorio per l'estrazione del segnale AP, la garanzia della qualità e il flusso di lavoro di segmentazione per quantificare e analizzare i parametri AP.
Protocollo
1. Preparazione di soluzioni e materiali (vedere Tabella dei materiali)
-
Rivestimento della piastra di coltura dei tessuti a 6 pozze
- Scongelare il substrato di rivestimento sul ghiaccio o a 4 gradi centigradi.
- Preparare un supporto di diluizione del substrato di rivestimento 1:100 nel mezzo freddo DMEM/F12. Mescolare la soluzione con pipettatura lenta.
- Trasferire 2 mL della soluzione di substrato di rivestimento (passaggio 1.1.2) per pozzo di una piastra di coltura dei tessuti a 6 pozzetti.
- Posizionare immediatamente la piastra di coltura dei tessuti rivestiti nell'incubatrice della coltura cellulare a 37 e 5% di CO2 per almeno 7 h e utilizzare entro 7 giorni.
-
hiPSC-CM mezzo di coltura
- Aggiungete 10 mL di supplemento multimediale CM scontrito a 4 gradi centigradi a 500 mL di supporto di base CM. Conservare a 4 gradi centigradi per un massimo di 2 settimane.
- Quantità richiesta di supporti per il giorno e portare a temperatura ambiente prima dell'uso.
- hiPSC-CM di scongelamento medio: Preparare fresco mescolando il mezzo di coltura hiPSC-CM (passaggio 1.2) con il siero bovino fetale 10% (FBS). Portare il supporto a temperatura ambiente prima dello scongelamento delle EGM per le sospensioni.
- Fibronectin 1 mg/mL per un uso successivo: 200 - L in tubi di microfuge sterili da 1,5 ml e conservati a 4 gradi centigradi per un uso successivo. Preparare una soluzione di lavoro di concentrazione di 50 g/mL appena sul ghiaccio.
- Soluzione di pulizia multiwell: unire 0,5 g di detergente ezimatico con 50 mL di acqua sterile a doppia distillazione (ddH2O). Vortice per mescolare il contenuto. Filtrare e conservare a 4 gradi centigradi per un massimo di una settimana.
2. Pre-platalazione di hiPSC-CM crioconservati per la maturazione (Figura 1)
NOTA: Questa sezione è destinata allo scongelamento e alla coltura di hiPSC-CMs differenziati utilizzando il metodo di monostrato senza alimentatore3,16 e crioconservati in azoto liquido 10 giorni dopo la differenziazione a 1-2 milioni di cellule/flalo. Le cellule di una fiala sono placcate in due pozzi rivestiti di substrato di una piastra di coltura tissutale a 6 pozze. I cardiomiociti tendono a depositarsi nella parte inferiore del tubo in modo delicato miscelazione al momento della pre-plating è importante per raggiungere anche la densità cellulare attraverso i pozzi.
- Aliquota 2 mL di FBS per fiala di hiPSC-MMs scontrizzati in un tubo conico da 15 mL e portare a temperatura ambiente.
- Scongelare le fiale di hiPSC-CMS crioconservati mettendole in un bagno d'acqua a 37 gradi centigradi e ruotare delicatamente per scongelare per non più di 3 min.
- Trasferire immediatamente il contenuto della fiala sul tubo contenente FBS (vedere il punto 2.1), mescolare vorticoso e centrifugare a 200 x g per 5 min.
- Aspirare il supernatante e risospendere il pellet cellulare in 1 mL di hiPSC-CM di scongelamento medio (vedi passo 1.3) per fiala scongelata. Utilizzare una pipetta di trasferimento per risospendere il pellet con una delicata triturazione. Valutare la vitalità cellulare.
- Aggiungere ulteriori 3 mL di mezzo di scongelamento per fiala di hiPSC-CM scongelato nel passaggio 2.4 e sospendere delicatamente utilizzando una pipetta di trasferimento per dissociare ulteriormente i grumi delle cellule.
- Distribuisci 2 mL di sospensione cellulare delicatamente in ogni pozzetto di piastre 6 pozze rivestite di substrato (vedi passo 1.1). Mettere in incubatrice coltura cellulare a 37 e 5% CO2.
- Sostituire con un nuovo mezzo di coltura hiPSC-CM dopo 24 ore e 3 volte settimanale in seguito per 20 giorni.
NOTA: Le cellule devono rispettare il rivestimento del substrato di 24 h e battere spontaneamente a 48 h post-placcatura (vedere video 1 e video 2).
3. Sterilizzazione e rivestimento della piastra MEA multiwell (Figura 2 e Figura 3)
NOTA: Il protocollo qui descritto è per la preparazione di piastre MEA 24-well con 12 micro oro pedOT-rivestito su vetro per placcatura hiPSC-CM. Evitare di toccare il fondo della piastra in quanto ciò potrebbe danneggiare gli elettrodi.
- Due giorni prima della placcatura cellulare, aggiungere 0,5 mL di supporto di coltura hiPSC-CM (vedere il punto 1.2) a ogni pozzo ed eseguire una registrazione di base per verificare il rapporto segnale-rumore per il controllo di qualità dei MEA.
- Aspirare i supporti, risciacquare con sterile ddH2O e sterilizzare sotto la luce UV all'interno di un cappuccio a flusso laminare durante la notte.
- Il giorno prima della placcatura cellulare, aggiungere 0,1 mL di FBS ad ogni pozzo per il trattamento idrofilo delle superfici MEA. Incubare per 30 min a temperatura ambiente. Questo passaggio è necessario per l'attacco cellulare.
- Aspirata l'FBS e risciacquare con 0,5 mL di sterile ddH2O per bene. Ripetere ancora una volta.
- Lasciare asciugare la piastra nel cofano a flusso laminare durante la notte.
- Preparare una diluizione di lavoro di 50 g/mL fibronectin a freddo DMEM/F12 medio dal magazzino (vedere il punto 1.4). Mantenere la soluzione sul ghiaccio.
- Pipetta 5 - L della diluizione fibronectina funzionante (vedi 3.6) e dispensare con cura la gocciolina al centro di ogni pozzo per coprire tutti i 12 elettrodi. È importante lavorare rapidamente attraverso i 24 pozzi per evitare che la gocciolina si secchi.
- Posizionare immediatamente la piastra MEA multiwell rivestita di fibronectina su una superficie rialzata all'interno di una camera umidante contenente ddH2O sterile per coprire l'intera superficie del piatto. Posizionare la camera con la piastra MEA multiwell per 3 h nell'incubatrice di coltura cellulare.
NOTA: L'inserimento della piastra 24 well MEA in una camera umidificante è fondamentale per evitare che le goccioline di fibronectin si secchino durante il periodo di incubazione.
4. dissociazione hiPSC-CM su piastra MEA Multiwell (Figura 3)
NOTA: Iniziare questo passaggio circa 1 h prima che l'incubazione della fibronectina MEA sia completa. Assicurarsi che la soluzione di dissociazione cellulare sia a 37 gradi centigradi e che il mezzo di scongelamento iPSC-CM sia a temperatura ambiente. I metodi di dissociazione sono stati ottimizzati per 30 giorni di hiPSC-CM post-differenziati coltivati su lastre di 6 pozzetti rivestite di substrato (vedi passo 2) per ottenere circa il 90% di CM vitali per la placcatura MEA. Occorre prestare attenzione a non introdurre bolle d'aria durante la triturazione per prevenire la morte delle cellule.
- Aspirare il mezzo di coltura da ogni pozzo del piatto di coltura dei tessuti a 6 pozzetti con 30 giorni di coltura hiPSC-CM post-differenziata (vedi passo 2.7) e lavare con 2 mL di D-PBS sterile per pozzo.
- Aggiungere 1 mL di soluzione di dissociazione cellulare preriscaldata (vedi Tabella deimateriali) per pozzo e incubare per 4 min a 37 gradi centigradi. Utilizzare una pipetta di trasferimento per triturare delicatamente per allentare le cellule per la dissociazione. Se la maggior parte delle cellule sono ancora aderenti, incubare per altri 3 min a 37 gradi centigradi e triturare di nuovo. Questa incubazione supplementare dovrebbe aiutare per il recupero massimo delle cellule. Non incubare per più di 7 min in quanto ciò potrebbe provocare una bassa vitalità cellulare.
- Utilizzando una pipetta di trasferimento, mettere a disposizione tutte le celle dissociate in un tubo conico contenente il mezzo di scongelamento hiPSC-CM (vedere il punto 1.3). Si raccomanda di sospendere le cellule in almeno il doppio del volume dei supporti (2 mL per pozzo raccolto) per bloccare l'attività della soluzione di dissociazione cellulare.
- Centrifuga a 200 x g per 5 min.
- Aspirare la soluzione con attenzione come il pellet è liberamente attaccato alla superficie e resospendere in 0,1 mL di hiPSC-CM mezzo di scongelamento. Utilizzare una pipetta di trasferimento per risospendere il pellet un paio di volte con una delicata triturazione delicata.
- 2 -L di cellule dissociate e diluire con 18 - L di supporto in un tubo di microfuge da 1,5 mL. Aggiungere 20 -L di Trypan Blue e mescolare per il numero di cellule e la valutazione di fattibilità.
- Regolare la densità delle cellule a 6.000 celle/L aggiungendo il volume appropriato del mezzo di scongelamento hiPSC-CM. Sospendere il pellet facendo un leggero sfarfallio un paio di volte. Gli hiPSC-CMs si staccano facilmente dalle superfici vetrate, soprattutto se placcati ad alte densità. Abbiamo ottimizzato la densità di seeding e le condizioni di placcatura per ottenere 15 giorni di registrazioni elettriche.
- Quando sei pronto, porta la piastra MEA multiwell nella cappa a flusso laminare per la semina cellulare. È fondamentale eseguire i seguenti due passaggi uno alla volta per evitare che la fibronectina si secchi.
- Rimuovere con cautela la goccia di fibronectina utilizzando una pipetta P10 senza toccare gli elettrodi.
- Immediatamente erogare una goccia di 5 celle (30.000 celle) al centro del pozzo della piastra MEA che copre tutti i 12 elettrodi. Ripetere il passo fino a quando tutti i 24 pozzi sono placcati. Si raccomanda la miscelazione intermittente della sospensione cellulare tramite sfarfallio.
- Collocare la piastra MEA multiwell nella camera umidante vagamente coperta e tornare all'incubatrice di coltura cellulare a 37 e 5% CO2 per 3 h per l'attaccamento cellulare.
- Aggiungere con cura 200 l di hiPSC-CM di scongelamento medio ad ogni pozzo senza disturbare le cellule utilizzando una pipetta P200. Aggiungere il supporto dropwise al lato del pozzo.
- Collocare la piastra MEA multiwell nell'incubatrice di coltura cellulare.
- Sostituire con un nuovo supporto di coltura hiPSC-CM a 24 h post placcatura. Il battito spontaneo di cardiomiociti può essere osservato a questo punto (vedere il video 3).
- Cambia i media ogni 2 giorni fino alla fine degli esperimenti.
5. elettroporazione hiPSC-CM e acquisizione del segnale (figura 4 – 6)
NOTA: Questo protocollo è per la registrazione simultanea di segnali di elettrodi ad alta velocità (12 siti per ciascuno dei 24 pozzi). Il sistema MEA multi-24-well multiwell viene utilizzato con il software di acquisizione (vedi Tabella dei materiali). Tutte le registrazioni MEA sono condotte a 37 gradi centigradi.
- Accendere la scheda di interfaccia e avviare il software di acquisizione. Concedere abbastanza tempo per la fase di testa multiwell MEA per raggiungere la temperatura di 37 gradi centigradi (vedere la freccia n. 1 nella Figura 4).
- Inserire la piastra MEA multiwell dal passaggio 4 nella fase di guida MEA multiwell posizionandola sopra la piattaforma di registrazione e fare clic sul pulsante Inserisci (vedere la freccia n. 2 in Figura 4). Lasciare stabilizzare la temperatura prima di avviare le registrazioni.
-
Regolare le impostazioni di acquisizione ed elettroporazione
- Fare clic sull'icona Definisci flusso sperimentale (vedere la freccia n. 3 in Figura 4) e impostare il tempo di registrazione su 2 min o come desiderato.
- Fare clic sull'icona Impostazione acquisizione dati (vedere la freccia n. 4 in Figura 4) e impostare la frequenza di campionamento su 20 kHz, il filtro a passaggio elevato su 0,1 Hz e il filtro passa-basso a 3500 Hz.
- Fare clic sull'icona Impostazioni stimolatore (vedere Figura 5). Nella scheda Definizione stimolante, definire la stimolazione come impulsi di tensione simmetrica bifasici di 1 mV, 1 ms e 1 Hz. Nella scheda Elettrodi di stimolazione, selezionare i siti di elettroporazione evidenziando tutti gli elettrodi pertinenti.
- Fare clic sul pulsante Esplora per visualizzare i segnali in tutti i pozzi. Verificare la qualità del segnale e le condizioni di stato costante. Prendere appunti sugli elettrodi con segnali FP nella gamma mV. Fare clic sullo stesso pulsante per interrompere l'esplorazione. Fino a questo punto non sono stati registrati dati.
- Avviare la registrazione facendo clic sul pulsante Vai!. Gli elettrodi in ogni pozzo mostreranno i segnali FP nella finestra dei dati grezzi (Figura 6). Dopo 30 s di registrazione, fare clic sul pulsante Stimola e lasciare che l'elettroporazione si svolgerà sui siti selezionati per 30 s; quindi, fare clic sullo stesso pulsante per interrompere la stimolazione e continuare la registrazione per i restanti 60 s.
NOTA: il file registrato può essere riprodotto passando a 'Modalità riproduzione' nel menu a discesa 'Applicazione'.
6. Pulizia piastra MEA multiwell per il riutilizzo
- Dopo gli esperimenti finali, pulire tutti i pozzi nella piastra multipozzo aspirando tutti i contenuti dei supporti da ogni pozzo ed evitando con attenzione di toccare la superficie dell'elettrodo.
- Aggiungere 1 mL di sterile ddH2O per pozzo. Aspirare e ripetere una volta.
- Aggiungere 0,3 mL di soluzione di pulizia multiwell (vedere il passaggio 1,5) per ogni pozzo. Incubare durante la notte a temperatura ambiente per spostare le cellule e detriti.
- La mattina seguente, aspirare la soluzione e risciacquare con 1 mL di sterile ddH2O. Incubare per 5 - 7 min e aspirare. Ripetere 5 volte.
- Aggiungere 0,5 mL di sterile ddH2O per pozzo. Registrare la linea di base della piastra multiwell pulita per il controllo di qualità dei MEA puliti (Figura 7).
- Conservare a 4 gradi centigradi fino a quando non è pronto per l'uso.
7. Conversione ed esportazione dei file di dati
NOTA: verranno generati quattro file di dati per ogni registrazione: file MWR, MWC, MWD e MWS. Utilizzando il software di conversione, il file MWD può essere convertito in file H5 per la successiva analisi utilizzando script personalizzato (vedere File supplementare 1).
- Avviare il software del convertitore (vedere Tabella dei materiali).
- Selezionare Imposta percorso di input dal menu File. Selezionare la cartella contenente i file di dati di interesse.
- Selezionate Imposta percorso di output (Set Output Path) dal menu File (File). Selezionare la cartella in cui salvare i file convertiti.
- Evidenziare il file MWD di interesse.
- Fare clic sul pulsante EXPORT to HDF5.
8. Segmentazione e analisi dei dati (figura 8-10)
NOTA: il software personalizzato basato su Matlab viene utilizzato per segmentare ed estrarre vari parametri di dati FP e AP. Il software è disponibile su richiesta.
- Eseguire il codice Waveform Analysis utilizzando Matlab (vedere Figura 8 per una visualizzazione della finestra principale della GUI).
- Fare clic su File e selezionare Elabora .h5.
- Individuare e selezionare il file mwd.h5 creato in base al passaggio 7 precedente.
- Fare clic sul pulsante Salva directory per modificare il percorso di archiviazione dei file di output.
- Creare una coda di elaborazione del segnale selezionando combinazioni di elettrodi/pozzi di interesse e facendo clic sul pulsante Coda. Ripetere questo passaggio per aggiungere altre combinazioni di elettrodi/pozzi da elaborare alla coda.
- Modificare la coda facendo clic direttamente su Med Name / Med Concentration se le cellule sono state trattate con farmaci (Figura8).
- Una volta che la coda è finale, fare clic sul pulsante Inizializza forme d'onda. Questo avvierà l'elaborazione preliminare in cui i segnali vengono identificati ed estratti per la segmentazione.
- Fare clic sul pulsante Ingrandisci e selezionare l'area potenziale di azione di interesse con il cursore (Figura 9).
- Fate clic sul pulsante Mantieni ed esaminate i pannelli. I picchi (x' rossa) e i trogoli (cerchi gialli) vengono rilevati per ogni forma d'onda e i potenziali di azione normalizzati sono sovrapposti. Fare clic sul pulsante Mantieni e passare alla traccia successiva nella coda (Figura 10).
- Ripetere i passaggi da 8,8 a 8,9 per il resto dei segnali di combinazione elettrodo/pozzo nella coda.
NOTA: verrà generato un file .csv con parametri APD misurati per ogni forma d'onda. Viene inoltre salvato un file .mat per ogni file .h5 per consentire un'ulteriore elaborazione dei dati segmentati.
Risultati
La vitalità e la densità di placcatura degli hiPSC-CMs post-scongelati sono fondamentali per la cultura MEA multi-gonfia. La pre-placcatura di 1-2 milioni di hiPSC-CMs/filine in due pozzi di una piastra di coltura tissutale a 6 piani con una vitalità pari o superiore al 50% produrrà una sana coltura monetrico con percosso spontaneo a 48 h. La scarsa vitalità delle popolazioni non miocite. Questi monostrati, dissociati per la placcatura MEA multi-bene, producono generalmente risultati incoerenti e segnali di cattiva qualità e pertanto dovrebbero essere scartati. La figura 1 mostra esempi di colture hiPSC-CMs ottimali rispetto a quelle non ottimali a 48 h dopo la placcatura. Scongelare le ZOm su piastre di coltura tissutali rivestite di substrato piuttosto che direttamente su MEA multiwell, consente il recupero cellulare e la maturazione3 . La placcatura diretta di CM crioconservati sull'array non è raccomandata in quanto ha prodotto risultati incoerenti.
Oltre alla qualità delle CM dissociate, l'attaccamento cellulare su MEA multiwell dipende fortemente dalla densità cellulare e dalla tecnica di rivestimento della fibronectina. La dimensione delle goccioline fibronectine è fondamentale in quanto le CMs si conformeranno ai confini dell'area rivestita di fibronectina. Per questo motivo, solo 5 L della soluzione di fibronectina vengono erogati direttamente sopra l'area dell'array di elettrodi. Per garantire che la goccia non si disperda, la superficie del pozzo deve essere completamente asciutta al momento del rivestimento. La figura 2 mostra il layout della piastra MEA multigonme con schemi di pretrattamento passo-passo per una preparazione ottimale. Inoltre, per evitare che la fibronectina si asciughi le placche MEA multigonfie deve essere collocata all'interno di una camera umidificante durante il periodo di incubazione che dura non più di 3 h (vedi passo 3.8). Una volta completato il periodo di incubazione, è importante rimuovere la goccia di fibronectina da ogni goccia ben prima della placcatura CM e solo allora procedere alla successiva placcatura del pozzo. Lavorare rapidamente e con attenzione erogando le Macchine virtuali è la chiave per un attacco cellulare di successo.
Le colture hiPSC-CM a 30 giorni dopo la differenziazione sono dissociate per la placcatura MEA multi-well utilizzando il metodo di dissociazione delle cellule enzimatiche (vedere il passaggio 4). Le MM si attaccheranno alle superfici MEA rivestite di fibronectina di 3 h e un monostrato che copre gli array sarà visibile dopo 24 h post-placcatura (Figura 3). Il battito sincrono del monostrato sarà osservato a 24-48 h. La dispersione delle goccioline cellulari influenzerà la densità della coltura o addirittura porterà all'essiccazione e alla morte cellulare. Il posizionamento preciso delle cellule direttamente sull'array è della massima importanza e quindi la tecnica deve essere praticata per una placcatura ottimale. L'adesione cellulare all'elettrodo di riferimento ostacolerà la produzione del segnale elettrico. Vedere Figura 3 per le immagini di posizionamento CM ottimale e la cultura dopo 24 h.
Le CM coltivate su MEA multiwell sono sottoposte a controllo di qualità per l'attività elettrica a 48 ore dopo la placcatura. Tipicamente, l'ampiezza del segnale FP aumenta dall'intervallo di V a mV in circa 4 giorni3. Se il 50% degli elettrodi all'interno di una rete e il 70% delle reti totali non producono segnali FP, la rete o la coltura sono non ottimali e dovrebbero essere scartate. Solo le impostazioni cultura che superano il controllo qualità vengono elaborate per l'analisi FP e AP. La figura 6 mostra esempi di segnali FP buoni e non standard.
Le registrazioni AP mediate dall'elettroporazione possono essere ottenute più volte dalle colture 48 h post-MEA plating. Utilizzando l'elettroporazione, abbiamo ottenuto l'accesso intracellulare per registrare AP ad alta risoluzione da più reti cardiomiociti derivati da hiPSC. Gli impulsi a bassa tensione (1 V, 1 ms, 1 Hz) per 30 s sono stati consegnati per una trasformazione transitoria e reversibile di FP in AP. L'elettroporazione consente un accesso intracellulare di successo per la misurazione dell'AP in circa il 75% degli elettrodi. I segnali elettrici sono registrati per 2 min che includono 30 s pre-elettroporazione, 30 s durante e 1 min post-elettroporazione. Un treno di 10 s AP d'onda forme d'onda 10 s post-elettroporazione sono valutati in tutti i siti per la qualità del segnale e l'analisi. Qualsiasi traccia non conforme al segnale AP puro viene eliminata. Per studiare se le ampiezità AP sono correlate al segnale FP, abbiamo elettropomezzato tutti i 288 siti per registrare simultaneamente le forme d'onda. I segnali di FP e AP rappresentativi registrati dallo stesso sito cellulare da due elettrodi diversi sono illustrati nella figura 11A. Non abbiamo osservato alcuna correlazione tra le ampiezza FP e le ampiezza AP post elettroporazione registrate dallo stesso sito cellulare. Inoltre, più elettroporazioni dello stesso sito cellulare a 0, 24, 48, 72 e 96 h non hanno avuto alcun effetto significativo sulla forma AP nel tempo (Figura 11B).
Data la natura ad alta velocità effettiva del sistema, una tecnica manuale per estrarre e quantificare i parametri di interesse come l'intervallo RR, la frequenza istantanea e la durata potenziale dell'azione differenziale è inefficiente e richiede molto tempo. Su richiesta viene impiegato uno script MATLAB personalizzato a disposizione della comunità di ricerca su richiesta per eseguire misurazioni della forma d'onda con una risoluzione di 1 s. I punti temporali di elettroporazione vengono sovrapposti con il segnale estratto per identificare 10 s di aP post-elettroporazione per condurre l'estrazione del segnale, la garanzia della qualità e il flusso di lavoro di segmentazione (Figura 8, Figura 9, Figura 10). L'interfaccia utente consente di selezionare il segmento desiderato utilizzando come guida gli indicatori di elettroporazione sovrapposti. La forma d'onda segmentata viene elaborata da subroutine per identificare ulteriormente le singole forme d'onda PA. Questo viene completato attraverso il rilevamento di picco, dove viene identificata la tensione più alta e più bassa per ogni ciclo. Una volta completato questo processo, le ampiezze vengono normalizzate e i vettori temporali di associazione vengono spostati per definire il tempo zero con un valore massimo di 1. L'interpolazione dei punti di intersezione lungo i singoli cicli è stata utilizzata per determinare le misurazioni Dell'APD. Pertanto, il flusso di lavoro di automazione parziale per la segmentazione della forma d'onda AP consente un'analisi efficiente dei dati per vari parametri APD in più batch di impostazioni cultura in un breve periodo di tempo. È in corso un'ulteriore automazione dei criteri di inclusione ed esclusione per SP e AP per l'analisi dei dati in tempo reale.
Un vantaggio significativo della piastra MEA multiwell è che può essere riutilizzato più volte. Questo restauro consente studi elettrofisiologici ripetitivi per la raccolta di dati a costi-economici e coerenti. Le registrazioni di aP dalla stessa matrice dopo 6 restauri sono mostrate nella Figura 12. Il rapporto segnale-rumore è simile tra più riutilizzi. Per dimostrare l'affidabilità dell'array per studi elettrofisiologici ripetitivi, un totale di 3815 forme d'onda AP sono raggruppate da tre lotti di ripristino e vengono estratti i dati sulla durata AP per esaminare la ripetibilità dei risultati. Vengono visualizzati i grafici di distribuzione per singole forme d'onda APD30, APD80, triangolazione (APD80- APD30) e l'accorciamento frazionario ((APD80) /(APD80)) (Figura13).

Figura 1: Pre-plating di hiPSC-CM crioconservato per la maturazione. (A) Elaborazione cellulare per una fiala pre-placcatura di 10 giorni post-differenziazione crioconservati hiPSC-CMs. (B) Immagini di contrasto della fase di colture hiPSC riuscite (a sinistra) e non riuscite (destra). Barra della scala: 275 m. Vedere video 1 e Video 2 per esempi di cultura di 14 e 24 giorni post-differenziazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Impostazione e preparazione della piastra Multiwell MEA. (A) Schemi di piastra MEA multiwell: La piastra è costituita da 24 pozzetti (da A1 a D6) ciascuno contenente 12 array di microelettrodi e 4 elettrodi di riferimento periferici. Diametro degli elettrodi: 30 m / Distanza interelettrodo: 300 m. Le registrazioni possono essere ottenute contemporaneamente dai 288 elettrodi. (B) Le fasi di sterilizzazione e trattamento idrofilo da condurre prima della placcatura hiPSC-CM. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: dissociazione hiPSC-CM e placcatura su piastra Multiwell MEA. (A) Schemi di fasi di placcatura hiPSC-CM MEA per ogni pozzo. (B) Immagine microscopica che illustra il corretto posizionamento delle goccioline cellulari che copre tutti i 12 elettrodi senza diffondersi ai 4 elettrodi di riferimento. (C) Colore di fase immagini microscopiche di un hiPSC-CM esemplare (a sinistra) e non ottimale (a destra) hiPSC-CM placcatura su MEA a 24 ore post-placcatura. Barra della scala 275 m. Vedere il video 3 per un esempio di placcatura MEA di successo. Fare clic qui per visualizzare una versione più grande di questa figura.
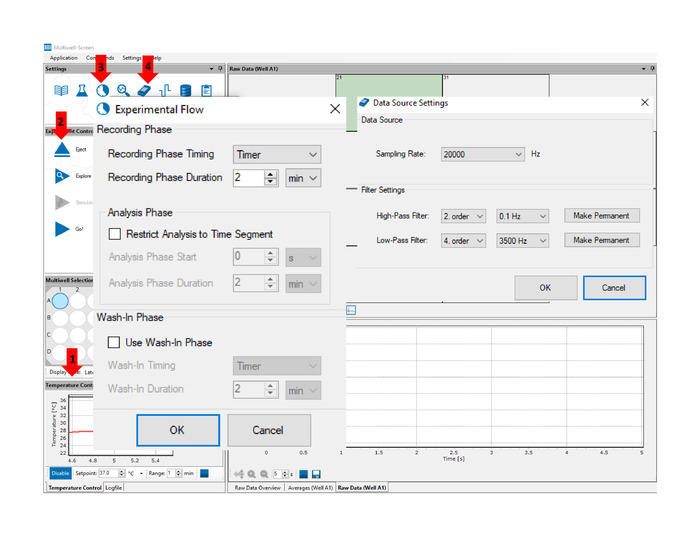
Figura 4: Software di acquisizione multiwell-screen. Le frecce indicano la posizione delle caratteristiche e delle funzioni principali a cui si fa riferimento nel pannello testo: Controllo temperatura (1) consente il monitoraggio della temperatura in tempo reale durante l'esperimento. Pulsante Inserisci/Espelli (2) attiva e rilascia la piastra Multiwell MEA. La funzione Definisci flusso sperimentale (3) consente all'utente di impostare la durata della registrazione. La funzione Data Acquisition Setup (4) consente all'utente di impostare la frequenza di campionamento e le impostazioni del filtro di acquisizione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: hiPSC-CM elettroporazione e acquisizione del segnale . La scheda Definizione stimolo consente all'utente di definire i parametri dell'impulso elettroporato. La scheda Elettrodi di stimolazione consente all'utente di selezionare gli elettrodi elettroforici. È possibile selezionare qualsiasi combinazione di 288 elettrodi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Controllo della qualità dei MEA Multiwell per l'attività elettrica. Multiwell- Software di acquisizionedello schermo che mostra finestre di dati grezzi con esempi rappresentativi di segnali FP ottimali (A) e sub-standard (B). Fare clic qui per visualizzare una versione più grande di questa figura.
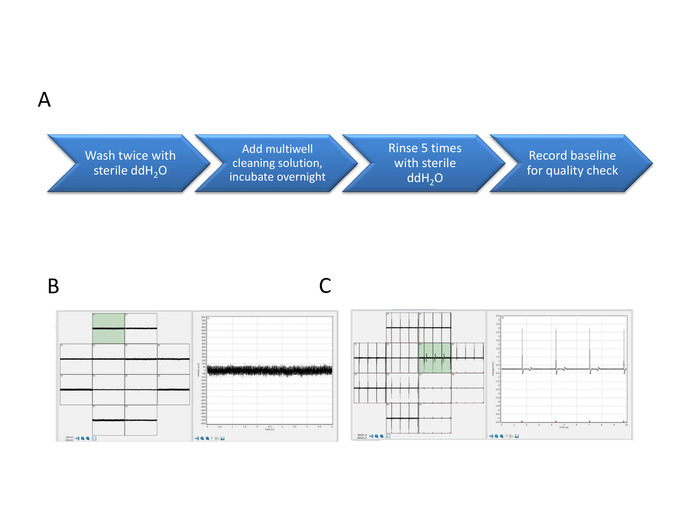
Figura 7: segnali FP e AP dall'array nuovo e ripristinato. Passaggi di pulizia ezimatici MEA multiwell (A). Il segnale di base del nuovo array mostra un rapporto segnale-rumore minimo (B) e i segnali FP mostrano l'attività elettrica della rete (C). Fare clic qui per visualizzare una versione più grande di questa figura.
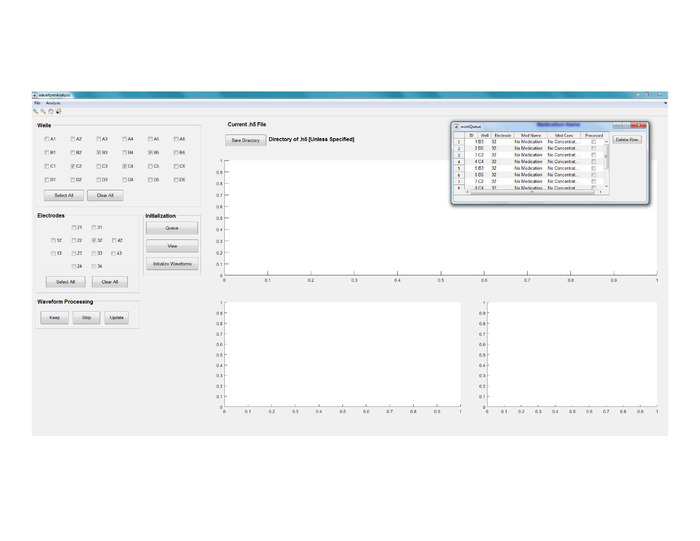
Figura 8: Segmentazione e analisi dei dati. Vista della finestra principale della GUI per Waveform Analysis. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Segmentazione e analisi dei dati. Inizializzare il pulsante Waveforms per identificare ed estrarre le forme d'onda AP per la segmentazione e per avviare l'elaborazione preliminare ingrandendo e selezionando l'area potenziale di azione di interesse. I cerchi rossi sono gli indicatori di elettroporazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: Segmentazione e analisi dei dati. I picchi (x' rossa) e i trogoli (cerchi gialli) vengono rilevati per ogni forma d'onda e gli AP normalizzati vengono sovrapposti per un controllo di qualità delle forme d'onda. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 11: Dipendenza da ampiezza AP dal segnale FP per più registrazioni dallo stesso sito cellulare. L'ampiezza FP negli intervalli V(A, il pannello in alto a sinistra) o mV (A , pannello superiore destro) registrati da due elettrodi indipendenti producono ampiezza AP in gamma mV (A, pannelli inferiore sinistro e destro) che non mostra alcuna correlazione tra le ampiezza FP e ampiezza AP post-elettroporazione. Le forme d'onda AP normalizzate per ogni registrazione sono sovrapposte come mostrato per ogni registrazione. Elettropoteri multipli dello stesso sito cellulare a 0 a 96 h prodotto forme d'onda AP di alta qualità permettendo il monitoraggio dell'elettrodinamica della membrana (B). Fare clic qui per visualizzare una versione più grande di questa figura.
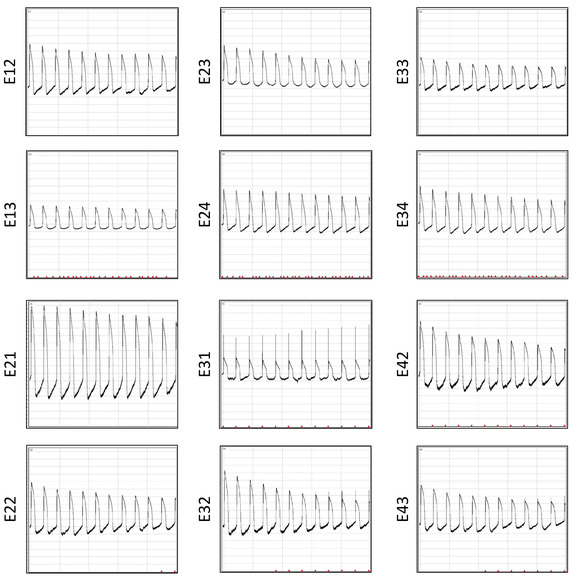
Figura 12: Registrazioni AP dopo sei restauri. Vengono visualizzate le forme d'onda AP registrate simultaneamente da 10 s post-elettroporazione su 12 elettrodi dello stesso pozzo. Fare clic qui per visualizzare una versione più grande di questa figura.
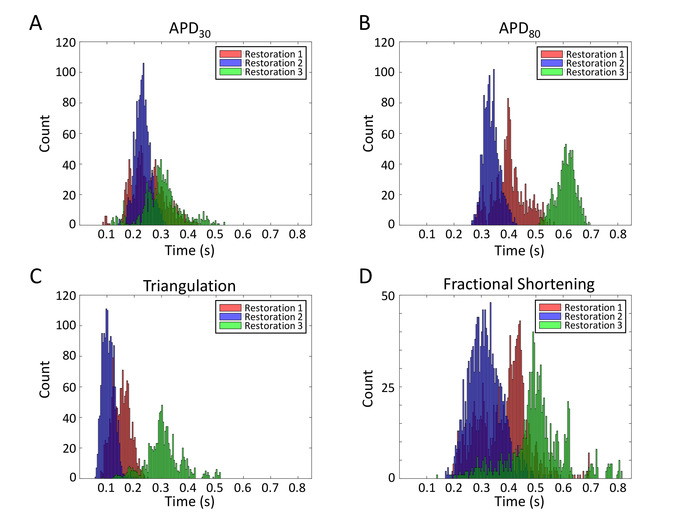
Figura 13: Istogrammi parametro APD da più restauri. Grafici di distribuzione per singole formed'onda APD30 ( APD ), APD80 (B), triangolazione (APD80- APD30) (C) e accorciamento frazionario ((APD80- APD30)/(APD80)) (D) vengono visualizzati. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementari. Video 1-3. Fare clic qui per scaricare questo file.
Discussione
Nel corso degli anni, l'applicazione di MEA si è limitata all'esecuzione di misurazioni FP di cellule eccitabili per studiare le loro proprietà elettrofisiologiche36,37,38,39. Solo pochi gruppi hanno riportato tracce di PA da cellule elettrogeniche utilizzando la tecnologia personalizzata basata su MEA18,29,30. Tuttavia, questi approcci non sono stati studiati per registrazioni ripetute dagli stessi preparativi. Abbiamo sviluppato una metodologia innovativa e accurata per studiare gli AP dallo stesso sito cellulare nel corso dei giorni in più reti hiPSC-CM contemporaneamente3. Nel nostro studio pubblicato, è stata impiegata una piattaforma MEA multi-oro micro-oro per generare librerie di forme d'onda AP da più lotti di colture hiPSC-CM con alta precisione e con una risoluzione temporale di 1 s. Il protocollo descritto qui spiega il seeding di hiPSC-CMs sull'array per lo sviluppo efficiente di reti CM sincronizzate per registrazioni DI PA ad alta velocità effettiva. Diversi passaggi critici del protocollo sono: 1) produzione di lotti ad alta purezza di CMS a controllo di qualità per il crioconservazione bancario, 2) CM post-scongelazione altamente vitali per la pre-placcatura e la maturazione, 3) trattamento della piastra MEA multiwell per CM semina, 4) dissociazione della cultura hiPSC-CM a 30 giorni dopo la differenziazione per la placcatura MEA e 5) ripristino dei MEA per il riutilizzo multiplo.
È importante notare che la variazione da batch a batch nella differenziazione hiPSC potrebbe influire sui risultati sperimentali. Il metodo monostrato di differenziazione è stato ottimizzato internamente per la produzione di cardiomiociti ad alta percentuale3,40. L'analisi FACS dei marcatori MLC2v e TNNT2 delle nostre culture dimostra un fenotipo ventricolare3. Queste culture controllate dalla qualità sono crioconservate per studi sperimentali. Gli attuali approcci di differenziazione producono un mix eterogeneo di cellule nodali, atriale e ventricolo3,16,17,41. Pertanto, le strategie impiegate per l'arricchimento della popolazione sottotipo di CM possono migliorare ulteriormente la specificità delle culture. Inoltre, approcci di ingegneria dei tessuti possono essere impiegati per migliorare la loro maturazione. I metodi qui proposti possono essere facilmente implementati per altre fonti CM.
Le forme d'onda AP registrate utilizzando MEA erano simili a quelle registrate da reti di cardiomiociti dalla mappatura ottica42,43, complementare semiconduttore di ossido di metallo MEA18,21, e simulato AP utilizzando le registrazioni FP20. Per affrontare il meccanismo delle misurazioni AP tramite MEA Hai e Spira25 ha dimostrato che l'interfaccia elettropore-elettrode imita la tecnica del microelettrodo di vetro affilato stabilita. Tuttavia, il potenziale della membrana a riposo e i veri valori di ampiezza nel nostro studio non possono essere stabiliti, dato che l'interfaccia elettropode-elettrodo nei sistemi MEA non è calibrata e che l'ampiezza è una funzione della sensibilità e della risoluzione del tecnica. Il nostro approccio condivide limitazioni simili alla mappatura ottica quando si tratta di ampiezza AP.
Le letture FP/AP multiwell basate su MEA hanno riferito qui di aprire nuove possibilità per la valutazione della sicurezza dei farmaci. Anche se spontanei, questi monostrati hiPSC-CM battono a velocità costanti. L'analisi dei parametri APD su più reti fornisce informazioni sull'eterogeneità elettrica (Figura 13). Tuttavia, le analisi complete della restituzione dell'APD devono includere intervalli diastolici precedenti. Inoltre, le forme d'onda AP di alta qualità registrate dallo stesso sito cellulare superiore a 96 h (Figura11B) sono il primo rapporto che tiene traccia dell'elettrodinamica della membrana nel tempo che sarà di valore nello sviluppo e nella malattia.
Il protocollo qui descritto per la quantificazione dei parametri AP può essere utilizzato per generare curve dose-risposta per testare i composti. Come recentemente riportato da Edwards et al.3, risposta alla dose di noradrenalina, isoproterenol ed E 4031 sono tracciati per APD in varie fasi di ripolarizzazione. Lo studio pubblicato ha dimostrato l'accuratezza e l'affidabilità dell'approccio per l'identificazione dei sottili cambiamenti dipendenti dalla dose nelle forme d'onda AP in tempo reale. Questa tecnica potrebbe essere facilmente estesa per altri composti o piccole librerie di molecole per comprendere varie risposte elettrofisiologiche.
L'approccio basato su MEA per le misurazioni AP presentato in questo studio sarà interessante non solo per gli elettrofisiologi, ma anche per i biologi cellulari e i modellatori in silico. Inoltre, le registrazioni FP/AP dallo stesso sito cellulare su hiPSC-CMs consentiranno ai ricercatori di generare librerie di dati bioelettriche di un'ampia gamma di reti cellulari eccitabili in un breve periodo di tempo. La disponibilità di queste risorse sarà preziosa per le scoperte di farmaci e la modellazione delle malattie.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
nessuno
Materiali
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
Riferimenti
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726 (2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100 (2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110 (2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206 (2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon