Method Article
Изготовление амилоидных микробусов для использования в моделировании болезни Альцгеймера
В этой статье
Резюме
Этот протокол иллюстрирует метод инкапсуляции клеток путем быстрого физического гелирования альгината для обездвиживания клеток. Полученные микробусы позволяют контролировать и устойчивое секрецию амилоида- q с течением времени и могут быть использованы для изучения эффектов секретированных амилоидов в in vitro и in vivo моделях.
Аннотация
Согласно гипотезе амилоидного каскада, самым ранним триггером в развитии болезни Альцгеймера (АД) является накопление токсичных фрагментов амилоида-з, что в конечном итоге приводит к классическим особенностям болезни: амилоидные бляшки, нейрофибрилларные клубки и синаптические и нейрональные потери. Отсутствие соответствующих нетрансгенных доклинических моделей, отражающих прогрессирование заболевания, является одним из основных факторов, препятствующих открытию эффективных лекарственных препаратов. С этой целью мы разработали протокол для изготовления альгинатных микробусов, содержащих амилоидно-секретные клетки, полезные для изучения последствий хронического производства АЗ.
Китайский хомяк клетки яичников ранее трансфицировали с человеческим геном APP, выделяя АЗ (т.е., 7PA2 клеток), были использованы в этом исследовании. Трехмерная (3D) модель in vitro для устойчивого высвобождения АЗ была изготовлена путем инкапсуляции 7PA2 клеток в альгинате. Этот процесс был оптимизирован для целевой диаметра биса 500-600 мкм для дальнейших исследований in vivo. Оптимизация инкапсуляции клеток 7PA2 в альгинате была проведена изменяя параметры изготовления, например, концентрацию альгината, скорость потока геля, электростатический потенциал, частота вибрации головы, раствор гелеобразования. Уровни секретируемых АЗ были проанализированы с течением времени и сопоставлены между альгинатными бусинами и стандартными методами клеточной культуры (до 96 ч).
Было установлено, что концентрация 1,5 х 106 7PA2 клеток/мл и концентрация альгината 2% (w/v) буферизированы с HEPES и последующее гелирование в 0,5 М хлорида кальция в течение 5 минут. Изготовленные микробусы были 1) равномерного размера, 2) со средним диаметром 550 мкм, 3), содержащий около 100-150 клеток на микробус и 4), способных выделять АЗ.
В заключение, наш оптимизированный метод для производства стабильных альгинатных микробусов, содержащих амилоидные клетки 7PA2, может позволить моделирование важных аспектов АД как in vitro, так и in vivo.
Введение
Моделирование нейродегенеративных заболеваний является сложной задачей из-за сложной и сложной природы мозга. При болезни Альцгеймера (AD), прогрессирующая потеря синаптической функции и смерть нейронов, как полагают, ниже по течению эффект устойчивого перепроизводства и накопления амилоидных бета (АЗ) пептидов после аномальной обработки амилоидных предшественников белок (APP) в соответствии с гипотезой амилоидного каскада1.
Для того, чтобы понять механизмы этой амилоидной патологии и помочь в определении новых целей лечения, ученые разработали различные in vivo доклинические модели. Одна категория моделей использует инъекцию болуса синтетического пептидаАЗ в мозг крыс 2,3,4. Основным ограничением таких моделей является то, что они полагаются на одноточечные или повторные процедуры с пептидами АЗ в высоких концентрациях, откладываемых все за один раз. Это несовместимо с хроническим, устойчивым характером высвобождения АЗ при болезни5. Другой категорией моделей in vivo является трансгенные модели животных, выражающие однуили несколько генетических мутаций, связанных с семейными вариациями заболевания 6,7,8,9, 10. Однако, поскольку семейный АД составляет лишь менее 5% всех случаев болезни Альцгеймера11, актуальность этих моделей в переводе на спорадические АД у людей сомнительна12. Другим недостатком трансгенного подхода является ускоренное формирование АЗ от рождения, что приводит к дефициту когнитивных функций и патологических изменений слишком быстро и агрессивно, чтобы напоминать прогрессирование болезни в спорадической АД у пациентов12 . Например, модель 5x FAD производит бляшки всего за 1,5 месяца13.
Интересно, что обе эти категории приводят к изменениямв когнитивной функции, отрелевки к исследованию AD 2,3,4,5,6, а иногда они сопровождаются появление патологических признаков заболевания, таких как амилоидные бляшки6,8,тау фосфорилирование6,7 и/или синаптические и нейронные потери7,9, 14. Но в то время как эти типы моделей могут дать нам представление о последствиях высокого уровня амилоидов в головном мозге, которые часто связаны с более поздними стадиями АД, они не отражают более ранние изменения, представленные в ответ на хроническое и устойчивое воздействие АЗ пептид12, такие как измененное выражение синаптических маркеров15 и компонентов в внеклеточной матрице16. Таким образом, по-прежнему существует необходимость в создании хронической модели, которая более точно иллюстрирует влияние устойчивой секреции АЗ на познание in vivo и иллюстрирует изменения в патологии.
С этой целью мы разработали систему, которая позволяет постоянную, устойчивую секрецию АЗ контролируемым образом, обездвиживая амилоидно-секретные клетки в гидрогельных микробусах, которые впоследствии могут быть имплантированы в мозг взрослых крыс для моделирования аспектов спорадических н.е.
Alginate был выбранный биоматериал, поскольку он является биосовместимым и не вызывает каких-либо побочных реакций при имплантации в vivo17. Клеточная инкапсуляция в альгинативных гидрогелях была хорошо зарекомендовала себя в течение последних четырех десятилетий. Первый пример его перевода в клинику было сообщено для лечения сахарного диабета типа 117. Самый ранний доклад об успешной инкапсуляции островков Лангерганса датируется 1980 годом. Трансплантация микробусов, содержащих инсулин-секретирующих клеток революционизировали варианты лечения больных сахарным диабетом, как он восстановил функцию поджелудочной железы, устраняя необходимость в инсулиновой инъекционной терапии18. Эти работы доклад о том, как клеточная инкапсуляция может защитить их от внешних стрессов, будь то механические или химические. В самом деле, альгинатные бусы выступать в качестве барьера и изолировать клетки из окружающей среды сохранения их фенотипа, в то время как позволяет достаточный доступ к окружающим средствам массовой информации для питательных веществ и очистки клеточных побочных продуктов19. Кроме того, использование альгината позволяет совмещеть механические свойства мягких тканей20. Alginate гидрогели могут быть настроены, чтобы иметь жесткость 1-30 кПа, просто изменяя альгината концентрации и перекрестной плотности20,21. Это важный аспект, не только для поддержания фенотипического выражения инкапсулированных клеток in vitro, но и для того, чтобы избежать воспалительных эффектов после прививки in vivo22.
В этом протоколе используются 7PA2 клетки - линия клеток китайского хомяка яичника, которая заглушается мутировавшим геном 23 человека. Эти клетки непрерывно производят каталитические продукты АПФ, в том числе АЗ1-4224,25, и были использованы для создания АЗ в качестве альтернативы синтетического производства в доклинических, острых in vivo исследований26. Мы описываем метод изготовления для иммобилизации 7PA2 клеток в "мягких" альгината микробусов, предназначенных для устойчивого секреции биомолекул. В качестве доказательства концепции, мы сообщаем о выпуске пептида Аз1-42 с течением времени. Используется альгинат с низким вязкостью с молекулярным весом 120 000-190 000 г/мол и маннуроническим и гулуроническим соотношением 1,56 (М/Г).
В дальнейших исследованиях, эти микробусы могут быть безопасно пересажены в регионах мозга крыс, имеющих отношение к АД (например, гиппокамп) для изучения влияния хронической секреции АЗ на поведение in vivo и патологии ex vivo. Кроме того, эта система может быть использована для изучения последствий хронического выпуска АЗ в приложениях in vitro и ex vivo. Например, 7PA2-содержащих альгинатных микробусов могут быть совместно культивированы в пробирке с нейронными или астроцитарными культурами для оценки воздействия хронического воздействия АЗ на клеточные механизмы, связанные с АД. Кроме того, этот метод может быть использован для изучения взаимосвязи между хроническим производством АЗ и длительным потенцированием в электрофизиологии ex vivo.
Изюминкой этого протокола является модульность и гибкость метода изготовления, который позволяет изготавливать альгинатные бусы с целевым измерением путем тонкой настройки параметров изготовления. В зависимости от применения, протокол может быть скорректирован для получения заказных целей в отношении размера микробов, плотности инкапсулированных клеток и жесткости микробов. Этот протокол может быть использован для инкапсуляции различных типов клеток, разрабатывая более актуальные трехмерные (3D) модели in vitro для изучения различных патологий. Недавно мы сообщили о том, как альгинат-инкапсулированные клетки могут быть использованы для моделирования ранних стадиях прогрессирования рака20.
Концепция инкапсуляционного процесса основана на экструзии ламинарной струи клеток, подвешенной в альгинатном растворе через сопло. Вибрирующая головка нарушает струю с контролируемой частотой, в результате чего в равной степени размера альгината основе капель. Внешнее электрическое поле позволяет отделить сформированные капли на основе альгината, которые при контакте с раствором, обогащенным раствором, обогащенным раствором, такими как ионы кальция, могут быстро пересекаться, сохраняя свою сферическую форму. Инкубация в растворе геляционного раствора позволяет образование сферических микробусов, содержащих клетки в однородном физическом гидрогеле27. Целевой размер микробусов и альгинатных гидрогелей позволяет обмениваться питательными веществами и кислородом с средой клеточной культуры в течение длительных периодов времени (недель). Рисунок 1 Показать схематическое представление используемого инкапсуляционного аппарата(рисунок 1B).

Рисунок 1 : Система инкапсуляции. (A) Схематическое представление системы инкапсуляции. Подвеска с альгинат-клетками загружается в шприц (2) и подается через резервуар на скорости экструзии, установленной на шприц насосе (1). В резервуаре вибрационная шляпа (3) вибрирует на частоте, установленной генератором волновой формы (4), чтобы нарушить поток с одинаковыми интервалами, образуя капельки одинакового размера. По мере того как разрешение подано через сопло (5) и капли сформированы, электростатический потенциал прикладной через электрод (7) установленный генератором напряжения (6), который немножко заряжает поверхность капель, позволяющ поток распространить в результате отталкивать электростатических сил. По мере того как капли включают сванной геля (8), Ca 2-управляемый перекрестное соединение alginate приводит в образовании сферических microbeads. (B) Фотография инкапсулятора перед изготовлением альгината микробусов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Размер микробида может быть изменен в зависимости от предполагаемого использования. Для того чтобы контролировать размер микробида, различные параметры, изложенные на рисунке 1А и в протоколе, корректируются соответствующим образом. Внутренний диаметр используемого сопла оказывает существенное влияние на размер капель; дальнейшая регулировка параметров инкапсуляции, а именно скорость экструзии, частота вибрации и напряжение, является ключом к достижению последовательного распределения размеров. Таблица 1 описывает, как различные параметры могут изменять размер микробусов, достигнутых с помощью этой системы.
| Параметр | Размер сопла | Частота вибрации | Расход | Электродное напряжение |
 |  |  |  | |
| Размер биса |
 
|  |  | – |
Таблица 1: Параметры изготовления и их влияние на размер микробуса. Таблица иллюстрирует, как каждый параметр может влиять на образоваваемый размер изготовленных микробусов, независимо от сопла и вязкости используемого раствора.
протокол
1. Подготовка
- Приготовьте 100 мл альгинатного акционерного раствора на 4% (w/v).
- Взвесить 4,4 г альгинатной соли натрия и добавить сухой порошок в 100 мл солевого раствора HEPES (HBS, 20 мМ HEPES (0,477 г) с 150 мм NaCl (0,877 г) в деионизированной воде, позволяющей гидратации.
- Используйте магнитный мешалку на 500 оборотов в минуту (об/ ч) и нагревайте до 50 градусов по Цельсию, чтобы обеспечить полное альгинатное увлажнение.
ПРИМЕЧАНИЕ: Альгинат может потребоваться один или два часа, чтобы быть полностью гидратированных. Чтобы сэкономить время, альгинатное решение можно сделать за день до протокола инкапсуляции и хранить при 4 градусах Цельсия до следующего дня. Когда альгинат был охлажден, тепло мягко до 37 градусов по Цельсию с помощью водяной ванны или горячей пластины и агитировать с магнитным мешалкой непосредственно перед использованием. - Стерильный фильтр альгината раствора с помощью 0,22 мкм поры политетерсульфона (PES) фильтр перед использованием. Фильтрация рекомендуется при 37 градусах Цельсия, чтобы обеспечить легкий поток альгината. Вязкость увеличится, если температура может снизиться.
- Подготовка 1000 мл 0,5 М CaCl2.
- Взвесить 55,49 г ангидроусов огороженного CaCl2 и растворить в 1000 мл HBS (20 мМ HEPES и 150 мм NaCl в 1000 мл деионизированной воды).
- Стерильный фильтр с использованием 0,22 мкм поры PES фильтр.
- Приготовьте смесь растворения на 100 мл.
- Приготовьте раствор 100 мМ HEPES (23,83 г) и 500 мМ трехнадосоем цитрат агидрат (147,05 г) в фосфатно-буферном солине.
- Отрегулируйте к pH 7.4 используя NaOH или HCl.
2. Настройка системы инкапсуляции
- Очистите ламинарный капот потока.
- Стерилизовать ламинарный капот потока, содержащего энкапселятор с помощью УФ-облучения с последующим распылением с 70% v/v этанола раствор.
- Промыть систему энкапселятора 10 мл 70% v/v этанола раствор а затем 10 мл стерильной деионизированной воды.
- Прикрепите сопло 300 мкм и повторите шаг 2.1.2.
- Спрей бутылку, содержащую фильтрованный раствор альгината, бутылку, содержащую фильтрованный раствор хлорида кальция и любые инструменты, оборудование и пустые культурные пластины, которые будут использоваться с 70% v/v этанол раствор и поместить их в ламинарный капот потока. Перед использованием, включите ультрафиолетовый свет снова в течение 30 минут, чтобы тщательно стерилизовать.
- Подготовьте мусорный стакан, наполненный дезинфицирующим раствором биологического класса, и поместите стакан в капот.
- Заполните стакан 100 мл стерильного раствора CaCl2 (aqueous) и добавьте в магнитный мешалку. Установите скорость перемешивания до 100 об/мин. Поместите стакан на магнитную платформу на высоте 18 см от кончика сопла. Этот стакан будет использоваться для сбора альгината бусин и позволяют их гелирования.
- Подготовка клеток к инкапсуляции.
- Удалить клетки из инкубатора и отсоединить от почти сольственной колбы с помощью 0,25% трипсин-EDTA раствор и инкубировать при 37 градусов по Цельсию в течение 5-10 мин.
- Изолировать образец для оценки плотности клеток, а затем центрифуги оставшиеся клетки на 1000 об/ ч в течение 5 минут, чтобы получить клеточной гранулы.
- Приостановите действие гранул в HBS (20 мм HEPES и 150 мм NaCl) для удвоения конечной желаемой концентрации клеток (например, для конечной концентрации 1,5 х 106 ячеек/мл, повторное приостановление клеток в HBS для достижения концентрации 3 х 106 ячеек/мл).
- В 50 мл центрифуги трубки, смешать клеточной подвески в соотношении 1:1 с 4% (w/v) альгинат решение для получения окончательной подвески, содержащей желаемую концентрацию клеток (например, 1,5 х 106 клеток / мл) в 2% (w/v) альгинативный раствор.
- Установите параметры инкапсуляции.
- Установите скорость машины-энкапселя до максимальной скорости экструзии (8,9 мл/мин), напряжение до 1,0 кВ и частоту до 5500 Гц.
ПРИМЕЧАНИЕ: Эти параметры были ранее оптимизированы для получения микробусов диаметром 550 мкм.
- Установите скорость машины-энкапселя до максимальной скорости экструзии (8,9 мл/мин), напряжение до 1,0 кВ и частоту до 5500 Гц.
3. Изготовление
- Изготовить микробусы.
- В шприцу объемом 20 мл загрузите 5 мл клеточной подвески и прикрепите шприц к энкапсулятору.
- Запустите инкапсулятор, активируя поток, который будет толкать клеточной суспензии через фидер. Поток капель будет экструдирован через сопло.
- Соберите первый 1 мл в стакане отходов, чтобы аннулировать первоначальный неравномерный поток.
- Продолжайте запускать оставшиеся 4 мл, позволяя каплям попадать в ванну для геля CaCl 2. Каждый миллилитр можно запустить отдельно (но последовательно) и собирать в четырех различных ваннах геля, если это необходимо.
ПРИМЕЧАНИЕ: При контакте с гельационной ванной, альгинат в каплях мгновенно перекрестно сионные с ионами кальция в гельационной ванне и образуют сферические микробусы. - Через минуту снимите шарик геля с магнитной платформы и дайте микробусам сидеть еще 4 минуты без возбуждения (время необходимо для полного гелирования через микробусы при комнатной температуре).
- Извлекайете микробусы.
- Удалите любой большой альгинат мусора или артефактов с помощью пары стерильных пинцета, а затем использовать стерильный пластиковый пипетка для передачи в 74 мкм сетчатый фильтр для извлечения микробусов из гельатальной ванны.
- Перенесите микробусы в центрифужную трубку с использованием соответствующей культуры среды и дайте уравновесить в течение 5 минут в среде клеточной культуры.
- Передача в колбу, тарелку или чашку Петри для инкубации и дальнейших экспериментов.
ПРИМЕЧАНИЕ: Геляционная ванна не должна использоваться повторно.
4. Тестирование и использование микробусов
- Тест микробида качества.
- Чтобы оценить жизнеспособность клеток (или других биологических считываний) после инкапсуляции и культуры, осторожно нарушить microbeads освободить инкапсулированных клеток с помощью растворения смеси.
ПРИМЕЧАНИЕ: Необходимый объем смеси растворения зависит от количества микробусов, используемых в тесте. Предлагаемый рацион составляет 4 мл растворения смеси на каждые 1 мл инкапсулированных клеток. Этот шаг должен быть выполнен только на одной выборке сюда каждой популяции микробов. - Инкубировать клетки в инкубаторе клеточной культуры дополняется 5% CO2 при 37 градусах по Цельсию в течение 10 мин.
- Оцените жизнеспособность клеток в настоящее время в растворе, как обычно, окрашивая клетки с трипан синим и с помощью гемоситометра камеры.
ПРИМЕЧАНИЕ: При использовании автоматизированных счетчиков клеток для оценки жизнеспособности клеток следует соблюдать осторожность, чтобы избежать альгината артефактов, мешающих подсчетам. В этих случаях рекомендуется подсчет налальных ячеек. - Для оценки устойчивости микробусов измерьте средний диаметр выборки от каждой популяции микробидов в течение времени с помощью микроскопа и программного обеспечения для визуализации. Резкие последующие колебания в диаметре могут свидетельствовать о деградации альгината.
- Чтобы оценить жизнеспособность клеток (или других биологических считываний) после инкапсуляции и культуры, осторожно нарушить microbeads освободить инкапсулированных клеток с помощью растворения смеси.
- Используйте микрошарики для обнаружения секретированных АЗ.
- Образец среды культуры клеток из 7PA2 ячеек культивируется в стандартных условиях (2D) с интервалом 24 ч и хранить при -20 градусов по Цельсию для дальнейшего анализа.
- Образец среды культуры клеток из инкапсулированных 7PA2 ячеек культивируется в стандартных условиях (3D) с интервалом 24 ч и хранится при -20 градусов по Цельсию для дальнейшего анализа.
- Обнаружить секрецию АЗ из 7PA2 клеток в собранные условные носители с помощью фермент-связанных иммуносорбентных анализ (ELISA) (Рисунок 4).
- Используйте микробусы для дальнейшего изучения в соответствующих приложениях.
ПРИМЕЧАНИЕ: Инкапсулированные 7PA2 клетки могут быть использованы для оценки воздействия устойчивого секреции АЗ в любой или модели.- Для микробов прививок внутри гиппокампа крысы в мозге, генерировать 1 мм толщиной корональных участков мозга крысы и использовать хирургические инструменты для вставки микробусов в нужную область (Рисунок 5).
- Инкапсулировать различные типы клеток в альгината микробусы после описанных протоколов для оценки устойчивого выпуска биомолекул, представляющих интерес. Соответствующие системы in vitro и in vivo могут быть дополнительно смоделированы.
- Обнаружить экспрессию мембранных маркеров инкапсулированных клеток с помощью цитометрии потока и/или иммунофлуоресценции.
ПРИМЕЧАНИЕ: Пример использования аналогичного метода для изготовления микробусов моделирования ранних стадиях роста опухолевой массы и экспрессии биомаркеров описывается Риос 20.
Результаты
Клетки 7PA2 успешно инкапсулированы в альгинатные микробусы
После приготовления с помощью этого протокола успешно генерируются однородные и сферические альгинатные микробусы. Изображения на рисунке 2А ниже демонстрируют пример того, как изменение одного из параметров (т.е. напряжения) изменяет поток и дисперсию потока альгината. Рисунок 2 B показывает пример полученных альгинатных бусин сразу после процесса гелирования.
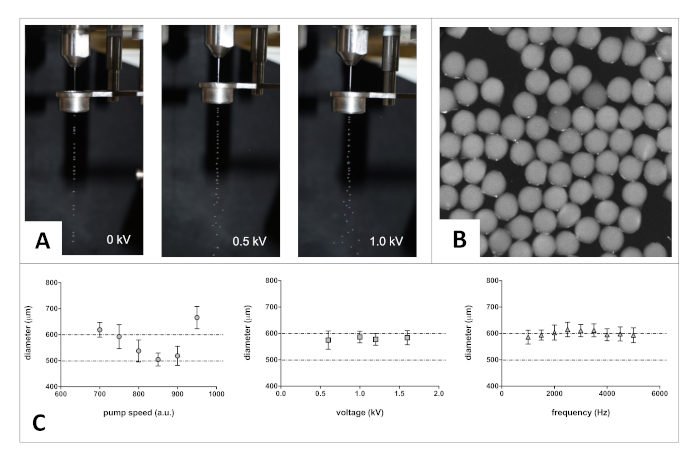
Рисунок 2 : Оптимизация метода изготовления. (A) Фотографии, показывающие изменения в дисперсии потока. (B) Ярко-поле изображение, показывающее альгинатные сферические микробусы сразу после изготовления. (C) Пример шага оптимизации: настройка выбранных параметров изготовления для достижения целевого размера микробида. Выбранные графики, чтобы проиллюстрировать взаимосвязь между каждым параметром и размером резцирующихся микробусов (распределение размера по крайней мере n и 100 микробусов). Обратите внимание, что насадка внутреннего диаметра, вязкость выброшенного раствора и условия гелевания также могут влиять на размер изготовленных бусин. Бары ошибок представляют S.D. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Описанный протокол является гибким и позволяет изготавливать различные размеры альгинатных микробусов, изменяющихся по составу в зависимости от применения. На рисунке 2C, мы сообщаем о влиянии альгината скорость потока, напряжения и частоты на размер микробида с помощью 2% (w/v) альгината раствора в HEPES (pH 7.2) экструдированный через сопло 300 мкм.
Поскольку область применения этого исследования заключалась в производстве микробусов, которые могут быть встроены в мозг крысы, мы скорректировали параметры изготовления, чтобы получить средний диаметр микробуса в диапазоне 500-600 мкм. Для целей контроля качества метод был оптимизирован, чтобы иметь минимальную изменчивость среди популяции сфабрикованных бусин (т.е. узкое распределение размеров). Пожалуйста, обратите внимание, что (1) произведенные бусы могут быть введены в мозг крысы с помощью шприца Гамильтон оснащен 20G иглы; и (2) одно полушарие мозга крысы может вместить до двух или трех бусин такого размера.
После оптимизации инкапсуляция 7PA2 клеток в концентрации 1,5 х 106 клеток/мл, взвешенных в 2% (w/v) альгинативном растворе, буферизированном с HEPES и сброшенной в ванне гелеобразования хлорида кальция 0,5 М, дала желаемые микробусы. Рисунок 3 Ниже показаны инкапсулированные 7PA2 клетки равномерно распределены в microbeads после одного дня в стандартных условиях культуры клетки. Пролиферация клеток 7PA2 была протестирована с использованием асссеа МТС в рамках протокола производителя. Не было существенной разницы между поведением клеток 7PA2, выращенных с альгинатом или без него в течение семидневного периода(рисунок 3B). При инкубации инкубированных клеток в стандартных условиях культуры, клетки, как ожидается, будет продолжать размножаться в течение всего эксперимента, и небольшие степени побега клеток можно ожидать, как в результате, как сообщается в других работах28. Эффекты этого могут быть смягчены путем инкапсулирования при меньшей плотности клеток или снижения концентрации сыворотки, в которой инкубируются микробусы.

Рисунок 3 : Инкапсулированные 7PA2 ячейки. (A) Ярко-поле изображение инкапсулированных 7PA2 клеток, показывающих равномерное распределение клеток по всей альгинатной микробад. Параметры изготовления были установлены для получения 150 7PA2 ячеек на бис. За 7 дней культуры не наблюдалось существенных изменений в альгинатных бусинах. (B) Не было отмечено разницы между общим распространением 7PA2 клеток, инкубированных с альгинатом против клеток, инкубированных без альгината. 7PA2 клетки растут и мигрируют по объему альгината шариков; снижение концентрации сыворотки можно считать замедлением роста клеток. Бары ошибок представляют S.D. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Alginate microbeads инкапсуляции 7PA2 клетки стабильны с течением времени
Для исследования размера и формы полученных альгинатных микробусов после изготовления и гелирования был проведен анализ микроскопа. Средний диаметр микробусов, полученных с помощью выбранного протокола, составляет 550 и 2 мкм.
Теоретически количество клеток, ожидаемых в микробане диаметром 550 мкм, можно рассчитать следующим образом:

где V и объем и радиус r. Объем одного микробида составляет 8,8 х 10-5 мл; Таким образом, количество клеток на микробус на момент инкапсуляции - 1,5 х 106) х (8,8 х 10-5) - 130 клеток.
Экспериментально мы подсчитали количество инкапсулированных ячеек сразу после изготовления. Alginate шарики были мягко нарушены с помощью растворения смеси и клетки были окрашены с трипан синий раствор. Оценка жизнеспособности и подсчет клеток проводилась с помощью гемоситометра; Полученные результаты показали, в среднем 116 и 17 живых клеток на микробус (n No 5, данные не сообщается). Как и ожидалось, незначительное различие между теоретическим и экспериментальным количеством клеток сразу же после инкапсуляции наблюдалось. Для некоторых приложений, и в частности для определения количества выпущенных АЗ с течением времени, важно предсказать количество клеток, инкапсулированных в каждом альгинатном бисяре.
Интересно, что процесс инкапсуляции не оказывает существенного влияния на жизнеспособность клеток. Результаты представлены в предыдущей работе, в которой колоректальные раковые клетки (т.е. HCT-116) были инкапсулированы с помощью аналогичного метода, без каких-либо различий в жизнеспособности клеток в альгинатиальных микробусов по сравнению с 2D-контролем20.
Для измерения стабильности альгината, используемого в процессе инкапсуляции, мы измерили диаметры микробов в течение 14-дневного периода (n no 100). Не было отмечено никаких изменений среднего диаметра через 14 дней после инкапсуляции по сравнению с сразу после инкапсуляции (данные не сообщаются).
Инкапсулированные 7PA2 ячейки высвобождают АЗ с течением времени
Условные средства массовой информации, проанализированные из 2D и 3D культур 7PA2 клеток, показывают постоянное увеличение уровня АЗ1-42. Средства массовой информации клеточной культуры были отобраны каждые 24 ч и до четырех дней, и проанализированы с помощью ELISA. Наши данные показывают, что скорость высвобождения АЗ1-42 из микробусов (3D) аналогична по профилю, высвобожденного из 2D-культуры (рисунок 4).
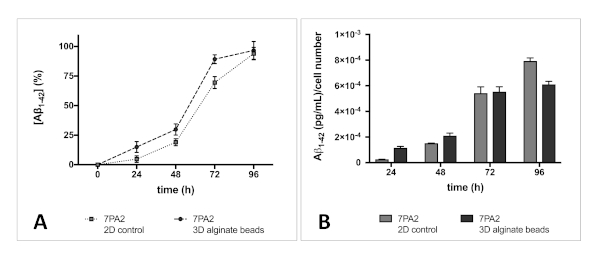
Рисунок 4 : Коэффициент секрецииА1-42 из 7PA2 ячеек. (A) Выпуск АЗ (% нормализованный после 4 дней) от 2D и 3D in vitro модели имеет аналогичный профиль. Обе модели показывают постоянное увеличение уровня АЗ в течение четырехдневного периода, и, как ожидается, устойчивая концентрация не достигается. (B) Концентрация А1-42 нормализовалась к первоначальному номеру ячейки, показывая аналогичную секрецию АЗ1-42 с течением времени, независимо от методов культивирования. Ни наличие альгината, ни процесс инкапсуляции (3D-модель in vitro) не изменяют секрецию АЗ1-42. Бары ошибок представляют S.D. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Потенциальное применение инкапсулированных 7PA2 ячеек
Сообщаем, что 7PA2 клетки, инкапсулированные в альгинатных микробусах, могут эффективно использоваться для устойчивого высвобождения АЗ1-42,и, следовательно, использоваться для проверки влияния хронической секреции АЗ в любой доклинической модели. На рисунке 5 ниже мы показываем преимущества использования альгинатных микробусов, которые могут быть легко введены и расположены в мозгу крысы. Разделы Ex vivo здесь используются для иллюстраций, сравнивая миллиметровый альгинатный шарик и изготовленные альгинатные микробусы.

Рисунок 5 : Использование микробусов для соответствующих доклинических применений. Микробусы для прививки в мозг крысы должны быть достаточно малы, чтобы быть встроенным, не создавая поражения слишком велики, чтобы избежать повреждения мозга паренхимы и отрицательно влияет на нормальную функцию мозга. Изображение (A) показывает сравнение размера между миллиметровым масоном и бисом микрометрового масштаба бок о бок. (B) Имплантация миллиметрового масштаба бибы в головном мозге для in vivo целей не будет работать. Изображение (C) показывает микробус, изготовленный с помощью этого протокола. Размер подходит для вставки в гиппокамп крысы, не оказывая пагубного влияния на нормальную физиологию. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
На приведенных выше изображениях подчеркивается важность контроля размера микробуса для таких исследований. Здесь мы демонстрируем преимущество использования микробусов диаметром менее 600 мкм. Это позволяет использовать минимально инвазивные инъекции (например, шприц Гамильтона), чтобы лучше контролировать расположение инъекционных бусин в головном мозге.
Таким образом, инкапсуляция 7PA2 клеток дает контроль над размером микробусов, количество инкапсулированных клеток и предсказание АЗ выделяется из микробусов (например, концентрация, профиль выпуска). Контроль размера микробусов имеет важное значение по двум причинам: 1) для того, чтобы позволить точно настроить контроль над концентрацией выпущенных АЗ, и 2) для имплантации в контролируемой области мозга крысы. Полученные здесь результаты описывают поверхностную настройку альгинатных микробусов и подчеркивают потенциальные применения для дальнейших исследований.
Обсуждение
Метод, изложенный в этой статье, полезен для инкапсуляции клеток, достигающих узкого распределения размеров альгинатных микробусов27. Это также дает преимущество выращивания клеток в иммуноизолированной среде17,19, защищая их от внешнего стресса. Кроме того, инкапсуляция клеток в альгинате более точно имитирует физиологические условия, особенно в отношении клеточных взаимодействий и матричной жесткости20. Все эти факторы имеют особенно важное значение для последующего использования в соответствующих приложениях, таких как in vivo engraftment, исключая потенциальные иммунные реакции в окружающих тканях17. Кроме того, основным преимуществом этого протокола является легкая настройка в зависимости от приложения интереса: можно изменить протокол и оптимизировать параметры для изготовления больших или меньших, а также более мягкую или жесткую бусинку. Описанный метод используется для изготовления бисера достаточно мал, чтобы быть введены с минимально инвазивных методов, и достаточно большой, чтобы разместить ряд клеток и обеспечить достаточное освобождение АЗ, чтобы привести к наблюдаемым поведенческих и патологических эффектов при инъекциях в животных моделях.
Успех этого протокола зависит от ряда важных шагов. Тщательная обработка клеток и оптимальные методы культивирования клеток важны для поддержания жизнеспособности клеток и функции20,28. Использование стандартных условий культуры обеспечивает сохранение нормальной функции 7PA2 клеток, как наблюдается. Это позволяет получить аналогичный профиль выпуска для АЗ1-42 из инкапсулированных ячеек по сравнению с 2D культурами. Кроме того, для оптимальной работы протокола, раствор с низкой вязкостью гарантирует лучшие результаты по сравнению с высоковязким альгинативным раствором. Это гарантирует, что однородная ламинальная струя выдавливается через сопло и равномерное распределение клеток в матрице сфабрикованных бусин27. Материалы, используемые для инкапсулирования клеток, должны иметь очень быстрый механизм гелирования, позволяющий удерживать форму.
Другим важным шагом в этом протоколе является обработка изготовленных микробусов после гелирования. Здесь мы показываем извлечения микробусов с помощью большой проемной пластиковой пипетки для передачи бисера. Кроме того, заливка раствора хлорида кальция, содержащего микробусы, в сетчатый фильтр может быть использован адля бисера. Для составления микробусов можно использовать серологическую пипетку (5, 10 или 25 мл), а затем промывать через сетчатый фильтр вместо заливки. Преимуществом этого является более высокая уверенность в бесплодии процедуры по сравнению с заливкой. Тем не менее, ограничения заключается в том, что некоторые бусы могут быть искажены, если они сжаты пипеткой, в дополнение к рискуя более низкой урожайности, если большая часть микробусов не спасены.
Этот подход был использован для инкапсулирования различных клеточных линий для моделирования и изучения различных заболеваний (например, высвобождение инсулина из инкапсуляционного поджелудочного газлета). Новизной нашего подхода является прививка микробусов, генерируемых с помощью этого протокола в качестве полезного метода в моделировании важных аспектов болезни Альцгеймера in vivo. При сравнении профиля выпуска АЗ из инкапсулированных клеток(Рисунок4) с уровнями АЗ, генерируемых инъекцией болуса (например, о том, что сообщалось в других исследованиях3,26), более хроническим и устойчивым высвобождение АЗ может быть Ожидал. Рисунок 6 иллюстрирует прогнозируемую тенденцию, которая может быть достигнута. Использование этой системы для моделирования in vivo более актуально для того, как болезнь прогрессирует и может быть более полезным в открытии и разработке лекарств.

Рисунок 6 : Прогнозируемый профиль выпуска АЗ1-42 из инкапсулированных 7PA2 клеток по сравнению с инъекцией болюса. Профиль выпуска АЗ из привязатых 7PA2-содержащих микробусов позволяет проверить воздействие хронических и устойчивых АЗ в животной модели, относящих ся. И наоборот, инъекция болуса создаст всплеск уровня АЗ в течение короткого периода времени, а затем быстрое обезвреживание АЗ от мозга. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить г-на Кажена Суреспарана, д-ра Джонатана Вубету, г-на Доминика Грудзински, г-на Чэнь Чжао и д-ра Тьерри Пилота за их помощь в оптимизации производства альгината микробов, клеточной культуры и обнаружения АЗ, а также полезных научных Обсуждения.
Материалы
| Name | Company | Catalog Number | Comments |
| µManager software | Vale Lab, UCSF, USA | v.1.46 | |
| 0.22 um PES filter | Merck, UK | SLGP033RS | |
| 15mm Netwell insert 74 um mesh filter | Constar, usa | #3477 | |
| Alginic acid sodium salt from brown algae | Sigma-Aldrich,uk | A0682 | |
| Calcium chloride | Sigma-Aldrich,uk | C1016 | |
| CellTiter96 AQueous One Solution cell proliferation assay | Promega, USA | G3580 | |
| Encapsulator | Inotech | IE-50 | serial no. 05.002.01-2005 |
| HEPES | Sigma-Aldrich,uk | H4024 | |
| Hu Aβ 1-42 ELISA | ThermoFisher, UK | KHB3441 | |
| ImageJ software | ImageJ | v1.49p | |
| Inverted light microscope | Olympus | CKX41 | |
| Leica microscope | Leica microsystems, UK | DMI6000B | |
| Neo sCMOS Camera | Ander, UK | 5.5 | |
| Phosphate buffered saline | Sigma-Aldrich,uk | D1408 | |
| Sodium chloride | Sigma-Aldrich,uk | 433209 | |
| Trispdium citrate dihydrate | Sigma-Aldrich,uk | W302600-K | |
| Trypsin-EDTA solution | Sigma-Aldrich,uk | T4049 |
Ссылки
- Hardy, J. A., Higgins, G. A. Alzheimer's disease: the amyloid cascade hypothesis. Science. 256, 184-185 (1992).
- Karthick, C., et al. Time-dependent effect of oligomeric amyloid-β (1-42)-induced hippocampal neurodegeneration in rat model of Alzheimer's disease. Neurological Research. 41 (2), 139-150 (2018).
- Watremez, W., et al. Stabilized Low-n Amyloid-β Oligomers Induce Robust Novel Object Recognition Deficits Associated with Inflammatory, Synaptic, and GABAergic Dysfunction in the Rat. Journal of Alzheimer's Disease. 62 (1), 213-226 (2018).
- Brouillette, J., et al. Neurotoxicity and memory deficits induced by soluble low-molecular-weight amyloid-β1-42 oligomers are revealed in vivo by using a novel animal model. Journal of Neurosciences. 32 (23), 7852-7861 (2012).
- Solana, C., Tarazona, R., Solana, R. Immunosenescence of Natural Killer Cells, Inflammation, and Alzheimer's Disease. International Journal of Alzheimer's Disease. , 3128758(2018).
- Sturchler-Pierrat, C., et al. Two amyloid precursor protein transgenic mouse models with Alzheimer disease-like pathology. Proceedings of the National Academy of Sciences of the United States of America. 94 (24), 13287-13292 (1997).
- Tomiyama, T., et al. A mouse model of amyloid beta oligomers: their contribution to synaptic alteration, abnormal tau phosphorylation, glial activation, and neuronal loss in vivo. Journal of Neurosciences. 30 (14), 4845-4856 (2010).
- Saito, T., et al. Single App knock-in mouse models of Alzheimer's disease. Nature Neurosciences. 17 (5), 661-663 (2014).
- Oddo, S., et al. Triple-Transgenic Model of Alzheimer's Disease with Plaques and Tangles: Intracellular A and Synaptic Dysfunction. Neuron. 39 (3), 409-421 (2003).
- Leon, W. C., et al. A Novel Transgenic Rat Model with a Full Alzheimer's-Like Amyloid Pathology Displays Pre-Plaque Intracellular Amyloid-β-Associated Cognitive Impairment. Journal of Alzheimer's Disease. 20 (1), 113-126 (2010).
- Prince, M., et al. Dementia UK: Second Edition - Overview. Alzheimer's Society. , 61(2007).
- Cavanaugh, S. E., Pippin, J. J., Barnard, N. D. Animal models of Alzheimer disease: historical pitfalls and a path forward. Alternatives to animal experimentation. 31 (3), 279-302 (2014).
- Oakley, H., et al. Intraneuronal β-Amyloid Aggregates, Neurodegeneration, and Neuron Loss in Transgenic Mice with Five Familial Alzheimer's Disease Mutations: Potential Factors in Amyloid Plaque Formation. The Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Forny-Germano, L., et al. Alzheimer's Disease-Like Pathology Induced by Amyloid-β Oligomers in Nonhuman Primates. Journal of Neuroscience. 34 (41), 13629-13643 (2014).
- Masliah, E., et al. Altered expression of synaptic proteins occurs early during progression of Alzheimer's disease. Neurology. 56 (1), 127-129 (2001).
- Lepelletier, F. X., Mann, D. M. A., Robinson, A. C., Pinteaux, E., Boutin, H. Early changes in extracellular matrix in Alzheimer's disease. Neuropathology and Applied Neurobiology. 43 (2), 167-182 (2017).
- Calafiore, R., Basta, G. Clinical application of microencapsulated islets: Actual prospectives on progress and challenges. Advanced Drug Delivery Reviews. 67-68, 84-92 (2014).
- Lim, F., Sun, A. M. Microencapsulated islets as bioartificial endocrine pancreas. Science. 210 (4472), 908-910 (1980).
- Tran, N. M., et al. Alginate hydrogel protects encapsulated hepatic HuH-7 cells against hepatitis C virus and other viral infections. PLoS One. 9 (10), 109969(2014).
- Rios de la Rosa, J. M., Wubetu, J., Tirelli, N., Tirella, A. Colorectal tumor 3D in vitro models: advantages of biofabrication for the recapitulation of early stages of tumour development. Biomedical Physics & Engineering Express. 4 (4), 045010(2018).
- Tirella, A., Orsini, A., Vozzi, G., Ahluwalia, A. A phase diagram for microfabrication of geometrically controlled hydrogel scaffolds. Biofabrication. 1 (4), 045002(2009).
- Smalley, K. S. M., Lioni, M., Herlyn, M. Life ins't flat: Taking cancer biology to the next dimension. In Vitro Cellular & Developmental Biology - Animal. 42 (8-9), 242-247 (2006).
- Podlisny, M. B., et al. Aggregation of secreted amyloid beta-protein into sodium dodecyl sulfate-stable oligomers in cell culture. Journal of Biological Chemistry. 270 (16), 9564-9570 (1995).
- Portelius, E., et al. Mass spectrometric characterization of amyloid-β species in the 7PA2 cell model of Alzheimer's disease. Journal of Alzheimer's Disease. 33 (1), 85-93 (2013).
- Welzel, A. T., et al. Secreted amyloid β-proteins in a cell culture model include N-terminally extended peptides that impair synaptic plasticity. Biochemistry. 53 (24), 3908-3921 (2014).
- O'Hare, E., et al. Orally bioavailable small molecule drug protects memory in Alzheimer's disease models. Neurobiology of Aging. 34 (4), 1116-1125 (2013).
- Nedović, V., Willaert, R. Fundamentals of Cell Immobilisation Biotechnology. Methods and Technologies for Cell Immobilisation/Encapsulation. , Focus on Biotechnology book series, Springer Link (FOBI, volume 8A) 185-204 (2004).
- Omer, A., et al. Long-term Normoglycemia in Rats Receiving Transplants with Encapsulated Islets. Transplantation. 79 (1), 52-58 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены