Method Article
تصنيع Amyloid-β-إفراز الجينات Microbeads لاستخدامها في نمذجة مرض الزهايمر
In This Article
Summary
يوضح هذا البروتوكول طريقة تغليف الخلايا عن طريق الهلام البدني السريع للالجينات لشل الخلايا. microbeads الحصول عليها تسمح بإفراز تسيطر عليها ومستمرة من الأميلويد بيتا مع مرور الوقت، ويمكن استخدامها لدراسة آثار الأميلويد بيتا تفرز في المختبر وفي نماذج الجسم الحي.
Abstract
وفقا لفرضية شلال الأميلويد، وأقرب الزناد في تطور مرض الزهايمر (AD) هو تراكم شظايا الأميلويد بيتا السامة (Aβ)، مما يؤدي في نهاية المطاف إلى السمات الكلاسيكية للمرض: لويحات الأميلويد، التشابك العصبي وفقدان متشابك والخلايا العصبية. عدم وجود نماذج ما قبل السريرية غير المعدلة وراثيا ذات الصلة التي تعكس تطور المرض هو واحد من العوامل الرئيسية التي تعوق اكتشاف العلاجات الفعالة للأدوية. ولهذه الغاية، قمنا بتطوير بروتوكول لتصنيع الخرز الصغير الجينات التي تحتوي على خلايا إفراز الأميلويد مفيدة لدراسة آثار إنتاج Aβ المزمن.
وقد استخدمت في هذه الدراسة خلايا مبيض الهامستر الصينية التي كانت تُنقل سابقاً بجين ة بشرية من الـ APP، تفرز Aβ (أي خلايا 7PA2)، في هذه الدراسة. تم تصنيع نموذج ثلاثي الأبعاد (ثلاثي الأبعاد) في المختبر للإفراج المستدام عن Aβ عن طريق تغليف خلايا 7PA2 في الجينات. تم تحسين هذه العملية لاستهداف قطر حبة من 500-600 ميكرومتر لمزيد من الدراسات في الجسم الحي. تم تنفيذ الأمثل من تغليف الخلايا 7PA2 في الجينات تغيير معلمات التصنيع، على سبيل المثال، تركيز الجينات، معدل تدفق هلام، الإمكانات الكهروستاتيكية، تردد اهتزاز الرأس، حل الهلام. تم تحليل مستويات Aβ تفرز مع مرور الوقت ومقارنة بين حبات الجينات وأساليب زراعة الخلايا القياسية (تصل إلى 96 ساعة).
تم العثور على تركيز 1.5 × 106 7PA2 الخلايا / مل وتركيز الجينات من 2٪ (ث / الخامس) المخزنة مع HEPES وهلام اللاحقة في 0.5 M كلوريد الكالسيوم لمدة 5 دقائق لتلفيق microbeads الأكثر استقرارا. وكانت microbeads ملفقة 1) من حجم موحد، 2) مع متوسط قطرها 550 ميكرومتر، 3) تحتوي على حوالي 100-150 خلية لكل ميكروبيد و 4) قادرة على إفراز Aβ.
في الختام، لدينا طريقة الأمثل لإنتاج microbeads الجينات مستقرة التي تحتوي على خلايا 7PA2 المنتجة الأميلويد قد تمكن من نمذجة جوانب هامة من AD في المختبر وفي الجسم الحي على حد سواء.
Introduction
النمذجة الأمراض العصبية صعبة بسبب الطبيعة المعقدة والمعقدة للدماغ. في مرض الزهايمر (AD)، ويعتقد أن فقدان تدريجي لوظيفة متشابك ووفاة الخلايا العصبية أن يكون تأثير المصب من الإفراط المستمر وتراكم بيتا الأميلويد (Aβ) الببتيدات بعد معالجة غير طبيعية من السلائف الأميلويد البروتين (APP) وفقا لفرضية شلال الأميلويد1.
من أجل فهم آليات هذا المرض الناجم عن الأميلويد والمساعدة في تحديد أهداف العلاج الجديدة، وقد وضعت العلماء مختلف في نماذج ما قبل السريرية الجسم الحي. فئة واحدة من النماذج يستخدم حقن بولوس من الببتيد Aβ الاصطناعية في الدماغ الفئران2،3،4. الحد الرئيسي من هذه النماذج هو أنها تعتمد على نقطة واحدة أو العلاجات المتكررة مع الببتيدات Aβ في تركيزات عالية أودعت كل دفعة واحدة. وهذا لا يتفق مع الطبيعة المزمنة والمستدامة لإطلاق Aβ في المرض5. فئة أخرى من النماذج في الجسم الحي هي نماذج الحيوانات المعدلة وراثيا التي تعبر عن واحد أو أكثر من الطفرات الوراثية المرتبطة الاختلافات العائلية للمرض6،7،8،9، 10.ومع ذلك، منذ AD العائلية لا يمثل سوى أقل من 5٪ من جميع حالات الزهايمر11،أهمية هذه النماذج في ترجمة إلى AD متفرقة في البشر مشكوك فيها12. عيب آخر من النهج المعدل وراثيا هو تشكيل Aβ المعجل من الولادة، والذي يترجم إلى العجز في الوظائف المعرفية والتغيرات المرضية بسرعة كبيرة وبقوة لتشبه تطور المرض في AD متفرقة في المرضى12 . على سبيل المثال، ينتج نموذج FAD 5x لويحات في أقل من 1.5 شهر13.
ومن المثير للاهتمام، كل من هذه الفئاتتؤدي إلى تغييرات في الوظائف المعرفية ذات الصلة لبحوث AD 2،3،4،5،6،وأحيانا تكون مصحوبة ظهور السمات المرضية للمرض مثل لويحات الأميلويد6،8، تاو فوسفوريل6،7 و / أو متشابك وفقدان الخلايا العصبية7،9، 14. ولكن في حين أن هذه الأنواع من النماذج قد تعطينا نظرة ثاقبة في آثار مستويات عالية من الأميلويد في الدماغ، والتي غالبا ما ترتبط مع المراحل اللاحقة من AD، فإنها تفشل في التعبير عن التغيرات السابقة التي عرضت استجابة للتعرض المزمن والمستمر لAβ الببتيد12،مثل تغيير التعبير من علامات متشابك15 والمكونات في المصفوفة خارج الخلية16. لذلك، لا تزال هناك حاجة لخلق نموذج مزمن يوضح بشكل أكثر دقة آثار إفراز Aβ المستمر على الإدراك في الجسم الحي ويوضح التغيرات في علم الأمراض.
ولهذه الغاية، قمنا بتطوير نظام يسمح بإفراز ثابت ومستدام من Aβ بطريقة خاضعة للرقابة عن طريق تعطيل الخلايا النشوانية السرية داخل الخرز الصغير هيدروجيل، والتي يمكن زرعها في وقت لاحق داخل الدماغ الفئران الكبار لنمذجة الجوانب من AD متفرقة.
كانت الجينات المواد الحيوية المختارة لأنها متوافقة بيولوجيا ولا تحفز أي استجابات سلبية عند زرعها في الجسم الحي17. وقد تم تأسيس تغليف الخلايا في هيدروجيلات الجينات بشكل جيد على مدى العقود الأربعة الماضية. تم الإبلاغ عن أول مثال على ترجمتها إلى العيادة لعلاج مرض السكري من النوع 117. يعود أقدم تقرير عن التغليف الناجح للجزر الصغيرة في لانجرهانس إلى عام 1980. زرع microbeads التي تحتوي على خلايا إفراز الأنسولين ثورة خيارات العلاج لمرضى السكري كما أنها استعادة وظيفة البنكرياس، والقضاء على الحاجة إلى العلاج حقن الأنسولين18. هذه الأعمال تقرير عن كيفية تغليف الخلايا يمكن حمايتها من الضغوط الخارجية، سواء الميكانيكية أو الكيميائية. في الواقع، حبات الجينات بمثابة حاجز وعزل الخلايا من البيئة المحيطة الحفاظ على النمط الظاهري، في حين يسمح الوصول الكافي إلى وسائل الإعلام المحيطة للمغذيات وإزالة المنتجات الثانوية الخلوية19. وعلاوة على ذلك، فإن استخدام الجينات يسمح مطابقة الخصائص الميكانيكية للأنسجة الرخوة20. يمكن ضبط هيدروجيلات الجينات لتكون صلابة من 1-30 كيلوباسكال، ببساطة متفاوتة تركيز الجينات وكثافة عبر ربط20،21. هذا هو الجانب الأساسي، ليس فقط للحفاظ على التعبير phenotypic من الخلايا المغلفة في المختبر، ولكن أيضا لتجنب أي آثار التهابية بعد الطعوم في الجسم الحي22.
في هذا البروتوكول، يتم استخدام خلايا 7PA2 - خط خلية مبيض الهامستر الصينية التي يتم نقلها بشكل ثابت مع الإنسان APP V717F الجينات المتحولة23 - . هذه الخلايا تنتج باستمرار المنتجات الحفازة من APP، بما في ذلك Aβ1-4224،25،وقد استخدمت لتوليد Aβ كبديل للإنتاج الاصطناعية في ما قبل السريرية، حادة في الدراسات الحية26. نحن نصف طريقة تصنيع لشل 7PA2 الخلايا داخل 'لينة' microbeads الجينات، مصممة للسماح بإفراز مستمر من الجزيئات الحيوية. كدليل على المفهوم، ونحن تقرير عن الافراج عن الببتيد Aβ1-42 مع مرور الوقت. الجينات التي يتم استخدامها هي الجينات منخفضة اللزوجة مع الوزن الجزيئي من 120،000-190،000 غرام / مول ونسبة المنوركونيك إلى الغولورونيكس من 1.56 (M / G).
في دراسات أخرى ، يمكن زرع هذه الخرز اتّجاهًا آمنًا داخل مناطق دماغ الفئران ذات الصلة بـ AD (على سبيل المثال، الحصين) لدراسة آثار إفراز Aβ المزمن على السلوك في الجسم الحي وعلم الأمراض في الجسم الحي . وبالإضافة إلى ذلك، يمكن استخدام هذا النظام لدراسة آثار الإفراج عن Aβ المزمن ة في تطبيقات المختبر والجسم الحي السابق. على سبيل المثال، يمكن زراعة الخرز الصغير الذي يحتوي على 7PA2 في المختبر مع الثقافات العصبية أو الفلكية لتقييم آثار التعرض المزمن لـ Aβ على الآليات الخلوية المرتبطة بAD. وعلاوة على ذلك، يمكن استخدام هذه الطريقة لدراسة العلاقة بين إنتاج Aβ المزمن والتقوية على المدى الطويل في الفيزيولوجيا الكهربائية في الجسم الحي السابق.
تسليط الضوء على هذا البروتوكول هو وحدات ومرونة طريقة التصنيع، والتي تمكن من تصنيع الخرز الجينات مع البعد المستهدف من خلال صقل المعلمات تلفيق. اعتمادا على التطبيق، يمكن تعديل البروتوكول للحصول على أهداف مفصلة فيما يتعلق بحجم microbead، وكثافة الخلايا المغلفة، وتصلب microbead. ويمكن استخدام هذا البروتوكول لتغليف مجموعة متنوعة من أنواع الخلايا، وتطوير نماذج ثلاثية الأبعاد (ثلاثية الأبعاد) أكثر صلة في المختبر لدراسة أمراض مختلفة. أبلغنا مؤخرا عن كيفية الخلايا المغلفة الجينات يمكن استخدامها لنموذج المراحل المبكرة من تطور السرطان20.
ويستند مفهوم عملية التغليف على قذف طائرة لامينار من الخلايا المعلقة في محلول الجينات من خلال فوهة. رئيس تهتز يعطل الطائرة مع تردد التحكم مما أدى إلى قطرات على أساس الجينات على قدم المساواة. يسمح الحقل الكهربائي الخارجي بفصل قطرات الجينات المُشكَّلة المستندة إلى الجينات، والتي يمكن هادىًذا النُصيب في الأيونات ثنائية التكافؤ، مثل أيونات الكالسيوم، بسرعة عبر الوصلات، مع الحفاظ على شكلها الكروي. الحضانة في حل الهلام يسمح تشكيل microbeads كروية تحتوي على خلايا داخل هيدروجيل المادية متجانسة27. الحجم المستهدف من microbeads وهيدروجيلات الجينات يسمحق المغذيات وتبادل الأكسجين مع وسائل الإعلام ثقافة الخلية لفترات طويلة من الزمن (أسابيع). الشكل 1 عرض تمثيل تخطيطي لجهاز التغليف المستخدم (الشكل1B).

الشكل 1 نظام التغليف: (أ) التمثيل التخطيطي لنظام التغليف. يتم تحميل تعليق خلايا الجينات في حقنة (2) ويتم تغذيتها من خلال خزان بسرعة قذف مجموعة في مضخة حقنة (1). في الخزان، تهتز قبعة الاهتزاز (3) عند تردد تم ضبطه بواسطة مولد الموجي (4) لتعطيل الدفق على فترات متساوية، مما يشكل قطرات متساوية الحجم. كما يتم تغذية الحل من خلال فوهة (5) ويتم تشكيل قطرات، يتم تطبيق إمكانات كهرباء عبر قطب كهربائي (7) التي وضعتها مولد الجهد (6)، والتي تشحن قليلا سطح قطرات، مما يسمح للتيار لتنتشر نتيجة لصد القوى الكهروستاتيكية. كما قطرات الانخراط مع حمام الهلام (8)، Ca2 +مدفوعة عبر ربط النتائج من الجينات في تشكيل microbeads كروية. (ب) صورة للتغليف قبل تصنيع microbeads الجينات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن تغيير حجم Microbead اعتمادا على الاستخدام المقصود. من أجل التحكم في حجم microbead، يتم تعديل المعلمات المختلفة المبينة في الشكل 1ألف وفي البروتوكول وفقا لذلك. القطر الداخلي للفوهة المستخدمة له تأثير كبير على حجم قطرات. مزيد من ضبط معلمات التغليف، وهي سرعة البثق، تردد الاهتزاز والجهد، هو المفتاح لتحقيق توزيع حجم متسقة. الجدول 1 يحدد كيف يمكن للمعلمات المختلفة تغيير حجم microbeads التي تحققت مع هذا النظام.
| المعلمه | فوهة حجم | تردد الاهتزاز | معدل التدفق | الكهربائي الكهربائي |
 |  |  |  | |
| حبة الحجم |
 
|  |  | – |
الجدول 1: معلمات التصنيع وتأثيرها على حجم microbead. يوضح الجدول كيف يمكن لكل معلمة أن تؤثر على الحجم الناتج من الخرز الصغير الملفق، بغض النظر عن فوهة ولزوجة الحل المستخدم.
Protocol
1 - الأعمال التحضيرية
- إعداد 100 مل من ~ 4٪ (ث / الخامس) حل الأسهم الجينات.
- وزن 4.4 غرام من ملح الصوديوم الجينات وإضافة مسحوق جاف إلى 100 مل من الملح HEPES المخزنة (HBS، 20 M HEPES (0.477 غرام) مع 150 مل NaCl (0.877 غرام) في الماء منزوع الأيونات مما يسمح بالترطيب.
- استخدم النمام المغناطيسي عند حوالي 500 ثورة في الدقيقة الواحدة (دورة في الدقيقة) والحرارة حتى 50 درجة مئوية للسماح بترطيب الجينات الكامل.
ملاحظة: قد تحتاج الجينات إلى ساعة أو ساعتين لتكون رطبة تماما. لتوفير في الوقت المحدد، يمكن أن يتكون حل الجينات قبل يوم واحد من بروتوكول التغليف وتخزينها في 4 درجة مئوية حتى اليوم التالي. عندما يتم تبريد الجينات، سخني بلطف إلى 37 درجة مئوية باستخدام حمام مائي أو طبق ساخن وتحريكمع النمام المغناطيسي مباشرة قبل الاستخدام. - تصفية معقمة محلول الجينات باستخدام 0.22 ميكرومتر م بوليإيثرسولفون (PES) مرشح قبل الاستخدام. ينصح بالتصفية عند درجة حرارة 37 درجة مئوية للسماح بتدفق سريع للالجينات. سوف تزيد اللزوجة إذا سمح لدرجة الحرارة أن تنخفض.
- إعداد 1000 مل من 0.5 M CaCl2.
- وزن 55.49 غرام من الكالكال اللامائية2 ويذوب في 1000 مل من HBS (20 MM HEPES و 150 MM NaCl في 1000 مل من المياه منزوعة الأيونات).
- فلتر معقم باستخدام فلتر مسام PES بـ 0.22 م.
- إعداد 100 مل من مزيج حل.
- إعداد 100 مم HEPES (23.83 غرام) و 500 مل سترات ثلاثي الصوديوم ثنائي الهيدرات (147.05 غرام) في محلول ملحي مخزن بالفوسفات.
- ضبط إلى الحموضة 7.4 باستخدام هيدروكسيد الصوديوم أو حمض الهيدروكلوريك.
2. إعداد نظام التغليف
- تنظيف غطاء محرك السيارة تدفق laminar.
- تعقيم غطاء محرك السيارة تدفق laminar التي تحتوي على التغليف باستخدام التعرض للأشعة فوق البنفسجية تليها الرش مع 70٪ الخامس / الخامس حل الإيثانول.
- امسح نظام التغليف بـ 10 مل من محلول الإيثانول بنسبة 70% مع 10 مل من الماء المعقمة.
- قم بإرفاق فوهة 300 ميكرومتر وكرر الخطوة 2.1.2.
- رش الزجاجة التي تحتوي على محلول الجينات المصفاة، وزجاجة تحتوي على محلول كلوريد الكالسيوم المصفاة وأي أدوات ومعدات ولوحات ثقافة فارغة التي سيتم استخدامها مع 70٪ الخامس / الخامس حل الإيثانول ووضعها في غطاء محرك السيارة تدفق لامينار. قبل الاستخدام، قم بتشغيل ضوء الأشعة فوق البنفسجية مرة أخرى لمدة 30 دقيقة لتعقيمه تمامًا.
- إعداد الكأس النفايات مليئة محلول مطهر الصف البيولوجية ووضع الكأس في غطاء محرك السيارة.
- ملء الكأس مع 100 مل من محلول CaCl2 (مائي) معقمة وإضافة في النمام المغناطيسي. تعيين سرعة التحريك إلى 100 دورة في الدقيقة. ضع الكأس على منصة مغناطيسية على ارتفاع 18 سم من طرف الفوهة. سيتم استخدام هذا الكأس لجمع الخرز الجينات والسماح لها هلام.
- إعداد الخلايا للتغليف.
- إزالة الخلايا من الحاضنة وفصل من قارورة شبه confluent باستخدام 0.25٪ trypsin-EDTA الحل وحضانة في 37 درجة مئوية لمدة 5-10 دقيقة.
- عزل عينة لتقدير كثافة الخلايا ومن ثم طرد الخلايا المتبقية في 1000 دورة في الدقيقة لمدة 5 دقائق للحصول على بيليه الخلية.
- إعادة تعليق بيليه في HBS (20 M HEPES و 150 مل حمض الانكل) لمضاعفة تركيز الخلية النهائي المطلوب (على سبيل المثال، للتركيز النهائي من 1.5 × 106 خلايا / مل، وإعادة تعليق الخلايا في HBS لتحقيق تركيز 3 × 106 خلايا / مل).
- في أنبوب الطرد المركزي 50 مل، مزيج تعليق الخلية في نسبة 1:1 مع ~ 4٪ (ث / الخامس) محلول الجينات للحصول على تعليق نهائي يحتوي على تركيز الخلية المطلوب (على سبيل المثال، 1.5 × 106 خلايا / مل) في ~ 2٪ (ث / الخامس) محلول الجينات.
- تعيين معلمات التغليف.
- تعيين سرعة آلة التغليف إلى أقصى سرعة قذف (8.9 مل / دقيقة)، والجهد إلى 1.0 كيلوفولت والتردد إلى 5500 هرتز.
ملاحظة: تم تحسين هذه المعلمات سابقا للحصول على microbeads من 550 ميكرومتر في القطر.
- تعيين سرعة آلة التغليف إلى أقصى سرعة قذف (8.9 مل / دقيقة)، والجهد إلى 1.0 كيلوفولت والتردد إلى 5500 هرتز.
3- التصنيع
- افتعال الخرز الصغير.
- في حقنة 20 مل، تحميل 5 مل من تعليق الخلية الجينات وإرفاق حقنة إلى التغليف.
- بدء التغليف عن طريق تفعيل تدفق التي سوف تدفع تعليق الخلية الجينات من خلال المغذية. سيتم مقذوف تيار من قطرات من خلال فوهة.
- جمع أول 1 مل في الكأس النفايات لإبطال تيار غير موحد الأولية.
- الاستمرار في تشغيل 4 مل المتبقية السماح للقطرات أن تقع في حمام الهلام CaCl 2. يمكن تشغيل كل ملليلتر بشكل منفصل (ولكن على التوالي) وجمعها في أربعة حمامات هلام مختلفة إذا لزم الأمر.
ملاحظة: عند الاتصال مع حمام الهلام، فإن الجينات في قطرات على الفور عبر الارتباط مع أيونات الكالسيوم في حمام الهلام وشكل microbeads كروية. - بعد دقيقة واحدة، إزالة الكأس هلام من المنصة المغناطيسية والسماح microbeads للجلوس لمدة 4 دقائق أخرى دون إثارة (الوقت اللازم للسماح الجلج الكامل عبر microbeads في درجة حرارة الغرفة).
- استرداد microbeads.
- إزالة أي الحطام الجينات الكبيرة أو المصنوعات اليدوية باستخدام زوج من ملاقط معقمة، ومن ثم استخدام ماصة بلاستيكية معقمة لنقل إلى مرشح شبكة 74 ميكرومتر لاسترداد microbeads من حمام الهلام.
- نقل microbeads في أنبوب الطرد المركزي باستخدام وسيلة الثقافة المناسبة والسماح لequilibrate لمدة 5 دقائق في وسط ثقافة الخلية.
- نقل إلى قارورة، لوحة أو طبق بيتري للحضانة والمزيد من التجارب.
ملاحظة: لا ينبغي إعادة استخدام حمام الهلام.
4. اختبار واستخدام microbeads
- اختبار نوعية microbead.
- لتقييم صلاحية الخلية (أو غيرها من التلاوة البيولوجية) بعد التغليف والثقافة، قم بتعطيل الخرز الصغير بلطف لإطلاق الخلايا المغلفة باستخدام مزيج الانحلال.
ملاحظة: يعتمد الحجم المطلوب من مزيج الانحلال على عدد الخرز الصغير المستخدم لكل اختبار. حصة المقترحة هو 4 مل من مزيج حل لكل 1 مل من الخلايا المغلفة. هذه الخطوة تحتاج فقط إلى أن تنفذ على عينة واحدة جيئة وذهابا كل السكان microbead. - حضانة الخلايا في حاضنة ثقافة الخلية تستكمل مع 5٪ CO2 في 37 درجة مئوية لمدة 10 دقيقة.
- تقدير صلاحية الخلية للخلايا الآن في الحل كالمعتاد عن طريق تلطيخ الخلايا مع الأزرق trypan واستخدام غرفة مقياس الهيموكيتوميمتر.
ملاحظة: إذا كان استخدام عدادات الخلايا الآلية لتقدير صلاحية الخلية، ينبغي الحرص على تجنب القطع الأثرية الجينات تتداخل مع التهم. في تلك الحالات، ينصح عد الخلايا الناوالية. - لتقييم استقرار microbead، قياس متوسط قطر عينة من كل السكان microbead على مدى دورة زمنية باستخدام المجهر وبرامج التصوير. ويمكن أن تكون التغيرات اللاحقة الهائلة في القطر مؤشرا على تدهور الجينات.
- لتقييم صلاحية الخلية (أو غيرها من التلاوة البيولوجية) بعد التغليف والثقافة، قم بتعطيل الخرز الصغير بلطف لإطلاق الخلايا المغلفة باستخدام مزيج الانحلال.
- استخدام microbeads للكشف عن Aβ تفرز.
- عينة من وسائط ثقافة الخلية من 7PA2 الخلايا المستزرعة في الظروف القياسية (2D) في فترات 24 ساعة وتخزينها في -20 درجة مئوية لمزيد من التحليل.
- عينة وسائط ثقافة الخلية من خلايا مغلفة 7PA2 المستزرعة في الظروف القياسية (3D) في فترات 24 ساعة وتخزينها في -20 درجة مئوية لمزيد من التحليل.
- الكشف عن إفراز Aβ من الخلايا 7PA2 في وسائل الإعلام المكيفة التي تم جمعها عن طريق الفحص المناعي المرتبط ة الانزيم (ELISA) (الشكل 4).
- استخدام microbeads لمزيد من الدراسة في التطبيقات ذات الصلة.
ملاحظة: يمكن استخدام خلايا مغلفة 7PA2 لتقييم آثار إفراز Aβ المستمر في أي أو نموذج.- لتطعيم الميكروبات داخل الحصين الفئران في العقول، وتوليد 1 ملم أقسام الإكليل سميكة من الدماغ الفئران واستخدام الأدوات الجراحية لإدراج microbeads في المنطقة المطلوبة (الشكل5).
- تغليف أنواع الخلايا المختلفة في microbeads الجينات بعد البروتوكولات الموصوفة لتقييم الإطلاق المستدام للجزيئات الحيوية ذات الأهمية. ويمكن وضع المزيد من النماذج في المختبر وفي النظم الحية.
- الكشف عن التعبير عن علامات غشاء ملزمة من الخلايا المغلفة باستخدام قياس التدفق الخلوي و / أو الفلورة المناعية.
ملاحظة: مثال على استخدام طريقة مماثلة لتصنيع microbeads النمذجة المراحل المبكرة من نمو كتلة الورم والتعبير biomarker هو وصف من قبل ريوس 20.
النتائج
يتم تغليف الخلايا 7PA2 بنجاح في microbeads الجينات
بعد التحضير، يتم إنشاء microbeads الجينات موحدة وكروية بنجاح باستخدام هذا البروتوكول. تعرض الصور الواردة في الشكل 2A أدناه مثالاً على كيفية تغيير أحد المعلمات (أي الجهد) يغير تدفق وتشتت دفق قطرات الجينات. الشكل 2 B يظهر مثالا على الخرز الجينات التي تم الحصول عليها مباشرة بعد عملية الهلام.
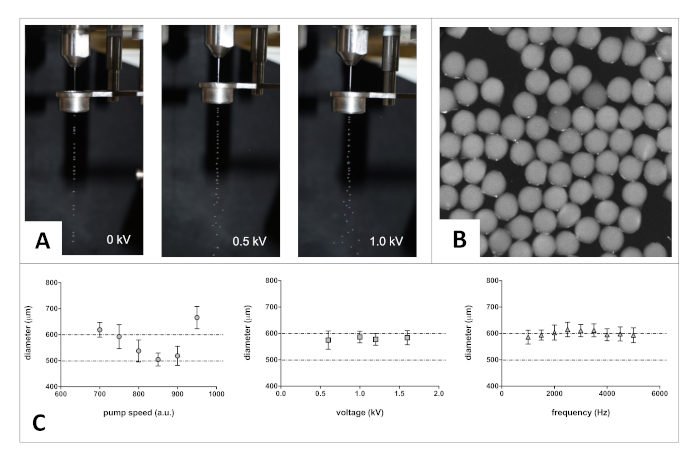
الشكل 2 طريقة التصنيع الأمثل. (أ) صور تظهر التغيرات في تشتت الدفق. (B) صورة مشرق ة تظهر الخرز الصغير الكروي ة الجينات مباشرة بعد التصنيع. (C) مثال على خطوة التحسين: ضبط معلمات التصنيع المحددة لتحقيق حجم microbead الهدف. رسوم بيانية مختارة لتوضيح العلاقة بين كل معلمة وحجم الخرز الصغير الناتج (توزيع الحجم من n = 100 microbeads على الأقل). لاحظ أن قطر فوهة الداخلية، لزوجة الحل طرد وظروف الهلام يمكن أن تؤثر أيضا على حجم الخرز ملفقة. أشرطة الخطأ تمثل S.D. الرجاء انقر هنا لعرض إصدار أكبر من هذا الرقم.
البروتوكول الموصوف مرن ويسمح بتصنيع أحجام مختلفة من الخرز الصغير القائم على الجينات، ومتفاوتة في تكوينها وفقا للتطبيق. في الشكل 2C،نبلغ عن تأثير معدل تدفق الجينات، والجهد والتردد على حجم microbead باستخدام 2٪ (ث / الخامس) محلول الجينات في HEPES (الرقم الهيدروجيني 7.2) مقذوف من خلال فوهة 300 ميكرومتر.
كما كان نطاق هذه الدراسة لإنتاج microbeads التي يمكن أن تكون جزءا لا يتجزأ من الدماغ الفئران، قمنا بتعديل معايير التصنيع للحصول على متوسط قطر microbead في نطاق 500-600 ميكرومتر. ولأغراض مراقبة الجودة، تم تحسين هذه الطريقة بحيث لا يكون لها أدنى قدر من التغير بين السكان من الخرز الملفق (أي توزيع الحجم الضيق). يرجى ملاحظة أن (1) الخرز المنتجة يمكن حقنها في الدماغ الفئران باستخدام حقنة هاملتون مجهزة إبرة 20G. و (2) نصف الكرة واحد من الدماغ الفئران يمكن أن تستضيف ما يصل إلى اثنين أو ثلاثة حبات من هذا الحجم.
بعد التحسين، تغليف 7PA2 الخلايا بتركيز 1.5 × 106 خلايا / مل معلقة في 2٪ (ث / الخامس) محلول الجينات المخزنة مع HEPES وانخفضت في حمام الجلج كلوريد الكالسيوم 0.5 M أسفرت عن microbeads المطلوب. الشكل 3 يظهر أدناه خلايا مغلفة 7PA2 موزعة بالتساوي في microbeads بعد يوم واحد في ظروف ثقافة الخلية القياسية. تم اختبار انتشار الخلايا 7PA2 باستخدام اختبار MTS وفقا لبروتوكول الشركة المصنعة. لم يكن هناك فرق كبير بين سلوك 7PA2 الخلايا نمت مع أو بدون الجينات على مدى فترة سبعة أيام (الشكل3B). عند احتضان الخلايا المغلفة في ظروف الثقافة القياسية، من المتوقع أن تستمر الخلايا في الانتشار على مدى مدة التجربة، ويمكن توقع درجات صغيرة من الهروب من الخلايا نتيجة لذلك، كما ورد في أعمال أخرى28. ويمكن التخفيف من آثار ذلك عن طريق تغليف في كثافة الخلية أصغر أو الحد من تركيز المصل الذي يتم حضانة microbeads.

الشكل 3 خلايا 7PA2 مغلفة. (أ) صورة مشرقة للخلايا المغلفة 7PA2 تظهر توزيع الخلايا حتى في جميع أنحاء microbead الجينات. تم تعيين معلمات التصنيع للحصول على ~ 150 7PA2 الخلايا لكل حبة. لم يلاحظ أي اختلاف كبير في حبات الجينات على مدى 7 أيام من الثقافة. (ب) لم يكن هناك فرق ملحوظ بين الانتشار الكلي للخلايا 7PA2 الحاضنة مع الجينات مقابل الخلايا الحاضنة دون الجينات. 7PA2 الخلايا تنمو وتهاجر عبر حجم حبات الجينات. يمكن اعتبار الحد من تركيز المصل لإبطاء نمو الخلايا. أشرطة الخطأ تمثل S.D. الرجاء انقر هنا لعرض إصدار أكبر من هذا الرقم.
الخرز الصغير الجينات تغليف 7PA2 الخلايا مستقرة مع مرور الوقت
للتحقيق في حجم وشكل microbeads الجينات التي تم الحصول عليها، تم إجراء تحليل المجهر بعد تلفيق وهلام. متوسط القطر للmicrobeads التي تم الحصول عليها باستخدام البروتوكول المحدد هو 550 ± 2 ميكرومتر.
من الناحية النظرية، يمكن حساب عدد الخلايا المتوقعة في ميكروبيد قطرها 550 ميكرومتر على النحو التالي:

حيث V = حجم وr = نصف قطرها. حجم ميكروبيد واحد هو V = 8.8 × 10-5 مل؛ لذلك، فإن عدد الخلايا لكل ميكروبيد في وقت التغليف =(1.5 × 10 6) × (8.8 × 10-5)- 130 خلية.
من الناحية التجريبية، قمنا بحساب عدد الخلايا المغلفة مباشرة بعد التصنيع. تم تعطيل حبات الجينات بلطف باستخدام مزيج الانحلال وكانت ملطخة الخلايا مع حل الأزرق trypan. تم إجراء تقدير الجدوى وحساب الخلايا باستخدام مقياس الهيموكيتومات؛ وأظهرت النتائج التي تم الحصول عليها في المتوسط 116 ± 17 الخلايا الحية لكل microbead (ن = 5، لم يتم الإبلاغ عن البيانات). وكما هو متوقع، لوحظ اختلاف طفيف بين عدد الخلايا النظرية والتجريبية مباشرة بعد التغليف. بالنسبة لبعض التطبيقات، وعلى وجه الخصوص لتحديد كمية Aβ المفرج عنها مع مرور الوقت، من المهم التنبؤ بعدد الخلايا المغلفة في كل حبة الجينات.
ومن المثير للاهتمام، عملية التغليف ليس لها تأثير كبير على بقاء الخلية. يتم الإبلاغ عن النتائج في عمل سابق، حيث تم تغليف الخلايا السرطانية القولون والمستقيم (أي HCT-116) باستخدام طريقة مماثلة، مع عدم وجود اختلافات في صلاحية الخلايا في microbeads الجينات مقارنة مع الضوابط 2D20.
لقياس استقرار الجينات المستخدمة في عملية التغليف، قمنا بقياس أقطار microbead على مدى فترة 14 يوما (ن = 100). لم تحدث تغيرات ملحوظة في متوسط القطر بعد 14 يوماً من التغليف مقارنة مباشرة بعد التغليف (لم يتم الإبلاغ عن البيانات).
خلايا مغلفة 7PA2 الإفراج عن Aβ مع مرور الوقت
وسائل الإعلام مكيفة تحليلها من الثقافات 2D و 3D من 7PA2 الخلايا تكشف عن زيادة مستمرة في مستويات Aβ1-42. تم أخذ عينات من وسائط ثقافة الخلية كل 24 ساعة، وتصل إلى أربعة أيام، وتحليلها باستخدام ELISA. تظهر بياناتنا أن معدل إطلاق Aβ1-42 من microbeads (3D) مماثل في الملف الشخصي لتلك التي تم إصدارها من ثقافة 2D (الشكل 4).
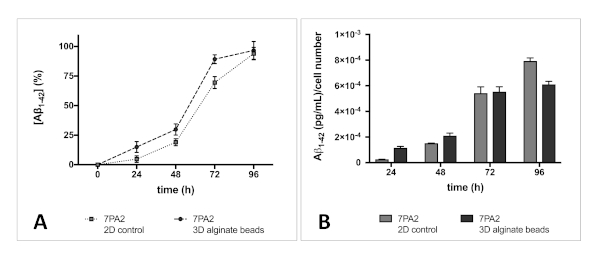
الشكل 4 معدل إفراز Aβ1-42 من 7PA2 الخلايا: (A) Aβ الإصدار (٪ تطبيع بعد 4 أيام) من 2D و 3D في نماذج المختبر لديه ملف مماثل. يظهر كلا النموذجين زيادة مستمرة في مستويات Aβ على مدى فترة أربعة أيام، وكما هو متوقع، لم يتم الوصول إلى تركيز ثابت. (ب) تركيز Aβ1-42 تطبيع إلى رقم الخلية الأولية، مما يدل على إفراز مماثل من Aβ1-42 مع مرور الوقت، بغض النظر عن أساليب الزراعة. لا وجود الجينات ولا عملية التغليف (3D في نموذج المختبر) تغيير إفراز Aβ1-42. أشرطة الخطأ تمثل S.D. الرجاء انقر هنا لعرض إصدار أكبر من هذا الرقم.
التطبيق المحتمل للخلايا مغلفة 7PA2
نحن نبلغ أن 7PA2 الخلايا المغلفة في microbeads الجينات يمكن استخدامها بشكل فعال للإفراج المستمر من Aβ1-42، وبالتالي تستخدم لاختبار تأثير إفراز Aβ المزمن في أي نموذج ما قبل السريرية. في الشكل 5 أدناه، نبين مزايا استخدام الخرز الصغير الجينات التي يمكن حقنها بسهولة وتقع داخل الدماغ من الفئران. يتم استخدام أقسام الجسم الحي السابق هنا لأغراض التوضيح، مقارنة حبة الجينات ملليمتر مقابل microbeads الجينات ملفقة.

الشكل 5 استخدام الخرز الصغير للتطبيقات ما قبل السريرية ذات الصلة. يجب أن تكون الخرزات الدقيقة للتطعيم في دماغ الفئران صغيرة بما يكفي ليتم تضمينها دون خلق آفة كبيرة جداً لتجنب الأضرار التي لحقت بالدماغ وتؤثر سلبا على وظيفة الدماغ العادية. تُظهر الصورة (A) مقارنة الحجم بين حبة مقاس ة مليمتر وحبة بمقياس ميكرومتر جنبًا إلى جنب. (ب) زرع حبة مقياس ملليمتر داخل الدماغ لأغراض في الجسم الحي لن تعمل. صورة (C) يظهر microbead ملفقة باستخدام هذا البروتوكول. حجم مناسب للإدراج داخل الحصين من الفئران دون أن يكون لها تأثير ضار على علم وظائف الأعضاء العادي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الصور أعلاه تسليط الضوء على أهمية السيطرة على حجم microbead لمثل هذه الدراسات. هنا، ونحن نبرهن على ميزة استخدام microbeads من أقطار أقل من 600 ميكرومتر. وهذا يسمح باستخدام الحقن طفيفة التوغل (على سبيل المثال، حقنة هاملتون) للسيطرة بشكل أفضل على موقع الخرز عن طريق الحقن داخل الدماغ.
وباختصار، فإن تغليف الخلايا 7PA2 يعطي السيطرة على حجم microbeads، وعدد من الخلايا المغلفة والتنبؤ Aβ تفرز من microbeads (على سبيل المثال، التركيز، وملف تعريف الإفراج). السيطرة على حجم microbeads أمر ضروري لسببين: 1) للسماح السيطرة ضبطها بدقة على تركيز Aβ صدر، و 2) للسماح زرع في منطقة تسيطر عليها من الدماغ الفئران. النتائج التي تم الحصول عليها هنا تصف ضبط سهل من microbeads الجينات وتسليط الضوء على التطبيقات المحتملة لمزيد من الدراسات.
Discussion
الطريقة الموضحة في هذه المقالة مفيدة لتغليف الخلايا تحقيق توزيع حجم ضيق من microbeads الجينات27. كما أنه يوفر ميزة نمو الخلايا في بيئة معزولة مناعية17،19، وحمايتهم من الإجهاد الخارجي. بالإضافة إلى ذلك، تغليف الخلايا في الجينات يحاكي بشكل أوثق الظروف الفسيولوجية، وعلى وجه التحديد فيما يتعلق بالتفاعلات من خلية إلى خلية وتصلب المصفوفة20. هذه العوامل كلها حاسمة بشكل خاص للاستخدام اللاحق في التطبيقات ذات الصلة، مثل في الطعوم في الجسم الحي، مما يحول دون ردود الفعل المناعية المحتملة في الأنسجة المحيطة17. وعلاوة على ذلك، فإن الميزة الرئيسية لهذا البروتوكول هي سهولة الضبط وفقا لتطبيق الفائدة: فمن الممكن تعديل البروتوكول وتحسين المعلمات لتصنيع الخرز أكبر أو أصغر، وأكثر ليونة أو أكثر صلابة. يتم استخدام الطريقة الموصوفة لتلفيق الخرز صغيرة بما يكفي لحقنها بأساليب طفيفة التوغل، وكبيرة بما يكفي لاستضافة عدد من الخلايا وتوفير ما يكفي من الإفراج عن Aβ ليؤدي إلى آثار سلوكية ومرضية ملحوظة عند الحقن في النماذج الحيوانية.
ويتوقف نجاح هذا البروتوكول على عدد من الخطوات الحاسمة. التعامل الدقيق مع الخلايا وتقنيات زراعة الخلايا المثلى مهمة للحفاظ على صلاحية الخلية والوظيفة20،28. استخدام الظروف الثقافية القياسية يضمن الحفاظ على الوظيفة العادية للخلايا 7PA2، كما لوحظ. يسمح هذا ملف تعريف إصدار مشابهل Aβ1-42 من الخلايا المغلفة بالمقارنة مع الثقافات 2D. وبالإضافة إلى ذلك، لكي يعمل البروتوكول على النحو الأمثل، يضمن حل الجينات منخفض اللزوجة نتائج أفضل مقارنة بمحلول الجينات عالية اللزوجة. وهذا يضمن أن طائرة لامينار متجانسة هو مقذوف من خلال فوهة وتوزيع حتى من الخلايا داخل مصفوفة من الخرز ملفقة27. المواد المستخدمة لتغليف الخلايا يجب أن يكون لها آلية هلام سريعة جدا، مما يسمح بالاحتفاظ بالشكل.
خطوة حاسمة أخرى في هذا البروتوكول هو التعامل مع microbeads ملفقة بعد هلام. هنا، نعرض استرجاع microbeads باستخدام ماصة بلاستيكية ذات فتحة كبيرة لنقل الخرز. بدلا من ذلك، صب محلول كلوريد الكالسيوم التي تحتوي على microbeads في مرشح شبكة يمكن استخدامها لاسترداد حبة. ويمكن استخدام ماصة مصلية كبيرة (5، 10 أو 25 مل) لرسم microbeads ومن ثم غسلها من خلال مرشح شبكة بدلا من صب. ميزة هذا هو زيادة الثقة في عقم الإجراء بالمقارنة مع صب. ومع ذلك، من القيود هو أن بعض الخرز قد تكون مشوهة إذا كانت مضغوطة من قبل الماصات، بالإضافة إلى المخاطرة بانخفاض العائد إذا لم يتم إنقاذ نسبة كبيرة من microbeads.
وقد استخدم هذا النهج لتغليف خطوط الخلايا المختلفة لنموذج ودراسة أمراض مختلفة (على سبيل المثال، إطلاق الأنسولين من زيت البنكرياس مغلفة). الجدة من نهجنا هو تطعيم microbeads ولدت باستخدام هذا البروتوكول كوسيلة مفيدة في نمذجة الجوانب الهامة لمرض الزهايمر في الجسم الحي. عند مقارنة ملف تعريف إطلاق Aβ من الخلايا المغلفة (الشكل 4) إلى مستويات Aβ الناتجة عن حقن البولوس (مثل تلك التي تم الإبلاغ عنها في دراسات أخرى3،26) ، يمكن أن يكون الإفراج عن أكثر مزمنة ومستمرة من Aβ المتوقع. ويبين الشكل 6 الاتجاه المتوقع الذي يمكن تحقيقه. استخدام هذا النظام لنمذجة في الجسم الحي هو أكثر صلة بالطريقة التي يتطور المرض ويمكن أن تكون أكثر فائدة في اكتشاف المخدرات والتنمية.

الشكل 6 ملف تعريف الإصدار المتوقع من Aβ1-42 من خلايا 7PA2 مغلفة مقارنة مع حقن بولس. يسمح ملف إطلاق Aβ من microbeads 7PA2 التي تحتوي على تطعيم اختبار آثار Aβ المزمنة والمستدامة في نموذج حيواني ذي صلة بـ AD. وعلى العكس من ذلك، فإن حقن البولوس خلق ارتفاع في مستويات Aβ على مدى فترة قصيرة من الزمن، تليها إزالة سريعة من Aβ من الدماغ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا السيد كاجين سوريسباران، والدكتور جوناثان ووبيتو، والسيد دومينيك غرودزينسكي، والآنسة تشين جاو، والدكتور تييري بايلوت على مساعدتهم في تحسين تصنيع الميكروبات الجينات، وثقافة الخلايا والكشف عن Aβ، والعلمية المفيدة المناقشات.
Materials
| Name | Company | Catalog Number | Comments |
| µManager software | Vale Lab, UCSF, USA | v.1.46 | |
| 0.22 um PES filter | Merck, UK | SLGP033RS | |
| 15mm Netwell insert 74 um mesh filter | Constar, usa | #3477 | |
| Alginic acid sodium salt from brown algae | Sigma-Aldrich,uk | A0682 | |
| Calcium chloride | Sigma-Aldrich,uk | C1016 | |
| CellTiter96 AQueous One Solution cell proliferation assay | Promega, USA | G3580 | |
| Encapsulator | Inotech | IE-50 | serial no. 05.002.01-2005 |
| HEPES | Sigma-Aldrich,uk | H4024 | |
| Hu Aβ 1-42 ELISA | ThermoFisher, UK | KHB3441 | |
| ImageJ software | ImageJ | v1.49p | |
| Inverted light microscope | Olympus | CKX41 | |
| Leica microscope | Leica microsystems, UK | DMI6000B | |
| Neo sCMOS Camera | Ander, UK | 5.5 | |
| Phosphate buffered saline | Sigma-Aldrich,uk | D1408 | |
| Sodium chloride | Sigma-Aldrich,uk | 433209 | |
| Trispdium citrate dihydrate | Sigma-Aldrich,uk | W302600-K | |
| Trypsin-EDTA solution | Sigma-Aldrich,uk | T4049 |
References
- Hardy, J. A., Higgins, G. A. Alzheimer's disease: the amyloid cascade hypothesis. Science. 256, 184-185 (1992).
- Karthick, C., et al. Time-dependent effect of oligomeric amyloid-β (1-42)-induced hippocampal neurodegeneration in rat model of Alzheimer's disease. Neurological Research. 41 (2), 139-150 (2018).
- Watremez, W., et al. Stabilized Low-n Amyloid-β Oligomers Induce Robust Novel Object Recognition Deficits Associated with Inflammatory, Synaptic, and GABAergic Dysfunction in the Rat. Journal of Alzheimer's Disease. 62 (1), 213-226 (2018).
- Brouillette, J., et al. Neurotoxicity and memory deficits induced by soluble low-molecular-weight amyloid-β1-42 oligomers are revealed in vivo by using a novel animal model. Journal of Neurosciences. 32 (23), 7852-7861 (2012).
- Solana, C., Tarazona, R., Solana, R. Immunosenescence of Natural Killer Cells, Inflammation, and Alzheimer's Disease. International Journal of Alzheimer's Disease. , 3128758(2018).
- Sturchler-Pierrat, C., et al. Two amyloid precursor protein transgenic mouse models with Alzheimer disease-like pathology. Proceedings of the National Academy of Sciences of the United States of America. 94 (24), 13287-13292 (1997).
- Tomiyama, T., et al. A mouse model of amyloid beta oligomers: their contribution to synaptic alteration, abnormal tau phosphorylation, glial activation, and neuronal loss in vivo. Journal of Neurosciences. 30 (14), 4845-4856 (2010).
- Saito, T., et al. Single App knock-in mouse models of Alzheimer's disease. Nature Neurosciences. 17 (5), 661-663 (2014).
- Oddo, S., et al. Triple-Transgenic Model of Alzheimer's Disease with Plaques and Tangles: Intracellular A and Synaptic Dysfunction. Neuron. 39 (3), 409-421 (2003).
- Leon, W. C., et al. A Novel Transgenic Rat Model with a Full Alzheimer's-Like Amyloid Pathology Displays Pre-Plaque Intracellular Amyloid-β-Associated Cognitive Impairment. Journal of Alzheimer's Disease. 20 (1), 113-126 (2010).
- Prince, M., et al. Dementia UK: Second Edition - Overview. Alzheimer's Society. , 61(2007).
- Cavanaugh, S. E., Pippin, J. J., Barnard, N. D. Animal models of Alzheimer disease: historical pitfalls and a path forward. Alternatives to animal experimentation. 31 (3), 279-302 (2014).
- Oakley, H., et al. Intraneuronal β-Amyloid Aggregates, Neurodegeneration, and Neuron Loss in Transgenic Mice with Five Familial Alzheimer's Disease Mutations: Potential Factors in Amyloid Plaque Formation. The Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Forny-Germano, L., et al. Alzheimer's Disease-Like Pathology Induced by Amyloid-β Oligomers in Nonhuman Primates. Journal of Neuroscience. 34 (41), 13629-13643 (2014).
- Masliah, E., et al. Altered expression of synaptic proteins occurs early during progression of Alzheimer's disease. Neurology. 56 (1), 127-129 (2001).
- Lepelletier, F. X., Mann, D. M. A., Robinson, A. C., Pinteaux, E., Boutin, H. Early changes in extracellular matrix in Alzheimer's disease. Neuropathology and Applied Neurobiology. 43 (2), 167-182 (2017).
- Calafiore, R., Basta, G. Clinical application of microencapsulated islets: Actual prospectives on progress and challenges. Advanced Drug Delivery Reviews. 67-68, 84-92 (2014).
- Lim, F., Sun, A. M. Microencapsulated islets as bioartificial endocrine pancreas. Science. 210 (4472), 908-910 (1980).
- Tran, N. M., et al. Alginate hydrogel protects encapsulated hepatic HuH-7 cells against hepatitis C virus and other viral infections. PLoS One. 9 (10), 109969(2014).
- Rios de la Rosa, J. M., Wubetu, J., Tirelli, N., Tirella, A. Colorectal tumor 3D in vitro models: advantages of biofabrication for the recapitulation of early stages of tumour development. Biomedical Physics & Engineering Express. 4 (4), 045010(2018).
- Tirella, A., Orsini, A., Vozzi, G., Ahluwalia, A. A phase diagram for microfabrication of geometrically controlled hydrogel scaffolds. Biofabrication. 1 (4), 045002(2009).
- Smalley, K. S. M., Lioni, M., Herlyn, M. Life ins't flat: Taking cancer biology to the next dimension. In Vitro Cellular & Developmental Biology - Animal. 42 (8-9), 242-247 (2006).
- Podlisny, M. B., et al. Aggregation of secreted amyloid beta-protein into sodium dodecyl sulfate-stable oligomers in cell culture. Journal of Biological Chemistry. 270 (16), 9564-9570 (1995).
- Portelius, E., et al. Mass spectrometric characterization of amyloid-β species in the 7PA2 cell model of Alzheimer's disease. Journal of Alzheimer's Disease. 33 (1), 85-93 (2013).
- Welzel, A. T., et al. Secreted amyloid β-proteins in a cell culture model include N-terminally extended peptides that impair synaptic plasticity. Biochemistry. 53 (24), 3908-3921 (2014).
- O'Hare, E., et al. Orally bioavailable small molecule drug protects memory in Alzheimer's disease models. Neurobiology of Aging. 34 (4), 1116-1125 (2013).
- Nedović, V., Willaert, R. Fundamentals of Cell Immobilisation Biotechnology. Methods and Technologies for Cell Immobilisation/Encapsulation. , Focus on Biotechnology book series, Springer Link (FOBI, volume 8A) 185-204 (2004).
- Omer, A., et al. Long-term Normoglycemia in Rats Receiving Transplants with Encapsulated Islets. Transplantation. 79 (1), 52-58 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved