Method Article
Использование нейробиоуправления на основе функциональной магнитно-резонансной томографии в режиме реального времени для подавления островковой коры головного мозга у курильщиков, страдающих никотиновой зависимостью
В этой статье
Резюме
При функциональной магнитно-резонансной томографии (РТМРТ) в режиме реального времени активность мозга экспериментально манипулируется как независимая переменная, а поведение измеряется как зависимая переменная. Представленный здесь протокол сосредоточен на практическом использовании rtfMRI в качестве терапевтического инструмента при психических расстройствах, таких как никотиновая зависимость.
Аннотация
Прошло более десяти лет с тех пор, как был успешно реализован первый подход нейробиоуправления на основе функциональной магнитно-резонансной томографии (фМРТ). С тех пор различные исследования показали, что участники могут научиться произвольно контролировать ограниченную область мозга. Следовательно, фМРТ в реальном времени (ртфМРТ) предоставила новую возможность для изучения изменений поведения из-за манипуляций с активностью мозга. Следовательно, быстро возросло количество сообщений о применении rtfMRI для тренировки саморегуляции мозговой активности и сопутствующих изменений в поведенческих и клинических состояниях, таких как неврологические и психиатрические расстройства [например, шизофрения, обсессивно-компульсивное расстройство (ОКР), инсульт].
Нейровизуализационные исследования в области исследований зависимостей показали, что передняя поясная кора, орбитофронтальная кора и островковая кора активируются во время предъявления сигналов, связанных с наркотиками. Кроме того, было показано, что активность как левой, так и правой островковой коры сильно коррелирует с побуждениями к употреблению наркотиков, когда участники подвергаются воздействию сигналов, вызывающих тягу. Следовательно, двусторонняя островковая доля имеет особое значение в исследовании наркотических влечений и зависимости из-за ее роли в репрезентации телесных (интероцептивных) состояний. В этом исследовании изучается использование нейробиоуправления rtfMRI для снижения зависимой от уровня кислорода активности в крови (BOLD) в двусторонней островковой коре участников с никотиновой зависимостью. В исследовании также проверяется, существуют ли связанные с нейробиоуправлением модификации в имплицитном отношении участников к сигналам тяги к никотину и явному поведению.
Введение
Нейробиоуправление — это процедура оперантного обусловливания, с помощью которой люди или животные могут научиться модулировать нейронную активность в одной или нескольких областях мозга. Дрессировка обычно приводит к изменениям в поведении1. В принципе, сигналы мозга от одной или нескольких ограниченных областей мозга преобразуются в сенсорную обратную связь (например, визуальную, слуховую или тактильную обратную связь), которая предоставляется участнику для контроля мозговой активности с помощью оперантного обусловливания или других форм обучения. В отличие от традиционной парадигмы нейровизуализации, исследования нейробиоуправления модулируют активность мозга как независимую переменную и измеряют поведение как зависимую переменную. Таким образом, нейробиоуправление обеспечивает новый подход к исследованию участия областей мозга в различных когнитивных функциях и того, как гипер- или гипоактивация этих областей мозга может привести к аномальному поведению.
Нейробиоуправление используется с различными методами нейровизуализации, такими как функциональная магнитно-резонансная томография (фМРТ), электроэнцефалография (ЭЭГ) и функциональная ближняя инфракрасная спектроскопия (фНИРС). Парадигмы нейробиоуправления на основе ЭЭГ и fNIRS имеют преимущества более высокого временного разрешения, доступности и портативности 2,3. Однако они характеризуются низким пространственным разрешением и невозможностью доступа к более глубоким областям мозга. Кроме того, ЭЭГ обладает вычислительной сложностью обратной задачи для определения источника нейронных активаций по поверхностным сигналам ЭЭГ4. Тем не менее, благодаря недавним достижениям в области фМРТ в реальном времени (ртфМРТ) стало возможным получить доступ к гемодинамическим сигналам от всех частей мозга с хорошим пространственным разрешением (например, 2мм3) и временным разрешением 720мс5. Таким образом, фМРТ преодолевает вышеупомянутые ограничения, которыми обладают методы фНИРС и ЭЭГ.
Зависимость от никотина является одной из основных причин смерти во всем мире из-за ряда заболеваний, связанных с курением6. Признанными факторами, приводящими к никотиновой зависимости, являются социальная, экологическая, психологическая и генетическая предрасположенность. На нейробиологическом уровне исследования показали активацию в передней поясной коре (ACC), орбитофронтальной коре (OFC), вентральной тегментальной области (VTA), вентральном стриатуме, миндалевидном теле, гиппокампе, префронтальной коре (PFC) и островковой коре во время предъявления сигналов, связанных с лекарством, в отличие от нейтральных контрольных сигналов 9,10,11,12,13,14 . Активность как левой, так и правой островковой доли сильно коррелирует с позывами к курению, когда курильщики воспринимали сигналы, связанные с наркотиками15,16. Островковая доля играет важную роль в возбуждении тягового поведения 17,18,19,20,21, так как она отвечает за восприятие телесного состояния. Сообщалось, что курильщики с поражениями островковой коры с большей вероятностью бросали курить, чем курильщики с повреждением головного мозга без вовлечения островковой доли18.
Одной из самых больших проблем в существующих методах отказа от курения является высокая частота рецидивов22. Более 80% курильщиков срываются в течение первых нескольких месяцев после отказа от курения23. Воздействие сигналов, ранее связанных с употреблением наркотиков, является основной причиной высокого уровня рецидивов никотиновой зависимости. Этот механизм называется эффектом инкубации. Настоящий протокол разработан для определения инкубационного эффекта, оцениваемого с помощью задачи аффективного прайминга. Предыдущие исследования показали, что воздерживающиеся от курения имеют негативное имплицитное отношение к сигналам, связанным с курением 25,26,27,28. В типичной задаче аффективного прайминга эмоциональные стимулы изменяют обработку аффективной цели таким образом, что время реакции и точность ответовизменяются. Другими словами, если основной и целевой стимулы имеют одинаковую валентность, время реакции в ответ на целевые стимулы будет быстрее, и наоборот.
В настоящем исследовании выдвигается гипотеза о том, что подавление двусторонней передней островковой коры приведет к снижению тяги, и, следовательно, валентность сигналов, вызывающих тягу, изменится с негативных на нейтральные, поскольку внимание и ассоциативное смещение будут отдаляться отсигналов, связанных с курением. Задача на имплицитное поведение — это задача на аффективный прайминг, первоначально адаптированная из Czyzewska and Graham31. Исходя из вышеупомянутой гипотезы, предполагается наблюдать уменьшение времени реакции в ответ на комбинацию простых (вызывающих тягу картинок или их нейтральный аналог картинки) и целевых слов с положительной валентностью после блокировки подавления по сравнению с исходной блокировкой. Задача прайминга (рис. 2В) состоит из простого (т.е. вызывающей тягу картинки или ее нейтрального аналога картинки32) и целевого слова с положительной или отрицательной валентностью. Простое изображение отображается в течение 200 мс, за которым следует целевое слово, представленное в течение 1 секунды. Асинхронность начала стимула (SOA) составляет 250 мс. Затем участников инструктируют оценить валентность целевого слова (положительного или отрицательного) и ответить нажатием кнопки как можно быстрее и точнее.
Система rtfMRI (рис. 1) состоит из следующих подсистем: (1) участник, (2) сбор сигнала, (3) анализ сигнала в режиме реального времени и (4) обратная связь по сигналу. Сбор сигнала осуществляется с помощью сканера всего тела Siemens Trio 3,0 Тл с использованием последовательности эхо-планарной визуализации (EPI)33. Такие процедуры, как реконструкция изображения, коррекция искажений и усреднение сигнала, выполняются на компьютере сканера. После восстановления и предварительной обработки изображений они экспортируются в подсистему анализа сигналов. Подсистема анализа сигналов реализована с помощью Turbo Brain Voyager (TBV)34. TBV извлекает восстановленные изображения и выполняет обработку данных, которая включает в себя 3D-коррекцию движения и статистический анализ в реальном времени с использованием общей линейной модели35. TBV позволяет пользователю рисовать области интереса (ROI) по нескольким вокселям на функциональных изображениях и извлекать средние значения ROI BOLD после каждого времени повторения (TR). Затем временные ряды выбранных ROI экспортируются в скрипт MATLAB, который рассчитывает и представляет обратную связь участнику.
Визуальная обратная связь по активности мозга предоставляется участникам в виде графически анимированного термометра, столбики которого меняются пропорционально проценту СМЕЛЫХ изменений ROI. В нескольких исследованиях использовалась прерывистая обратная связь (обратная связь, предоставленная участнику после нескольких ТУ последовательности EPI) для участников тренинга 36,37. Тем не менее, в данном исследовании ожидалось, что участники будут испытывать большие трудности в подавлении сигнала BOLD в передней островковой доле с непрерывной обратной связью из-за роли островковой доли в сенсорной интеграции и участии вобработке визуальной обратной связи. Следовательно, было высказано предположение, что непрерывная обратная связь приведет к конфликту между двумя процессами в островковой коре, одним из которых сигнал усиливается за счет внешней обратной связи, а другим — за счет обучения нейробиоуправлении. Следовательно, в этом исследовании мы предоставляем обратную связь только в конце каждого блока подавления (отложенная обратная связь). Участникам показывается текст (например, 0,87 евро) в качестве визуальной обратной связи (рис. 2A, C), в котором указана сумма заработанных ими денег (денежное вознаграждение). Это вознаграждение пропорционально процентному подавлению, достигнутому в блоке регулирования.
РТМРТ – это новая нейротехнология, которая может помочь преодолеть проблемы в терапевтических подходах к лечению зависимости и обеспечить более надежные и эффективные вмешательства для снижения рецидивов. Долгосрочные цели настоящего исследования состоят из трех частей: 1) проверить, могут ли никотиновые наркоманы научиться подавлять сигналы BOLD в передней островковой доле во время присутствия стимулов, вызывающих тяговое поведение; 2) изучить, приводит ли тренировка нейробиоуправления к изменениям в поведении тяги; и 3) изучить, сохраняются ли изменения в уровнях тяги во время тренировки нейробиоуправления подавления островковой доли после шести месяцев тренировок без какого-либо другого вмешательства. В данной статье подробно описан протокол эксперимента с rtfMRI и его различные компоненты. Также представлены образцы данных исследования и обсуждение будущих проблем и потенциала этого метода в дополнительных исследованиях. Представленный протокол предназначен для изучения возможности использования нейробиоуправления на основе фМРТ для изучения снижения активности мозга в островковой коре курильщиков. Кроме того, протокол предназначен для изучения взаимосвязи между активацией островковой коры и тяговым поведением курильщиков сигарет.
протокол
Комитет по этике медицинского факультета Тюбингенского университета и Папского католического университета Чили утвердил следующий протокол rtfMRI.
1. Настройка оборудования
- Оборудование, представленное на рисунке 1 , подготавливается только один раз для настройки экспорта данных МРТ в режиме реального времени.
- Подготовка кабинета МРТ такая же, как и при традиционном измерении фМРТ. Подготовьте кабинет МРТ до приезда участника.
- Прикрепите к сканеру катушку с 32 или 20 каналами головки.
- Подключите кабель VGA/HDMI проектора и совместимое с МР ответное устройство (кнопочный блок) к компьютеру стимулов.
ПРИМЕЧАНИЕ: В большинстве установок МРТ устройство реагирования подает TR-триггер на компьютер стимулов. Этот триггер помогает синхронизировать предъявление стимула и сбор данных.
2. Подготовка участников вне сканера
- Подготовьте форму согласия и анкеты, которые участники должны заполнить до своего приезда.
- Как только участник придет, объясните ему суть эксперимента и технику проведения фМРТ. Кроме того, проинструктируйте участника о том, как выполнять задание (например, во время эксперимента участники должны держать глаза открытыми и всегда смотреть на изображения на экране, а также стараться не двигать головой внутри сканера).
- Попросите участника подписать форму согласия и заполнить анкеты, необходимые для оценки уровня тяги.
- Попросите участников заполнить следующие анкеты: 1) VAS-C: Визуальная аналоговая шкала, Тяга к курению39, 2) QSU-b: Опросник о позывах к курению – Краткая версия40 и 3) Сигареты в день.
- Попросите участника сделать выдох через прибор для измерения угарного газа (CO).
ПРИМЕЧАНИЕ: Измерение CO41 показывает, воздерживается ли участник от курения по крайней мере за 3 часа до прибытия на сеанс нейробиоуправления. CO измеряется в ppm (частях на миллион). Низкие значения CO указывают на то, что участник не курил в течение как минимум пары часов до прибытия. Участников следует попросить воздержаться от курения, чтобы сигналы тяги вызывали высокую тягу во время эксперимента. Участники с высоким уровнем CO будут предупреждены перед будущим сеансом нейробиоуправления, чтобы они воздержались от курения перед сеансом rtfMRI. Участники, которые не воздерживаются от курения дважды, должны быть исключены из исследования.
3. Позиционирование участников
ПРИМЕЧАНИЕ: Процедура позиционирования участника на столе сканера аналогична традиционному эксперименту с фМРТ.
- Попросите участника вынуть все металлические предметы из карманов перед входом в кабинет МРТ.
- Попросите участника вставить беруши перед тем, как он или она ляжет на стол сканера в лежачем положении.
- С помощью подушечек фиксируйте положение головы участника внутри катушки для головы. Этот шаг помогает уменьшить смещение головы во время измерения.
- Зафиксируйте верхнюю часть катушки головки и закрепите зеркало на катушке головки.
- Передайте ответное устройство участнику и разместите ответное устройство в соответствии с удобством участника.
- Попросите участника закрыть глаза и отметить положение головы участника между бровями с помощью лазерного света.
- Переместите стол сканера, чтобы поместить отмеченное положение в центр отверстия МРТ.
- Подтвердите у участника, что он находится в удобном положении и что он может видеть визуальные стимулы, проецируемые на экран за сканером с помощью зеркала. При необходимости отрегулируйте зеркало.
4. Сбор данных
- Во время первоначального сканирования попросите участника закрыть глаза и стараться не двигать головой.
- Начните измерение с последовательности импульсов локализатора. Эта последовательность обычно используется для определения положения среза при последующем проведении анатомического сканирования и функционального сканирования (последовательность EPI).
- Выберите поле зрения (FOV) для анатомического сканирования со следующими параметрами: TR = 11,5 мс, TE = 5 мс, 176 срезов без промежутка между срезами, FOV = 240 x 240 мм2, матрица = 256 x 256, угол поворота = 18°, обеспечивая 1 мм3 изотропных вокселя. Поле зрения последовательности будет охватывать всю голову участника.
- Поле зрения для функционального сканирования (последовательность EPI) выровнено по линии передней спайки/задней спайки (линия AC-PC). Отрегулируйте положение срезов так, чтобы они охватывали целевую область интереса. Параметры последовательности следующие: TR = 1,5, FOV = 192 мм, 25 срезов, воксель = 3 мм x 3 мм x 3 мм, угол переворота = 70°.
5. Нейробиоуправление FMRI
- Предупредите участника о начале сеанса нейробиоуправления и повторите ранее предоставленные инструкции (например, что во время базового уровня блок обозначается знаком «+»).
ПРИМЕЧАНИЕ: Участник должен наблюдать за изображением на экране дисплея. С другой стороны, во время блока регуляции, представленного стрелкой вниз, участники должны попытаться отстраниться от тяговых побуждений, используя некоторые когнитивные стратегии. Сумма денег, отображаемая в конце каждого блока регулирования, отражает их эффективность. Чем больше денег, тем выше производительность. - Выполните прогон нейробиоуправления, в котором исходный и регуляторный блоки чередуются (по 30 с каждый; Рисунок 2).
- На стимульном компьютере запустите программное обеспечение для презентации с помощью кода стимула и нажмите кнопку Enter после того, как на экране появится надпись «Готово ». Код презентации теперь ожидает триггера для запуска нейробиоуправления.
ПРИМЕЧАНИЕ: Код синхронизирован с триггерами TR, поступающими от сканера. Таким образом, это первый шаг в подготовке к запуску пробега с нейробиоуправлением. - На компьютере для анализа запустите собственный набор инструментов MATLAB и турбо-вояджер для мозга (TBV).
- В наборе инструментов MATLAB введите информацию, относящуюся к участнику, такую как идентификатор пациента и номер прогона нейробиоуправления.
- Нажмите кнопку Создать файлы протокола, чтобы подготовить файл протокола, используя информацию, вставленную в шаге 5.5.
ПРИМЕЧАНИЕ: Файл протокола содержит информацию, относящуюся к времени выполнения условия (например, время, в которое должно начаться определенное состояние и какой стимул должен быть предъявлен). Он будет использоваться как инструментарием MATLAB, так и TBV. - Нажмите кнопку execute в графическом интерфейсе набора инструментов MATLAB. Теперь код ожидает получения данных от TBV.
- В TBV выберите файл протокола, сгенерированный на шаге 5.6. Кроме того, выберите файл .roi, созданный в результате предыдущих сеансов нейробиоуправления.
ПРИМЕЧАНИЕ: Выбор файла ROI важен, так как это позволит избежать сбоя программного обеспечения TBV в начальный (10 TR) период выполнения нейробиоуправления. - Подготовьте последовательность EPI, которая будет реализована на главном компьютере MR. Нажмите кнопку запуска в TBV.
- Перерисовка целевых ROI в программном обеспечении TBV в соответствии с анатомическими ориентирами. Форма и размер желудочков в головном мозге используются в качестве ориентиров для выбора передней островковой доли. Кроме того, используется волнистая форма островковой коры с точным выделением вокселей, относящихся к двусторонней передней островковой доле.
- Нарисуйте ROI на первичной моторной области (M1), используя центральную борозду в качестве анатомического ориентира. Первичная моторная область действует как эталонная рентабельность инвестиций, устраняя эффект глобального увеличения BOLD и колебаний BOLD из-за движения головы.
- В конце каждого сеанса нейробиоуправления спрашивайте участника: «Какую когнитивную стратегию вы использовали во время блока регуляции?». Кроме того, спросите участника о его или ее уровне комфорта и о том, хочет ли он или она продолжать эксперимент.
- После четырех прогонов нейробиоуправления выберите переключатель Да для прогона передачи.
ПРИМЕЧАНИЕ: Передаточный прогон похож на прогон нейробиоуправления. Однако участники осуществляют саморегуляцию в отсутствие обратной связи. Это помогает определить, переносится ли выученная саморегуляция в ситуацию, в которой участник не будет получать нейробиоуправление (например, вне сканера).
6. Контрольная группа
- Инструктируйте участников контрольной группы таким же образом, как и участников экспериментальной группы. Тем не менее, предоставляйте участникам обратную связь по желтку.
ПРИМЕЧАНИЕ: В обратной связи с ярмом среднее количество подкрепления (денег) как в экспериментальной, так и в контрольной группах остается неизменным. Единственное различие между этими двумя группами заключается в случайности обратной связи, предоставляемой участникам. Для участников контрольной группы общая сумма подкрепления (денег) распределяется между случайно назначенными 40% испытаний с подавлением. Однако в остальных 60% испытаний участники получают отрицательные отзывы (ноль евро). Таким образом, участники контрольной группы не получают условной обратной связи.
7. Автономный анализ
- Предварительная обработка данных фМРТ
- Используйте набор инструментов статистического параметрического картирования (SPM) для предварительной обработки данных фМРТ (https://www.fil.ion.ucl.ac.uk/spm/ext/).
- Преобразуйте данные фМРТ в формате DICOM в формат NIFTI с помощью утилиты преобразования форматов пакетной функции SPM.
- Удалите первоначальные 10 сканирований из данных каждого прогона нейробиоуправления, чтобы избежать эффектов градиентного равновесия42.
- Выполните процесс перекомпоновки, чтобы удалить артефакты движения и выровнять все тома по первому объему сеанса. Кроме того, выполните коррекцию временного среза для компенсации задержки захвата среза43.
- Проведение сегментации анатомического сканирования, совместной регистрации данных последовательности EPI и анатомических данных, а также нормализации для сопоставления данных предметного пространства со стандартным шаблоном мозга Монреальского неврологического института (MNI)44.
- Используя наш собственный код MATLAB, извлеките сигналы BOLD из кубических ROI, созданных вокруг координат MNI, соответствующих двусторонней передней островковой доле и первичной моторной коре.
- Расчет процентного изменения сигнала BOLD
- Рассчитайте процентное изменение сигнала BOLD на основе среднего изменения сигнала BOLD для каждого ROI в течение блока регулирования по сравнению с предыдущим базовым блоком. Уравнение для процентного изменения сигнала BOLD выглядит следующим образом:
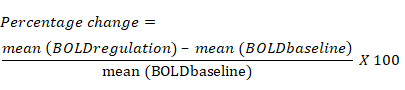
- Рассчитайте процентное изменение сигнала BOLD на основе среднего изменения сигнала BOLD для каждого ROI в течение блока регулирования по сравнению с предыдущим базовым блоком. Уравнение для процентного изменения сигнала BOLD выглядит следующим образом:
- Анализ явного курительного поведения участников
- Импортируйте ответы участников на анкеты (т.е. QSU-b, VAS-C, CO measure и сигареты в день) в MATLAB.
- Проверьте нормальность данных с помощью одновыборочного теста Колмогорова-Смирнова от MATLAB.
- Для сравнения ответов на различные анкеты каждого участника следует использовать t-критерий с одной выборкой, а для сравнения баллов между экспериментальной и контрольной группами следует использовать t-критерий с парной выборкой.
- Анализ имплицитного отношения к сигналам, вызывающим тягу
- Извлеките время реакции (RT) испытаний аффективного прайминга для каждого участника из файлов журналов, сгенерированных программным обеспечением для презентаций.
- Исключите выбросы, основанные на RT (т.е. не включайте испытания с RT длиннее 2x стандартного отклонения от среднего RT участника).
- Проверьте нормальность данных с помощью одновыборочного теста Колмогорова-Смирнова от MATLAB.
- Сравните влияние подавления на медианное время реакции уникальных комбинаций простых чисел (вызывающих тягу и нейтральных изображений) и мишеней (позитивных и отрицательных слов) для каждого участника, а также сравните экспериментальную и контрольную группы с помощью парного мудрого t-критерия.
Результаты
Четыре пациента были набраны на основе их баллов по опроснику Фагерстрёма на никотиновую зависимость (FTND)45 на предмет никотиновой зависимости среднего уровня (оценка FTND >4) и количества выкуриваемых сигарет каждый день (>15). Кроме того, было установлено, что у участников нет татуировок или металлических имплантатов в соответствии с мерами безопасности МРТ учреждения. Каждому участнику было проведено пять сеансов ртфМРТ, из которых первые четыре сеанса проводились в течение 2 недель (2 сеанса в неделю), а пятый сеанс был проведен через 6 месяцев после четвертого сеанса. Участников попросили воздерживаться от курения по крайней мере за 3 часа до каждого сеанса.
В первый день участники прошли предварительные тренинги (перед тренингом нейробиоуправления) с целью получения исходных имплицитных поведенческих реакций на картинки, вызывающие тяговое поведение. На сессиях 2 и 3 проводилась тренировка нейробиоуправления (рис. 2C) для тренировки подавления сигнала BOLD в левой (ROI1) и правой (ROI2) передней островковой коре в качестве ROI. Затем проводился посттренировочный (после тренинга нейробиоуправления; сеанс 4) сеанс, который был идентичен предтренировочному сеансу. Для того, чтобы оценить долгосрочное влияние тренировки с помощью нейробиоуправления на имплицитное поведение, через 6 месяцев после тренировки была проведена последующая сессия, аналогичная послетренировочной. Во время предтренинговой сессии (рис. 2А) участники не выполняли никаких заданий в течение блока регламента, и им не предоставлялась обратная связь. Тем не менее, во время посттренинговых и последующих сессий участники использовали стратегии саморегуляции, усвоенные в течение периода обучения. Участникам предоставлялась условная обратная связь (денежное вознаграждение) в конце каждого блока регламента. На рисунках (Рисунок 4, Рисунок 5, Рисунок 6) приведены образцы данных от четырех участников экспериментальной группы. Представленные данные связаны с показателями нейробиоуправления участников и изменениями в тяговом поведении, оцененными с помощью опросников и задачи аффективного прайминга на сеансах нейробиоуправления фМРТ.
Участники научились значительно подавлять сигналы BOLD (tdf = 3,14, p < 0,05, t-критерий двусторонней парной выборки) в двусторонней островковой коре с помощью нейробиоуправления. Успех участников оценивался путем вычисления процентного изменения в уравнении сигнала BOLD, как описано ниже.
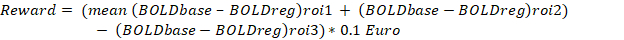
Где: левая передняя островковая доля (ROI1) и правая передняя островковая доля (ROI2) были выбраны на основе анатомических ориентиров. В качестве эталонного ROI была выбрана первичная моторная область (M1), а именно ROI3, чтобы устранить эффект глобального увеличения BOLD и флуктуации BOLD из-за движения головы.
Чем ниже значение процентного изменения сигнала BOLD, тем выше вероятность успеха участников в подавлении билатеральной островковой коры (рис. 4). Тем не менее, участникам не удалось сохранить выученную даунрегуляцию во время последующей сессии. Кроме того, мы наблюдали значительное общее снижение (tdf = 2,78, p < 0,05, двухсторонний t-критерий с одной выборкой) в явном поведении к курению, измеренном с помощью CPD (рис. 5A) во время третьего и четвертого сеансов rtfMRI, которое еще больше снижается во время последующего сеанса.
Аналогичным образом, мы наблюдали значительное снижение баллов по опросникам поведения в отношении курения, таким как QSU-b (баллы до тренинга: tdf = 11,1; баллы после тренинга: tdf = 6,5, p < 0,05, один тест t; Рисунок 5В) и VAS-C (баллы до тренинга: tdf = 13,7; баллы после тренинга: tdf = 16,07, p < 0,05, t-критерий двухсторонней парной выборки; Рисунок 5С). Однако в случае имплицитного поведения тяги (рис. 6) было замечено, что время реакции (мс) было значительно ниже в задачах, представленных после блока даунрегуляции, по сравнению с задачами, представленными после базового блока. В задаче на аффективный прайминг существует четыре комбинации основного сигнала (вызывающий сигнал тяги и его нейтральный аналог) и целевого слова (положительная и отрицательная валентность). Из вышеупомянутых четырех комбинаций две комбинации прайминг-сигнала и целевого сигнала [т.е. прайм: нейтральный и цель: положительный (tdf = 2,97) и прайм: тяга и цель: положительный (tdf = 2,78)] показали значительно более быстрое (p < 0,05) время реакции в задаче после блокировки подавления. Общее сокращение времени реакции на задачи после базового и регламентирующего блоков можно отнести к эффекту практики. Тем не менее, сокращение времени реакции на комбинации простых (жаждущих и нейтральных) и позитивных целевых слов (рис. 6В) указывает на изменение воспринимаемой участником валентности сигналов, вызывающих тягу.
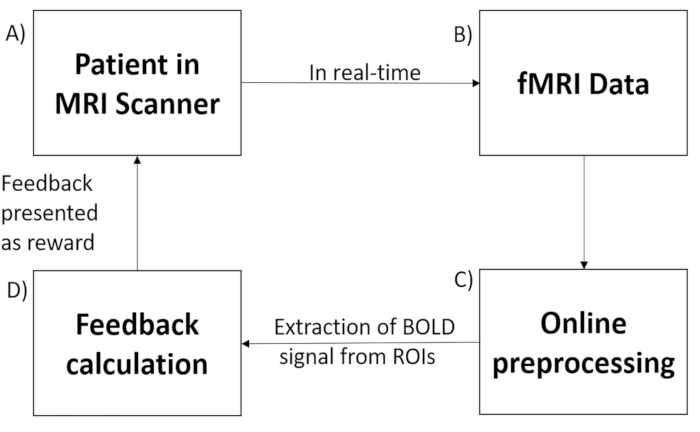
Рисунок 1: Настройка фМРТ в реальном времени. Система нейробиоуправления на основе фМРТ в реальном времени состоит из следующих подсистем: (А) участник сканера, (В) получение сигнала с помощью последовательности импульсов эхо-планарной визуализации (ЭПИ), (В) предварительная обработка полученных данных в режиме онлайн, (Г) вычисление обратной связи в соответствии с гипотезой и (Д) обратная связь сигнала через проекционную систему сканера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
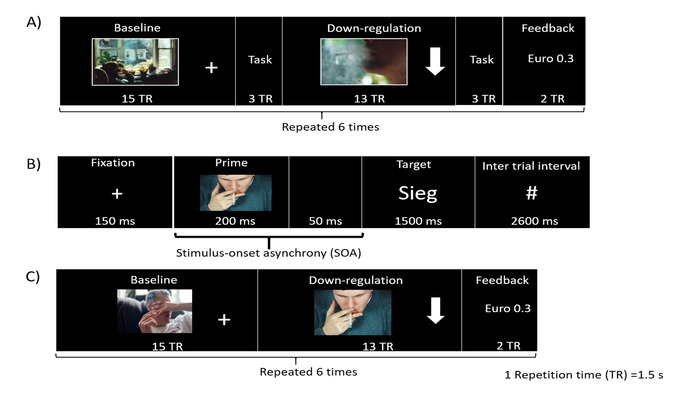
Рисунок 2: Экспериментальная парадигма. (А) Схематическая иллюстрация экспериментальной парадигмы для предтренинговых, посттренинговых и последующих сессий. Протокол состоит из шести чередующихся блоков исходного уровня и регулирования. За каждым блоком следовала задача аффективного прайминга. (Б) Используемая здесь задача аффективного прайминга оценивает влияние подавления на имплицитное отношение к сигналам тяги. Он состоит из простого числа (вызывающего желание изображения или нейтрального аналога изображения), за которым следует целевое слово (положительная или отрицательная валентность). Слово «Зиг» имеет положительную валентность, и это немецкое слово, означающее «победа». (C) Каждый тренировочный прогон rtfMRI состоит из блоков исходного уровня, подавления и обратной связи в том порядке, в котором повторяются шесть раз. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
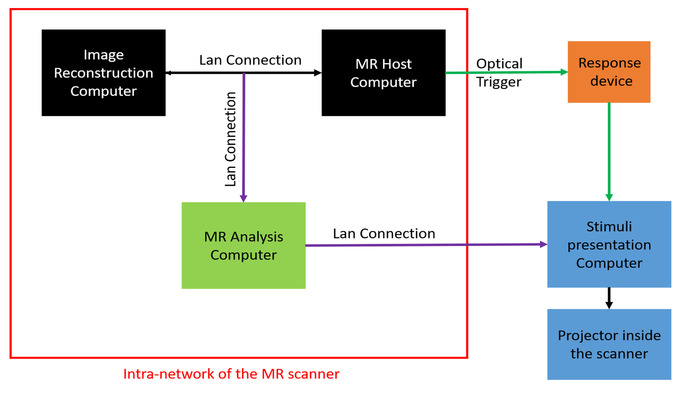
Рисунок 3: Настройка аппаратного обеспечения для фМРТ в реальном времени. Система фМРТ в реальном времени состоит из следующих трех подсистем: (1) компьютер для реконструкции изображений и МРТ (черный), (2) компьютер для анализа МРТ в реальном времени (зеленый) и (3) компьютер для представления стимулов и проектор (синий). Соединения LAN, представленные фиолетовым цветом, добавлены к существующей стандартной настройке фМРТ. Оптический триггер (темно-зеленый) подключен к компьютеру для предъявления стимулов через МР-совместимое ответное устройство (оранжевый). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Процентное изменение сигнала BOLD. На рисунке показано процентное изменение сигнала BOLD в левой (синей) и правой (оранжевой) островковой коре во время предтренировочной (Т1), нейробиокоррекции (Т2, Т3), посттренировочной (Т4) и последующей (через 6 месяцев после тренировки; Т5). У участника наблюдалось достоверное (парный выборочный t-критерий; *p < 0,05) снижение активности BOLD во время блока подавления по сравнению с исходным блоком (упомянутым выше). Отрицательное значение процентного изменения сигнала BOLD представляет собой понижение регуляции. Полосы погрешностей представляют собой стандартное отклонение значений процентного изменения в испытаниях по подавлению регулирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
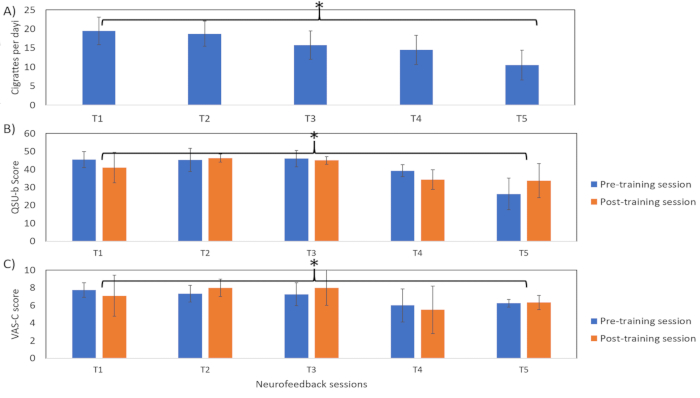
Рисунок 5: Явное поведение жажды. На рисунке представлено явное тяговое поведение участника, а именно визуальная аналоговая шкала тяги (VAS-C), опросник о позывах к курению (QSU-b) и количество сигарет в день (CPD) во время предварительного тренинга (T1), нейробиоуправления (T2, T3), посттренинга (T5) и последующего наблюдения (через 6 месяцев после тренинга; Т5). Более высокие баллы указывают на более высокий уровень тяги. Эти результаты показывают, что существует значительное (один выборочный t-критерий; *p < 0,05) общее снижение баллов по всем шкалам, что указывает на снижение явного стремления к поведению участника. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Имплицитное поведение жажды. Рисунок представляет собой имплицитное поведение участника по отношению к вызывающим тягу картинкам и его аналогам нейтральным картинкам, оцениваемое с помощью задачи аффективного прайминга на сеансах фМРТ (до тренировки, после тренировки и последующего наблюдения). Время реакции (мс) представлено для базового (синий) и подавления (оранжевый) блоков. Время реакции (мс) между исходным и регуляторным блоками для нейтральной (C) и вызывающей тягу (D) простых чисел достоверно различалось (t-критерий парной выборки; *p < 0,05) в последующем сеансе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Предтренировочная сессия (Т1) | Тренировка нейробиоуправления (Т2 и Т3) | Пост-нейробиоуправление (Т4) | Последующий сеанс (6 месяцев) (Т5) |
| Анкеты о курении | Анкеты о курении | Анкеты о курении | Анкеты о курении |
| 8 сеанс фМРТ и с заданием на прайминг | 4 Тренинг по нейробиоуправлению на основе фМРТ | 8 сеанс фМРТ и с заданием на прайминг | 8 сеанс фМРТ и с заданием на прайминг |
| Анатомическое сканирование | 1 перенос нейробиоуправления | Анатомическое сканирование | Анатомическое сканирование |
| ФМРТ в состоянии покоя | Анатомическое сканирование | ФМРТ в состоянии покоя | ФМРТ в состоянии покоя |
| Диффузионно-тензорная визуализация (DTI) | Диффузионно-тензорная визуализация (DTI) | Диффузионно-тензорная визуализация (DTI) |
Таблица 1: Экспериментальная парадигма для пяти сессий, состоящая из анкет и тренингов по фМРТ в режиме реального времени.
Обсуждение
Результаты, полученные от четырех участников, демонстрируют возможность для курильщиков сигарет научиться подавлять активацию в двусторонней передней островковой доле в присутствии сигналов, вызывающих тягу. Изменения в имплицитном и явном поведении при курении после тренинга нейробиоуправления у испытуемого участника могут быть связаны с усвоенным подавлением курения, поскольку участник не подвергался каким-либо другим клиническим или экспериментальным вмешательствам в ходе эксперимента. Изменение в неявном поведении участника может указывать на изменение смещения внимания в сторону тяги к картинкам, вызывающим тягу. Изменения во времени реакции на позитивные целевые слова указывают на то, что смещение внимания участника могло сместиться в сторону нейтральных валентных сигналов после тренировки подавления. Это может указывать на возможность того, что после подавления островковой доли образы, вызывающие тягу, оказывали меньшее влияние на участников, чем во время исходного состояния, что указывает на потенциальное снижение тяги из-за подавления.
Этот результат согласуется с оценками явного поведения, поскольку участники сообщили о меньшей тяге к сигарете и снижении среднего количества сигарет в день (до 10 в день) после 6 месяцев исследования, по сравнению с 20 сигаретами в день до включения в исследование. Этот результат особенно примечателен тем, что в течение 6-месячного периода между посттренингом и последующими сессиями не проводилось никаких клинических или экспериментальных вмешательств. В то время как вышеупомянутое снижение тяги к сигарете и количества выкуриваемых сигарет в день не может быть с уверенностью связано только с тренировкой нейробиоуправления, эти результаты имеют обнадеживающие последствия в лечении рецидивов. Мы помним о необходимости размера выборки лагера и более надежной статистики для более надежного вывода.
Несколько нейровизуализационных исследований продемонстрировали роль островковой доли в позывах к наркотикам, таким как алкоголь46,47, кокаин15,48 и героин49. Еще одно применение текущего протокола может быть у пациентов с ожирением. Известно, что передняя и средняя дорсальная островковая доля сильно активизируются, когда голодным пациентам с ожирением представляются изображения высококалорийной пищи по сравнению с худыми испытуемыми. Текущий протокол может быть обобщен для других зависимостей в качестве терапевтического вмешательства с использованием различных сигналов, связанных с наркотиками.
Эти предварительные результаты свидетельствуют о том, что с дальнейшим прогрессом в этом подходе нейробиоуправление на основе фМРТ может привести к терапевтическому вмешательству, в соответствии с наблюдениями, сделанными в других исследованиях 51,52,53,54. Нейробиоуправление как клиническое вмешательство все еще находится на ранней стадии; тем не менее, многие рандомизированные клинические испытания (РКИ) были проведены у пациентов с определенными клиническими состояниями, такими как синдром дефицита внимания и гиперактивности (СДВГ). В клинических испытаниях СДВГ пациенты были обучены снижать амплитуду низкочастотных колебаний ЭЭГ (например, дельта- и тета-диапазонов ЭЭГ), которые, как известно, высоки у пациентов с СДВГ. Эти РКИ показали, что пациенты научились снижать амплитуды с помощью тренировки нейробиоуправления с улучшением симптомов СДВГ 55,56,57,58.
Кроме того, величина клинического эффекта от тренировки с нейробиоуправлением может быть выше, чем у традиционной компьютеризированной тренировки внимания. Аналогичным образом, РКИ подтвердили улучшение двигательных функций у пациентов с инсультом за счет сочетания нейробиоуправления на основе ЭЭГ с существующими терапевтическими подходами59 (физиотерапия) или современными подходами к стимуляции [например, функциональный электростимулятор60 (FES), транскраниальная магнитная стимуляция61 (TMS) и роботизированная ассистивная терапия62,63)]. Тем не менее, наблюдаемые улучшения двигательной функции также наблюдались как крайне непоследовательные у разных пациентов, возможно, из-за вариабельности расположения и размеровпоражений головного мозга.
Несмотря на то, что несколько исследований нейробиоуправления на основе фМРТ продемонстрировали улучшение поведенческих улучшений при психических и неврологических расстройствах, до сих пор не было проведено ни одного РКИ с использованием этого подхода. Несмотря на свои преимущества, нейробиоуправление на основе rtfMRI имеет определенные препятствия для его использования в клинических условиях, включая высокие эксплуатационные расходы и клаустрофобную, шумную среду внутри сканера. Эти ограничения также распространяются на текущий протокол. Поэтому важно определить подход, который можно использовать для дополнения rtfMRI более дешевым методом, таким как подходы на основе нейробиоуправления на основе ЭЭГ или fNIRS. Таким образом, в будущих исследованиях может быть разработан протокол, сочетающий в себе как нейробиоуправление на основе фМРТ, так и подходы к обучению на основе нейробиоуправления на основе ЭЭГ или фНИРС.
На начальном этапе протокола пациенты будут обучены подавлять островковую кору с помощью нейробиоуправления на основе фМРТ, а одновременная запись ЭЭГ будет проводиться для оценки нейроэлектрических компонентов, которые коррелируют с изученной подавлением островковой коры. Позже может быть разработана модель паттернов активации глубоких структур мозга (например, островковой доли) на основе данных поверхностной ЭЭГ. Это может быть достигнуто за счет использования существующих методов алгоритмов локализации источников65 , позволяющих построить 3D-модель электрической активности в головном мозге на основе точной электромагнитной томографии низкого разрешения (eLORETA)66 или метода67 ЭЭГ. На втором этапе предлагаемого протокола пациентам может быть предоставлена расширенная тренировка по нейробиоуправлению с использованием нейробиоуправления на основе ЭЭГ. Таким образом, данный протокол дает возможность обучать (тренировать нейробиоуправление) пациентов в течение более длительных периодов времени в удобной для пользователя среде и с меньшими затратами. Таким образом, это может позволить перевести научно строгие результаты обучения нейробиоуправления rtfMRI в портативную и доступную клиническую систему для лечения психических и неврологических расстройств. Дальнейшее использование этого неинвазивного метода для регистрации как нейронной, так и гемодинамической активности в мозге во время экспериментов с нейробиоуправлением открывает новые захватывающие возможности для клинического лечения и реабилитации.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) через Fondo Nacional de Desarrollo Científico y Tecnológico, Fondecyt Postdoctoral grant (No 3100648), Fondecyt Regular (проекты No 1171313 и No 1171320) и CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Материалы
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
Ссылки
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419 (2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25 (2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2017. , (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031 (2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. . International smoking images series (with neutral counterparts). , (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911 (2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499 (2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17 (2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174 (2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421 (2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
ISSN 1940-087X
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.