Method Article
Uso de neurofeedback baseado em ressonância magnética funcional em tempo real para regular negativamente o córtex insular em fumantes viciados em nicotina
Neste Artigo
Resumo
Na ressonância magnética funcional em tempo real (rtfMRI), a atividade cerebral é manipulada experimentalmente como uma variável independente e o comportamento é medido como uma variável dependente. O protocolo aqui apresentado enfoca o uso prático da rtfMRI como ferramenta terapêutica para transtornos psiquiátricos, como a dependência de nicotina.
Resumo
Já se passou mais de uma década desde que a primeira abordagem de neurofeedback baseada em ressonância magnética funcional (fMRI) foi implementada com sucesso. Desde então, vários estudos demonstraram que os participantes podem aprender a controlar voluntariamente uma região circunscrita do cérebro. Consequentemente, a fMRI em tempo real (rtfMRI) forneceu uma nova oportunidade para estudar modificações de comportamento devido à manipulação da atividade cerebral. Assim, os relatos de aplicações de rtfMRI para treinar a autorregulação da atividade cerebral e as modificações concomitantes em condições comportamentais e clínicas, como distúrbios neurológicos e psiquiátricos [por exemplo, esquizofrenia, transtorno obsessivo-compulsivo (TOC), acidente vascular cerebral] aumentaram rapidamente.
Estudos de neuroimagem na pesquisa de dependência mostraram que o córtex cingulado anterior, o córtex orbitofrontal e o córtex insular são ativados durante a apresentação de pistas associadas a drogas. Além disso, a atividade nos córtices insulares esquerdo e direito demonstrou estar altamente correlacionada com os impulsos de drogas quando os participantes são expostos a estímulos que provocam o desejo. Portanto, a ínsula bilateral é de particular importância na pesquisa de impulsos e dependência de drogas devido ao seu papel na representação de estados corporais (interoceptivos). Este estudo explora o uso de neurofeedback rtfMRI para a redução da atividade dependente do nível de oxigênio no sangue (BOLD) em córtices insulares bilaterais de participantes viciados em nicotina. O estudo também testa se há modificações associadas ao treinamento de neurofeedback nas atitudes implícitas dos participantes em relação aos sinais de desejo de nicotina e comportamento de desejo explícito.
Introdução
O neurofeedback é um procedimento de condicionamento operante através do qual humanos ou animais podem aprender a modular a atividade neural em uma ou mais regiões do cérebro. O treinamento geralmente leva a modificações comportamentais1. Em princípio, os sinais cerebrais de uma ou mais regiões cerebrais circunscritas são transformados em feedback sensorial (por exemplo, feedback visual, auditivo ou tátil), que é fornecido ao participante para controle da atividade cerebral por condicionamento operante ou outras formas de aprendizagem. Na reversão do paradigma tradicional de neuroimagem, os estudos de neurofeedback modulam a atividade cerebral como uma variável independente e medem o comportamento como uma variável dependente. Assim, o neurofeedback fornece uma nova abordagem para investigar o envolvimento de regiões cerebrais em diferentes funções cognitivas e como a hiper ou hipoativação dessas regiões cerebrais pode levar a um comportamento anormal.
O neurofeedback tem sido usado com diferentes modalidades de neuroimagem, como ressonância magnética funcional (fMRI), eletroencefalografia (EEG) e espectroscopia funcional de infravermelho próximo (fNIRS). Os paradigmas de neurofeedback baseados em EEG e fNIRS têm as vantagens de maior resolução temporal, acessibilidade e portabilidade 2,3. No entanto, eles são caracterizados por baixa resolução espacial e incapacidade de acessar regiões cerebrais mais profundas. Além disso, o EEG tem a complexidade computacional do problema inverso para determinar uma fonte de ativações neurais a partir de sinais de EEG de superfície4. No entanto, com os recentes desenvolvimentos em fMRI em tempo real (rtfMRI), é possível acessar sinais hemodinâmicos de todas as partes do cérebro, com boa resolução espacial (por exemplo, 2 mm3) e resolução temporal de 720 ms5. Assim, a fMRI supera as limitações acima mencionadas possuídas pelas técnicas de fNIRS e EEG.
A dependência da nicotina é uma das principais causas de morte em todo o mundo devido a uma série de doenças associadas ao tabagismo6. Os fatores reconhecidos que levam ao vício em nicotina são sociais, ambientais, psicológicos7 e suscetibilidade genética8. Em um nível neurobiológico, estudos mostraram ativação no córtex cingulado anterior (ACC), córtex orbitofrontal (OFC), área tegmental ventral (VTA), estriado ventral, amígdala, hipocampo, córtex pré-frontal (PFC) e córtex insular durante a apresentação de pistas associadas a drogas em contraste com pistas de controle neutras 9,10,11,12,13,14 . A atividade nas ínsulas esquerda e direita está altamente correlacionada com os impulsos de fumar quando os fumantes visualizaram pistas associadas a drogas15,16. A ínsula desempenha um papel importante na indução do comportamento de fissura 17,18,19,20,21, pois é responsável pela percepção do estado corporal. Foi relatado que fumantes com lesões em seus córtices insulares eram mais propensos a parar de fumar do que fumantes com danos cerebrais não envolvendo a ínsula18.
Um dos maiores desafios nos métodos existentes de cessação do tabagismo é a alta taxa de recaída22. Mais de 80% dos fumantes recaem nos primeiros meses após parar de fumar23. A exposição a pistas previamente associadas ao uso de drogas é uma das principais razões para a alta taxa de recaída na dependência de nicotina24. Esse mecanismo é chamado de efeito de incubação. O protocolo atual é desenvolvido para direcionar o efeito de incubação avaliado por uma tarefa de priming afetivo. Estudos anteriores demonstraram que fumantes que se abstêm têm atitudes implícitas negativas em relação a pistas relacionadas ao tabagismo 25,26,27,28. Na tarefa típica de priming afetivo, os estímulos de priming emocional modificam o processamento de um alvo afetivo para que o tempo de reação e a precisão das respostas sejam alterados29. Em outras palavras, se os estímulos primo e alvo forem da mesma valência, o tempo de reação em resposta aos estímulos alvo será mais rápido e vice-versa.
No estudo atual, levanta-se a hipótese de que a regulação negativa do córtex insular anterior bilateral reduzirá o desejo e, portanto, a valência das pistas indutoras de desejo mudará de negativa para neutra, pois o viés de atenção e associativo se afastará das pistas relacionadas ao tabagismo30. A tarefa de comportamento implícito é uma tarefa de priming afetivo originalmente adaptada de Czyzewska e Graham31. Com base na hipótese acima mencionada, espera-se observar uma diminuição no tempo de reação em resposta a uma combinação de prime (imagem que provoca desejo ou sua imagem de contraparte neutra) e palavras-alvo com valência positiva após o bloqueio de regulação negativa em comparação com o bloqueio de linha de base. A tarefa de priming (Figura 2B) consiste em uma figura primo (ou seja, uma imagem que provoca desejo ou sua contraparte neutra32) e uma palavra-alvo com valência positiva ou negativa. A imagem principal é apresentada por 200 ms, seguida por uma palavra-alvo apresentada por 1 segundo. A assincronia de início do estímulo (SOA) é de 250 ms. Os participantes são então instruídos a julgar a valência da palavra-alvo (positiva ou negativa) e responder pressionando um botão com a maior rapidez e precisão possível.
O sistema rtfMRI (Figura 1) consiste nos seguintes subsistemas: (1) participante, (2) aquisição de sinal, (3) análise de sinal online e (4) feedback de sinal. A aquisição do sinal é realizada com um scanner de corpo inteiro Siemens Trio 3.0T usando uma sequência de imagem ecoplanar (EPI)33. Procedimentos como reconstrução de imagem, correção de distorção e média do sinal são realizados no computador do scanner. Uma vez que as imagens são reconstruídas e pré-processadas, elas são exportadas para o subsistema de análise de sinal. O subsistema de análise de sinal é implementado usando o Turbo Brain Voyager (TBV) 34 . O TBV recupera as imagens reconstruídas e realiza o processamento de dados que inclui correção de movimento 3D e análise estatística em tempo real usando o modelo linear geral35. O TBV permite que o usuário desenhe regiões de interesse (ROIs) em vários voxels nas imagens funcionais e extraia valores médios de BOLD do ROI após cada tempo de repetição (TR). As séries temporais dos ROIs selecionados são então exportadas para o script MATLAB que calcula e apresenta feedback ao participante.
O feedback visual da atividade cerebral é fornecido aos participantes na forma de um termômetro animado graficamente, com suas barras mudando proporcionalmente às mudanças percentuais de BOLD nos ROIs. Vários estudos usaram feedback intermitente (feedback fornecido a um participante após uma série de TRs da sequência EPI) para treinar participantes36,37. No entanto, no presente estudo, previu-se que os participantes teriam maior dificuldade em regular negativamente o sinal BOLD na ínsula anterior com feedback contínuo devido ao papel da ínsula na integração sensorial e envolvimento no processamento de informações de feedback visual38. Portanto, presumiu-se que o feedback contínuo resultaria em um conflito entre dois processos no córtex insular, um processo que aumenta o sinal devido ao feedback externo e outro que diminui o sinal devido ao treinamento de neurofeedback. Portanto, neste estudo, fornecemos feedback apenas no final de cada bloco de regulação negativa (feedback atrasado). Os participantes recebem um texto (por exemplo, 0,87 euros) como feedback visual (Figura 2A, C) que indica a quantidade de dinheiro que ganharam (recompensa monetária). Essa recompensa é proporcional à porcentagem de downregulation alcançada no bloco de regulação.
A RtfMRI é uma nova neurotecnologia que pode superar problemas nas abordagens terapêuticas para o tratamento da dependência e pode fornecer intervenções mais confiáveis e eficazes para reduzir a recaída. Os objetivos de longo prazo do estudo atual são três: 1) testar se os viciados em nicotina podem aprender a regular negativamente os sinais BOLD na ínsula anterior durante a presença de estímulos que provocam o comportamento de desejo; 2) examinar se o treinamento de neurofeedback leva a modificações no comportamento de fissura; e 3) explorar se as mudanças nos níveis de fissura durante o treinamento de neurofeedback de regulação negativa da ínsula persistem após seis meses de treinamento sem qualquer outra intervenção. Este artigo fornece uma descrição detalhada do protocolo experimental rtfMRI e seus diferentes componentes. Também são apresentados dados de amostra do estudo e uma discussão sobre os desafios futuros e o potencial desse método, além da pesquisa. O protocolo apresentado é projetado para investigar se o treinamento de neurofeedback baseado em fMRI pode ser usado para estudar reduções na atividade cerebral no córtex insular de fumantes de cigarro. Além disso, o protocolo destina-se a estudar as relações entre a ativação do córtex insular e os comportamentos de fissura dos fumantes de cigarro.
Protocolo
O Comitê de Ética da Faculdade de Medicina da Universidade de Tübingen e da Pontifícia Universidade Católica do Chile aprovou o seguinte protocolo de rtfMRI.
1. Configuração de hardware
- O hardware representado na Figura 1 é preparado apenas uma vez para configurar a exportação em tempo real dos dados de ressonância magnética.
- A preparação da sala de ressonância magnética é a mesma que a medição tradicional de fMRI. Prepare a sala de ressonância magnética antes da chegada do participante.
- Conecte a bobina principal de 32 ou 20 canais ao scanner.
- Conecte o cabo VGA/HDMI do projetor e o dispositivo de resposta compatível com RM (caixa de botões) ao computador de estímulo.
NOTA: Na maior parte da configuração de RM, o dispositivo de resposta fornece o gatilho TR ao computador de estímulo. Esse gatilho ajuda a sincronizar a apresentação do estímulo e a aquisição de dados.
2. Preparação dos participantes fora do scanner
- Prepare o formulário de consentimento e os questionários que os participantes precisam preencher antes de sua chegada.
- Assim que o participante chegar, explique o experimento e a técnica de fMRI. Além disso, instrua o participante sobre como realizar a tarefa (por exemplo, durante o experimento, os participantes devem manter os olhos abertos e sempre olhar para as imagens na tela de exibição, e devem tentar não mover a cabeça dentro do scanner).
- Peça ao participante que assine o termo de consentimento e preencha os questionários necessários para avaliar os níveis de fissura.
- Peça aos participantes que preencham os seguintes questionários: 1) VAS-C: Escala Visual Analógica, Desejo39, 2) QSU-b: Questionário de Impulsos de Fumar – Versão Breve40 e 3) cigarros por dia.
- Peça ao participante para expirar através do dispositivo de medição de monóxido de carbono (CO).
NOTA: A medição de CO41 indica se o participante se abstém ou não de fumar pelo menos 3 h antes da chegada para a sessão de neurofeedback. O CO é medido em ppm (partes por milhão). Valores baixos de CO indicam que o participante não fumou por pelo menos algumas horas antes da chegada. Os participantes devem ser solicitados a abster-se de fumar para que os sinais de desejo provoquem alta fissura durante o experimento. Os participantes com altos valores de CO serão advertidos antes da futura sessão de neurofeedback para garantir que se abstenham de fumar antes da sessão de rtfMRI. Os participantes que não se abstiverem de fumar duas vezes devem ser excluídos do estudo.
3. Posicionamento do participante
NOTA: O procedimento de posicionamento do participante na mesa do scanner é semelhante ao experimento tradicional de fMRI.
- Peça ao participante para remover todos os objetos metálicos de seus bolsos antes de entrar na sala de ressonância magnética.
- Peça ao participante para inserir tampões de ouvido antes de se deitar na mesa do scanner em decúbito dorsal.
- Use almofadas para fixar a posição da cabeça do participante dentro da bobina da cabeça. Esta etapa ajuda a reduzir o movimento da cabeça durante a medição.
- Trave a parte superior da bobina principal e fixe o espelho na bobina principal.
- Dê o dispositivo de resposta ao participante e coloque o dispositivo de resposta de acordo com o conforto do participante.
- Peça ao participante para fechar os olhos e marcar a posição de referência da cabeça do participante entre as sobrancelhas usando luz laser.
- Mova a mesa do scanner para colocar a posição marcada no centro do orifício de ressonância magnética.
- Confirme com o participante se ele está em posição confortável e se pode ver os estímulos visuais projetados na tela atrás do scanner usando o espelho. Ajuste o espelho, se necessário.
4. Aquisição de dados
- Durante os exames iniciais, peça ao participante para fechar os olhos e tentar não mover a cabeça.
- Inicie a medição com uma sequência de pulso do localizador. Essa sequência é normalmente usada para determinar a posição do corte da varredura anatômica e funcional (sequência EPI) executada posteriormente.
- Selecione o campo de visão (FOV) para a varredura anatômica com os seguintes parâmetros: TR = 11,5 ms, TE = 5 ms, 176 cortes sem slice gap, FOV = 240 x 240mm2, matriz = 256 x 256, ângulo de inversão = 18°, fornecendo 1 mm3 voxels isotrópicos. O FOV da sequência cobrirá toda a cabeça do participante.
- O campo de visão para a varredura funcional (sequência EPI) está alinhado com a linha de comissura anterior/comissura posterior (linha AC-PC). Ajuste a posição das fatias para cobrir a região alvo de interesse. Os parâmetros da sequência são os seguintes: TR = 1,5, FOV = 192 mm, 25 cortes, voxel = 3 mm x 3 mm x 3 mm, ângulo de inversão = 70°.
5. Neurofeedback FMRI
- Alerte o participante de que a execução do neurofeedback está começando e repita as instruções fornecidas anteriormente (por exemplo, que durante a linha de base, um bloco é representado por um sinal "+").
NOTA: O participante deve observar a imagem na tela do visor. Por outro lado, durante o bloqueio de regulação, representado por uma seta no sentido descendente, os participantes devem tentar se desprender dos impulsos de desejo usando algumas estratégias cognitivas. A quantidade de dinheiro mostrada no final de cada bloco de regulamentação representa seu desempenho. Uma quantia maior de dinheiro representa melhor desempenho. - Execute a corrida de neurofeedback em que os blocos de linha de base e regulação são alternados (30 s cada; Figura 2).
- No computador de estímulo, execute o software de apresentação escrita do código de estímulo e pressione o botão Enter depois que Ready aparecer na tela. O código de apresentação agora está aguardando o gatilho para iniciar a execução do neurofeedback.
NOTA: O código está sincronizado com os gatilhos TR provenientes do scanner. Portanto, é o primeiro passo na preparação para executar a corrida de neurofeedback. - No computador de análise, execute a caixa de ferramentas interna do MATLAB e o turbo brain voyager (TBV).
- Na caixa de ferramentas do MATLAB, insira as informações específicas do participante, como ID do paciente e número de execução do neurofeedback.
- Pressione Gerar arquivos de protocolo para preparar o arquivo de protocolo usando as informações inseridas na etapa 5.5.
NOTA: O arquivo de protocolo contém informações relacionadas ao momento da condição (por exemplo, o momento em que a RT uma condição específica deve começar e qual estímulo deve ser apresentado). Ele será usado tanto pela caixa de ferramentas MATLAB quanto pelo TBV. - Pressione o botão executar na GUI da caixa de ferramentas do MATLAB. O código agora está aguardando para receber dados do TBV.
- No TBV, selecione o arquivo de protocolo gerado na etapa 5.6. Além disso, selecione o arquivo .roi gerado a partir das sessões anteriores de neurofeedback.
NOTA: Selecionar um arquivo ROI é importante, pois evitará a falha do software TBV durante o período inicial (10 TRs) da execução do neurofeedback. - Prepare a seqüência EPI a ser implementada no computador host MR. Pressione o botão Iniciar no TBV.
- Redesenhe as ROIs alvo no software TBV de acordo com os pontos de referência anatômicos. A forma e o tamanho dos ventrículos no cérebro são usados como pontos de referência para selecionar a ínsula anterior. Além disso, a forma ondulada do córtex insular é usada para selecionar com precisão os voxels relacionados à ínsula anterior bilateral.
- Desenhe uma ROI na área motora primária (M1) usando o sulco central como um marco anatômico. A área motora primária atua como um ROI de referência para remover o efeito dos aumentos globais de BOLD e flutuações de BOLD devido ao movimento da cabeça.
- No final de cada sessão de neurofeedback, pergunte ao participante: "Que estratégia cognitiva você estava usando durante o bloco de regulação?". Além disso, pergunte ao participante sobre seu nível de conforto e se ele deseja ou não continuar com o experimento.
- Após quatro execuções de neurofeedback, selecione o botão de opção Sim para a execução de transferência.
NOTA: Uma execução de transferência é semelhante à execução de neurofeedback. No entanto, os participantes realizam a autorregulação na ausência de feedback. Isso ajuda a determinar se a autorregulação aprendida é transferida para a situação em que o participante não receberá neurofeedback (por exemplo, fora do scanner).
6. Grupo de controle
- Instrua os participantes do grupo de controle da mesma maneira que os do grupo experimental. No entanto, forneça feedback sobre o Yolk aos participantes.
NOTA: No feedback em jugo, a quantidade média de reforço (dinheiro) nos grupos experimental e de controle permanece a mesma. A única diferença entre os dois grupos é a contingência do feedback fornecido aos participantes. Para os participantes do grupo de controle, a quantidade total de reforço (dinheiro) é distribuída entre os 40% aleatoriamente designados dos ensaios de regulação negativa. No entanto, nos outros 60% dos ensaios, os participantes recebem feedback negativo (zero euros). Assim, os participantes do grupo de controle não recebem feedback contingente.
7. Análise offline
- Pré-processamento de dados de fMRI
- Use uma caixa de ferramentas de mapeamento paramétrico estatístico (SPM) para pré-processar os dados de fMRI (https://www.fil.ion.ucl.ac.uk/spm/ext/).
- Converta os dados de fMRI no formato DICOM para o formato NIFTI usando o utilitário de conversão de formato da função de lote SPM.
- Remova as 10 varreduras iniciais de cada dado de execução de neurofeedback para evitar efeitos de equilíbrio de gradiente42.
- Execute o processo de realinhamento para remover artefatos de movimento e alinhar todos os volumes ao primeiro volume da sessão. Além disso, execute a correção de fatia de tempo para compensar o atraso de aquisição da fatia43.
- Realizar segmentação da varredura anatômica, co-registro dos dados da sequência EPI e dos dados anatômicos e normalização para mapear os dados do espaço do sujeito para o modelo cerebral padrão do Montreal Neurological Institute (MNI)44.
- Usando nosso código MATLAB interno, extraia os sinais BOLD de ROIs em forma de cubo criadas em torno das coordenadas MNI correspondentes à ínsula anterior bilateral e ao córtex motor primário.
- Cálculo da variação percentual no sinal BOLD
- Calcule a variação percentual no sinal BOLD com base na alteração média no sinal BOLD para cada ROI durante o bloco de regulação em comparação com o bloco de linha de base anterior. A equação para variação percentual no sinal BOLD é a seguinte:
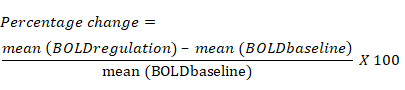
- Calcule a variação percentual no sinal BOLD com base na alteração média no sinal BOLD para cada ROI durante o bloco de regulação em comparação com o bloco de linha de base anterior. A equação para variação percentual no sinal BOLD é a seguinte:
- Análise do comportamento explícito de fumar dos participantes
- Importe as respostas dos participantes aos questionários (ou seja, QSU-b, VAS-C, medida de CO e cigarros por dia) para o MATLAB.
- Teste a normalidade dos dados usando um teste de Kolmogorov-Smirnov de uma amostra do MATLAB.
- Um teste t de uma amostra deve ser usado para comparar as respostas de diferentes questionários para cada participante e um teste t de amostra pareada para comparar as pontuações entre os grupos experimental e controle.
- Análise da atitude implícita em relação às pistas que provocam o desejo
- Extraia o tempo de reação (RT) das tentativas de priming afetivo para cada participante dos arquivos de log gerados pelo software de apresentação.
- Remova os outliers com base no TR (ou seja, não inclua ensaios com um TR maior que 2x o desvio padrão do TR médio do participante).
- Teste a normalidade dos dados usando um teste de Kolmogorov-Smirnov de uma amostra do MATLAB.
- Compare os efeitos da regulação negativa nos tempos médios de reação de combinações únicas de primos (imagens neutras e indutoras de desejo) e alvos (palavras positivas e negativas) para cada participante e compare entre os grupos experimental e controle usando um teste t sábio pareado.
Resultados
Quatro pacientes foram recrutados com base em seus escores no questionário Fagerström Test for Nicotine Dependence (FTND)45 para dependência de nicotina de nível médio (escore FTND >4) e no número de cigarros fumados todos os dias (>15). Além disso, foi garantido que os participantes não possuíssem nenhuma tatuagem ou implante metálico de acordo com as medidas de segurança de ressonância magnética da instituição. Cinco sessões de rtfMRI foram realizadas para cada participante, nas quais as primeiras quatro sessões foram realizadas ao longo de 2 semanas (2 sessões por semana) e a quinta sessão foi realizada 6 meses após a quarta sessão. Os participantes foram solicitados a se abster de fumar pelo menos 3 h antes de cada sessão.
No dia 1, os participantes foram submetidos a sessões de pré-treinamento (antes do treinamento de neurofeedback) para obter respostas comportamentais implícitas básicas às imagens que provocam o comportamento de desejo. Nas sessões 2 e 3, o treinamento de neurofeedback (Figura 2C) foi realizado para treinar a regulação negativa do sinal BOLD nos córtices insulares anteriores esquerdo (ROI1) e direito (ROI2) como ROIs. Uma sessão pós-treinamento (após o treinamento de neurofeedback; sessão 4) idêntica à sessão pré-treinamento foi então realizada. Para avaliar os efeitos a longo prazo do treinamento de neurofeedback no comportamento implícito, uma sessão de acompanhamento semelhante à sessão pós-treinamento foi realizada 6 meses após a sessão pós-treinamento. Durante a sessão de pré-treinamento (Figura 2A), os participantes não estavam realizando nenhuma tarefa durante o bloco de regulação, e não foi fornecido feedback a eles. No entanto, durante as sessões pós-treinamento e acompanhamento, os participantes usaram estratégias de autorregulação aprendidas durante o período de treinamento. Os participantes receberam feedback contingente (recompensa monetária) no final de cada bloco de regulação. As figuras (Figura 4, Figura 5, Figura 6) mostram dados amostrais de quatro participantes do grupo experimental. Os dados apresentados estão relacionados ao desempenho do neurofeedback dos participantes e às mudanças nos comportamentos de fissura, avaliados pelos questionários e pela tarefa de preparação afetiva nas sessões de fMRI de neurofeedback.
Os participantes aprenderam a regular significativamente os sinais BOLD (tdf = 3,14, p < 0,05, teste t de amostra emparelhada bicaudal) no córtex insular bilateral com treinamento de neurofeedback. O sucesso dos participantes foi estimado calculando a variação percentual na equação do sinal BOLD, conforme explicado abaixo.
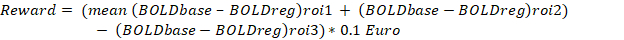
Onde: a ínsula anterior esquerda (ROI1) e a ínsula anterior direita (ROI2) foram selecionadas com base nos pontos anatômicos. A área motora primária (M1) foi selecionada como ROI de referência, ou seja, ROI3, para remover o efeito do aumento global do BOLD e da flutuação do BOLD devido ao movimento da cabeça.
Quanto menor o valor da mudança percentual no sinal BOLD, maior a taxa de sucesso dos participantes na regulação negativa do córtex insular bilateral (Figura 4). No entanto, os participantes não conseguiram manter a regulação negativa aprendida durante a sessão de acompanhamento. Além disso, observamos uma redução geral significativa (tdf = 2,78, p < 0,05, teste t bicaudal de uma amostra) no comportamento explícito de fumar medido pelo CPD (Figura 5A) durante a terceira e quarta sessões de rtfMRI, que diminui ainda mais durante a sessão de acompanhamento.
Da mesma forma, observou-se uma redução significativa nos escores dos questionários de comportamento tabágico, como o QSU-b (escores pré-treinamento: tdf = 11,1; escores pós-treinamento: tdf = 6,5, p < 0,05, teste t de uma amostra; Figura 5B) e VAS-C (escores pré-treinamento: tdf = 13,7; escores pós-treinamento: tdf = 16,07, p < 0,05, teste t de amostra pareada bicaudal; Figura 5C). No entanto, no caso do comportamento de fissura implícita (Figura 6), observou-se que os tempos de reação (ms) foram significativamente menores nas tarefas apresentadas após o bloqueio de regulação negativa em comparação com as tarefas apresentadas após o bloqueio basal. Na tarefa de priming afetivo, existem quatro combinações da sugestão principal (sugestão de provocação do desejo e sua contraparte neutra) e palavra-alvo (valência positiva e negativa). Das quatro combinações acima mencionadas, duas combinações de sugestão de priming e sugestão alvo [ou seja, prime: neutro e alvo: positivo (tdf = 2,97) e prime: craving e target: positivo (tdf = 2,78)] mostraram tempos de reação significativamente mais rápidos (p < 0,05) na tarefa após os bloqueios de regulação negativa. A redução geral no tempo de reação para as tarefas após os blocos de linha de base e regulação pode ser atribuída ao efeito da prática. No entanto, a redução nos tempos de reação para as combinações de palavras-alvo primárias (desejo e neutras) e positivas (Figura 6B) indica uma mudança na valência percebida do participante das pistas indutoras de desejo.
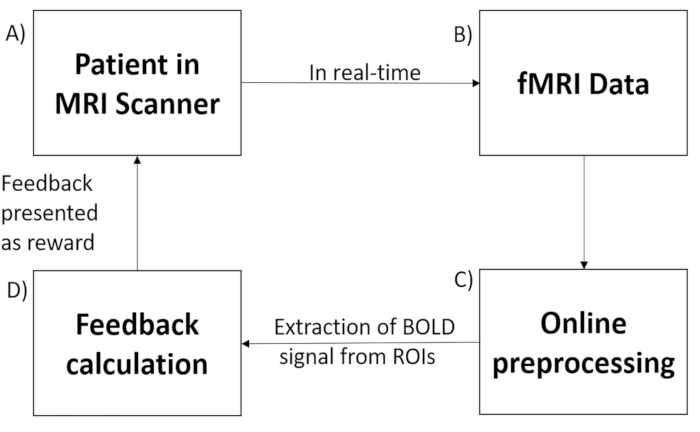
Figura 1: Configuração de fMRI em tempo real. O sistema de neurofeedback baseado em fMRI em tempo real é composto pelos seguintes subsistemas: (A) participante do scanner, (B) aquisição de sinal usando uma sequência de pulso de imagem planar de eco (EPI), (C) pré-processamento online dos dados adquiridos, (D) cálculo do feedback de acordo com a hipótese e (E) feedback do sinal através do sistema de projeção do scanner. Clique aqui para ver uma versão maior desta figura.
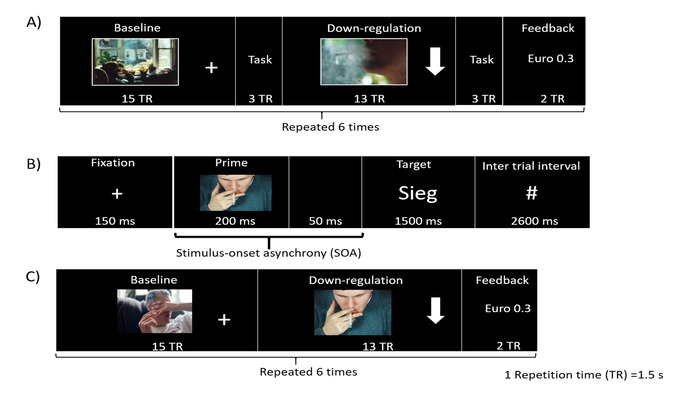
Figura 2: Paradigma experimental. (A) Ilustração esquemática do paradigma experimental para sessões de pré-treinamento, pós-treinamento e acompanhamento. O protocolo consiste em seis blocos alternados de linha de base e regulação. Cada bloco foi seguido por uma tarefa de priming afetivo. (B) A tarefa de priming afetivo usada aqui avalia o efeito da regulação negativa na atitude implícita em relação às pistas de desejo. Consiste em um primo (imagem que provoca desejo ou imagem de contraparte neutra), que é então seguido por uma palavra-alvo (valência positiva ou negativa). A palavra "Sieg" tem valência positiva e é uma palavra alemã que significa "vitória". (C) Cada execução de treinamento rtfMRI consiste em blocos de linha de base, regulação negativa e feedback nessa ordem repetidos seis vezes. Clique aqui para ver uma versão maior desta figura.
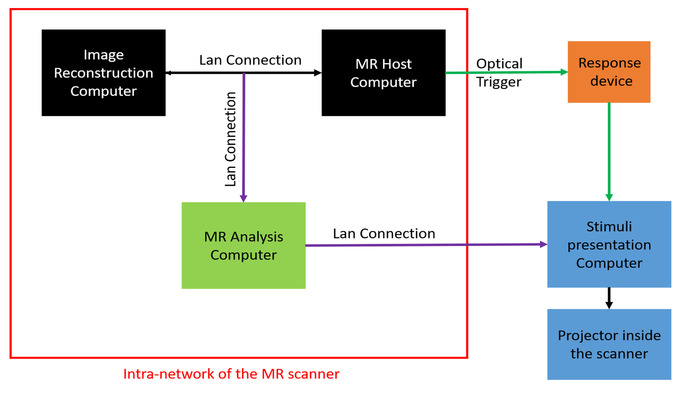
Figura 3: Configuração de hardware de fMRI em tempo real. A configuração de fMRI em tempo real consiste em três subsistemas a seguir: (1) reconstrução de imagem e computador host de RM (preto), (2) computador de análise de ressonância magnética em tempo real (verde) e (3) computador de apresentação de estímulo e projetor (azul). As conexões LAN apresentadas na cor roxa são adicionadas à configuração padrão existente de fMRI. O gatilho óptico (verde escuro) é conectado ao computador de apresentação do estímulo por meio de um dispositivo de resposta compatível com RM (laranja). Clique aqui para ver uma versão maior desta figura.

Figura 4: Variação percentual no sinal BOLD. A figura representa a alteração percentual no sinal BOLD nos córtices insulares esquerdo (azul) e direito (laranja) durante o pré-treinamento (T1), treinamento de neurofeedback (T2, T3), pós-treinamento (T4) e acompanhamento (6 meses após a sessão pós-treinamento; T5). O participante mostrou uma redução significativa (teste t de amostra pareada; *p < 0,05) na atividade do BOLD durante o bloco de regulação negativa em comparação com o bloco de linha de base (mencionado acima). Um valor negativo de variação percentual no sinal BOLD representa regulação negativa. As barras de erro representam o desvio padrão nos valores de alteração percentual dos ensaios de regulação negativa. Clique aqui para ver uma versão maior desta figura.
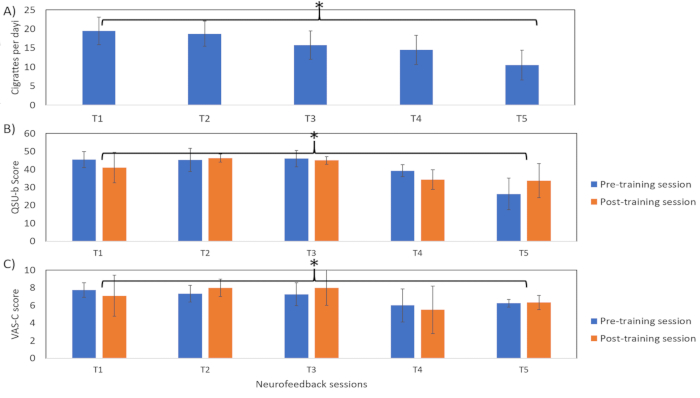
Figura 5: Comportamento explícito de fissura. A figura representa o comportamento explícito de fissura do participante, a saber, Escala Visual Analógica de Fissura (VAS-C), Questionário de Urgências Breves de Fumar (QSU-b) e número de cigarros por dia (CPD) durante o pré-treinamento (T1), treinamento de neurofeedback (T2, T3), pós-treinamento (T5) e acompanhamento (6 meses após a sessão pós-treinamento; T5). Pontuações mais altas indicam níveis mais altos de desejo. Esses resultados mostram que há uma redução geral significativa (teste t de uma amostra; *p < 0,05) nas pontuações de todas as escalas, indicando uma redução no comportamento de desejo explícito do participante. Clique aqui para ver uma versão maior desta figura.

Figura 6: Comportamento de desejo implícito. A figura representa o comportamento implícito do participante em relação às pistas de imagem que provocam o desejo e suas imagens neutras equivalentes, avaliadas por uma tarefa de preparação afetiva nas sessões de fMRI (pré-treinamento, pós-treinamento e acompanhamento). O tempo de reação (ms) é apresentado para os blocos de linha de base (azul) e regulação negativa (laranja). Os tempos de reação (ms) entre os blocos basal e de regulação para uma imagem primária neutra (C) e indutora de desejo (D) foram significativamente diferentes (teste t de amostra pareada; * p < 0,05) na sessão de acompanhamento. Clique aqui para ver uma versão maior desta figura.
| Sessão de pré-treino (T1) | Treinamento de neurofeedback (T2 e T3) | Treinamento pós-neurofeedback (T4) | Sessão de acompanhamento (6 meses) (T5) |
| Questionários sobre tabagismo | Questionários sobre tabagismo | Questionários sobre tabagismo | Questionários sobre tabagismo |
| 8 sessões de fMRI e com tarefa de priming | 4 Sessão de treinamento de neurofeedback baseada em fMRI | 8 sessões de fMRI e com tarefa de priming | 8 sessões de fMRI e com tarefa de priming |
| Varredura anatômica | 1 corrida de transferência de neurofeedback | Varredura anatômica | Varredura anatômica |
| FMRI em estado de repouso | Varredura anatômica | FMRI em estado de repouso | FMRI em estado de repouso |
| Imagem por tensor de difusão (DTI) | Imagem por tensor de difusão (DTI) | Imagem por tensor de difusão (DTI) |
Tabela 1: Paradigma experimental para as cinco sessões que consistem em questionários e sessões de treinamento de fMRI em tempo real.
Discussão
Os resultados de quatro participantes demonstram a possibilidade de os fumantes aprenderem a regular negativamente a ativação na ínsula anterior bilateral na presença de pistas que provocam o desejo. Mudanças nos comportamentos implícitos e explícitos de fumar após o treinamento de neurofeedback no participante da amostra podem estar relacionadas à regulação negativa aprendida, já que o participante não passou por nenhuma outra intervenção clínica ou experimental durante o curso do experimento. A mudança no comportamento implícito do participante pode indicar uma mudança no viés de atenção em relação ao desejo que provoca imagens. As mudanças no tempo de reação para palavras-alvo positivas indicam que o viés de atenção do participante pode ter mudado para as pistas de valência neutras após o treinamento de regulação negativa. Isso pode indicar a possibilidade de que os participantes tenham sido menos afetados pelas imagens indutoras de desejo após a regulação negativa da ínsula do que durante a condição basal, indicando redução potencial do desejo devido à regulação negativa.
Esse resultado está de acordo com as pontuações de comportamento explícito, pois os participantes relataram menos desejo e um número médio reduzido de cigarros por dia (para 10 por dia) após 6 meses de estudo, em comparação com 20 por dia antes da inscrição. Este resultado é particularmente notável porque nenhuma intervenção clínica ou experimental foi envolvida durante o período de 6 meses entre as sessões pós-treinamento e acompanhamento. Embora a redução acima no desejo e no número de cigarros fumados por dia não possa ser relacionada com certeza apenas ao treinamento de neurofeedback, esses resultados têm implicações encorajadoras no tratamento de recaídas. Estamos cientes da necessidade de um tamanho de amostra de cerveja e estatísticas mais robustas para uma conclusão mais confiável.
Vários estudos de neuroimagem demonstraram um papel da ínsula nos impulsos de drogas como álcool 46,47, cocaína15,48 e heroína49. Outra aplicação do protocolo atual pode ser em pacientes obesos. Sabe-se que a ínsula anterior e médio-dorsal torna-se altamente ativada quando pacientes obesos famintos são apresentados a imagens de alimentos altamente calóricos em comparação com indivíduos magros50. O protocolo atual pode ser generalizado para outros vícios como uma intervenção terapêutica usando diferentes pistas associadas a drogas.
Esses resultados preliminares sugerem que, com mais progresso nessa abordagem, o neurofeedback baseado em fMRI pode levar a uma intervenção terapêutica, em linha com observações feitas em outros estudos 51,52,53,54. O neurofeedback como intervenção clínica ainda está em estágio inicial; no entanto, muitos ensaios clínicos randomizados (ECRs) foram realizados em pacientes com certas condições clínicas, como transtorno de déficit de atenção e hiperatividade (TDAH). Nos ensaios clínicos de TDAH, os pacientes foram treinados para diminuir a amplitude nas oscilações de EEG de baixa frequência (por exemplo, bandas delta e do EEG), que são conhecidas por serem altas em pacientes com TDAH. Esses ECRs demonstraram que os pacientes aprenderam a diminuir as amplitudes usando treinamento de neurofeedback com melhora nos sintomas de TDAH 55,56,57,58.
Além disso, o tamanho do efeito clínico devido ao treinamento de neurofeedback pode ser maior do que o treinamento de atenção computadorizado tradicional. Da mesma forma, os ECRs validaram a melhora nas funções motoras de pacientes com AVC, combinando o treinamento de neurofeedback baseado em EEG com abordagens terapêuticas existentes59 (fisioterapia) ou abordagens modernas de estimulação [por exemplo, estimulador elétrico funcional60 (FES), estimulação magnética transcraniana61 (TMS) e terapia assistiva robótica62,63)]. No entanto, as melhorias observadas na função motora também foram observadas como altamente inconsistentes em diferentes pacientes, possivelmente devido à variabilidade nas localizações e tamanhos das lesões cerebrais64.
Embora vários estudos de neurofeedback baseados em fMRI tenham demonstrado melhorias comportamentais em distúrbios psiquiátricos e neurológicos, nenhum ECR foi realizado até agora usando essa abordagem. Apesar de seus benefícios, o neurofeedback baseado em rtfMRI apresenta certos obstáculos para seu uso em um ambiente clínico, incluindo altos custos operacionais e um ambiente claustrofóbico e barulhento dentro do scanner. Essas limitações também se aplicam ao protocolo atual. Portanto, é importante identificar uma abordagem que possa ser usada para complementar o rtfMRI com uma modalidade mais barata, como abordagens de neurofeedback baseadas em EEG ou fNIRS. Assim, em estudos futuros, um protocolo pode ser desenvolvido que combine abordagens de treinamento de neurofeedback baseadas em fMRI e neurofeedback baseadas em EEG ou fNIRS.
No estágio inicial do protocolo, os pacientes seriam treinados para regular negativamente o córtex insular usando treinamento de neurofeedback baseado em fMRI, e a gravação simultânea de EEG será realizada para avaliar os componentes neuroelétricos que se correlacionam com a regulação negativa aprendida do córtex insular. Mais tarde, um modelo de padrões de ativação de estruturas cerebrais profundas (por exemplo, ínsula) a partir de dados de EEG de superfície pode ser desenvolvido. Isso pode ser alcançado usando métodos existentes de algoritmos de localização de fonte65 que permitem a construção de um modelo 3D de atividade elétrica no cérebro, com base na tomografia eletromagnética exata de baixa resolução (eLORETA) 66 ou no método de impressão digital EEG67. Na segunda etapa do protocolo proposto, os pacientes podem receber um treinamento estendido de neurofeedback com uma abordagem de neurofeedback baseada em EEG. Assim, este protocolo oferece a possibilidade de treinar (treinamento de neurofeedback) pacientes por períodos mais longos em um ambiente amigável e a um custo menor. Dessa forma, isso pode permitir a tradução de descobertas cientificamente rigorosas do treinamento de neurofeedback rtfMRI para um sistema clínico portátil e acessível para o tratamento de distúrbios psiquiátricos e neurológicos. O uso adicional deste método não invasivo para registrar a atividade neuronal e a atividade hemodinâmica no cérebro durante experimentos de neurofeedback levanta novas possibilidades empolgantes para tratamento clínico e reabilitação.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este estudo foi financiado pela Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) através do Fondo Nacional de Desarrollo Científico y Tecnológico, bolsa de pós-doutorado Fondecyt (nº 3100648), Fondecyt Regular (projetos nº 1171313 e nº 1171320) e CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Materiais
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
Referências
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.