Method Article
Генная инженерия сапротрофные discoideum клетки на основе выбора и роста бактерий
В этой статье
Резюме
Сапротрофные discoideum это организм популярная модель для изучения сложных клеточных процессов миграции клеток, эндоцитоза и развития. Полезность организма зависит от возможности генетической манипуляции. Здесь мы представляем методы для transfect сапротрофные discoideum клеток, которые позволяют преодолеть существующие ограничения культивирования клеток в жидких средах.
Аннотация
Сапротрофные discoideum является интригующей организм модель для изучения процессов дифференцировки клеток во время разработки, ячейка сигнализации и другие вопросы, важные клеточная биология. Технологии, имеющиеся для генетически манипулировать сапротрофные клетки развитая. Transfections может производиться с использованием различных выбираемых маркеров и маркер, повторно Велоспорт, включая гомологичная рекомбинация и инсерционному мутагенезу. Это подтверждается хорошо аннотированных генома. Однако эти подходы оптимизированы для стерильных клеточных линий, растущих в жидком культур и трудно применять к не стерильных одичал тип клеток, которые питаются только бактерии. Мутации, которые присутствуют в стерильных штаммов беспокоить РАН сигнализации, вызывая чрезмерное макропиноцитозом, необходимые для кормления и ухудшить миграции клеток, которая смешивает толкование сигнала и хемотаксис экспериментов в этих штаммов. Ранее попытки генетически манипулировать не стерильных клетки хватало эффективности и требуется комплекс экспериментальных процедур. Мы разработали простой трансфекции протокол, который, в первый раз, преодолевает эти ограничения. Эти серии больших улучшений сапротрофные молекулярной генетики позволяют одичал тип клетки, чтобы манипулировать так же легко, как стандартные лабораторные штаммы. Помимо преимущества для изучения неповрежденный сигнализации и подвижность процессов мутантов, которые нарушают роста на основе макропиноцитозом теперь можно легко изолировать. Кроме того весь трансфекции рабочий процесс значительно ускоряется, с рекомбинантным клетки, которые могут быть созданы в дней вместо недель. Еще одним преимуществом является, что молекулярная генетика далее может быть выполнена с свежевыделенных одичал тип сапротрофные проб из окружающей среды. Это может помочь расширить сферу применения подходов, используемых в этих областях исследований.
Введение
Род сапротрофные являются социальные амебы почвы жизни, основном питаются бактериями. Будучи помещены в Фила Amoebozoa, большое количество видов были изолированы, могут быть сгруппированы в четыре разных КЛАДЕС1. Видов сапротрофные discoideum (D. discoideum) стала популярной модели организма для изучения сложных клеточных процессов миграции клеток и фагоцитоз. Для управления и стандартизации экспериментальных условиях, стерильных клеток линии были разработаны, которые способны расти в сложных или определенных жидкой среде при отсутствии бактерий2. Особое значение имеют Ax2, Ax3, и Ax4 штаммов, которые были созданы в 1970-х и в конечном счете, полученных из одной дикой изолировать НС43. Были разработаны инструменты для генной инженерии в эти стерильных штаммов, что приводит к опубликованной финала в 1987 году4,5. Протоколы были далее разработаны и оптимизированы для использования в стерильных условиях6,7.
Адаптация этих протоколов к одичал тип D. discoideum штаммов, которые не способны расти в жидкий бульон предпринимались несколькими лабораториями. Однако это не стало полностью успешных так как трансфекции протоколы являются сложными и отсутствие эффективности, отчасти из-за бактерий способность выступать в качестве резервуара для селективного реагенты8,9. В результате по существу всех молекулярных данных на D. discoideum приходит от потомками одного изолята одичал типа. Мы хотели, чтобы преодолеть это ограничение и разработать метод генетически модифицировать D. discoideum клетки независимо от их способности расти в жидкой среде. Необходимость такого метода может объясняться наблюдения, что предполагалось в прошлом, что мутации, позволяя стерильных роста были главным образом нейтральными и не снижать физиологии клетки. Это предположение верно только частично. В общем есть два заметных различий; Во-первых между различными изолированными стерильных штаммов и во-вторых, когда эти стерильных штаммов по сравнению с не стерильных диких изолятов8,9.
Возможно наиболее важным фактором является ключевым стерильных ген, топорB, которая была недавно названа RasGAP NF1. Основная функция NF1 как RasGAP является удержать РАН деятельности3. Удаление фермента в стерильных всех штаммов приводит к чрезмерной активности ран проявляется как формирование крупных активных РАН патчей. Эти увеличенные патчи РАН приводят к накоплению PIP3 в плазматической мембраны. Эти случайно появляясь патчи, PIP3 и активные РАН, шаблон для формирования круговой рябь, которая в конечном итоге закрывает и приводит к образованию macropinosomes10. Следствием является чрезмерное увеличение активности macropinocytic. Макропиноцитозом — это актин управляемый процесс. Конкурс для цитоскелетных компонентов для формирования macropinosomes или ложноножки является результатом. Ее влияние на поведение клеток отражается в почти полной профилактики хемотаксис вегетативных клеток фолиевой кислоты11. Массово увеличенная патчи PIP3 являются очень стойкими. Даже в голодали клеток патчи PIP3 остаются и может быть неправильно истолковано как ложноножки, которые может вызвать проблемы толкования исследования на хемотаксис в лагерь.
В некоторых случаях NF1 мутации экспериментально полезным. Это приводит нас к второй мотивации для разработки метод трансфекции бактериально выросли D. discoideum клетки, так как увеличение частоты макропиноцитозом делает стерильных клетки ценные для изучения основных аспектов этого процесса12 . Однако мутации в генах, необходимых для макропиноцитозом, например, ран и PI3-киназы10, почти отменили стерильных роста, что делает необходимым для манипулирования эти клетки путем роста бактерий. Еще одна причина, что оказывает на основе бактерий transfections ценные является более широкое использование Dictyostelids для изучения вопросов в эволюции Мульти клеточности13,14, Кин признание15,16, и альтруистическим клеточного поведения, которые главным образом зависят от использования свежевыделенных одичал типа изолирует17. Все упомянутые области исследований может быть облегчено эффективных методов генетической манипуляции диких изолятов, которые являются не стерильных и не растут в жидкий бульон.
Наши протоколы позволяют для преодоления ограничений, описанных. Взятые вместе, возможность выполнения генетических манипуляций с бактериальной, выращенных D. discoideum клетки имеет преимущества для всех сапротрофные исследователей, даже если это просто увеличена скорость процесса отбора из-за быстрее рост амеба (4 h удвоение время) на бактерии, по сравнению с ростом в стерильных СМИ (10 h время удвоения).
протокол
1. Подготовка клеток и материалов
-
Подготовка SorMC буфера
- Подготовка 100 мл 100 x SorMC (Соренсен буфера, включая MgCl2 и CaCl2) буфера путем растворения 20,36 g 5.47 g Na2HPO4·7 H2O (2 мм) в 100 мл воды O2ddH и KH2PO4 (15 мм). Перемешать раствор при комнатной температуре (RT) и доводят объем до 100 мл с dH2O.
Примечание: Результирующий буфер имеет рН 6 и нуждается в корректировке. - Производить 1000 мл 1 x рабочего раствора в ddH2O. Добавьте 50 мкл каждого MgCl2 и2 CaCl для достижения окончательного концентрации 50 мкм. Фильтр стерилизовать решения с помощью фильтра 0.22 мкм.
Примечание: 1 x буфер, чтобы избежать осадков солей в 100 x Стоковый раствор всегда добавьте MgCl2 и CaCl2 . - Кроме того готовить КК2 буфера (2,2 g KH2PO4 и 0,7 g K2HPO4 на 1 Л буфера) дополнены 50 мкм MgCl2 и 50 мкм CaCl2 (далее именуемая КК2MC). Используйте этот буфер всей вместо SorMC.
- Подготовка 100 мл 100 x SorMC (Соренсен буфера, включая MgCl2 и CaCl2) буфера путем растворения 20,36 g 5.47 g Na2HPO4·7 H2O (2 мм) в 100 мл воды O2ddH и KH2PO4 (15 мм). Перемешать раствор при комнатной температуре (RT) и доводят объем до 100 мл с dH2O.
-
Подготовка бактерий в качестве источника пищи для D. discoideum
- Использовать единую колонию K. исследовании и прививать 1 Л LB-средний (lysogeny бульон). Используйте 2 L колбу. Пусть бактерии растут на ночь при 37 ° C при встряхивании в 220 об/мин.
Примечание: Если требуются большое количество бактерий, использовать богатые средства массовой информации как 2xTY (экстракт дрожжей Триптон средний) или SOB (супер оптимального бульон) вместо фунтов. В случае, если из-за ограничений безопасности не разрешается использовать K. исследовании бактерий, E. coli BL21 может использоваться вместо него. - Следующий день урожая клетки, вращая их вниз в двух 500 мл пробирок на ~ 6600 x g для бактерий мыть 20 мин с 500 мл SorMC буфера.
- Ресуспензируйте гранулы в 20 мл SorMC. Проверка ОД600 (оптическая плотность 600 Нм) с использованием фотометра. Разбавляют этот же буфер ОД600 около 100.
Примечание: K. исследовании бактерии являются трудно Пелле, поэтому необходимо, чтобы избежать потери продовольствия бактерий относительно высокой скорости для прядения вниз бактерий. Результате бактериальной Стоковый раствор может храниться до 4 месяцев в холодильнике при температуре 4 ° C и поддерживать ее полезности как источник пищи для D. discoideum. 1 Л на ночь K. исследовании подвеска, выращенных в среде LB обычно дает 20 мл ОД600 около 100.
ОСТОРОЖНОСТЬЮ: Чтобы убедиться, что подготовленный бактерии являются монокультуры K. исследовании, выполните все шаги под капотом.
- Использовать единую колонию K. исследовании и прививать 1 Л LB-средний (lysogeny бульон). Используйте 2 L колбу. Пусть бактерии растут на ночь при 37 ° C при встряхивании в 220 об/мин.
-
Подготовка H40 электропорации буфера
- Подготовка 100 мл буферного раствора, распустить 0.952 g HEPES в воде2O ddH и 100 мкл MgCl2 от 1 М раствор. Отрегулируйте к пэ-ашу 7 с помощью Кох для титрования. Стерилизуйте буфер с помощью фильтра 0.22 мкм или автоклаве. Использование свободной кислоты HEPES и не натриевой соли.
- Выполните подготовку плазмида после производителя протокол и использования комплектов, обобщены в Таблице материалов. Используйте плазмид, приведены в таблице 1.
Примечание: Качество для transfection ДНК имеет решающее значение. Выбор transfectants D. discoideum , растущих на бактерии имеет специальные требования к промоутеров, вождение выбор и выражение кассеты (см. обсуждение).
| имя плазмиды | сопротивление/выбор в бактериях | сопротивление/выбор в сапротрофные | Тег |
| нехромосомной выражение плазмиды | |||
| pDM1203 | Ампициллина | G418 | Нет |
| pDM1207 | Ампициллина | G418 | N-терминальный GFP |
| pDM1208 | Ампициллина | G418 | N-концевой mCherry |
| pPI159 | Ампициллина | G418 | N-концевой mNeon |
| pPI437 | Ампициллина | G418 | N-концевой mScarlet |
| pPI54 | Ампициллина | G418 | N-концевой mTurquoise2 |
| pDM1209 | Ампициллина | G418 | C-терминала GFP |
| pDM1210 | Ампициллина | G418 | C-терминал mCherry |
| pPI143 | Ампициллина | G418 | C-терминал mNeon |
| pPI459 | Ампициллина | G418 | C-терминал mScarlet |
| pPI142 | Ампициллина | G418 | C-терминал mTurquoise2 |
| Трансфер плазмиды | |||
| pDM344 | Ампициллина | Нет | Нет |
| pDM1019 | Ампициллина | Нет | N-терминальный GFP |
| pDM1018 | Ампициллина | Нет | N-концевой mCherry |
| pPI152 | Ампициллина | Нет | N-концевой mNeon |
| pPI418 | Ампициллина | Нет | N-концевой mScarlet |
| pPI150 | Ампициллина | Нет | N-концевой mTurquoise2 |
| pDM1021 | Ампициллина | Нет | C-терминала GFP |
| pDM1020 | Ампициллина | Нет | C-терминал mCherry |
| pPI153 | Ампициллина | Нет | C-терминал mNeon |
| pPI457 | Ампициллина | Нет | C-терминал mScarlet |
| pPI151 | Ампициллина | Нет | C-терминал mTurquoise2 |
| индуцибельной нехромосомной выражение плазмиды | |||
| pDM1038 | Ампициллина | Hygromycin | Нет |
| pDM1047 | Ампициллина | Hygromycin | N-терминальный GFP |
| pDM1046 | Ампициллина | Hygromycin | N-концевой mCherry |
| pPI450 | Ампициллина | Hygromycin | N-концевой mNeon |
| pPI452 | Ампициллина | Hygromycin | N-концевой mScarlet |
| pPI449 | Ампициллина | Hygromycin | N-концевой mTurquoise2 |
| pDM1049 | Ампициллина | Hygromycin | C-терминала GFP |
| pDM1048 | Ампициллина | Hygromycin | C-терминал mCherry |
| pPI470 | Ампициллина | Hygromycin | C-терминал mNeon |
| pPI460 | Ампициллина | Hygromycin | C-терминал mScarlet |
| pPI469 | Ампициллина | Hygromycin | C-терминал mTurquoise2 |
| убежище act5 ориентации плазмиды | |||
| pDM1501 | Ампициллина | Hygromycin | Нет |
| pDM1513 | Ампициллина | Hygromycin | N-терминальный GFP |
| pDM1514 | Ампициллина | Hygromycin | N-концевой mCherry |
| pPI231 | Ампициллина | Hygromycin | N-концевой mNeon |
| pPI419 | Ампициллина | Hygromycin | N-концевой mScarlet |
| pPI228 | Ампициллина | Hygromycin | N-концевой mTurquoise2 |
| pDM1515 | Ампициллина | Hygromycin | C-терминала GFP |
| pDM1516 | Ампициллина | Hygromycin | C-терминал mCherry |
| pPI230 | Ампициллина | Hygromycin | C-терминал mNeon |
| pPI458 | Ампициллина | Hygromycin | C-терминал mScarlet |
| pPI229 | Ампициллина | Hygromycin | C-терминал mTurquoise2 |
| REMI выражение плазмиды | |||
| pDM1220 | Ампициллина | Hygromycin | Нет |
| pDM1351 | Ампициллина | Hygromycin | N-терминальный GFP |
| pDM1259 | Ампициллина | Hygromycin | N-концевой mCherry |
| pPI465 | Ампициллина | Hygromycin | N-концевой mNeon |
| pPI468 | Ампициллина | Hygromycin | N-концевой mScarlet |
| pPI466 | Ампициллина | Hygromycin | N-концевой mTurquoise2 |
| pDM1352 | Ампициллина | Hygromycin | C-терминала GFP |
| pDM1305 | Ампициллина | Hygromycin | C-терминал mCherry |
| pPI471 | Ампициллина | Hygromycin | C-терминал mNeon |
| pPI467 | Ампициллина | Hygromycin | C-терминал mScarlet |
| pPI472 | Ампициллина | Hygromycin | C-терминал mTurquoise2 |
| в кадр плазмиды | |||
| pDM1355 | Ампициллина | Hygromycin | C-терминала GFP |
| pPI461 | Ампициллина | Hygromycin | C-терминал mCherry |
| pPI462 | Ампициллина | Hygromycin | C-терминал mNeon |
| pPI464 | Ампициллина | Hygromycin | C-терминал mScarlet |
| pPI463 | Ампициллина | Hygromycin | C-терминал mTurquoise2 |
| нокаут-плазмиды | |||
| pDM1079 | Ампициллина | Blasticidin | Нет |
| pDM1080 | Ампициллина | Nourseothricin | Нет |
| pDM1081 | Ампициллина | Hygromycin | Нет |
| pDM1082 | Ампициллина | G418 | Нет |
| CRE выражение плазмиды | |||
| pDM1483 | Ампициллина | Nourseothricin | Нет |
| pDM1489 | Ампициллина | Hygromycin | Нет |
| pDM1488 | Ампициллина | G418 | Нет |
Таблица 1: Список плазмиду для не стерильных transfections.
-
Настройка сапротрофные клетки для transfection
- Расти K. исследовании до впадения в среде SM (питательные среды) Ночевка на RT. культур может храниться до 2 недель при 4 ° C.
- Около 400 мкл этой бактериальных подвеска на пластину агар SM (Пептон 10 г/Л; дрожжевой экстракт 1 г/Л; глюкозы 10 г/Л; KH2PO4 1,9 г/Л; K2HPO4 x 3 H2O, 1,3 г/Л; MgSO4 безводный 0,49 г/Л; 1,7% агар) и равномерно. Возьмите стерильные цикла и прививать с сапротрофные клеток. Распространения клеток на одном из краев плиты.
- Инкубируйте пластину в 22 ° C в течение 2 дней, чтобы обеспечить достаточно большой рост зон для transfection.
Примечание: Сапротрофные штаммов, которые не делают большой рост зоны (например, Ax3, DH1 или JH10), или для неопытных экспериментаторов, используйте вместо очистки пластин. Для этого следуйте инструкциям шагов 1.5.4 для 1.5.6. - Возьмите стерильные петлю и прививать с сапротрофные клетки (примерно 2-4 x 105 клеток). Клетки перехода к 800 мкл плотной K. исследовании подвеска в клетках сантиметр Mix, закупорить вверх и вниз.
- Перенести на свежий плиты агара SM 400 мкл, 200 мкл, 100 мкл и 50 мкл. Добавить к каждой пластины 400 мкл дополнительных SM K. исследовании подвеска, равномерно и сухой.
- Инкубируйте пластины при 22 ° C около 2 дней, до тех пор, пока пластины стали полупрозрачными.
Примечание: Из-за их более быстрыми темпами роста изначально бактерии производить вырожденная газон, и амёбы впоследствии «очистить» пластину бактерий. Время, необходимое для этого процесса может отличаться в зависимости от штамма фон и способность мутантные клетки растут на бактерии.
2. transfection клеток сапротрофные основе бактериальной выбора

Рисунок 1 : Рабочий процесс для transfection клетки бактерии выращенные сапротрофные . Ниже перечислены шаги для transfection. Рост клеток D. discoideum на табличке SM семенами с K. исследовании бактерий (красный). Урожай клетки только от кормления фронта (зеленый), избегая клетки, которые уже разрабатывают (тёмно-зеленый). Вымойте клетки в H40. Ресуспензируйте клетки к окончательной плотности 2-4 x 10-7 кл/мл. Перемешать суспензию клеток с 1-2 мкг ДНК. Передача смеси электропорации кювет и пульс клеток. Передать клетки непосредственно после электропорации блюдо с SorMC и бактерий. Разрешить клетки для восстановления для 5 h перед добавлением выбора маркера. Для нехромосомной плазмид добавьте выбор непосредственно на блюдо. Transfectants обычно видны после ~ 2 дня. Для линеаризованного конструкций, которые направлены для одного интеграции в геноме настроить три разведениях как указано и добавить выделение. Бактерии, взяты из ОД600 = 100 Стоковый раствор. Хорошо перемешайте труб и передача клетки культуры ткани 96-луночных плоскодонные плиты. Используйте две пластины на разведение. Пипетка 150 мкл суспензии клеток в каждый хорошо. Она занимает около 5 дней пока туго колоний видны. Красный скважин показывают пример обычной количество успешно преобразованных клеток, полученных (Верхняя панель изменения от предыдущей публикации22). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Подготовить пластины с K. исследовании подвеска, добавить 10 мл SorMC буфера, содержащий бактерии K. исследовании плотность OD600 = 2 (200 мкл подготовленный ОД600 = 100 K. исследовании Стоковый раствор для желаемого Концентрация бактерий) в 10 см ткани Культура лечение Петри.
Примечание: Эта пластинка позже необходимо культивировать transfected клеток D. discoideum . Кроме того может использоваться плита 6-ну культуры ткани. В случае трансфекции нехромосомной плазмид пластину 6-ну культуры ткани является более эффективное использование ресурсов. Используйте 2 мл исследовании K. SorMC (ОД600 = 2) подвеска за хорошо. -
Подготовка сапротрофные клеток
- С помощью цикла одноразовые прививка 10 мкл, скрести клетки от зон роста (около 3 см) культуры плиты (край очищенной области) или очистка пластины. Перевести клетки в 1,5 мл, содержащие 1 мл ледяной H40 буфера.
Примечание: Время уборки клеток от очистки пластин имеет решающее значение. Заготовка слишком рано дает слишком мало количество клеток, во время сбора урожая в конце увеличивает риск приносит частично разработаны клетки. - Вымыть клетки, спиннинг вниз на 2 мин 1000 x g или флэш спиннинг для 2 s на 10000 x g. Отменить супернатант и Ресуспензируйте клетки в буфере H40 к окончательной плотности 2-4 x 10-7 кл/мл. Держите холодной клетки во время всей трансфекции процедуры. Используйте ледяной воды шлама для обеспечения прямого контакта трубок и льда.
- С помощью цикла одноразовые прививка 10 мкл, скрести клетки от зон роста (около 3 см) культуры плиты (край очищенной области) или очистка пластины. Перевести клетки в 1,5 мл, содержащие 1 мл ледяной H40 буфера.
-
Электропорация
- Добавьте 100 мкл клеток трубка с 1-2 мкг ДНК. Тщательно перемешать, закупорить вверх и вниз.
- Передача смеси клеток/ДНК в кювет предварительно охлажденные электропорации (зазор 2 мм).
- Пульс клетки, используя следующие параметры площади волны: 350 V, 8 мс, 2 импульсов и 1 интервал пульса s.
Примечание: Не добавляйте более чем 2 мкг ДНК. Более высокие суммы токсичны для клеток и снизить эффективность трансфекции. Общая добавил, что ДНК объем не должен превышать 5 мкл. - Немедленно передать клетки ранее подготовленные 10 см Петри с K. исследовании SorMC и позволяют клеткам восстанавливаться за 5 ч.
Примечание: Проверьте ячейки в чашке Петри под инвертированным микроскопом. Клетки непосредственно после электропорации появятся раунд, но вернется в их Саркодовые форму после около 30 мин, когда они имели достаточно времени, чтобы правильно приложить к поверхности.
-
Выбор transfectants: в зависимости от ли трансфекции направлена для создания нокаут, забивные или стук в act5 , или выразить флуоресцентные репортер белка от нехромосомной плазмида, осуществлять процесс отбора через один из Ниже описаны методы.
Примечание: В отличие от axenically выращенные клетки бактериально выращенные клетки обладают высокой устойчивостью к blasticidin. Отбор, поэтому всегда осуществляется с помощью G418 или hygromycin (см. обсуждение).- Стук аутов, стук ins и act5 стучите ins
- Отсоедините клетки тщательно Петри, неоднократно заставляя жидкости из пипетки на поверхность.
- Настройка трех разведений в SorMC исследовании K. подвеска (OD600 = 2) и добавить селективный агента в соответствии используемых сопротивления (см. рис. 1).
- Низкая Разбавление: смешать 9 мл суспензии клеток с 20,4 мл SorMC и 600 мкл K. исследовании Стоковый раствор.
- Средний Разбавление: смешать 900 мкл суспензии клеток с 28,5 мл SorMC и 600 мкл K. исследовании Стоковый раствор.
- Высокой разведение: смесь 90 мкл суспензии клеток с 29.3 мл SorMC и 600 мкл K. исследовании Стоковый раствор.
- 30 мкл выбора маркера (100 x Стоковый раствор).
- Распространить подготовленный разведений в 96-луночных плоскодонные тканевой культуры пластин, дозирования 150 мкл суспензии клеток в каждой скважине.
Примечание: Эта процедура направлена на экране одного клоны, вместо того, чтобы население. Выбор занимает около 5-7 дней, в зависимости от конструкции используется.
- Нехромосомной плазмиды
- Добавить маркер выбирается непосредственно в 10 мл блюдо (см. Рисунок 1).
Примечание: Существует не нужно настроить разведения, так как нет желания для клоновых населения. Процесс отбора нехромосомной плазмид быстрее из-за высокой копия чисел в D. discoideum клеток. Transfectants можно ожидать после 32 h до 2 дней.
Предупреждение: Антибиотиков, используемых как выбирается маркер являются токсичными. Надевайте перчатки.
- Добавить маркер выбирается непосредственно в 10 мл блюдо (см. Рисунок 1).
- Стук аутов, стук ins и act5 стучите ins
-
Экран полученные клонов для положительных tranfectants. Нокаут- или стучите в попытки следуйте инструкциям в шаге 2.5.1. Проверьте трансфекции успех для нехромосомной плазмид, используя инструкции на шаге 2.5.2.
- Для детонации аутов стук ins и act5 стук ins, выполнить начальный экран через PCR для подтверждения интеграции конструкции в правильный геномной Локус.
Примечание: Чтобы максимизировать вероятность клоновых населения, использование высоких возможных разрежения, что дает transfectants после выбора. Цель для пластин, которые максимум треть скважин занимал.- Для расширения клоновых населения, передачи клоны, которые выросли после выбора от 96-луночных культуры ткани пластины в культуре ткани 12-ну плиту расти достаточно клетки для изоляции геномной ДНК. Поставка каждой скважины с 1 мл раствора SorMC K. исследовании (OD600 = 2) и свежие выбирается маркер.
Примечание: 1 день обычно достаточно для получения притока хорошо подходит для изоляции ДНК. - Для выполнения мини-геномной ДНК изоляции, урожай клетки вырожденная хорошо и изолировать genomic дна с помощью мини-комплект для экстракции ДНК следуя инструкциям производителя.
- Использование изолированных геномной ДНК вместе с подходящей грунтовки и Taq-полимеразы (см. Таблицу материалы) ПЦР экран для положительных integrands.
Примечание: После подтверждения позитивной интеграции в правильный геномной Локус Южная помарка анализа должны быть выполнены. Это обеспечивает большую уверенность, что не произошли события дополнительные вставки в неспецифической геномной регионах.
- Для расширения клоновых населения, передачи клоны, которые выросли после выбора от 96-луночных культуры ткани пластины в культуре ткани 12-ну плиту расти достаточно клетки для изоляции геномной ДНК. Поставка каждой скважины с 1 мл раствора SorMC K. исследовании (OD600 = 2) и свежие выбирается маркер.
- Для флуоресцентных репортер белков визуально выявить позитивные люминесцентные клеток и проверьте с флуоресцентным микроскопом. Кроме того выполните западную помарку с подходящим антитела для биохимической идентификации.
- Для детонации аутов стук ins и act5 стук ins, выполнить начальный экран через PCR для подтверждения интеграции конструкции в правильный геномной Локус.
| Программа PCR | ||
| шаг | Температура | время |
| Первоначальный денатурации | 94 ° C | 30 s |
| 30 циклов | 94 ° C | 15-30 s |
| 42 ° C | 15-60 s | |
| 68 ° C | 1 мин/КБ | |
| Окончательное расширение | 68 ° C | 5 мин |
| Удерживайте | 4-10 ° C | |
| Реакция состав | ||
| компонент | Реакция 25 мкл | конечная концентрация |
| 10 мкм вперед грунт | 0.5 МКЛ | 0.2 МКМ |
| Обратный Primer 10 мкм | 0.5 МКЛ | 0.2 МКМ |
| Шаблон ДНК | переменная (ОК. 5 мкл) | < 1000 нг |
| 2 x Мастер микс с стандартного буфера, включая полимеразы (см. таблицу материалов) | 12.5 МКЛ | 1 x |
| Нуклеаза свободной воды | до 25 мкл | < 1000 нг |
Таблица 2: пример программы и состав ПЦР для амплификации D. discoideum геномной ДНК.
Результаты
Нехромосомной плазмид используются для репортера исследования, с целью выявления локализации некоторых белков внутри ячейки или изменения в клеточную структуру клеток-мутантов. Для многих подходов, таких как мониторинг клеточного цикла важно выразить двух журналистов в то же время. Теперь это возможно с помощью нашей системы двойной репортер нехромосомной плазмида (Таблица 1). День 1 клетки были transfected перед добавлением выбирается маркер G418 после 5 h (рис. 1). В примере, НС4, DdB, Ax2 и самостоятельно производных диких изолятов V12M2 и WS2162 (Дополнительные таблицы 1) были transfected с плазмида pPI289, который кодирует для GFP-тубулина, маркер для микротрубочки и mCherry-PCNA, белок, который является используется для мониторинга клеточного цикла(Рисунок 2). После 32 h были замечены клетки под микроскопом. Большинство клеток выражена как люминесцентные меченых фьюжн белков, согласуется с предыдущей сообщает это выражение двух журналистов из же плазмида показывает аналогичные уровни выражения, что практически невозможно при использовании двух разных плазмид 18,19. Представитель ячейки для каждой ячейки строки (НС4, DdB, Ax2, V12M2 и WS2162) выражая желаемого двойной репортер показано в рисунке 2B. Эффективность трансфекции приводится на рисунке2 C. НС4 производные клеточных линий показывают лучшее эффективность трансфекции. Однако для клеточных линий, V12M2 и WS2162, был получен значительно большое количество transfectants.

Рисунок 2 : Выражение нехромосомной плазмида. (A) нехромосомной плазмид непосредственно transfected в круглую форму. В качестве примера показан двойной репортер pPI289. MIV сайты НПОуказывают вставки второй репортер в плазмиду нехромосомной выражение. (B) Z-проекция представитель ячейки, выражая GFP-тубулина (цитоплазмы) и mCherry-PCNA (главным образом ядерных) для пяти различных одичал тип клеточных линий используется (НС4, DdB, Ax2, V12M2, WS2162). (C) трансфекции эффективности для пяти клеточных линий, изображенный в пункте (B) были рассчитаны. Показано это среднее двух экспериментов. Планки погрешностей указывают ± SD. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Интеграция ориентации вектора в указанной геномной Локус является более сложной и требует более тщательного анализа созданного клеточной линии. На рисунке 3 act5- mCherry ки в НС4 предпринимается попытка. Во-первых плазмида должны линеаризации для увеличения частоты рекомбинации событий после transfection. Для этого плазмида pDM1514 режется с НПОВИО. Две полосы получаются после запуска дайджест на геле агарозы. 4127 bp полоса содержит нужную конструкцию (рис. 3). Для transfection усваивается ДНК должны быть извлечены из геля и очищается с помощью комплекта извлечения геля следуя инструкциям производителя.

Рисунок 3 : Подготовка стук в act5 и ДНК для transfection. Приведен пример использования действуют5 стук в pDM1514 плазмиды. Ниже перечислены шаги для подготовки. (A) перед электропорация, линеаризации плазмида, используя указанные сайты MIV НПО. (B, C) Запустите плазмиды отрезока на геле агарозы, до тех пор, пока надлежащим образом отделены две полосы ожидаемой. Вырезать из группы ВР 4127, содержащий оружия рекомбинацию, mCherry и сопротивление кассета, и гель извлечь ДНК. ДНК теперь готов к трансфекции. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Очищенная ДНК был использован для transfection НС4 клеток. После 5-6 дней отбора были получены клоны. Представитель трансфекции эффективность и количество положительных выявленных клонов для нескольких попыток стук в act5 резюмируются в таблице 3. Два клонов НС4 трансфекции были случайным образом выбраны и анализ методом ПЦР (рис. 4A), и оба показали предсказал группы моделей ожидается от стука в и далее были проверены с юга блот анализ для обеспечения единого интеграции в случае конструкции в геном20. Пятно показывает ясно одно интеграции в нужное act5 локус (Рисунок 4B). Сгенерированный клеточная линия NC4::act5-mCherry теперь может использоваться в экспериментах.

Рисунок 4 : Проверка act5- mCherry KIs в НС4. (A) схема и управления PCRs для проверки положительных внедрений в локусе act5 . Указанные грунтовки были использованы для анализа двух независимых клоны и родителя. Оба клоны Показать ожидаемый полос для сопротивления кассеты и вниз по течению (P1) или вышестоящего праймер (P2), которые не присутствуют в родительский сорт. Грунтовка комбинации (P1/P2) подтверждает правильную интеграции mCherry и сопротивление кассету в локусе act5 . Одичал тип НС4 показывает ожидаемое группа bp 2800, в то время как оба клоны ки не хватает этой группы и вместо отображения продукт PCR около 1400 низкопробных пар больше. (B) схема используется ограничение дайджест и Южная помарка. Оба клоны стук в показывают меньшие группы ВР 3400, который является результатом интеграции конструкции в локусе действовать5, специально дополнительные Bclя на сайте в кассету сопротивления hygromycin. Одичал тип управления показывает ожидаемое 5.8 КБ, вытекающие из двух течению расположен Bclя сайтов. Блот был обрезан и сращивания для ясности. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| целевые конструкции в локусе act5 | имя плазмиды | количество оккупированных скважин | количество проверенных клонов | Позитивные клоны | Правильное клоны (%) | Штамм сапротрофные используется | эффективность трансфекции (transfectants / 2 x 10 ^ 6/1 мкг ДНК) |
| LifeAct-mCherry | pPI226 | 7 | 7 | 1 | 14.2 | AX2 | 3.5 x 10 ^ -6 |
| LifeAct-GFP | pPI227 | 12 | 12 | 5 | 41,6 | AX2 | 6 x 10 ^ -6 |
| ЗЕЛЁНЫЙ ФЛУОРЕСЦЕНТНЫЙ БЕЛОК | pDM1513 | 3 | 3 | 2 | 66,6 | AX2 | 1,5 х 10 ^ -6 |
| mCherry | pDM1514 | 3 | 3 | 1 | 33.3 | AX2 | 1,5 х 10 ^ -6 |
| ЗЕЛЁНЫЙ ФЛУОРЕСЦЕНТНЫЙ БЕЛОК | pDM1513 | 66 | 9 | 5 | 55,5 | AX2 | 3.3 x 10 ^ -5 |
| mCherry | pDM1514 | 221 | 12 | 10 | 83.3 | AX2 | 1.1 x 10 ^ -4 |
| H2B-mCherry | pPI420 | 3 | 3 | 1 | 33.3 | AX2 | 1,5 х 10 ^ -6 |
| H2B-mCherry | pPI420 | 7 | 7 | 6 | 85,7 | AX2 | 3.5 x 10 ^ -6 |
| mCherry | pDM1514 | 10 | 10 | 7 | 70 | DdB | 5 x 10 ^ -6 |
| mCherry | pDM1514 | 240 | 12 | 11 | 91,6 | DdB | 1,2 х 10 ^ -4 |
| mCherry | pDM1514 | 320 | 12 | 12 | 100 | НС4 | 1.6 x 10 ^ -4 |
Таблица 3: эффективность трансфекции и количество полученных положительных transfectants для поколения act5 KIs в различных штамма стола 22 .
Локус действовать5 предлагает относительно однородных выражение комплексной репортер21. Созданные NC4::act5-mCherry клетки позволяют смесь экспериментов с другими act5 стучите модулей с помощью различных флуоресцентных белков, таких как GFP. Чтобы подчеркнуть большое преимущество этой системы, отображаются смешивания эксперименты с Ax2::act5-GFP . Из-за неспособности transfect не стерильных одичал тип клеток такой подход не может быть выполнена раньше. Mix эксперименты являются важным инструментом для анализа поведения ячеек, потому что они позволяют прямое сравнение между различных клеточных линий, идентичные экспериментальных условиях. НС4 клетки растут быстрее на бактериальных газоны чем Ax2 клеток (рис. 5A). Это может быть из-за более высокой способностью фагоцитоз бактерий или улучшенная возможность перемещать и показать хемотаксис к источнику питания. Используя assay хемотаксис заместитель агар фолиевой кислоты, была выполнена прямое сравнение населения NC4::act5-mCherry и Ax2::act5-GFP , показывая, что гораздо более эффективным в зондирования фолиевая кислота NC4::act5-mCherry . После 4 ч более NC4::act5-mCherry клетки смогли лезть под агарозы чем Ax2::act5-GFP клетки (рис. 5B). Анализ стандартные метрики хемотаксис для клетки мигрируют в агарозном показали, что NC4::act5-mCherry клетки были быстрее и сильнее эозинофилов ответа, чем Ax2::act5-GFP клеток (рис. 5C-E ).
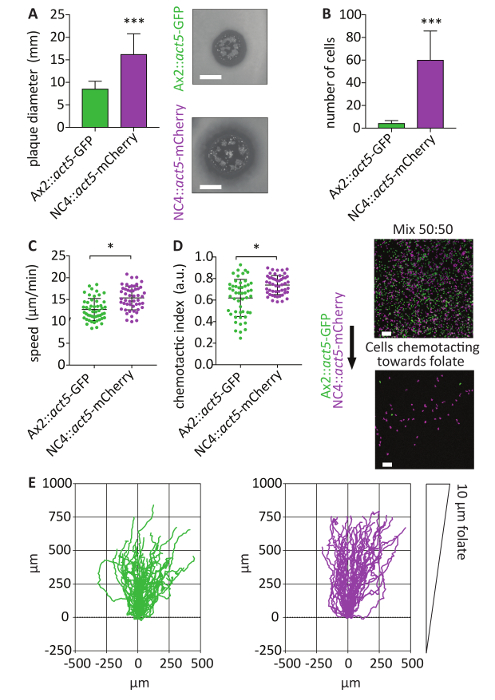
Рисунок 5 : Использование действовать5 KIs для экспериментов смесь на основе образа хемотаксис. (A) NC4::act5-mCherry и Ax2::act5-GFP выражая указанных флуоресцентный белок от locus действовать5 были проанализированы на предмет способности расти на бактериальных газон. После 4 дней диаметр зубного налета, возникли от одиночного покрытием сапротрофные клетки были измерены. Non стерильных act5:: НС4 клетки производят значительно больше бляшек чем стерильных Ax2::act5-GFP клетки (означает ± SD, *** p < 0,0001, n = 3, масштаб бар 5 мм). (B) для использования под агарозы фолиевой кислоты хемотаксис пробирного22 непосредственно сравнить эозинофилов способности NC4::act5-mCherry и Ax2::act5-ГФП в (A), выращенных амёбы обоих штаммов бактерий-были смешанные в соотношении. Клетки были позволены ползать под агарозы. После 4 ч клетки, которые мигрируют на подъеме фолиевой кислоты были образы с помощью конфокального микроскопа. Количество NC4::act5-mCherry и Ax2::act5-GFP клетки затем было определено. NC4::act5-mCherry клетки были более эффективны в зондирования фолиевой кислоты. О 10 раз больше NC4::act5-mCherry клетки были найдены, по сравнению с Ax2::act5-GFP клетки (означает ± SD, *** p < 0,0001, n = 6, шкалы бар 100 мкм). (C, D) Клетки были сняты для 60 мин, и их скорость и эозинофилов индекс были рассчитаны. После предварительного отбора наиболее chemotactically реагировать клеток (только те, которые мигрировали под агарозы) Ax2::act5-GFP клеток показало более низкие значения для ячейки скорость и хемотаксис. Были проанализированы 50 ячеек на линии клеток. (средний ± SD, * p < 0.01, n = 3). (E) треки NC4::act5-mCherry и Ax2::act5-GFPact5 стук модули выводятся более 60 мин, показаны более направленного движения к источнику chemoattractent NC4::act5-mCherry клеток (средний ± SD, ** * p < 0,0001, n = 6). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Стук в клеточных линий act5 может также использоваться для проточной цитометрии. Как с ростом на бактерии, существуют основные различия между стерильных штаммов и не стерильных дикий типы в области развития. После разработки, плодовые тела клетки НС4 приблизительно дважды как большой, как те производный от Ax2 клеток. Если клетки являются смешанными, получается промежуточного размера плодовые тела. Чтобы проанализировать вклад обеих линий клетки более количественно, был использован проточной цитометрии. Эти анализы показали, что средние плодовые тела из-за различных уровней взносов от обеих линий клетки. В то время как NC4::act5-mCherry клетки составляют около 75% измеренной споры, Ax2::act5-GFP внесли только 25%, выявление потенциальных преимуществ фитнес для не стерильных штаммов (рис. 6). Поскольку анализ не контролировать населенности клетки стебля, есть две возможности объяснить дисбаланса в развитии между Ax2 и НС4. Одним из возможных вариантов является, что Ax2 клетки являются главным образом способствовать популяции клеток стебель, вместо ввода споро популяции клеток. Кроме того более НС4 клетки могут войти развития цикла, с Ax2 относительно задержки, и следовательно они неспособны внести свой вклад в Ассамблее плодовые тела. Возможность transfect не стерильных одичал тип клеток далее развивает другие подходы и значительно упрощает экспериментальной процедуры.

Рисунок 6: закон5 KIs позволяют проводить анализ смеси экспериментов с использованием проточной цитометрии. (A) NC4::act5-mCherry и Ax2::act5-ГФП были разработаны отдельно или в смеси 50: 50 на не питательный агар пластины. NC4::act5-mCherry клетки образуют большие плодовые тела чем Ax2::act5-GFP. Смеси вместо показывает средний размер (масштаб бар 5 мм). Конфокальный флуоресценции световой микроскопии предполагает большее количество NC4::act5-mCherry споры в головах споро, производный от смеси. (B) для количественной оценки этой наблюдения, количество спор в заготовленной spore, которую руководители от смешивания эксперимента в (A) были проанализированы проточной цитометрии. Около 75% споры возникли от NC4::act5-mCherry клеток, с только 25% из клеток Ax2::act5-GFP . (C) представитель распределение споры от обеих линий клетки, показано в разброс цитометрии потока. Около 0,05% Показать позитивные сигналы mCherry и GFP, предполагая, что parasexual фьюжн процессы происходили или прилипания споры друг с другом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Клеточная линия | Генетически фон | Номер ссылки | Опубликованы до | Тип |
| Ax2 (ка) | DBS0235521 | Блумфилд et al., 2008 | дикого типа | |
| НС4 (S) | Блумфилд et al., 2008 | дикого типа | ||
| act5::mCherry клон 5 | НС4 | HM1912 | Пашке et al., 2018 | стук в act5 |
| act5::GFP клон 2 | AX2 | HM1930 | Пашке et al., 2018 | стук в act5 |
| V12M2 | Блумфилд et al., 2008 | дикого типа | ||
| WS2162 | Блумфилд et al., 2008 | дикого типа |
Дополнительная таблица 1: различных штаммов Сапротрофные учился.
Обсуждение
Использование не стерильных, одичал типа сапротрофные клеток была весьма ограниченной, пока в молекулярных исследований. Доступные методы генной инженерии этих штаммов лишены надежности и эффективности23, предотвращая их всеобщего принятия. Сгенерированный материалы и протоколы, представленные здесь может использоваться для любого штамма D. discoideum , независимо от ее способности расти в жидкой среде. Следует отметить, что этот протокол оптимизирован для НС4 производные клеточных линий. Эффективность трансфекции свежевыделенных штаммов от диких отличаются от НС4, как мы наблюдали до и показаны здесь для V12M2 и WS21628,9. Электропорация условий в частности кажется, имеют значительное влияние на эффективность трансфекции и может потребовать дальнейшей оптимизации для некоторых штаммов. В общем всех штаммов протестированы до настоящего времени, показать, что эти методы являются реальные наблюдается достаточное количество transfectants. Количество положительных transfectants, полученных с помощью НС4 производные штаммов, выше, чем для других не стерильных штаммов дикого типа, но во всех случаях, достаточное количество transfectants получаются для дальнейших экспериментов. Это, а также простота нашего протокола, является значительное улучшение по сравнению с ранее попытки8,9.
Эти новые номера стерильных протоколы охватывают все стандартные процедуры генетических и добавить дополнительные преимущества, поскольку transfections могут быть выполнены быстро и эффективно параллельно. Позитивные клонов можно получить в дней вместо недель, после роста на половинки бактерий время Отдел. Недавно созданной плазмиды также работают в стерильных условиях и может постоянно использоваться при обоих условиях роста, который является другой продвижение этой methology22. Как введена в протоколе, плазмиды, используемые для отбора на бактерии имеют специальные требования, которые имеют решающее значение для успеха transfection. В частности промоутеров, вождение выражение и сопротивления кассеты имеют важное значение для успешного transfection. Промоутер часто используют act6 (актина 6)24 для движения сопротивления или выражение кассеты не хватает эффективности, когда клетки выращивают на бактерии. В нашей системе плазмида промоутер высокоактивный act15 (актина 15) диски все выражение кассеты, в то время как сопротивление кассеты находятся под контролем промотора coA (coactosin A), оба из которых являются активными в стерильных условиях и в клетки, выращенных на бактерии. Требования для выражения репортер конструкции а также забивные и нокаут-конструкции делают необходимым использовать наш репертуар плазмида, но к сожалению ограничивает использование векторов, уже создан, использующие неэффективной act6 промоутер.
Промоутер эффективность особенно важны для transfections, которые зависят события одного интеграции в правильный геномной Локус. Благодаря нашей промоутеров, вождение экспрессии генов сопротивления достаточно сопротивление белка производится из одного локуса интеграций. Серьезную озабоченность вызывает, в пользу нескольких внедрений в геном, при использовании hygromycin или G418, как описано. Не в пользу нескольких внедрений наблюдается так далеко, как сообщалось ранее, по G418 критериям с использованием старых систем промоутер25. Это означает, что оба hygromycin и G418 подходящий выбор маркеров для поколения чистый стук аутов и стук соц.страх к сожалению, выбирается маркер blasticidin не работает не в стерильных условиях. Это основной недостаток нашего метода, так как сопротивление кассета blasticidin обычно используется для создания нокаут-конструкции в D. discoideum. Конструкции, которые уже были созданы с blasticidin сопротивление кассеты будет нужно быть rederived с помощью одного из действенных выбираемых маркеров. Еще одна возможность для преодоления этого ограничения является объединить недавно созданной стерильных D. discoideum ТРИФОСФАТЫ технологии с этот протокол transfection26. Поколение РНК подходит, единого руководства (sgRNAs), проще и быстрее, чем восстановление полный нокаут-конструкции. Для будущих направлений, возможность создания нескольких стук аутов с помощью ТРИФОСФАТЫ/Cas9 в сочетании с этот протокол transfection является привлекательным и может проложить путь для многих исследователей в сообществе сапротрофные . Однако следует тщательно изучить работоспособность системы установленных временных выражение используется для ТРИФОСФАТЫ/Cas9 в стерильных выращенные клетки.
Act5 стучите в системе представлены предлагает систему надежной и безопасной интеграции для формирования стабильных клеточных линий в D. discoideum, с преимуществом подобных сайтов в других организмов22. Он также зависит от интеграции одного события в геноме и предлагает много возможностей для направления различных исследований. Промоутер act5 сильно активен и гарантирует практически однородной выражение27 независимо от условий выращивания. Репортер флуоресцентные белки легко могут быть интегрированы это убежище локус, используя инженерии таргетинга плазмид. Это может быть полезным, например, для ячейки отслеживания, как показано здесь в эксперименте микс. Клетки показывают минимальный к ячейке выражения изменчивости, которые могут помочь в автоматизированные ячейки отслеживания. Важно отметить, что включение желаемой последовательности в локусе действовать5 появляется фенотипически нейтральных28,29. Поскольку выражение не зависит выбор маркера для поддержания выражение протеина, как видно из случайных integrants или нехромосомной вектор подшипник клеточных линий, act5 система может быть полезным для спасения экспериментов, а также. Поскольку линии клетки являются однородными, все клетки могут быть проанализированы. Это не возможно с помощью нехромосомной плазмиду для выражения, в котором находится значительная неоднородность в выражении.
Помимо этих общих улучшений для всех штаммов возможность использования не стерильных одичал тип ячейки для молекулярных исследований позволяет оценку воздействия накопленных мутаций в текущем лабораторные штаммы. Было обнаружено несколько генетических перестроек с момента принятия Ax2 штамм в 1970 году, как показано ранее опубликованных microarray анализ26. Синтетические фенотипов наблюдаются вследствие присутствия этих мутаций. Например мутант сообщил phg2 показывает снижение адгезии в одной лаборатории штамм фон и увеличение адгезии в другой3. Такие противоречивые данные теперь может быть решена, повторив эксперимент в общий предок штамм (в данном случае, DdB). Сила этого подхода было недавно показано для малых ГТФазы RasS30,31.
Возможность выполнения генетических экспериментов в любой штамм D. discoideum расширяет потенциал новых направлений исследований, которые зависят от использования диких изолятов, особенно с участием социальной эволюции, Кин признание и полового цикла22.
Раскрытие информации
Авторы не имеют никаких конфликтов интересов раскрыть.
Благодарности
Авторы благодарят Кей лаборатории для ввода для данного метода и ЛКМ микроскопии и потока цитометрии для прекрасную научную и техническую поддержку. Эта работа финансировалась Грант Грант MC_U105115237 р. р. Кей, СИББН (биотехнологии и биологических наук научно-исследовательского совета) Совет медицинских исследований BB/K009699/1-р. р. Кей, Cancer Research UK предоставлять A15672 R. H. Insall, Добро пожаловать доверять старший стипендий 202867/Z/16/Z Джонатан R Chubb и MRC финансирования (MC_U12266B) к блоку MRC университета LMCB в UCL.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Eppendorf Microcentrifuges 5424/5424R | ThermoScientific | 05-400-002 | |
| Eppendorf 5702R Centrifuges with A-4-38 Model Rotor | ThermoScientific | 12823252 | |
| Eppendorf Mastercycler Nexus Thermal Cyclers | Sigma Aldrich | EP6331000025 | |
| Gene Pulser X Cell, including CE & PC modules | BioRad | 1652660 | |
| Safety Cabinet Foruna - SCANLAF | Labogene | ||
| BioPhotometer Plus | Eppendorf | ||
| CLSM 710 | Zeiss | ||
| Media & Agaroses | |||
| LoFlo Medium | Formedium | LF0501 | |
| Seakem GTG Agarose | Lonza | 50071 | |
| Low EEO Agarose | BioGene | 300-200 | |
| Purified Agar | Oxoid | LP0028 | |
| SM broth | Formedium | SMB0102 | |
| 2x LB broth | Formedium | LBD0102 | |
| Chemicals | |||
| SYBR Safe DNA Gel Stain | ThermoScientific | S33102 | |
| 1 Kb Plus DNA Ladder | ThermoScientific | 10787018 | |
| 1 Kb DNA Ladder | NEB | N3232L | |
| HEPES free acid | Sigma Aldrich/Merck | 391340 EMD | |
| KH2PO4 | VWR | P/4800/53 | |
| Na2HPO4 * 2 H2O | VWR | 10028-24-7 | |
| MgCl2 * 6 H2O | Sigma Aldrich/Merck | 5982 EMD | |
| CaCl2 * 2 H2O | Sigma Aldrich | 442909 | |
| Folic Acid | Sigma Aldrich | F7876 | |
| KOH | VWR | 26668.263 | |
| Cultur Dishes | |||
| 96 Well Cell Culture Cluster, Flat Bottom with Low Evaporation Lid, Tissue Culture Treated | Corning Incorporated | 3595 | |
| 6 Well Cell Culture Cluster, Flat Bottom with Lid, Tissue Culture Treated | Corning Incorporated | 3516 | |
| 100 x 20 mm style Tissue Culture Dish, Tissue Culture Treated | Corning Incorporated | 353003 | |
| 50 mm Glass Bottom Microwell Dishes No1.5 | MatTek Corporation | P50G-1.5-30-F | |
| Antibiotics | |||
| Geneticin G418-sulphate | Gibco by Life Technologies | 11811-023 | |
| Hygromycin B Gold | InvivoGen | ant-hg-1 | |
| Additional Consumables | |||
| 2 mm gap electroporation cuvettes, long electrode | Geneflow Limited | E6-0062 | |
| 10 µL Inoculating Loop, Blue 10 Micro L | ThermoScientific | 129399 | |
| Spreader, L-shaped, sterile | greiner bio-one | 730190 | |
| Combitips advanced 5 mL | Eppendorf BIOPUR | 30089669 | |
| Kits | |||
| ZR Plasmid Miniprep Classic | Zymoresearch | D4016 | |
| Quick DNA Miniprep Kit | Zymoresearch | D3025 | |
| Zymoclean DNA Recovery Kit | Zymoresearch | D40002 | |
| Enzymes | |||
| Restriction enzymes | NEB | ||
| OneTaq 2X Master Mix with Standard Buffer | NEB | M0482L | |
| T4 DNA Ligase | NEB | M0202S | |
| PrimeSTAR Max DNA Polymerase | TakaraBio | R045A |
Ссылки
- Schaap, P. Evolutionary crossroads in developmental biology: Dictyostelium discoideum. Development. 138 (3), 387-396 (2011).
- Sussman, R., Sussman, M. Cultivation of Dictyostelium discoideum in axenic culture. Biochemical and Biophysical Research Communications. 29, 53-55 (1967).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), 75 (2008).
- Witke, W., Nellen, W., Noegel, A. Homologous recombination in the Dictyostelium alpha-actinin gene leads to an altered mRNA and lack of the protein. The EMBO Journal. 6, 4143-4148 (1987).
- De Lozanne, A., Spudich, J. A. Disruption of the Dictyostelium myosin heavy chain gene by homologous recombination. Science. 236, 1086-1091 (1987).
- Howard, P. K., Ahern, K. G., Firtel, R. A. Establishment of a transient expression system for Dictyostelium discoideum. Nucleic Acids Research. 16, 2613-2623 (1988).
- Knecht, D., Pang, K. M. Electroporation of Dictyostelium discoideum. Methods in Molecular Biology. 47, 321-330 (1995).
- Wetterauer, B., et al. Wild-type strains of Dictyostelium discoideum can be transformed using a novel selection cassette driven by the promoter of the ribosomal V18 gene. Plasmid. 36, 169-181 (1996).
- Lloyd, M. M., Ceccarelli, A., Williams, J. G. Establishment of conditions for the transformation of nonaxenic Dictyostelium strains. Developmental Genetics. 11, 391-395 (1990).
- Bloomfield, G., et al. Neurofibromin controls macropinocytosis and phagocytosis in Dictyostelium. eLife. 4, (2015).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. eLife. 5, (2016).
- Veltman, D. M., Lemieux, M. G., Knecht, D. A., Insall, R. H. PIP(3)-dependent macropinocytosis is incompatible with chemotaxis. The Journal of Cell Biology. 204 (4), 497-505 (2014).
- Hoeller, O., Kay, R. R. Chemotaxis in the absence of PIP3 gradients. Current Biology. 17, 813-817 (2007).
- Chubb, J. R., Wilkins, A., Thomas, G. M., Insall, R. H. The Dictyostelium RasS protein is required for macropinocytosis, phagocytosis and the control of cell movement. Journal of Cell Science. 113, 709-719 (2000).
- Schaap, P., et al. Molecular phylogeny and evolution of morphology in the social amoebas. Science. 314, 661-663 (2006).
- Du, Q., Kawabe, Y., Schilde, C., Chen, Z. H., Schaap, P. The Evolution of Aggregative Multicellularity and Cell-Cell Communication in the Dictyostelia. Journal of Molecular Biology. 427 (23), 3722-3733 (2015).
- Hirose, S., Benabentos, R., Ho, H. I., Kuspa, A., Shaulsky, G. Self-recognition in social amoebae is mediated by allelic pairs of tiger genes. Science. 333 (6041), 467-470 (2011).
- Strassmann, J. E., Queller, D. C. Evolution of cooperation and control of cheating in a social microbe. Proceedings of the National Academy of Sciences of the United States of America. 108 (2), 10855-10862 (2011).
- Wolf, J. B., et al. Fitness Trade-offs Result in the Illusion of Social Success. Current Biology. 25 (8), 1086-1090 (2015).
- Veltman, D. M., Akar, G., Bosgraaf, L., Van Haastert, P. J. A new set of small, extrachromosomal expression vectors for Dictyostelium discoideum. Plasmid. 61 (2), 110-118 (2009).
- Southern, E. M. Detection of specific sequences among DNA fragments separated by gel electrophoresis. Journal of Molecular Biology. 98 (3), 503-517 (1975).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), 0196809 (2018).
- Woznica, D., Knecht, D. A. Under-agarose chemotaxis of Dictyostelium discoideum. Methods in Molecular Biology. 346, 311-325 (2006).
- Dubin, M., Nellen, W. A versatile set of tagged expression vectors to monitor protein localisation and function in Dictyostelium. Gene. 465 (1-2), 1-8 (2010).
- de Hostos, E. L., et al. Dictyostelium mutants lacking the cytoskeletal protein coronin are defective in cytokinesis and cell motility. Journal of Cell Biology. 120, 163-173 (1993).
- Sekine, R., Kawata, T., Muramoto, T. CRISPR/Cas9 mediated targeting of multiple genes in Dictyostelium. Scientific Reports. 8 (1), 8471 (2018).
- Sadelain, M., Papapetrou, E. P., Bushman, F. D. Safe harbours for the integration of new DNA in the human genome. Nature Reviews Cancer. 12 (1), 51-58 (2011).
- Rosengarten, R. D., et al. Leaps and lulls in the developmental transcriptome of Dictyostelium discoideum. BMC Genomics. 16, 294 (2015).
- Tunnacliffe, E., Corrigan, A. M., Chubb, J. R. Promoter-mediated diversification of transcriptional bursting dynamics following gene duplication. Proc Natl Acad Sci USA. 115 (33), 8364-8369 (2018).
- Gebbie, L., et al. Phg2, a kinase involved in adhesion and focal site modeling in Dictyostelium. Molecular Biology of the Cell. 15, 3915-3925 (2004).
- Jeon, T. J., Lee, D. J., Merlot, S., Weeks, G., Firtel, R. A. Rap1 controls cell adhesion and cell motility through the regulation of myosin II. Journal of Cell Biology. 176, 1021-1033 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены