Method Article
Репортер BW системы для изучения взаимодействия рецептор лиганд
В этой статье
Резюме
Этот протокол описывает, как создать систему репортер, который может использоваться для идентификации и количественной оценки взаимодействия рецептор лиганд.
Аннотация
Взаимодействие между рецепторами и лигандами составляют основной биологический процесс. Однако, прямые эксперименты с клетками, которые выражают родной рецепторов и лигандом являются сложными, поскольку лигандом со специфическими рецепторами могут быть неизвестны и экспериментальных процедур с родной лиганд может быть технически сложным. Чтобы устранить эти препятствия, мы описываем репортер системы для обнаружения привязки и активации со специфическими рецепторами лигандом интерес. В этой системе репортер внеклеточного домена со специфическими рецепторами конъюгированных мыши CD3ζ и этот химерных белок затем выражается в клетки мыши BW. Эти transfected клеток BW можно затем инкубируют с различными целями (например, клетки или антител). Активация transfected рецептора приводит к секреции мыши интерлейкин-2 (mIL-2) которые могут быть обнаружены энзим соединенный assay иммуносорбента (ELISA). Эта система репортер имеет преимущества чувствительных и специфические для одной рецепторов. Кроме того уровень активации со специфическими рецепторами легко могут быть количественно и может использоваться даже в тех случаях, когда неизвестно лигандов рецепторов. Эта система была внедрена успешно во многих из наших исследований характеризовать рецептор лиганд взаимодействий. Недавно мы использовали эту систему для изучения активации человеческого Fcγ рецепторы (FcγRs), различные моноклонального анти CD20 антител в клинической практике.
Введение
Репортер система BW — это метод для изучения взаимодействия рецептор лиганд1. Эта система особенно выгодно, когда лигандом со специфическими рецепторами неизвестна или эксперименты с эндогенного лиганда технически сложным. Он может также использоваться для изучения привязки моноклональных антител человека FcγRs. Метод основан на выражая химерных белка в клетках мыши BW. Этот химерных белок состоит из внеклеточного домена рецептора интерес, сливается в трансмембранного и внутриклеточных домены цепи ζ мыши. Связывание соответствующие лигандами рецептора приводит к секреции IL-2 мыши, который может быть легко обнаружен ELISA, как показано на рисунке 1. Этот метод является чувствительным и специфичные для отдельных рецепторов, легко работать и высокую воспроизводимость. Он может таким образом дополнить дополнительные инструменты для изучения взаимодействия рецептор лиганд. Например он может использоваться для экран несколько клеточных линий на наличие лигандом для конкретных рецепторов (даже если лиганд, сам не были определены) или для определения активации человеческого FcγRs моноклональные антитела или сыворотку крови человека содержащих анти-вирусные антител. Хотя основной иммунные клетки Экспресс эндогенного FcγRs, они обычно трудно обрабатывать и обычно выражают несколько Fc рецепторов.
Мы использовали эту систему успешно во многих из наших исследований характеризовать рецептор лиганд взаимодействий. Они включают определение гемагглютинин как лиганд NK клеточных рецепторов NKp462, выявление PVR и nectin-2 как лигандов для человека и мыши TIGIT3,4, и показывает, что nucleatum фузобактерии бактерия связывает и активирует человека TIGIT5. Кроме того BW клетки, которые выражают Fc рецепторов успешно используются для обнаружения Противовирусные антитела в пациентов сера,6,7,,8. В частности мы недавно создали BW клетки, которые выражают человека FcγRs обнаружить дифференциального FcR активации антител анти CD20, используется для лечения хронического лимфолейкоза (ХЛЛ)9. Важно отметить, что в дополнительных экспериментов были подтверждены результаты системы репортер бо.
протокол
1. поколение плазмида, который выражает химерных построить
Примечание: Цель заключается в создании плазмида, который выражает внеклеточного домена рецептора интерес, сливается в трансмембранного и внутриклеточных домены мыши CD3ζ цепи (рис. 2A).
- Извлечение последовательности внеклеточного домена рецептора интерес, включая сигнал пептид. Получение материала ДНК, который, как ожидается, выразить этот рецептор (например, cDNA или плазмиду).
- Получение материала ДНК, который выражает трансмембранного и внутриклеточных домены мыши CD3ζ цепи (например., cDNA или плазмиду).
- Дизайн последовательность синтез белка на основе общей структуры, показано на рисунке 2А. Убедитесь, что вся последовательность находится в пределах той же раме кодон чтения. Эта последовательность используется для разработки соответствующей грунтовки и проверки конечного продукта.
- Дизайн два ПЦР-реакции для того чтобы усилить каждый из фрагментов синтез белков отдельно (Рисунок 2B, 2 C)10.
Примечание: Особые условия для ПЦР-реакции (например., удлинение времени и отжига температура) зависят от характера праймеров, которые предназначены для конкретных рецепторов.- Усилить внеклеточного сегмент рецептора.
- Дизайн грунт 5', который включает в себя часть сигнала пептид рецептора, последовательность Козак консенсус и соответствующие ограничения сайта (рис. 2B).
- Дизайн грунт 3', что Бока обе части синтез белка (рис. 2B). Например для первоначального дизайна этот грунт 3' может включать 20 последних пар оснований внеклеточного сегмента рецептора и первые 9 низкопробных пар CD3ζ сегмента.
Примечание: Существует не нужно добавить сайт ограничение в грунт 3', так как этот грунт будет использоваться для создания плавленого последовательности и не используется для перевязки.
- Усиливает CD3ζ сегмента.
- Дизайн праймера 5', который флангов обе части синтез белка (рис. 2 c). Например для первоначального дизайна грунтовка 5' может включать последние 9 низкопробных пар внеклеточного сегмента рецептора и первые 20 пар оснований CD3ζ сегмента.
Примечание: Существует не нужно добавить сайт ограничение в грунт 5', поскольку этот грунт будет использоваться для создания плавленого последовательности и не используется для перевязки. - Дизайн грунт 3', которая включает в себя конец последовательности CD3ζ, а также соответствующее ограничение сайта (рис. 2 c).
- Дизайн праймера 5', который флангов обе части синтез белка (рис. 2 c). Например для первоначального дизайна грунтовка 5' может включать последние 9 низкопробных пар внеклеточного сегмента рецептора и первые 20 пар оснований CD3ζ сегмента.
- Исправьте последовательностей праймера в каждой из этих двух реакций, так что отжига температура похожа в каждой паре (Обратите внимание, что грунт, который включает в себя последовательности из двух частей синтез белка, только anneals с частью последовательности в каждой реакции).
- Усилить внеклеточного сегмент рецептора.
- Выполнить дополнительные PCR, в котором используется смесь продуктов ПЦР первых двух реакций как шаблон ДНК с 5' грунтовка внеклеточного рецептор сегмента (шаг 1.4.1.1) и 3' CD3ζ сегмента (шаг 1.4.2.2) (Рисунок 2D)10 . Эта реакция должна генерировать окончательного плавленого последовательности.
- Приступить, как обычно для клонирования.
- Перевязать конечный продукт PCR с целью сократить вектор (вектор целевой обычно является pcDNA3, который выражает G418 и ампициллин сопротивление).
- Трансформировать перевязаны вектор в компетентных бактерий11.
- Оттепель 50 мкл компетентным бактерий на льду.
- Добавьте перевязаны вектор для бактерий и инкубировать на льду за 20 мин.
- Инкубируйте на 42 ° C для 45 s.
- Добавьте 200 мкл фунтов без антибиотиков.
- Инкубируйте 1 час при 37 ° C с непрерывной тряски.
- Семя на плите LB с соответствующие антибиотики (например, ампициллин решение с конечной концентрации 0,1 мг/мл).
- Собирать и расти несколько бактериальных колоний в 5 мл фунтов (в 15 мл пробирок).
- Следующий день, экстракт плазмид с набором мини-prep.
- Анализ гена вставка с энзимами ограничения.
- Последовательность соответствующих колоний и убедитесь, что последовательность и рамка чтения (как указано в шаге 1.3).
- Трансформировать проверенных плазмида в компетентных бактерий11.
- Размораживание 20 мкл компетентным бактерий на льду.
- 1 мкл плазмида бактерий и инкубировать на льду за 20 мин.
- Инкубируйте на 42 ° C для 45 s.
- Добавьте 200 мкл фунтов без антибиотиков.
- Инкубируйте 1 час при 37 ° C с непрерывной тряски.
- Семя на пластине роста бактерий с соответствующие антибиотики (например, ампициллин решение с конечной концентрации 0,1 мг/мл).
- Следующий день, растут бактериальные колонии в большом контейнере LB с 0,1 мг/мл ампициллин (~ 250 мл).
- Следующий день, выполняют макси приготовительная согласно инструкции, представленной в комплект.
Примечание: Для электропорации процедуры, большое количество плазмида требуется, как описано ниже.
2. transfection плазмида, выражающий химерных белка в BW клетки
Примечание: Различные методы могут также использоваться для transfection (например., лентивирусные инфекции). До электропорация выполняют этанола осадков ДНК, как описано ниже. Следующие шаги требуют стерильных условий.
- За день до, подготовить BW5147 (клетки «BW») для электропорации. Пластина 10 пластины (10 см) с 10 мл 100 000 BW5147 клеток/мл (т.е. в общей сложности 10 х 106 клеток) с RPMI, дополненная плода теленка 10% сыворотки (FCS), пируват натрия 1%, 1% L-глютамином, 1% несущественные аминокислот и 1% пенициллин стрептомицином («полного среднего»).
- Место 100 мкг плазмида pcDNA3, который выражает синтез белка в 1,5-2 мл трубку и добавить 3 M ацетат натрия при pH 5.3-5.5 к нему. Объем ацетат натрия должна соответствовать 0,1 (10%) объема 100 мкг плазмиды; Титруйте pH ацетат натрия с рН метр путем добавления NaOH или HCl.
- Добавьте 2.5 тома 100% этанола в смесь плазмида и ацетат натрия как описано в шаге 2.2 (2,5 x общий объем плазмиды и натрия ацетата). Инкубируйте на ночь при-20 ° C или за 2 ч при 70 ° C.
- 2.4. 24 ч после покрытием BW клетки собирают все клетки BW (~ 100 мл) в 2 50 мл трубки. Центрифуга клетки для 5 мин на 515 x g и удалить супернатант.
- Вновь приостановите гранулы из обеих трубок в 25 мл RPMI - в единый 50 мл трубки. К примеру, вновь приостановить Пелле одной трубки с 25 мл RPMI - и затем использовать эту жидкость вновь приостановить жидкости в других 50 мл трубки, таким образом, чтобы общая гранулы из клеток BW вновь приостановлено в 25 мл среды в однотрубных.
Примечание: Средство должно быть без дополнений, так как сыворотки может мешать электропорации. - Центрифуга клетки снова за 5 мин на 515 x g. Вновь приостановить гранулы в 1 мл RPMI и передавать содержимое до 0,4 см кювета на льду.
- Центрифуга плазмиды, которые прошли этанола осадков (шаг 2.3) за 30 мин при 16000 x g и 4 ° C.
- После промойте 1 мл 70% этанола и центрифуги для другого 20 минут, 16000 x g и 4 ° C (смыть соль).
- Удалите все этанола и пусть гранулы сухого слегка (т.е., в открытой трубой в культуре ткани капот). Вновь приостановить лепешка с 100 мкл RPMI-ранее подогретой до 60 ° C.
- Добавить вновь приостановлено плазмида (шаг 2.8) клетки в кювет и инкубировать в течение 5 минут на льду.
- Electroporate клетки на 0,23 кв, 250 дипломирования. Это должно занять ~ 4 мс.
- Electroporated клетки перехода к 50 мл трубки, добавить 50 мл полного среднего и центрифуги для 5 мин в 515 x g.
- Отменить супернатант и вновь приостановить клетки с 50 мл полной среды.
- Пластина electroporated клеток в культуре 24-ну блюда (1 мл на хорошо, в общей сложности ~ 50 скважин) и Инкубируйте на 37 ° C и 5% CO2 в течение 48 часов.
- Выберите transfected клеток с помощью антибиотиков. После 48 h добавить 1 мл полного среднего, дополнена 10 мг/мл G418 для каждой скважины (на данном этапе конечный объем в каждом хорошо 2 мл и конечная концентрация G418 в каждом хорошо 5 мг/мл).
Примечание: Если плазмида содержит различные антибиотикорезистентности, определите антибиотик концентрации, необходимые для убить untransfected BW клетки до этого шага. - Каждые 48 ч, тщательно отбросить 1 мл верхняя объема каждой скважины без перемешивания среды в скважине (BW клетки, как правило, быть в нижней части скважины). Добавление полного среднего, дополнена 5 мг/мл G418 для каждой скважины, так что окончательный объем в каждой скважине снова 2 мл.
- Изучение культуры пластин для роста клеток на всех скважинах регулярно.
Примечание: Изменения в цвет средне-желтый может помочь определить рост клеток; Однако, в начале носителя будет желтый из-за G418 сам. Выявление положительных скважин (скважины с ростом клеток). Эти колодцы являются G418 устойчивостью и поэтому, как ожидается, выразить синтез белка. Этот процесс обычно занимает ~ 3 недели.
3. Проверка выражения Transfected рецепторами в клетках в положительных скважин.
- Пятно transfected клеток BW с специфическим антителом против рецептора, который был transfected.
- Сравните уровень экспрессии рецептора подачей cytometry выражение управления (клетки untransfected BW).
- После проверки одного или нескольких скважин немедленно использовать клетки в экспериментальных целях, растут в культуре или заморозить для будущих приложений.
- Проверьте выражение transfected рецептора перед выполнением новый эксперимент. После нескольких недель роста, клетки с G418 с выражением стабильной рецепторов, G418 может быть опущен из питательной среды.
4. инкубации клеток Transfected BW с целями
Примечание: При использовании transfected клеток BW для в первый раз, желательно проверить их на цели, которые выражают известные лигандов рецепторов интерес или плита прыгните антител, конкретно направленных против рецептора интерес (сшивки эксперименты; Смотрите ниже, в разделе 4.2.1.3).
- Предпочтительно разбить ячейки BW 24 ч до эксперимента (например, путем добавления 10 мл полного среднего до 2 мл клеток в культуре в новой пластинкой культуры 10 см).
- Инкубируйте transfected клеток BW с их целями. Выполните эксперимент одновременно управления BW клетки, которые выражают пустой вектор (или родительский BW клетки). 96f пластины являются предпочтительными (но может также использоваться 96U пластины). Выполнение эксперимента в трех экземплярах. Приостановите все клетки в средне-полной.
- Подготовка целей. Тип целевого объекта изменяется в зависимости от цели и может быть клетки, клетки, которые были предварительно инкубировали с антителами, или только антитела. Эта система также используется с бактериями как цели5.
- Если целевые показатели делящиеся клетки (то есть, клеточных линий), облучить их в 6000 rad до assay. Место 50 000 клеток-мишеней в одном хорошо 96 пластины (в объеме 100 мкл).
- Для экспериментов с антител и BW клетки, которые выражают человеческого FcγRs, инкубации клеток-мишеней с антитело на льду в 96 хорошо плиты (например, 50 мкл клеток-мишеней и 50 мкл антител; могут быть проверены различные антитела доз).
- При использовании антител только как цели (сшивки экспериментов), они должны быть пластины привязкой. Для этой цели сначала инкубации антитела в полной среды в 96F пластина для 1-2 ч при 37 ° C и 5% CO2 (типичная начальная доза-0,5 мкг специфического антитела в 50 мкл). Вымойте тарелку, чтобы удалить несвязанные антитела.
Примечание: В этом случае плиты 96F позволит Связывание антитела к пластине, которая после добавления transfected клеток BW приведет к активации рецептора transfected.
- Добавьте BW (эффекторные клетки). Место 50000 BW клетки в один хорошо 96 пластины (в объеме 100 мкл).
- Полный объем в каждой скважине до 200 мкл при необходимости.
- Инкубируйте пластин при 37 ° C и 5% CO2 в течение 48 часов (этот период времени может быть откалиброван).
- Подготовка целей. Тип целевого объекта изменяется в зависимости от цели и может быть клетки, клетки, которые были предварительно инкубировали с антителами, или только антитела. Эта система также используется с бактериями как цели5.
- После 48 ч, заморозить пластины при-20 ° C и оттепели до ELISA, или использовать немедленно для ИФА-диагностики (см. Далее).
5. ELISA
- Герб ELISA пластины с антитело против мыши Ил-2 (анти-mIL-2). 0,05 мкг mIL-2 место в объеме 50 мкл ПБС в колодец. Инкубируйте пластину покрытием ELISA с антителом mIL-2 на 4 ° C на ночь или на 37 ° C в течение 2 ч.
Примечание: Для выполнения ELISA сразу после инкубации шаг, пластину ELISA должны быть покрыты 24 h до конца периода инкубации клеток BW. - Отменить жидкости в пластину ELISA и добавить блокировки решение (200 мкл в колодец), который состоит из ПБС и 1% бычьим сывороточным альбумином (БСА). Инкубируйте пластину ELISA втечение 2 ч при комнатной температуре.
- Вымойте пластину ELISA три раза с 0,05% раствора PBS анимации (т.е. 0,5 мл Tween-20 в 1 литре ПБС).
- Возьмите 96 пластина, которая имеет BW клетки, которые инкубировали с их целями (4.3). Если плита был заморожен, полностью разморозить его (например., короткий инкубационный при 37 ° C). Центрифуга 96 пластина (5 мин, 515 x g) и тщательно передавать предварительно покрытых и заблокированных ELISA пластины 100 мкл супернатант в каждой скважине.
Примечание: Супернатант должны быть собраны из сторон каждой скважины, чтобы избежать принятия клетки. - При желании, добавьте один из пустых строк с покрытием плиты ELISA для создания стандартной кривой mIL-2 рекомбинантных mIL-2 с определенной концентрации. Например, начать с мил-2 концентрация 2500 пг/мл и затем уменьшить на 50% в каждом последующем хорошо; не добавляйте mIL-2 к последнему хорошо.
- Инкубируйте ELISA пластины на 4 ° C на ночь или при 37 ° C на 2 ч.
- Вымойте пластину ELISA четыре раза с PBS анимации.
- Добавьте биотина анти мыши IL-2 пластину ELISA. Использовать в концентрации 1 мкг антител в 1 мл раствора 1 x PBS с 1% BSA и разделить на 100 мкл в колодец.
- Инкубации при комнатной температуре в течение 1 ч.
- Вымойте тарелку ELISA шесть раз с PBS анимации.
- Добавьте HRP конъюгированных стрептавидина. В 1 мл раствора PBSX1 с 1% BSA использовать концентрацию 1 мкл стрептавидина и разделите его на 100 мкл в колодец.
- Инкубации при комнатной температуре за 30 мин.
- Вымойте тарелку ELISA шесть раз с PBS анимации.
- 100 мкл на хорошо ТМБ раствора субстрата. Завершите этот этап быстро свести к минимуму различия между скважинами из-за времени запаздывания при добавлении ТМБ.
- Читайте пластину ELISA с ELISA пластины чтения на 650 Нм (чтение может быть повторяться, если сигнал слабый).
Результаты
Рисунок 3 показывает результаты эксперимента с системой репортер бо. В этом эксперименте клетки CLL были предварительно инкубировали с различными анти CD20 антител (rituximab и obinutuzumab) и затем совместно инкубировали с transfected клеток BW, которые выражают CD16a-CD3ζ. Подобные эксперименты были проведены в нашем исследовании9. На рисунке 3A представляет изображение сырые плиты ELISA, где интенсивность цвета соответствует концентрации mIL-2. Эксперимент проводился в трех экземплярах. Этот эксперимент включено несколько элементов управления: ЛЛЦ клетки инкубировали с родительской клетки untransfected BW (верхняя строка) и ХЛЛ клетки инкубировали с BW клетки, которые выражают CD16a-CD3ζ, но без антитело или управления антитела (шесть скважин во втором ряду слева) . Инкубация BW ячеек выражена CD16 с ХЛЛ клетки, которые предварительно были инкубировали с антител анти CD20 индуцированной значительный секрецию mIL-2 по сравнению с мил-2 уровень контроля скважин. Главное, предварительной инкубации клеток ЛЛЦ с анти CD20 obinutuzumab активированный CD16 более сильно, чем Ритуксимаб, известный, поиск, который был изъятый в нашей системе. Последняя строка показывает, по убыванию предварительно определенных концентрациях рекомбинантных mIL-2 (без добавления ячеек). Право также в последней строке не мил-2 и представляет собой фон чтения, которая выглядит контроля скважин. Рисунок 3B представляет количественная оценка результатов пластину ELISA, показано на рисунке 3A. Оптическая плотность (OD) уровни были преобразованы в концентрации mIL-2, на основе стандартной кривой с рекомбинантным mIL-2. Рисунок 3 c представляет эксперименте ответ дозы, где различных доз антител были предварительно инкубировали с ХЛЛ клетки и затем инкубируют с клетками BW, выражая CD16.
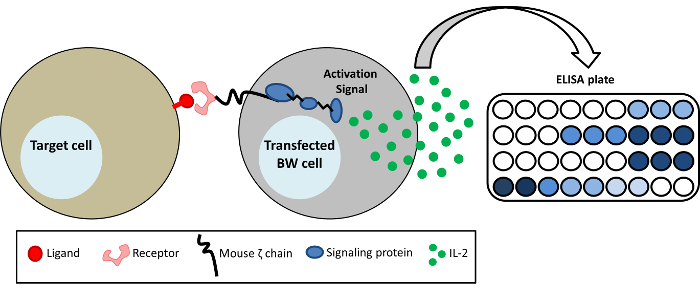
Рисунок 1: Схематическое представление о системе репортер BW. BW5147 клетки являются стабильно transfected с внеклеточного часть различных рецепторов, сливается с трансмембранного и цитоплазматических доменов мыши CD3ζ цепи (химерных recptor-CD3ζ). Активация конкретных рецепторов CD3ζ лигандом результаты в секреции mIL-2, которые могут быть обнаружены по ELISA. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: структура химерных рецепторов CD3ζ и дизайн праймеров PCR. (A) общая структура рецептора внеклеточного сливается в трансмембранного и внутриклеточных домены мыши CD3ζ. (B внеклеточного домена рецептора был усилен с грунт 3', которая также включала нуклеотидов CD3ζ. (C внутриклеточные и трансмембранных доменов CD3ζ были усилены с праймером 5', которая также включала рецептор нуклеотидов. (D) в окончательной реакции ПЦР обоих сегментов, которые имеют перекрывающиеся последовательности, использовались как шаблона дна. В всех рисунок панели домены различных белков цветом и зажаты в синие прямоугольники (CD3ζ последовательности) и красными прямоугольниками (рецептор последовательности). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
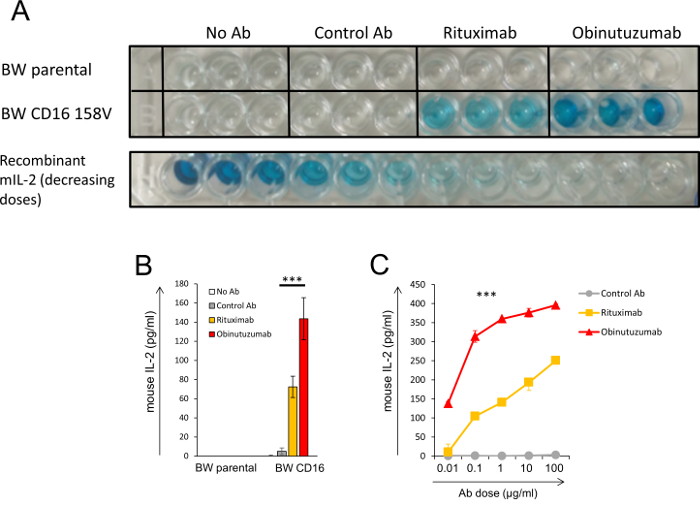
Рисунок 3: Иллюстрация конечного продукта системы репортер BW. (A, B, C) CLL клетки были предварительно инкубируют с или без двух антител анти CD20 (rituximab и obinutuzumab) или управления антитела. После этого антитела прыгните клетки инкубировали с родительского BW клетки или клетки BW, которые выражают CD16a-CD3ζ. Уровень mIL-2 в надосадке определяется ELISA. (A) изображение сырые плиты ELISA. Интенсивность цвета указывает концентрация mIL-2 в надосадке. Эксперимент проводился в трех экземплярах. Нижней строке показывает ELISA индикация в снижении концентрации рекомбинантных mIL-2, которые были проанализированы в том же пластины. (B) количественная оценка ELISA, чтение показано в (A). MIL-2 уровни были рассчитаны с использованием стандартной кривой mil-2. (C) A доза ответ эксперимент где различных доз антител были предварительно инкубировали с ХЛЛ клетки и затем инкубируют с клетками BW, выражая CD16a-CD3ζ. , P < 0,001; T -критерия Стьюдента (B) или дисперсионный анализ с несколькими сравнения (C). Только сравнение в (C), которая существенно не отличалась был ритуксимаба и управления Ab в первом концентрации (0,01 мкг/мл). Планки погрешностей представляют собой стандартное отклонение triplicates. Подобные эксперименты были проведены в рамках одного из наших недавних исследований9. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Здесь мы представляем протокол для генерации репортер системы расследовать рецептор лиганд взаимодействий (сокращенная форма этого протокола в1см). Протокол состоит из трех основных частей: клонирование, химерных белка, который включает внеклеточного домена со специфическими рецепторами сплавили Внутриклеточный домен CD3ζ, transfection плазмида, который выражает синтез белка в BW клеток (например , путем электропорации) и количественного обнаружения мыши IL-2, ELISA. Конечный продукт каждого из этих частей должна быть проверена независимо: процесс клонирования должны проверяться путем полного sequencing синтез белка в целевой плазмида, transfection клетки BW должны быть проверены путем изучения выражение рецептор интерес в BW клетки (например, подачей cytometry) и процесс ELISA должна проверяться общие позитивные элементы управления (например, рекомбинантных mIL-2), а также с конкретными элементами управления для transfected клеток BW; т.е. цели, которые выражают известные лигандов рецепторов интерес (например, клетки, что Экспресс CD48 может использоваться как позитивный элемент управления для BW клетки, которые выражают NK клеток рецепторов 2B4). Например процесс клонирования может быть успешным, но синтез белка не выраженные BW клеток. В этом случае следует повторить электропорации. Кроме того, если нет сигнала выше фонового уровня пластину ELISA (особенно для позитивных элементов управления) transfected клеток BW могут не удалось выразить рецептор (или выражение было потеряно) или техническая проблема может иметь место во время процесс ELISA.
Этот протокол может внести несколько изменения при сохранении общих принципов процедуры. Эти изменения включают в себя вектора используется для выражения синтез белка, метод для transfecting плазмиды клетки BW и конкретных параметров, связанных с инкубации и ELISA как тип целевого объекта (например, клетки, антител и т.д.) , число клеток-мишеней или концентрации антитела, если соответствующие (мы используем 50 000 ячеек на колодец и антитело начальная доза 0,5 мкг/скважины), время инкубации (мы используем время инкубации 48 ч) и супернатанта тома, который передается пластину ELISA.
Этот метод является чувствительным, конкретные и может быть легко количественно. Это идеальное место для проверки на наличие лигандов для конкретных рецепторов (особенно если лиганд, сам не было признано). После подготовки transfected клеток BW, которые выражают со специфическими рецепторами, эти клетки можно замороженные и используется при необходимости для дополнительных экспериментов. Мы и другие использовали эту систему успешно в ходе предыдущих исследований для изучения рецептор лиганд взаимодействий (например2,3,5,12,13,14 ,1516) и результаты, полученные этой системы были проверены другими методами. Этот метод также может использоваться для изучения активации различных человеческих FcγR рецепторов антител, как это было сделано для анти-вирусные антител в сыворотке крови6,,78 или с моноклональными антителами против CD20 9.
Поскольку это репортер системы, в которых выражается только внеклеточного сегмент рецептора, результаты, полученные этой системы должна дополняться дополнительные эксперименты с эндогенных рецепторов, например цитотоксичность анализов с натуральными клеток-киллеров (НК) для изучения взаимодействия с NK клеток рецепторов. Кроме того некоторые взаимодействия лигандов/рецептор не может привести к секреции mIL-2 репортер системой и поэтому может упускаться из виду. Кроме того как и любой экспериментальной установки, результаты должны быть проверены для различных параметров, как описано выше. Это особенно важно в тех случаях, когда сравнение двух условий требуется (например, активации рецептора же ФК различными антителами). Важно также, чтобы убедиться, что чувствительность взаимодействия конкретных лиганд рецептор находится в пределах диапазона линейной системы. В противном случае это может привести к насыщенности значения, которые могут препятствовать правильное сравнение различных условий. Это может быть достигнуто с помощью стандартной кривой mIL-2, а также путем создания кривой доза ответ с протестированных лиганда (в случае насыщения значения, экспериментальные параметры должны быть изменены; например, меньший объем супернатант должны быть проанализированы ELISA). Еще одно возможное ограничение этой системы является использование целевых ячеек с эндогенной секреции mIL-2 (например, клетки мыши T) который бы замаскировать секреции IL-2 BW клеток. Для преодоления этих весьма необычных явлений, которые ограничиваются клетки мыши, этот репортер система может быть усовершенствована с помощью различных репортер (например, GFP), которая выражается не в клетки-мишени.
Раскрытие информации
Авторы заявляют не конкурирующих финансовых интересов.
Благодарности
Авторы благодарят Эстер певица за язык редактирования. Это исследование было поддержано Европейским Советом исследования под седьмой рамочной программы Европейского союза (FP/2007-2013) / соглашение грантов ЕИС номер 320473-BacNK. Дальнейшая поддержка была оказана путем я-CORE программа планирования и составления бюджета Комитета и научного фонда Израиля и я ядро на хроматин и РНК в регулирование гена, Фонд GIF, Льюис Фонд семьи, НЕРС профессора Грант, Гельмгольца Израиль Грант и Rosetrees доверие (все для о.м.). Это исследование было также поддержано Израиля научного фонда (Грант 502/15), Kass медицинских исследований премии и исследовательский грант от Израиля общества гематологии и переливания медицины (чтобы Восточная). А.М – профессор Корона молекулярной иммунологии.
Материалы
| Name | Company | Catalog Number | Comments |
| AccuPrep, Plasmid Mini Extraction Kit | Bioneer | K-3030 | |
| Anti-mouse IL-2 | BioLegend | 503702 | |
| Biotin anti-mouse IL-2 | BioLegend | 503804 | |
| ELISA plates | De-groot | 60-655061 | |
| Fetal Bovine Serum | Sigma | F7524-500ml | |
| G418 | Mercury | MBS3458105GM | |
| Gene Pulser II | Bio-Rad | 165-2105, 165-2106, 165-2107, 165-2108, 165-2109, 165-2110 | |
| L-Glutamine | Biological industry | 03-020-1B | |
| MEM Non-Essential Amino Acids Solution | Biological industry | 01-340-1B | |
| Penicillin-Streptomycin Solution | Biological industry | 03-031-1B | |
| peroxidase streptavidin | Jackson ImmunoResearch | 016-030-084 | |
| PureLink HiPure Plasmid Filter Maxiprep Kit | ThermoFisher Scientific | K210016 | |
| RPMI-1640 Medium | Biological industry | 30-2001 | |
| Sodium Pyruvate | Biological industry | 03-042-1B | |
| TMB | SouthernBiothech | 0410-01 |
Ссылки
- Mandelboim, O., Lankry, D., Gazit, R. Natural Killer Cell Protocols. , Second edn, Humana Press. 258-262 (2010).
- Mandelboim, O., et al. Recognition of haemagglutinins on virus-infected cells by NKp46 activates lysis by human NK cells. Nature. 409 (6823), 1055-1060 (2001).
- Stanietsky, N., et al. The interaction of TIGIT with PVR and PVRL2 inhibits human NK cell cytotoxicity. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17858-17863 (2009).
- Stanietsky, N., et al. Mouse TIGIT inhibits NK-cell cytotoxicity upon interaction with PVR. European Journal of Immunology. , (2013).
- Gur, C., et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack. Immunity. 42 (2), 344-355 (2015).
- Corrales-Aguilar, E., et al. A novel assay for detecting virus-specific antibodies triggering activation of Fcgamma receptors. Journal of Immunoogical Methods. 387 (1-2), 21-35 (2013).
- Corrales-Aguilar, E., et al. Highly individual patterns of virus-immune IgG effector responses in humans. Medical Microbiology and Immunology. 205 (5), 409-424 (2016).
- Radinsky, O., et al. Sudan ebolavirus long recovered survivors produce GP-specific Abs that are of the IgG1 subclass and preferentially bind FcgammaRI. Scientific Reports. 7 (1), 6054(2017).
- Elias, S., Kahlon, S., Kotzur, R., Kaynan, N., Mandelboim, O. Obinutuzumab activates FcgammaRI more potently than other anti-CD20 antibodies in chronic lymphocytic leukemia (CLL). Oncoimmunology. 7 (6), e1428158(2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998(2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), 253(2007).
- Bar-On, Y., et al. NKp46 Recognizes the Sigma1 Protein of Reovirus: Implications for Reovirus-Based Cancer Therapy. Journal of Virology. 91 (19), (2017).
- Glasner, A., et al. Expression, Function, and Molecular Properties of the Killer Receptor Ncr1-Noe. Journal of Immunology. 195 (8), 3959-3969 (2015).
- Glatzer, T., et al. RORgammat(+) innate lymphoid cells acquire a proinflammatory program upon engagement of the activating receptor NKp44. Immunity. 38 (6), 1223-1235 (2013).
- Gur, C., et al. The activating receptor NKp46 is essential for the development of type 1 diabetes. Nature Immunology. 11 (2), 121-128 (2010).
- Markel, G., et al. Pivotal role of CEACAM1 protein in the inhibition of activated decidual lymphocyte functions. Journal of Clinical Investigation. 110 (7), 943-953 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены