Method Article
受容体-リガンド相互作用を研究するための BW レポーター システム
要約
このプロトコルでは、識別し、受容体-リガンド相互作用を定量化に使用できるレポーター システムを確立する方法について説明します。
要約
受容体とリガンドの相互作用は、基本的な生物学的プロセスを構成します。ただし、直接ネイティブの受容体を発現する細胞と実験と特定の受容体のリガンドが不明であるか、ネイティブのリガンドと実験手順は技術的に複雑なすることができますので、配位子に挑戦しています。これらの障害に対処するため興味のリガンドによるバインドと特定の受容体の活性化を検出するレポーター システムについて述べる。このレポーター システムでマウス CD3ζ に特定の受容体の細胞外ドメインを活用し、このキメラ蛋白質はマウス BW 細胞で発現し、します。これら transfected BW セルは、異なるターゲット (例えば、セルまたは抗体) と培養することができます。Transfected 受容体の活性化は、酵素免疫測定法 (ELISA) によって検出することができますマウス インターロイキン 2 (mIL-2) の分泌に します。この記者のシステムには、単一の受容体に特異的かつ高感度であることの利点があります。さらに、特定の受容体の活性化レベルは簡単に定量化することができ、受容体のリガンドが不明な場合でも使用することができます。このシステムは、多くの受容体-リガンド相互作用を特徴付ける研究で正常に実装されています。臨床使用中の異なるモノクローナル抗 CD20 抗体によるヒト Fcγ 受容体 (FcγRs) の活性化を研究するこのシステムを導入しました。
概要
BW レポーター システムは、受容体-リガンド相互作用1を勉強の技術です。このシステムは、特定の受容体のリガンドが不明または内因性リガンドを用いた実験は技術的に困難なとき特に有利であります。それは、人間の FcγRs に対するモノクローナル抗体の結合を勉強するため使用できます。メソッドは、マウス BW 細胞キメラ蛋白を発現するのに基づいています。このキメラ蛋白質はマウス ζ 鎖の膜と細胞内ドメインに融合した関心の受容体の細胞外ドメインで構成されます。受容体の適切な配位子の結合は、図 1に示すように, elisa 法にて容易に検出することができますマウス IL-2 の分泌につながります。このメソッドは、機密と再現性の高い個々 の受容体、作動すること容易に固有です。受容体-リガンド相互作用を研究するための追加のツールを補完することができますそれ。たとえば、それ使えます (リガンド自体は特定されていない) 場合でも、特定の受容体のリガンドが存在するいくつかの細胞株を選別するモノクローナル抗体、ひと血清を含む抗ウイルス人間 FcγRs の活性化を検出するには抗体。主な免疫細胞は、内因性の FcγRs を表現、処理し、通常いくつかの Fc 受容体を表現する一般的に困難です。
使いましたこのシステム正常に私たちの研究の多くの受容体-リガンド相互作用を特徴付けるため。人間のための ligands とマウス TIGIT3,4、PVR および質のネクチン-2 を識別する NK 細胞受容体 NKp462の配位子としてヘマグルチニンを識別するが含まれます、フゾバクテリウム nucleatum を示す細菌にバインドと人間の TIGIT5をアクティブにします。さらに、Fc 受容体を発現する BW 細胞は患者の血清6,7,8抗ウイルス抗体を検出する正常に使用されています。具体的には、我々 は最近 BW 細胞慢性リンパ球性白血病 (CLL)9の治療に使用される抗 CD20 抗体の活性の FcR を検出する人間の FcγRs を表すを設立しました。重要なは、BW レポーター システムの結果は、相補的な実験で検証されてきた。
プロトコル
1. キメラ作成を表現するプラスミッドの世代
注: 目的はマウス CD3ζ チェーン (図 2 a) の膜と細胞内ドメインに融合した関心の受容体の細胞外ドメインを表現するプラスミッドを生成します。
- 信号ペプチドを含む受容体の細胞外ドメインのシーケンスを取得します。この受容体 (例えば、 cDNA またはプラスミッド) を表現するために期待されている DNA 材料を取得します。
- 貫通型を表す DNA 材料およびマウス CD3ζ の鎖の細胞内ドメイン取得 (e.g。、cDNA またはプラスミッド)。
- 図 2 aに示す一般的な構造に基づく融合タンパク質のシーケンスを設計します。シーケンス全体が同じコドンの読み枠の内であることを確認します。この順序は、適切なプライマーを設計し、最終製品の検証に使用されます。
- 個別に各融合蛋白質のフラグメントを増幅する 2 つの PCR の反作用の設計 (図 2 b, 2 C)10。
注: PCR の反作用のための特定の条件 (e.g。、伸長時間及び焼鈍温度) 特定の受容体用に設計されたプライマーの性質によって異なります。- 受容体の細胞外のセグメントを増幅します。
- 受容体、コザック配列、および適切な制限サイト (図 2 b) のシグナルペプチドの一部を含む 5' プライマーを設計します。
- 融合蛋白質 (図 2 b) の両方の部分を側面 3' プライマーを設計します。たとえば、初期デザインのこの 3' プライマーは、受容体の細胞外のセグメントと CD3ζ セグメントの最初 9 塩基対の最後 20 塩基対を含めることができます。
注: このプライマー融合シーケンスを生成に使用する結紮に使用しないので、3' プライマーに制限のサイトを追加する必要はありません。
- CD3ζ のセグメントを増幅します。
- 融合蛋白質 (図 2) の両方の部分の側面 5' プライマーを設計します。たとえば、初期デザインの 5' プライマーは、受容体の細胞外のセグメントと CD3ζ セグメントの最初 20 塩基対の最後 9 塩基対を含めることができます。
注: このプライマー融合のシーケンスを生成する使用されますが結紮に使用されないので、5' プライマーに制限のサイトを追加する必要はありません。 - 適切な制限サイト (図 2) と同様、CD3ζ シーケンスの終わりを含む 3' プライマーを設計します。
- 融合蛋白質 (図 2) の両方の部分の側面 5' プライマーを設計します。たとえば、初期デザインの 5' プライマーは、受容体の細胞外のセグメントと CD3ζ セグメントの最初 20 塩基対の最後 9 塩基対を含めることができます。
- アニーリングの温度は各ペア (融合蛋白質の 2 つの部分シーケンスが含まれています、プライマーのみ各反応のシーケンスの一部で焼鈍注) のようなこれらの 2 つの反応のプライマー シーケンスを修正します。
- 受容体の細胞外のセグメントを増幅します。
- 最初の 2 つの反作用の PCR の製品の混合物が細胞外の受容体セグメント (ステップ 1.4.1.1) の 5' プライマーと、3' CD3ζ セグメント (ステップ 1.4.2.2) の10 (図 2 D) DNA のテンプレートとして使用されている追加の PCR を実行します。.この反応は最終的な融合のシーケンスを生成します。
- クローニングのためにいつものように進んでください。
- ターゲット (目標点のベクターは通常 G418 およびアンピシリン耐性を表現する pcDNA3) ベクトルをカットする最終の PCR の製品を縛る。
- 有能な細菌11に結紮のベクトルを変換します。
- 氷の上の有能な細菌の 50 μ L を解凍します。
- 細菌に結紮のベクトルを追加し、20 分間氷の上をインキュベートします。
- 45 42 ° C で s。
- LB の抗生物質なしの 200 μ L を追加します。
- 連続振動で 37 ° C で 1 時間インキュベートします。
- (例えば、0.1 mg/mL の最終アンピシリン溶液) 適切な抗生物質で LB プレートの種子。
- 収集し、(15 mL チューブ) の LB の 5 mL のいくつかの細菌のコロニーを成長します。
- 次の日はミニ準備キットでプラスミドを抽出します。
- 制限の酵素と遺伝子の挿入を分析します。
- 関連するコロニーをシーケンス シーケンスとリーディング ・ フレームがで示される手順 1.3) が正しいことを確認してください。
- 有能な細菌11に確認されたプラスミドを変換します。
- 氷の上の有能な細菌の 20 μ L を解凍します。
- 細菌にプラスミドの 1 μ L を追加し、20 分間氷の上を孵化させなさい。
- 45 42 ° C で s。
- LB の抗生物質なしの 200 μ L を追加します。
- 連続振動で 37 ° C で 1 時間インキュベートします。
- (例えば、0.1 mg/mL の最終アンピシリン溶液) 適切な抗生物質で細菌の成長板の種。
- 次の日は、0.1 mg/mL アンピシリン (~ 250 mL) と大規模なポンド容器の細菌のコロニーを成長します。
- 次の日は、キットによって提供される特定の手順に従ってマキシ準備を実行します。
注: エレクトロポレーション手順プラスミド量は下記のとおり、必要です。
2. BW 細胞キメラ蛋白質を表現するプラスミッドのトランスフェクション
注: transfection のための異なる方法を採用もできます (e.g。、レンチ ウイルス感染によって)。エレクトロポレーション、前に下記のとおり DNA のエタノール沈殿を実行します。次のステップでは、滅菌条件を必要とします。
- 前に、の日に備えるエレクトロポレーション BW5147 細胞 (「BW 細胞」)。10% ウシ胎仔血清 (FCS)、ピルビン酸ナトリウム 1%、1 %l-グルタミン、1% 非本質的なアミノ酸、1% 添加 RPMI 100,000 BW5147 細胞/mL (すなわち10 × 10 の6セルの合計) の 10 ml (10 cm) の 10 皿を板します。ペニシリン-ストレプトマイシン (「完全な媒体」)。
- 1.5-2 mL チューブに融合蛋白質を表現 pcDNA3 プラスミドの 100 μ g を置き、3 M 酢酸ナトリウム pH 5.3 5.5 で追加します。酢酸ナトリウムの量は 100 μ g のプラスミドの量の 0.1 (10%) に対応する必要があります; 酢酸ナトリウムの pH を pH 計を水酸化ナトリウムや塩酸を追加することにより滴定しなさい。
- ステップ 2.2 (プラスミッドおよびナトリウムのアセテートの合計量 × 2.5) で説明されているよう、プラスミドと酢酸ナトリウムの混合物を 2.5 倍量の 100% エタノールを追加します。70 ° C で 2 時間、-20 ° C で一晩インキュベートします。
- 2.4 24 h BW 細胞がめっきされた後 2 50 mL チューブのすべての BW セル (~ 100 mL) を収集します。515 x gで 5 分間細胞を遠心分離し、上澄みを廃棄します。
- 再 1 つの 50 mL チューブに RPMI-25 mL で両方のチューブからペレットを中断します。たとえば、再 RPMI-25 ml 1 管のペレットを中断し、単管の中の 25 mL で BW 細胞から合計ペレットが中断されて再、再他の 50 mL チューブに流体を中断するこの流体を使用します。
注: メディアする必要があります追加、血清はエレクトロポレーションを妨げる可能性がありますので。 - 515 x gで 5 分間のために再度細胞を遠心します。RPMI、1 mL にペレットを再停止し、氷の上内容を 0.4 cm キュベットに転送します。
- 16,000 x gと 4 ° C で 30 分のエタノールの沈殿物 (ステップ 2.3) を施行したプラスミドを遠心分離します。
- 70% エタノール 1 mL、x gと 4 ° C (塩を洗い流す) ~ 16,000 で別の 20 分間の遠心分離で一度洗います。
- すべてのエタノールを削除し、わずかに乾燥ペレット (すなわち、ティッシュ文化フードのオープン チューブで)。RPMI - 以前は 60 ° C に加熱を 100 μ l 添加の餌を再停止します。
- キュヴェットのセルに再度中断されたプラスミド (ステップ 2.8) を追加し、氷で 5 分間インキュベートします。
- Electroporate 0.23 でセル kV 250 精子。これは、〜 4 ms を取る必要があります。
- 50 mL のチューブに electroporated セルを転送、515 x g.で 50 mL の完全培地の 5 分間遠心を追加
- 上澄みを廃棄し、50 mL の完全培地で細胞を再度中断します。
- 24 ウェル培養皿 (50 ~ 井戸の合計のためのウェルあたり 1 mL) で electroporated 細胞をプレートし、37 ° C、5% CO2 48 h で孵化させなさい。
- 抗生物質と transfected セルを選択します。48 h 追加 1 mL の完全培地を各ウェル G418 を 10 mg/mL を添加した後 (この段階ではそれぞれの最終巻もは 2 mL、各 G418 の最終濃度も 5 mg/mL)。
注: プラスミッドに異なる抗生物質耐性がある場合この手順の前に融合 BW 細胞を殺すために必要な抗菌薬濃度を決定します。 - すべての 48 h は慎重に井戸の中を攪拌せず各ウェルの上限量の 1 mL を破棄 (BW 細胞は井戸の底にする傾向がある)。各ウェルに G418 を 5 mg/mL の完全培を追加し、各ウェルで最終巻は再び 2 mL ようにします。
- すべての井戸での細胞の培養皿を定期的に確認します。
注: 黄色に培地の色の変化は、成長している細胞を同定するのに役立つただし、初めに媒体になります黄色、G418 のため自体。肯定的な井戸 (細胞の増加とウェルズ) を識別します。これらの井戸は G418 耐性であり、融合蛋白質を表現すると予想されます。このプロセスは通常、〜 3 週間をかかります。
3 肯定的な井戸のセルに Transfected 受容体の発現の実証。
- トランスフェクションされた受容体に対する特異抗体を transfected BW 細胞を染色します。
- コントロール細胞 (融合 BW 細胞) の発現をフローサイトメトリーによる受容体の発現レベルを比較します。
- 1 つまたは複数の井戸の検証後、すぐに実験用セルを使用、文化で育つまたは将来のアプリケーションのための凍結します。
- 新しい実験を実行する前に transfected の受容体の発現を確認します。成長、安定した受容体の発現と G418 をセルの数週間後 G418 を培地から省略できます。
4. ターゲットを持つ BW Transfected セルのインキュベーション
注: 初めて transfected BW セルを使用する場合それは知られている興味の受容体のリガンドを表すターゲットまたはプレート連結抗体具体的関心 (架橋の受容体に対してそれらをテストすることをお勧め実験;以下を参照してください、セクション 4.2.1.3)。
- 好ましくは、(たとえば、新しい 10 cm 培養プレートで培養細胞の 2 mL を 10 mL の完全培を追加) した BW 細胞実験の前に 24 時間を分割します。
- ターゲットと transfected BW セルを孵化させなさい。同時に空のベクター (または親の BW 細胞) を表す制御 BW の細胞で実験を実行します。96F プレートが望ましい (ただし 96U プレートも使用できます)。3 通で実験を実行します。完全な媒体のすべてのセルを停止します。
- ターゲットを準備します。対象の型は、目的の関数として変化され、細胞、抗体や抗体だけで事前に培養されている細胞です。このシステムは、ターゲット5として、細菌に使用されています。
- ターゲット (つまりセルの行) のセルに分割されますアッセイの前に 6,000 の rad に放射線を照射します。96 板 (100 μ L のボリューム) の単一の井戸の標的細胞の場所 50,000。
- 抗体と人間の FcγRs を表す BW 細胞実験インキュベート 96 well プレートの氷に抗体を用いた標的細胞の (たとえば、標的細胞の 50 μ、50 μ L 抗体; の異なる抗体投与テストできます)。
- (架橋実験) のターゲットとして抗体だけを使用して、彼らはプレート バインドにはずです。この目的のためインキュベート 96F プレート (典型的な先発の線量は 50 μ L で特定の抗体の 0.5 μ g) 37 ° C および 5% の CO2 1-2 時間で完全な媒体中の抗体が最初。非連結の抗体を削除するプレートを洗います。
注: この場合、96F プレートになります transfected BW セルの付加の後 transfected 受容体の活性化につながるとプレートに抗体の結合。
- BW (エフェクター細胞) を追加します。96 板 (100 μ L のボリューム) の単一の井戸の 50,000 の BW セルを配置します。
- 必要に応じて 200 μ L を各ウェル内のボリュームを完了します。
- (この期間を調整することができます) 48 h の CO2を 37 ° C、5% で版を孵化させなさい。
- ターゲットを準備します。対象の型は、目的の関数として変化され、細胞、抗体や抗体だけで事前に培養されている細胞です。このシステムは、ターゲット5として、細菌に使用されています。
- 48 時間後-20 ° C および ELISA 前の雪解けでプレートを固定または ELISA をすぐに利用 (次の手順を参照してください)。
5. ELISA
- 抗マウス IL-2 抗体 (抗 mIL-2) elisa 用プレートをコートします。50 μ L/ウェル 1 × PBS の量に抗 mIL 2 0.05 μ g を配置します。2 h の 37 ° C、4 ° c 一晩アンチ mIL 2 抗体コーティングの elisa 用プレートを孵化させなさい。
注: インキュベーション ステップ直後後、ELISA を実行するには、elisa 用プレートがコーティングする 24 h BW 細胞の培養期間の終了前に。 - ELISA プレート内の流体を破棄し、ブロッキング液 (200 μ L/ウェル) 1x PBS と 1% ウシ血清アルブミン (BSA) で構成されているを追加します。室温で 2 h の elisa 用プレートを孵化させなさい。
- ELISA 0.05 %pbs トゥイーン ソリューション (すなわち、 1 リットル 1 × PBS の Tween 20 0.5 mL) を 3 回洗浄します。
- 彼らのターゲット (4.3) を添加して BW 細胞のある 96 プレートを取る。プレートが固定されている場合は、その完全に解凍 (e.g。 で、37 ° C で培養を短い)。(5 分、515 x g) 96 プレートを遠心し、慎重に各ウェルの上澄みの 100 μ L をプレコートとブロックの elisa 用プレートに転送。
注: セルを防ぐため各ウェルの側面から上澄みを収集すべき。 - 必要な場合は、ミル 2 の標準的な曲線を生成するコーティングの elisa 用プレートの空の行の 1 つに定義された濃度で組換えミル 2 を追加します。たとえば、2,500 pg/mL のミル 2 濃度から開始し、各後続の井戸; 50% 減、追加しないでくださいミル 2 の最後も。
- Elisa 用プレート 4 ° C 夜間、37 ° C 2 時間孵化させなさい。
- PBS トゥイーンで 4 回 elisa 用プレートを洗います。
- ビオチン抗マウス IL-2 を elisa 用プレートに追加します。1 mL の 1 %bsa を用いた 1 × PBS で 1 μ g 抗体の濃度を使用し、100 μ L/ウェルに分割します。
- 1 時間室温で孵化させなさい。
- 6 回 PBS トゥイーンと elisa 用プレートを洗います。
- HRP 標識ストレプトアビジンを追加します。1 ml 1 %bsa を用いた PBSX1 の濃度 1 μ L ストレプトアビジンを使用し、100 μ L/ウェルに分割します。
- 30 分間室温でインキュベートします。
- 6 回 PBS トゥイーンと elisa 用プレートを洗います。
- 基板の解決を TMB のウェルあたり 100 μ L を追加します。TMB を追加するときのタイムラグによる井戸の違いを最小限に抑えるために迅速にこの段階を完了します。
- 650 で ELISA プレート リーダーと elisa 用プレートを読む nm (読書をすることができます信号が弱いかどうかは繰り返される)。
結果
BW レポーターアッセイ系を用いた実験の結果を図 3に示します。この実験では、CLL 細胞プレインキュベートした異なる抗 CD20 抗体 (リツキシマブと obinutuzumab), 次いで共同エクスプレス CD16a CD3ζ transfected BW 細胞.私たちの研究9で同様の実験を行った。図 3 aは、色の鮮やかさがミル 2 の濃度に対応する生の elisa 用プレートのイメージを提示します。3 通で実験を行った。この実験にはいくつかのコントロールが含まれている: 親融合 BW 細胞 (上段) と CLL 細胞培養 CLL 細胞培養 CD16a CD3ζ を表現する BW 細胞が抗体なしまたはコントロール抗体 (左側の 2 番目の行で 6 井戸).抗 CD20 抗体を添加して事前 CLL 細胞 CD16 を表明した BW 細胞の培養は、ミル 2 ミル 2 コントロール井戸のレベルと比較しての重要な分泌を誘導されます。重要なは、抗 CD20 obinutuzumab と CLL 細胞の前培養では当社のシステムで締めくくっているを見つける知られているリツキシマブより強く CD16 アクティブになります。最後の行は、セルの追加) を除いた組換えミル 2 の事前に定義された濃度を降順を示しています。最後の行の右もミル 2 はありませんを表しコントロール ウェルズに似て表示されます背景読書。図 3 bは、図 3 aに示すように elisa 用プレートの結果の定量化を提示します。光学濃度 (OD) レベルは、組換えのミル - 2 標準曲線に基づくミル 2 濃度に変換されました。抗体の異なった線量が CLL 細胞プレインキュベートしたいた、次いで BW 細胞 CD16, 線量応答実験を図 3に示します。
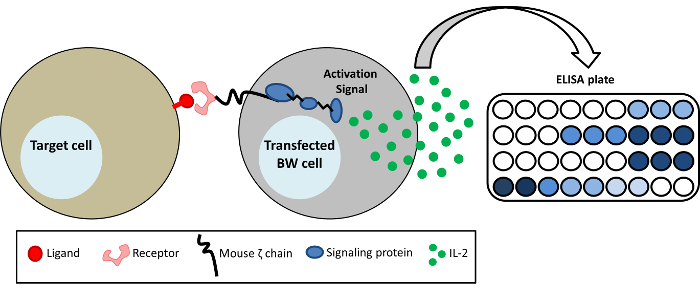
図 1: BW レポーター システムの略図。BW5147 細胞はマウス CD3ζ チェーン (キメラ recptor CD3ζ) の膜と細胞質ドメインに融合した異なった受容体の細胞外の部分と安定発現します。Elisa 法によって検出することができますミル 2 の分泌リガンドにより特定の受容体 CD3ζ の活性化。この図の拡大版を表示するのにはここをクリックしてください。

図 2: キメラ受容体 CD3ζ と PCR のプライマーの設計構造です。(細胞外の受容体 A) 一般的な構造は、マウス CD3ζ の膜と細胞内ドメインに融合。(B) 受容体の細胞外ドメインは、CD3ζ のヌクレオチドを含んだ 3' プライマーで増幅されました。(C) CD3ζ の細胞内と膜貫通ドメインは、受容体のヌクレオチドを含む 5' プライマーで増幅されました。(D) 最終的な PCR の反作用のシーケンスを重複している、両方のセグメントは、DNA のテンプレートとして使用されました。図のすべてのパネルで異なる蛋白質ドメインは色分けされ青い長方形 (CD3ζ シーケンス) および赤い (受容体シーケンス) の箱入り。この図の拡大版を表示するのにはここをクリックしてください。
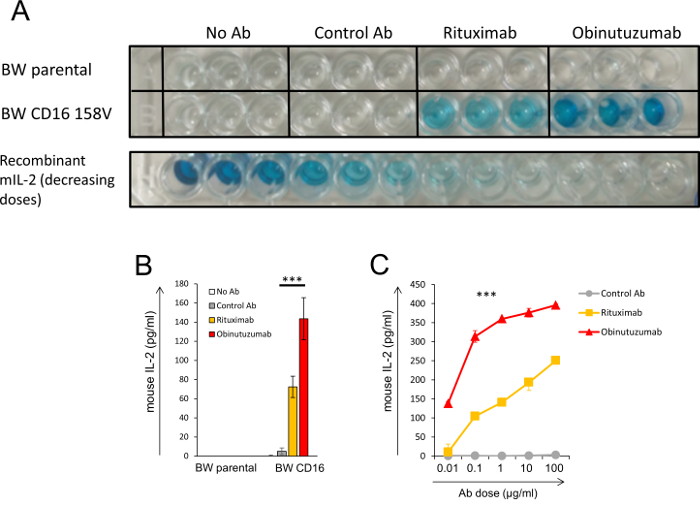
図 3: BW レポーター システムの最終製品のイラスト。(A、B、C)CLL 細胞は 2 つの抗 CD20 抗体 (リツキシマブと obinutuzumab) またはコントロール抗体の有無と前培養.その後、抗体が結合セル親 BW 細胞または CD16a CD3ζ を表現する BW 細胞による培養。清ミル 2 のレベルは、ELISA によって決定されました。(A) 生の elisa 用プレートのイメージです。色の濃さは、上澄みのミル 2 の濃度を示します。3 通で実験を行った。下段は、同じプレートに解析した遺伝子組換えミル 2 の濃度を減少させる ELISA 読み出しを示しています。(B) (A) に示すように読んで ELISA の定量化。ミル 2 レベルは、ミル 2 の標準曲線を算出しました。抗体の異なった線量が CLL 細胞プレインキュベートしたいた、次いで BW 細胞 CD16a CD3ζ, (C) 線量応答実験。、P < 0.001;スチューデントのt検定 (B) または ANOVA と多重比較 (C)。有意差はなかった (c) だけの比較は、リツキシマブと最初の濃度 (0.01 μ g/mL) Ab 制御のためだった。誤差範囲は、トリプリケートの標準偏差を表します。私たちの最近の研究9の 1 つの一部として同様の実験を行った。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
(1ではこのプロトコルの省略形を参照してください) 受容体-リガンド相互作用を調査するレポーター システムを生成するためのプロトコルをご紹介します。プロトコルは 3 つの主要部分から成る: CD3ζ、BW 細胞に融合蛋白質を表現するプラスミッドのトランスフェクションの細胞内ドメインに融合した特定の受容体の細胞外ドメインを含むキメラ蛋白質のクローニング (など、電気穿孔法による)、およびマウス IL-2 ELISA の定量的検出。これらの部品のそれぞれの最終製品を個別に確認する必要があります: ターゲット プラスミドの融合蛋白質の完全な配列によるクローン作成プロセスを確認必要があります、BW 細胞の遺伝子の発現を調べることによって検証すべき、BW の細胞 (例えば、フローサイトメトリーによる)、および ELISA プロセスへの関心の受容体は transfected BW セルの特定のコントロールを持つだけでなく、一般的な肯定的なコントロール (例えば、組換えミル 2) によって検証すべきすなわち、ターゲット目的 (例えば、BW 細胞、NK を表現する細胞受容体 2B4 のエクスプレス CD48 が肯定的な制御として使用できます、セル) の受容体の知られている配位子を表す。例えば、クローン作成プロセスが成功すると、ありますが、BW 細胞に融合蛋白質は示されていません。この場合、エレクトロポレーションを繰り返す必要があります。また、elisa 用プレートのバック グラウンド レベル上の信号がない場合 (特にポジティブ コントロール) transfected BW セル可能性があります失敗して受容器を表現する (または式は失われている) 中に技術的な問題が発生したかELISA プロセス。
このプロトコルにプロシージャの一般的な原則を維持しながらいくつかの変更が可能します。これらの変更は、BW セルとインキュベーションと ELISA ターゲット(例えば細胞、抗体等)の種類などに関する特定のパラメーターにプラスミドを株のメソッド融合蛋白質を表現するために使用するベクトル、標的細胞や抗体濃度 (井戸と先発の線量は 0.5 μ g/ウェルの抗体あたり 50,000 セル使用)、該当する場合の潜伏時間 (48 時間の培養時間を使用) と elisa 用プレートに転送される培養上清中のボリューム。
このメソッドは、特定し、簡単に定量化することができます。(配位子自体は認識されていない) 場合は特に特定の受容体のリガンドのスクリーニングに最適です。特定の受容体を発現する transfected BW 細胞の準備ができたら、これらの細胞を冷凍し、追加実験に必要なときに使用できます。私たちと他の人がこのシステム正常に使用前の研究で受容体-リガンド相互作用 (たとえば2,3,5,12,13,14 を探索するには、15,16) このシステムによって得られた結果は、他の技術によって検証されていると。このメソッドは、抗体、抗ウイルス抗体血清6,7、8 CD20 に対するモノクローナル抗体の行われている異なるヒト FcγR 受容体の活性化の研究にも使用できます。9。
内因性受容体、自然な細胞毒性の試金など追加実験によるこのシステムによって得られた知見を補完する必要がありますこれは、受容体の細胞外のセグメントだけを表現するレポーター システムは、NK との相互作用を研究するキラー (NK) 細胞は細胞受容体です。また、特定のリガンド ・受容体相互作用はレポーター システムでミル 2 分泌でない原因、見落されるかもしれない。さらに、任意の実験装置では、ように結果されたことを確認各種パラメーターの上記します。これは、2 つの条件の比較が必要 (例えば、異なった抗体による同じ Fc 受容体の活性化) がいる場合に特に重要です。また、特定のリガンド-受容体相互作用の感度がシステムの線形の範囲内にあることを確認することが重要です。そうでなければ条件が有効な比較を妨げることがあります飽和値にこの可能性があります。ミル 2 標準曲線を使用してだけでなく、テスト配位子をもつ用量反応曲線を生成することによって、これを実現できます (値を飽和の場合実験パラメーターが変更する必要があります;例えば、上清の小さいボリュームを分析し、elisa 法による)。このシステムのもう一つの可能な制限は、mIL-2 の (例えばマウス T 細胞) BW 細胞の IL-2 分泌を隠すという内因性分泌物と標的細胞の使用です。マウス細胞に限られている非常に珍しい出現するこれらを克服するために、標的細胞によって (例えばGFP) が表記されていない、異なるレポーターを使用してこのレポーター システムを改善できます。
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
著者は、エスターの歌手が言語編集をありがちましょう。この研究は、欧州連合の第 7 フレームワーク プログラム (FP/2007-2013) の下で欧州研究評議会によって支えられた/ERC 助成契約番号 320473-BacNK。私コア計画および予算委員会およびイスラエル科学財団のプログラムと私-コア クロマチンと RNA の遺伝子調節、GIF 財団、ルイスの家族財団、ICRF 教授グラントにさらなる支援が提供された、ヘルムホルツ イスラエル グラントそして Rosetrees 信頼 (O.M. すべて)。本研究は、イスラエル科学財団 (グラント 502/15)、Kass 医学研究賞と (セ) に対するイスラエル社会の血液と輸血からの研究助成金によっても支えられました。O.M は分子免疫学の冠教授です。
資料
| Name | Company | Catalog Number | Comments |
| AccuPrep, Plasmid Mini Extraction Kit | Bioneer | K-3030 | |
| Anti-mouse IL-2 | BioLegend | 503702 | |
| Biotin anti-mouse IL-2 | BioLegend | 503804 | |
| ELISA plates | De-groot | 60-655061 | |
| Fetal Bovine Serum | Sigma | F7524-500ml | |
| G418 | Mercury | MBS3458105GM | |
| Gene Pulser II | Bio-Rad | 165-2105, 165-2106, 165-2107, 165-2108, 165-2109, 165-2110 | |
| L-Glutamine | Biological industry | 03-020-1B | |
| MEM Non-Essential Amino Acids Solution | Biological industry | 01-340-1B | |
| Penicillin-Streptomycin Solution | Biological industry | 03-031-1B | |
| peroxidase streptavidin | Jackson ImmunoResearch | 016-030-084 | |
| PureLink HiPure Plasmid Filter Maxiprep Kit | ThermoFisher Scientific | K210016 | |
| RPMI-1640 Medium | Biological industry | 30-2001 | |
| Sodium Pyruvate | Biological industry | 03-042-1B | |
| TMB | SouthernBiothech | 0410-01 |
参考文献
- Mandelboim, O., Lankry, D., Gazit, R. . Natural Killer Cell Protocols. , 258-262 (2010).
- Mandelboim, O., et al. Recognition of haemagglutinins on virus-infected cells by NKp46 activates lysis by human NK cells. Nature. 409 (6823), 1055-1060 (2001).
- Stanietsky, N., et al. The interaction of TIGIT with PVR and PVRL2 inhibits human NK cell cytotoxicity. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17858-17863 (2009).
- Stanietsky, N., et al. Mouse TIGIT inhibits NK-cell cytotoxicity upon interaction with PVR. European Journal of Immunology. , (2013).
- Gur, C., et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack. Immunity. 42 (2), 344-355 (2015).
- Corrales-Aguilar, E., et al. A novel assay for detecting virus-specific antibodies triggering activation of Fcgamma receptors. Journal of Immunoogical Methods. 387 (1-2), 21-35 (2013).
- Corrales-Aguilar, E., et al. Highly individual patterns of virus-immune IgG effector responses in humans. Medical Microbiology and Immunology. 205 (5), 409-424 (2016).
- Radinsky, O., et al. Sudan ebolavirus long recovered survivors produce GP-specific Abs that are of the IgG1 subclass and preferentially bind FcgammaRI. Scientific Reports. 7 (1), 6054 (2017).
- Elias, S., Kahlon, S., Kotzur, R., Kaynan, N., Mandelboim, O. Obinutuzumab activates FcgammaRI more potently than other anti-CD20 antibodies in chronic lymphocytic leukemia (CLL). Oncoimmunology. 7 (6), e1428158 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), 253 (2007).
- Bar-On, Y., et al. NKp46 Recognizes the Sigma1 Protein of Reovirus: Implications for Reovirus-Based Cancer Therapy. Journal of Virology. 91 (19), (2017).
- Glasner, A., et al. Expression, Function, and Molecular Properties of the Killer Receptor Ncr1-Noe. Journal of Immunology. 195 (8), 3959-3969 (2015).
- Glatzer, T., et al. RORgammat(+) innate lymphoid cells acquire a proinflammatory program upon engagement of the activating receptor NKp44. Immunity. 38 (6), 1223-1235 (2013).
- Gur, C., et al. The activating receptor NKp46 is essential for the development of type 1 diabetes. Nature Immunology. 11 (2), 121-128 (2010).
- Markel, G., et al. Pivotal role of CEACAM1 protein in the inhibition of activated decidual lymphocyte functions. Journal of Clinical Investigation. 110 (7), 943-953 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved