Method Article
Разгадке ключевые игроки гуморального иммунитета: Расширенный и оптимизированный протокол лимфоцитов изоляции от патчи Пейера в мышиных
В этой статье
Резюме
В этом исследовании мы представляем Роман и эффективного протокола для изоляции лимфоциты от Пейера (PPs), которые могут быть впоследствии использованы в vivo и in vitro функциональных анализов, а также поток гранулярных исследования фолликулярной T вспомогательные и зародышевого центра B клетки.
Аннотация
В слизистой оболочке кишечника иммунные клетки представляют собой уникальный иммунологические сущности, которая способствует иммунной толерантности при одновременно присвоении иммунной обороны против патогенов. Хорошо известно, что Пейера (PPs) играют важную роль в слизистой иммунной сети хостинг нескольких эффекторных T и B клетки подмножеств. Некоторая часть этих клеток-эффекторов, фолликулярная Т-хелперов (ЦГЗ) и клетки B зародышевого центра (GC) профессиональную в регуляции гуморального иммунитета. Таким образом характеристика эти подмножества ячеек в PPs с точки зрения их дифференциации программы и функциональных свойств могут обеспечить важную информацию о слизистой иммунитета. С этой целью легко применимые, эффективной и воспроизводимый метод лимфоцитов изоляции от PPs будет ценным для исследователей. В этом исследовании мы стремились создать эффективный метод для изоляции лимфоцитов из PPs мыши с высоким клетки доходности. Наш подход показал, что первоначальный ткани, обработки, например использование пищеварительной реагентов и ткани агитации, а также ячейки окрашивание условий и выбор панелей антитела, имеют большое влияние на качество и личность изолированных лимфоцитов и на экспериментальные результаты.
Здесь мы описываем протокол позволяет исследователям эффективно изолировать популяций лимфоцитов из PPs, позволяя воспроизводимого потока цитометрии-оценки на основе подмножеств T и B cell, сосредоточиваясь в первую очередь на TFH и GC B подмножества ячеек.
Введение
Всего желудочно-кишечного тракта от начала до конца палубных с обширной сетью лимфоидной, содержащий иммунных клеток, больше чем любой другой орган человека и мыши1. Пейера в патчи (PPs) являются одним из основных компонентов кишечника отделения этой клеточных иммунных Организации, так называемые кишечнике связанных лимфоидной ткани (GALT)2,3. В PPs, тысячи миллионов антигенов, производный от пищевых материалов, синантропных микробиоту и патогенов будучи непрерывно, и при необходимости соответствующие иммунных реакций к ним смонтированные таким образом поддерживая кишечной иммунной гомеостаз. В этом смысле PPs может называться «миндалин кишечника». PPs состоят из основных суб отсеков: Субэпителиальная купол (SED), большие зоны B-клеток фолликула; эпителия вышележащих связанные фолликула (инженер) и межфолликулярных области (IFR) где T-клетки расположены4. Этот уникальный дробления PPs позволяет различных эффекторных клеток подмножеств сотрудничать, таким образом, наделяет туберкулина в кишечнике.
PPs не хватает афферентные лимфатические, и по этой причине, антигены, перевезены в PPs из тонкой кишки не проводятся через лимфатические сосуды в отличие от большинства других лимфоидных органов. Вместо этого специализированные эпителиальные клетки, расположенные в фей, так называемые M клеток, отвечают за передачу Люминал антигенов в PPs5. Впоследствии, перевозимых антигены подобрал дендритных клеток (DCs) и фагоциты, которые расположены в регионе Субэпителиальная купол (SED) под FAE6,7. Этот процесс сортировки антигена, DCs в PP важно инициировать адаптивного иммунного ответа8 и последующее поколение IgA, секреции клетки9.
Из-за антигенные бремя от синантропных флоры и пищевых материалов PPs хост эндогенно активированного эффекторных T и клетки B подмножества в большой обилия например TFH и IgA+ GC B клеток10, предложив, что PPs представляют сайт активной иммунной 11ответ. Обнаружение до 20-25% TFH клетки в течение всего CD4+ T Мобильный отсека и до 10 – 15%, GC B клетки в течение всего клетки B возможен в PPs, собранных от неиммунизированных молодых мышей C57BL/612. В отличие от других типов вспомогательные клетки T (т.е., Th1, Th2, Th17 клетки), TFH клетки показывают уникальные тропизм в клетки B фолликулы главным образом благодаря CXCR5 выражение, которое способствует TFH клеток самонаведения вдоль градиента CXCL1313. В зонах B клеток фолликула PPs TFH клетки вызывают рекомбинации переключатель класса IgA и соматические Гипермутационный в активированные клетки B, из которых высокоспецифичные IgA производства клеток дифференцировать14. Впоследствии эти антитела секретирующих плазматических клеток миграции propria пластинки (LP) и регулировать иммунного гомеостаза в кишечнике10.
Определение и характеристика TFH и GC B клеточных популяций в PPs может позволить исследователей для изучения динамики гуморального иммунного ответа в условиях устойчивого состояния без необходимости длительной иммунизации моделей традиционно используется в TFH-GC B клеток исследования15,16,17,18. Анализируя TFH клетки в PPs не так просто, как другие клетки подмножеств. Технические проблемы включают в себя выявление условий приготовления идеальной ткани, поверхности антитела маркер комбинация, а также выбрав соответствующие положительной и отрицательной контроля. TFH и PP поля исследования демонстрируют большое разнообразие с точки зрения экспериментальной процедуры и далеки от наделения консенсуса для установления стандартизованных протоколов по нескольким причинам. Во-первых каждого подмножества ячеек в пределах PPs, как правило, быть затронуты дифференциально условий приготовления тканей, требующих дальнейшего изменения подмножества конкретным образом клетки. Во-вторых существует значительное расхождение среди сообщаемых методов относительно деталей подготовка клетки от PPs. третьего, количество на основе протокола сравнительных исследований, изучения методов подготовки идеально тканей и экспериментальных условий для PP и ЦГВЗ исследования является довольно ограниченной.
Текущие исследования на основе протокола предложил для PP ячейки подготовка19,20,21,22 были не TFH - или GC клетки B ориентированный. Кроме того, были найдены некоторые условия подготовки ткани, рекомендуется для PPs19,20 , например на основе коллагеназы пищеварение негативно повлияли на результат идентификации TFH подачей cytometry18. Исходя из этого мы полагали, что оптимизированные, стандартизированных и воспроизводимые протокол, который может использоваться для изучения TFH и GC B динамика клеток в PPs будет ценным для следователей, работающих по этой теме. Эта потребность дал нам стимул для создания улучшение и современный протокол для изоляции и характеристика лимфоцитов PP, мелко оптимизированную для клеточного восстановления, жизнеспособности и эффективности для потока гранулярных характеристика несколько T и B подмножества ячеек. Мы также стремились исключить несколько трудоемкий подготовительных шагов, предложенных в предыдущих протоколах, таким образом, снижая необходимые манипуляции и времени для подготовки ткани и клетки от PPs.
протокол
Руководящие принципы согласно институциональный уход животных и использование Комитет (IACUC) Бет Израиля Deaconess медицинский центр были проведены все исследования и эксперименты, описанные в настоящем Протоколе.
1. проектирование экспериментальной установки и мыши групп
- (Необязательно) Совместное дом экспериментальной мышей для облегчения горизонтальной передачи кишка микробиоты между экспериментальной мышей и уменьшить неспецифической изменчивости в пределах PP лимфоцитов. Кроме того использование элементов управления помёте того же пола для минимизации изменчивости.
2. Хирургическое иссечение и ткани подготовительные шаги:
- Хирургическое удаление тонкой кишки (SI)
- Усыпить мышей с использованием CO2 удушья или любой эквивалентный метод, одобренный Комитетом по институциональной животных этики.
- Передача мыши на выделенной области для хирургического иссечения. Положите зад и дезинфицировать живота с 70% этиловом спирте. Выполните лапаротомия путем разрезания живота кожи и брюшины вдоль средней линии от лобка до грудной клетки, брюшной полости, открывая таким образом.
Примечание: Выполните первый разрез на относительно небольшой участок кожи, чтобы избежать проникновения брюшной полости и повреждения кишечных тканей. Продолжать иссечение до желаемого анатомические границы. - Определите caecum, который является идеальным вехой для обнаружения терминала подвздошной кишки, которая представляет собой Дистальный сегмент тонкой кишки.
Примечание: Обычно Caecum расположен на нижней левой части живота мыши. - Определить ileocaecal перекрестка и сделать надрез на этом уровне дистальных, как можно отделить от caecum тонкой кишки. На протяжении следующих шагов Избегайте чрезмерного физического контакта с кишечной стенки, потому что хрупкие PPs свернуть легко на ощупь.
- Аккуратно удалите весь кишечник до привратник путем разрезания брыжейке, используя ножницы. Идентифицировать стыке Пилора и двенадцатиперстной кишки, и СНиП двенадцатиперстную кишку на этом уровне, что приведет к полный отряд кишечник от брюшной полости.
Примечание: (i) Избегайте гиперэкстензии как это может привести к разрыву кишечной стенки. (ii) если LP лимфоцитов изоляции помимо PP лимфоцитов, необходимо полное удаление верхней брыжеечной жира. Однако для изоляции PP только, оставаясь брыжеечных жира может предоставить некоторые преимущества во время дальнейших шагов изоляции; Таким образом она должна быть сохранена. - Отдельностоящий тонкий кишечник в 6-ну пластины, наполненный холодной RPMI + 10% плода бычьим сывороточным (ФБС) и аккуратно агитировать ткани вручную до тех пор, пока все кишечные сегменты погружали в холодной средства массовой информации. Поддержания тканей на льду на протяжении последующих шагов.
- После рассечения желаемое количество мыши тонкий кишечник, перейдите к PP иссечение из собранных тонкий кишечник.
- Хирургическое иссечение PPs и подготовка одноклеточного подвеска:
- Аккуратно передачи в тонком кишечнике на бумажное полотенце, захвата верхней брыжеечной жира с помощью щипцов и место верхней брыжеечной стороной бумажным полотенцем. Смочите весь кишечный сегмент с холодной RPMI + 10% FBS, чтобы избежать обезвоживания тканей и липкость.
Примечание: Оставшиеся брыжеечных жира может быть полезным на данном этапе потому, что сегменты жировой ткани на участке верхней брыжеечной SI будет прилипать к бумажным полотенцем, сохраняя анти брыжеечных сайта вверх. - Определите PPs, которые появляются как белый мульти lobulated агрегатов в форме «цветной капусты как» на стороне анти брыжеечных кишечной стенки.
Примечание: Промывка Люминал содержимого не рекомендуется до тех пор, пока все PPs обрезанию. Опорожнение Люминал содержание может привести к краху PPs и предотвратит цветового контраста между PPs и кишечной стенки, которая очень полезна для визуальной идентификации PPs. - После выявления PPs на стороне анти брыжеечных, место хирургический изогнутый конец ножниц на PPs (кривая должна противостоять) запретительных PP от проксимальных и дистальных границы.
Дополнительно: Push PP плавно спускающемся лезвия ножниц с помощью пальца. Этот маневр приведет к лучше исключение окружающие ткани-PP. Акцизный PPs мягко, исключая окружающие ткани кишечника.
Примечание: (i) этот шаг имеет решающее значение для получения максимальной доходности PP клеток при сведении к минимуму загрязнение клетки из соседних кишечных отсеков как LP и кишечного эпителия, которые также богаты в Т-клеток. (ii) от одного SI иссечена от мыши C57BL/6 5-10 PPs (средний размер, мульти lobulated) могут быть собраны. С целью еще меньше PPs (не мульти lobulated), коллекция до 12-13 PPs на мышь (C57BL/6) можно, используя этот протокол. - Передачи подакцизным PPs плиты культуры ткани 12-хорошо наполненный ледяной RPMI + 10% FBS и поддерживается на льду, с помощью щипцов или изогнутые ножницы хирургические.
Примечание: (i) сразу же после иссечения PPs, слизи и кишечного содержимого на PP поверхности могут быть очищены, потерев ткани мягко на бумажное полотенце. Этот шаг поможет улучшить жизнеспособность лимфоцитов PP. (ii) вместо передачи PPs на тарелку, передачи отделены трубы могут также считаться в зависимости от числа общей выборки. - Опционально: После завершения PP иссечение и последующего размещения в пластину хорошо, количество и размер PPs, собранных из различных экспериментальных/мыши групп может быть документально принимая картину пластину культуры ткани, содержащие PPs.
- Подготовить набор 50 мл конические трубы заполнены с 25 мл RPMI + 10% FBS (предварительно нагревают при 37 ° C). Использование ножницами, вырежьте края кончик 1000 мкл от расстояния, которое позволит стремление PPs с Пипетка 1 мл. Аспирационная PPs с 1 мл пипетки и передавать их от плиты культуры ткани 12-хорошо подготовленные 50 мл конические трубы.
Примечание: Используйте новый наконечник для каждого образца мыши чтобы избежать перекрестного загрязнения среди образцов. - Безопасный крышку и трубок вертикально в орбитальный шейкер при 37 ° C, с непрерывной агитации за 10 мин на 125 – 150 об/мин. Тем временем подготовить новый набор 50 мл трубки и место стрейнер клеток 40 мкм на вершине каждой трубе, через который будет подготавливаться одноклеточного подвеска.
Примечание: (i агитация шаг удалит оставшиеся кишечных содержание, слизи и ячейки мусор, который уменьшить жизнеспособность клеток и восстановления PP лимфоцитов, если не удалены. (ii) не применяются любые виды пищеварительных ферментов на PP ткани, потому что процесс пищеварения приводит к драматической потере CXCR5 выражения из клеточной поверхности. - После агитации передать PPs ситечко клеток 40 мкм, помещены на вершине свежеподготовленные конические 50 мл трубки. Используя закругленными сторону поршень шприца 10 мл, аккуратно сорвать PPs через сито ячейки, чтобы генерировать одну ячейку подвеска. Промойте ситечко с 15 – 20 мл холодного RPMI + 10% FBS.
Примечание: (i) до фильтрации, встряхните пробирки, содержащие PPs горизонтально. Этот короткий трясти будет способствовать передаче PPs в ячейки сита. (ii) с помощью стрейнер ячейки 70 мкм для изоляции не лимфоидные клетки иммунной системы (например., моноциты, макрофаги, DCs) рекомендуется. - Центрифуга для одной ячейки суспензий на 350 – 400 x g 10 мин при 4 ° C.
- Тщательно удалить супернатант и Ресуспензируйте клетки в концентрации 10 х 106 клеток/мл. Подсчет количества ячеек с помощью Горяева.
Примечание: (i) до подсчета клеток, общий мобильный номер для каждой мыши PP группы можно приблизительно оценить по следующей формуле: «0.5-1 х 106 клеток x (количество PPs) = Общая клеток». Могут потребоваться дальнейшие разведений с Трипановый синий для подсчета клеток. (ii) в качестве альтернативы ручной подсчет может использоваться автоматизированные ячейки счетчики. - 2-2,5 х 106 клеток в соответствующий объем передачи (например., 200 мкл) в 96-луночных раунд-днище.
Примечание: Для одного цвета и отрицательных контрольных образцов, 0.5-1 х 106 клеток может быть достаточно. - Центрифуга пластину на 350 g x 5 мин при 4 ° C. Проведите пластины.
- Вымойте клетки в 200 мкл буфера пятнать.
- Аккуратно передачи в тонком кишечнике на бумажное полотенце, захвата верхней брыжеечной жира с помощью щипцов и место верхней брыжеечной стороной бумажным полотенцем. Смочите весь кишечный сегмент с холодной RPMI + 10% FBS, чтобы избежать обезвоживания тканей и липкость.
3. поверхности антитело пятная
- Жизнеспособность окрашивание:
- После окончательной стирки Ресуспензируйте клетки в 100 мкл поправимо жизнеспособности краски разводят в PBS (1:1, 000). Инкубируйте 30 мин на льду или на 4 ° C в темноте.
Примечание: (i) внутриклеточных окрашивания для выявления ключевых транскрипции такие факторы, как Foxp3 или Bcl-6 требует фиксации клеток. В этом случае не поправимо жизнеспособности красители (например., 7-AAD, DAPI) не может использоваться. (ii) для разбавления поправимо жизнеспособности красителя, не использовать любой окрашивание буфер, который содержит белок. Средства массовой информации, используемые в этом этапе должна быть белка бесплатно. (iii) исключения омертвевших клеток с помощью окрашивания жизнеспособности важно, потому что мертвые клетки могут вызвать серьезные технические трудности в анализе потоков цитометрии, испуская аутофлюоресценция и связывая поверхности антител nonspecifically, которые могли бы привести к ложь положительные результаты. - Вымойте клетки дважды с пятнать буфера. Центрифуга на 350 x g 5 мин при 4 ° C. Проведите пластины.
- После окончательной стирки Ресуспензируйте клетки в 100 мкл поправимо жизнеспособности краски разводят в PBS (1:1, 000). Инкубируйте 30 мин на льду или на 4 ° C в темноте.
- Блок ФК и поверхности - слоя I:
- Приготовляют раствор Fc блока путем разбавления антитела анти CD16/32 (1: 200) в пятнать буфера.
- Ресуспензируйте клетки в 20 мкл приготовленный раствор Fc блок. Инкубируйте 15 мин на льду.
- Без стирки, добавьте 80 мкл поверхностных антител коктейль (см. таблицу 1 на суммарные антитела) подготовлен на соответствующих разведений. Инкубируйте на льду, по крайней мере 30 минут.
- Мыть дважды добавляя чрезмерное окрашивание буфера. Центрифуга на 350 x g 5 мин при 4 ° C. Проведите пластины.
- Поверхности - слой II:
- Подготовьте окрашивание решения стрептавидина путем разбавления конъюгированных флюрохром стрептавидина окрашивание буфера.
- После окончательной стирки Ресуспензируйте клетки с 100 мкл предварительно разбавленного стрептавидина (1: 100), окрашивание раствора. Инкубируйте по крайней мере 15 минут на льду в темноте.
- Дважды промыть пятнать буфера. Центрифуга на 350 x g 5 мин при 4° C. Проведите пластины.
Необязательно: Если внутриклеточного пятная для обнаружения фолликулярной регулирования Т-клеток не желателен, после последнего мыть, Ресуспензируйте клетки в 200 мкл окрашивания буфер и передачи в соответствующие трубы для получения данных в проточный цитометр. Когда образцы не являются фиксированными, приобретение данных подачей cytometry должно выполняться в течение 3-4 ч для получения точных результатов.
4. клетки фиксации
- Подготовьте фиксации/permeabilization (исправить/Пермь) рабочим раствором с помощью реагентов от Foxp3/транскрипция фактор пятнать буфера набора. Смешайте одну часть фиксации/permeabilization концентрат с тремя частями фиксации/permeabilization разбавителя для желаемого конечного объема.
- После окончательной стирки Ресуспензируйте клетки в 200 мкл рабочего раствора исправить/Пермь.
- Инкубируйте пластину на льду или на 4 ° C в течение 20 мин. Не превышать 20 минут для этого шага. Длиннее время инкубации может серьезно уменьшить восстановления клеток.
- Центрифуга на 350 x g 5 мин при 4 ° C. Проведите пластины. (Необязательно) После этого шага, фиксированные клетки могут храниться в течение нескольких дней на 4 ° C в буфере с бычьим сывороточным альбумином (БСА) пятнать или FBS до последующего приобретения внутриклеточных пятнать или потока цитометрии.
- Ресуспензируйте клетки в 200 мкл permeabilization буфера (x1) свежезаваренным предварительно разводят в очищенной деионизованной воде.
- Центрифуга на 350 g x 5 мин при комнатной температуре (RT).
- После промойте 200 мкл буфера permeabilization и центрифуги на 350 x g 5 мин на RT.
5. внутриклеточных пятнать
- Приготовляют раствор Fc блока путем разбавления антитела анти CD16/32 (1: 200) в буфер permeabilization.
Примечание: После фиксации шага, клетки должны поддерживаться в буфер permeabilization до конца процесс внутриклеточного окрашивание. - После окончательной стирки Ресуспензируйте клетки в 20 мкл раствора Fc блок. Инкубируйте на 10-15 мин на RT в темноте.
- Без стирки, добавьте 80 мкл внутриклеточных антитела коктейль (100 мкл окончательный объем) предварительно разводят в буфер permeabilization. Инкубируйте 30 мин на RT.
- Добавить 100 мкл буфера Пермь, и центрифуги на 350 g x 5 мин на RT.
- Один раз Помойте с 200 мкл буфера permeabilization, центрифуги на 350 x g 5 мин на RT.
- После окончательной стирки Ресуспензируйте клетки в 200 мкл окрашивания буфера и передавать клетки в соответствующие трубы (окончательный объем 400 мкл окрашивание буфера) и приобретать данные подачей cytometry. Образцы, окрашенных в 96-луночных пластины могут также работать без передачи в трубы, если проточный цитометр с пластины читателя параметр доступен. Этот шаг минимизирует потери клеток во время передачи клеток.
- Приобрести не менее 5 х 105 всего клеток на проточный цитометр, чтобы иметь возможность выполнить воспроизводимость анализа ЦГВЗ, ОКР, а также клетки GC B.
Результаты
В отличие от предыдущих протокол20, мы наблюдали, что PPs не распределяются равномерно по всему Си, но локализованы более плотно к проксимальных и дистальных концов Си, как показано в Рисунок 1A. Потока гранулярных анализ показал, что, если правильно выполнены, наш протокол дает населения лимфоцитов PP, который демонстрирует вперед стороне разброс распределение похож на splenocytes (рисунок 2AE и 2D, H) с > 95% клеток жизнеспособность (Рисунок 2B и 2F). В отличие от других вторичных лимфоидных органов (SLO), мышей C57BL/6 примерно 70-80% всего PP лимфоцитов состоят из клетки, тогда как CD4+ T клетки составляют лишь 10 – 15% всего PP-лимфоцитов (рис. 2 c и 2 G).
Обратите внимание, что CD4+ CD19+ клетки двойной положительный (DP) составляют ≈ 1% всего PP лимфоцитов. С некоторые меры предосторожности во время подготовки клетки как выполнение Fc-блок против Fc рецепторов клеток B и исключая Дуплеты, CD4+ CD19+ DP популяции клеток может быть свернут (рис. 3A и B). Однако, часть DPs, не демонстрируют характеристики Дуплеты вперед точечной (FSC) является неизбежным и следует воротами от одного позитивного T и B cell ворот (рис. 3B). Наши результаты показали, что клетки B внутри клетки DP высоко Экспресс CXCR5 на их поверхности (рис. 3 c), что может привести к ложных положительных результатов в ворота ЦГВЗ, который корректируется на основе CXCR5 выражения в CD4+ T клетки. С другой стороны, мы обнаружили, что GL7, маркером активированных клеток B, также выражается в CD4+ CD19+ DP клеток (рис. 3D), которая может вызвать помехи стробирования клетки GC B.
Примеры TFH и GC B ячейки стробирования алгоритмы изображены на рисунке 4. GC B клеток стробирования, мы используем GL7 маркировки по сравнению с CD38, который идентифицирует клетки GC B как GL7+ CD38 клетки B– (рис. 4A-B). ПНА маркировка может использоваться вместо GL723 , тогда как CD38 могут быть заменены одним из следующих маркеров: IgD, Bcl-6 и CD95. Альтернатива стробирования стратегии для клетки GC B демонстрируются в Рисунок S1. GC B соотношение клеток в PPs показывает большой изменчивости в мышей C57BL/6. Однако по сравнению с другими SLOs, PPs имеют значительно выше соотношение клеток GC B с кругом 2-10% от общего числа B клеток в условиях устойчивого состояния. Стробирования стратегия для PP TFH клетки описано как CD19– CD4+ PD-1Привет CXCR5+ Т-клеток (рис. 4A, C). «Зебра печати» был найден оптимальный демонстрации методом для TFH стробирования как он изображает PD-1Привет населения более дискретно по сравнению с другими типами участок (рис. 4 c). СКР, подмножества ячеек ЦГВЗ, выражая Foxp3, являются воротами как CD19– CD4+ PD-1Привет CXCR5+ Foxp3+ Т-клеток (рис. 4 d). Как клетки GC B, часть клеток TFH также варьируется в неиммунизированных мыши лиц с кругом 10 – 20% от всего CD19– CD4+ PP лимфоцитов. Подробности альтернативных стробирования алгоритмов для клетки TFH описаны в Рисунок 4E, F и Фигура S1C, D.
Чтобы избежать ложных позитивность вследствие окрашивания фона и аутофлюоресценция, изотипа или альтернативных эквивалентные элементы управления например флуоресценции минус один (FMO) должны включаться в панели окрашивание как отрицательный контроль для TFH и GC B ячейки маркеры ( Рисунок 4 g-J).
Для оптимизации условий для подготовки ткани PP, мы разработали Роман внутренне контролируемые экспериментальные стратегию, в которой PPs были собраны от одного индивидуального мыши и пул отдельно в зависимости от их анатомического происхождения (например., двенадцатиперстной кишки, подвздошной). Для проведения экспериментов, обобщённые PPs были назначены отдельным группам так что каждый экспериментальной и контрольной группы входит равное количество PPs от каждого анатомического региона (Рисунок 5A). Этот подход, мы обнаружили, что на основе коллагеназы ферментативного пищеварения (протестировано на 37,5 мг коллагеназы II или IV на 25 мл смеси пищеварения = 1,5 мг/мл), который обычно используется для изоляции лимфоцитов из различных тканей слизистых оболочек, значительно сокращена CXCR5 выражение в PP лимфоцитов (Рисунок 5B), особенно в клетках TFH (Рисунок 5F-я), в то время как выражение других поверхностных молекул (например., CD19, CD4) остались нетронутыми (Рис. 5 C-E). Снижение CXCR5 обнаружения был видно, так что выражение CXCR5 на лечение коллагеназы TFH клетки был почти неотличимы от изотипа управления (Рисунок 5F-я). Дальнейшие эксперименты показали, что уровень вмешательства ферментативного пищеварения с выражением CXCR5 зависит от CXCR5 антитела клон используется (Рисунок 6A-F). В частности после лечения II коллагеназы, способность обнаружения CXCR5 антитела клон 2 g 8 был более существенно ослабленным, чем способность обнаружения антител клона CXCR5 L138D7 (Рис. 6A-D).
Ферментативный пищеварения сокращено не только выражение CXCR5, но и доля всего лимфоцитов внутри клетки PP определяется характеристиками FSC-SSC, хотя значительная часть клеток, изолированных от переваривается PPs выставлена вперед и боковые разброс большей интенсивностью, чем PP лимфоцитов (Рисунок 7а C). Воздействию коллагеназы на восстановление клеток произошла в зависимости от дозы (рис. 7A, H-J). Ферментативный пищеварения увеличение жизнеспособности клеток (рис. 7 d, E). Однако, это преимущество не связана causatively с коллагеназы пищеварение потому что клетки изолированы от PPs после агитации без коллагеназы были благоприятствования аналогично (рисунок 7F). Обнаружения ядерного транскрипционного фактора Foxp3, который представляет особый интерес здесь потому, что обычно оценивается во время TFH изоляции для выявления TFR клетки, была улучшена путем перемешивания при 37 ° C независимо от коллагеназы пищеварения (Рисунок 7G ).

Рисунок 1: макроскопический структуры и анатомического распределения мышиных Пейера. (A). изображения, полученные из двенадцатиперстной кишки конец тонкой кишки с желудком. С черными стрелками указаны два близко расположенными PPs в двенадцатиперстную кишку. (B). PPs, собранных из одиннадцати мышей C57BL/6 хранились отдельно в 12 хорошо плиты. (C). образ PPs свежезаваренным подакцизным мыши отображается на сито клеток 40 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
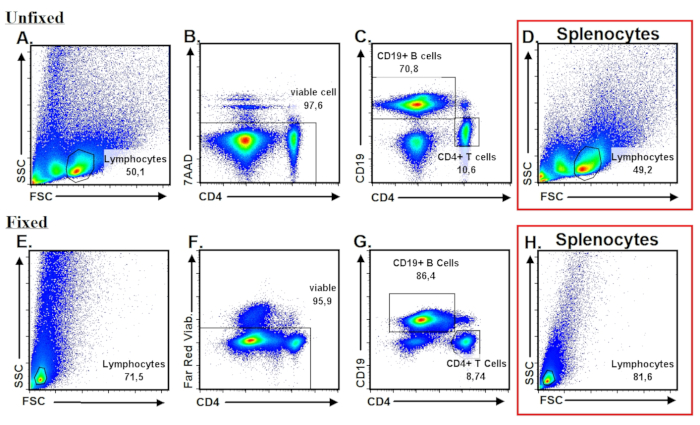
Рисунок 2: поток гранулярных характеристика и основные стробирования алгоритм для PP лимфоцитов. (A). точка участки продемонстрировать распределение свежевыделенных нефиксированных PP лимфоцитов по осям FSC и SSC, которые exhibit большое сходство в splenocytes, изображенные в (D). (B). исключение омертвевших клеток с помощью выражения 7AAD. 7AAD– клетки представляют собой живые клетки. (C). CD19 и основанные на CD4 Иммунофенотипирование клеток T и B среди предварительно условного живых клеток PP. (E-G). Анализ представительных потока фиксированных PP лимфоцитов. (H). Представитель потока характеристики фиксированной splenocytes. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: CD4+ CD19+ двойной положительный (DP) клетки причиной ложных положительности в TFH и GC B клеток стробирования. (A). CD4+CD19+ DP продемонстрировал лимфоцитов в живые клетки PP. (B). разделение DP клетки основанный на характеристиках FSC как Дуплеты и фуфайки. (C,D). CXCR5 и GL7 выражение DP клеток изображены в участков гистограммы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
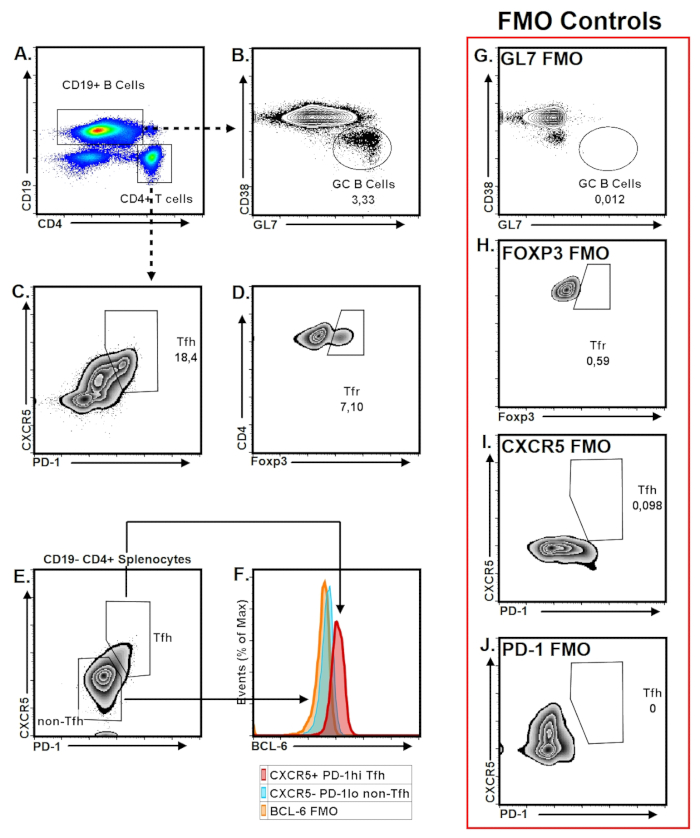
Рисунок 4: представитель TFH и GC B мобильный стробирования стратегии. С 3 - месячного мыши были собраны PPs и лимфоцитов были изолированы, как описано в разделе протокол. (A) CD19 и CD4 маркировки живой PP лимфоцитов изображены. (B) CD38Ло GL7ПриветCD19+ B клетки были закрытого как клетки GC B. (C) TFH клетки были закрытого как CXCR5+PD-1Привет CD4+ клеток. (D) СКР клетки часть клеток ЦГВЗ, выражая регулирования конкретных клеток транскрипционный фактор Foxp3 вместе с TFH маркеры и являются воротами как CXCR5+ PD-1Привет Foxp3+ CD4+ T клетки. (E-F) Стробирования стратегия для TFH поверхностных маркеров, подтвердил в splenocytes изолированы от NP-OVA-иммунизированные мыши с помощью выражения BCL-6. (G-J) Изображены флуоресценции минус один (FMO) элементы управления для ключа TFH-СКР и GC ячейки маркеры. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: на основе коллагеназы ферментативного пищеварения приводит к массовым сокращению обнаружения CXCR5. (A) PPs от 2 месяцев мыши расположен в двенадцатиперстную кишку (≈ 1/3 Проксимальная), тощая кишка (≈ 1/3 средний) и подвздошной кишки (≈ 1/3 дистальной) были собраны и объединены отдельно. Обобщённые PPs были равномерно распределены в экспериментальной группы. Ферментативный пищеварения с коллагеназы II или IV на 1,5 мг/мл, концентрация была выполнена с агитации за 10 минут при 37 ° C. (B-E) Гистограмма участков, изображающие экспрессии молекул (CXCR5, CD19, ПД-1, CD4) поверхности клеток, изолированных от PPs, которые были подвергнуты на основе коллагеназы пищеварение. (F-я) TFH стробирования в ведении коллагеназы и группы управления проявляется в Зебра участков. Данные представляют собой три независимых экспериментов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
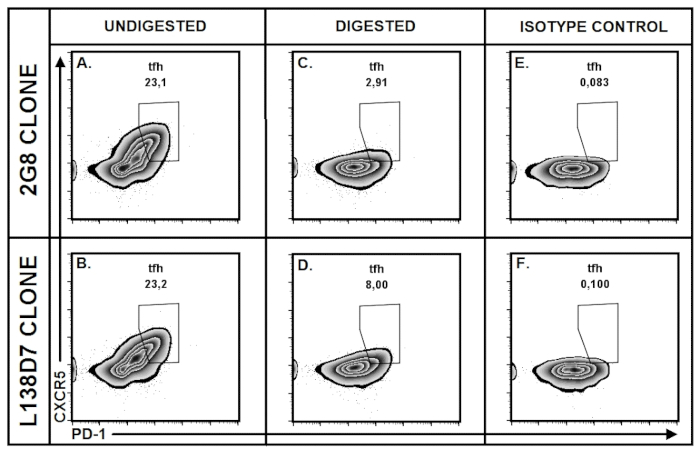
Рисунок 6: эффект коллагеназы на выражение CXCR5 показал большое различие в зависимости от клонов антитела анти CXCR5. PP лимфоцитов, собранных от 6-месячного мыши, пула и разлученных в различных групп в отношении антитела клон приложения используется и ферментативного пищеварения. (A-F) Доля клеток TFH изображен в Зебра участков в пределах предварительно условного жить, CD19– CD4+ T клетки. (A, C и E) PP клетки окрашивали конъюгированных биотина анти мыши CXCR5 антитела (2 g 8 клонировать), и стрептавидина проспряганное с BV421 флюрохром. (B, D и F) PP клетки окрашивали первичного конъюгированных антител CXCR5 анти мышь (L138D7 клон). (A-B) TFH стробирования сюжеты из непереваренной PP лимфоцитов. (C-D) PPs переваривается с коллагеназы II (20 мг/25 мл смеси пищеварения) и агитировал за 10 минут при 37 ° C. Данные представляют собой два независимых экспериментов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7: на основе коллагеназы пищеварение и агитации при 37 ° C влиять на жизнеспособность клеток, восстановления и внутриклеточных окрашивание эффективности. 3 мыши C57BL/6 месяцев было принесено в жертву; PPs были собраны и объединены как описано в Рисунок 5A. (.A) после того, как коллекция PPs, ткани были взволнованный присутствии коллагеназы II (37,5 мг/25 мл смеси пищеварение) за 10 мин, FSC и SSC характеристики клеток фиксированной PP изображены в (A) и жизнеспособности, окрашивание участок изображен ( D). (B, E) после сбора PPs, тканях хранились на льду без агитации или ферментативного пищеварения; FSC и SSC характеристики клеток фиксированной PPs изображены в (B) и жизнеспособности пятнать изображен в (E). (C, F) После сбора PPs тканей были агитировала на 125-150 об/мин, 10 минут при 37° C в отсутствие коллагеназы; FSC и SSC характеристики и жизнеспособности окрашивания клеток фиксированной PP изображены (C, F), соответственно. (G) сравнение выражения Foxp3 в нормативных Т-клеток, изолированных от взволнованным и unagitated PPs без коллагеназы администрации изображен сюжет гистограммы. (H-J) PPs собраны из 6 - месячный мыши C57BL/6 и лечили разные концентрации коллагеназы II: 25 мг на пищеварение микс 25 мл, 15 мг на 25 мл пищеварение mix или не коллагеназы. Изображены FSC и SSC участки, которые показывают последствия ферментативного пищеварения на восстановление клеток PP и урожайность. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
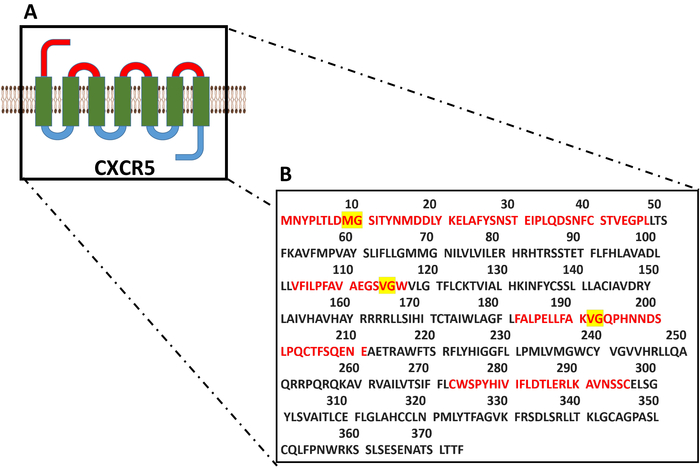
Рисунок 8: молекулярные модели и полный аминокислотной последовательности CXCR5. (A) семь перевал моделируется структура белка трансмембранного CXCR5. Продемонстрировал (B) полное аминокислотной последовательности CXCR5. Последовательность внеклеточного регионов указывается в красном и внеклеточной аминокислот с предположительным коллагеназы чувствительных химических связей демонстрируются в желтом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Антиген | Клон | Fluourochrome | Разбавление |
| CD4 | GK1.5, RM4-5 | APC, PECy7, PerCpCy5.5, FITC | 1: 100 |
| CD19 | 5 6 D | FITC, APC/Cy7 | 1: 100 |
| PD-1 | J43 | PE ef 610 (Техас красный) | 1: 100 |
| ICOS | 15 F9, 7E.17G9 | PE | 1: 100 |
| GL7 | GL7 | PerCp/Cy5.5 | 1: 75 Черноморское |
| CXCR5 | 2 g 8,L138D7 * | Биотин | 1:50 |
| BCL-6 | 7 D 1 | PE/Cy7 | 1:50 |
| FOXP3 | FJK-16 | APC, ЧП | 1: 100 |
| Стрептавидина | - | BV421, ЧП | 1: 100 |
| FixableViability краска | - | BV 510(AQUA) | 1:1,000 |
| 7AAD | - | PerCp/Cy5.5 | 1: 500 |
| FcBlock (CD16/32) | 2.4G2 | - | 1: 200 |
Таблица 1: резюме антитела. Указаны разведений, клонов и спряжения флюрохром для соответствующих антител и жизнеспособности красители. Оптимальное разведение может варьироваться в зависимости от экспериментальных условий и много качество продукта. Первичного клона конъюгированных BV421 L138D7 в 1:20 разрежения показал сопоставимых способность обнаружения CXCR5 с 2 g 8 конъюгированных биотина клон в 1:50 разрежения. Таким образом, начальная конъюгированных L138D7 может использоваться как альтернатива конъюгированных биотина 2 g 8 клон.
Рисунок дополнительного 1 (S1): альтернативные стробирования стратегии для ячеек TFH и GC B. (A) изображены Live PP лимфоцитов из 3 месяца старая мышь на фоне C57BL/6. (B-C) GC B клетки являются воротами как CD38– GL7+ (B) и BCL-6+ GL7+ B-клеток (C). (D-E) TFH клетки изображаются как PD-1Привет CXCR5+ (D) и как ICOS+CXCR5+ CD4 + T клетки (E). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь мы описываем протокол, оптимизированный для потока характеристика гранулярных клеток TFH и GC B. Одним из основных преимуществ нашего протокола является, что он позволяет изоляции до 107 (в среднем 4-5 х 106 клеток) всего PP клеток из одной мыши (штамм C57BL/6) без каких-либо процесс пищеварения. Мы отметили, что доходность ячейке положительно коррелирует с числом PPs и может быть оценена из следующих простое уравнение, которое является полезным для планирования экспериментальных: «общее количество PP клеток за мыши = 0,5 – 1 x (количество подакцизным PP за мышь) x 106». Этот высокий клеток урожайность была дополнена жизнеспособность расширенной клеток (> 95%). Улучшенная ячейка восстановления и жизнеспособности допускается выполнение потока гранулярных анализа различных лимфоцитов в PPs, используя разнообразные антитело пятная панелей параллельно.
По сравнению с недавно Протокол изоляции PP, Опубликовано де Жезуш и др. 20 и предыдущих докладов19,21, наш протокол дал значительно выше ячейке урожайность и жизнеспособности, несмотря на отсутствие пищеварения с коллагеназы. Хотя выявление PPs может быть «хитрый» впервые следователей, довольно крутой кривой обучения для этого протокола, и если освоил, наша техника позволяет идентификации и хирургическое иссечение PPs из тонкой кишки в короткие время. Если требуемое число PP не достигается после первой попытки, мы предлагаем, повторив шаг идентификации PP, сосредоточив внимание на проксимальном и дистальном конце Си. В нашей практике, почти в каждой мыши два близко расположенных PPs в конце двенадцатиперстной кишки (рис. 1A) и по крайней мере 2-3 PPs в пределах последних 5 см подвздошной кишки были обнаруживаемыми.
TFH пятнать может быть более требовательным, чем другие клетки подмножества в PPs, таким образом, требует дополнительного внимания18. Если определенные шаги пропускаются при обработке тканей и клеток изоляции, результаты могут оказаться довольно заблуждение. Следовательно мы предлагаем исследователи обратить внимание на следующие экспериментальные «советы». С ключевые TFH и GC B ячейки маркеры такие, как CXCR5 и GL7 могут быть выражены в клетках B и T, важно включить маркер клетки B в антитела панелей, чтобы избежать ложных положительных результатов из-за загрязнения CD19+CD4+ DP клетки24 ( Рисунок 2). Пожалуйста, обратите внимание, что стробирования стратегии на основе Т-клеток маркеры только25 не будет предоставлять достаточно исключение DP клеток, так как эти клетки также высоко Экспресс маркеров Т-клеток, включая CD3 (данные не отображаются) и CD4. Помимо исключения DP клеток, следует проверить и подтвердил, используя соответствующие негативный контроль потока цитометрии результаты (например., изотипа контроль, FMOs). Не только ложные позитивности, но и неправильно TFH ворота может привести к ложным результаты и выводы. Корректировка TFH ворота иногда могло быть затруднительным, особенно если TFH популяции клеток не обильные, тем самым не появляясь как дискретные населения в проточной цитометрии. Чтобы обойти это ограничение, добавление нескольких TFH маркеров (например., BCL-6, ПД-1, ИКОС) в антитела группа может предоставить альтернативные стробирования возможности и увеличить точность26. По практическим соображениям BCL-6 оказался идеальным совместно окрашивание маркер для альтернативных TFH стробирования, как он может быть использован для стробирования GC B клеток одновременно16 (Рисунок S1C).
Кроме того имея положительный контроль образцов, содержащих значительную TFH может обеспечить исследователей хорошей навигации для размещения TFH ворота правильно. В наших экспериментах, мы использовали PP образцов от возрасте мышей (старше 6 месяцев) как позитивный элемент управления так, как мы обнаружили, что старение вызывает повышение TFH клеток в PPs до 40% всего CD4+ T клеток в стационарном состоянии (данные не показаны). Мы также призываем исследователей, которые заинтересованы в технических деталях TFH пятнать взглянуть на методы в книге опубликованной протокол для ячейки TFH пятнать18.
Тестирование экспериментальных гипотез в PP может быть довольно сложным и может потребовать очень большое количество мышей на группу достичь статистической значимости21. Используя преимущества высокой ячейке доходности нашего протокола, мы обойти это препятствие с следующих экспериментальных стратегий. Во-первых, мы подакцизным PPs и сортировка их отдельно в зависимости от их анатомического происхождения (например., двенадцатиперстной кишки, тощей кишки и подвздошной). Затем мы равномерно эти объединенные PPs в различных экспериментальных и контрольных групп. Это внутренне контролируемые экспериментальные стратегии позволило нам свести к минимуму между индивидуальные различия в мышей, в то время как все клетки были получены от одной мыши.
Кроме того изменчивость между различных кишечных отсеков (например., двенадцатиперстную кишку против. подвздошной кишки)-сообщалось ранее значительные2 — был лишен как экспериментальных и контрольных групп состояла из равного числа PPs за анатомического региона (Рисунок 5A). Выполняя реплицирует независимых экспериментов с использованием того же подхода, мы улучшили надежность и значимость наших результатов. Помимо устранения неспецифические изменения, эта методология также помогает запасных мышей, реагентов и время.
Во время разработки и оптимизации нашего протокола наши результаты показали, что коллагеназы пищеварения на основе II и IV поразительно сокращены выражение (Рисунок 5B) CXCR5 то время как другие поверхности молекул для обнаружения TFH и клетки GC B оставались нетронутыми) Рисунок 5 c -E) . В недавно сообщили JoVE протокол19коллагеназа II был показан весьма эффективными для лимфоцитов изоляции от PPs и пластинок. Однако коллагеназа II ранее сообщалось у высокой tryptic активностью, которая приводит расщепление молекул нескольких поверхности. Учитывая его поверхности молекула дружественный характер27 вследствие более низких tryptic активности и более общего использования в литературе28,29,30, коллагеназа IV также были включены в дополнение к коллагеназы II в Наши исследования и используется в концентрации, как это рекомендовано в этих предыдущих докладах. Использование коллагеназы и эквивалентные ферментов был противоречивым вопросом в слизистой иммунологии из-за нежелательные эффекты пищеварения на иммунные клетки таких как изменения поверхности молекулы выражение31,27.
Ранее сообщалось, что использование различных типов коллагеназы может мешать потока гранулярных обнаружения CXCR5 в кишечнике человека32 и миндалины образцы18. И наоборот другие исследования продемонстрировали изоляции TFH и GC B клеток от PPs без использования коллагеназ24,33. Однако до теперь не сравнительного подхода были предприняты ли включение или исключение коллагеназы пищеварение будет представлять оптимальные условия для изоляции CXCR5-выражая TFH клеток из мышиных PPs. мыши CXCR5 — 374 аминокислота долго семь перевал мембранные белки с относительно коротким внеклеточного регионами, по сравнению с другими трансмембранные белки, такие как CD4, CD19, обильно выражаются в лимфоидных клетках в PPs (данные, полученные от UniProt). В рис. 8А-B, молекулярные модели и общая аминокислотной последовательности мыши CXCR5 изображены с предполагаемой последовательности на основе коллагеназы пищеварения, который, как правило, отделить химических связей между глицин (Gly) и нейтральных аминокислот кислоты34. Семь перевал трансмембранного молекулярной структуры результате короткий внеклеточных доменов может быть ответственность за уязвимыми для ферментативного пищеварения (рис. 8A) молекулы CXCR5. Интригующе мы нашли что обнаружение CXCR5 выражение после лечения коллагеназы зависимой от антитела clone используется. Хотя 2 g 8 и L138D7 клонов показывает аналогичные показатели в группе непереваренных PP, как определяется обнаружения сопоставимых TFH фракций, в группе переваривается PP, L138D7 клон показали приблизительно 3 x выше часть TFH клеток в пределах CD4 (≈ 9%)+ Т-клеток, чем 2 g 8 клон (≈ 3%) (Рис. 6). Этот вывод свидетельствует о том, что снижение CXCR5 окрашивания могут быть вторичными конфигурации изменение трехмерных эпитоп, Ферментативная активность коллагеназы. Наши результаты показывают, что на основе коллагеназы пищеварения следует избегать при подготовке PP.
Вмешательство коллагеназы диссоциации с CXCR5 молекулы обнаружения было обойти путем исключения шаг пищеварение. Однако следует отметить, что для некоторых тканей, таких как LP, механические нарушения не достаточно, чтобы изолировать клетки, и для таких тканей, ферментативного пищеварения будет требуется19. В будущем он будет существенно важное значение для тестирования условия альтернативного пищеварение, а также клоны пищеварение совместимых антитела обойти это техническое ограничение для тканей, требующих ферментативные процессы пищеварения. До тех пор как метод выбора для обнаружения ЦГЗ в этих тканях будет оставаться методы обработки изображений, например иммунной флуоресцентной микроскопии. Помимо изоляции клетки LP, изоляции некоторых подмножеств гемопоэтических клеток, таких как DCs и плазматические клетки от PPs требуют ферментативного пищеварения35. При использовании нашего протокола, исследователи, кто стремится изолировать эти подмножества ячеек из PPs должен включать соответствующие ферментативного пищеварения шаг20. Следует учитывать возможное вмешательство ферментативного пищеварения с выражением DC маркеров и пищеварение условия должны быть оптимизированы, при необходимости. При изоляции клеток TFH и GC B пожелан помимо подмножество ячеек, требует коллагеназы пищеварение36, PPs, собранные из каждой мыши могут быть отделены в двух группах для обработки и без лечения коллагеназы в параллельных панелей.
Эффекты коллагеназы на PP лимфоциты не ограничивались поверхности молекулы выражение. Наши результаты показали, что ферментативного пищеварения вызвало относительное сокращение числа лимфоцитов внутри клетки PP в зависимости от дозы (рис. 7). Снижение доли лимфоцитов может быть следствием коллагеназы опосредованной выпуска других типов гемопоэтических клеток подмножеств фагоцитов и DCs от PPs, которые крупнее и более детальном, чем лимфоидных клеток. Это также возможно, что пищеварение коллагеназы опосредовано клетки релиз от соседних LP и интраэпителиальной отсеков может способствовать изменению профиля FSC-SSC. Это загрязнение клеток от других отсеков кишки также может вызвать помехи в анализе потоков PP-лимфоцитов. На этой основе для максимальной чистоты клеток, мы также избежать добавления реагентов как ЭДТА или DTT, которые широко используются для извлечения эпителиальных клеток и слизи20, сохраняя условий приготовления ткани как физиологический и unmanipulated как можно. Несмотря на эти неблагоприятные последствия ферментативного пищеварения благотворное влияние на PP лимфоцитов были также обнаружены такие улучшения внутриклеточных окрашивание и жизнеспособность клеток (рис. 7 d-F, G). Однако дальнейшие анализы показали, что эти эффекты были отнесены к агитации процесс при 37 ° C независимо от ферментативного пищеварения, потому что жизнеспособность клеток и внутриклеточных Foxp3 окрашивание были благоприятствования в сопоставимой степени, когда клетки были взволнованный в отсутствие коллагеназы. Механически благотворное влияние агитации может быть Улучшено удаление кишечного содержимого и слизь из PPs.
В целом мы описали Усовершенствованный протокол для изоляции лимфоцитов из изолированного PPs. клетки может быть запятнано для потока гранулярных характеристики нескольких подмножеств ячейки или можно подвергается сортировки клеток и впоследствии занятых в различных в пробирке и в естественных условиях функциональных анализов.
Раскрытие информации
Отсутствие конфликта интересов объявил.
Благодарности
Мы хотели бы поблагодарить Лаура Штраус и Питер Sage за полезные обсуждения и поддержки с cytometry анализ потоков.
Материалы
| Name | Company | Catalog Number | Comments |
| anti-mouse CD4 antibody | eBioscience, Biolegend* | 17-0041-81 ,10054* | For detailed information see Table 1 |
| anti-mouse CD19 antibody | eBioscience | MA5-16536 | For detailed information see Table 1 |
| anti-mouse PD-1 antibody | eBioscience | 61-9985-82 | For detailed information see Table 1 |
| anti-mouse ICOS antibody | eBioscience | 12-9942-82 | For detailed information see Table 1 |
| anti-mouse GL7 antibody | Biolegend | 144610 | For detailed information see Table 1 |
| anti-mouse CXCR5 antibody | Biolegend*, BD Bioscience | 145512*, 551960 | For detailed information see Table 1 |
| anti-mouse BCL-6 antibody | Biolegend | 358512 | For detailed information see Table 1 |
| anti-mouse Foxp3 antibody | eBioscience | 17-5773-82 | For detailed information see Table 1 |
| Streptavidin-BV421 | BD Bioscience | 563259 | For detailed information see Table 1 |
| FixableViability Dye | eBioscience | L34957 | For detailed information see Table 1 |
| 7AAD | Biolegend | 420404 | For detailed information see Table 1 |
| FcBlock (CD16/32) | BD Bioscience | 553141 | For detailed information see Table 1 |
| Collagenase II | Worthington | LS004176 | |
| Collagenase IV | Worthington | LS004188 | |
| Foxp3/Transcription Factor Staining Buffer Set | eBioscience | 00-5523-00 | |
| 6-well,12-well & 96-well plates | Falcon/Corning | 353046,353043/3596 | |
| 50 mL conical tubes | Falcon | 3520 | |
| 40 µm cell strainer | Falcon | 352340 | |
| 10 mL syringe-plunger | Exel INT | 26265 | |
| RPMI | Corning | 15-040-CV | |
| PBS | Corning | 21-040-CM | |
| FBS | Atlanta Biologicals | S11150 | |
| Orbital shaker | VWR | Model 200 | |
| Curved-end scissor | |||
| Fine Serrated Forceps | |||
| Small curved scissor |
Ссылки
- van den Berg, T. K., van der Schoot, C. E. Innate immune ‘self’ recognition: a role for CD47-SIRPα interactions in hematopoietic stem cell transplantation. Trends in Immunology. 29 (5), 203-206 (2008).
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Reboldi, A., Cyster, J. G. Peyer’s patches: Organizing B-cell responses at the intestinal frontier. Immunological Reviews. 271 (1), 230-245 (2016).
- Heel, K. A., McCauley, R. D., Papadimitriou, J. M., Hall, J. C. Review: Peyer’s patches. Journal of Gastroenterology and Hepatology. 12 (2), 122-136 (1997).
- Fagarasan, S., Kinoshita, K., Muramatsu, M., Ikuta, K., Honjo, T. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria. Nature. 413 (6856), 639-643 (2001).
- Hopkins, S. A., Niedergang, F., Corthesy-Theulaz, I. E., Kraehenbuhl, J. P. A recombinant Salmonella typhimurium vaccine strain is taken up and survives within murine Peyer’s patch dendritic cells. Cellular Microbiology. 2 (1), 59-68 (2000).
- Shreedhar, V. K., Kelsall, B. L., Neutra, M. R. Cholera toxin induces migration of dendritic cells from the subepithelial dome region to T- and B-cell areas of Peyer's patches. Infection and Immunity. 71 (1), 504-509 (2003).
- Sato, A., Iwasaki, A. Peyer’s patch dendritic cells as regulators of mucosal adaptive immunity. Cellular and Molecular Life Sciences. 62 (12), 1333-1338 (2005).
- Bemark, M., Boysen, P., Lycke, N. Y. Induction of gut IgA production through T cell-dependent and T cell-independent pathways. Annals of the New York Academy of Sciences. 1247 (1), 97-116 (2012).
- Fagarasan, S., Kawamoto, S., Kanagawa, O., Suzuki, K. Adaptive Immune Regulation in the Gut: T Cell-Dependent and T Cell-Independent IgA Synthesis. Annual Review of Immunology. 28, 243-273 (2010).
- Hase, K., et al. Uptake through glycoprotein 2 of FimH + bacteria by M cells initiates mucosal immune response. Nature. 462 (7270), 226-230 (2009).
- Wu, H., et al. An Inhibitory Role for the Transcription Factor Stat3 in Controlling IL-4 and Bcl6 Expression in Follicular Helper T Cells. Journal of Immunology. 195 (5), 2080-2089 (2015).
- Vinuesa, C. G., Tangye, S. G., Moser, B., Mackay, C. R. Follicular B helper T cells in antibody responses and autoimmunity. Nature Reviews Immunology. 5 (11), 853-865 (2005).
- Victora, G. D., Nussenzweig, M. C. Germinal Centers. Annual Review of Immunology. 30, 429-457 (2012).
- Vaeth, M., et al. Store-Operated Ca2+Entry in Follicular T Cells Controls Humoral Immune Responses and Autoimmunity. Immunity. 44 (6), 1350-1364 (2016).
- Meli, A. P., et al. The Integrin LFA-1 Controls T Follicular Helper Cell Generation and Maintenance. Immunity. 45 (4), 831-846 (2016).
- Fu, W., et al. Deficiency in T follicular regulatory cells promotes autoimmunity. Journal of Experimental Medicine. 215 (3), 815-825 (2018).
- Espéli, M., Walker, J. M. T follicular helper cells - Methods and Protocols. , (2015).
- Couter, C. J., Surana, N. K. Isolation and Flow Cytometric Characterization of Murine Small Intestinal Lymphocytes. Journal of Visual Experiments. (111), e54114(2016).
- De Jesus, M., Ahlawat, S., Mantis, N. J. Isolating And Immunostaining Lymphocytes and Dendritic Cells from Murine Peyer’s Patches. Journal of Visual Experiments. (73), e50167(2013).
- Pastori, C., Lopalco, L. Isolation and in vitro Activation of Mouse Peyer’s Patch Cells from Small Intestine Tissue. Bio-protocol. 4 (21), e1282(2014).
- Fukuda, S., Hase, K., Ohno, H. Application of a Mouse Ligated Peyer’s Patch Intestinal Loop Assay to Evaluate Bacterial Uptake by M cells. Journal of Visual Experiments. (58), 3225(2011).
- Naito, Y., et al. Germinal Center Marker GL7 Probes Activation-Dependent Repression of N-Glycolylneuraminic Acid, a Sialic Acid Species Involved in the Negative Modulation of B-Cell Activation. Molecular and Cellular Biology. 27 (8), 3008-3022 (2007).
- Bollig, N., et al. Transcription factor {IRF4} determines germinal center formation through follicular T-helper cell differentiation. Proceedings of the National Academy of Science of U. S. A. 109 (22), 8664-8669 (2012).
- Pérez-Mazliah, D., et al. Follicular Helper T Cells are Essential for the Elimination of Plasmodium Infection. EBioMedicine. 24, 216-230 (2017).
- Sage, P. T., Sharpe, A. H. T follicular regulatory cells in the regulation of B cell responses. Trends Immunology. 36 (7), 410-418 (2015).
- Van Damme, N., et al. Chemical agents and enzymes used for the extraction of gut lymphocytes influence flow cytometric detection of T cell surface markers. Journal of Immunological Methods. 236 (1-2), 27-35 (2000).
- Meenan, J., et al. Altered expression of alpha 4 beta 7, a gut homing integrin, by circulating and mucosal T cells in colonic mucosal inflammation. Gut. 40 (2), 241-246 (1997).
- Cao, A. T., et al. Interleukin (IL) -21 promotes intestinal IgA response to microbiota. Mucosal Immunology. 8 (5), 1072-1082 (2015).
- Wei, J., et al. Autophagy enforces functional integrity of regulatory T cells by coupling environmental cues and metabolic homeostasis. Nature Immunology. 17 (3), 277-285 (2016).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. 33 (S1), (2017).
- Bergqvist, P., Gardby, E., Stensson, A., Bemark, M., Lycke, N. Y. Gut IgA Class Switch Recombination in the Absence of CD40 Does Not Occur in the Lamina Propria and Is Independent of Germinal Centers. Journal of Immunology. 177 (11), 7772-7783 (2006).
- Keil, B., Gilles, A. M., Lecroisey, A., Hurion, N., Tong, N. T. Specificity of collagenase from Achromobacter iophagus. FEBS Letters. 56 (2), 292-296 (1975).
- Mora, J. R., et al. Selective imprinting of gut-homing T cells by Peyer’s patch dendritic cells. Nature. 424 (6944), 88-93 (2003).
- Reboldi, A., et al. Mucosal immunology: IgA production requires B cell interaction with subepithelial dendritic cells in Peyer’s patches. Science. 352 (6287), (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены