Method Article
שחקני המפתח unraveling Humoral חסינות: מתקדם וממוטב לימפוציט בידוד פרוטוקול טלאים מאתר של Peyer
In This Article
Summary
במחקר זה, אנו מציגים הרומן ונוהל יעיל הבידוד של לימפוציטים מ טלאים של פייה (PPs), בו ניתן להשתמש לאחר מכן ב- vivo ו- in vitro לקשרי מבחני פונקציונלי, כמו גם מחקרים cytometric זרימה של הזקיקים T עוזר, מרכז נבטי B תאים.
Abstract
ברירית המעיים, תאים חיסוניים מהווים ישות אימונולוגי ייחודי, אשר מקדם עמידות מערכת החיסון בזמן במקביל היוועצות ההגנה החיסונית נגד פתוגנים. היא מבוססת היטב כי התיקונים של פייה (PPs) יש תפקיד חיוני הרירית ברשת מערכת החיסון על ידי אירוח מספר אפקטור T ו B cell קבוצות משנה. חלק מסוים של אפקטור תאים אלה, הזקיקים T helper (TFH) ותאי B מרכז נבטי (GC) הם professionalized בוויסות humoral חסינות. לפיכך, אפיון אלה קבוצות משנה תא בתוך PPs במונחים של בידול התוכנית ומאפייני פונקציונלי שלהם יכול לספק מידע חשוב על חסינות הרירית. לשם כך, שיטה ישימה בקלות, יעיל ו לשחזור של לימפוציטים בידוד מ- PPs יהיה ערך לחוקרים. במחקר זה, כיוונו כדי ליצור שיטה יעילה כדי לבודד לימפוציטים מן העכבר PPs עם תשואה גבוהה התא. הגישה שלנו חשף את הרקמה הראשונית הזאת עיבוד בהן: ריאגנטים העיכול ועצבנות רקמות, כמו גם תא מכתימים תנאים ומבחר של נוגדן פאנלים, יש השפעה רבה על איכות ועל זהות של לימפוציטים מבודד תוצאות הניסוי.
כאן, אנו מתארים את פרוטוקול המאפשר לחוקרים ביעילות לבודד לימפוציט אוכלוסיות מ- PPs ומאפשר זרימה לשחזור מבוססי cytometry הערכה של קבוצות משנה T ו- B cell, התמקדות בעיקר TFH ו- GC B תא קבוצות משנה.
Introduction
מערכת העיכול כולה מההתחלה עד הסוף הוא עדיין עם מערך הלימפה המכילה תאים חיסוניים יותר מכל איבר-אנוש אחרים, העכבר1. Peyer של טלאים (PPs) מהווים מרכיב מרכזי של הענף מעיים של הארגון מערכת החיסון התאית, כביכול הקשורים הבטן רקמת הלימפה (גולט)2,3. בתוך PPs, אלפי מיליוני אנטיגנים נגזר חומרים תזונתיים, commensal microbiota, פתוגנים הם להיות שנדגמו ברציפות, כאשר הצורך תגובות מערכת החיסון המתאים כלפיהם הם הנטען החיסון במעי ובכך שמירה הומאוסטזיס. במובן הזה, PPs יכול להיקרא בשם כמו "השקדים של המעי הדק". PPs מורכב תאי משנה עיקריים: כיפת subepithelial (SED), אזורים גדולים תא B זקיק; אפיתל זקיק-הקשורים שמעליה (מיסטי) ואזור interfollicular (למעלה) איפה ממוקם4תאי T. מידור ייחודית זו של PPs מאפשר אפקטור שונים תא קבוצות משנה לשתף פעולה, לפיכך, מקנה immunocompetence בבטן.
PPs חסרה lymphatics מביא, בשל סיבה זו, אנטיגנים מועבר PPs מן המעי הדק שלא מתנהלים דרך כלי הלימפה בניגוד למרבית איברי הלימפה אחרים. במקום זאת, תאים אפיתל מיוחדים ממוקם מיסטי, תאי M כביכול, אחראים העברת אנטיגנים luminal לתוך PPs5. לאחר מכן, אנטיגנים מועבר הן נאספות על ידי התאים הדנדריטים (Dc) ו phagocytes הממוקמים באזור כיפת subepithelial (SED) מתחת מיסטי6,7. תהליך המיון זה אנטיגן על-ידי בקרי ב PP חיוני ליזום תגובה חיסונית אדפטיבית8 ו דור עוקבות של תאים מפרישים איגה9.
בשל העומס antigenic כבד של פלורה commensal והחומרים התזונתיים, המארח PPs endogenously מופעל אפקטור T ו- B cell קבוצות משנה ב- abundances גדול כגון TFH ו- B GC איגה+ תאים10, רומז כי PPs מייצגים אתר של החיסון הפעיל תגובה11. זיהוי של עד 20 – 25% TFH תאים בתוך CD4 הכולל+ T תא תא ו למעלה עד 10 – 15% GC B תאים בתוך תאי B הכולל אפשרית ב- PPs שנאסף unimmunized צעיר C57BL/6 עכברים12. לעומת סוגים אחרים של תא מסייע T (כלומר., Th1, Th2, תאים Th17), תאים TFH להראות tropism ייחודי אל תוך זקיקי תא B בעיקר בשל ביטוי CXCR5, המקדם TFH יונת תא לאורך מעבר הצבע CXCL1313. באזורי זקיק תא B של PPs, תאים TFH זירוז איגה הכיתה לעבור רקומבינציה, היפרמוטציה בתאי B מופעל שממנו גבוהה-זיקה איגה לייצר תאים להבדיל14. לאחר מכן, אלו תאים פלזמה מפריש נוגדן להגר פרופריה. מוסקולריס (LP), לווסת את המערכת החיסונית הומאוסטזיס בטן10.
זיהוי ואפיון של אוכלוסיות תאים TFH ו- GC B בתוך PPs עשויה לאפשר לחוקרים לחקור את הדינמיקה של תגובות חיסוניות ההורמונאלית בתנאים מצב יציב ללא הצורך של מודלים התחסנות זמן רב משמשת גם TFH-GC B תא מחקרים15,16,17,18. ניתוח TFH תאים בתוך PPs אינה ברורים ככל קבוצות משנה אחרים בתא. האתגרים הטכניים כוללים זיהוי הרקמה אידיאלי הכנה תנאים, שילוב השטח נוגדן-marker, וכן בחירת הפקדים המתאימים חיוביים ושליליים. תחומי מחקר TFH ו- PP התערוכה שונות רבה במועדי מבחינת נהלים ניסיוני, רחוקים היוועצות קונצנזוס להקים פרוטוקולים סטנדרטיים בשל מספר סיבות. ראשית, משנה תא בתוך PPs נוטה להיות מושפעים באופן שונה על ידי רקמת הכנה מצבים הדורשים שינויים נוספים באופן ספציפי משנה תא. שנית, קיים פער משמעותי בין השיטות המדווחת לגבי הפרטים של הכנה תא מ השלישי ול-pps , המספר של מחקרים השוואתיים מבוססי פרוטוקול חוקרת טכניקות להכנת רקמות האידיאלית והתנאים ניסיוני עבור עמודים ו- TFH מחקר מוגבל למדי.
מחקרים נוכחיים מבוססי פרוטוקול, הציע PP תא הכנה19,20,21,22 לא היו TFH - או GC מונחה תא B. יתר על כן, כמה תנאים רקמות הכנה מומלצת PPs19,,20 , כגון עיכול מבוססי collagenase נמצאו משפיעים על התוצאות של זיהוי TFH מאת cytometry זרימה שלילית18. על בסיס זה, אנחנו הסיק כי פרוטוקול ממוטבת, סטנדרטית ו לשחזור שיכול לשמש בחקר דינמיקה תא TFH ו- GC B בתוך PPs יהיה יקר בפני החוקרים עובדים על נושא זה. הצורך הזה נתן לנו את הדחף ליצור פרוטוקול ועדכני של שיפור עבור בידוד ואפיון של לימפוציטים PP דק הממוטב עבור שחזור הסלולר, הכדאיות ויעילות זרימת cytometric פלואורסנציה מספר T ו- B תא קבוצות משנה. גם כיוונו כדי לא לכלול מספר צעדים הכנה מפרך המוצעת פרוטוקולים הקודמים, ובכך, להפחית את המניפולציות נדרש והשעה עבור הכנת הרקמה והתא מ- PPs.
Protocol
כל המחקרים, הניסויים המתוארים פרוטוקול זה נערכו תחת הנחיות לפי אכפת לי חיה מוסדיים ועל שימוש הוועדה (IACUC) של המרכז הרפואי בית ישראל מסדר הדיאקוניסות.
1. עיצוב ניסיוני הקמה וקבוצות העכבר
- (אופציונלי) בשיתוף בית העכברים ניסיוני כדי להקל על העברה אופקית של הבטן microbiota בין עכברים ניסיוני וכדי להקטין את השתנות שאינם ספציפיים בתוך PP לימפוציטים. בנוסף, השתמש בפקדי littermate ממין זהה כדי למזער את השתנות.
2. כריתה כירורגית ושלבי ההכנה רקמות:
- הסרה כירורגית של המעי הדק (SI)
- המתת חסד עכברים באמצעות CO2 חנק או כל שיטה מקבילה אושרו על ידי ועדת האתיקה בעלי חיים מוסדיים.
- העבר את העכבר על אזור ייעודי עבור כריתה כירורגית. למקם את הישבן למטה, לחטא את הבטן עם 70% אתנול. לבצע פתיחה של הבטן על ידי חיתוך בעור בטן של הצפק לאורך הקו האמצעי מהמפשעה, לכלוב הצלעות, ובכך לפתוח חלל הצפק.
הערה: לבצע את החתך הראשון על שטח קטן יחסית של העור כדי למנוע חדירה חלל הצפק ופגיעה רקמת המעי. המשך הכריתה עד גבול אנטומי הרצוי. - לזהות את caecum, המהווה נקודת ציון אידיאלי עבור הגילוי של ileum מסוף, המהווה את החלק הדיסטלי של המעי הדק.
הערה: Caecum ממוקמת בדרך כלל בצד השמאלי התחתון של הבטן העכבר. - לאתר ileocaecal בצומת ולעשות חתך ברמה זו כמו דיסטלי ככל האפשר להפריד את caecum המעי הדק. לאורך כל השלבים הבאים, למנוע את מגע פיזי מופרז עם הדקיקים שבדופן כי PPs שביר לכווץ בקלות על מגע.
- הסר בעדינות המעי הדק כולו עד הטבעת מולדת על ידי גזירה את מצע המעי באמצעות מספריים. לזהות את הצומת בין השוער התריסריון, לגזור התריסריון ברמה זו, אשר יוביל להשלמת התנתקות של המעי הדק של חלל הבטן.
הערה: (i) להימנע hyperextension כמו זו עלולה לגרום שבר דופן המעי. (ii) אם LP לימפוציט בידוד רצוי בנוסף PP לימפוציטים, הסרה מלאה של השומן מצע המעי העליון נחוץ. עם זאת, בידוד PP בלבד, שנותרו שומן מצע המעי העליון יכול לספק כמה יתרונות במהלך השלבים בידוד נוסף; לכן, זה צריך להישמר. - מקום מנותק המעי הדק בצלחת 6-ובכן מלא עם RPMI קר + 10% סרום שור עוברית (FBS), בעדינות להתסיס את הרקמות באופן ידני עד כל שכבות המעי טובע בתקשורת קר. לשמור על הרקמות על קרח לאורך כל השלבים הבאים.
- לאחר לנתח את המספר הרצוי של המעי הדק העכבר, המשך PP כריתה של המעי הדק שנאספו.
- כריתה כירורגית של PPs והכנה של תא בודד ההשעיה:
- בעדינות העבר המעי הדק על מגבת נייר מאת כשתפסת השומן מצע המעי העליון באמצעות מלקחיים ומניחים על מצע המעי העליון בצד הפונה מגבת הנייר. להרטיב את כל הקטע מעיים עם קר RPMI + 10% FBS כדי למנוע התייבשות רקמות הדביקות.
הערה: שנותרו שומן מצע המעי העליון יכולה להועיל בשלב זה כי מקטעי רקמת שומן באתר מצע המעי העליון של SI ידבק מגבת הנייר מחזיק אתר אנטי-מצע המעי העליון פונה כלפי מעלה. - לזהות את PPs, אשר מופיעים אגרגטים רב lobulated לבן בצורת "כמו כרובית" בצד אנטי-מצע המעי העליון של הקיר מעיים.
הערה: פלאשינג החוצה התוכן luminal לא מומלץ עד PPs כל הדליות. ריקון תוכן luminal עלול לגרום להתמוטטות של PPs, תמנע את חדות הצבעים בין PPs מהקיר מעיים, אשר הוא מאוד מועיל עבור זיהוי חזותי של PPs. - לאחר זיהוי PPs בצד אנטי-מצע המעי העליון, במקום את המספריים מעוקל-end כירורגי על PPs (עקומת צריך פנים למעלה) הרחקה PP מגבול שלה הדיסטלי, צינתור.
אופציונלי: לדחוף PP בעדינות לכיוון הלהבים של מספריים משתמש קצה האצבע. תמרון זה יוביל הכללת יותר עמודים שאינם הרקמה שמסביב. לסלק את PPs בעדינות, למעט מעיים הרקמה שמסביב.
הערה: (i) השלב זה קריטי להשגת תשואה תא PP מקסימלי תוך הקטנת הזיהום תא מגבולות תאי המעי כגון LP ואפיתל המעי, אשר הם גם עשירים בתאי T. (ii) מ סי אחד טוחנות מכל עכבר C57BL/6, ניתן לאסוף 5-10 PPs (גודל ממוצע, רב lobulated). על-ידי כיוון אפילו קטנה יותר PPs (לא רב lobulated), אוסף של עד 12-13 PPs לכל עכבר (C57BL/6) זה אפשרי באמצעות פרוטוקול זה. - העברת PPs נכרת צלחת תרביות רקמה 12-ובכן מלא קפואים RPMI + 10% FBS וקרח מתוחזק על באמצעות מלקחיים או מספריים כירורגיים מעוקל.
הערה: (i) מיד לאחר כריתה של PPs, ריר ותוכן המעי על פני עמודים ניתן לנקות על ידי שפשוף רקמת בעדינות על מגבת נייר. שלב זה יעזור לשפר את הכדאיות של לימפוציטים PP. (ii) במקום של העברת PPs על צלחת, העברת מופרדים צינורות יכול להיות גם נחשב בהתאם למספר המדגם. - אופציונלי: לאחר השלמת כריתה PP והמיקום עוקבות המשקולת היטב, המספר והגודל של PPs שנאספו מקבוצות שונות ניסויית/עכבר יכול להיות מתועד על ידי לקיחת תמונה של צלחת תרביות רקמה המכיל PPs.
- הכנת סט של 50 מ ל צינורות חרוט ממולא 25 מ של RPMI + 10% FBS (להתחמם מראש ב 37 מעלות צלזיוס). בעזרת זוג מספריים, לחתוך את הקצה של טיפ µL 1,000 ממרחק זה יאפשר את השאיפה של PPs עם פיפטה 1 מ"ל. וארוקן את PPs עם פיפטה 1 מ"ל ומעבירים אותם מהצלחת תרביות רקמה 12-ובכן אל הצינורות חרוט מוכן 50 מ.
הערה: השתמש טיפ חדש עבור כל דגימה העכבר כדי למנוע זיהום צולב בין הדגימות. - לאבטח את המכסה ומניחים הצינורות אנכית שייקר מסלולית-37 מעלות צלזיוס, עם עצבנות רציפה ב- 125-150 סל ד למשך 10 דקות. בינתיים, הכנת סט חדש של 50 מ ל צינורות ומניחים על מסננת תא 40 µm בראש כל שפופרת, שדרכו תהיה מוכנה התליה תא בודד.
הערה: (i) השלב עצבנות יסיר את הנותרים מעיים תוכן, ריר ופסולת תאים, אשר להקטין את הכדאיות תא ושחזור של לימפוציטים PP אם לא הוסר. (ii) אינן חלות כל סוג של אנזימי עיכול על רקמות PP כי תהליך עיכול גורם ההפסד הדרמטי של הביטוי CXCR5 מפני השטח התא. - לאחר התסיסה, להעביר את PPs מסננת תא 40 µm הניח על ראש הצינורות החדש מוכן חרוט 50 מ. בעדינות בעזרת הצד מעוגל של פומפה מזרק 10 מ"ל, לשבש את PPs דרך מסננת התא כדי ליצור תא בודד ההשעיה. לשטוף את מסננת 15 – 20 מ של קר RPMI + 10% FBS.
הערה: (i) לפני הסינון, ללחוץ את הצינורות המכילים את PPs אופקית. לנער קצר זה יקל על העברת PPs לתוך התא strainers. (ii) באמצעות מסננת תא מיקרומטר 70 הבידוד של תאים חיסוניים-הלימפה (למשל., ומונוציטים, מקרופאגים, בקרי קבוצת מחשבים) מומלץ. - Centrifuge את המתלים תא בודד ב 350 – 400 g x 10 דקות ב 4 º C.
- בזהירות למחוק את תגובת שיקוע, resuspend את התאים-ריכוז של 10 x 106 תאים/מ ל.... לספור את התאים באמצעות hemocytometer.
הערה: (i) לפני לספור תאים, המספר בתא סכום עבור כל קבוצה העכבר PP יכול להיות כ מוערך באמצעות הנוסחה הבאה: "0.5-1 x 106 תאים x (מספר PPs) = ספירת התאים הכולל". דילולים נוספת עם trypan blue לספירת תא ייתכן שיהיה צורך. (ii) כחלופה לספור ידנית, אוטומטית תא מונים יכול לשמש. - העברת 2-2.5 x6 10, בתאי האחסון המתאים (למשל., 200 µL) לתוך צלחת 96-ובכן סיבוב למטה.
הערה: עבור צבע אחד ודוגמאות שליטה שלילי, 0.5-1 x 106 תאים עשוי להספיק. - Centrifuge את הצלחת ב g x 350 דקות 5-4 מעלות צלזיוס. קפיצי את הצלחת.
- לשטוף את התאים µL 200 מאגר מכתים.
- בעדינות העבר המעי הדק על מגבת נייר מאת כשתפסת השומן מצע המעי העליון באמצעות מלקחיים ומניחים על מצע המעי העליון בצד הפונה מגבת הנייר. להרטיב את כל הקטע מעיים עם קר RPMI + 10% FBS כדי למנוע התייבשות רקמות הדביקות.
3. משטח נוגדן מכתים
- צביעת הכדאיות:
- לאחר השטיפה הסופית resuspend תאי μL 100 של הכדאיות ניתן לתיקון צבע מדולל ב- PBS (1:1, 000). תקופת דגירה של 30 דקות על קרח או ב 4 ° C בחושך.
הערה: צביעת תאיים (i) איתור של שעתוק מפתח גורמים כגון Foxp3 או Bcl-6 מחייב קיבעון של התאים. במקרה הזה, שאינו ניתן לתיקון הכדאיות צבענים (למשל-, 7-מ, דאפי) אינו יכול לשמש. (ii) כדי לדלל הכדאיות בר תיקון צבע, אין להשתמש בכל מאגר מכתימים המכילה חלבון. התקשורת בשימוש בשלב זה חייב להיות ללא חלבון. (iii) אי-הכללה של תאים מתים באמצעות צביעת הכדאיות חיוני כי תאים מתים יכול לגרום קשיים טכניים רציני ניתוח cytometry זרימה על ידי פליטת autofluorescence על ידי איגוד נוגדנים משטח nonspecifically, אשר עלול להוביל שווא תוצאות חיוביות. - לשטוף את התאים פעמיים עם צביעת מאגר. צנטריפוגה-350 גרם x עבור 5 דקות ב 4 º C. קפיצי את הצלחת.
- לאחר השטיפה הסופית resuspend תאי μL 100 של הכדאיות ניתן לתיקון צבע מדולל ב- PBS (1:1, 000). תקופת דגירה של 30 דקות על קרח או ב 4 ° C בחושך.
- בלוק fc משטח - שכבה i:
- הכן את הפתרון Fc-בלוק על ידי דילול נוגדן anti-CD16/32 (1:200) בצביעת מאגר.
- Resuspend תאי μL 20 בפתרון Fc-בלוק מוכן. תקופת דגירה של 15 דקות על קרח.
- בלי כביסה, להוסיף μL 80 של קוקטייל משטח נוגדנים (ראה טבלה 1 נוגדן סיכום) מוכן במלון דילולים המתאים. דגירה על קרח במשך לפחות 30 דקות.
- לשטוף פעמיים על-ידי הוספת יתר מאגר מוכתמים. צנטריפוגה-350 גרם x עבור 5 דקות ב 4 º C. קפיצי את הצלחת.
- משטח - שכבה II:
- הכן פתרון מוכתמים Streptavidin על ידי דילול מצומדת fluorochrome Streptavidin במאגר מוכתמים.
- לאחר השטיפה הסופית resuspend התאים עם 100 μL של Streptavidin מראש מדולל (1: 100) צביעת פתרון. תקופת דגירה של פחות 15 דקות על קרח בחושך.
- לשטוף פעמיים עם צביעת מאגר. צנטריפוגה-350 גרם x עבור 5 דקות ב 4 º C. קפיצי את הצלחת.
אופציונלי: אם תאיים מכתים לגילוי הזקיקים תא T רגולטורי אינו רצוי, לאחר השטיפה האחרונה resuspend תאי μL 200 של צביעת מאגר והעברת לתוך צינורות המתאים לרכוש נתונים בזרימה cytometer. כאשר הדגימות אינם קבועים, רכישת נתונים על-ידי cytometry זרימה צריכה להתבצע בתוך 3-4 h כדי לקבל תוצאות מדויקות.
4. תא קיבוע
- להכין את הקיבעון/permeabilization (תיקון/פרם) הפתרון עובד באמצעות של ריאגנטים מ Foxp3/תמלול גורם מכתים המאגר להגדיר. מערבבים אחד-חלק פיקסציה/permeabilization להתרכז עם שלושת החלקים של קיבעון/permeabilization diluent לאמצעי האחסון הסופי הרצוי.
- לאחר השטיפה הסופית resuspend תאי μL 200 של הפתרון עובד תיקון/פרם.
- דגירה את הצלחת על קרח או ב 4 מעלות צלזיוס למשך 20 דקות. לא יעלה על 20 דקות בשלב זה. זמן הדגירה יותר קשות עלול להקטין את ההתאוששות התא.
- צנטריפוגה-350 גרם x עבור 5 דקות ב 4 º C. קפיצי את הצלחת. (אופציונלי) לאחר שלב זה, תאים קבוע ניתן לאחסן במשך מספר ימים ב 4 ° C בצביעת מאגר המכיל אלבומין שור (BSA) או FBS עד עוקבות תאיים להכתים או לזרום cytometry רכישה.
- Resuspend תאי μL 200 של permeabilization מאגר (x1) טרי מראש מדולל במים מטוהרים יונים.
- צנטריפוגה-350 גרם x עבור 5 דקות בטמפרטורת החדר (RT).
- לשטוף פעם עם μL 200 של מאגר permeabilization, צנטריפוגה-350 גרם x עבור 5 דקות ב- RT.
5. תאיים מכתים
- הכן את הפתרון Fc-בלוק על ידי דילול נוגדן anti-CD16/32 (1:200) במאגר permeabilization.
הערה: לאחר השלב קיבעון, התאים חייב להישמר במאגר permeabilization עד תום תהליך צביעת תאיים - לאחר השטיפה הסופית resuspend תאי μL 20 של Fc-בלוק פתרון. תקופת דגירה של 10 – 15 דקות ב RT בחושך.
- בלי כביסה, להוסיף μL 80 של תאיים נוגדן קוקטייל (100 μL נפח סופי) מדולל מראש במאגר permeabilization. תקופת דגירה של 30 דקות ב- RT.
- להוסיף 100 μL של המאגר פרם, צנטריפוגה-350 גרם x עבור 5 דקות ב- RT.
- לשטוף פעם עם μL 200 מאגר permeabilization, צנטריפוגה ב g 350 x דקות 5-RT.
- לאחר השטיפה הסופית resuspend תאי μL 200 של צביעת מאגר להעביר את התאים לתוך צינורות המתאים (סופי נפח של μL 400 במאגר מכתימים), לרכוש נתונים על ידי cytometry זרימה. דוגמאות צבעונית בצלחת 96-ובכן ניתן להפעיל גם מבלי להעביר לתוך צינורות אם cytometer זרימה עם צלחת קורא אפשרות זמינה. שלב זה ממזערת אובדן התא במהלך העברת תאים.
- לרכוש מינימום של 5 x 105 הכולל תאים cytometer זרימה כדי להיות מסוגל לבצע ניתוח לשחזור של TFH, TFR וכן תאי GC B.
תוצאות
בניגוד הקודם פרוטוקול20, הבחנו כי PPs אינם מופצים בצורה שווה לאורך סי אך מותאמים יותר בצפיפות לכיוון קצות דיסטלי הפרוקסימלית SI כפי שמוצג איור 1A. ניתוח תזרים cytometric הראה, כי אם בעקבות נכונה, פרוטוקול שלנו נותן אוכלוסיית לימפוציטים PP מדגים לפנים לצד פיזור והפצה דומה splenocytes (איור 2 אE, ו- 2D, H) עם > 95% תא הכדאיות (איור 2B ו- 2F). בניגוד משני הלימפה לאיברים אחרים (SLOs), בעכברים C57BL/6 כ- 70-80% של לימפוציטים PP הכולל מורכב בתאי B, ואילו CD4+ T תאים מהווים רק 10 – 15% של סך לימפוציטים PP (איור 2C ו- 2 G).
שימו לב CD4 הזה+ CD19+ תאים כפול חיובי (DP) מהווים ≈ 1% של סך PP לימפוציטים. עם מספר כללי זהירות במהלך ההכנה התא כגון ביצוע הפקודה Fc-בלוק נגד רצפטורים Fc של תאי B, למעט doublets, CD4+ CD19+ DP תא אוכלוסייה יכול להיות ממוזער (איור 3 א ו- B). עם זאת, שבריר DPs המדגימים לא פיזור קדמי (FSC) מאפייני doublets היא בלתי נמנעת, צריך להיות פיקוח החוצה מהשערים יחיד חיובי T ו- B cell (איור 3B). התוצאות שלנו גילה כי תאים B בתוך התאים DP CXCR5 מאוד מפורשת על פני השטח (איור 3C) עלול להוביל לתוצאות חיוביות כוזבות בשער TFH אשר מותאם מבוסס על CXCR5 ביטוי CD4+ T תאים. מצד שני, מצאנו כי GL7, סמן של תאי B מופעל, מתבטאת גם CD4+ CD19+ DP תאים (איור 3D), אשר עלולה לגרום להפרעה עם gating תא GC B.
דוגמאות של התא TFH ו- GC B gating אלגוריתמים מתוארת באיור 4. עבור GC B תא gating, נשתמש GL7 תיוג לעומת CD38, אשר מזהה תאים GC B כמו GL7+ CD38– B תאים (איור 4A-B). תיוג PNA עשוי לשמש במקום GL723 ואילו CD38 יכול להיות מוחלף על ידי אחד הסמנים הבאים: IgD Bcl-6, CD95. חלופה gating אסטרטגיות עבור תאים GC B מודגמות ב איור S1. יחס תא GC B PPs מראה שונות רבה במועדי בעכברים C57BL/6. אולם, לעומת אחרים SLOs, PPs יש יחס תא GC B באופן משמעותי גבוה יותר עם מגוון של 2-10% של תאים B הכולל בתנאים מצב יציב. Gating אסטרטגיה עבור תאים PP TFH מתואר CD19– CD4+ PD-1שלום CXCR5+ T תאים (איור 4A, ג). "זברה מגרש" נמצאה להיות שיטה הפגנה אופטימלית עבור TFH gating כמו זה מתאר PD-1היי אוכלוסייה יותר בצינעה לעומת סוגים אחרים מגרש (איור 4C). TFR, תת-קבוצה של תאים TFH לבטא Foxp3, הן פיקוח כמו CD19– CD4+ PD-1שלום CXCR5+ Foxp3+ T תאים (איור 4D). כאילו GC B תאים, השבר תאים TFH משתנה גם אצל אנשים העכבר unimmunized עם מגוון של 10 – 20% של סך CD19– CD4+ PP לימפוציטים. פרטים של אלגוריתמים המגביל חלופי TFH תאים מתוארים 4E איור, F ודמות S1C, ד
כדי להימנע חיוביות כוזבות עקב הרקע מכתים, autofluorescence, isotype בפקדי או חלופה שוות ערך כגון קרינה פלואורסצנטית מינוס אחד (FMO) צריכים להיכלל בלוח מכתימים כפקד שלילי עבור סמני תא TFH ו- GC B ( איור 4G-J).
כדי למטב את התנאים להכנה רקמת עמודים, פיתחנו הרומן פנימי מבוקרת ניסיוני אסטרטגיה, שבו PPs היו שנאספו מכל אחת לעכבר הבודד, איחדו בנפרד בהתאם מוצאם אנטומיים (למשל., תריסריון, ileal). עבור ביצוע ניסויים, PPs במאגר שהוזמנו כל כך כי כל ניסיוני מקבוצות, קבוצת הביקורת כללה מספר שווה של PPs של כל אזור אנטומי (איור 5A). לפי גישה זו, מצאנו את עיכול אנזימטי מבוסס collagenase (נבדק ב- 37.5 מ"ג של collagenase II או IV לכל 25 מ של עיכול מיקס = 1.5 mg/mL), אשר משמש בדרך כלל לבידוד לימפוציט רקמות הרירית שונים, CXCR5 מופחת באופן משמעותי ביטוי PP לימפוציטים (איור 5B), במיוחד בתאי TFH (איור 5F-אני), בעוד הביטוי של מולקולות על פני אחרים (למשל., CD19, CD4) נותרה ללא שינוי (איור 5 C-E). הפחתה של זיהוי CXCR5 היה בולט כך הביטוי של CXCR5 בתאי TFH שטופלו collagenase היה כמעט ולא isotype שליטה (איור 5F-אני). לניסויים נוספים הראו כי רמת הפרעות עיכול אנזימטי עם ביטוי CXCR5 הייתה תלויה CXCR5 נוגדנים השיבוט בשימוש (איור 6A-F). באופן ספציפי, על טיפול collagenase II, יכולת הזיהוי של שיבוט נוגדן CXCR5 2G 8 היה לקוי יותר באופן משמעותי, מאשר יכולת הזיהוי של השיבוט נוגדן CXCR5 L138D7 (איור 6A-D).
עיכול אנזימטי מופחת לא רק הביטוי של CXCR5, אלא גם את הפרופורציה של לימפוציטים הכולל בתוך התאים PP כפי שיקבע את מאפייני FSC-האס, תוך שבריר ניכר של תאים מבודד PPs מתעכל הציג קדימה וצד פיזור של בעוצמה גבוהה יותר מאשר PP לימפוציטים (איור 7 א-ג). השפעת collagenase על שחזור תא אירעה באופן תלוי מינון (איור 7 א, H-J). עיכול אנזימטי גדלה הכדאיות תא (איור 7D, E). עם זאת, הטבה זו לא מעמדת גרימה קושר collagenase עיכול כי התאים מבודד PPs לאחר התסיסה ללא collagenase היו אהודים באופן דומה (איור 7F). זיהוי הגורם שעתוק גרעיני Foxp3, וזה עניין מיוחד כאן כי זה בדרך כלל בבדיקות TFH בידוד כדי לזהות תאים TFR, היה משופר על ידי התסיסה ב 37 ° C ללא קשר collagenase עיכול (איור 7G ).

איור 1: מבנה מאקרוסקופית והפצה האנטומי של טלאים של פייה מאתר- (א)-תמונה המתקבל תריסריון-end של המעי הדק עם הקיבה. שני PPs הממוקם צמוד לבמה מצוינים עם חצים שחורים. (B). PPs שנאסף עכברים C57BL/6 11 היו מאוחסנים בנפרד בצלחת-ובכן 12. (ג)-תמונה של העכבר טרי נכרת PPs המוצג על מסננת תא 40 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
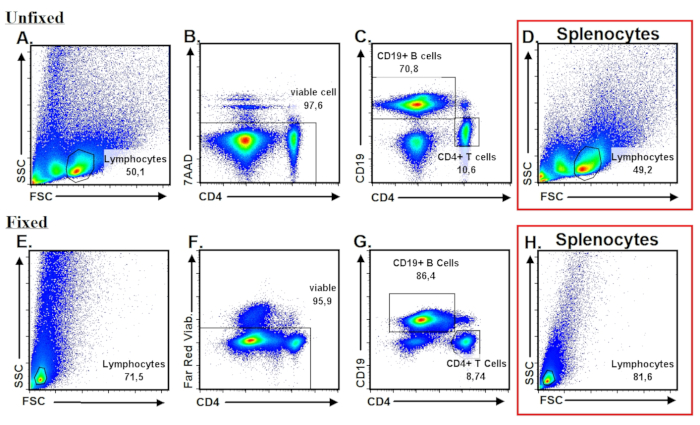
איור 2: זרימה בסיסיים באלגוריתם חסימה עבור PP לימפוציטים ואפיון cytometric. (א)-נקודה חלקות להדגים את חלוקת לימפוציטים PP מבולבל מבודד טריים לאורך צירים FSC של האס, אשר מוצג הדמיון הרב כדי splenocytes מצטיירת (D). (B)-אי-הכללה של תאים מתים על-ידי ביטוי 7AAD. 7AAD– תאים מייצגים תאים חיים. (ג)-CD19 ומבוסס-CD4 immunophenotyping של תאי T ו- B בקרב מגודרת מראש PP תאים חיים. (E-G). ניתוח תזרים נציג של לימפוציטים PP קבוע. (H). מאפייני הזרימה נציג של splenocytes קבוע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: CD4+ CD19+ כפול חיובי (DP) תאים כי שקר לממוצע ב TFH ו- GC B תא gating. (A). CD4+CD19+ DP לימפוציטים בתוך תאים חיים PP מודגמות. (B)-תאי ההפרדה של DP בהתבסס על מאפייני FSC כמו doublets ו ללבישה. (C,D). CXCR5 וביטוי GL7 של תאים DP מתוארים ב היסטוגרמה חלקות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
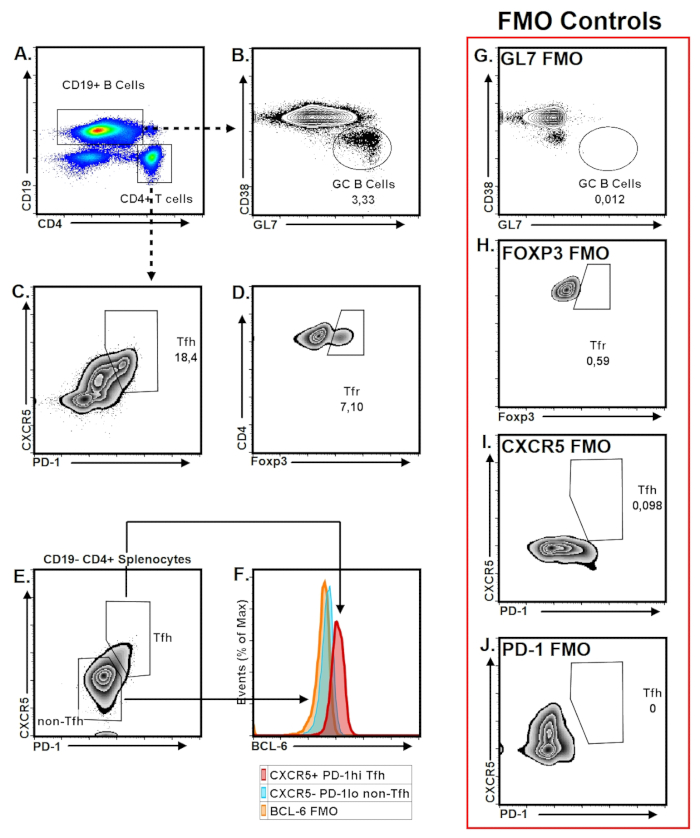
איור 4: TFH נציג ו- GC B תא אסטרטגיה חסימה. PPs שנאספו מעכבר 3 - חודש הזקן, לימפוציטים היו מבודדים כמתואר בסעיף פרוטוקול. (א) CD19 ו CD4 תיוג של לימפוציטים PP בשידור חי מתוארים. (B) CD38הלאו GL7שלוםCD19+ B תאים היו מגודרת כמו בתאי GC B. (ג) TFH התאים היו מגודרת כמו CXCR5+PD-1היי CD4+ תאים. (ד) TFR תאים שבריר של תאים TFH לבטא גורם שעתוק ספציפיים תא רגולטורי Foxp3 יחד עם סמנים TFH, הן פיקוח כמו CXCR5+ PD-1היי Foxp3+ CD4+ T תאים. (E-F) Gating אסטרטגיה עבור TFH סמני פני אישר splenocytes מבודד מן העכבר NP-ביצית-לחסן באמצעות ביטוי BCL-6. (G-J) קרינה פלואורסצנטית מינוס אחד (FMO) פקדים עבור מפתח TFH-TFR וסמנים תא GC מתוארים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: מבוסס על Collagenase עיכול אנזימטי מוביל ירידה מסיבית של זיהוי CXCR5. (א) PPs של עכבר בן חודש 2 ממוקם בתריסריון (≈ 1/3 proximal), מעי צם (≈ 1/3 האמצעי) מעי (≈ 1/3 דיסטלי) היו נאספים, איחדו בנפרד. PPs במאגר הופצו באופן שווה לקבוצות ניסיוני. עיכול אנזימטי עם collagenase II או IV ב- 1.5 mg/mL ריכוז בוצעה עם עצבנות 10 דקות ב 37 º C. (B-E) היסטוגרמה חלקות המתארים את הביטוי של מולקולות על פני (CXCR5, CD19, PD-1, CD4) של התאים מבודד PPs אשר היו נתונים מבוססי collagenase עיכול. (F-אני) TFH gating בתוך collagenase-מנוהל והפגינו שליטה קבוצות בזברה חלקות. נתונים מייצגים 3 ניסויים עצמאית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
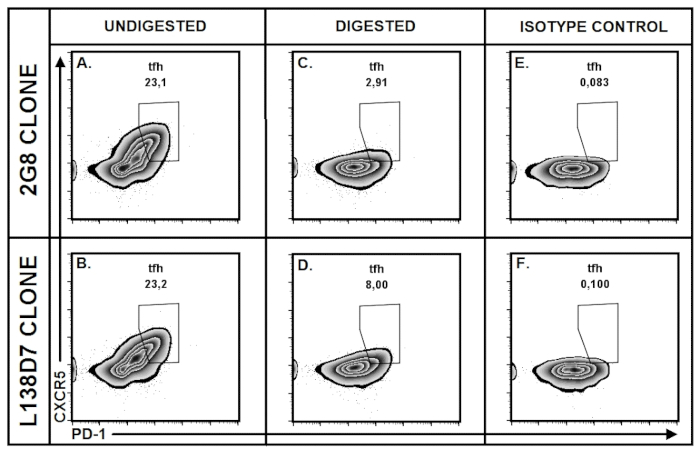
איור 6: השפעת collagenase על הביטוי CXCR5 הראו הבדל גדול בהתאם השיבוט נוגדן anti-CXCR5. לימפוציטים PP שנאספו מכל עכבר בן 6 חודשים, במאגר, מופרדים לתוך קבוצות שונות בנוגע נוגדן לשכפל עיכול אנזימטי והאהובות היישום. (A-F) היחס של תאים TFH מתואר בזברה חלקות בהישג מראש מגודרת חי, CD19– CD4+ T תאים. (א, ג , E) PP התאים היו מוכתמים הנוגדן CXCR5 העכבר אנטי ביוטין-מצומדת (כפיל 2G 8), ו Streptavidin מצומדת עם BV421 fluorochrome. תאים PP (B, D ו- F) היו מוכתמים ראשי מצומדת העכבר אנטי CXCR5 נוגדנים (שיבוט L138D7). (A-B) TFH gating חלקות מ לימפוציטים PP מעוכל. PPs (C-D) עם collagenase II (20 מ"ג/25 מ"ל של עיכול mix) מתעכל נסער 10 דקות ב 37 º C. נתונים מייצגים שני ניסויים עצמאית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 7: עצבנות ב 37 מעלות צלזיוס והעיכול מבוססות Collagenase להשפיע על הכדאיות תא, שחזור ויעילות מכתימים תאיים. עכבר C57BL/6 בן חודש 3 הוקרב; PPs היו נאספים, איחדו כפי שמתואר איור 5A. (א) לאחר האוסף של PPs, הרקמות היה נסער בנוכחות collagenase II (37.5 מ"ג/25 מ"ל של עיכול mix) למשך 10 דקות, מאפייני תאים PP קבוע FSC ואת האס מתוארים ב (א) הכדאיות מכתים העלילה מתוארת ב ( D)-(B, E) לאחר האוסף של PPs, הרקמות הוחזקו על קרח בלי עצבנות או עיכול אנזימטי; מאפייני תאים PPs קבוע FSC ואת האס מתוארים ב (B), הכדאיות מכתים מתואר ב- (E). (ג, F) לאחר האוסף של PPs, רקמות היו נסער-125-150 סל ד 10 דקות ב 37 מעלות צלזיוס בהיעדרו של collagenase; מאפייני FSC ואת האס ו הכדאיות צביעת תאי PP קבוע הם מתוארים (C, F), בהתאמה. השוואה (G) של Foxp3 ביטוי בתאי T רגולטוריים מבודד PPs נסערת ובלתי unagitated ללא collagenase המינהל מתואר בהמשך העלילה היסטוגרמה. (H-J) PPs שנאסף עכבר C57BL/6 - 6, בת חודשים וטופלו עם ריכוזים שונים של collagenase II: 25 מ ג לכל 25 מ ל מערכת העיכול מיקס, 15 מ ג לכל 25 מ ל מערכת העיכול ערבוב או לא collagenase. מתוארים FSC, האס מתווה אשר חושפים את ההשפעות של עיכול אנזימטי על שחזור תא PP ועם תשואה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
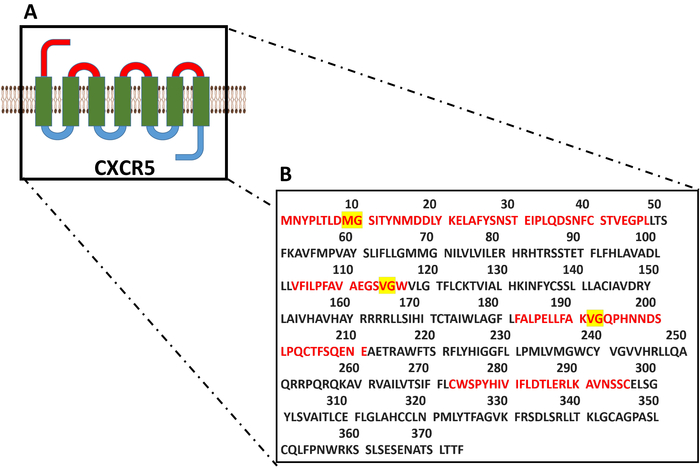
איור 8: המודל מולקולרית, על רצף חומצות אמיניות שלם CXCR5. (א) בשבעה מעברים טראנסממברנלי מבנה של CXCR5 הוא המודל. (B) רצף חומצות אמיניות שלם CXCR5 הוכח. הרצף של אזורים חוץ-תאית מסומן באדום, חוץ-תאית-חומצות אמינו עם קשרים כימיים רגיש presumable collagenase מודגמות בצהוב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| אנטיגן | שיבוט | Fluourochrome | דילול |
| CD4 | GK1.5, RM4-5 | APC, PECy7, PerCpCy5.5, FITC | בטחונות |
| CD19 | 6D 5 | FITC, APC/Cy7 | בטחונות |
| PD-1 | J43 | PE ef 610 (טקסס אדום) | בטחונות |
| ICOS | 15 F9, 7E.17G9 | PE | בטחונות |
| GL7 | GL7 | PerCp/Cy5.5 | 1:75 |
| CXCR5 | 2G 8,L138D7 * | ביוטין | 1:50 |
| BCL-6 | 7D 1 | PE/Cy7 | 1:50 |
| FOXP3 | FJK-16 | APC, PE | בטחונות |
| Streptavidin | - | BV421, PE | בטחונות |
| FixableViability צבע | - | BV 510(AQUA) | 1:1,000 |
| 7AAD | - | PerCp/Cy5.5 | שבערך |
| FcBlock (CD16/32) | 2.4G2 | - | 1:200 |
טבלה 1: סיכום נוגדן. דילולים, שיבוטים fluorochrome ההטיות נוגדנים הרלוונטיים, צבעי הכדאיות מצוינים. דילול אופטימליים עשויים להשתנות בהתאם הרבה לאיכות המוצר והתנאים ניסיוני. שיבוט ראשוני L138D7 מצומדת BV421 בשעה 1:20 דילול הראה יכולת זיהוי CXCR5 דומות עם 8 2G מצומדת ביוטין שיבוט בשעה 1:50 דילול. לכן, L138D7 מצומדת הראשי יכול לשמש אלטרנטיבה מצומדת ביוטין 2G 8 לשכפול.
איור משלים 1 (S1): אלטרנטיבי gating אסטרטגיות עבור תאי TFH ו- GC B. (א) מתוארים לימפוציטים PP לחיות מעכבר בן חודש 3 על רקע C57BL/6. (בג) בתאי GC B הן פיקוח כמו CD38– GL7+ (B) ו- BCL-6+ GL7+ B תאים (C). (D-E) תאים TFH מתוארים PD-1שלום CXCR5+ (ד) וכן ICOS+CXCR5+ CD4 + T תאים (E). אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
כאן, אנו מתארים את פרוטוקול אופטימיזציה עבור זרימת cytometric אפיון TFH ותאי GC B. אחד היתרונות הגדולים של פרוטוקול שלנו הוא שהם מאפשרים את ניתוקה של עד 107 (ממוצע 5-4 x 106 תאים) הכולל PP תאים מן עכבר אחת (זן C57BL/6) ללא כל תהליך העיכול. הבחנו כי התשואה cell סך הכל היה בקורלציה עם המספר של PPs, יכול להיות מוערך מן המשוואה פשוטה הבאה, אפשרות שימושית לתכנון הניסוי: "הכולל PP תא ספירת לכל העכבר = 0.5-1 x (מספר עמודים נכרת לכל בעכבר) x 106". זו תשואה גבוהה התא היה השלים עם תא משופרת הכדאיות (> 95%). שחזור משופר התא ואת הכדאיות מותר ביצוע ניתוח cytometric זרימה של קבוצות משנה לימפוציט שונים ב- PPs באמצעות נוגדן מגוונות צביעת לוחות במקביל.
לעומת פרוטוקול בידוד PP האחרונים שפורסמו על-ידי ז'זוס ואח. 20 ודוחות קודמים19,21, פרוטוקול שלנו נתן תשואה בתא סכום גבוה באופן משמעותי ואת הכדאיות, למרות העדר העיכול עם collagenase. למרות הזיהוי של PPs עלול להיות "מסובך" החוקרים בפעם הראשונה, עקומת למידה עבור פרוטוקול זה הוא גבוה למדי, אם שולט, הטכניקה שלנו מאפשרת זיהוי של כריתה כירורגית של PPs מן המעי הדק קצר הגיע הזמן. אם מספר עמודים שיופיעו לא הושגה לאחר הניסיון הראשון, אנו מציעים חוזר על השלב של זיהוי PP התמקדות בקצה הדיסטלי, מקורב של סי. במרפאה שלנו, כמעט בתוך כל עכבר, שני PPs מקרוב ממוקם בסוף תריסריון (איור 1 א') ולפחות 2-3 PPs במרחק 5 ס מ האחרון של מעי היו לזיהוי.
צביעת TFH יכול להיות תובעני יותר מאשר קבוצות אחרות תא משנה בתוך PPs, ובכך הדורשים תשומת לב נוספת18. אם צעדים מסוימים הם החמיצו במהלך עיבוד רקמות ובידוד תא, ייתכן תוצאות די מטעה. לפיכך, אנו ממליצים החוקרים להקדיש תשומת לב ניסיוני "העצות הבאות". מאז מפתח סמני TFH ו- GC B תא כגון CXCR5 ו- GL7 יכול להתבטא תאי B ו- T, חשוב לכלול סמן תא B נוגדנים חלוניות כדי למנוע תוצאות חיוביות כוזבות עקב CD19 משחיתה+CD4+ DP תאים24 ( איור 2). הינכם מתבקשים לשים לב כי gating אסטרטגיות מבוסס על תא T סמנים בלבד25 לא יספק מספיק אי-הכללה של תאים DP מאז תאים אלה גם מאוד לבטא סמני תא T כולל CD3 (נתונים לא מוצג) ו CD4. בנוסף הכללת תאים DP, לתוצאות cytometry זרימה צריך להיות מאומת ומאושר על-ידי העסקת הפקדים המתאימים שלילית (למשל., פקדים isotype, FMOs). לא רק חיוביות כוזבות, אלא גם שער TFH במקומה יכול להוביל והתוצאות כוזבות ומסקנות. לפעמים יכול להיות מאתגר ההתאמה של שער TFH במיוחד אם TFH תא האוכלוסייה אינה בשפע, ובכך לא מופיע כאוכלוסיה נפרדת ב cytometry זרימה. כדי לעקוף מגבלה זו, התוספת של מספר סמני TFH (למשל-BCL-6, PD-1, ICOS) לתוך נוגדן לוח עשוי לספק הזדמנויות המגביל חלופי ולהגדיל את דיוק26. מטעמים פרקטיים, BCL-6 נמצאה להיות שסמן מכתימים שיתוף אידיאלי עבור gating TFH חלופיים כמו זה יכול לשמש עבור gating GC B תאים בו-זמנית16 (איור S1C).
יתר על כן, יש דגימת בקרה חיובית המכילים שיעור גבוה TFH יכול לספק חוקרים ניווט טובה להנחה TFH שער כראוי. בניסויים שלנו, השתמשנו בדגימות PP של עכברים בגיל העמידה (שגילן עולה על 6 חודשים) כפקד חיובית מאז מצאנו כי הזדקנות גורמת השיפור של תאים TFH בתוך PPs עד 40% של CD4 הכולל+ T תאים במצב יציב (נתונים לא מוצג). אנו גם מעודדים את החוקרים שיש עוד עניין הפרטים הטכניים של TFH מכתים להסתכל על השיטות בספר שפורסם פרוטוקול עבור תא TFH מכתים18.
בדיקת השערות ניסיוני ב PP יכול להיות מאתגר יחסית, וייתכן שיידרשו מספר גבוה מאוד של עכברים לכל קבוצה כדי להגיע מובהקות סטטיסטית21. על ידי ניצול של התשואה גבוהה התא של פרוטוקול שלנו, אנחנו עקפו את המכשול הזה עם ניסיוני באסטרטגיות הבאות. ראשית, אנחנו טוחנות PPs, מיינו אותם בנפרד בהתאם מוצאם אנטומיים (למשל., תריסריון, jejunal ו- ileal). . אז, אנחנו מופץ באותה מידה אלה PPs במאגר לתוך שונים ניסיוני, קבוצות שליטה. אסטרטגיה ניסיוני פנימי מבוקרת זו אפשרה לנו למזער את ההבדל בין הפרט בעכברים בזמן כל התאים, התקבלו עכבר אחת.
יתר על כן, השתנות בין תאי המעי שונה (למשל., תריסריון vs. מעי)-דיווח בעבר כדי להיות משמעותי2 — נמנעה ככל ניסיוני, קבוצות הבקרה כללה של מספר שווה של PPs לכל האזור האנטומי (איור 5A). על ידי ביצוע/בית עצמאי ניסויים באמצעות אותה גישה, שיפרנו את המהימנות ואת המשמעות של התוצאות שלנו. מלבד היעדר וריאציות לא ספציפית, מתודולוגיה זו מסייעת גם עכברים חילוף, ריאגנטים וזמן.
במהלך פיתוח, אופטימיזציה של פרוטוקול שלנו, התוצאות שלנו גילה כי collagenase II-IV מבוססי מערכת העיכול בצורה בולטת מופחתת ביטוי CXCR5 (איור 5B) ואילו מולקולות על פני אחרים לגילוי TFH ונשאר בתאי GC B (ללא פגע איור 5C -E) . דיווחו לאחרונה יופיטר פרוטוקול19, collagenase II הוצגה ויעילים מאוד לבידוד לימפוציט PPs ו LPs. עם זאת, collagenase II דווחה בעבר לקיים פעילות tryptic גבוהה, דבר המתבטא המחשוף של מספר מולקולות על פני. נתון שלה הטבע ידידותי השטח-מולקולה27 עקב פעילות tryptic נמוכה יותר נפוץ יותר השימוש בספרות28,29,30, Collagenase הרביעי היה גם לכלול בנוסף collagenase II ב המחקר שלנו בשימוש הריכוזים כמומלץ בדוחות קודמים אלה. השימוש collagenase ואנזימים המקבילה כבר בעיית סותרות אימונולוגיה הרירית עקב השפעות לא רצויות העיכול תאים חיסוניים משתנה כגון מולקולה משטח ביטוי31,27.
בעבר דווח כי השימוש של סוגים שונים של collagenase עלולה להפריע זרימת cytometric CXCR5 זיהוי בתוך הבטן האנושית32 ו שקדים דגימות18. לעומת זאת, מחקרים אחרים הראו בידודו של תאי TFH ו- GC B מ- PPs ללא שימוש24,collagenases33. עם זאת, עד עכשיו אין גישה השוואתית כבר על עצמו כדי להעריך אם הכללה או אי הכללה של עיכול collagenase מייצגים מצב אופטימלי עבור בידוד של תאים TFH לבטא CXCR5 מן CXCR5 העכבר ול-pps מאתר היא 374 חומצת אמינו חלבון ממברנה ארוך בשבעה מעברים עם אזורים חוץ-תאית קצר יחסית בהשוואה לחלבונים transmembrane אחרים כגון CD4, CD19 באים לידי ביטוי בשפע בתאים הלימפה PPs (והנתונים שהתקבלו UniProt). איור 8A-B, מודל מולקולרית, חומצת אמינו הכולל רצף של העכבר CXCR5 מתוארים עם הרצפים היעד המשוער של עיכול מבוססי collagenase, אשר נוטה לנתק קשרים כימיים בין נייטרלי אמינו גליצין (Gly) חומצות34. המבנה המולקולרי transmembrane בשבעה מעברים וכתוצאה מכך קצר חוץ-תאית תחומים ייתכן שאחראי לייצור המולקולה CXCR5 לפגיע עיכול אנזימטי (איור 8A). מסקרן, מצאנו את הגילוי של הביטוי CXCR5 לאחר collagenase הטיפול תלויה השיבוט הנוגדן בשימוש. למרות 2G 8 ו שיבוטים L138D7 הראו ביצועים דומים בקבוצה PP מעוכל, כפי שנקבע על-ידי זיהוי שברים TFH דומות, בקבוצה PP מעוכל, שיבוט L138D7 גילה כ 3 x (≈ 9%) חלק גבוה יותר של תאים TFH בתוך CD4+ תאי T מאשר 2G 8 שיבוט (≈ 3%) (איור 6). ממצא זה מצביע על כך מכתים CXCR5 מופחת עשוי להיות משני לתצורת ששונה epitope תלת מימדי על ידי הפעילות האנזימטית מתרחשת של collagenase. התוצאות שלנו מציינים כי יש להימנע מבוססי collagenase העיכול במהלך ההכנה PP.
ההפרעה של דיסוציאציה collagenase עם גילוי מולקולה CXCR5 היה מצויין למעט השלב לעיכול. עם זאת, יצוין כי על רקמות מסוימות כגון דיקור, שיבושים מכניים אינה מספיקה כדי לבודד את התאים ויהיה כזה לרקמות, עיכול אנזימטי נדרש19. בעתיד, זה יהיה חיוני כדי לבדוק תנאים חלופיים עיכול, כמו גם מערכת העיכול תואמי נוגדן שיבוטים כדי לעקוף מגבלה זו טכני בשביל לרקמות הדורשות תהליכי עיכול אנזימטי. עד אז, טכניקות הדמיה כגון מיקרוסקופ פלורסצנטיות המערכת החיסונית תישאר כמו שיטת הבחירה לגילוי TFH ברקמות אלה. בנוסף לבודד תאים LP, בידודו של כמה קבוצות משנה תא hematopoietic כגון DCs ותאים פלזמה PPs דורשים עיכול אנזימטי35. בעת העסקת פרוטוקול שלנו, חוקרים המבקשים לבודד קבוצות משנה אלה תא מ- PPs עליך לכלול את שלב המתאים עיכול אנזימטי20. הפרעות אפשריות של עיכול אנזימטי עם הביטוי של DC סמנים צריכים להילקח בחשבון וממוטב עיכול התנאים צריכים להיות לפי הצורך. מתי בידוד תאי TFH ו- GC B רצוי בנוסף תת-קבוצה תא שדורש עיכול collagenase36, PPs שנאסף בכל עכבר יכול להיות מופרדים בשתי קבוצות לעיבוד עם וללא טיפול collagenase פאנלים מקבילים.
השפעת collagenase על לימפוציטים PP לא היו מוגבלים לביטוי מולקולה משטח. התוצאות שלנו גילה כי עיכול אנזימטי נגרמת ירידה יחסית ביחס של לימפוציטים בתוך התאים PP באופן תלוי מינון (איור 7). הירידה של השבר לימפוציט עשוי להיות תוצאה של בתיווך collagenase שחרור של סוגים אחרים של קבוצות משנה תא hematopoietic כגון phagocytes ו- DCs PPs כי הם גדולים יותר פרטנית יותר מאשר בתאי הלימפה. זה גם אפשרי כי עיכול collagenase מתווכת שחרור תאים שכנים LP, תאים intraepithelial הנרתיק יכול לתרום השינוי של פרופיל FSC-האס. זה זיהום תא של תאים אחרים הבטן עלול גם לגרום להפרעה בניתוח זרימה של לימפוציטים PP. על בסיס זה להגדיל את טוהר תא, אנחנו גם למנוע התוספת של ריאגנטים כגון EDTA או DTT אשר נמצאים בשימוש נרחב כדי לחלץ בתאי אפיתל ריר20, שמירה על תנאים הכנת הרקמה הפיזיולוגיות, unmanipulated ככל האפשר. למרות אלה השפעות שליליות של עיכול אנזימטי, השפעות מועילות על לימפוציטים PP התגלו גם כגון שיפור של צביעת תאיים, תא הכדאיות (איור 7D-F, G). לעומת זאת, עוד ניתוחים גילה כי תופעות אלו יוחסו תהליך עצבנות ב 37 ° C ללא תלות עיכול אנזימטי כי התא הכדאיות, צביעת Foxp3 תאיים היו אהודים במידה דומה כאשר התאים היו עצבני ב העדר collagenase. . Mechanistically, ההשפעה החיובית של עצבנות ייתכן כתוצאה מהסרת משופרת, ריר PPs של תוכן המעי.
לסיכום, שתיארנו פרוטוקול יעילים לבידוד של לימפוציטים מ ול-pps מבודד יכול להיות מוכתם זרימה אפיון cytometric של מספר קבוצות משנה תא או יכול להיות נתון מיון תא והתאים לאחר מכן המועסקים שונים הפריה , ויוו מבחני פונקציונלי.
Disclosures
שאין ניגודי אינטרסים הכריז.
Acknowledgements
ברצוננו תודה לורה שטראוס ומרווה פיטר לדיונים מועיל ולתמוך עם ניתוחים cytometry זרימה.
Materials
| Name | Company | Catalog Number | Comments |
| anti-mouse CD4 antibody | eBioscience, Biolegend* | 17-0041-81 ,10054* | For detailed information see Table 1 |
| anti-mouse CD19 antibody | eBioscience | MA5-16536 | For detailed information see Table 1 |
| anti-mouse PD-1 antibody | eBioscience | 61-9985-82 | For detailed information see Table 1 |
| anti-mouse ICOS antibody | eBioscience | 12-9942-82 | For detailed information see Table 1 |
| anti-mouse GL7 antibody | Biolegend | 144610 | For detailed information see Table 1 |
| anti-mouse CXCR5 antibody | Biolegend*, BD Bioscience | 145512*, 551960 | For detailed information see Table 1 |
| anti-mouse BCL-6 antibody | Biolegend | 358512 | For detailed information see Table 1 |
| anti-mouse Foxp3 antibody | eBioscience | 17-5773-82 | For detailed information see Table 1 |
| Streptavidin-BV421 | BD Bioscience | 563259 | For detailed information see Table 1 |
| FixableViability Dye | eBioscience | L34957 | For detailed information see Table 1 |
| 7AAD | Biolegend | 420404 | For detailed information see Table 1 |
| FcBlock (CD16/32) | BD Bioscience | 553141 | For detailed information see Table 1 |
| Collagenase II | Worthington | LS004176 | |
| Collagenase IV | Worthington | LS004188 | |
| Foxp3/Transcription Factor Staining Buffer Set | eBioscience | 00-5523-00 | |
| 6-well,12-well & 96-well plates | Falcon/Corning | 353046,353043/3596 | |
| 50 mL conical tubes | Falcon | 3520 | |
| 40 µm cell strainer | Falcon | 352340 | |
| 10 mL syringe-plunger | Exel INT | 26265 | |
| RPMI | Corning | 15-040-CV | |
| PBS | Corning | 21-040-CM | |
| FBS | Atlanta Biologicals | S11150 | |
| Orbital shaker | VWR | Model 200 | |
| Curved-end scissor | |||
| Fine Serrated Forceps | |||
| Small curved scissor |
References
- van den Berg, T. K., van der Schoot, C. E. Innate immune ‘self’ recognition: a role for CD47-SIRPα interactions in hematopoietic stem cell transplantation. Trends in Immunology. 29 (5), 203-206 (2008).
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Reboldi, A., Cyster, J. G. Peyer’s patches: Organizing B-cell responses at the intestinal frontier. Immunological Reviews. 271 (1), 230-245 (2016).
- Heel, K. A., McCauley, R. D., Papadimitriou, J. M., Hall, J. C. Review: Peyer’s patches. Journal of Gastroenterology and Hepatology. 12 (2), 122-136 (1997).
- Fagarasan, S., Kinoshita, K., Muramatsu, M., Ikuta, K., Honjo, T. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria. Nature. 413 (6856), 639-643 (2001).
- Hopkins, S. A., Niedergang, F., Corthesy-Theulaz, I. E., Kraehenbuhl, J. P. A recombinant Salmonella typhimurium vaccine strain is taken up and survives within murine Peyer’s patch dendritic cells. Cellular Microbiology. 2 (1), 59-68 (2000).
- Shreedhar, V. K., Kelsall, B. L., Neutra, M. R. Cholera toxin induces migration of dendritic cells from the subepithelial dome region to T- and B-cell areas of Peyer's patches. Infection and Immunity. 71 (1), 504-509 (2003).
- Sato, A., Iwasaki, A. Peyer’s patch dendritic cells as regulators of mucosal adaptive immunity. Cellular and Molecular Life Sciences. 62 (12), 1333-1338 (2005).
- Bemark, M., Boysen, P., Lycke, N. Y. Induction of gut IgA production through T cell-dependent and T cell-independent pathways. Annals of the New York Academy of Sciences. 1247 (1), 97-116 (2012).
- Fagarasan, S., Kawamoto, S., Kanagawa, O., Suzuki, K. Adaptive Immune Regulation in the Gut: T Cell-Dependent and T Cell-Independent IgA Synthesis. Annual Review of Immunology. 28, 243-273 (2010).
- Hase, K., et al. Uptake through glycoprotein 2 of FimH + bacteria by M cells initiates mucosal immune response. Nature. 462 (7270), 226-230 (2009).
- Wu, H., et al. An Inhibitory Role for the Transcription Factor Stat3 in Controlling IL-4 and Bcl6 Expression in Follicular Helper T Cells. Journal of Immunology. 195 (5), 2080-2089 (2015).
- Vinuesa, C. G., Tangye, S. G., Moser, B., Mackay, C. R. Follicular B helper T cells in antibody responses and autoimmunity. Nature Reviews Immunology. 5 (11), 853-865 (2005).
- Victora, G. D., Nussenzweig, M. C. Germinal Centers. Annual Review of Immunology. 30, 429-457 (2012).
- Vaeth, M., et al. Store-Operated Ca2+Entry in Follicular T Cells Controls Humoral Immune Responses and Autoimmunity. Immunity. 44 (6), 1350-1364 (2016).
- Meli, A. P., et al. The Integrin LFA-1 Controls T Follicular Helper Cell Generation and Maintenance. Immunity. 45 (4), 831-846 (2016).
- Fu, W., et al. Deficiency in T follicular regulatory cells promotes autoimmunity. Journal of Experimental Medicine. 215 (3), 815-825 (2018).
- Espéli, M., Walker, J. M. T follicular helper cells - Methods and Protocols. , (2015).
- Couter, C. J., Surana, N. K. Isolation and Flow Cytometric Characterization of Murine Small Intestinal Lymphocytes. Journal of Visual Experiments. (111), e54114(2016).
- De Jesus, M., Ahlawat, S., Mantis, N. J. Isolating And Immunostaining Lymphocytes and Dendritic Cells from Murine Peyer’s Patches. Journal of Visual Experiments. (73), e50167(2013).
- Pastori, C., Lopalco, L. Isolation and in vitro Activation of Mouse Peyer’s Patch Cells from Small Intestine Tissue. Bio-protocol. 4 (21), e1282(2014).
- Fukuda, S., Hase, K., Ohno, H. Application of a Mouse Ligated Peyer’s Patch Intestinal Loop Assay to Evaluate Bacterial Uptake by M cells. Journal of Visual Experiments. (58), 3225(2011).
- Naito, Y., et al. Germinal Center Marker GL7 Probes Activation-Dependent Repression of N-Glycolylneuraminic Acid, a Sialic Acid Species Involved in the Negative Modulation of B-Cell Activation. Molecular and Cellular Biology. 27 (8), 3008-3022 (2007).
- Bollig, N., et al. Transcription factor {IRF4} determines germinal center formation through follicular T-helper cell differentiation. Proceedings of the National Academy of Science of U. S. A. 109 (22), 8664-8669 (2012).
- Pérez-Mazliah, D., et al. Follicular Helper T Cells are Essential for the Elimination of Plasmodium Infection. EBioMedicine. 24, 216-230 (2017).
- Sage, P. T., Sharpe, A. H. T follicular regulatory cells in the regulation of B cell responses. Trends Immunology. 36 (7), 410-418 (2015).
- Van Damme, N., et al. Chemical agents and enzymes used for the extraction of gut lymphocytes influence flow cytometric detection of T cell surface markers. Journal of Immunological Methods. 236 (1-2), 27-35 (2000).
- Meenan, J., et al. Altered expression of alpha 4 beta 7, a gut homing integrin, by circulating and mucosal T cells in colonic mucosal inflammation. Gut. 40 (2), 241-246 (1997).
- Cao, A. T., et al. Interleukin (IL) -21 promotes intestinal IgA response to microbiota. Mucosal Immunology. 8 (5), 1072-1082 (2015).
- Wei, J., et al. Autophagy enforces functional integrity of regulatory T cells by coupling environmental cues and metabolic homeostasis. Nature Immunology. 17 (3), 277-285 (2016).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. 33 (S1), (2017).
- Bergqvist, P., Gardby, E., Stensson, A., Bemark, M., Lycke, N. Y. Gut IgA Class Switch Recombination in the Absence of CD40 Does Not Occur in the Lamina Propria and Is Independent of Germinal Centers. Journal of Immunology. 177 (11), 7772-7783 (2006).
- Keil, B., Gilles, A. M., Lecroisey, A., Hurion, N., Tong, N. T. Specificity of collagenase from Achromobacter iophagus. FEBS Letters. 56 (2), 292-296 (1975).
- Mora, J. R., et al. Selective imprinting of gut-homing T cells by Peyer’s patch dendritic cells. Nature. 424 (6944), 88-93 (2003).
- Reboldi, A., et al. Mucosal immunology: IgA production requires B cell interaction with subepithelial dendritic cells in Peyer’s patches. Science. 352 (6287), (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved