Method Article
Гиалуроновой кислоты на основе гидрогелей для 3-мерного культуры клеток пациента производные глиобластомы
В этой статье
Резюме
Здесь мы представляем собой протокол для трехмерных культуры клеток глиобластомы пациента производные в пределах ортогонально перестраиваемый биоматериалов, предназначен для имитации матрице мозга. Этот подход обеспечивает в пробирке, экспериментальная платформа, которая поддерживает многие характеристики в естественных условиях обычно потерял в культуре клеток глиобластомы.
Аннотация
Глиобластома (GBM) является наиболее распространенным, но наиболее смертоносных, рак центральной нервной системы. В последние годы многие исследования были посвящены как внеклеточного матрикса (ECM) уникальный мозг окружающей среды, таких как гиалуроновая кислота (HA), облегчает GBM прогрессии и вторжения. Однако большинство в vitro культуры модели включают GBM клетки вне контекста ECM. Часто также используются мышиных ксенотрасплантатов GBM клеток. Однако в естественных условиях модели делают сложно изолировать взносов индивидуальных особенностей комплекса опухоли микроокружения опухоли поведение. Здесь мы описываем HA на основе гидрогеля, трехмерные (3D) культуры платформу, которая позволяет исследователям самостоятельно изменять концентрацию га и жесткость. Высокомолекулярный HA и полиэтиленгликоля (PEG) составляют гидрогели, которые являются высокоструктурированные через Майкл тип сложения в присутствии живых клеток. Пациента производный GBM клетки экспонат жизнеспособность и распространения 3D гидрогеля культур ставки так хорошо, как, или лучше, чем, когда культивировали как стандартный gliomaspheres. Гидрогель система также позволяет включение ECM-подражательный пептидов изолировать эффекты взаимодействия конкретных клеток ECM. Гидрогели оптически прозрачным, так что живой клетки могут отражаться в 3D культуры. Наконец HA гидрогеля культур совместимы с стандартных методов молекулярной и клеточной анализов, включая ПЦР, Западный blotting и cryosectioning следуют иммунофлюоресценции пятнать.
Введение
Трехмерная (3D) культуры систем пилки взаимодействия между клетками и их окружающие внеклеточного матрикса (ECM) в родной тканях лучше, чем их двухмерный (2D) коллегами1,2. Выдвижения в тканевой инженерии принесли сложные, 3D культуры платформы, которые позволяют контролируемых расследование 1) как химические и физические компоненты матрицы микроокружения влияет на клетки поведения и 2) эффективность новых терапевтических стратегии для целого ряда заболеваний, включая рак2. В то время как в vitro модели нельзя объяснить системных факторов, таких как эндокринной и иммунной сигналов и таким образом не может полностью заменить в естественных условиях модели, они предоставляют ряд преимуществ, включая воспроизводимости, экспериментальная управления, доступность и скорость. Здесь мы описывают использование мозга подражательный гидрогели, в котором 3D культур клеток опухоли пациента производные мозга захватить многие аспекты опухоли физиологии, в частности, динамику получения лечения сопротивление3. По сравнению с другими методами в пробирке , эти культуры лучше представляют в естественных условиях модели опухоли и клинических наблюдений3.
Глиобластома (GBM) является наиболее частой и смертоносных рака, происходящих в головном мозге, с медиана выживаемости лишь 1-2 года4,5. В последние годы многие исследования были сосредоточены на влияние среды матрица опухоли в GBM6,,7,8. Было сообщено ECM уникальный мозг влияет на GBM ячейки миграция, распространение и терапевтические сопротивление6,,78,9,10,11 , 12. гиалуроновая кислота (HA) – обильные Глюкозаминогликан (GAG) в головном мозге, где он взаимодействует с другими приколами и протеогликаны формы Гидрогель как сетка13. Многие исследования сообщили HA гиперэкспрессия в GBM опухоли и его последующее воздействие на рак прогрессия8,9,13,14,15,16 ,17. Другие компоненты ECM также влияют на GBM опухолевого роста и вторжения6,7,15,18. Например фибронектин и vitronectin, которые обычно оверэкспрессировали в GBM, побудить heterodimerization рецепторов клеток поверхности Интегрин через привязку к последовательности «РСЗ» и инициировать комплекс сигнальные каскады, способствующих выживания опухоли19 ,,2021. Кроме биохимических влияний физические свойства ткани матрицы также влияют на GBM прогрессии22,23.
Постоянное приобретение резистентности к терапии является одной из главных движущих сил GBM летальность4. Наркотики, показывая многообещающие результаты в 2D или gliomasphere модели потерпели неудачу в последующих исследованиях на животных и клинические случаи3, указав, что воздействие microenvironmental факторов значительно способствовали GBM опухоли ответ1. В то время как Животные модели могут обеспечить 3D, физиологически целесообразно микроокружения xenografted клетки пациента и генерировать клинически значимых исходах24,25, сложность мозга микроокружения в естественных условиях делает его трудно определить, какие функции, включая ячейки матрицы взаимодействия, являются ключевыми для конкретных биологических результатов. Выявление новых терапевтических целей выиграют от использования упрощенных культуры платформ, в которых определены биохимические и биофизические свойства.
В отличие от сообщалось ранее биоматериала модели GBM опухоли микроокружения26,27 , которые не достигли истинный ортогональных контроль над индивидуальных биохимические и физические особенности ECM, платформа биоматериала сообщил здесь позволяет разделение вклад нескольких независимых функций GBM фенотипа клетки. Здесь мы представляем систему гидрогеля на основе ха, ортогонально перестраиваемый, для 3D культуры клеток пациента производные GBM. Гидрогели формируются из двух полимерных компонентов: 1) биологически активных HA и 2) биологически инертным полиэтиленгликоля (PEG). PEG является широко используемым биосовместимых и гидрофильные материал с низким содержанием белка адсорбции и минимальным иммуногенности28. Здесь около 5% глюкуроновой кислоты постановление на HA цепи являются функционализированных с тиоловых групп для сшивки в коммерчески доступных 4-руки КОЛЫШЕК с малеинимидов через Майкл тип сложения. В его наиболее распространенной форме в организме HA существует в цепи высокомолекулярного (HMW). Здесь низкой степенью модификации HMW га (500-750 кДа) помогает сохранить родной взаимодействия HA и его рецепторы клеток, в том числе CD4429. Заменив PEG-тиоловых для HA-тиоловых при сохранении постоянной молярное соотношение общего тиолы к малеинимидов, ха концентрации могут быть отделены от механических свойств в результате гидрогелей. Кроме того нейтро элементы управления могут использоваться для конъюгата хвоща завершенной пептиды для определенных среднее количество maleimide завершенной оружия на каждый 4-руки КОЛЫШЕК. Включение пептидов ECM-производные, клей позволяет взаимодействия с интегринов на культивируемых клеток, через которые биохимических и химических сигналов, transduced1. Maleimide тиоловых дополнение происходит очень быстро, в физиологических условиях, свести к минимуму время, необходимое для инкапсуляции клеток и максимизация выживание пациента, полученных клеток. Кроме того гидрогеля культур можно рассматривать как образец типичных ткани и совместимы с методами стандартных характеристик, включая Западный blotting, проточной цитометрии и пятнать иммунофлюоресценции. Следующий протокол описывает процедуры для изготовления гидрогели, создание 3D культур клеток пациента производные GBM и методы биохимического анализа.
протокол
Все человеческие ткани коллекции шаги были проведены под институционально утвержденных протоколов.
1. Thiolation гиалуроновой кислоты
Примечание: Молярная коэффициенты указаны отношении общее количество групп карбоксилат если не указано иное.
- Растворите 500 мг натрия гиалуронат (HA, 500-750 кДа) на 10 мг/мл в дейонизированной, дистиллированной воде (DiH2O) в автоклаве стерилизации, 250 мл колбу Эрленмейера. Перемешайте раствор (~ 200 об/мин) при комнатной температуре на 2 часа, чтобы полностью растворить га. Используйте перемешать бар и Плиты магнитные перемешать держать перемешивании во время процедуры thiolation реакции.
- С помощью 0,1 М соляной кислоты (HCl), скорректировать рН раствора ха-5.5. Весят, 69,6 мг (0.25 x молярное соотношение) 1-ethyl-3-(3-dimethylaminopropyl) Карбодиимиды (EDC).
Примечание: Хотя нерастворенных EDC могут быть добавлены непосредственно в решение HA, это обычно проще сначала растворяют EDC в 1 мл DiH2O и затем быстро добавить решение EDC ха решение. До распада в 1 мл DiH2O также может быть сделано с N-оксисукцинимидного (ГСЗ) и Цистамин dihydrocholoride перед добавлением к реакции в шаге 1.3 и 1.4. - Добавьте 17,9 мг (0,125 x молярное соотношение) ГСЗ в реакции. Отрегулируйте рН раствора реакции 5.5 с помощью 0,1 М HCl и инкубировать реакции при комнатной температуре в течение 45 минут.
- Добавьте 70,0 мг (0.25 x молярное соотношение) Цистамин дигидрохлорида в раствор реакции. Для регулировки рН до 6,25 используйте 0,1 М гидроокиси натрия (NaOH). Инкубируйте реакции при комнатной температуре на ночь помешивая.
- На следующий день используйте 1 M NaOH для регулировки рН реакции раствора около 8. Добавьте 192 мг (4 x молярное соотношение) Дитиотреитол (DTT) реакции. Отрегулируйте pH обратно до 8 после добавления DTT и оставить помешивая на 1-2 часа при комнатной температуре.
- Для регулировки рН 4 Используйте 1 M HCl. Перевести весь реакционную смесь в предварительно замоченные диализа мембраны (молекулярный вес отсечения вокруг 13 кДа) и dialyze против DiH2O заранее скорректирована до pH 4.
Примечание: Объем DiH2O для диализа должны быть по крайней мере 40 раз объем раствора отреагировал ха (например, 50 мл образцов в 2 Л DiH2O, рН 4). - Замените диализа решение (DiH2O, pH 4) дважды ежедневно в течение 3 дней при комнатной температуре.
- Фильтр dialyzed решение через мембрану 0,22 мкм, вакуум управляемый фильтр. Флэш-замораживания раствора thiolated HA в жидком азоте. Используйте лиофилизатор заморозить сухих образцов в течение 2 дней. Thiolated га в сухом виде может храниться в вакуумной Эксикатор при-20 ° C по меньшей мере 6 месяцев.
- Для определения степени thiolation, используйте Эллман в тест или Протон ЯМР спектроскопии30,31.
2. Подготовка материалов сшивки
- Растворяют thiolated HA на желаемой концентрации (в этом примере, 13.3 мг/мл) в HEPES-амортизированное saline (20 мм HEPES в буфере сбалансированных соли физраствора (HBSS) Хэнка, скорректированы падать в пределах рН 8-9) в Янтарный флакон для сведения к минимуму воздействия окружающего света. Держите решения, постоянно помешивая.
Примечание: Образование дисульфидных связей между тиолов, конъюгированных с ха может произойти, если рН выше 8, концентрация раствора слишком высока, или решение осталось перемешивания для слишком долго до гелеобразования. Чтобы избежать этой проблемы, используйте ниже 15 мг/мл thiolated HA и распустить thiolated HA в течение 2 часов формирования гидрогели. - Растворите 4-руки PEG-maleimide (PEG-Mal, 20 кДа) и 4-руки PEG-тиоловых (PEG-тиоловых, 20 кДа) в фосфатный буфер (PBS), рН 7,4, подготовить 50 мг/мл PEG-Mal и ПЭГ тиоловых акций решения.
Примечание: Она занимает по крайней мере 1 час полностью растворить PEG реагентов. - Если добавление ECM-производные пептиды, Растворите цистеин содержащее пептидов в PBS подготовить раствор.
Примечание: Использование запасов концентрации 2-4 мм. - Замочите силиконовая резина формы в этаноле для по крайней мере 20 минут, чтобы очистить их и затем автоклав их стерилизации.
3. гидрогеля сшивки и инкапсуляции ячейки
Примечание: в качестве примера, инкапсуляции четырех человек, 80 мкл гидрогели с 0,5% (w/v) HA и модуль сжатия 1 кПа вот описаны3. Смотрите таблицу 1 для примера рецептов, которые дают гидрогели с различными свойствами: два гидрогели, включения Интегрин привязки пептид РСЗ и два гидрогели, включение хвоща шапки как отрицательный контроль деятельности пептида. Заполнение концентрации клеток пациента производные GBM — это 500000 клеток/мл.
- Разбавьте PEG-Mal Стоковый раствор (50 мг/мл, от шага 2.2) до 12,5 мг/мл, добавив 40 мкл раствора акций 120 мкл PBS. Разбавленный раствор можно разделить две 1,5 мл microcentrifuge трубы так, чтобы каждая трубка имеет 80 мкл.
- Добавьте 16 мкл запасов РСЗ решение (2,8 мм, с шагом 2.3) одной трубы и 16 мкл раствора (2,8 мм, с шагом 2.3) запасов хвоща на вторую трубу. Вихрь смешивать. Место PEG-Mal-РГД или ПЭГ-Mal-CYS решения на льду до использования в шаг 3.9.
Примечание: Процедура, как описано здесь гидрогели урожайности с ~ 140 мкм пептида. Это эквивалентно примерно 1 из каждые 8 доступных оружия PEG заняты с пептид. Это может быть изменено путем изменения молярное соотношение хвоща завершенной пептиды доступны maleimide групп. В общем максимальная концентрация 280 мкм пептида может быть достигнуто оставляя достаточное количество maleimide групп, доступных для сшивки гидрогеля. - ПЭГ тиоловых Стоковый раствор (50 мг/мл, от шага 2.2) до 5 мг/мл разбавляют путем смешивания 4 мкл 50 мг/мл Стоковый раствор с 36 мкл PBS. Мкл 120 растворенного, thiolated HA от шаг 2.1 к смеси.
Примечание: Решения HMW га являются очень вязкой. Таким образом мы рекомендуем использовать широкий отверстия микропипеткой подсказка для передачи решения. Пипетка медленно, чтобы избежать решения прилипание к стенкам микропипеткой наконечник и улучшить точность измерений. - Место чистой, сухой плесени (подготовленных на шаге 2.4) в каждой скважине лечение 12-ну плиты культуры ткани. Использование чистой, тупой конец кончика пипетки, нажмите на гель плесени и дважды проверить уплотнение между плесени и нижней части хорошо пластины.
Примечание: Проверьте герметичность снова прямо перед инкапсуляцией для предотвращения утечки. - Проход культивируемых клеток GBM, разъединять в отдельные ячейки и определить, что концентрация клеток как описано3.
Примечание: Некоторые GBM линии не могут быть отделены в отдельные ячейки. В этом случае может быть инкапсулирована вся gliomaspheres. Однако Подготовьте диссоциированных единичных клеток после точного клеток подсчета для улучшения воспроизводимость. Протокол для gliomasphere пассированый варьируется среди различных лабораторий и многие из них, вероятно, совместимы с гидрогеля инкапсуляции.- (Рекомендуется) Центрифуги gliomaspheres на 500 g x 5 мин удалить супернатант и добавьте 1 mL фермента диссоциации клеток в клетки Пелле. Затем Инкубируйте на 5 мин, аккуратно касания трубку агитировать.
- Добавьте 4 мл полной питательной среды (50 нг/мл EGF 20 нг/мл ФБП-2, 25 мкг/мл гепарина, G21 дополнения и 1% пенициллина/стрептомицина в среде DMEM/F12) клетки.
- Центрифуга снова на 500 g x 5 минут и удалить супернатант. Наконец Ресуспензируйте Пелле клеток в 1 мл полного среднего и пройти подвесные клетки через стрейнер ячейки 70 мкм. (Рекомендуется) мыть сито с еще 4 мл полной среды увеличить количество ячеек восстановлены.
- Оценки концентрации клеток в суспензии с помощью Горяева. Суспензию клеток разделен на 2 пробирок, где каждая трубка содержит ~ 80000 клетки. Центрифуга на 500 g x 5 мин; как правило 80000 клетки будут составлять 2 80 мкл гидрогели.
- Удалить супернатант и Ресуспензируйте один Пелле в 80 мкл раствора ПЭГ-MAL-РСЗ и второй Пелле в 80 мкл раствора ПЭГ-MAL-CYS (подготовленных на шаге 3.1).
- С помощью 200 мкл, широкий отверстия микропипеткой наконечник, обойтись 40 мкл раствора ха (от шага 3.3 выше) в каждой резиновые силиконовые формы (как подготовленные на шаге 3.4).
- С помощью 200 мкл, широкий отверстия микропипеткой наконечник, Смешайте 40 мкл PEG-MAL-КМС или PEG-MAL-РГД ячейки решения с ха решение в плесени. Пипетка вверх и вниз быстро не более 10 раз. Повторите для каждой культуры гель готовится.
Примечание: Этот шаг принимает практике, поскольку первоначальный гелеобразования происходит быстро (в течение 30 s). Пипетка вверх и вниз, при перемещении кончик в разных местах формы для обеспечения даже смешивания. Всегда держите кончик ниже уровня жидкости, чтобы избежать образования воздушных пузырей. Сделать не смесь, раствор слишком много раз, как гель может получить образуются внутри микропипеткой чаевые. ПЭГ-MAL-CYS и ПЭГ-MAL-РГД могут быть объединены в различные коэффициенты для достижения желаемой концентрации пептид РГД. - Место хорошо плита, содержащие гель инкапсулированные клетки в инкубатор культуры клеток 37 ° C на 5-10 минут для обеспечения завершения реакции.
- Добавьте 2-2,5 мл питательной среды для каждой скважины с форматом гели. Используйте стерильные, 2 мкл наконечник пипетки или микро шпатель, осторожно отделить плесени и гель. Используйте предварительно стерилизованные щипцы для удалить плесень из хорошо пластины. Место хорошо пластины обратно в инкубатор (37 ° C и 5% CO2) ячейку для культуры и дальнейших экспериментов.
Примечание: Потяните плесень вертикально вверх чтобы избежать вреда гель культур. В целом средний в гель культур должны быть заменены каждые 3-4 дня. Будьте осторожны, не аспирационная гидрогели, при удалении среды. Если это проблема, мы рекомендуем использовать пипетки пластиковые передачи. Если планируется биолюминесценции imaging для отслеживания количества клеток, GBM клетки должны преобразованы с кодирования конститутивно Люцифераза выражение перед инкапсуляцией, как описано выше3человека. Для изображений биолюминесценции, добавьте 1 мм D-люциферин питательной среды 1 h до изображений свечения.
4. lysate подготовка для западный Blotting
- Холод 1.5 мл пробирок microcentrifuge на льду (1 на гель образцов). Прохладный центрифуги до 4 ° C.
- Удаление среднего из хорошо пластины. Перевести гели в prechilled microcentrifuge трубы.
- 100 мкл Буфер RIPA ингибиторами протеазы/фосфатазы 1 x.
- С помощью 1 мл шприца с иглой 20 G, разбейте гель, нажав смеси в целом через иглу по крайней мере 20 раз.
- Флэш-спин образца с помощью топ microcentrifuge скамейке и место образца обратно на льду.
- Вихревой образцов кратко каждые 5 минут в общей сложности 20 мин.
- Центрифуга образцы на 14000 g x 15 мин при 4 ° C.
- Супернатант передать новый, предварительно охлажденный microcentrifuge трубы и хранить при-20 ° C (кратковременно) или и -80 ° C (долгосрочные). Выполняйте гель-электрофорез с использованием стандартных процедур, как было описано выше3.
5. Извлечение одной клетки из гидрогеля культур для проточной цитометрии
- Удаление средних и передачи культуры геля (из шага 3.11) в трубку microcentrifuge 1,5 мл.
- Проинкубируйте гель с 500 мкл фермента диссоциации клеток (например, трехкратная Экспресс) при 37 ° C за 5 минут, иногда стряхивая трубки агитировать.
- Передача смеси в 50 мл пластиковых пробирок с 5 мл полной среды. Место труб на льду.
- Прикрепите 20G иглу на шприц 10 мл. Осторожно потяните суспензию клеток вверх и вниз через иглу 8 раз.
- Стекает смесь через 70 мкм ячейки сита в новых центрифуг Тюбик 50 мл. Применить дополнительные 5 мл полной среды через сито, чтобы собирать любые оставшиеся ячейки.
- Центрифуга образца на 400 x g 5 минут удалить супернатант и Ресуспензируйте гранулы нужного буфера для проточной цитометрии (с использованием стандартных протоколов3).
6. криоконсервирования гидрогелей для разрезания
- Удаление средних культур геля (из шага 3.11).
- Проинкубируйте гель культур с 2 мл параформальдегида 4% (PFA) при 4 ° C на ночь.
Предупреждение: PFA токсичных и должны быть тщательно обработаны. - На следующий день удалите PFA. Добавить 2 мл 5% сахарозы в ФБР гели и инкубировать 1 час при комнатной температуре.
- Заменить 5% раствор сахарозы с 2 мл 20% сахарозы в ФБР и Инкубируйте 30 мин.
- Заменить раствора сахарозы с 2 мл свежего 20% сахарозы в ФБР и инкубировать еще 30 мин.
- В третий раз замените раствора сахарозы с 2 мл свежего 20% сахарозы в ФБР. Инкубируйте на 4 ° C на ночь.
- Подготовка 20% сахарозы в комплексе оптимальной температуры вырезывания (OCT).
Примечание: Из-за вязкости OCT, распада сахарозы может занять некоторое время (до ночлега). Мы рекомендуем размещать смесь на шейкер при растворении вести агитацию. - На следующий день, удалить раствор 20% сахарозы и осторожно залить 20% сахарозы в октября решение гель. Убедитесь в том охватить весь гель. Инкубируйте на 4 ° C на 3 ч.
- Перевести гель в центр внедрения плесени, с помощью шпателя большие, плоские; Это должно быть сделано тщательно, чтобы избежать повреждения геля.
- Прохладный 2-methylbutane внутри криокамеры с избытком сухого льда.
- Заполните встраивание формы с чистой OCT (не сахарозы). Заполните чуть ниже верхнего края формы.
- Заморозить гидрогеля образец путем погружения в охлажденный 2-methylbutane и затем секционирование.
- В разделе пример с помощью криостата; в разделе толщина 10-18 мкм и секущей температура около-26 ° c рекомендуется.
- Стандартные иммуноокрашивания процедуры можно выполните на секционного гель культуры, как описано выше3.
Примечание: PFA известен раздражающее и канцерогенов. Пожалуйста, обрабатывать и распоряжаться PFA согласно локально применимых стандартов и правил.
7. Общая РНК добыча от образцов в Гидрогель
Примечание: Здесь мы описываем протокол, с помощью коммерческих комплект (см. таблицу материалы) для извлечения всего РНК из гидрогеля культивируемых клеток. Буферы и все материалы доступны в пакете используется.
- Удаление питательной среды. Используйте пипетку передачи P1000 с wide родила подсказка для передачи гидрогеля культуры в 1,5 мл microcentrifuge трубку.
- 350 мкл буфера RLT, к культуре гидрогеля.
- С помощью иглы 20 G прилагается к 1 мл шприц, лоскуток гель, нажав смеси в целом через иглу по крайней мере 20 раз.
- Передача смеси в целом в столбец гомогенизатор, помещены в 2-мл пробирку коллекции. Центрифуга на 13 000 x g на 2 мин.
- Перенесите супернатант в пробки microcentrifuge чистой 1,5 мл. Будьте осторожны, чтобы не нарушить гель осадок на дне.
- Смешайте lysate образца с 350 µL 100% этанола. Передать все образца спин столбец (из комплекта) место в 2-мл пробирку коллекции. Центрифуги для 1 мин на 13 000 x g.
- Для последующих шагов для очистки РНК для ПЦР выполните общий протокол, предоставляемой изготовителем комплекта.
Примечание: После РНК добывается, стандартные протоколы для ПЦР может использоваться.
Результаты
Для каждой партии thiolated ха степень thiolation должны быть проверены с помощью H1-ЯМР или Эллман тест. HA модификации, используя процедуру, описанную здесь последовательно создает ~ 5% thiolation (определяемой как молярное соотношение тиолы HA дисахариды) (рис. 1).
Создание этой новой культуры платформы потребует каждой лаборатории для выполнения тщательного тестирования для обеспечения надлежащей культуры жизнеспособность до реализации широкомасштабных экспериментов. Наши 80 мкл гидрогели с посевной плотность 500000 клеток/мл (40 000 ячеек/геля) неизменно приводят темпов распространения, которые сопоставимы с, или лучше, чем, gliomasphere культур (рисунок 2A-2 C). Как HA/PEG гидрогели оптически прозрачным, поведение клеток можно наблюдать непосредственно в жить, 3D культур с использованием фазы контраст или флуоресцентной микроскопии. Рисунок 3A , показывает, что через 4 дня после инкапсуляции, GBM клетки в РГД содержащих гидрогели exhibit инвазивных фенотип, в то время как клетки культивировали в гидрогеля с помощью PEG-MAL-CYS элементы управления имеют сферической морфологии.
Как обычно с ксенотрансплантата модели, где исследователи должны ждать дней до месяцев имплантированными опухолями до прогрессивного роста24,32, пациент производные клетки также взять время, чтобы приспособиться к новой среде культуры. Таким образом мы рекомендуем, культивирование 4-8 дней до начала экспериментов, например медикаментозное лечение, чтобы убедиться, что большинство клеток вступили в фазу экспоненциального роста. Помимо лекарств реактивы как растворимые цикло РГД, которые конкурсно нарушить взаимодействия клеток с РГД в гидрогели, могут быть добавлены к питательной среды (рис. 3A).
Наша система гидрогеля совместимы с многими общими методами для изучения биологии клетки глиомы. С помощью изображений биолюминесценции, который обычно используется для мониторинга грызунов ксенотрансплантата опухоли, относительное количество жизнеспособных клеток можно наблюдать в гидрогеля культур во время курса лечения. Рисунок 3B пример этого метода, где эффекты лечения эрлотиниб на клетки культивировали гидрогеля GBM были оценены более 6 дней. В общем гидрогеля культур могут рассматриваться как образцы тканей при подготовке лизатов для западной помарки или ПЦР. Западный анализ помаркой рассеченного поли ADP полимеразы указывает, что относительная степень апоптоза в обработанных CD44 нокдаун клеток является выше, чем wildtype GBM клетки культивировали в 0,5% ха гидрогелиРисунок 3 c) (). Аналогичным образом Одноячеистый подвески могут быть получены из гидрогеля культур для анализа через проточной цитометрии с помощью стандартных протоколов для освобождения единичных клеток из неповрежденной ткани (рис. 2). В дополнение к функции клеток cryosections на основе гидрогеля, 3D культур сохранить ECM, сданный культивируемых клеток. Например осаждения типа IV коллаген сдвига после лечения эрлотиниб гидрогеля культур (рис. 3D).

Рисунок 1 : H представитель 1 -NMR спектр гиалуроновой кислоты thiolated. Интегрированный пиков указывают, что примерно 5% ха глюкуроновой кислоты групп были изменены с тиоловых. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Пролиферацию клеток, инкапсулированные гидрогеля. A) пример изображения изготовлены 80 мкл гелей в 12-ну пластины. После сшивки гидрогели распухли в среде культуры клеток. B) представитель результаты распространения Скорость измеряется с помощью проточной цитометрии. GBM клетки (HK301) были инкубировали с 1 мкм Эду (5-ethynyl-2′ дезоксиуридина) для 2.5 h на четвертый день после инкапсуляции или пассированый. Клик реакция была использована для конъюгата флуоресцентного красителя включены EdU, как подробно указано в Xiao et al. 2017. негативный контроль3 , где нет EdU был добавлен к культурам, были включены. C) представитель confocal микроскопии изображений жить (зеленый) и мертвых (красный) клетки 24 часа после того, как Гидрогель культур GBM клеток (HK157) были созданы. Масштаб баров = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
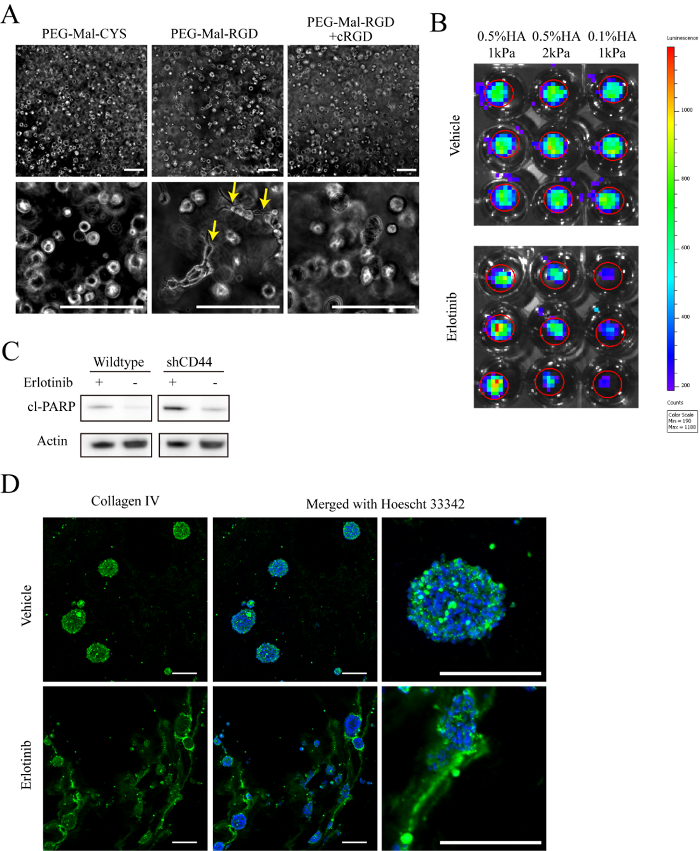
Рисунок 3 : Характеристика. A) представитель этап контрастность изображения 0,5% (w/v) HA Гидрогель культивируемых клеток при различных условиях для 8 дней после инкапсуляции. Стрелки показывают ячейки с инвазивной морфологии. B) представитель изображения биолюминесценции сигнала измерены после 15 дней лечения с 1 мкм эрлотиниб или транспортного средства (ДМСО). 1 мм D-люциферин был добавлен в ячейку культуры средних 1 h до изображений. Клетки были преобразованы с человека, кодирование для учредительного выражение Люцифераза Светлячок перед инкапсуляцией. C) представитель изображения иммунной блот анализ расщепляется поли ADP полимеразы (cl ПАРП) выражение в GBM клеток (HK301) культивировали в гидрогели с 0,5% (w/v) HA и модуль сжатия 1 кПа. Все обрезанные изображения показаны были от же пятно. D) представитель пятнать коллаген IV (зеленый) и Hoechst 33342 (синий) в клетки культивировали Гидрогель HK301 12 дней после лечения с 1 мкм эрлотиниб или транспортного средства (ДМСО). Шкалы бар = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Тип гель | Часть (40 мкл каждого) | Часть B (по 40 мкл) | ||||
| 4Arm-PEG-MAL (50 мг/мл) | Хвоща или РСЗ (2.81 mM) | PBS (рН 7,4) | 4Arm-PEG-тиоловых (50 мг/мл) | PBS (рН 7,4) | Ха-S (13.3 мг/мл) | |
| HA 1kPa 0,5% (w/v) | 10 МКЛ | 4.00 МКЛ | 26 МКЛ | 1.00 МКЛ | 9.00 МКЛ | 30,0 МКЛ |
| HA 2kPa 0,5% (w/v) | 20,0 МКЛ | 4.00 МКЛ | 16.0 МКЛ | 8.00 МКЛ | 2.00 МКЛ | 30,0 МКЛ |
| HA 1kPa 0,1% (w/v) | 10 МКЛ | 4.00 МКЛ | 26 МКЛ | 8.00 МКЛ | 26,0 МКЛ | 6.00 МКЛ |
Таблица 1. Гидрогель составы, уступая независимый контроль концентрации HA и механических свойств.
Обсуждение
Воспроизводимость данных с использованием этой системы 3D культуры требует: 1) последовательно партии партии thiolation ха, 2) практика для достижения эффективного смешивания гидрогеля прекурсоров и обработка гидрогеля культур для предотвращения повреждения и 3) оптимизированы посева плотность для каждой ячейки строки используется.
Желано особый вес процент ха в гидрогеля, степень thiolation HA определяет плотность crosslink. Мы рекомендуем использовать последовательное количество HA для каждой thiolation реакции к минимуму различия партии к партии. Мы предлагаем, что по крайней мере 300 мг HA использоваться для каждой thiolation реакции, так что той же партии thiolated HA может использоваться для нескольких экспериментальных повторяется. Молярное соотношение тиолы группам maleimide на 4-руки PEG следует всегда быть 1.1:1 для обеспечения максимальной сшивки эффективности. Таким образом если степень thiolation меняется, то количество PEG-Mal добавил должна корректироваться соответственно. Когда пептиды конъюгированных с малеинимидов до формирования гель, предполагаемое количество оружия КОЛЫШЕК с привязи пептиды должна вычитаться из общего числа доступных малеинимидов для этого расчета. Кроме того мы рекомендуем сохранять степень HA thiolation ниже 10-15% чтобы избежать формирования дисульфида облигаций, что позволит предотвратить распад и последовательно, гелеобразование.
Майкл тип реакции между группами тиоловых и maleimide гарантирует, что гелеобразования происходит в соответствии с минуту. Хотя этот быстрый гелеобразования минимизирует количество времени, что клетки приостановлено в гидрогеля прекурсоров без полного среднего, который может поставить под угрозу их жизнеспособности, процесс инкапсуляции требует опыта работы со всеми дозирование и смешивание шаги для достижения воспроизводимые результаты. Как правило у нас есть новые стажеров практиковать несколько раундов гелеобразования без клетки перед выполнением «реальных» инкапсуляции экспериментов.
Два фактора могут быть tweaked чтобы модулировать скорость гелеобразования: реакции рН температуры и прекурсоров. Снижение температуры реакции, поместив хорошо пластины на льду во время смешивания замедляет реакцию и обеспечивает большее время замеса прекурсоров решений. Однако это должно быть сделано в стерильных условиях, с использованием надлежащих асептических методов. Аналогично pH растворов прекурсоров могут быть изменены чтобы увеличить или уменьшить время реакции с помощью рН выше или ниже, соответственно. Поскольку thiolated HA dialyzed против кислой воды для предотвращения формирования дисульфидными облигаций, воссозданная thiolated HA принесет рН ниже, чем в противном случае можно было бы ожидать. В общем, растворения в 20 мм HEPES в HBSS буфера, скорректированы до pH 9, принесет рН около 7 когда 15 мг/мл thiolated HA растворяется (~ 5% thiolated). Мы рекомендуем использовать рН 6,8-7 thiolated ха решение разрешить даже смешивания решения гелем при максимальном здоровье клеток.
Заполнение плотность при инкапсуляции имеет решающее значение для клеточной жизнеспособности и экспериментальной воспроизводимость. Мы рекомендуем в посев в диапазоне от 100 000 до 2 000 000 клеток/мл. Мы обнаружили, что этот диапазон является оптимальным для жизнеспособности большинства типов клеток при одновременном недопущении за confluency в экспериментальной сроки по крайней мере 3-х недель. Начальная плотность посева, оптимизирует жизнеспособность должна определяться экспериментально для каждого типа ячейки используется.
Очень осторожно следует при изменении ячейки среднего во избежание повреждения гидрогеля культур. В частности заботиться не аспирационная Гидрогель в пипетку. Таким образом не использовать вакуум-аспирации и вместо этого использовать стерильные передачи пипетки для аспирационная вручную. Также может помочь изменение только половину среднего в культуре хорошо в то время.
В общем этот метод требует практики для достижения необходимых ловкость и последовательности. После того, как создана лаборатория конкретного протокола, система 3D культура позволяет исследователь использовать многие методы характеристика как типичные для культуры клеток и тканей, описаны. Здесь мы описали несколько методов для анализа, в том числе иммунофлюоресценции, проточной цитометрии, Западный blotting и биолюминесценции изображений живой, 3D культур (рис. 2-3). Для более подробных протоколов характеристика методов смотрите Xiao et al. 20173. Наконец как оптически прозрачные HA/PEG гидрогели, стандартные световой микроскопии методы, в том числе конфокальная томография, может использоваться для мониторинга живой, 3D культур.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Эта работа была поддерживается с финансирования из низ (R21NS093199) и UCLA дуги 3R премии. Наша искренняя благодарность идти в лаборатории д-р Harley Корнблюм для предоставления HK301 и HK157 клеточных линий. Мы также благодарим UCLA ткани патологии Core лаборатории (TPCL) для cryosectioning, расширенные свет микроскопии/спектроскопия основного фонда (ALMS) в Калифорнии наносистем институт (НКНИ) в Калифорнийском университете для использования конфокального микроскопа, UCLA Крамп институт Молекулярное воображение для использования ИВИС тепловизионной системы, UCLA молекулярной инструментария центр (MIC) для предоставления спектроскопия магнитного резонанса и поток Cytometry Core в Йонссон Всеобъемлющем Рак центр (ЮКЧК) в Калифорнийском университете за предоставление инструментария для потока цитометрии.
Материалы
| Name | Company | Catalog Number | Comments |
| pH meter | Thermo Fisher | N/A | Any pH meter that has pH 2-10 sensitivity |
| Stir plate | Thermo Fisher | N/A | General lab equipment |
| Erlenmeyer flask (125mL) | Thermo Fisher | FB-501-125 | |
| dialysis tubes | Thermo Fisher | 21-152-14 | |
| 2L polypropylene beaker | Thermo Fisher | S01916 | |
| sodium hyaluronan | Lifecore | HA700k-5 | 500-750 kDa range |
| 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) | Thermo Fisher | PI-22980 | |
| N-hydroxysuccinimide (NHS) | sigma aldrich | 130672-5G | |
| Hydrochloric acid (HCl) | Thermo Fisher | SA48-500 | |
| Sodium hydroxide (NaOH) | Thermo Fisher | SS266-1 | |
| Cystamine dihydrochloride | Thermo Fisher | AC111770250 | |
| Dithiolthreitol (DTT) | Thermo Fisher | BP172-25 | |
| Ellman's test reagent (5-(3-Carboxy-4-nitrophenyl)disulfanyl-2-nitrobenzoic acid | Sigma Aldrich | D218200-1G | |
| Deuterated water (deuterium oxide) | Thermo Fisher | AC166301000 | |
| 0.22µm vacuum driven filter | CellTreat | 229706 | |
| Phosphate buffered saline (PBS) | Thermo Fisher | P32080-100T | |
| Hanks' balanced salt saline (HBSS) | Thermo Fisher | MT-21-022-CV | |
| 4-arm-PEG-maleimide | JenKem Technology | A7029-1 | molecular weight around 20kDa |
| 4-arm-PEG-thiol | JenKem Technology | A7039-1 | molecular weight around 20kDa |
| L-Cysteine | sigma aldrich | C7880-100G | |
| RGD ECM mimetic peptide | Genscript Biotech | N/A | Custom peptide with sequence "GCGYGRGDSPG", N-terminal should be acetylated |
| silicone molds | Sigma Aldrich | GBL664201-25EA | Use razor blade to cut into single pieces |
| complete culture medium | Various | Various | DMEM/F12 (Thermofisher) with non-serum supplement (G21 from GeminiBio), epidermal growth factor 50ng/mL (Peprotech), fibroblast growth factor 20ng/mL (Pepro Tech) and heprain 25µg/mL (Sigma Aldrich), culture medium varies in different labs |
| patient derived GBM cell | N/A | N/A | |
| 20G needle | BD medical | 305175 | |
| 1mL syringe | Thermo Fisher | 14-823-434 | |
| 10mL syringe | BD medical | 302995 | |
| RIPA Buffer | Thermo Fisher | PI-89901 | |
| protease/phosphatase inhibitor mini tablet | sigma aldrich | 5892970001 | |
| vortex shaker | Thermo Fisher | 12-814-5Q | |
| TrypLE express | Thermo Fisher | 12604013 | |
| 70µm cell strainer | Thermo Fisher | 22-363-548 | |
| Paraformaldehyde | Thermo Fisher | AC416785000 | Dissolve 4% (w/v) in PBS, keep pH 7.4 |
| D-sucrose | Thermo Fisher | BP220-1 | |
| Optimal Cutting Temperature (O.C.T.) compound | Thermo Fisher | NC9373881 | |
| Cell culture incubator | Thermo Fisher | N/A | Any General One with 5% CO2 and 37C |
| fridge/freezer | Thermo Fisher | N/A | Any General Lab equipment with -20C and -80C capacity |
| Disposable embedding molds | Thermo Fisher | 12-20 | |
| Lyapholizer | Labconco | N/A | Any -105C freeze dryers |
| HEPES | Thermo Fisher | BP310-500 | |
| Amber vial | Kimble Chase | 60912D-2 | |
| Wide orifice pipette tips | Thermo Fisher | 9405120 | |
| 2-methylbutane | Thermo Fisher | 03551-4 | |
| Dry Ice | N/A | N/A |
Ссылки
- Xiao, W., Sohrabi, A., Seidlits, S. K. Integrating the glioblastoma microenvironment into engineered experimental models. , (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and bioengineering. 103 (4), 655-663 (2009).
- Xiao, W., et al. Brain-mimetic 3d culture platforms allow investigation of cooperative effects of extracellular matrix features on therapeutic resistance in glioblastoma. Cancer Research. 78 (5), 1358-1370 (2018).
- Holland, E. C. Glioblastoma multiforme: the terminator. Proceedings of the National Academy of Sciences. 97 (12), 6242-6244 (2000).
- Ostrom, Q. T., et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2006 - 2010. Journal of Neuro-Oncology. 15 (6), 788-796 (2013).
- Bellail, A. C., Hunter, S. B., Brat, D. J., Tan, C., Van Meir, E. G. Microregional extracellular matrix heterogeneity in brain modulates glioma cell invasion. International Journal of Biochemistry and Cell Biology. 36 (6), 1046-1069 (2004).
- Zamecnik, J. The extracellular space and matrix of gliomas. Acta Neuropathologica. 110 (5), 435-442 (2005).
- Jadin, L., et al. Hyaluronan expression in primary and secondary brain tumors. Annals of translational medicine. 3 (6), (2015).
- Park, J. B., Kwak, H. J., Lee, S. H. Role of hyaluronan in glioma invasion. Cell adhesion & migration. 2 (3), 202-207 (2008).
- Pedron, S., et al. Spatially graded hydrogels for preclinical testing of glioblastoma anticancer therapeutics. MRS communications. 7 (3), 442-449 (2017).
- Jiglaire, C. J., et al. Ex vivo cultures of glioblastoma in three-dimensional hydrogel maintain the original tumor growth behavior and are suitable for preclinical drug and radiation sensitivity screening. Experimental cell research. 321 (2), 99-108 (2014).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Day, A. J., Prestwich, G. D. Hyaluronan-binding proteins: tying up the giant. Journal of Biological Chemistry. 277 (7), 4585-4588 (2002).
- Wiranowska, M., Tresser, N., Saporta, S. The effect of interferon and anti-CD44 antibody on mouse glioma invasiveness in vitro. Anticancer Research. 18 (5A), 3331-3338 (1998).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. GLIA. 59 (8), 1169-1180 (2011).
- Gilg, A. G., et al. Targeting hyaluronan interactions in malignant gliomas and their drug-resistant multipotent progenitors. Clinical Cancer Research. 14 (6), 1804-1813 (2008).
- Misra, S., Hascall, V. C., Markwald, R. R., Ghatak, S. Interactions between hyaluronan and its receptors (CD44, RHAMM) regulate the activities of inflammation and cancer. Frontiers in immunology. 6, 201(2015).
- Varga, I., et al. Expression of invasion-related extracellular matrix molecules in human glioblastoma versus intracerebral lung adenocarcinoma metastasis. Zentralblatt fur Neurochirurgie. 71 (4), 173-180 (2010).
- Guo, W., Giancotti, F. G. Integrin signalling during tumour progression. Nature Reviews Molecular Cell Biology. 5 (10), 816-826 (2004).
- Bello, L., et al. αvβ3 and αvβ5 integrin expression in glioma periphery. Neurosurgery. 49 (2), 380-390 (2001).
- Chamberlain, M. C., Cloughsey, T., Reardon, D. A., Wen, P. Y. A novel treatment for glioblastoma: integrin inhibition. Expert review of neurotherapeutics. 12 (4), 421-435 (2012).
- Chopra, A., et al. Augmentation of integrin-mediated mechanotransduction by hyaluronic acid. Biomaterials. 35 (1), 71-82 (2014).
- Kim, Y., Kumar, S. CD44-mediated adhesion to hyaluronic acid contributes to mechanosensing and invasive motility. Molecular Cancer Research. 12 (10), 1416-1429 (2014).
- Joo, K. M., et al. Patient-specific orthotopic glioblastoma xenograft models recapitulate the histopathology and biology of human glioblastomas in situ. Cell Reports. 3 (1), 260-273 (2013).
- Oh, Y. T., et al. Translational validation of personalized treatment strategy based on genetic characteristics of glioblastoma. PloS one. 9 (8), e103327(2014).
- Pedron, S., Becka, E., Harley, B. A. C. Regulation of glioma cell phenotype in 3D matrices by hyaluronic acid. Biomaterials. 34 (30), 7408-7417 (2013).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular pharmaceutics. 11 (7), 2115-2125 (2014).
- Zhu, J. Bioactive modification of poly(ethylene glycol) hydrogels for tissue engineering. Biomaterials. 31 (17), 4639-4656 (2010).
- Stern, R., Asari, A. A., Sugahara, K. N. Hyaluronan fragments: an information-rich system. European journal of cell biology. 85 (8), 699-715 (2006).
- Riddles, P. W., Blakeley, R. L., Zerner, B. Ellman's reagent: 5, 5′-dithiobis (2-nitrobenzoic acid)-a reexamination. Analytical biochemistry. 94 (1), 75-81 (1979).
- Jin, R., et al. Synthesis and characterization of hyaluronic acid-poly (ethylene glycol) hydrogels via Michael addition: An injectable biomaterial for cartilage repair. Acta biomaterialia. 6 (6), 1968-1977 (2010).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of visualized experiments. 41, 3-7 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены