Method Article
Ácido hialurónico basado en hidrogeles de 3 dimensiones cultura de células de Glioblastoma derivados del paciente
En este artículo
Resumen
Aquí, presentamos un protocolo para el cultivo tridimensional de células de glioblastoma derivados del paciente dentro de biomateriales ortogonalmente ajustables diseñados para imitar la matriz del cerebro. Este enfoque proporciona una en vitro, plataforma experimental que mantiene muchas características de en vivo células de glioblastoma normalmente perdidas en cultura.
Resumen
Glioblastoma (GBM) es el cáncer más común, pero más letal, del sistema nervioso central. En los últimos años, muchos estudios se han centrado en cómo la matriz extracelular (ECM) del medio cerebro único, como el ácido hialurónico (ah), facilita la invasión y la progresión de GBM. Sin embargo, la mayoría en vitro cultura modelos incluye células GBM fuera del contexto de un ECM. Murinos xenoinjertos de células GBM se utilizan comúnmente también. Sin embargo, en vivo modelos hacen difícil aislar la contribución de determinadas características del microambiente tumoral compleja al comportamiento del tumor. Aquí, describimos una plataforma de base de hidrogel, tridimensional (3D) cultura HA que permite a los investigadores modificar independientemente tiesura y la concentración de HA. Alto peso molecular HA y polietilenglicol (PEG) son hidrogeles, que son reticulado por adición tipo Michael en presencia de células vivas. Culturas de hidrogel 3D del paciente derivado GBM células muestra viabilidad y proliferación tasas tan buena como o mejor que cuando se cultivan gliomaspheres como estándar. El sistema de hidrogel también permite la incorporación de péptidos miméticos de ECM para aislar los efectos de las interacciones célula-ECM específicas. Los hidrogeles son ópticamente transparentes que células vivas pueden ser reflejadas en la cultura 3D. Por último, HA hidrogel culturas son compatibles con técnicas estándar de análisis moleculares y celulares, incluyendo PCR, Western Blot y cryosectioning seguido manchando de la inmunofluorescencia.
Introducción
Sistemas de cultivo (3D) tridimensional recapitulan las interacciones entre las células y su matriz extracelular circundante (ECM) en los tejidos nativos mejores que sus dos dimensiones (2D) homólogos1,2. Los avances en ingeniería tisular han dado plataformas 3D, sofisticada cultura que permitan nuevas investigaciones controladas en componentes físicos y químicos 1) cómo la Matriz microambiente afectan células comportamientos y 2) eficacia de terapéutica estrategias para un número de enfermedades, incluyendo cáncer2. Mientras que en vitro modelos no pueden explicar por factores sistémicos, tales como señales de endocrinos e inmunes y por lo tanto no pueden sustituir completamente en vivo modelos, ofrecen varias ventajas incluyendo reproducibilidad, control experimental, accesibilidad y velocidad. Aquí, describimos el uso de hidrogeles cerebro mimética en que 3D, cultivos de células de tumor de cerebro paciente derivado capturan muchos aspectos de la fisiología del tumor, en particular, la dinámica de adquirir tratamiento resistencia3. En comparación con otros métodos en vitro , estas culturas representan mejor en vivo tumor modelos y observaciones clínicas3.
Glioblastoma (GBM) es el cáncer más frecuente y letal que origina en el cerebro, con una supervivencia media de sólo 1-2 años4,5. En los últimos años, muchos estudios se han centrado en la influencia del entorno de la matriz del tumor en GBM6,7,8. El ECM cerebro único se ha divulgado para afectar la migración celular GBM, proliferación y resistencia terapéutica6,7,8,9,10,11 , 12. ácido hialurónico (ah) es un abundante glicosaminoglicano (GAG) en el cerebro, donde interactúa con otros GAGs y proteoglicanos para formar un hidrogel como malla13. Muchos estudios han reportado HA sobreexpresión en tumores GBM y sus efectos posteriores sobre cáncer progresión8,9,13,14,15,16 ,17. Otros componentes del ECM también afectan GBM tumor invasión y crecimiento6,7,15,18. Por ejemplo, fibronectina y vitronectina, que típicamente son overexpressed en GBM, inducen heterodimerization de receptores celulares de superficie de integrinas a través de unión a la secuencia de "Servicios" e inician complejas cascadas de señalización que promueven la supervivencia del tumor19 ,20,21. Además de influencias bioquímicas, propiedades físicas de la matriz del tejido también afectan GBM progresión22,23.
Adquisición continua de la resistencia a las terapias es uno de los principales impulsores de GBM mortalidad4. Drogas que muestran resultados prometedores en modelos 2D o gliomasphere han fracasado en posteriores estudios en animales y casos clínicos3, indicando que los efectos de factores microambiental contribuyeron significativamente a GBM tumor respuesta1. Mientras que los modelos animales pueden proporcionar un 3D, fisiológicamente apropiado microambiente a las células de pacientes investigaciones y generar resultados clínicamente relevantes24,25, la complejidad del cerebro microambiente en vivo hace difícil para determinar que características, incluyendo las interacciones célula-matriz, son los resultados biológicos claves específicos. Identificación de nuevas dianas terapéuticas se beneficiará de la utilización de plataformas de cultura simplificado en el que se definen propiedades bioquímicas y biofísicas.
A diferencia de los modelos de biomaterial previamente divulgados del GBM tumor microambiente26,27 que no han logrado cierto control ortogonal sobre determinadas características bioquímicas y físicas de la ECM, la plataforma de biomaterial reportado aquí permite la disociación de las contribuciones de múltiples funciones de independiente al fenotipo de la célula GBM. Aquí, presentamos un sistema de hidrogel basado en HA, ortogonalmente regulables, para cultura 3D de células derivadas del paciente GBM. Los hidrogeles están formados de dos componentes de polímero: HA 1) biológicamente activa y 2) biológicamente inerte polietilenglicol (PEG). PEG es un ampliamente utilizado material biocompatible e hidrofílico con adsorción baja en proteínas y de inmunogenicidad mínima28. Aquí, aproximadamente el 5% de moléculas de ácido glucurónico en cadenas HA son funcionalizado con grupos tiol para reticulación en una 4-brazo-clavija comercialmente disponible con maleimides vía la adición tipo Michael. En su forma más común en el cuerpo, HA existe en cadenas de alto peso molecular (HMW). Aquí, un bajo grado de modificación de HMW HA (500-750 kDa) ayuda a conservar las interacciones nativas de HA y sus receptores celulares, incluyendo CD4429. Sustituyendo PEG-tiol tiol HA manteniendo una constante relación molar de tioles totales a maleimides, HA concentración puede ser disociada de propiedades mecánicas de los hidrogeles resultantes. Además, pueden utilizarse controles estequiométricos conjugar terminó de cisteína de péptidos a un número definido de promedio de brazos maleimida terminado en cada 4-brazo-PEG. Incorporación de péptidos derivados de ECM, adhesivo permite interacción con integrinas en las células cultivadas, a través del cual las señales bioquímicas y químicas son transduced1. Además de maleimida-tiol se produce muy rápidamente en condiciones fisiológicas, minimizando el tiempo requerido para la encapsulación de la célula y maximizar la supervivencia de células derivadas del paciente. Por otra parte, las culturas hidrogel pueden tratarse como espécimen de tejido típico y son compatibles con técnicas de caracterización estándar incluyendo Western Blot, citometría de flujo y tinción de inmunofluorescencia. El siguiente protocolo describe el procedimiento para la fabricación de los hidrogeles, establecer cultivos 3D de células derivadas del paciente GBM y técnicas de análisis bioquímico.
Protocolo
Se realizaron todos los pasos de colección tejido humano bajo protocolos aprobados institucionalmente.
1. Thiolation de ácido hialurónico
Nota: Relaciones molares se indican con respecto al número total de grupos carboxilato a menos que se especifique lo contrario.
- Disolver 500 mg de hialuronato sódico (HA, 500-750 kDa) 10 mg/ml en agua desionizada, agua destilada (DiH2O) en autoclave esterilizado, Erlenmeyer de 250 mL. Agitar la solución (~ 200 rpm) a temperatura ambiente durante 2 horas disolver completamente HA. Use una barra de agitación y la placa de agitación magnética para evitar reacción revolviendo durante el procedimiento de thiolation.
- 0,1 M de ácido clorhídrico (HCl), ajustar el pH de la solución HA de 5.5. Pesar 69,6 mg (0.25 x fracción molar) de 1-ethyl-3-(3-dimethylaminopropyl) carbodiimida (EDC).
Nota: Aunque sin disolver EDC puede añadirse directamente a la solución de la HA, es típicamente más fácil de disolver EDC primero en 1 mL de DiH2O y luego agregar rápidamente la solución EDC a la solución de la HA. Previa disolución en 1 mL de DiH2O puede también hacerse con N-hydroxysuccinimide (NHS) y cistamina dihydrocholoride antes de añadir a la reacción en los pasos 1.3 y 1.4. - Añadir 17,9 mg (0.125 x fracción molar) del NHS a la reacción. Ajustar el pH de la solución de reacción a 5.5 utilizando 0.1 M HCl e incubar la reacción a temperatura ambiente durante 45 minutos.
- Añadir 70,0 mg (0.25 x fracción molar) de diclorhidrato de cistamina en la solución de reacción. Usar hidróxido de sodio de 0,1 M (NaOH) para ajustar el pH a 6.25. Incubar la reacción a temperatura ambiente durante la noche mientras revuelve.
- Al día siguiente, utilice 1 M NaOH para ajustar el pH de la solución de reacción a unos 8. Añadir 192 mg (4 x fracción molar) de Ditiotreitol (DTT) para la reacción. Ajustar el pH a 8 después de la adición de la TDT y dejar de revolver durante 1-2 horas a temperatura ambiente.
- Utilice 1 M HCl para ajustar el pH a 4. Transferir la mezcla de reacción entera en membrana de diálisis previamente remojadas (corte de peso molecular alrededor de 13 kDa) y dializo contra DiH2O previamente ajustado a pH 4.
Nota: El volumen de DiH2O para la diálisis debe ser por lo menos 40 veces el volumen de la solución HA reaccionado (p. ej., 50 mL de muestra en 2 L de DiH2O, pH 4). - Reemplazar la solución de diálisis (DiH2O, pH 4) dos veces al día durante 3 días a temperatura ambiente.
- Filtrar la solución de dializado a través de una membrana de 0,22 μm, filtro de vacío. Flash solución de thiolated HA en nitrógeno líquido. Utilice un liofilizador para congelar muestras secas en 2 días. Thiolated HA en forma seca puede guardarse en un desecador sellado a-20 ° C durante al menos 6 meses.
- Para determinar el grado de thiolation, utilizar test de Ellman o protón NMR espectroscopia30,31.
2. preparación de materiales de cura
- Disolver thiolated HA en la concentración deseada (en este ejemplo, 13,3 mg/mL) en solución salina tamponada con HEPES (20 mM HEPES buffer de solución salina de sal balanceada (HBSS) de Hank, para caer dentro de un pH de 8-9) en un frasco ámbar para minimizar la exposición a la luz ambiente. Mantener la solución sin dejar de remover.
Nota: La formación de enlaces disulfuro entre tioles conjugados HA puede ocurrir si el pH está por encima de 8, concentración de la solución es demasiado alta, o la solución queda agitación durante demasiado tiempo antes de la gelificación. Para evitar este problema, utilice a continuación 15 mg/mL de thiolated HA y disolver thiolated HA a 2 horas de formación de hidrogeles. - Disolver 4-brazo-PEG-maleimida (PEG-Mal, 20 kDa) y 4-brazo-PEG-tiol (PEG-tiol, 20 kDa) en tampón fosfato salino (PBS), pH 7,4, preparar 50 mg/mL soluciones PEG-Mal y PEG-tiol.
Nota: Tarda al menos 1 hora para disolver completamente reactivos de PEG. - Si la adición de péptidos derivados de ECM, disolver péptidos que contienen cisteína en PBS para preparar una solución madre.
Nota: Utilice una concentración stock de 2-4 mM. - Caucho de silicón de remojo los moldes en etanol durante al menos 20 minutos para limpiar ellos y autoclave les para la esterilización.
3. hidrogel reticulación y encapsulación de la célula
Nota: como ejemplo, el encapsulado de cuatro persona, 80 μl hidrogeles con 0.5% (p/v) HA y módulo de compresión de 1 kPa es descrito3. Por favor vea la tabla 1 para las recetas de ejemplo que los hidrogeles con diferentes propiedades: dos hidrogeles incorporando el péptido de Unión integrinas RGD y dos hidrogeles incorporando tapas de cisteína como un control negativo para la actividad del péptido. Sembrador de la concentración de células derivadas del paciente GBM es 500.000 células/mL.
- Diluir la solución PEG-Mal (50 mg/mL, en el paso 2.2) a 12,5 mg/mL mediante la adición de 40 μl de la solución madre a 120 μl PBS. Dividir la solución diluida en dos tubos de microcentrífuga de 1,5 mL para que cada tubo tiene 80 μl.
- Añadir 16 μl del stock solución RGD (2,8 mM, en el paso 2.3) a un tubo y 16 μl de solución stock de cisteína (2,8 mM, en el paso 2.3) para el segundo tubo. Vortex para mezclar. Coloque las soluciones PEG-Mal-RGD o PEG-Mal-CYS en hielo hasta su uso en el paso 3.9.
Nota: El procedimiento como se describe aquí rendimientos hidrogeles con ~ 140 μm de péptido. Esto equivale a aproximadamente 1 de cada 8 brazos PEG disponibles está ocupada con un péptido. Esto puede variar alterando la relación molar de péptidos terminada en cisteína a grupos de maleimida disponibles. En general, se logra una concentración máxima de 280 μm de péptido dejando todavía un número suficiente de grupos de maleimida disponibles para la reticulación de hidrogel. - Diluir la solución madre de PEG-tiol (50 mg/mL, en el paso 2.2) a 5 mg/mL mezclando 4 μL de 50 mg/mL solución stock con 36 μl de PBS. Añadir 120 μl de thiolated disuelto, HA de paso 2.1 a la mezcla.
Nota: Las soluciones de APM HA son muy viscosas. Así, recomendamos utilizar punta de micropipeta por todo orificio para transferencia de soluciones. Pipeta lentamente para evitar la solución se pegue a las paredes de la punta de la micropipeta y para mejorar la exactitud de la medida. - Coloque los moldes limpios y secos (preparados en el paso 2.4) en cada pocillo de una placa de 12 pozos tratada cultura del tejido. Con el extremo limpio y contundente de una punta de pipeta, presione el molde de gel y comprobar estanqueidad entre moldes y base de placa del bien.
Nota: Verifique el sello otra vez justo antes de la encapsulación para evitar fugas. - Paso las células cultivadas del GBM, disociar a las células y determinar la concentración de células como describió anteriormente3.
Nota: Algunas líneas GBM es indisociable a las células. En este caso, puede encapsular todo gliomaspheres. Sin embargo, preparar las células disociadas después de celular preciso contar mejorar la reproducibilidad. El protocolo de gliomasphere pases varía entre los diferentes laboratorios y muchos de ellos son probablemente compatibles con la encapsulación de hidrogel.- (Recomendado) Gliomaspheres centrifugar a 500 x g por 5 min Quite el sobrenadante y agregar 1 mL de enzima de disociación celular para el precipitado de células. A continuación, incubar durante 5 minutos, golpeando suavemente el tubo para agitar.
- Añadir 4 mL de medio de cultivo completo (50 ng/mL EGF, FGF-2, 25 μg/mL heparina, suplemento G21 y 1% de penicilina/estreptomicina de 20 ng/mL de DMEM/F12) a las células.
- Centrifugar nuevamente a 500 x g durante 5 minutos y retirar el sobrenadante. Finalmente, Resuspender el precipitado de células en 1 mL de medio completo y pasar las células suspendidas a través de un tamiz celular de 70 μm. Lavado (recomendado) recuperó el colador con una adicional 4 mL del medio completo para maximizar el número de células.
- Calcular la concentración de células en la suspensión usando un hemocitómetro. La suspensión de células se dividió en 2 tubos de centrífuga, donde cada tubo contiene células ~ 80.000. Centrifugar a 500 x g por 5 min; generalmente, las 80.000 células conforman 2 80 μl hidrogeles.
- Quite el sobrenadante y resuspender el uno pellet en 80 μl de solución de PEG-MAL-RGD y un segundo pellet en 80 μl de solución de PEG-MAL-CYS (preparada en el paso 3.1).
- Utilizando un 200 μL, punta de micropipeta por todo orificio, dispensar 40 μl de solución HA (de paso 3.3 anterior) en cada molde de silicona de caucho (como preparado en el paso 3.4).
- Con un 200 μL, punta de micropipeta por todo orificio, mezcla 40 μl de PEG-MAL-CYS o PEG-MAL-RGD celular solución con la solución de la HA en el molde. Pipetee hacia arriba y hacia abajo rápidamente no más de 10 veces. Repita para cada cultura de gel se prepara.
Nota: Este paso requiere de práctica, puesto que gelificación inicial se produce rápidamente (en 30 s). Pipetee hacia arriba y hacia abajo mientras se mueve la punta en los moldes para asegurar incluso una mezcla de diferentes lugares. Mantenga la punta por debajo del nivel del líquido para evitar la formación de burbujas de aire. No no mezcla la solución muchas veces como gel puede conseguir formado dentro de la micropipeta de punta. PEG-MAL-CYS y PEG-MAL-RGD pueden combinarse en diferentes proporciones para lograr la concentración deseada de péptido RGD. - Coloque la placa de pozo que contiene las células encapsuladas en gel en una incubadora de cultura de célula de 37 ° C durante 5-10 minutos completar la reacción.
- Añadir 2-2.5 mL de medio de cultivo en cada pocillo con geles formados. Utilice un estéril, pipeta de 2 μl o micro-espátula, para separar suavemente el molde y gel. Utilice pinzas previamente esterilizados para sacar el molde de la placa de la pozo. Coloque la placa bien a incubadora de la célula (37 ° C y 5% CO2) para la cultura y experimentos futuros.
Nota: Tirar el molde verticalmente hacia arriba para evitar dañar las culturas de gel. En general, media en las culturas de gel debe ser reemplazado cada 3-4 días. Tenga cuidado de no para aspirar los hidrogeles al retirar medio. Si esto es un problema, se recomienda utilizar una pipeta de transferencia plástica. Si se planea la bioluminiscencia de imágenes para rastrear numero de celular, las células GBM deben transduced con lentivirus codifican constitutivamente expresión de luciferasa antes de encapsulamiento, como se describió anteriormente3. Para imágenes de bioluminiscencia, añadir 1 mM D-luciferin a medio de cultivo 1 h antes de la proyección de imagen de luminiscencia.
4. lisado preparación para Western Blotting
- Enfriar los tubos de microcentrífuga de 1,5 mL en hielo (1 por muestras de gel). Fresco centrifugar a 4 ° C.
- Retire el medio de placas bien. Transferencia de geles en tubos de microcentrífuga prechilled.
- Añadir 100 μl de buffer RIPA con inhibidores de proteasa/fosfatasa de x 1.
- Utilizando una jeringa de 1 mL con una aguja de 20 G, romper el gel empujando la mezcla entera a través de aguja al menos 20 veces.
- Flash centrifugado la muestra usando microcentrífuga superior Banco y coloque la muestra de vuelta en el hielo.
- Vórtice muestras brevemente cada 5 minutos para un total de 20 minutos.
- Muestras de centrifugar a 14000 x g durante 15 min a 4 ° C.
- Transferir el sobrenadante a tubos de microcentrífuga nuevo, previamente enfriada y almacenar a-20 ° C (corto plazo) o y -80 ° C (largo plazo). Realizar la electroforesis del gel utilizando procedimientos estándar, como se describió anteriormente3.
5. extracción de las células de culturas de hidrogel para citometría de flujo
- Quite el medio y la transferencia de cultura de gel (de paso 3.11) en un tubo de microcentrífuga de 1,5 mL.
- Incubar el gel con 500 μl de enzima de disociación celular (por ejemplo, TrypLE Express) a 37 ° C durante 5 minutos, sacudiendo de vez en cuando el tubo para agitar.
- Transferir la mezcla a un tubo de centrífuga de 50 mL con 5 mL de medio completo. Coloque el tubo en hielo.
- Coloque una aguja de 20G en una jeringa de 10 mL. Tire suavemente de la suspensión hacia arriba y hacia abajo a través de la aguja 8 veces.
- Flujo de la mezcla a través de 70 μm tamiz de célula en un tubo de centrífuga de 50 mL nuevo. Se aplica un adicional 5 mL de medio completo a través del tamiz para recoger las células restantes.
- Centrifugar la muestra a 400 x g por 5 minutos quite el sobrenadante y resuspender el precipitado en tampón deseado para citometría de flujo (mediante protocolos estándar3).
6. criopreservación de hidrogeles para seccionamiento
- Retire el medio de culturas de gel (de paso 3.11).
- Incubar las culturas gel con 2 mL de paraformaldehído al 4% (PFA) a 4 ° C durante la noche.
PRECAUCIÓN: PFA es tóxica y debe manipularse con cuidado. - Al día siguiente, quitar PFA. Añadir 2 mL de sacarosa al 5% en PBS a geles e incubar 1 h a temperatura ambiente.
- Reemplazar la solución de sacarosa al 5% con 2 mL de sacarosa al 20% en PBS e incubar durante 30 minutos.
- Reemplazar la solución de sacarosa con 2 mL de sacarosa al 20% fresco en PBS e incubar durante una 30 minutos adicionales.
- Por tercera vez, reemplazar la solución de sacarosa con 2 mL de sacarosa al 20% fresco en PBS. Incubar a 4 ° C durante la noche.
- Preparar 20% sacarosa en compuesto temperatura de corte óptima (OCT).
Nota: Debido a la viscosidad de la OCT, disolución de sacarosa puede tomar algunos tiempo (hasta durante la noche). Recomendamos poner la mezcla en un agitador durante disolución para mantener agitación. - Al día siguiente, retire la solución de sacarosa al 20% y verter suavemente el 20% de sacarosa en solución de OCT sobre el gel. Asegúrese de cubrir el gel entero. Incubar a 4 ° C por 3 h.
- Transferir el gel en el centro de un molde de inclusión con una espátula grande y plana; Esto debe hacerse con cuidado para no dañar el gel.
- 2-Metilbutano fresco dentro de un cryochamber con un exceso de hielo seco.
- Llenar el molde de incrustación con OCT puro (no sacarosa). Llene hasta justo por debajo del borde superior del molde.
- Congelar la muestra de hidrogel por inmersión en frío de 2-Metilbutano y luego proceder a seccionar.
- Sección de la muestra usando un criostato; se recomienda espesor de sección de 10-18 μm y seccionamiento temperatura alrededor de-26 ° c.
- Realizar procedimientos de immunostaining estándar de gel seccionado cultura, como se describió anteriormente3.
Nota: El PFA es conocido irritante y cancerígeno. Por favor utilice y deseche PFA según reglamentos y normas locales aplicables.
7. extracción de ARN total de muestras en hidrogel
Nota: Aquí, describimos un protocolo usando un comercial kit (ver la tabla de materiales) para extraer el ARN de las células cultivada del hidrogel. Los topes y todo el material están disponibles en el kit utilizado.
- Retire el medio de cultivo. Utilizar una pipeta P1000 con punta ancha para transferir la cultura de hidrogel tubo de microcentrífuga de 1,5 mL.
- Añadir 350 μl de tampón de RLT a la cultura de hidrogel.
- Utilizando una aguja de 20 G conectada a una jeringa de 1 mL, triturar el gel empujando la mezcla entera a través de aguja al menos 20 veces.
- Transferir la mezcla todo en una columna de homogeneizador en un tubo de recogida de 2 mL. Centrifugar a 13.000 x g durante 2 minutos.
- Transferir el sobrenadante a un tubo de microcentrífuga limpio de 1,5 mL. Tenga cuidado de no disturbar el precipitado de gel en la parte inferior.
- Mezcle la muestra de lisado con 350 μl de etanol al 100%. Transferir la muestra a un lugar de la columna (del kit) de vuelta en un tubo de recogida de 2 mL. Centrifugar por 1 min a 13.000 x g.
- Para realizar los siguientes pasos para la purificación de RNA por PCR, seguir el protocolo general proporcionado por el fabricante del kit.
Nota: Una vez que se extrae el RNA, pueden utilizarse protocolos de PCR.
Resultados
Por cada lote de thiolated HA, debe verificarse el grado de thiolation con1H -NMR o test de un Ellman. HA modificación utilizando el procedimiento descrito aquí constantemente genera thiolation ~ 5% (definido como la fracción molar de tioles a disacáridos HA) (figura 1).
Creación de esta nueva plataforma de cultura requerirá cada laboratorio para llevar a cabo pruebas rigurosas para asegurar la viabilidad de buena cultura antes de la implementación de experimentos a gran escala. Nuestros 80 μl los hidrogeles con una siembra densidad 500.000 células/mL (gel o células 40.000) resultan consistentemente en las tasas de proliferación que son comparables o mejores que las culturas gliomasphere (figura 2A-2 C). Como HA/PEG hidrogeles son ópticamente transparentes, comportamientos de la célula se observan directamente en las culturas viven, 3D mediante microscopía de contraste o fluorescencia de fase. Figura 3A muestra que 4 días después de la encapsulación, células GBM en los hidrogeles que contienen RGD exhiben un fenotipo invasivo, mientras que las células cultivan en hidrogel utilizando PEG-MAL-CYS controles tienen una morfología esférica.
Como es típico con modelos de xenoinjerto donde los investigadores tienen que esperar días a meses hasta tumores implantados alcanzan crecimiento progresivo24,32, células derivadas del paciente también toman tiempo para adaptarse a un nuevo entorno de la cultura. Por lo tanto, se recomienda cultivo de 4 a 8 días antes de comenzar los experimentos, como tratamiento, para asegurar la que mayoría de las células ha entrado en la fase de crecimiento exponencial. Más allá de los tratamientos con fármacos, reactivos como soluble cyclo-RGD, que competitivamente interrumpen las interacciones celulares con RGD en hidrogeles, se pueden agregar al medio de cultivo (Figura 3A).
Nuestro sistema de hidrogel es compatible con muchos métodos comunes para la investigación de Biología de la célula de glioma. Usando proyección de imagen de bioluminiscencia, que comúnmente se utiliza para monitorear tumores xenoinjerto roedores, números relativos de células viables se observan en las culturas de hidrogel durante el curso del tratamiento. Figura 3B es un ejemplo de este método, donde se evaluaron efectos del tratamiento de erlotinib en células cultivadas de hidrogel GBM durante 6 días. En general, culturas de hidrogel pueden tratarse como las muestras de tejido durante la preparación de lisados de Western blot o PCR. Mancha blanca /negra occidental análisis de exfoliados poli ADP de polimerasa indica que relativo grado de apoptosis en células de precipitación de CD44 tratadas es mayor que las de células de tipo salvaje GBM cultivan en 0.5% hidrogeles HA ()figura 3). Suspensiones celulares solo se pueden preparar del mismo modo, de hidrogel culturas para análisis mediante citometría de flujo utilizando protocolos estándar para liberar las células de los tejidos intactos (figura 2). Además de las características de la célula, cryosections de culturas basadas en el hidrogel, 3D preservar ECM depositado por células cultivadas. Por ejemplo, patrones de deposición de cambio de colágeno de tipo IV sobre el tratamiento de erlotinib de hidrogel culturas (figura 3D).

Figura 1 : H representante 1 -NMR espectro de ácido hialurónico de thiolated. Integrado picos indican que aproximadamente el 5% de HA glucurónico ácidos grupos han sido modificado con un tiol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Proliferación de las células encapsuladas de hidrogel. A) imágenes de ejemplo de geles de μl 80 fabricado en placas de 12 pocillos. Después de la reticulación, los hidrogeles fueron hinchados en medio de cultivo celular. B) resultados representativos de la tasa de proliferación medición mediante citometría de flujo. Células GBM (HK301) se incubaron con el 1 μm EdU (5-ethynyl-2 '-desoxiuridina) por 2,5 h en el cuarto día después de la encapsulación o pases. Una click-reacción fue utilizada para conjugado colorante fluorescente a EdU incorporado, como se detalla en Xiao et al. 2017.3 controles negativos, donde no hay EdU fue agregada a las culturas, se incluyeron. Imágenes de microscopía confocal C) representante de viven (verde) y muerto (rojo) las células 24 horas después se establecieron cultivos de hidrogel de GBM células (HK157). Barras de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
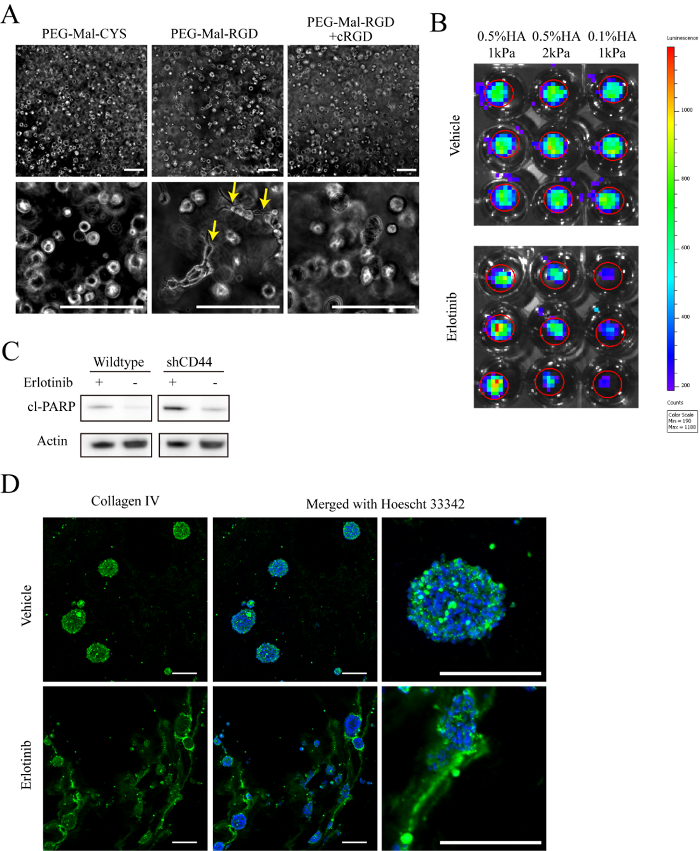
Figura 3 : Caracterización. A) imágenes de contraste de fase representante de 0.5% (p/v) HA cultivadas de hidrogel células bajo diferentes condiciones durante 8 días después de la encapsulación. Las flechas indican células con una morfología invasor. B) imágenes representativas de señal de bioluminiscencia se midieron después de 15 días de tratamiento con 1 μm erlotinib o vehículo (DMSO). 1 mM D-luciferin añadido al medio de cultivo celular 1 h antes de la proyección de imagen. Las células fueron transduced con lentivirus codificación constitutiva expresión de luciferasa de luciérnaga antes de la encapsulación. C) representante inmunitario-blot imágenes analizando partida poli ADP polimerasa (PARP-cl) expresión células GBM (HK301) cultivada en hidrogeles con 0.5% (p/v) HA y 1 módulo de resistencia a la compresión kPa. Todas recortadas imágenes mostradas eran de la misma mancha. D) representante de tinción del colágeno IV (verde) y Hoechst 33342 (azul) en las células cultivadas de hidrogel HK301 12 días después del tratamiento con 1 μm erlotinib o vehículo (DMSO). Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
| Tipo gel | Parte una (40 μl cada una) | Parte B (40 μL) | ||||
| 4Arm-PEG-MAL (50mg/mL) | Cisteína o RGD (2,81 mM) | PBS (pH 7.4) | 4Arm-PEG-tiol (50mg/mL) | PBS (pH 7.4) | HA-S (13,3 mg/mL) | |
| 0.5% (p/v) HA 1kPa | 10 ΜL | ΜL 4,00 | 26 ΜL | 1.00 ΜL | ΜL DE 9.00 | 30.0 ΜL |
| 2kPa HA de 0.5% (p/v) | 20.0 ΜL | ΜL 4,00 | 16.0 ΜL | ΜL DE 8.00 | ΜL DE 2.00 | 30.0 ΜL |
| 0.1% (p/v) HA 1kPa | 10 ΜL | ΜL 4,00 | 26 ΜL | ΜL DE 8.00 | 26.0 ΜL | ΜL DE 6.00 |
Tabla 1. Formulaciones de hidrogel rendimiento control independiente de la concentración de HA y propiedades mecánicas.
Discusión
Generación de datos reproducibles mediante este sistema de cultivo 3D requiere: 1) constante-lotes thiolation de la HA, 2) práctica para lograr la mezcla de precursores de hidrogel eficiente y manejo del hidrogel culturas para prevenir daños y 3) optimizado siembra densidad para cada línea celular utilizada.
Cuando se desea un porcentaje del peso de la HA en el hidrogel, el grado de thiolation de HA determina la densidad de reticulación. Se recomienda utilizar una cantidad constante de HA para cada reacción thiolation para minimizar la variación de lote a lote. Le sugerimos que al menos 300 mg de HA ser utilizado para cada reacción de thiolation para que el mismo lote de thiolated HA puede ser utilizado para múltiples repeticiones experimentales. La fracción molar de tioles a grupos de maleimida en brazo 4 clavija debe ser siempre ser 1.1:1 para asegurar eficacia máxima reticulación. Por lo tanto, si se varía el grado de thiolation, entonces la cantidad de PEG-Mal añadido debe modificarse en consecuencia. Cuando péptidos se conjugan para maleimides antes de la formación de gel, el número de brazos de PEG con péptidos atados debe restar del número total de maleimides disponibles para este cálculo. Además, se recomienda mantener el grado de HA thiolation por debajo de 10-15% para evitar la formación de Enlace disulfuro que evitará disolución y congelación constante.
La reacción de adición tipo Michael entre los grupos tiol y maleimida asegura que gelificación ocurre en menos de un minuto. Mientras que esta congelación rápida reduce al mínimo la cantidad de tiempo las células suspendidas en precursores de hidrogel son sin medio completo, que puede poner en peligro su viabilidad, el proceso de encapsulación requiere experiencia con pipeteo y mezcla pasos para lograr resultados reproducibles. Por lo general, tenemos nuevos alumnos practican varias rondas de congelación sin células antes de realizar experimentos de encapsulación "real".
Dos factores pueden ser ajustados para modular la velocidad de gelificación: pH temperatura y precursor de la reacción. Bajar la temperatura de reacción mediante la colocación de la placa de la pozo en hielo mientras se mezcla retarda la reacción y proporciona mayor tiempo mezclar disoluciones precursoras. Sin embargo, esto debe hacerse en condiciones estériles utilizando técnicas asépticas adecuadas. Del mismo modo, el pH de disoluciones precursoras puede modificarse para aumentar o disminuir el tiempo de reacción mediante el uso de pH superior o inferior, respectivamente. Desde thiolated HA se dializaron contra agua ácida para evitar la formación del enlace de disulfuro, thiolated reconstituido HA producirá menor pH que cabría esperar lo contrario. En general, rinde un pH cerca de 7 cuando reconstitución en 20 mM HEPES en tampón HBSS, ajustado a pH 9, 15 mg/mL de thiolated HA (~ 5% thiolated) se disuelve. Se recomienda utilizar pH 6.8-7 thiolated HA solución para permitir incluso mezcla de gel de solución mientras que maximiza la salud celular.
Densidad de siembra durante la encapsulación es crítico para la viabilidad celular y reproducibilidad experimental. Se recomienda sembrar en el rango de 100.000 a 2.000.000 células/mL. Hemos encontrado que esta gama es óptima para la viabilidad de la mayoría de los tipos de la célula evitando sobre-confluencia dentro de un plazo experimental de al menos 3 semanas. La densidad de siembra inicial que optimiza la viabilidad debe determinarse experimentalmente para cada tipo de célula utilizada.
Deben extremarse al cambiar el medio de la célula para evitar dañar cultivos de hidrogel. En particular, tenga cuidado de no para aspirar el hidrogel en la pipeta. Por lo tanto, no use aspiración al vacío y en lugar de otro utilizar una pipeta estéril para aspirar manualmente. Cambiando sólo la mitad del medio en una cultura bien a la vez también puede ayudar.
En general, esta técnica requiere práctica para lograr la destreza manual necesaria y la consistencia. Una vez establecido un protocolo específico de laboratorio, el sistema de cultivo 3D permite al investigador a utilizar muchos métodos de caracterización como típico para cultivo de células y tejidos explanted. Aquí, hemos descrito varias técnicas para el análisis, incluyendo inmunofluorescencia, citometría de flujo, el borrar occidental y proyección de imagen de bioluminiscencia de culturas vivas, 3D (figura 2-3). Protocolos más detallados de los métodos de caracterización, consulte Xiao et al. 20173. Por último, como hidrogeles HA/PEG son ópticamente transparentes, técnicas de la microscopia ligera estándar, incluyendo proyección de imagen confocal, pueden utilizarse para supervisar las culturas viven, 3D.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Este trabajo fue financiado con fondos de los NIH (R21NS093199) y Premio de 3R de arco UCLA. Nuestro agradecimiento más sincero al laboratorio del Dr. Harley Kornblum para provisión de las líneas celulares HK301 y HK157. También agradecemos a UCLA tejido patología base laboratorio (TPCL) para cryosectioning, instalaciones de centrales avanzadas luz microscopia/espectroscopia (limosna) en el Instituto de nanosistemas de California (CNSI) en UCLA para el uso del microscopio confocal, UCLA Crump Institute for La proyección de imagen molecular para el uso de sistema de proyección de imagen de IVIS, UCLA Molecular instrumentación Center (MIC) por espectroscopia de resonancia magnética y núcleo de citometría de flujo en Jonsson comprensivo cáncer Center (JCCC) en UCLA para proporcionar instrumentación para flujo Citometría.
Materiales
| Name | Company | Catalog Number | Comments |
| pH meter | Thermo Fisher | N/A | Any pH meter that has pH 2-10 sensitivity |
| Stir plate | Thermo Fisher | N/A | General lab equipment |
| Erlenmeyer flask (125mL) | Thermo Fisher | FB-501-125 | |
| dialysis tubes | Thermo Fisher | 21-152-14 | |
| 2L polypropylene beaker | Thermo Fisher | S01916 | |
| sodium hyaluronan | Lifecore | HA700k-5 | 500-750 kDa range |
| 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) | Thermo Fisher | PI-22980 | |
| N-hydroxysuccinimide (NHS) | sigma aldrich | 130672-5G | |
| Hydrochloric acid (HCl) | Thermo Fisher | SA48-500 | |
| Sodium hydroxide (NaOH) | Thermo Fisher | SS266-1 | |
| Cystamine dihydrochloride | Thermo Fisher | AC111770250 | |
| Dithiolthreitol (DTT) | Thermo Fisher | BP172-25 | |
| Ellman's test reagent (5-(3-Carboxy-4-nitrophenyl)disulfanyl-2-nitrobenzoic acid | Sigma Aldrich | D218200-1G | |
| Deuterated water (deuterium oxide) | Thermo Fisher | AC166301000 | |
| 0.22µm vacuum driven filter | CellTreat | 229706 | |
| Phosphate buffered saline (PBS) | Thermo Fisher | P32080-100T | |
| Hanks' balanced salt saline (HBSS) | Thermo Fisher | MT-21-022-CV | |
| 4-arm-PEG-maleimide | JenKem Technology | A7029-1 | molecular weight around 20kDa |
| 4-arm-PEG-thiol | JenKem Technology | A7039-1 | molecular weight around 20kDa |
| L-Cysteine | sigma aldrich | C7880-100G | |
| RGD ECM mimetic peptide | Genscript Biotech | N/A | Custom peptide with sequence "GCGYGRGDSPG", N-terminal should be acetylated |
| silicone molds | Sigma Aldrich | GBL664201-25EA | Use razor blade to cut into single pieces |
| complete culture medium | Various | Various | DMEM/F12 (Thermofisher) with non-serum supplement (G21 from GeminiBio), epidermal growth factor 50ng/mL (Peprotech), fibroblast growth factor 20ng/mL (Pepro Tech) and heprain 25µg/mL (Sigma Aldrich), culture medium varies in different labs |
| patient derived GBM cell | N/A | N/A | |
| 20G needle | BD medical | 305175 | |
| 1mL syringe | Thermo Fisher | 14-823-434 | |
| 10mL syringe | BD medical | 302995 | |
| RIPA Buffer | Thermo Fisher | PI-89901 | |
| protease/phosphatase inhibitor mini tablet | sigma aldrich | 5892970001 | |
| vortex shaker | Thermo Fisher | 12-814-5Q | |
| TrypLE express | Thermo Fisher | 12604013 | |
| 70µm cell strainer | Thermo Fisher | 22-363-548 | |
| Paraformaldehyde | Thermo Fisher | AC416785000 | Dissolve 4% (w/v) in PBS, keep pH 7.4 |
| D-sucrose | Thermo Fisher | BP220-1 | |
| Optimal Cutting Temperature (O.C.T.) compound | Thermo Fisher | NC9373881 | |
| Cell culture incubator | Thermo Fisher | N/A | Any General One with 5% CO2 and 37C |
| fridge/freezer | Thermo Fisher | N/A | Any General Lab equipment with -20C and -80C capacity |
| Disposable embedding molds | Thermo Fisher | 12-20 | |
| Lyapholizer | Labconco | N/A | Any -105C freeze dryers |
| HEPES | Thermo Fisher | BP310-500 | |
| Amber vial | Kimble Chase | 60912D-2 | |
| Wide orifice pipette tips | Thermo Fisher | 9405120 | |
| 2-methylbutane | Thermo Fisher | 03551-4 | |
| Dry Ice | N/A | N/A |
Referencias
- Xiao, W., Sohrabi, A., Seidlits, S. K. Integrating the glioblastoma microenvironment into engineered experimental models. , (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and bioengineering. 103 (4), 655-663 (2009).
- Xiao, W., et al. Brain-mimetic 3d culture platforms allow investigation of cooperative effects of extracellular matrix features on therapeutic resistance in glioblastoma. Cancer Research. 78 (5), 1358-1370 (2018).
- Holland, E. C. Glioblastoma multiforme: the terminator. Proceedings of the National Academy of Sciences. 97 (12), 6242-6244 (2000).
- Ostrom, Q. T., et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2006 - 2010. Journal of Neuro-Oncology. 15 (6), 788-796 (2013).
- Bellail, A. C., Hunter, S. B., Brat, D. J., Tan, C., Van Meir, E. G. Microregional extracellular matrix heterogeneity in brain modulates glioma cell invasion. International Journal of Biochemistry and Cell Biology. 36 (6), 1046-1069 (2004).
- Zamecnik, J. The extracellular space and matrix of gliomas. Acta Neuropathologica. 110 (5), 435-442 (2005).
- Jadin, L., et al. Hyaluronan expression in primary and secondary brain tumors. Annals of translational medicine. 3 (6), (2015).
- Park, J. B., Kwak, H. J., Lee, S. H. Role of hyaluronan in glioma invasion. Cell adhesion & migration. 2 (3), 202-207 (2008).
- Pedron, S., et al. Spatially graded hydrogels for preclinical testing of glioblastoma anticancer therapeutics. MRS communications. 7 (3), 442-449 (2017).
- Jiglaire, C. J., et al. Ex vivo cultures of glioblastoma in three-dimensional hydrogel maintain the original tumor growth behavior and are suitable for preclinical drug and radiation sensitivity screening. Experimental cell research. 321 (2), 99-108 (2014).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Day, A. J., Prestwich, G. D. Hyaluronan-binding proteins: tying up the giant. Journal of Biological Chemistry. 277 (7), 4585-4588 (2002).
- Wiranowska, M., Tresser, N., Saporta, S. The effect of interferon and anti-CD44 antibody on mouse glioma invasiveness in vitro. Anticancer Research. 18 (5A), 3331-3338 (1998).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. GLIA. 59 (8), 1169-1180 (2011).
- Gilg, A. G., et al. Targeting hyaluronan interactions in malignant gliomas and their drug-resistant multipotent progenitors. Clinical Cancer Research. 14 (6), 1804-1813 (2008).
- Misra, S., Hascall, V. C., Markwald, R. R., Ghatak, S. Interactions between hyaluronan and its receptors (CD44, RHAMM) regulate the activities of inflammation and cancer. Frontiers in immunology. 6, 201(2015).
- Varga, I., et al. Expression of invasion-related extracellular matrix molecules in human glioblastoma versus intracerebral lung adenocarcinoma metastasis. Zentralblatt fur Neurochirurgie. 71 (4), 173-180 (2010).
- Guo, W., Giancotti, F. G. Integrin signalling during tumour progression. Nature Reviews Molecular Cell Biology. 5 (10), 816-826 (2004).
- Bello, L., et al. αvβ3 and αvβ5 integrin expression in glioma periphery. Neurosurgery. 49 (2), 380-390 (2001).
- Chamberlain, M. C., Cloughsey, T., Reardon, D. A., Wen, P. Y. A novel treatment for glioblastoma: integrin inhibition. Expert review of neurotherapeutics. 12 (4), 421-435 (2012).
- Chopra, A., et al. Augmentation of integrin-mediated mechanotransduction by hyaluronic acid. Biomaterials. 35 (1), 71-82 (2014).
- Kim, Y., Kumar, S. CD44-mediated adhesion to hyaluronic acid contributes to mechanosensing and invasive motility. Molecular Cancer Research. 12 (10), 1416-1429 (2014).
- Joo, K. M., et al. Patient-specific orthotopic glioblastoma xenograft models recapitulate the histopathology and biology of human glioblastomas in situ. Cell Reports. 3 (1), 260-273 (2013).
- Oh, Y. T., et al. Translational validation of personalized treatment strategy based on genetic characteristics of glioblastoma. PloS one. 9 (8), e103327(2014).
- Pedron, S., Becka, E., Harley, B. A. C. Regulation of glioma cell phenotype in 3D matrices by hyaluronic acid. Biomaterials. 34 (30), 7408-7417 (2013).
- Wang, C., Tong, X., Yang, F. Bioengineered 3D brain tumor model to elucidate the effects of matrix stiffness on glioblastoma cell behavior using PEG-based hydrogels. Molecular pharmaceutics. 11 (7), 2115-2125 (2014).
- Zhu, J. Bioactive modification of poly(ethylene glycol) hydrogels for tissue engineering. Biomaterials. 31 (17), 4639-4656 (2010).
- Stern, R., Asari, A. A., Sugahara, K. N. Hyaluronan fragments: an information-rich system. European journal of cell biology. 85 (8), 699-715 (2006).
- Riddles, P. W., Blakeley, R. L., Zerner, B. Ellman's reagent: 5, 5′-dithiobis (2-nitrobenzoic acid)-a reexamination. Analytical biochemistry. 94 (1), 75-81 (1979).
- Jin, R., et al. Synthesis and characterization of hyaluronic acid-poly (ethylene glycol) hydrogels via Michael addition: An injectable biomaterial for cartilage repair. Acta biomaterialia. 6 (6), 1968-1977 (2010).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of visualized experiments. 41, 3-7 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados