Method Article
Характеристика опухолевых клеток с помощью медицинская проволока для захвата циркулирующих клеток опухоли: 3D подход, основанный на иммунофлюоресценции и ДНК рыбы
В этой статье
Резюме
Мы представляем новый подход к характеризуют опухолевых клеток. Мы объединили иммунофлюоресценции с ДНК люминесцентные -монолитного-гибридизации оценить клетки, захвачен функционализированных медицинская проволока, способны в vivo обогащения CTCs непосредственно из крови пациента.
Аннотация
Циркулирующих клеток опухоли (CTCs) связаны с бедными выживания в лечении метастатического рака. Их идентификации, фенотипа и генотипирования может привести к более глубокому пониманию опухоли неоднородность и таким образом облегчить отбор пациентов для лечения персонализированные. Однако это затрудняется из-за редкости ЦОК. Мы представляем новаторский подход для выборки большого количества крови пациента и получения информации о присутствия, фенотип и Джин транслокации ЦОК. Этот метод сочетает в себе иммунофлюоресценции окрашивание и ДНК люминесцентные -монолитного-гибридизации (ДНК рыбы) и на основе функционализированных медицинская проволока. Этот провод является инновационным устройством, которое позволяет в естественных условиях изоляции CTCs от большого объема периферической крови. Объем крови, проверяются администрацией 30-мин провода — примерно 1,5-3 л Чтобы продемонстрировать целесообразность такого подхода, эпителиальных клеток сцепления молекул (EpCAM) выражение и транслокация гена ALK были определены в не небольшие клеток легких рака легкого (НМРЛ) клеточных линий захвачен функционализированных проволоки и Витражи с иммуно ДНК рыбы подход. Нашей главной задачей было выполнить пробу на 3D структуры, функционализированных провода и определить иммуно фенотипа и рыбы сигналов на этой поддержки, с помощью обычных флуоресцентным микроскопом. Полученные результаты показывают, что ловить CTCs и анализа их фенотипа и хромосомная перестановка может потенциально представляют собой новый компаньон диагностический подход и предоставляют инновационные стратегии для улучшения персонализированных лечения рака.
Введение
ЦОК представляют собой ключевой шаг раковых клеток распространение1. Их присутствие в периферической крови больных ассоциируется с (метастазов) рецидива и болезнь прогрессии2,3. КТК изоляции и характеристика от крови больных раком — это тип неинвазивные жидкого биопсии. В последние годы становится все более очевидным, что мониторинг прогрессии и реакции опухоли на различные процедуры с использованием такого рода анализ обеспечивает важной клинической информации4,5. Жидкий биопсии еще более полезным, когда операция не является возможным или когда первичной опухоли не доступен, то есть, для не biopsiable поражений. Следовательно этот подход является перспективным в конкретных рака параметры, такие как метастатического НМРЛ, где было показано присутствие CTCs иметь отрицательные прогностические роль6. НМРЛ это опухоль, особенно от целевых терапевтических подходов7,8,9 , призванных действовать на определенных молекул (молекулярных целей) известный участвовать в росте, прогрессии, и распространение болезни. Следовательно необходима обнаружения конкретных целей во время болезни. КТК расследование является чрезвычайно интересным диагностический подход для выявления и мониторинга наркотиков целей без необходимости для первичного или метастатической тканей. Например обнаружение транслокации гена ALK в клетках НМРЛ связан с чувствительностью к crizotinib, конкретной целенаправленной терапии10. Однако в настоящее время обнаружения ALK транслокации выполняется только на тонкоигольной пунктаты или небольших биопсий; в результате без опухоль ткани ALK анализ не является возможным. ЦОК являются потенциальной альтернативой опухоли на основе ткани расследований и представляют собой весьма перспективным компаньон диагностический подход.
Несмотря на их потенциальное значение ЦОК по-прежнему являются предметом большой дискуссии среди исследований, главным образом из-за их редкости (1-10 клеток/мл периферической крови11). Текущие жидкость биопсии методы используют ограниченное количество крови (т.е., 1-30 мл)12,13, но это создает ситуацию субоптимальные чувствительности для обнаружения CTCs. Следовательно, заслуживает проведения исследований для нахождения подходов и разработке устройств для выполнения КТК целевой жидких биопсий на больший объем периферической крови.
Альтернативные устройства, функционализированных медицинская проволока (см. Таблицу материалы), был разработан преодолеть ограничения отбора проб крови и получить более представительным анализ ЦОК. Этот функционализированных проволока является одобренный CE медицинской устройство, которое захватывает CTCs непосредственно из крови больных раком1. Он состоит из 16-см длиной нержавеющей стальной проволоки (рис. 1a) с длиной 2 см функционализированных наконечником с 0,2 мкм толстый слой золота покрытием. В свою очередь слой покрывается 1-5 мкм толщиной поликарбоксилата гидрогеля страте ковалентно в сочетании с антитела, направленные против EpCAM, один из наиболее широко выраженная антигенов на поверхности CTCs14. Функционализированных кончик проволоки вводится в вену руки пациента и остается в положении по крайней мере 30 минут. Этот подход позволяет изоляции ЦОК в естественных условиях, непосредственно в периферической крови и экран около 1,5-3,0 Л крови (примерно 300-fold больше, чем объем, используемый для альтернативных подходов)1.
Pantel и др. продемонстрировали эффективность этого подхода в изоляции CTCs прямо в руки Вены больных раком легкого15. Они исполнили проволока иммунофлюоресценции окрашивания для выявления ЦОК, с использованием обычных антитела, направленные против EpCAM и Пан Цитокератины и CD45 лейкоцитарной обнаружения. Провод был рассмотрен под микроскоп оптический флуоресценции15. Авторы показали, что устройство было возможность изолировать ЦОК, но они не расследовать любые связанные с терапии целей, таких как ALK транслокации.
Представленный метод направлен на выявление предполагаемых ЦОК в НМРЛ клеточных линий на основе фенотипические параметров, например, EpCAM позитивность и наличие молекулярных биомаркеров, например состояние ALK (рис. 1b). Эта процедура 3-дн длинней сочетает в себе функционализированных проволоки и иммунофлюоресценции, окрашивание с ДНК флуоресценции -in situ-гибридизации (ДНК рыбы), названный иммуно-ДНК-рыба. Учитывая, что CTCs редких сущности, преимуществом этого протокола является что CTCs можно охарактеризовать на же проволоки терминах иммунофенотипических функций и перераспределения ДНК.
протокол
1. иммуно ДНК рыбы на 2D Coverslip
- Coverslip подготовка и сторонник клеток посева
Примечание: Выполните все следующие действия под капотом ламинарного потока в стерильных условиях.- Погрузите coverslip в 100% этанола, чтобы вылечить их.
Примечание: Мы используем 12 мм × 12 мм силиконовые поддерживаемые квадрате coverslips (все реагенты, перечислены в Таблице материалы). - Поместите coverslips в чашке Петри (диаметр 100 мм). Сухой с помощью принудительного воздушного потока на 5 мин.
- Мыть Петри с 15 мл стерильного 1 × Дульбекко фосфат буфер солевой раствор (PBS).
- Мыть Петри с 10 мл полной среды (см. таблицу 1).
- Семя адэрентных клеток (около 1650000 ячейки в 10 мл среды, учитываются путем анализа СУИМ), осторожно сбрасывая суспензию клеток на Петри блюдо для получения единообразных ячейки покрытия (около 30 000 клеток/см2).
Примечание: Для ~ 70% слияния, сторонник клетки должны культивированный на coverslips для по крайней мере 48 часов.
- Погрузите coverslip в 100% этанола, чтобы вылечить их.
- Фиксация и permeabilization
Предупреждение: Ацетон-легковоспламеняющиеся и раздражает летучие вещества. Используйте только ацетон устойчивостью пластмассы или стеклянной тары (без ПВХ или PVDF).
Примечание: Выполните эти шаги под химических зонта.- Удалите носитель культуры, с помощью одноразовой пипетки аспирационных.
- Вымойте Петри с 1 × PBS.
- С помощью пинцета, мыть coverslips путем погружения их в стеклянный стакан, содержащих по 5 мл 1 × PBS.
- Сухой coverslips на промокательной бумаги.
- Исправьте клетки на coverslip, погружая его в 100% раствор ацетона 10 мин при комнатной температуре (RT).
- Удалите coverslip, пинцеты. Сухой coverslip с помощью принудительного воздушного потока на 5 мин.
Примечание: Протокол может быть приостановлена на данный момент. Coverslip должны храниться при температуре-20 ° C.
- Иммунофлюоресценции день 1
Примечание: Этот этап включает в себя ночь инкубации (O/N) (~ 16 ч).- Мыть coverslips в 1 × PBS дважды.
- Падение 100 мкл буфера разбавления антитела (подробную информацию см. в таблице 1 ) на coverslip и Инкубируйте 30 мин на RT.
Примечание: Решение объем должен корректироваться на основе coverslip поверхность для того, чтобы покрыть весь coverslip и избежать риска переполнения. - Подготовьте смесь антител (Таблица 1) с использованием в 1:20 разрежения моноклональные антитела первичной проспряганное с флюрохром и антитела буфером для разбавления проб, как указано в таблице, представленной изготовителем.
Примечание: Настоятельно рекомендуется использовать моноклональные антитела, конъюгированных с термостабильной флюрохром. Если используется не термостабильные флюрохром, температура, использованных в ДНК-рыба шаги протокола могут повредить флюрохром и потушить Флуоресцентные выбросов. В этом протоколе, мы выбрали для EpCAM-FITC антитела (1:20 разрежения), которые не показывают каких-либо значительных проблем с используемой температуры. - Промывайте coverslips дважды в 1 × PBS.
- Место coverslips стороны ячейки вверх в влажный камеры и падение 100 мкл антител микс на coverslip.
Примечание: Решение объем должен корректироваться на основе coverslip поверхности покрыть весь coverslip и уменьшить риск переполнения. - Инкубировать O/N (~ 16 ч) в темноте при 4 ° C.
- Иммунофлюоресценции день 2
- Блокировать Антитело инкубации, Стиральная coverslips в 1 × PBS дважды.
Примечание: Магазин coverslips погружается в 100 мкл 1 × PBS на 4 ° C в камере с постоянным влажной среде в темноте до тех пор, пока генотипирования рыбы.
- Блокировать Антитело инкубации, Стиральная coverslips в 1 × PBS дважды.
- 2D ДНК рыбный день 2
Предупреждение: Особое внимание должно уделяться высокой температуры инструментов и влажной камере.- Установить печь гибридизации и сухого тепла печь (~ 3 h перед началом протокол ДНК-рыбы). Установить печь гибридизации при 75 ° C, установить печь сухим жаром при 37 ° C и прохладный 0,4 × SSC раствора (рН = 7,0 ± 0,1) (SSC рецепт см. в таблице 1) до 4 ° C.
Примечание: рН статус буферов рыб важно: рН = 7,0 ± 0.1. - Мыть coverslip три раза в ледяной 0,4 × SSC решения.
- Сухой coverslip под химических зонт для 10 минут в темноте.
- Вортекс для 10 s и выполнять быстрый спин вниз (по максимальной ставке) зонд из стены зонд-трубки.
- Место coverslip стороны ячейки вниз на капли 5 мкл рыбы зонда на слайд и печать всех краев coverslip с резиновый клей.
Предупреждение: Два следующих шагов включают высоких температур. Надевайте защитные перчатки. - Поместите слайд в темных влажных камеру в духовке 8 мин при 75 ° C для полного денатурации ДНК гибридизации.
- Переместить влажной камере в сухого тепла печь на 37 ° C O/N.
- Установить печь гибридизации и сухого тепла печь (~ 3 h перед началом протокол ДНК-рыбы). Установить печь гибридизации при 75 ° C, установить печь сухим жаром при 37 ° C и прохладный 0,4 × SSC раствора (рН = 7,0 ± 0,1) (SSC рецепт см. в таблице 1) до 4 ° C.
- 2D ДНК рыбный день 3
- Установите водяной бане при температуре 72 ° C и поместите сосуд с 0,4 × SSC буфера слайд окрашивание в него (Таблица 1). После 30 минут, проверьте температуру 0,4 × SSC буфера, который должен быть на 72 ± 1 ° C.
- Подготовить две стеклянные стаканы: одна с 2 × ККК + 0,05% анимации буфере (рН = 7,0 ± 0,1) (Таблица 1) и еще один с дистиллированной водой.
- Удалить влажной камере из духовки, тщательно удалите резиновый клей из слайда и отсоединение coverslip с помощью пинцета.
- Мыть coverslip погружением в 0,4 × SSC на 2 мин при 72 ° C.
- Мыть coverslip погружением в 2 × ККК + 0,05% анимации буфер для 30 s.
- Промывайте coverslip в дистиллированной воде.
- Сухой coverslips под химических зонт для 10 минут в темноте.
- Маунт coverslip в среде жидкого монтажа с 1,5 мкг/мл 4´, 6-diamidino-2-phenylindole (DAPI) чтобы изображение всего ДНК. Место coverslip стороны ячейки вниз на капли 5 мкл монтажа среды на слайде, нажмите пинцет на coverslip чтобы получить воздух и печать с ногтей.
Примечание: Монтаж средний объем должен корректироваться на основе размер coverslip поверхности.
- 2D Микроскоп наблюдение и анализ
Примечание: Изображения могут быть приобретены с различными Микроскоп систем.
- Получать изображения с помощью 12-битный цифровой фотоаппарат и 20 × / 0,50 NA и 40 × / 0,65 NA цель с соответствующими фильтрами для красного (возбуждения: 599 Нм, выбросов: 588 Нм), зеленый (возбуждения: 509, выбросов: 524) и синий (возбуждения: 367 Нм, выбросов: 452 Нм) зонды.
- Анализ изображений с помощью программного обеспечения инструмент выбора.
Примечание: Для оценки пятнать иммунофлюоресценции и локализации ALK-зонд, мы использовали ImageJ. Слайды можно хранить при температуре-20 ° C в темноте для максимум 3 недели. Для длительного хранения мы хотели бы предложить, с использованием конкретных монтажа средних для длительного хранения.
2. иммуно ДНК рыбы на провод
- Ячейки строки Спайк в на проволоке (поддержка 3D)
Примечание: Предварительные настройки предполагает точный выбор приверженца клеток линии, основанные на EpCAM ым. Провод функционализированных с анти EpCAM антител, так что только EpCAM положительных клеток окрашенных.
Примечание: Не прикасайтесь функционализированных часть провода, чтобы избежать повреждений.
Примечание: Все шаги должны осуществляться под Ламинарный шкаф в стерильных условиях.- Ресуспензируйте все содержимое колбы T75 (80% слияния) в 5 мл флакон, используя 4 мл полной среды; для одного пика около 2000000 клетки рекомендуется для обеспечения максимальной адгезии клеток на проволоку.
- Выньте провод из упаковки стекла.
- Окуните функционализированных часть золота провода в пробирку, обеспечивая что провод стоппером водонепроницаемыми подходит для флакона. Печать с лабораторией фильм.
Примечание: Рекомендуется использовать 5 мл трубки для правильный матч между проволока пробка и флакона. - Инкубируйте 30 мин на RT в ротатор трубки (0-120 угол).
- Промывайте провод три раза в 1 × PBS решения с помощью 3 различных чистых флаконов.
- Фиксация и permeabilization
Предупреждение: Ацетон является легковоспламеняющиеся вещества, которое может вызвать раздражение дыхательных путей. Только используйте ацетон устойчивостью пластмассы или стеклянной тары (без ПВХ или PVDF).
Примечание: Выполните эти шаги под химических зонта.- Просушите провода.
- Исправьте клетки путем погружения проволоки в 100% раствора ацетона для 10 мин на RT. использования 5 мл.
Примечание: Проволока пробка не должны соприкасаться с фиксатором. - Просушите проволока для 5 мин на RT.
Примечание: Протокол может быть приостановлена здесь. Провода должны храниться при температуре-20 ° C. При упаковке проволока для длительного хранения, место провода стоппером рядом с функционализированных кончик и осторожно вставьте провода в хранения стеклянной трубки, стараясь не повредить функционализированных кончик. Закройте хранения стекла и хранить (вертикально или горизонтально) при-20 ° C.
- Иммунофлюоресценции день 1
Примечание: Этот этап предполагает инкубации O/N (~ 16 ч).- Мыть дважды в 1 × PBS решения с использованием 5 мл.
- Инкубируйте провод в буфере разбавления антитела для 30 мин на RT, используя 5 мл.
- Подготовка 150 мкл антител смеси с разрежения моноклональных основное антитело проспряганное с флюрохром в буфере разбавления антитела, как указано в таблице. Например, EpCAM-FITC антитела был использован с 1:20 разрежения.
- Использовать подсказку Р200 для выполнения инкубации, следующим образом: извлечь провод из проволоки пробка и аккуратно вставьте провод через большие отверстия кончика. Сначала вставьте конец unfunctionalized и медленно вытяните провод через небольшие отверстия, пока часть золота не только за большие дыры.
- Аккуратно удалите 150 мкл антител смесь (например анти EpCAM_FITC антител 1:20 разбавленный) в наконечник. Чтобы избежать риска формирования пузыря, аккуратно вертеть провода до тех пор, пока функционализированных часть полностью погрузился.
- Печать вверх отверстие кончик. Упаковочной пленки лаборатории вокруг отверстия может помочь.
- Инкубировать вертикально O/N (~ 16 ч) в темноте при 4 ° C.
- Иммунофлюоресценции день 2
- Блокировать Антитело инкубации, омыв провод дважды в 1 × PBS.
- Повторно вставьте провод в его провод пробкой.
Примечание: Магазин в 1 X PBS на 4 ° C в 5 мл флаконе до тех пор, пока генотипирования рыбы.
- 3D ДНК рыбный день 2
Предупреждение: Особое внимание должно уделяться высокой температуры инструментов и влажной камере.- Установить печь гибридизации и сухого тепла печь (~ 3 h перед началом протокол ДНК-рыбы). Установить печь гибридизации при 75 ° C, установить печь сухим жаром при 37 ° C и прохладный 0,4 × SSC раствора (рН = 7,0 ± 0,1) до 4 ° C.
Примечание: РН статус буферов рыбы имеет решающее значение и должна быть 7,0 ± 0,1. - Вымойте провод 3 раза в ледяной 0,4 × SSC решения.
Примечание: Держите провод в темноте, чтобы избежать флюрохром Фотообесцвечивание во время следующих процедур. - Химчистка для 10 минут в темноте под вытяжного шкафа.
- Вортекс и спинового зонда для 5 s.
- Падение 10 мкл зонда в theglass микропробирок. Крышка с лабораторией фильм.
- Спиновые пробирок следующим: Оберните Микропробирка в сухих впитывающих, бумага put в 50-мл пробирку и спина кратко.
- Тщательно место сушеные провод в Микропробирка и вставьте провода пробкой. Печать с резиновый клей.
Предупреждение: Два следующих шагов включают высоких температур.
- Установить печь гибридизации и сухого тепла печь (~ 3 h перед началом протокол ДНК-рыбы). Установить печь гибридизации при 75 ° C, установить печь сухим жаром при 37 ° C и прохладный 0,4 × SSC раствора (рН = 7,0 ± 0,1) до 4 ° C.
- Поместите слайд пятнать банку с 0,4 × SSC раствор в ванну с водой и в 72 ° C.
- Проверьте температуру раствора SSC 0,4 × до тех пор, пока он достигает 72 ± 1 ° C.
- Подготовить два стекла мензурки, одна с 2 × ККК + 0,05% анимации (рН = 7,0 ± 0,1) решение и второй с дистиллированной водой.
- Удалять влажной камере из сухого тепла печи, осторожно удалите резиновый клей из проволоки пробка с помощью пинцета и выньте провод.
Примечание: Осторожно потяните немелованной конец провода через IN-пробка, стараясь не повредить функционализированных кончик. - Окуните провод в раствор SSC 0,4 × 2 мин при 72 ° C.
- Вымойте провод в 2 × ККК + 0,05% раствор анимации для 30 s на RT.
- Вымойте провод в дистиллированной воде в рт.
- Сухие провод под зонт для 10 минут в темноте.
- Подготовьте раствор DAPI 1,43 мкм в 2 мл 1 × PBS.
- Инкубировать функционализированных кончик провода с DAPI решения в флакон 2 мл на 1 ч в темноте на RT.
- Промойте провод дважды в 1 × PBS и просушите.
- Позиция провод в держателе провода. Осторожно вставьте кончик функционализированных через точку входа специального держателя, до тех пор, пока кончик соответствует точке сцепления. Будьте осторожны, чтобы не повредить функционализированных кончик (рис. 1a).
- Поместите Специальный держатель на микроскопа. Отрегулируйте фокус с помощью 20 × объектива микроскопа. Сначала крупно сосредоточиться на специальной поддержки, а затем настроить мелко на клетки, которые появляются яркие DAPI-канале.
- Только положите в центре внимания клетки центральной для объектива.
Примечание: Изображения могут быть приобретены с различными Микроскоп систем. В этой обстановке, мы используем обычных флуоресцентный Микроскоп, наделен стандартным коммерческим программным обеспечением для захвата изображений. - Получать изображения с помощью 12-битный цифровой фотоаппарат и 20 × / 0,50 NA и 40 × / 0,65 NA цель с соответствующими фильтрами для красного (возбуждения: 599 Нм, выбросов: 588 Нм), зеленый (возбуждения: 509, выбросов: 524) и синий (возбуждения: 367 Нм, выбросов: 452 Нм) зонды.
Примечание: Изображения могут быть визуализированы с помощью различных инструментов и программного обеспечения. Мы используем ImageJ для оценки иммунофлюоресценции окрашивание и ALK-зонд локализации.
Примечание: Протокол может быть приостановлена здесь. Провода должны храниться при температуре-20 ° C. При упаковке проволока для длительного хранения, место провода стоппером рядом с функционализированных кончик и осторожно вставьте провода в хранения стеклянной трубки, стараясь не повредить функционализированных кончик. Закройте хранения стекла и хранить (вертикально или горизонтально) при-20 ° C.
Результаты
С помощью описанной выше процедуры можно выполнить assay иммуно-ДНК рыбы на CTCs (или других эквивалентных клетки), обогащенные функционализированных проволоки. Прежде чем настраивать этот протокол, совместимости двух методов был решительным (иммуно флуоресценции с рыбой) на стандартные 2D поддерживает. Были выбраны две различных клеточных линий НМРЛ, выражая EpCAM (обязательно придерживаться провода, в сочетании с антителами против EpCAM). Они имеют иной статус ALK, который полезно для тестирования различных стартовых условий. Во-первых, NCI-H1975, у гены ALK дикого типа (WT), в то время как второй, NCI-H3122, характеризуется ALK транслокации.
Была использована система брейк Помимо обнаружения гена ALK для assay рыбы. Система состоит из двух зондов, один гибридизировать в проксимальных регион в пределах ALK 2p 23 и один гибридизировать дистальнее ALK (зеленый) (оранжевый). На 2D опоры иммуно-ДНК рыбы представили четкие сигналы как антитела, так и зонд (рис. 2). В частности оба мобильных линий показали четкой локализации EpCAM мембраны. Кроме того, зонд сигналы появились яркие и острые: клетки NCI-H1975 показало перекрытия оранжевый и зеленый зонды, подтверждающий статус wildtype гена ALK (Рисунок 2a, b). И наоборот NCI-H3122 клеток показали перекрытие сигналов и одного зелеными точками, отражая удаление гена ALK (рис. 2 c, d). При выполнении анализа иммуно-ДНК рыбы на 3D поддержки функционализированных проволока, антител и зонд сигналы были обычно менее определенными, чем на 2D поддержку. Окрашивание EpCAM был виден. ALK зонд сигналы были менее определены, но по-прежнему отражает состояние ожидаемого ALK (рис. 3). Результаты показали, что иммунофлюоресценции окрашивания не вмешиваться ДНК рыбы сигналов. Зонды гибридизированных конкретно с их целями. Линии клетки NCI-H3122 показал аберрантных статус гена ALK (рис. 3b), в отличие от NCI-H1975, с геном ALK дикого типа (рис. 3a).
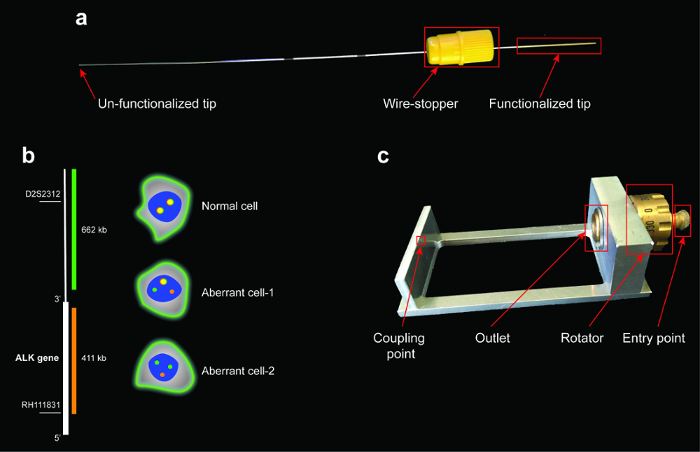
Рисунок 1 : Функционализированных проволока, схема расположения ALK апарт брейк зондов, схема предполагаемой структуры ALK перегруппировки и специальных держатель. () красный выделить три основные части провода: функционализированных кончика, проволока пробка и ООН функционализированных наконечник. Кончик функционализированных является самой деликатной частью провода и не должны быть затронуты во время обращения во избежание мобильный отряд или повреждения. (b) зеленый и красный зонды соответственно привязку к последовательности вверх и вниз по течению от локусам гена ALK (слева). Справа отображаются exemplificative узоры ALK договоренностей. Красный и зеленый Сопредседатель локализация сигналов на нормальные клетки; раздельный зеленый и красный сигналы указывают ALK гена хромосома перерыв (транслокации гена ALK) и один зеленый оранжевый colocalization сигнала (аберрантных клеток-1). Один красный сигнал и два зеленых сигналы указывают на потерю одного красного сигнала, предлагая транслокация и удаления (аберрантных клеток-2). (c) провод держателя; красные коробки выделить области, где уход необходим при обработке провода во время анализа в микроскопии. Провод можно пройти анализ 360 °, повернув ротатора. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
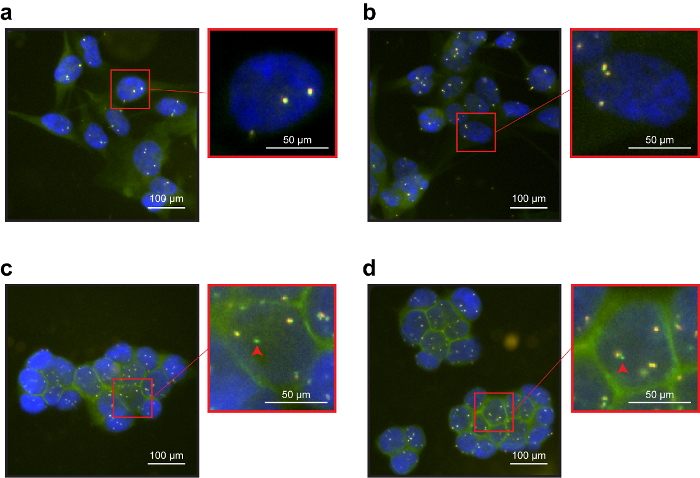
Рисунок 2 : Пробирного иммуно-ДНК рыбы на поддержка 2D (coverslip). (, b) NCI-H1975 клеток слабо положительный для EpCAM. EpCAM FITC сигналы были заметны. Оранжевый и зеленый зонды ALK брейк-отдельно перекрываются, подтверждающий статус WT ALK гена в NCIH1975 линии клеток. Клетки, отображение более двух спаренных сигналы присутствовали вследствие их анеуплоидии. (c, d) В высокой линии клеток выразить EpCAM NCIH3122 иммунофлюоресценции сигналы были яркими, которая была акцентирована в ячейке развязок. РЫБЫ анализ подтвердил удаления гена ALK, типичных для этой линии клеток. Красные стрелки показывают один зеленый зонды (без соответствующего оранжевый зонды), отражающие ALK гена удаления. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
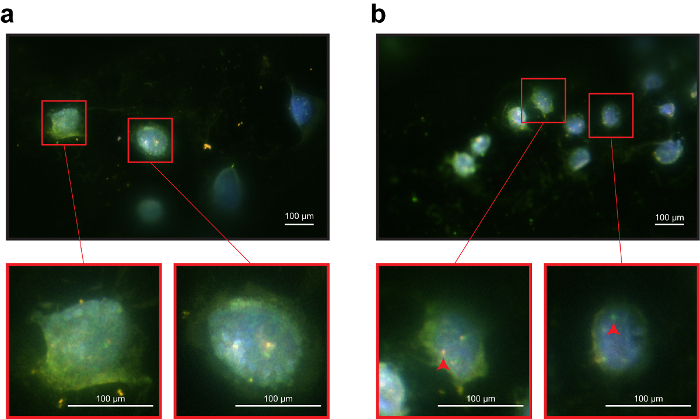
Рисунок 3: Иммуно-ДНК рыбы пробирного используя функционализированных провод как поддержка 3D. () представитель изображение NCI-H1975 клеток на проволоку. Хотя трудно приобрести полностью фокус изображения 3D форма клеток на проводе, EpCAM сигнал хорошо видна во всех клетках. (b) представитель изображение NCI-H3122 клеток на проволоку. ALK зондов показала гена удаления (красные стрелки), как ранее видели на поддержка 2D. Видимые фон сигналы были скорее всего объясняется наличие слоя полимера. Однако это не затрагивает значительно анализа идентификации или флуоресценции клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Буфер | Состав | Примечание | Запасы |
| Ячейки, полной питательной среды | Глютамин RPMI 1640 + 2 мм + 5-10% плода бычьим сывороточным (ФБС). | RPMI: 4 ° C; Глютамин, ФБС:-20 ° C | |
| Антитела Diluition буфера | BSA 1%, 0,3% Тритон X-100 в однократном ПБС | RT. печать с лабораторией фильм. | |
| 20 x SSC решение | 3 M хлорид натрия, цитрат натрия 300 мм, растворенных в ddH20 | Фильтр раствор и рН = 7.0 +/-0.1 с HCl | RT. печать с лабораторией фильм. |
| 0,4 x SSC решение | Разбавить фондовой 20 x SSC в дистиллированной H2O | Фильтр раствор и рН = 7.0 +/-0.1 с HCl | RT. |
Таблица 1: Рецепты решений.
Обсуждение
В этом документе в первый раз, метод, объединяющий иммунофлюоресценции окрашивание и ДНК рыбы, для использования с функционализированных проволоки было предложено. Метод был вызван иммуно-ДНК рыбы. Этот метод был разработан для одновременной идентификации предполагаемого ЦОК на 3D провод на основе фенотипические параметры, такие как позитивность для EpCAM (событие 1) и для облегчения обнаружения молекулярных изменений, таких как ALK гена статус ( Мероприятие 2). Одновременной идентификации двух событий позволяет обнаружить их совместного локализации. Следовательно этот подход может быть адаптирована для выявления и описания ЦОК, полученных из крови больных раком. Потенциальные последствия брюшинного компонентов и лейкоцитов на процедуре окрашивание не вмешиваться в обычно процедура. В частности данные, приведенные в литературе указывается, что брюшинного компоненты и лейкоцитов не влияют иммунофлюоресценции окрашивания клеток, придает провода, важным шагом для определения фактической CTCs1,15.
Яркости флуоресценции иммуно-ДНК рыбы немного менее заметно, чем традиционные immunophototyping пробирного и является результатом высокой температуры, необходимой для assay рыбы. Однако все еще заметна иммунофлюоресценции пятнать. Например слабый сигнал до сих пор обнаружить в низкой EpCAM выражая клеток линии, NCIH1975. Высокой температуры, необходимой для assay рыба является основным сдерживающим фактором в выборе правой флюрохром, связаны с антитела. В этом протоколе антитела должны увязываться на термостабильным флюрохром для того, чтобы терпеть температура денатурации ДНК. Например из-за флюрохром деградации, вызванной высокой температуры в этой обстановке фикоэритрин, термочувствительных флюрохром, не рекомендуется. Флуоресцеин Изотиоцианаты является хорошим выбором и часто общей флюрохром, работающих на зонды рыбы. Это очень плохой на стандартные 2D поддерживает сигнал аутофлюоресценция иммуно-ДНК рыбы. На поддержку проволока полимерный слой может вызвать незначительные аутофлюоресценция сигнал, особенно на красный канал. В отличие от 2D фон aspecific фонового сигнала заметные на проводе, но существенно не влияет на ядрах идентификации или клетки характеристика.
Микроскоп оценку провода является гораздо более fatiguing, чем на 2D поддержки из-за пределов оптический микроскоп в чтении на поверхности 3D структуры с цилиндрической формы. Однако эти трудности могут быть преодолены Вращающийся держатель проводов и получения изображений, которые преимущественно локализуются вдоль средней линии провода. Держатель проводов позволяет вращение 360 ° провода. После уделялось ядер, изменения флюоресценции каналы не обязательно полностью сосредоточиться на целевой области. По этой причине важно сосредоточить внимание на внутренний клеточной целевой области.
Эта техника может быть адаптирована для обнаруживать и определять характеристики клеток на различных видов 3D поддерживает. Она также может быть возможно использование различных антител и зонды рыбы. При выборе использования различных антител, флюрохром термостойкость и уровень экспрессии антигена целевой на клеточной мембраны являются важными факторами для рассмотрения. Также могут быть окрашены внутри цитоплазматического антигены. При зонды с использованием различных видов рыб, важно проверить, что данные характеристики для процедуры денатурации и подготовить клеток для рыб пробирного соответственно.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Материалы
| Name | Company | Catalog Number | Comments |
| Ethanol | Carlo Erba | # 414605 | |
| Tween 20 | BIO RAD | # 1706531 | |
| PBS (Phosphate Buffered Saline) | Medicago | # 09-9400-100 | |
| Acetone | Sigma Aldrich | # 534064-500ML | |
| BSA | Sigma Aldrich | # A7906 | |
| Triton X-100 Detergent | BIO RAD | # 1610407 | |
| RUBBERCEMENT | Royal Talens | # 95306500 | |
| Vysis 20X SSC (66g) | Abbott Molecular Inc. | # 30-804850 | powder to be resuspended in distilled H2O, as recommended |
| RPMI 1640 | Gibco | # 31870-025 | |
| FBS (Fetal Bovine Serum) | Gibco | # 10270-098 | |
| L-Glutamine (200mM) | Gibco | # 25030-024 | |
| Penicillin-Streptomycin | Gibco | # 15140-122 | |
| H20 | MilliPore | ||
| XT ALK BA | MetaSystems Probes | # D-6001-100-OG | |
| DAPI, FluoroPure grade | Invitrogen | # D21490 | |
| SlowFade Diamond Antifade Mountant with DAPI | Life Technologies | # S36973 | |
| EpCAM-FITC (clone: HEA-125) | Mitenyi | # 130-080-301 | |
| Micro tubes M-Tube18 | Gilupi Nanomedizin | ||
| Detektor CANCER01 EpCAM | Gilupi Nanomedizin | Functionalized wire | |
| STAR FROST Microscope Slides | Knittel GLÄSER | VS1117# 076FKB | |
| SecureSlip Silicone Supported Coverglass | GRACE BIO-LABS | # 104112 | |
| ZEISS Fluorescent Microscope Axioskop | ZEISS | ||
| Nikon NIS-Elements BR 4.11.00 64 bit software | Nikon | BR 4.11.00 | |
| Nikon DS-QiMc 12 bit digital camera | Nikon | DS-QiMc |
Ссылки
- Saucedo-Zeni, N., et al. A novel method for the in vivo isolation of circulating tumor cells from peripheral blood of cancer patients using a functionalized and structured medical wire. Int. J. Oncol. 41 (4), 1241-1250 (2012).
- Xu, W., et al. Comparison of three different methods for the detection of circulating tumor cells in mice with lung metastasis. Oncol. Rep. , 1-8 (2017).
- Chen, S., et al. Catch and Release: rare cell analysis from a functionalised medical wire. Sci. Rep. 7 (February), 43424(2017).
- Masuda, T., Hayashi, N., Iguchi, T., Ito, S., Eguchi, H., Mimori, K. Clinical and biological significance of circulating tumor cells in cancer. Mol. Oncol. 10 (3), 408-417 (2016).
- Toss, A., Mu, Z., Fernandez, S., Cristofanilli, M. CTC enumeration and characterization: moving toward personalized medicine. Ann. Transl. Med. 2 (11), 108(2014).
- Wang, J., Huang, J., Wang, K., Xu, J., Huang, J., Zhang, T. Prognostic significance of circulating tumor cells in non-small-cell lung cancer patients: a meta-analysis. PLoS One. 8 (11), e78070(2013).
- Maemondo, M., et al. Gefitinib or Chemotherapy for Non?Small-Cell Lung Cancer with Mutated EGFR. N. Engl. J. Med. 362 (25), 2380-2388 (2010).
- Shaw, A. T., et al. Crizotinib versus Chemotherapy in Advanced ALK -Positive Lung Cancer. N. Engl. J. Med. 368 (25), 2385-2394 (2013).
- Borghaei, H., et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N. Engl. J. Med. 373 (17), 1627-1639 (2015).
- Costa, D. B., et al. Clinical Experience With Crizotinib in Patients With Advanced ALK -Rearranged Non-Small-Cell Lung Cancer and Brain Metastases. J. Clin. Oncol. 33 (17), 1881-1888 (2015).
- Fischer, J. C., et al. Diagnostic leukapheresis enables reliable detection of circulating tumor cells of nonmetastatic cancer patients. Proc. Natl. Acad. Sci. U. S. A. 110 (41), 16580-16585 (2013).
- Coumans, F. A. W., Ligthart, S. T., Uhr, J. W., Terstappen, L. W. M. M. Challenges in the enumeration and phenotyping of CTC. Clin. Cancer Res. 18 (20), 5711-5718 (2012).
- Allard, W. J., Terstappen, L. W. M. M. CCR 20th Anniversary Commentary: Paving the Way for Circulating Tumor Cells. Clin. Cancer Res. 21 (13), 2883-2885 (2015).
- Theil, G., et al. The use of a new CellCollector to isolate circulating tumor cells from the blood of patients with different stages of prostate cancer and clinical outcomes - A proof-of-concept study. PLoS One. 11 (8), 1-14 (2016).
- Gorges, T. M., et al. Enumeration and Molecular Characterization of Tumor Cells in Lung Cancer Patients Using a Novel In Vivo Device for Capturing Circulating Tumor Cells. Clin. Cancer Res. 22 (9), 2197-2206 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены