Method Article
循環腫瘍細胞を取り込むため医療用ワイヤー線を用いた腫瘍細胞の特性解析: 蛍光抗体法や DNA 魚に基づく 3 D アプローチ
要約
腫瘍細胞の特徴への新しいアプローチを提案します。我々 は DNA 蛍光-原と蛍光を組み合わせる-機能性医療用ワイヤー線の生体内でCtc を患者の血液から直接豊かの対応によってキャプチャされているセルを評価する交配。
要約
循環腫瘍細胞 (CTCs) は、転移性癌の予後に関連付けられます。同一証明、表現、および遺伝子型が腫瘍の不均一性のよりよい理解につながるし、こうして患者個別の治療のための選択を容易にします。ただし、これは Ctc の希少性のために妨げられます。患者の血液の大量のサンプリングと Ctc の存在、表現型、遺伝子の転座に関する情報の取得のための革新的なアプローチを提案します。メソッドを組み合わせた蛍光染色、DNA 蛍光-原-交配 (DNA 魚)、機能性医療用ワイヤー線に基づいています。この線は、末梢血の大音量から Ctc の生体内で分離を可能にする革新的なデバイスです。ワイヤーの 30 分投与による上映血液量は約 1.5-3 l. です。このアプローチの可能性を示すためには、上皮細胞接着分子 (EpCAM) 発現と ALK 遺伝子の染色体転座は、非小細胞肺癌 (NSCLC) 細胞株官能のワイヤーによってキャプチャで決定されたと免疫 DNA 魚アプローチと汚れます。我々 の主な課題は、三次元構造、機能性ワイヤーにアッセイを実行、免疫表現型を決定する、この魚信号を従来の蛍光顕微鏡によるサポートします。得られた結果を示す Ctc をキャッチし、彼らの表現型と染色体再配列の分析でした可能性のある新しいコンパニオン診断アプローチを表して提供する革新的な、戦略を改善するためオーダーメイドのがん治療です。
概要
Ctc は、癌細胞播種1の重要なステップを表します。患者の末梢血でのプレゼンスに関連付けられて (転移) 再発や病気の進行2,3。CTC 単離とがん患者の血液からの解析は、非侵襲的な液体生検の種類です。近年、ますます進行し腫瘍のこの種の分析を使用してさまざまな治療法に対する応答を監視提供重要な臨床情報4,5することあきらかとなった。手術が可能でない場合や腫瘍組織が利用できないとき、液体生検はさらに便利にすなわち、非 biopsiable 病変。したがって、このアプローチは特定の癌転移性非小細胞肺癌、Ctc の存在が否定的な予後の役割6示されているなど設定で有望です。非小細胞肺癌は、ターゲットを絞った治療アプローチ7,8,9成長、進行に関与すると知られている特定の分子 (分子標的) に作用するように設計の恩恵を特に腫瘍と病気の広がり。したがって、病気の進行の間に特定のターゲットの検出が必要です。CTC の調査、検出およびプライマリまたは転移の組織を必要とせず創薬ターゲットを監視する非常に興味深い診断アプローチです。たとえば、非小細胞肺癌細胞における ALK 遺伝子の転座の検出は、標的治療10クリゾチニブに対する感度に関連付けられます。ただし、現時点では、ALK 転座の検出は細針吸引または小さいバイオプシー; 上でのみ実行します。その結果、腫瘍なし組織 ALK 解析はできません。Ctc は腫瘍の潜在的な代替組織ベースの調査で、非常に有望なコンパニオン診断アプローチを表しています。
潜在的重要性にもかかわらずに、Ctc は、まだ、その希少性 (末梢血111 10 セル/mL) のために主の研究の間で大きな議論の対象です。現在液体の生検の方法血 (すなわち、1 30 mL)12,13の限られた量を使用して、しかし、これ CTCs。 したがって検出感度が次善の状態を作成、見つけることに研究を保証アプローチと発展途上のデバイスを末梢血のより大きい容積に CTC 向け液体生検を行います。
代替デバイス、機能性医療用ワイヤー線血液サンプリングの制限を克服し、Ctc のより代表的な分析を得る (材料の表を参照) を開発しました。機能性ワイヤが Ctc を癌患者1の血流から直接キャプチャ CE 承認の医療機器です。金の 0.2 μ m 厚い層で被覆長さ 2 cm 機能チップで長さ 16 cm ステンレス鋼ワイヤー (図 1 a) から成り立っています。レイヤー順番 EpCAM、CTCs14の表面で最も広く表現される抗原の一つに対して指示される抗体と共有結合 1 に 5 μ m の厚さのポリカルボン酸系ハイドロゲル層によって覆われています。ワイヤの機能性のヒントは、患者の腕の静脈に導入して、少なくとも 30 分の位置のままになります。このアプローチにより、末梢血に直接、血液 (約 300 以上の代替アプローチに使用されるボリューム)1.の約 1.5 3.0 L の画面に Ctc の生体内での分離
Pantelら。肺がん患者15の腕の静脈に直接 Ctc を分離するこのアプローチの有効性を実証しました。彼らはワイヤ蛍光 EpCAM と汎サイトケラチン、CD45 に対する白血球検出のため従来の抗体を使用して Ctc を識別するために染色を行います。蛍光顕微鏡15の下でワイヤーを調べた。著者は示したデバイスは、Ctc を分離することができたが、ALK 転座など治療関連ターゲットを調査しなかった。
提案手法は、表現型のパラメーター、例えば、EpCAM 陽性および分子バイオ マーカーの存在、例えば ALK の状態 (図 1 b) に基づいて非小細胞肺癌細胞株における推定 Ctc を識別するために目指しています。この 3 日間にわたる手順を組み合わせた蛍光 DNA 蛍光その場で染色、機能性電線-交配 (DNA 魚)、免疫、DNA-魚の名前します。Ctc は、まれなエンティティをされますが、このプロトコルの長所は DNA の再編成、肺浸潤機能面で同じ線に Ctc を特徴付けることができます。
プロトコル
1. 免疫 DNA 2次元 Coverslip の魚
- Coverslip の準備、付着細胞播種
メモ: は、無菌状態で層流フードの下のすべての次の手順を実行します。- それらを消毒し、100% エタノールに、coverslip を浸します。
メモ: 我々 は 12 mm × 12 mm シリコン サポート乗 coverslips (すべての試薬は材料の表で表示) を使用します。 - シャーレ (直径 100 mm) に、coverslips を配置します。5 分のための空気の流れを強制乾燥を使用しています。
- 15 mL 滅菌 1 × ダルベッコ リン酸ペトリ皿の洗浄は生理食塩水 (PBS) バッファー。
- 10 ml の完全培地のシャーレを洗う (表 1参照)。
- 種の付着性のセル (FACS 解析では培地、10 mL で約 1,650,000 セルがカウントされます) 優しく均一セルめっき (約 30,000 セル/cm2) を取得するシャーレに細胞懸濁液をドロップします。
: 注 〜 70% 合流、付着性の細胞は、少なくとも 48 時間 coverslips に培養する必要があります。
- それらを消毒し、100% エタノールに、coverslip を浸します。
- 固定・透過
注意: アセトンは、可燃性や揮発性物質を刺激です。だけアセトン-抵抗力があるプラスチックまたはガラス容器 (ポリ塩化ビニールまたは PVDF) を使用します。
注: 化学の発煙のフードの下でこれらの手順に従います。- 使い捨て吸引ピペットを使用して培養液を削除します。
- 1 × PBS でシャーレを洗います。
- ピンセットを使用すると、1 × PBS の 5 mL を含むガラス ビーカーにそれらを浸すことによって、coverslips を洗います。
- あぶらとり紙の上 coverslips を乾燥させます。
- 部屋の温度 (RT) で 10 分間の 100% アセトン溶液に浸漬することによって、上セルを修正します。
- ピンセット、coverslip を削除します。5 分間の強制の空気の流れを使用して乾燥 coverslip。
注: プロトコルをこの時点で一時停止できます。Coverslip は-20 ° C で保存する必要があります。
- 蛍光抗体法により 1 日目
注: この段階では、夜通しの (O/N) 孵化 (~ 16 h)。- 1 × PBS で 2 回、coverslips を洗います。
- 抗体希釈バッファーの 100 μ L をドロップ (詳細については表 1を参照)、coverslip に室温 30 分間インキュベートし、
注: 解決の容積は、全体の coverslip のカバーし、オーバーフローのリスクを回避するために coverslip の表面に基づいて調整必要があります。 - 準備、1:20 を使用して抗体ミックス (表 1) メーカーが提供するデータシートで指定されている、螢光色素と抗体の希釈バッファー抱合モノクローナル抗体一次抗体の希釈。
注: それが強く耐熱性螢光色素を持つモノクローナル抗体を使用するお勧め。非耐熱性の螢光色素を使用している場合プロトコルの DNA 魚手順中温度が螢光色素を損傷し、蛍光の排出を消します。このプロトコルでは、我々 は EpCAM FITC 抗体を選んだ (1:20 希釈)、使用温度に重大な問題が表示されませんでしたが。 - 1 × PBS で 2 回、coverslips をすすいでください。
- 上、湿気のある商工会議所とドロップの 100 μ L、上抗体ミックスで coverslips 細胞側に置きます。
注意: 解決の容積は全体 coverslip のカバーし、オーバーフローのリスクを軽減する coverslip の表面に基づいて調整する必要があります。 - O/N を孵化させなさい (~ 16 h) 4 ° C で暗闇の中で
- 蛍光抗体法により 2 日目
- 1 × PBS で 2 回、coverslips を洗浄することにより抗体の孵化をブロックします。
注: ストア、coverslips に没頭して暗闇の中で一定の湿度の高い環境で、商工会議所の 4 ° C で 1 × PBS 100 μ L 魚分析が実行されるまで。
- 1 × PBS で 2 回、coverslips を洗浄することにより抗体の孵化をブロックします。
- 2次元 DNA 魚 2 日目
注意: 楽器と湿気の多い室内の高温に特別な注意を支払わなければなりません。- ハイブリダイゼーション オーブンと乾熱オーブンを設定 (~ DNA 魚のプロトコルを開始する前に 3 h)。75 ° C でハイブリダイゼーション オーブンを設定、37 ° C で乾燥した熱オーブンを設定、0.4 × SSC ソリューションを冷却 (pH 7.0 ± 0.1 を =) (SSC レシピの表 1を参照してください) 4 ° c
注: 魚バッファーの pH 状態は重要です: pH 7.0 ± 0.1 を =。 - 冷たい 0.4 × SSC ソリューションの 3 回、coverslip を洗ってください。
- 暗闇の中で 10 分間の化学発煙のフードの下で coverslip を乾燥させます。
- 10 の渦のプローブ管の壁からのプローブ (最大速度) でダウン クイック スピンを実行します。
- スライドとシール ラバー セメントを用いた coverslip のすべてのエッジに魚プローブの 5 μ L のドロップに coverslip の携帯側を置きます。
注意: 次の 2 つの手順は、高温を伴います。保護手袋を着用します。 - 完全な DNA の変性 75 ° C で 8 分間交配のオーブンに暗く湿気のある室にスライドを置きます。
- 37 で乾熱オーブンに湿気のある部屋に移動 ° C O/n.
- ハイブリダイゼーション オーブンと乾熱オーブンを設定 (~ DNA 魚のプロトコルを開始する前に 3 h)。75 ° C でハイブリダイゼーション オーブンを設定、37 ° C で乾燥した熱オーブンを設定、0.4 × SSC ソリューションを冷却 (pH 7.0 ± 0.1 を =) (SSC レシピの表 1を参照してください) 4 ° c
- 2次元 DNA 魚 3 日目
- 72 ° C で風呂の水を設定し、(表 1) に 0.4 × SSC バッファーとスライド染色の jar ファイルを配置します。30 分後 72 ± である必要があります 0.4 × SSC バッファーの温度を確認 1 ° C
- 2 つのガラス ビーカーを準備: 2 × SSC + 0.05% トゥイーン バッファーと 1 つ (pH 7.0 ± 0.1 を =) (表 1)、蒸留水で 2 つ目。
- 湿気の多い部屋をオーブンから取り出し、慎重にゴム セメントをスライドから削除、ピンセットで、coverslip をデタッチします。
- 72 ° c. で 2 分間 0.4 × SSC を浸すことによって、coverslip を洗う
- 2 × SSC + 30 0.05% トゥイーン バッファーに浸漬洗浄、coverslip s。
- 蒸留水の coverslip をすすいでください。
- 暗闇の中で 10 分間の化学発煙のフードの下で coverslips を乾燥させます。
- 4´、6-diamidino-2-phenylindole (DAPI) 総 DNA の対比染色に 1.5 μ g/mL で液体取付中 coverslip をマウントします。スライドでメディアをマウントの 5 μ L のドロップにダウン coverslip 細胞側に配置、空気を取得し、マニキュアでシール coverslip のピンセットを押します。
注意: ミディアム ボリュームのマウントは、coverslip のサーフェイスのサイズに基づいて調整する必要があります。
- 2 D の顕微鏡観察および分析
注: 画像は、別の顕微鏡システムを取得できます。
- 12 ビット デジタル カメラと 20 ×/0.50 NA と 40 ×/0.65 NA 目的赤の適切なフィルターを使用してイメージを取得 (励起: 599 nm、発光: 588 nm)、緑 (励起: 509, 発光: 524)、青 (励起: 367 nm、発光: 452 nm) プローブします。
- 選択のソフトウェア ツールを使用して画像を分析します。
注: 蛍光染色と ALK プローブ ローカリゼーションを評価するには、ImageJ を使用しました。スライドは、最大 3 週間の暗闇の中での-20 ° C で保存できます。長期の保管、長期保存用メディアを特定のマウントを使用してをお薦めします。
2. 免疫 DNA ワイヤー魚
- セル行スパイクでワイヤー (3 D 対応)
注: 予備のセットアップを含む正確な付着性の細胞 EpCAM 積極性に基づいた行。EpCAM 陽性細胞のみが染色できるように修飾はアンチ EpCAM 抗体とワイヤー。
注: は、任意の損傷を避けるためにワイヤーの機能の一部を触れないでください。
注: すべての手順が無菌状態で層流フードの下で実施している必要があります。- 4 mL の完全培; を使用して 5 mL バイアルで T75 フラスコ (80% 合流) の内容全体を再懸濁しますスパイクで単一の約 2,000,000 の細胞はワイヤーへの細胞接着を最大限に推奨します。
- ガラス パッケージからワイヤを削除します。
- バイアルにワイヤの官能の金色の部分を浸し、バイアルに適したワイヤー ストッパーは、水密を確保します。研究室のフィルムでシールします。
注: ワイヤー ストッパーとバイアルの正しい一致を許可するには、5 mL チューブの使用の使用をお勧めします。 - チューブ回転の RT で 30 分間インキュベート (0-120 角)。
- 3 の異なるクリーン バイアルを使用して 1 × PBS 溶液中線 3 回をすすいでください。
- 固定・透過
注意: アセトンは気道を刺激することができる可燃性物質です。アセトン-抵抗力があるプラスチックまたはガラス容器 (ポリ塩化ビニールまたは PVDF) のみ使用します。
注: 化学の発煙のフードの下でこれらの手順に従います。- ワイヤーを風乾します。
- 5 mL チューブ ルート使用で 10 分のアセトン 100% 溶液でワイヤを浸漬によってセルを修正します。
注: ワイヤー ストッパーでする必要があります、定着剤は接触しません。 - 室温 5 分用のワイヤーを風乾します。
注: プロトコルはここで一時停止することができます。ワイヤーは、-20 ° C で保存されなければなりません。長期保存用のワイヤーをパッキング、官能の先端の横にワイヤー ストッパーを置き、慎重に官能の先端を傷つけないように世話ストレージ ガラス管にワイヤを挿入します。ストレージ ・ ガラスを閉じ、-20 ° C で (垂直方向または水平方向) を保管
- 蛍光抗体法により 1 日目
注: この段階では、O ・ N インキュベーション (~ 16 h)。- 5 mL のチューブを使用して 1 × PBS ソリューションで 2 回洗います。
- 5 mL チューブを用いた RT で 30 分の抗体希釈バッファーにワイヤを孵化させなさい。
- 抗体希釈バッファー、データシートで指定されている蛍光色素標識モノクローナル抗体の一次抗体の希釈抗体ミックスの 150 μ L を準備します。たとえば、EpCAM FITC 抗体は、1:20 で使用された希釈。
- P200 ヒントを使用して、培養を次のように実行する: ワイヤー ストッパーから線を抽出し、先端の大きな穴を介してワイヤをそっと挿入します。最初 unfunctionalized の先端を挿入し、金色の部分は大きな穴の向こうまで、小さい穴を通してワイヤーをゆっくりと引き出します。
- 抗体ミックスの 150 μ L をゆるやかに降下 (たとえば抗 EpCAM_FITC 抗体 1:20 希釈) 先端に。バブル形成のリスクを避けるためには、機能の一部は、完全に陥ってまで、ゆっくりワイヤーをクルクル回します。
- シールは、先端の穴をアップします。穴の周りラップ研究室フィルムができます。
- インキュベート垂直 O/N (~ 16 h) 4 ° C で暗闇の中で
- 蛍光抗体法により 2 日目
- ワイヤーを 1 × PBS で 2 回洗浄することにより抗体の孵化をブロックします。
- そのワイヤー ストッパーでワイヤーを挿入し直します。
注: 1 の店で 4 ° C 5 mL の 1x PBS バイアル魚分析が実行されるまで。
- 3 D DNA 魚 2 日目
注意: 楽器と湿気の多い室内の高温に特別な注意を支払わなければなりません。- ハイブリダイゼーション オーブンと乾熱オーブンを設定 (~ DNA 魚のプロトコルを開始する前に 3 h)。75 ° C でハイブリダイゼーション オーブンを設定、37 ° C で乾燥した熱オーブンを設定、0.4 × SSC ソリューションを冷却 (pH 7.0 ± 0.1 を =) 4 ° c
注: 魚バッファーの pH 状態は非常に重要です、7.0 ± 0.1 をする必要があります。 - 冷たい 0.4 × SSC ソリューションの 3 回ワイヤーを洗ってください。
注: は、次の手順の中に螢光色素退色を避けるために暗闇の中の配線をしてください。 - シリカフューム戸棚の下で暗闇の中で 10 分間乾燥させます。
- 渦とスピン 5 プローブ s。
- 屈伏チューブにプローブの 10 μ L をドロップします。研究室のフィルムでカバーします。
- 次のように、チューブをスピン: 50 mL チューブに乾燥吸水性、紙入れで、チューブをラップし、簡単にスピンします。
- 慎重に配置したマイクロ チューブに乾燥のワイヤー、ワイヤー ストッパーを挿入します。ゴム系をシールします。
注意: 次の 2 つの手順は、高温を伴います。
- ハイブリダイゼーション オーブンと乾熱オーブンを設定 (~ DNA 魚のプロトコルを開始する前に 3 h)。75 ° C でハイブリダイゼーション オーブンを設定、37 ° C で乾燥した熱オーブンを設定、0.4 × SSC ソリューションを冷却 (pH 7.0 ± 0.1 を =) 4 ° c
- 水お風呂に 0.4 × SSC ソリューションの瓶を染色スライドを配置し、72 ° C で設定
- まで 72 ± 0.4 × SSC の液温をチェック 1 ° C
- 2 つのガラス ビーカーを 2 × SSC + 0.05 %1 つの準備トゥイーン (pH 7.0 ± 0.1 を =) ソリューションと 2 つ目の蒸留水します。
- 乾熱オーブンから湿気のある商工会議所を取り出し、ワイヤー ストッパーからゴム セメントを丁寧にピンセットを使用して、線を取る。
注: は、官能の先端を傷つけないように注意しながらのストッパーを介してワイヤの光沢の終わりを慎重に引き出します。 - 72 ° c. で 2 分間 0.4 × SSC ソリューションにディップします。
- 2 × SSC + 0.05% トゥイーン向け 30 の線を洗って室温 s
- 室温の蒸留水でワイヤーを洗う
- 暗闇の中で 10 分間ヒューム フードの下でワイヤーを乾燥させます。
- DAPI の原液 2 ml 1 × PBS の 1.43 μ m を準備します。
- 右で暗闇の中 1 h の 2 mL バイアルに DAPI 溶液でワイヤーの官能の先端を孵化させなさい
- 1 × PBS で 2 回ワイヤーをすすいで空気乾燥します。
- ワイヤーのホルダーにワイヤを配置します。慎重に先端に結合点が一致するまで特別なホルダーのエントリ ポイントを通じて機能のヒントを挿入します。機能性のヒント (図 1 a) を傷つけないように注意します。
- 顕微鏡ステージ上には、特別なホルダーを取り付けます。20 × レンズを使用して顕微鏡の焦点を調整します。まず特別支援に焦点を粗く、DAPI チャネルで明るく表示されているセルを細かく調整します。
- だけ入れてフォーカス セル レンズの中心。
注: 画像は、別の顕微鏡システムを取得できます。この設定では、従来の蛍光顕微鏡画像の獲得のための標準的な商用ソフトウェアに恵まれているを使用します。 - 12 ビット デジタル カメラと 20 ×/0.50 NA と 40 ×/0.65 NA 目的赤の適切なフィルターを使用してイメージを取得 (励起: 599 nm、発光: 588 nm)、緑 (励起: 509, 発光: 524)、青 (励起: 367 nm、発光: 452 nm) プローブします。
注: 画像は、さまざまなツールやソフトウェアを使用して視覚化できます。我々 は, 免疫蛍光染色と ALK プローブ ローカリゼーションを評価するのに ImageJ を使用します。
注: プロトコルはここで一時停止することができます。ワイヤーは、-20 ° C で保存されなければなりません。長期保存用のワイヤーをパッキング、官能の先端の横にワイヤー ストッパーを置き、慎重に官能の先端を傷つけないように世話ストレージ ガラス管にワイヤを挿入します。ストレージ ・ ガラスを閉じ、-20 ° C で (垂直方向または水平方向) を保管
結果
それを上記の手順を使用して官能のワイヤーによって豊かに Ctc (または他の同等の細胞) の免疫 DNA 魚アッセイを行うことが可能です。このプロトコルを設定する前に 2 つの技術の互換性は決定 (免疫蛍光魚) 標準的な 2 D 支持だったEpCAM (EpCAM 抗体と結合線に付着する必須) を表現する 2 つの異なる非小細胞肺癌細胞株が選ばれました。彼らがある異なる ALK のステータスは、別の開始条件をテストすると便利です。最初、NCI-H1975 秒、NCI-H3122 は ALK 転座によって特徴付けられる間、ALK 遺伝子の野生型 (WT) があります。
魚の試金のための ALK 遺伝子分解検出システムが使用されました。システムは、2 つのプローブは、1 つ (オレンジ) 2 p 23、1 つ (緑) 交配 ALK の遠位アルク内近位領域を交配させることで構成されています。2 D のサポート、免疫 DNA 魚抗体やプローブ (図 2) の両方のための明確に定義された信号を提供しました。特に、両方の細胞の明確に定義された EpCAM 膜局在を示した線。さらに、プローブ信号登場明るくシャープ: NCI H1975 細胞を示した (図 2 ab) ALK 遺伝子の野生型のステータスを確認、オレンジ色と緑色のプローブを重複します。逆に、NCI H3122 細胞は、シグナルと重なったと ALK 遺伝子 (図 2 c、 d) の削除を反映した単一の緑のドットを示した。免疫 DNA 魚アッセイを行ったとき 3 D サポート機能性ワイヤー、抗体やプローブの信号は 2次元のサポートにより一般により少なく定義されました。EpCAM 染色、見えなかった。ALK プローブ信号が少なく定義しますが、まだ期待される ALK 状態 (図 3) を反映します。結果は、免疫蛍光染色でした DNA 魚信号と干渉しないことを示した。プローブは、ターゲットと具体的に交配。NCI H3122 細胞株は野生型 ALK 遺伝子 (図 3 a) と NCI-H1975 と対照をなして異常 ALK 遺伝子状態 (図 3 b) を示した。
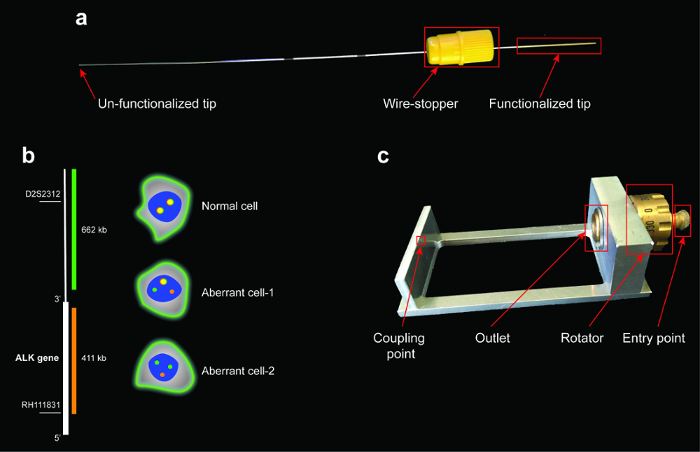
図 1: ワイヤー、ALK 分解プローブの回路配置、ALK リアレンジメントと特別なホルダーの予想されるパターンのスキームを修飾します。(、) 赤のボックスがワイヤーの 3 つの主要な部分を強調表示: チップ、ワイヤー ストッパーと非機能性のヒント。機能性のヒントは、ワイヤの最も繊細な部分で、細胞の剥離や損傷を避けるために処理中に触れてはなりません。(b) 緑と赤プローブをそれぞれシーケンスにバインド (左側) ALK 遺伝子の遺伝子座の下流・上流。右側に、ALK 手配の exemplificative パターンが表示されます。赤と緑の共局在信号正常細胞;分離の緑と赤の信号は、ALK 遺伝子染色体改 (ALK 遺伝子の転座) と 1 つの緑オレンジ共存信号 (異常細胞-1) を示します。1 赤の信号と 2 つの緑信号は、染色体転座と削除 (異常細胞 2) 1 つの赤い信号の損失を表します。(c) ワイヤー ホルダー;赤い箱は、顕微鏡分析中にワイヤーを処理するとき、介護が必要な領域を強調表示します。ワイヤーは、回転子を回すことによって 360 ° の分析を受けることができます。この図の拡大版を表示するのにはここをクリックしてください。
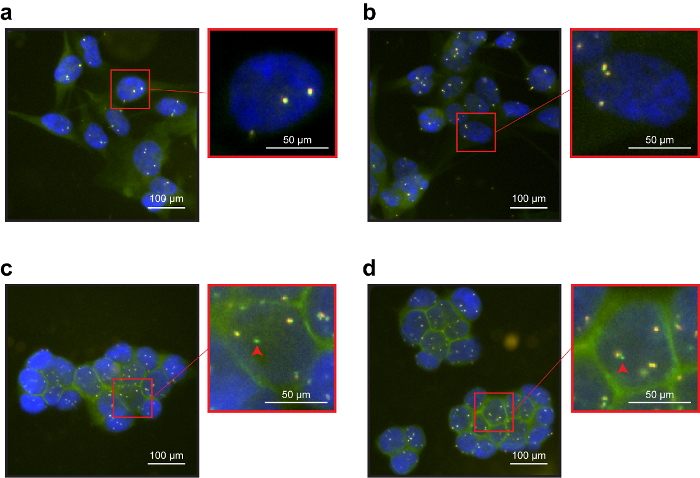
図 2: 2次元のサポート (coverslip) の免疫 DNA 魚アッセイ。(、 b)NCI H1975 EpCAM の弱陽性を細胞します。EpCAM FITC 信号はかなりあった。ALK の休憩-離れてのオレンジ色と緑色のプローブがオーバー ラップ、NCIH1975 細胞における ALK 遺伝子の WT 状態を確認します。3 つ以上のペアの信号を表示する細胞の異数性のため存在していた。(c、 d)高 EpCAM 表現 NCIH3122 セルラインで蛍光信号が明るい、細胞接合を強調されました。この細胞ラインの典型的な ALK 遺伝子の魚分析確認削除。赤い矢印は、ALK 遺伝子欠失を反映した単一の緑プローブ (対応するオレンジ プローブ)、なしを示します。この図の拡大版を表示するのにはここをクリックしてください。
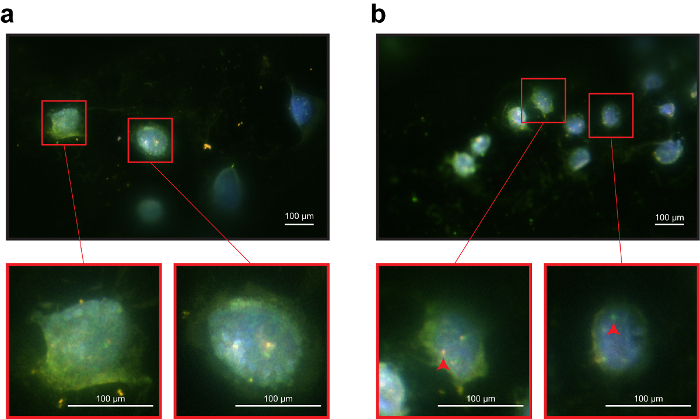
図 3:免疫 DNA 魚アッセイの 3 D サポートとして官能のワイヤーを使用しています。ワイヤーの NCI H1975 セルの (、) 代表のイメージ。ワイヤ上のセルの 3 D 形状を作る完全に焦点画像を取得することは困難、すべてのセルの EpCAM 信号はよく見える。ワイヤーの NCI H3122 セルの代表者 (b) イメージ。ALK プローブは、遺伝子欠失 (赤矢印)、前述は、2次元のサポートを示した。背景信号は、ポリマー層の存在のために最も可能性が高かった。ただし、それは与えません細胞識別または蛍光分析。この図の拡大版を表示するのにはここをクリックしてください。
| バッファー | 組成 | メモ | 株式 |
| 完全な培 | RPMI 1640 + 2 mM グルタミン + 5-10% 胎児血清 (FBS)。 | RPMI: 4 ° Cグルタミン、FBS:-20 ° C | |
| 抗体 Diluition バッファー | 1 %bsa、1 × PBS で 0.3% トリトン X-100 | 実験映画としたシール。 | |
| 20 x SSC のソリューション | 3 M の塩化ナトリウム、ddH20 に溶解した 300 mM クエン | フィルター ソリューションおよび pH = HCl で 0.1 ± 7.0 | 実験映画としたシール。 |
| x SSC 液 0.4 | 在庫 20 の希釈で x SSC 蒸留 H2O | フィルター ソリューションおよび pH = HCl で 0.1 ± 7.0 | RT。 |
表 1: ソリューションのレシピ。
ディスカッション
この論文で初めて、免疫蛍光染色、DNA 魚を組み合わせた手法官能のワイヤを使用を提案しました。免疫 DNA 魚メソッドが呼び出されました。この手法は EpCAM (イベント 1) に陽性などの表現型パラメーターに基づいて 3 D ワイヤの推定 CTCs の同時識別を許可して ALK 遺伝子の状態 (など、分子の変異の検出を容易にするために開発されました。イベント 2)。2 つのイベントの同時同定の共局在の検出が可能します。したがって、このアプローチは、識別し、がん患者の血液から取得した Ctc を特徴付けるカスタマイズできます。汚損プロシージャの haemo 成分と白血球の潜在的な影響は通常、プロシージャを妨げない。特に、haemo 成分と白血球影響を及ぼさないことワイヤー、実際 CTCs1,15を識別するために重要なステップに接続されている細胞の免疫蛍光染色文献で報告されるデータが示されます。
免疫 DNA 魚の蛍光明るさは伝統的な immunophototyping の試金、魚のアッセイに必要な高温の結果よりわずかにより少なくマーク付きです。しかし、免疫蛍光染色、まだかなり。たとえば、微弱な信号は依然として低い EpCAM 発現細胞株、NCIH1975 で検出です。魚のアッセイに必要な高温は、右の螢光抗体にリンクの選択の主な制限要因です。このプロトコルでは、抗体は DNA 変性温度を容認するために耐熱性の螢光色素にリンクする必要があります。たとえば、フィコエ リスリン、感温性螢光は高温による螢光色素の劣化のためこの設定で推奨されません。かに良い選択は、よくありがちな螢光色素魚プローブで採用されています。免疫 DNA 魚蛍光信号は、標準の 2D サポートに非常に貧しいです。ワイヤー サポートにポリマー層は、特に赤のチャネル上のわずかな蛍光信号を引き起こす可能性があります。2 D 背景とは異なり特定背景信号は、ワイヤ上識別できるが、核の識別またはセルの特性は大きく影響しません。
ワイヤーの顕微鏡評価は円筒状の 3 D 構造の表面を読むことに光学顕微鏡の限界のための 2次元のサポートによりもはるかに疲労です。しかし、この難しさは、ワイヤーのホルダーを回転し、ワイヤの正中線に沿って主にローカライズされた画像を取得で克服できます。ワイヤーのホルダーは、ワイヤの 360 ° 回転を許可します。核に焦点を当てて、一度蛍光チャンネルを変更する必ずしも保持されませんターゲット領域に焦点を当てる。このため、セル内のターゲット領域にフォーカスを維持するために不可欠です。
この技術は、3 D サポートの異なる種類の細胞の特徴を検出してカスタマイズできます。それは異なった抗体を使用することもできます、魚プローブします。異なった抗体を使用する場合、耐熱性螢光色素と細胞膜上の標的抗原の発現レベルは考慮するべき重要な要因。内抗原も染色することができます。プローブの使用別の魚、魚の細胞を準備する変性プロシージャのデータシート仕様がそれに応じて試金をチェックすることが重要です。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
資料
| Name | Company | Catalog Number | Comments |
| Ethanol | Carlo Erba | # 414605 | |
| Tween 20 | BIO RAD | # 1706531 | |
| PBS (Phosphate Buffered Saline) | Medicago | # 09-9400-100 | |
| Acetone | Sigma Aldrich | # 534064-500ML | |
| BSA | Sigma Aldrich | # A7906 | |
| Triton X-100 Detergent | BIO RAD | # 1610407 | |
| RUBBERCEMENT | Royal Talens | # 95306500 | |
| Vysis 20X SSC (66g) | Abbott Molecular Inc. | # 30-804850 | powder to be resuspended in distilled H2O, as recommended |
| RPMI 1640 | Gibco | # 31870-025 | |
| FBS (Fetal Bovine Serum) | Gibco | # 10270-098 | |
| L-Glutamine (200mM) | Gibco | # 25030-024 | |
| Penicillin-Streptomycin | Gibco | # 15140-122 | |
| H20 | MilliPore | ||
| XT ALK BA | MetaSystems Probes | # D-6001-100-OG | |
| DAPI, FluoroPure grade | Invitrogen | # D21490 | |
| SlowFade Diamond Antifade Mountant with DAPI | Life Technologies | # S36973 | |
| EpCAM-FITC (clone: HEA-125) | Mitenyi | # 130-080-301 | |
| Micro tubes M-Tube18 | Gilupi Nanomedizin | ||
| Detektor CANCER01 EpCAM | Gilupi Nanomedizin | Functionalized wire | |
| STAR FROST Microscope Slides | Knittel GLÄSER | VS1117# 076FKB | |
| SecureSlip Silicone Supported Coverglass | GRACE BIO-LABS | # 104112 | |
| ZEISS Fluorescent Microscope Axioskop | ZEISS | ||
| Nikon NIS-Elements BR 4.11.00 64 bit software | Nikon | BR 4.11.00 | |
| Nikon DS-QiMc 12 bit digital camera | Nikon | DS-QiMc |
参考文献
- Saucedo-Zeni, N., et al. A novel method for the in vivo isolation of circulating tumor cells from peripheral blood of cancer patients using a functionalized and structured medical wire. Int. J. Oncol. 41 (4), 1241-1250 (2012).
- Xu, W., et al. Comparison of three different methods for the detection of circulating tumor cells in mice with lung metastasis. Oncol. Rep. , 1-8 (2017).
- Chen, S., et al. Catch and Release: rare cell analysis from a functionalised medical wire. Sci. Rep. 7 (February), 43424 (2017).
- Masuda, T., Hayashi, N., Iguchi, T., Ito, S., Eguchi, H., Mimori, K. Clinical and biological significance of circulating tumor cells in cancer. Mol. Oncol. 10 (3), 408-417 (2016).
- Toss, A., Mu, Z., Fernandez, S., Cristofanilli, M. CTC enumeration and characterization: moving toward personalized medicine. Ann. Transl. Med. 2 (11), 108 (2014).
- Wang, J., Huang, J., Wang, K., Xu, J., Huang, J., Zhang, T. Prognostic significance of circulating tumor cells in non-small-cell lung cancer patients: a meta-analysis. PLoS One. 8 (11), e78070 (2013).
- Maemondo, M., et al. Gefitinib or Chemotherapy for Non?Small-Cell Lung Cancer with Mutated EGFR. N. Engl. J. Med. 362 (25), 2380-2388 (2010).
- Shaw, A. T., et al. Crizotinib versus Chemotherapy in Advanced ALK -Positive Lung Cancer. N. Engl. J. Med. 368 (25), 2385-2394 (2013).
- Borghaei, H., et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N. Engl. J. Med. 373 (17), 1627-1639 (2015).
- Costa, D. B., et al. Clinical Experience With Crizotinib in Patients With Advanced ALK -Rearranged Non-Small-Cell Lung Cancer and Brain Metastases. J. Clin. Oncol. 33 (17), 1881-1888 (2015).
- Fischer, J. C., et al. Diagnostic leukapheresis enables reliable detection of circulating tumor cells of nonmetastatic cancer patients. Proc. Natl. Acad. Sci. U. S. A. 110 (41), 16580-16585 (2013).
- Coumans, F. A. W., Ligthart, S. T., Uhr, J. W., Terstappen, L. W. M. M. Challenges in the enumeration and phenotyping of CTC. Clin. Cancer Res. 18 (20), 5711-5718 (2012).
- Allard, W. J., Terstappen, L. W. M. M. CCR 20th Anniversary Commentary: Paving the Way for Circulating Tumor Cells. Clin. Cancer Res. 21 (13), 2883-2885 (2015).
- Theil, G., et al. The use of a new CellCollector to isolate circulating tumor cells from the blood of patients with different stages of prostate cancer and clinical outcomes - A proof-of-concept study. PLoS One. 11 (8), 1-14 (2016).
- Gorges, T. M., et al. Enumeration and Molecular Characterization of Tumor Cells in Lung Cancer Patients Using a Novel In Vivo Device for Capturing Circulating Tumor Cells. Clin. Cancer Res. 22 (9), 2197-2206 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved