Method Article
Мониторинг влияние осмотического стресса на секреторные пузырьки и экзоцитоз
В этой статье
Резюме
Осмотическая стресс влияет на экзоцитоз и количество нейромедиатора, выпущен в ходе этого процесса. Мы демонстрируем, как сочетания электрохимических методов вместе с просвечивающей электронной микроскопии может использоваться для изучения влияния внеклеточного осмотического давления на экзоцитоз активности, везикул квантовый размер и количество нейромедиатора выпустила во время экзоцитоз.
Аннотация
Запись Amperometry клеток, подвергается осмотическим шоком показать, что секреторных клеток реагировать на этот физический стресс, снижая экзоцитоз активность и количество нейромедиатора, освобожден из пузырьков в одном экзоцитоз события. Было высказано предположение о том, что сокращение нейротрансмиттеров изгнаны при из-за изменений в биофизических свойств мембраны клетки сокращаться в ответ осмотического стресса и с предположения, что не затрагиваются секреторные пузырьки в цитоплазме клеток Внеклеточные осмотического стресса. Amperometry запись экзоцитоз контролирует, что освобождается от клеток момент везикул предохранители с плазматической мембраны, но не предоставить информацию о содержании везикул перед сплавливание vesicle срабатывает. Таким образом, комбинируя amperometry записи с другими дополнительных аналитических методов, которые способны характеризующие секреторные пузырьки перед экзоцитоз клеток запускается предлагает широкий обзор для изучения как секреторные пузырьки и процесс экзоцитоз, подвержены осмотическим шоком. Здесь мы опишем, как дополняя amperometry записи с внутриклеточной электрохимических цитометрии и передачи изображений электронной микроскопии (ТЕА) может использоваться для характеристики изменения в размер и нейромедиатора содержание секреторные пузырьки на хромаффинных клеток по отношению к деятельности экзоцитоз до и после воздействия осмотического стресса. Связывая количественная информация, полученная от экспериментов с использованием всех трех методов анализа, были ранее сделаны выводы секреторные пузырьки реагировать внеклеточного осмотического стресса, сокращается в размере и уменьшая квантовый размер пузырьков в поддерживать постоянное везикул нейромедиатора концентрации. Следовательно это дает некоторые разъяснения относительно почему везикулы, в ответ на осмотического стресса, снижения суммы нейротрансмиттеров, выпущенный во время выпуска экзоцитоз. Амперометрическое записи здесь указывают, что это обратимый процесс и что везикул после осмотическим шоком пополняются с нейротрансмиттерами когда помещены клетки восстанавливаются в изотонический среду.
Введение
Хромаффинных клетках надпочечников являются нейроэндокринные клетки, что освобождение нейромедиатора молекул в поток крови. Это происходит через сотовый процесс, который включает док- и слияние заполнены нейромедиатора везикулы, привело содержание выпуска от везикулы внеклеточного пространства в процессе, называемом экзоцитоз. Нейромедиаторов (адреналина и норадреналина) в хромаффинных клетках активно транспортируется мембранных белков в большие плотные ядра везикулы (LDCVs) и хранятся в высоких концентрациях (~0.5-1 М)1,2. Накоплением нейромедиаторов внутри LDCVs достигается путем сродством катехоламинов молекул к матрице белка intravesicular плотные ядра состоит из chromogranin белки (~ 169 мг/мл)3,4,5 ,6и intravesicular коктейль раствор, содержащий ключевые компоненты для хранения и погрузки катехоламинов в пузырек например7АТФ (125-300 мм), Ca2 + (50-100 мкм в раствор и ~ 40 мм привязаны к Матрица белка)8, мг2 + (5 мм)9, аскорбиновая кислота (10-30 мм)10и рН11,~5.512. LDCVs сохранить iso осмотического состояние ячейки цитоплазмы (310 мОсм/кг)13, даже несмотря на то, что теоретические концентрации вещества внутри везикул сумма до более чем 750 мм. В состав intravesicular компонентов необходима не только для загрузки и хранения катехоламинов, но и для агрегирования растворенных веществ к матрице плотной основной белок. Это значительно снижает осмолярности везикулы значительно уменьшается и может повлиять на сумму катехоламинов, которая высвобождается при экзоцитоз5,6.
Исследования о влиянии внеклеточного осмотического давления на процесс экзоцитоз Амперометрическое записи сообщили, что высокое осмотическое давление внеклеточного подавляет активность экзоцитоз и уменьшает количество нейротрансмиттеров, выделяется из одного везикул отсеков4,14,,1516,17,18,19. Объяснения этих наблюдений спекулировали на возможное повышение макромолекулярных скученности в клетки цитоплазме ингибирующих везикул фьюжн события и изменения в мембраны биофизических свойств, влияющих на количество выпущен в ходе экзоцитоз нейротрансмиттеров. Эти мысли предположить, что высокий внеклеточного осмотического стресса не влияет на квантильного размер пузырьков, который определяет количество молекул нейромедиатора, хранящиеся в отсеке везикул на предварительной стадии вызвали экзоцитоз14, 15 , 17 , 19 , 20 , 21. в Амперометрическое измерения выпуска экзоцитоз в одиночных клетках, микроэлектродные диск углеродное волокно помещается в тесном контакте с поверхности клетки, создавая экспериментальная Настройка подражая синапса конфигурации, где Амперометрическое электрод служит постсинаптических детектор (рис. 1)22,23. Стимулируя клетки экзоцитоз, одно может вызвать заполнены нейромедиатора пузырьки сливаются с мембраной клетки плазмы и освободить часть или полную везикул содержание во внеклеточное пространство. Эти молекулы нейромедиатора, выпущенный на поверхности электрода может быть обнаружен электрохимически если нейротрансмиттеров Электроактивные (например, катехоламинов), применяя redox потенциал + 700 мВ против Ag/AgCl электродов ссылки . Следовательно серия тока Марк обнаружения отдельных экзоцитоз событий. Из текущего против времени след в записи Амперометрическое площадь под каждой одной Амперометрическое Спайк представляет заряда, обнаруженных за экзоцитоз событие и может быть преобразован в моль нейротрансмиттеров, выпущенный, используя уравнение Фарадея. Таким образом Амперометрическое записи количественную информацию о сумма нейротрансмиттеров, изгнаны из одного экзоцитоз событий и сообщать о частоте экзоцитоз события, но не представляют количественную информацию о секреторные пузырьки содержимое перед сплавливание vesicle и нейромедиатора релиз был начат.
Таким образом чтобы получить более глубокое понимание как секреторные пузырьки в ячейке цитоплазме реагировать внеклеточного осмотического стресса прежде чем ячейка запускается пройти экзоцитоз, другие дополнительные аналитические методы могут использоваться для обогатить эту информацию. Например расследовать если осмотического стресса изменяет объем везикул, просвечивающей электронной микроскопии (ТЕА) imaging анализ может использоваться для измерения размера везикул клеток после химической фиксации. Для изучения если осмотического стресс влияет на квантильного размер пузырьков, недавно разработанных Амперометрическое технику, называемую внутриклеточных электрохимических цитометрии, может применяться для количественного определения содержания везикул нейромедиатора в секреторные пузырьки в их родного государства, когда по-прежнему проживающих в цитоплазме26живых клеток. В внутриклеточного электрохимических цитометрии технику, электрод цилиндрический углеродного волокна nanotip аккуратно вставляется в цитоплазме живых клеток и, применив + 700 мВ потенциал этого электрода (против Ag/AgCl ссылка электрода), может быть определена количественно содержание катехоламинов в пузырьки путем обнаружения текущей всплеска редокс от одного везикулы столкновения, поглощения и впоследствии ковшах сверлении на поверхности электрода и высвободив тем самым их содержимое против поверхности электрода26. Таким образом в Амперометрическое текущего против время трассировки, каждое событие электромеханическая один пузырек может привести к текущей переходных и, путем интеграции области каждой текущей всплеска, Квантовый размер пузырьков можно рассчитать с помощью Faraday´s права.
Таким образом связывая количественная информация, полученная от везикул размер измерения с использованием изображений ТЕА вместе с анализом квантовый размер пузырьков, зафиксированный внутриклеточных электрохимических цитометрии, везикул нейромедиатора концентрации могут также быть определены. Это позволяет пузырьков характеристика когда клетки подвергаются воздействию различных осмотического условий и обеспечивает более четкое представление о как пузырьки могут реагировать на внеклеточные осмотического стресса на этапе до экзоцитоз. Результаты объединения этих методов показали, что при наличии внеклеточного высокое осмотическое давление, везикулы сокращаться и отрегулировать их квантильного размер и сравнивая количественную информацию о относительные изменения от этих измерений показывает, что во время усадки, везикулы отрегулировать их содержание и размер для поддержания постоянной нейромедиатора концентрации24. Таким образом это понимание является ценным в подключении к замечания, сделанные на нейромедиатора релиз в клетках подвергаются осмотического стресса. В этих протоколах мы описывают использование этих трех взаимодополняющих методологий, которые позволяют квалификация как секреторные пузырьки в их родной среде реагировать осмоляльность внеклеточной и последствия этого ответа на экзоцитоз процесс. В дополнение к наши предыдущие замечания относительно эффекта высокое осмотическое давление на экзоцитоз24мы представляем дополнительные эксперименты, которые описывают ячейки восстановления после осмотическим шоком и эффект нескольких бария стимуляцию в хромаффинных клетки.
протокол
1. клеточной культуры говядину хромаффинных клеток, изолированные от ферментативного пищеварения из надпочечников
- Чтобы изолировать хромаффинных клеток, собранных из говядину надпочечников, стерилизуйте клетки с 70% этанола раствор. Trim away жира и соединительной ткани с помощью скальпеля. Чтобы удалить кровь, промойте надпочечниковой Вены, используя Локка раствор (NaCl 154 мм, KCl 5.6 мм, NaHCO3 3.6 мм, 5,6 мм при рН 7,4 гидроксиэтилкрахмала piperazineethanesulfonic кислоты (HEPES)), который был термостатируемое 37 ° c.
- Дайджест ткани, надуть каждой железы путем инъекций приблизительно 2,5 мл теплой стерильной фильтрации коллагеназы P 0,2% раствора через надпочечниковой Вены с помощью шприца и инкубировать ткани для 20 минут при 37 ° C. Изучите желез для обеспечения завершения процесса пищеварения мозга. Ткани должны чувствовать себя мягкой и не напряженным.
- Собирайте переваривается продолговатого мозга, отсекая от желез в продольном направлении. Фарш в ткани мозга с помощью скальпеля. Фильтр ткани подвески над сталь сито и разбавляют Локка раствор для примерно 50 мл тома для снижения активности коллагеназы P.
- Пелле клетки на 300 x g в центрифуге для 10 мин при комнатной температуре и собирать в 50 мл стерильные пробирки. Вновь приостановить полученные гранулы в 20 мл Локка раствор и фильтровать решение над нейлоновая сетка стерильные 100 мкм в пробирки.
- Перемешать суспензию хромаффинных клеток с стерильных Percoll (1:1) и центрифуги мобильные решения на 18600 g x 20 мин при комнатной температуре. Собирать верхний слой градиента плотности и фильтровать решение над 100 мкм нейлоновая сетка в пробирки.
- Чтобы исключить Percoll, разбавления суспензии клеток с Локка раствор и центрифуги на 300 x g 10 мин при комнатной температуре до повторной приостановки гранулы в Локка раствор. Сметные клеток плотность подвеска изолированных клеток составляет примерно 4 миллионов клеток/мл.
- Для записи Амперометрическое экзоцитоз и внутриклеточных цитометрии измерений, плита хромаффинных клеток в коллаген IV покрытием 60 мм пластиковая блюда на плотность составляет около 17,5 × 103 клеток/см2 и инкубации клеток при 37 ° C в 5% CO2 окружающей среды. Выполните электрохимических экспериментов в течение 1-3 дней культуры клеток.
- Для ТЕА imaging эксперименты, плита хромаффинных клеток в 75 см2 клетки культуры колбы на плотности 7-8 миллионов клеток за флакон и инкубировать при 37 ° C в среде 5% CO2 на 1 день.
2. одну ячейку экзоцитоз Amperometry экспериментов24
- Для изготовления микроэлектродов углеродного волокна для этих экспериментов, взять стакан капилляра с наружным диаметром подходит для держателя электрода на головы стадии, которая будет использоваться в этих экспериментах. Используйте боросиликатного стекла капилляр с наружным диаметром 1,2 мм и внутренним диаметром 0.69 мм.
- Подключите один из капилляров концы к трубе стремление воды. Место 5 мкм диаметр волокна углерода на чем-то, такие, как кусок белой бумаги, для улучшения визуализации.
- Определение единого углеродного волокна и удерживайте волокна на одном конце с палец держать углеродного волокна на месте во время позиционирования открытый конец капилляра в близости к свободному концу углеродного волокна. Аккуратно аспирационная углеродного волокна в стеклянный капилляр, так что углеродного волокна торчит через обоих концах капилляра. Отойти стремление сил.
- Уложите микропипеткой съемник капилляра с углеродного волокна и тянуть стекла капилляров в две отдельные стекла наконечники. Чтобы отключить углеродного волокна, который подключен между двумя стекла советы, используйте ножницы сократить углеродное волокно и получить два микроэлектродов углеродного волокна.
- Под микроскопом место углеродного волокна на вершине толще микроскопа, который позволяет ручной резки углеродного волокна на краю где волокно простирается от стекла капиллярное покрытие с помощью скальпеля.
- После резки углеродного волокна, оставляя кончик стекла с покрытием углеродного волокна, вставьте несколько мм электрода в раствор эпоксидной за 10 минут, чтобы подтянуть эпоксидных и уплотнения любой возможной открытое пространство между углеродного волокна и стекла окружающие. Поднимите электродов медленно из эпоксидной решения для предотвращения громоздкие клей капли от формирования на кончике электрода.
- Место электроды на держателе (например, деревянную палку плоской) с двух сторон жаропрочные Скотч к которому можно прикрепить электроды. Выпекать эпоксидной лечение электродов на ночь в духовке при температуре 100 ° C. Электрод, советы легко разбить, если они имели контакт с поверхностью, поэтому обеспечить электроды всегда безопасно хранятся с использованием держателя, где электроды крепятся на месте и советы не рискуют быть коснутым.
- Для получения поверхности электрода плоский диск, поместить электрод в держатель microgrinder и скос каждый электрод углеродного волокна на угол 45°. После снятия фасок, Марк капилляров на его верхней с помощью постоянного маркера суметь как найти поверхности электрода диска под углом в 45°, при размещении электрода возле клетки для измерения экзоцитоз позже.
Примечание: Этот шаг имеет важное значение, как и эти эксперименты, овальный диск электрода должен быть сделан плоской верхней части клетки с ее поверхности параллельно поверхности Петри. Кроме того фаска электроды выполняются в тот же день эксперименты для обеспечения поверхности электрода свежим и чистым. - Перед использованием место каждого углеродного волокна микроэлектродные в тестовое решение (например, 0,1 мм допамина в буфере (рН 7,4) PBS) для мониторинга устойчивого состояния текущего с помощью циклической вольтамперометрии. Для сканирования циклической вольтамперометрии, применять треугольник потенциальных сигнала от – 0,2 V до + 0.8 V против Ag/AgCl электрод сравнения на 100 МВ/s для обеспечения хорошей реакции кинетики данные получаются, которые согласуются с теоретически рассчитанных значений для диска диаметром 5 мкм углеродного волокна микроэлектродные25.
- Для amperometry записи экзоцитоз, место Петри с искусственного хромаффинных клеток на инвертированным микроскопом. Важно оградить Микроскоп создана с клетку Фарадея для устранения электронного шума во время записи, из-за очень малых токов измеряется amperometry. Используйте Отопление Этап микроскопа для поддержания температуры 37 ° c в ходе экспериментов ячейки.
- Использовать инструмент зажим малошумящие патч применять постоянный потенциал + 700 мВ на рабочем электроде против Ag/AgCl электрод сравнения, которая также размещена в Петри от рабочих электродом. Для записи экзоцитоз хромаффинных клеток оцифровка сигнала на 10 кГц и применять внутренние НЧ фильтр Бесселя на 2 кГц для фильтрации записываемого сигнала.
- Для выполнения записи в отдельные клетки Амперометрическое, смонтируйте диск микроэлектродные свежезаваренным скошенная и испытаны углеродного волокна в Электрододержатель головы этапа, который используется с потенцио.
- Аккуратно поместить электрод с плоской овальной диск форму электрода поверхности вниз к апикальной поверхности клетки и место электрода при контакте с клеточной мембраны, используя микроманипулятор.
- Отрегулировать расстояние от электрода к ячейке путем мониторинга клетки деформации, вызванные электрода после размещения поверх клеточной мембраны и затем тщательно убрать электрода на расстоянии, где клетки обретает форму близко к своей первоначальной форме ячейки . Идеально подходит для записи кинетические и количественные является создание тонкопленочных жидкость 100 нанометров отделить поверхности электрода и клеток, которые имеют аналогичные условия для постсинаптических обнаружения химических выпуска в синапсе.
- Чтобы стимулировать клетки экзоцитоз, позиция микропипеткой стекла с кончика размером 2-3 мкм в диаметре, заполнены раствором 5 мм BaCl2 на расстоянии по меньшей мере 20 мкм от ячейки, чтобы предотвратить любое решение, утечка от кончика пипетки влиять эксперимент и применить 5 импульса впрыска s 5 мм BaCl2 раствора на поверхности клеток для стимулирования ячейки экзоцитоз.
- Для изучения обратимой влияние осмотического давления на процесс экзоцитоз, подготовить изотонический буферный раствор (150 мм NaCl, 5 мм KCl, 1,2 мм MgCl2, глюкозы 5 мм, 10 мм HEPES, рН 7,4) с 310 мОсм/кг iso осмотическое давление и гипертонический буфера, сделанные корректировки Концентрация NaCl изотонический буферный раствор с осмотического давления соответствует 730 мОсм/кг.
- Клетки в изотонический буфера и стимулировать клетки к экзоцитоз, применяя импульса впрыска бария во время записи Амперометрическое текущие переходные процессы в ходе начатых экзоцитоз деятельности примерно 3 мин.
- Чтобы сравнить экзоцитоз ответы в изотонический условиях гипертонический условий, инкубации клеток для 10 минут в растворе гипертонический буфера и затем применить импульса впрыска бария стимулирует экзоцитоз и выполнять 3 мин Амперометрическое записи.
- Обратимые реакции клеток, инкубации клеток снова за 10 мин в изотонический буферный раствор и стимулировать клетки путем применения 5s бария инъекции пульс и выполнить 3 мин записи экзоцитоз ответ от ячейки.
- Как управления экспериментов для определения влияния на активность экзоцитоз, несколько бария стимуляцию, выполняют запись Амперометрическое экзоцитоз освобождения от трех последовательных BaCl2 стимуляцию на той же ячейки помещаются в изотонический буфера и используя тот же протокол время для последовательных ячейки инкубации экспериментов с различными осмолярности.
3. внутриклеточных электрохимических цитометрии24,26
- Для изготовления электродов для измерений квантовый размер пузырьков, использовать те же материалы и начать подготовку 5 мкм в диаметр электрода углеродного волокна согласно описания в разделах 2.1 и 2.2 микроэлектродные изготовления для Амперометрическое экзоцитоз измерения.
- Под микроскопом используйте скальпель сократить углеродное волокно расширения из кончик стекла, так что углеродного волокна длиной от 30 до 100 мкм осталось торчали из кончик стекла.
- Для подготовки пламени травлению наконечник электрода углеродного волокна, используйте Бутан пламени. Для достижения равномерно травлению, цилиндрической формы электрода, электрод цилиндрической формы углеродного волокна, удерживая его поворота и место углеродного волокна простирается от стекла в синий край Бутан пламени до тех пор, пока кончик углерод превращается красный Цвет. Это часто занимает менее 2 s. Если успешно, это приводит к травлению электродов размером кончика 50-100 Нм в диаметре (SEM изображение такого кончика показан на рис. 5B). После травления пламени место электрода под микроскопом, чтобы оценить электрода.
- Вставка цилиндрического nanotip микроэлектродные в растворе эпоксидной 3 мин, после чего 15 s погружение электрода в раствор ацетона. Это позволяет эпоксидной смолы для герметизации потенциальных разрыв пространства между углеродного волокна и изоляционного стекла капиллярного стены, в то время как ацетон удаляет эпоксидной от поверхности запечатленными углеродного волокна электрода. Чтобы вылечить Эпоксидная, выпекать электродов в духовке на ночь при 100 ° C.
- Перед использованием проверить ток устойчивого состояния каждого углеродного волокна микроэлектродные, как описано в разделе 2.7 с помощью циклической вольтамперометрии. Для экспериментов, использовать только электродов, отображающие текущее вокруг плато 1,5-2,5 НС27.
- Для межклеточных amperometry измерений месте микроскопом клетки, как описано в 2.8 и использовать те же экспериментальные параметры потенцио как описано в 2.9.
- Для выполнения измерения внутриклеточного растворенного в воде и для предотвращения значительного физического повреждения клетки, вставить цилиндрические микроэлектродные nanotip в клетку, добавив нежный механической силы, просто достаточно, чтобы подтолкнуть электрод через клетки плазмы мембраны и в цитоплазме клеток с помощью микроманипулятор.
- После вставки и с клеточной мембраны, герметичный вокруг цилиндрических электродов Начните Амперометрическое запись на месте в живой клетке. При окислении потенциал, применяется к электроду, везикулы адсорбироваться на поверхности электрода и ковшах разрыва. Следовательно нет необходимости для любого вида стимул начать этот процесс.
- Чтобы определить осмотическо Влияние на квантильного размер пузырьков, соберите измерения внутриклеточного цитометрии от группы клеток, которые были инкубировали в изотонический и гипертонический буфера с использованием экспериментальные условия, как описано в разделе 2.13.
4. анализ данных по Amperometry записи
- Для анализа данных записанных amperometry от внутриклеточного везикул квантовый размер анализ и экзоцитоз, используйте программное обеспечение программа, которая позволяет анализ текущих транзиентов в записи текущая или время трассировки так что кинетические параметры пик и интегрированный полного заряда для отдельных текущей вершины может быть определена. Для анализа данных мы использовали программное обеспечение, разработанное в лаборатории компании Sulzer, который был написан для программы анализа данных Игорь28.
- При анализе Амперометрическое шипы, выберите порог для вершины три раза корень среднего квадратный (RMS) стандартное отклонение шума для каждой записи.
- Собирать Амперометрическое шипы из каждой ячейки записи вручную, чтобы предотвратить ложные шипы, которые не следуют гауссова форма, двойной шипы, которые могут быть результатом слияния экзоцитоз событий и принимать только Гаусса формы шипы с порога три раза выше, чем шум RMS.
- Собрать данные для полного заряда в одном Амперометрическое пик и использовать Faradays закон (N = QnF) для расчет молярный объем катехоламинов нейромедиатора, обнаруженных за экзоцитоз или внутриклеточных один пузырек разрыв событие, где N — это моли медиаторы, пройдя через redox реакция на поверхности электрода, Q = общего заряда, обнаруженных под каждой Спайк, n = количество электронов, переведены в окислительно-восстановительные реакции (n = 2 для катехоламинов) и Faraday´s постоянно F = 96485 C/моль.
- Статистический анализ данных, собранных первый расчет средний заряд, обнаруженные на событие для каждой ячейки. Затем на расхождение между ячейками, рассчитать средний заряд между ячейками и студента t теста между ячейками, предполагая неравными дисперсиями. Это исследование используется в программе MATLAB для статистического анализа.
5. ТЕА визуализации для анализа размер пузырьков
- Чтобы выполнить изображений ТЕА клеток в различных условиях осмотического, сначала Инкубируйте клетки в изотонический или гипертонический буфер 10 минут при 37 ° C в среде 5% CO2 перед химической фиксации клеток.
- Выполнение фиксации ячейки с помощью метода фиксирующие Карновского29. С помощью этого метода, инкубации клеток с помощью решения, содержащие азид натрия 0,01%, 1% формальдегида и 1,25% глютаральдегид, в котором образец можно хранить при 4 ° C.
- После фиксации Вымойте клетки с 0,15 М натрия cacodylate буфера.
- Пятно ячейки образцы сообщение фиксации и в рамках подготовки изображений ТЕА, инкубации клеток с раствором 1% осмия тетраоксид втечение 2 ч при температуре 4 ° C, следуют 1 ч инкубации в 0,5% раствор ацетата уранила при комнатной температуре в темноте.
- В окончательной фиксации шаг обезвоживает клетки прежде промыв клетки в 100% этанола и затем промойте клетки с помощью ацетона.
- Внедрить образцы клетки в epoxyresin и затем выполнить центрифугирования в 4000 x g для 30-40 мин и позволяют образец клеток для полимеризации при 40 ° C на 15 h, после 48 ч инкубации при температуре 60 ° C.
- В рамках подготовки изображений, в разделе образец клеток встроенные в агар 100 смолы ломтиками толщиной 60 Нм, с помощью ultramicrotome.
- Тема клетки к 4% уранила acetate/25% этанола раствор для 4 мин, после чего 20 s промывки водой. Вымыть клетки с Рейнольдс свинца цитрат за 3 мин, затем 20 s промывки водой.
- Выполнение передачи электронной микроскопии изображений образцов клеток. В наших экспериментах, мы использовали просвечивающий электронный микроскоп, который эксплуатируется на 120 кв.
- Из каждого записанного образа кюветное отделение, иллюстрирующие ультраструктуру клетки, отображающий населением везикулы в цитоплазме клеток сначала калибровки размер пикселя изображения, касающимся пикселов записанных линейки в каждом изображении ТЕА. Использование изображений программное обеспечение для определения размеров пузырьков на каждое изображение клетки подвергаются изотонический или гипертонический условий. В наших экспериментах мы использовали программное обеспечение ImageJ для анализа изображений. Стоит отметить, что для анализа изображений сотовой Ультраструктура от изображений ТЕА клеток, корректировку размеров этих измерений, на основании толщина слоев клеток необходимо рассматривать и ранее были описаны Almers´s лаборатории30.
Результаты
Мы здесь описать протокол для как сочетание изображений ТЕА вместе с двух электрохимических методологий, углеродного волокна amperometry и внутриклеточных электрохимических цитометрии, может предоставить информацию, которая приобретает более широкий взгляд, намекая на эффект Внеклеточные осмотическое давление на секреторные пузырьки и экзоцитоз процесса. Сравнивая записи представителя Амперометрическое экзоцитоз выпуска на одного хромаффинных клеток с использованием экспериментальной установки (показано на рис. 1), было показано значительное снижение exocytotic активности, когда клетки были подвержены осмотического подчеркнуть по сравнению с клетки в изотонический условиях (рисунок 2A)24. Из этих записей и с помощью Faraday´s права, полного заряда определяется каждого индивидуального Амперометрическое текущей всплеска была использована для вычисления количества молекул изгнаны из одного везикул экзоцитоз событий на клетки подвергаются в различных осмотического условий. Для сравнения как показано в рисунке 2B по меньшей площади средняя Амперометрическое текущего Спайк обнаружено клетками в гипертонический раствор, меньше нейромедиатора молекулы были освобождены от каждого везикул клетками зондирования осмотического стресса24 .
Чтобы определить обратимость этого снижение числа молекул нейромедиатора, выпущенный, мы провели Амперометрическое записи экзоцитоз на клетки подвергаются гипертонический окружающей среды и, впоследствии, на клетки после помещается обратно в изотонический окружающей среды. В этих экспериментах, хромаффинных клетках были стимулировали три раза подряд с BaCl2 решения: сначала в изотонический буфера, а затем второй стимуляции после того, как клетки инкубировали 10 мин в гипертонический раствор и, наконец, третий стимуляция после инкубации клеток 10 мин изотонические условий. Результаты отображаются в Рисунок 3A настоящее время что количество нейротрансмиттеров выпущен был сокращен на ~ 50%, когда клетки подвергаются гипертонический состоянии, по сравнению с первым Ba2 + стимуляции в изотонический состоянии. Впоследствии, когда клетки были возвращены к среде изотонические и подвергается треть Ba2 + стимуляция, сумма нейромедиатора, выпущенный за экзоцитоз событие было отменено вернуться к первоначальной суммы, записанная на первой стимуляции, который подтвердили предыдущие замечания14. Управления эксперименты с трех последовательных Ba2 + стимуляцию клеток в изотонический состояния (см. рисунок 3B) показывают, что несколько последовательных Ba2 + стимуляцию в изотонический условиях не изменяют сумму нейромедиатора выпущен в ходе экзоцитоз. Это предполагает, что квантовый размер пузырьков быстро и обратимо корректируется с внеклеточного осмолярности.
Однако, при анализе Амперометрическое следы от этих экспериментов с точки зрения активности экзоцитоз, стало очевидным, как показано в рисунке 4A, что экзоцитоз деятельность значительно препятствует когда клетки подвергаются гипертонический стресс. Во время осмотического стресса экзоцитоз события были снижены до 12% активности клеток в изотонический состоянии. Впоследствии после осмотическим шоком и клетки были помещены обратно в isosmotic среду, клетки восстановили 41% их оригинальный экзоцитоз активности. Интересно, что управления эксперименты в изотонический условиях, показал, как показано в Рисунок 4B, что после проведения трех последовательных BaCl2 стимуляцию, частота событий экзоцитоз был сокращен до 53% после второй стимуляции и далее вплоть до 26%, третьего стимуляции по сравнению с первой стимуляции. Таким образом ясно, что подряд Ba2 + стимуляцию, по-видимому, не влияет на количество нейротрансмиттеров, освобожден от каждого везикул, когда экзоцитоз срабатывает, но значительно влияет на эффективность процесса выпуска везикул.
Расследовать как секреторные пузырьки в их родной среде, подвержены внеклеточного осмотического стресса объему пузырьков или квантильного размер, везикул размер анализ с использованием изображений ТЕА была объединена с внутриклеточной электрохимических цитометрии в клетки воздействию изотонические и гипертонический условий. В экспериментах внутриклеточных электрохимических цитометрии электрод nanotip углеродное волокно был вставлен в цитоплазме живой хромаффинных клеток при помещении в изотонический и гипертонический раствор (как показано на рис. 5). В результате Амперометрическое текущего spike контролируется из каждого везикул в цитоплазме клеток столкновения, поглощения и ковшах сверлении и выпускать содержимое пузырьков на поверхности электрода Амперометрическое после разрыва26. Интегрированный полного заряда, для каждого пика в текущем против время след обнаружен был использован для вычисления квантовый размер средняя везикул в каждой ячейке, запись Faraday´s законом. Эти измерения внутриклеточного электрохимических цитометрии, показано на рисунке 6 и Рисунок 7B, продемонстрировали, что квантовый размер пузырьков в клетки подвергаются осмотического стресса были значительно сокращены по сравнению с на клетки в изотонический условиях. Сравнение величины изменения в квантовый размер пузырьков как измеряется внутриклеточных электрохимических цитометрии, дробные снижение в количестве нейромедиатора, выпускаемых экзоцитоз на клетки, испытывают внеклеточного осмотического стресса , показали относительное сокращение на 60% в квантильного размер и сумму нейромедиатора выпустила по сравнению с на клетки в изотонический условий (рис. 7)24. Связать перестройки в квантовый размер пузырьков в везикул нейромедиатора концентрации клеток, которые испытывают осмотическое давление потенциальные изменения, был проведен анализ изображений ТЕА для определения размера везикул клеток подвергается изотонические и гипертонический условий. Кроме того темные пятная матрица белка плотные ядра внутри LDCVs, визуализируется в изображений ТЕА как темные области в мембране везикулы был использован для измерения объема ядро плотной матрицы в этих пузырьков. Как показано на рисунке 8, размер пузырьков был сокращен до 60% на клетки подвергаются внеклеточного осмотического стресса, по сравнению с на клетки в изотонический условиях. От вычислительного объема измерений диаметра LDCV и плотным ядром объем раствора окружающих гало, появляется как ясное решение внутри LDCVs в изображениях ТЕА также была рассчитана. Обобщенные результаты анализа изображений ТЕА, как показано на рисунке 8, показали, что во время внеклеточного осмотическим шоком, это главным образом объем гало решения в LDCVs, уменьшили24.

Рисунок 1 : Одну ячейку экзоцитоз amperometry. Схема экспериментальной установки для измерения растворенного в воде экзоцитоз на сингл хромаффинных клеток24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
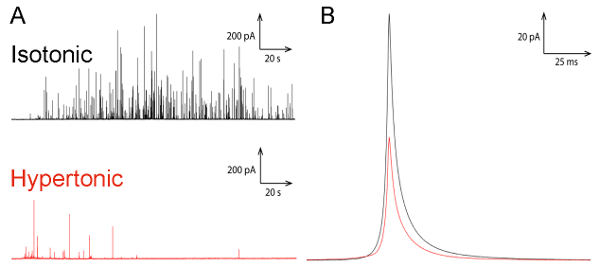
Рисунок 2: Амперометрическое следы от экзоцитоз измерений. A (A) представитель Амперометрическое запись экзоцитоз в хромаффинных клеток в изотонический (черный цвет) и внеклеточных средах гипертонический (красный цвет). (B) расширение среднего Амперометрическое Спайк экзоцитоз измерения хромаффинных клеток в изотонический (черный) и гипертонический внеклеточных средах (красный)24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
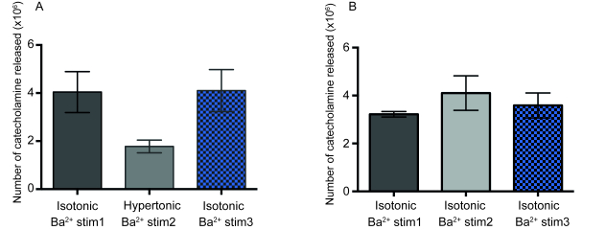
Рисунок 3 : Обратимости количество катехоламинов, выпущенный в экзоцитоз после осмотическим шоком. (A) количество молекул, выпущенный во время экзоцитоз из хромаффинных клеток (n = 4), три последовательных Ba2 + стимуляцию, с первой стимуляции в изотонический, второй гипертонический и третий в изотонический буфера. Статистические результаты непарных t-теста отображаются. P -для сравнения первой Ba2 + стимуляции (Ba2 + СТИМ 1) в изотонический буфер с второй Ba2 + стимуляция (Ba2 + stim 2) в гипертонический буфера значение p= 0.1088 и p-значение Сравнение второй Ba2 + стимуляции в гипертонический раствор с третьего Ba2 + стимуляция (Ba2 + stim 3) в изотонический буфера это p = 0,059. (B) контроля эксперимент свидетельствует количество молекул нейромедиатора, выпущенный на трех последовательных Ba2 + стимуляцию хромаффинных клеток (n = 4) в изотонический буфера. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Влияние осмотического давления на экзоцитоз активность. (A) эффект внеклеточного осмолярности экзоцитоз деятельности представлен как частота событий экзоцитоз когда хромаффинных клеток (n = 4) стимулируются раствором бария в изотонический, затем гипертонический и наконец в изотонический условиях. Значения представлены в виде среднее количество шипов из каждой ячейки и в среднем от всех клеток пробы (Среднеквадратичная ошибка среднего значения (SEM)). Статистическая значимость изменений представлено с помощью t тест для непарных данных ( p -изотонический Ba2 + стимуляция 1 и гипертонический Ba2 + стимуляция 2 значение p= 0.0126 и p-значение для сравнения гипертонический Ba2 + стимуляция 2 и изотонический Ba2 + стимуляция 3 является p= 0,037). (B) контроля эксперимент, представляя частота экзоцитоз событий после трех последовательных бария стимуляцию в хромаффинных клеток (n = 4) в изотонический условиях. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
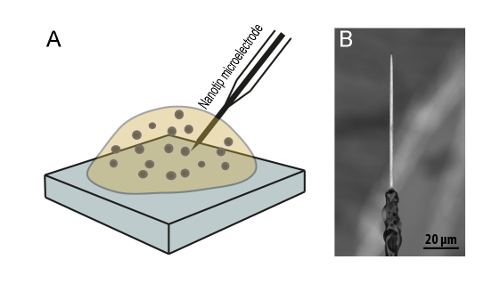
Рисунок 5 : Внутриклеточный везикул электрохимических цитометрии для мониторинга изменений в квантовый размер пузырьков. (A) схема экспериментальной настройка используется для внутриклеточного электрохимических цитометрии. (B) сканирования электронная микроскопия image типичный nanotip конические углеродного волокна электрода24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6 : Внутриклеточные электрохимических цитометрии измерения показаны (A) представитель следы внутриклеточных Амперометрическое цитометрии записей в хромаффинных клеток в изотонический (черный) и гипертонический (красный) внеклеточных средах. (B) расширение среднего Амперометрическое всплеска от измерения внутриклеточного цитометрии в хромаффинных клеток в изотонический (черный) и гипертонический внеклеточных средах (красный)24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7 : Количественная оценка количества катехоламинов, выпущен в экзоцитоз и определение размера квантовый везикул. (A) среднее количество молекул, выпущенный во время записи экзоцитоз в хромаффинных клеток в изотонический (n = 22) и гипертонический (n = 20) средах. Значения представлены как среднее количество молекул выпустила за экзоцитоз события из каждой ячейки и в среднем от ячейки выборки (± SEM). Статистическая значимость изменений представлены с использованием t тест для непарных данных (p -значение = 0.0003) (B) среднее количество молекул в везикул, обнаруживаемых внутриклеточных электрохимических цитометрии в хромаффинных клеток в изотонический (n = 19) и гипертонический (n = 16) условия. Значения представлены как среднее количество молекул на Спайк как обнаружено из каждой ячейки и составляет в среднем от всех клеток пробы (± SEM). Статистическая значимость изменений представлено с помощью t тест для непарных данных (p - значение = 0.0108)24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
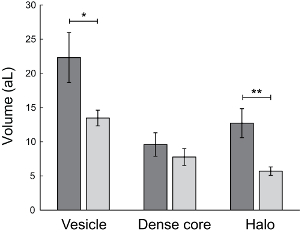
Рисунок 8 : Влияние осмотического давления на размер больших плотных сердечника везикул. Расчетный объем LDCVs, густой основной белок и решение гало вокруг густой основной белок матрица была рассчитана в attolitres (aL) от анализа изображений изображений ТЕА хромаффинных клеток в изотонический (n = 12) и гипертонический (n = 9) буферов. Результаты были собраны в среднем 311 везикулы в клетку и средние от единичных клеток (± SEM). P-от непарных t тесты, сравнения изотонические и гипертонический буферы сообщаются значения. P-значение 0.0385 (*) для тома везикул, 0.3967 для плотной основные тома, 0,0047 (*) для halo объем24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Мы здесь представляем, протокол и преимущества объединения трех дополнительных аналитических методов для анализа секреторные пузырьки и экзоцитоз процесс, чтобы лучше понять, как физической силы как осмотическое давление может повлиять на секреторные пузырьки и процесс экзоцитоз в секреторных клеток. Эти методы включают углеродного волокна микроэлектродные amperometry, который является установленным метод для записи активности экзоцитоз, внутриклеточный электрохимических цитометрии, который используется для определения квантильного размер пузырьков в их родной среде, и передача электронной микроскопии анализ изображений для мониторинга объема секреторные пузырьки. В этой работе, посредством сбора количественных данных от amperometry записи событий экзоцитоз один пузырек в хромаффинных клетках подвергаются изотонические и гипертонический внеклеточных среды, мы подтвердили, что осмотическим шоком значительно снижает сумма нейротрансмиттеров выпущено во время экзоцитоз, и что эти клетки обратимо можно восстановить и освободить первоначального количества, если помещен обратно в среде изотонические (рис. 3).
Амперометрическое записи представили информацию о частота событий экзоцитоз против времени и поэтому также может использоваться для отслеживания изменений в экзоцитоз активности клеток в различных средах, осмотической. Эти данные можно интерпретировать и использовать различать ли изменения в деятельности происходят мгновенно или как функцию от времени. Как мы показали в предыдущей работе, хотя осмотического стресса препятствует exocytotic деятельности, вряд ли препятствовать сплавливания легко публикуемой бассейн везикулы24. Данные о деятельности экзоцитоз может также использоваться для анализа общей exocytotic активности в период времени записи. Здесь мы представляем Накопленное число экзоцитоз событий из записи 3-х минутах экзоцитоз в хромаффинных клеток воздействию двух разных осмотического условий. Эти данные показывают ингибитирование экзоцитоз активности клеток, испытывают осмотического стресса и добиться частичного восстановления этой деятельности после того, как клетки вернуться к внеклеточным изотонический среды. Однако очень важно, управления эксперименты показали, что несколько Ba2 + стимуляцию в сроки, используемые в этих экспериментах вызваны значительное снижение активности экзоцитоз каждый раз, когда ячейка была простимулирована к секреции. Третий подряд Ba2 + стимуляция только треть экзоцитоз деятельности была сохранена, и четко бария и возможно также сроки стимуляцию в этих экспериментах, затрагивает везикул цикла. Это может быть актуально для объяснения, почему exocytotic активность была восстановлена в клетках, помещены в изотонический раствор после осмотическим шоком и почему эти клетки отображается аналогичное сокращение относительной активности по сравнению с клетками в изотонический условиях после трех последовательные Ba2 + стимуляцию. Следовательно amperometry запись экзоцитоз предоставляет информацию о секреторные пузырьки с момента, когда везикулы запускаются слиться с плазматической мембраны, выпуская нейротрансмиттеров через поры фьюжн. Таким образом, количественные данные о один пузырек нейромедиатора релиз и может собираться информация о деятельности экзоцитоз.
Количество нейромедиатора выпустила может регулироваться режимом экзоцитоз, которое срабатывает, когда выпущен полный везикул содержание или часть содержания. Изучая исключительно экзоцитоз релиз с использованием углеродного волокна amperometry, что только обнаруживает, что исключили из везикул, трудно отличить, если изменение в обнаруженных количество нейромедиатора выпустила связано с изменения в режиме срабатывает экзоцитоз, изменения в сотовой биофизических свойств, влияющих на содержание выпуска везикул, или изменения в квантовый размер пузырьков. Таким образом, дополняя записи Амперометрическое экзоцитоз с измерения с использованием внутриклеточных электрохимических цитометрии, в situ измерения квантовый размер пузырьков в живые клетки можно охарактеризовать и поэтому используется для сравнения фракция везикул содержание выпуска от пузырьков во время экзоцитоз26.
В этой работе расследовать если квантовый размер пузырьков пострадал от осмотического стресса, мы применили эту технику для количественного определения и оценки квантовый размер пузырьков в клетки, изотонические и гипертонический условиях. Как вставки nanotip электрода в цитоплазме живой клетки считается довольно инвазивных, эти эксперименты были выполнена только один раз на ячейку и не повторялись в той же клетке. Таким образом эти эксперименты преференциально выполняются как отдельных измерений от групп случайно выбранных ячеек, изотонические и гипертонический внеклеточных среды. Чтобы сравнить изменения в квантовый размер пузырьков как измеряется внутриклеточных электрохимических цитометрии для изменения в сумму нейромедиатора, выпущенный в экзоцитоз, следует учитывать соответствие экспериментальных условиях внутриклеточной записи и также выполните запись amperometry экзоцитоз на отдельных случайных клетках. Если исследования выполняются на одной и той же клетке, важно в этих экспериментальных протоколов также рассмотреть влияние последовательных BaCl2 стимуляции и чтобы убедиться, что экспериментальные условия соответствуют те, которые используются для внутриклеточного цитометрии измерения. Стоит также отметить, что это трудно контролировать точное размещение и глубина электрода при вставке в ячейку. Таким образом каждая ячейка обеспечивает случайной выборки для анализа квантовый размер пузырьков. Кроме того зондирование квантовый размер пузырьков с помощью этого метода не различать различия, например, везикул зрелости и поэтому также может добавить вариант для измерений. Внутриклеточные эксперименты показали, что квантовый размер пузырьков был сокращен на клетки подвергаются внеклеточного осмотического давления. Относительное сокращение квантовый размер определяется этот метод был по сравнению с замечания относительного изменения в нейромедиатора релиз во время экзоцитоз. Это исследование показало, что относительное снижение квантовый размер был в том же порядке, как падение в нейромедиатора релиз на клетки, зондирования осмотического стресса.
Чтобы проверить, если осмотического стресса было изменить нейротрансмиттера концентрации везикул, объем везикул оценивалась с использованием ТЕА визуализации анализа для химически фиксированной хромаффинных клеток, которые подверглись воздействию условий изотонические и гипертонический. ТЕА изображений анализ показал, что везикулы уменьшаться, когда клетки подвергаются осмотическим шоком и что относительное уменьшение размера корректируется вместе с квантовый размер пузырьков для поддержания постоянной нейромедиатора концентрации24. Анализ изображений ТЕА, которая обеспечивает разрешение изображения нанометра можно выделить два фаз, матрица белка плотные ядра и окружающих решения гало внутри LDCVs и таким образом делает возможным определить объем плотной основной белок матрицы и Рассчитайте объем раствора гало. Из этого анализа сокращение объема везикул определялась главным образом связано с уменьшением объема от решения гало вокруг плотные основной белок матрицы24.
В целом это исследование представляет протокол, продемонстрировав как три аналитических методов в сочетании и позволяет характеристика секреторные пузырьки перед нейромедиатора релиз и что освобождаются от этих пузырьков когда клетки активируются для экзоцитоз, чтобы лучше понять, как секреторные пузырьки и клеточной функции как экзоцитоз зависит от внеклеточных стресса. Этот протокол может использоваться также помочь ответить вопросы о как нейромедиатора релиз на экзоцитоз и квантовый размер пузырьков влияют другие изменения в физической среде или потенциальных лекарственных препаратов, которые могут повлиять на секреторных клеток.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить Совет Швеции исследования (349-2007-8680) для финансирования и Котт Dalsjöfors AB (Dalsjöfors, Швеция) за пожертвование в размере говядину надпочечников.
Материалы
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma Aldrich | S7653 | |
| KCl | Sigma Aldrich | P9333 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| HEPES | Sigma Aldrich | H3375 | |
| MgCl2 | Sigma Aldrich | M-2670 | |
| Glucose | Sigma Aldrich | G8270 | |
| Collagenase P | Roche, Sweden | 11 213 857 001 | |
| 100-µM Nylon mesh | Fisher Sientific | 08-771-19 | |
| Percoll | Sigma Aldrich | P1677 | |
| Collagen IV coated 60 mm plastic dish | VWR | 354416 | |
| Centrifuge | Avanti J-20XP | ||
| Borosilicate glass capillary | Sutter instrument Co., Novato, CA | ||
| Micropipette puller | Narishing Inc., Japan | PE-21 | |
| Epoxy solutions (A and B) | Epoxy technology, Billerica, MA | ||
| Beveller | Narishing Inc. | EG-400 | |
| Inverted Microscope | Olympus | IX81 | |
| Patch clamp Instrument | Molecular Devices, Sunnyvale, CA | Axopatch 200B | |
| Micromanipulator | Burleigh Instrument Inc., USA | PCS-5000 | |
| Butane Flame | Multiflame AB, Hässelholm, Sweden | ||
| Transmission electron microscopy | Omega | Leo 912 AB |
Ссылки
- Albillos, A., et al. The exocytotic event in chromaffin cells revealed by patch amperometry. Nature. 389 (6650), 509-512 (1997).
- Dunevall, J., et al. Characterizing the Catecholamine Content of Single Mammalian Vesicles by Collision-Adsorption Events at an Electrode. J Am Chem Soc. 137 (13), 4344-4346 (2015).
- Crivellato, E., Nico, B., Ribatti, D. The chromaffin vesicle: advances in understanding the composition of a versatile, multifunctional secretory organelle. Anat Rec. 291 (12), 1587-1602 (2008).
- Morris, S., Schultens, H., Schober, R. An osmometer model for changes in the buoyant density of chromaffin granules. Biophys J. 20 (1), 33 (1977).
- Winkler, H., Smith, A. D. The chromaffin granule and the storage of catecholamines. Handbook of Physiology. 6 (7), 321-399 (1975).
- Phillips, J., Allison, Y., Morris, S. The distribution of calcium, magnesium, copper and iron in the bovine adrenal medulla. Neurosci. 2 (1), 147-152 (1977).
- Estévez-Herrera, J., et al. ATP: The crucial component of secretory vesicles. Proc Natl Acad Sci. 113 (28), 4098-4106 (2016).
- Machado, J. D., Camacho, M., Alvarez, J., Borges, R. On the role of intravesicular calcium in the motion and exocytosis of secretory organelles. Commun integr biol. 2 (2), 71-73 (2009).
- Toll, L., Howard, B. D. Role of Mg2+ ion-activated ATPase and a pH gradient in the storage of catecholamines in synaptic vesicles. Biochemistry. 17 (13), 2517-2523 (1978).
- Terland, O., Flatmark, T. Ascorbate as a natural constituent of chromaffin granules from the bovine adrenal medulla. FEBS letters. 59 (1), 52-56 (1975).
- Camacho, M., Machado, J. D., Montesinos, M. S., Criado, M., Borges, R. Intragranular pH rapidly modulates exocytosis in adrenal chromaffin cells. J Neurochem. 96 (2), 324-334 (2006).
- Jankowski, J. A., Schroeder, T. J., Ciolkowski, E. L., Wightman, R. M. Temporal characteristics of quantal secretion of catecholamines from adrenal medullary cells. J Biol Chem. 268 (20), 14694-14700 (1993).
- Daniels, A., Williams, R., Wright, P. The character of the stored molecules in chromaffin granules of the adrenal medulla: a nuclear magnetic resonance study. Neurosci. 3 (6), 573-585 (1978).
- Borges, R., Travis, E. R., Hochstetler, S. E., Wightman, R. M. Effects of external osmotic pressure on vesicular secretion from bovine adrenal medullary cells. J Biol Chem. 272 (13), 8325-8331 (1997).
- Troyer, K. P., Mundorf, M. L., Fries, H. E., Wightman, R. Separating vesicle fusion and exocytosis in hypertonic conditions. Ann NY Acad Sci. 971 (1), 251-253 (2002).
- Brodwick, M. S., Curran, M., Edwards, C. Effects of osmotic stress on mast cell vesicles of the beige mouse. J Membrane Biol. 126 (2), 159-169 (1992).
- Amatore, C., Arbault, S., Bonifas, I., Lemaitre, F., Verchier, Y. Vesicular exocytosis under hypotonic conditions shows two distinct populations of dense core vesicles in bovine chromaffin cells. Chem Phys Chem. 8 (4), 578-585 (2007).
- Hampton, R. Y., Holz, R. W. Effects of changes in osmolality on the stability and function of cultured chromaffin cells and the possible role of osmotic forces in exocytosis. J Cell Biol. 96 (4), 1082-1088 (1983).
- Troyer, K. P., Wightman, R. M. Temporal separation of vesicle release from vesicle fusion during exocytosis. J Biol Chem. 277 (32), 29101-29107 (2002).
- Pihel, K., Travis, E. R., Borges, R., Wightman, R. M. Exocytotic release from individual granules exhibits similar properties at mast and chromaffin cells. Biophys J. 71 (3), 1633 (1996).
- Jankowski, J. A., Finnegan, J. M., Wightman, R. M. Extracellular ionic composition alters kinetics of vesicular release of catecholamines and quantal size during exocytosis at adrenal medullary cells. J Neurochem. 63 (5), 1739-1747 (1994).
- Leszczyszyn, D. J., et al. Nicotinic receptor-mediated catecholamine secretion from individual chromaffin cells. Chemical evidence for exocytosis. J Biol Chem. 265 (25), 14736-14737 (1990).
- Wightman, R., et al. Temporally resolved catecholamine spikes correspond to single vesicle release from individual chromaffin cells. P Natl Acad Sci. 88 (23), 10754-10758 (1991).
- Fathali, H., Dunevall, J., Majdi, S., Cans, A. -. S. Extracellular osmotic stress reduces the vesicle size while keeping a constant neurotransmitter concentration. ACS Chemical Neuroscience. , (2017).
- Bath, B. D., et al. Subsecond adsorption and desorption of dopamine at carbon-fiber microelectrodes. Anal Chem. 72 (24), 5994-6002 (2000).
- Li, X., Majdi, S., Dunevall, J., Fathali, H., Ewing, A. G. Quantitative Measurement of Transmitters in Individual Vesicles in the Cytoplasm of Single Cells with Nanotip Electrodes. Angew Chem Int Edit. 54 (41), 11978-11982 (2015).
- Zoski, C. G., Mirkin, M. V. Steady-state limiting currents at finite conical microelectrodes. Anal Chem. 74 (9), 1986-1992 (2002).
- Mosharov, E. V., Sulzer, D. Analysis of exocytotic events recorded by amperometry. Nat Methods. 2 (9), 651-658 (2005).
- Morris, J. K. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-139 (1965).
- Parsons, T. D., Coorssen, J., Horstmann, H., Almers, W. Docked granules, the exocytic burst, and the need for ATP hydrolysis in endocrine cells. Neuron. 15 (5), 1085-1096 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены