Method Article
Модель мыши для трансплантации поджелудочной железы с помощью модифицированных манжеты
* Эти авторы внесли равный вклад
В этой статье
Резюме
Среди твердых трансплантации органов брюшной полости поджелудочной графтов склонны к развитию тяжелой ишемии реперфузии связанные травмы трансплантата ущерб, в конечном итоге приводит к ранней потере трансплантата. Этот протокол описывает модель трансплантации мышиных поджелудочной железы, с использованием техники-шов манжет, идеально подходит для анализа этих ранних, пагубные убытков.
Аннотация
Мышь модели имеют ряд преимуществ в трансплантации исследований, включая управляемость, разнообразные генетически четко определенных штаммов и наличие широкого спектра молекулярные датчики и реагенты для выполнения в естественных условиях , а также в in vitro исследования. Основываясь на нашем опыте с различными моделями трансплантации мышиных, мы разработали модель трансплантации heterotopic поджелудочной железы у мышей с намерением проанализировать механизмы, лежащие в основе тяжелой ишемии реперфузии связанные травмы начале трансплантат повреждения. В отличие от ранее описанных методов, с помощью методов шовный материал, здесь мы опишем новую процедуру с использованием техники-шов манжет.
В последние годы, мы выполнили более чем 300 трансплантации поджелудочной железы у мышей с общий показатель успеха > 90%, показатель успеха никогда не описано ранее в трансплантации поджелудочной железы мыши. Основой этой техники-шов манжет для реваскуляризации трансплантата состоит из двух основных этапов: (I) потянув получателя судна над полиэтиленовые или полиамидные манжеты и фиксации его с продольных лигатур и (II) размещение доноров судна над вывернута получателей судна и его фиксации с второй продольных лигатур. Результирующая непрерывности эндотелиального слоя приводит к менее тромбогенного поражений с высокой проходимости тарифы и, наконец, высокий уровень успеха.
В этой модели артериальных анастомозов достигается путем вытягивать брюшной аорты доноров трансплантата над everted общей сонной артерии получателя животного. Венозный дренаж трансплантат достигается путем вытягивать воротной вены трансплантата над everted внешней яремной получателя. Эта рукопись содержит деталей и важнейшие шаги восстановления орган и орган имплантации процедур, которые позволят исследователей с микрохирургической навыки для успешного выполнения трансплантации в их лабораториях.
Введение
Одновременная почек-поджелудочной железы трансплантации (СПК) представляет текущий стандарт медицинской помощи для пациентов, страдающих сахарным диабетом и конец стадии почечной болезни. Успешные трансплантации приводит к долгосрочной независимость инсулина, связанные с стабилизации или даже регрессии диабетической микроангиопатии и лучшего качества жизни1. Однако в отличие от других общих твердых пересадки, как почек и пересадки печени, поджелудочной железы графтов более восприимчивы к ишемии-реперфузии травмы (IRI). Зарегистрированных случаев до 35% ставят под угрозу не только трансплантата, но даже пациента, выживание2,3.
Оксидативный стресс, микроциркуляции, увеличение выражение провоспалительных цитокинов, и молекулы адгезии результате наконец в эндотелиальных активации и потери ее целостности, все были отнесены к этой травмы не аллогенной трансплантата 4. до настоящего времени, точные молекулярные механизмы ИРИ в основном неизвестны и может варьироваться от органа в орган.
Несмотря на значительный прогресс, используя модели в vitro развитие животных моделей важно углубить знания молекулярных механизмов, участвующих в ИРИ связанные трансплантата изменения после трансплантации поджелудочной железы. Несколько моделей трансплантация поджелудочной железы были разработаны в грызунов5,6, но только один сообщается в7мышей. Ахиллесова пята этого весьма требовательных микрохирургическая процедура является низкой выживаемости 46%. Однако мыши модели представляют лучшие модели для трансплантации исследований, поскольку самые разнообразные инструменты молекулярного анализа могут быть применены к ним. Основываясь на опыт микрохирургическое мышей с различными орган трансплантаций8,9,10, мы разработали новый, высокую воспроизводимость техника для поджелудочной железы heterotopic, шейки матки Пересадка в мышей с > 90% успеха, используя технику-шов манжет. С этой техникой анастомозов осложнения сведены к минимуму, и высокий уровень успеха может быть достигнуто по сравнению с швом модель11. Пока только одна модель мыши с аналогичными показателями успеха был описан Лю et al12. Однако Есть никаких исследований, опубликованных с помощью этой модели пока.
протокол
Во избежание alloimmune ответы и расследовать строго ишемии реперфузии травматизмом трансплантата повреждения, пару сингенных донор реципиент должен использоваться. В этом протоколе, мужской C57BL6 (H2b) 10-12-week-old мышей, весом 26 – 28 g использовались как размер соответствует пар донор реципиент. Все животные были размещены в объекте бесплатно возбудителя барьер и получил человеческого ухода в соответствии с «принципы лабораторных животных ухода «сформулированные национальным обществом для медицинских исследований и «руководство для ухода и использования лабораторных животных» подготовленный Национальной академии наук и опубликованных национальных институтов здравоохранения (низ публикация № 86-23, пересмотренный 1985). Министерство образования, науки и культуры Австрии одобрил эксперименты, описанные в этой рукописи (BMWF-66.011/0056-II/3b/2011).
1. поджелудочная железа закупки
- Анестезировать доноров животное с внутрибрюшинного (и.п.) инъекции Ксилазина (5 мг/кг массы тела) и кетамин (100 мг/кг массы тела) с помощью иглы (G) 27-го калибра.
- Брить волосы в области живота, с использованием электрической бритвы и исправить мыши на операционного поля в лежачем положении с нити ленты.
- Скраб для операционного поля три раза с хлоргексидином пропитанной сетки.
- Выполните срединной брюшной разрез с расширением двусторонней онкогорошину, с помощью ножниц. Аккуратно неубранной внутренностей слева с стерильные ватные палочки и обернуть их в смоченную марлю. Поднимите xyphoid краниально с Москито зажим для обеспечения максимального воздействия брюшной полости для следующих шагов.
- С помощью иглы 19 G, придать 400 мкл стерильные 1:4 гепарина натрия хлорида раствор для heparinisation в нижней полой вены (IVC). После удаления иглы, усыпить животных от обескровливания transecting аорты.
- Вскрыть брюшной аорты между происхождения превосходной верхней брыжеечной артерии и право почечной артерии, аккуратно разделив фиброзной ткани, используя щипцы изогнутые подсказка. Подорвать аорты и связать его с 8/0 шелк вязью.
- Идентифицировать печеночно связки, которая проходит между postpyloric двенадцатиперстной кишки и печени рубчика. Разделите желчных протоков ниже входа кистозный протока после дистальной лигатур и аккуратно вскрыть и разрез воротной вены как можно иметь достаточной длины для выполнения анастомоза в получателя дистально.
- Используя щипцы изогнутые наконечник, тупо вскрыть брюшной аорты, начиная от предыдущих лигатур (см. шаг 1.6). Подорвать periaortic ткани, используя щипцы изогнутые наконечник, связать его с шелковой вязью 8/0 и разрез с ножницами.
- С помощью биполярного пинцета, коагулировать все филиалы поясничного и разрез аорты с ножницами максимально до диафрагмы, для обеспечения достаточной длины судна анастомоза. Наконец разрез уже связали аорты выше левой почечной артерии.
- Perfuse поджелудочной железы с 19 G шприца с 5 мл раствора гистидин триптофана ketoglutarate перфузии 4 ° C в антеградная моды через брюшной аорты, до тех пор, пока существует четкое стоков, поступающих от воротной вены. Придайте низкого давления, чтобы избежать образования отеков.
Примечание: Выполните шаги 1,5 до 1,9 в быстрый и стандартизированных моды избежать каких-либо предубеждений, теплый ишемического ухудшения восстановленные трансплантата. - Замените внутренние органы в брюшной полости, используя стерильные ватные палочки.
- Используя щипцы изогнутые наконечник, отдельные поджелудочной железы поэтапно, начиная с postpyloric двенадцатиперстной кишки и двигаться вперед до достижения связки Treitz. Для этих шагов определите районах аваскулярного соединительной ткани между стенку двенадцатиперстной кишки и поджелудочной железы.
- Тупо препарировать эти районы, используя щипцы изогнутые подсказка для того чтобы изолировать мост судов между поджелудочной железы и двенадцатиперстную кишку. Пройти 8/0 шелк лигатура вокруг каждой изолированных сосудистые структуры и связать его.
- Наконец разрез сосудистые структуры с ножницами к стенке двенадцатиперстной кишки. Таким же образом используйте Шелковый шов 8/0 для разделения поджелудочной железы от брыжейке, поперечно-ободочной кишки и желудка.
Примечание: Во время этой процедуры, перевязано холедохо панкреатического протока.
- Определите gastrosplenic связки, работает от хандры желудка, и короткие желудка ветви, подняв желудка краниально и резки его ножницами. Оставляйте Хандра, придает восстановленный трансплантата.
Примечание: Для того, чтобы свести к минимуму трансплантата подогрева, полива поджелудочной железы, непрерывно с помощью 10 мл шприц с иглой 19 G раствором холодной гистидин триптофана ketoglutarate перфузии, хранящиеся на льду. - Наконец удалите поджелудочной железы от донора сайта (рис. 1B), схватив селезенки с щипцами и передать его в получателя.
- Кроме того чтобы вызвать тяжелой ишемии-реперфузии травмы, храните трансплантата в перфузии раствор стерильный, 4 ° C для 16 h до имплантации в получателя животное.
2. получателей подготовка
- Анестезировать получателя животное с и.п. инъекции Ксилазина (5 мг/кг массы тела) и кетамин (100 мг/кг массы тела) с помощью иглы 27 G.
- Бритье регионе правой боковой шейки матки с помощью электрической бритвы и поместите указатель мыши на операционного поля в лежачем положении. Исправьте мыши, с помощью нитей ленты. Избегайте распыления Передние конечности, чтобы избежать ущерба для дыхания.
- Скраб для операционного поля, три раза с помощью сеток, пропитанных хлоргексидина.
- Сделайте правильный paramedian, слегка косо Кожный разрез от шейный разрез на угол правой челюсти.
- Тупо выявлять и мобилизовывать боковых ветвей право внешних яремной вены. Свертываться их с биполярного пинцета и разрез их ножницами.
- Поднимите правой доли подчелюстной слюнной железы краниально, выявление сосудистой ножке и прижечь его с помощью биполярного пинцета. Удалите мочку, transecting прижигание ножке с ножницами.
- По аналогии с шагом 2.5 определить все медиальной ветви внешней яремной вены, прижечь их с биполярного пинцета и разрез их ножницами.
3. Имплантация
- Место трансплантата в область шеи получателя с помощью Хандра как ручка, с головой ориентированные боков, хвост, включая селезенки медиально и судно пни Вентро каудально. Использование ватные палочки правильно позиционировать трансплантата.
- Осторожно потяните воротной вены поджелудочной железы трансплантата над внешней яремной получателя животного, который был ранее вывернута, и зафиксировано на соответствующие манжеты (см. шаг 2.10). Исправить это с круговой 8/0 шелк вязью.
- Натяните пень брюшной аорты трансплантата everted общей сонной артерии получателя животного. Исправить это с продольных шелковые вязью 8/0 (рис. 1 c).
- Идентифицировать селезеночной судов вблизи рубчика селезенки и подорвать их пинцетом изогнутый кончик. Связать их с 8/0 шелк лигатуры и разрез селезеночной судов для удаления селезенки. Наконец Сократите связей.
- С помощью струбциной, применяя щипцы, сначала удалите зажим на венозной манжету. Затем удалите артериальной зажим.
Примечание: Если трансплантация прошла успешно, поджелудочной трансплантата будет быть reperfused немедленно показаны однородного розоватого цвета и видимые артериальной пульсации (рис. 1 d). - Смочите лоскута с нормотермических солевой раствор.
- Снимите ручку венозной манжеты с использованием прямой щипцами.
- Закрыть хирургической раны с воспроизводимым шовные 6/0.
4. послеоперационный уход (конечной точки)
- После процедуры, применяются до 0,5 мл физиологическим подкожно (с.к.) для замены интраоперационной потери жидкости с помощью иглы 19 G.
- Держите получателя животных на грелку до полного выздоровления от анестезии.
- Как только проснулся, возвращения получателя животное жилищного фонда, где он может иметь пищи и воды ad libitum.
- Для предотвращения послеоперационной боли, администрирование сразу после операции (1) Buprenorphin (0,1 мг/кг веса тела) каждые 12 ч в первые 5 дней и 4 мг/кг веса тела (2) carprofen каждые 12 ч s.c. за первую неделю.
- Для оценки надлежащего рациона, контролировать вес (г) каждого получателя животного каждый день. Потеря веса более чем 10-15% по сравнению с весом в день операции, апатия, Калечащий, очень Бент обратно, а также инфекции хирургические стороны представляют конечные точки.
- В этом случае, а также после достижения клинического конечной точки приносят в жертву животное с помощью терминала изофлюрановая ингаляции.
Результаты
За последнее десятилетие мы провели более 300 операций по пересадке поджелудочной железы у мышей. После установления протокол, было общее выживание > 90%. Послеоперационные кровотечения был главной причиной для отказа, следуют трансплантата тромбоза с последующим смертельным некротические трансплантата панкреатита. В обоих случаях конечные точки были достигнуты в течение 24 часов и приносили в жертву животных. Не было каких-либо неврологических расстройств, такие симптомы, как дисфагия и хирургические стороны инфекции в этой серии.
Расследовать эндокринной функции пересаженных графтов, и поэтому проверить проходимость модели, гипергликемия было вызвано получателей мышей предварительной обработки с однократным введением внутрибрюшинно прикладной Стрептозотоцин (312,5 мг/кг массы тела) 4 дней до операции. Мышей были рассмотрены гипергликемической, если уровень глюкозы в крови были > 300 мг/дл. Рисунок 2A показывает уровень глюкозы в крови различных групп. Мышей, получения трансплантатов без длительной холодной ишемии время 16 h достигли normogylcemia в течение 24 ч после трансплантации и сохранить этот метаболических государства за весь период наблюдений. В отличие от животных пересаженные оставался гипергликемической. Поскольку мы были заинтересованы в влияние ишемии реперфузии связанные травмы трансплантата повреждения на эндокринную функцию, мы добавили третья группа, где подвергаются графтов в 16 h длительное время холодной ишемии (МКЖТ) и 45 минут времени теплых ишемии (WIT). Мышей, получающих эти трансплантаты не достигают нормогликемия и должен был быть принесен в жертву после 48 ч за счет развития панкреатита, который был показан быть смертельной в этой модели13.
Эта модель полезна для различных проектов, направленных на изучение ишемии реперфузии связанные травмы начале трансплантат повреждения. Дальнейшие исследования включали, среди прочего, конфокальная прижизненной флуоресцентной микроскопии для количественного определения микроциркуляторных расстройства, выполняются 2 ч, после трансплантации. Контраст графтов микрососудов был усилен путем инъекций 0,3 мл 0,4% флуоресцеин Изотиоцианаты меченных декстрана (МВт 150 000) в Вену полового члена. Рисунок 2B отображает шаблон регулярного капиллярного наивно мышиных поджелудочной железы и пересаженные поджелудочной железы трансплантата, которая не была подвержена длительной CIT (рис. 2 c). В противоположность этому 2D рисунок показывает нарушения микроциркуляции в результате разоблачения поджелудочной железы трансплантата для длительного CIT.
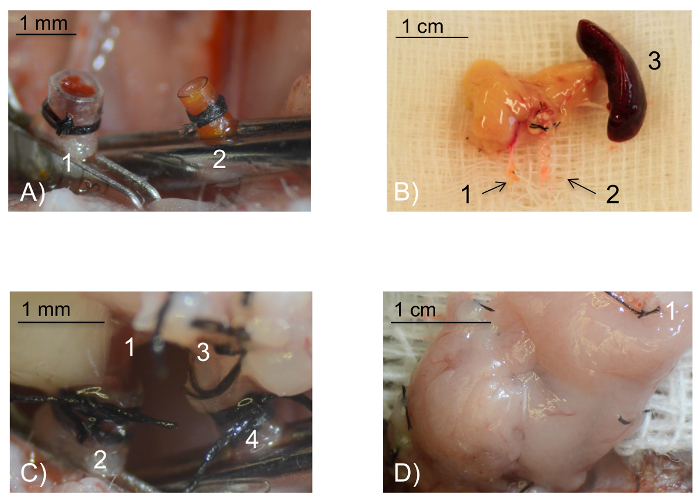
Рисунок 1 : Интраоперационная фотографии. (A) интраоперационной вид получателя судов, подготовленное для анастомоза. Внешние яремной (1) вывернута над венозной полиэтиленовые манжеты и фиксированной с круговой шелковые вязью 8/0. По аналогии общей сонной артерии (2) вывернута и фиксированной над меньше артериальной полиамид манжету. Масштаб 1 мм бар. (B) поджелудочной железы трансплантата ex situ. Воротной вены (1) и пней брюшной аорты (2) необходимые для сосудистого анастомоза. Селезенка (3) извлекается вместе с поджелудочной железы и используется в качестве маркера. Селезенка, будут удалены перед реперфузии трансплантата. Бар 1 cm. (C) интраоперационной представление масштабах анастомозов. Воротной вены (1) вытащил над манжета everted внешней яремной (2) и фиксированной с круговой шелковый галстук 8/0. Аналогично аортальный пень брюшной аорты (3) вытягиван над манжета everted общей сонной артерии (4). Шкалы и 1 мм. (D) интраоперационной посмотреть перфузии поджелудочной железы трансплантата, после реперфузии 5 мин: после удаления вен, следуют артериальной зажим, успешно пересаженных поджелудочной железы трансплантата отображает однородного розоватого цвета. Селезенка удалена перед реперфузии (1: перевязаны селезеночной судно). Масштаб бар 1 cm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Эндокринной функции поджелудочной железы трансплантата и конфокальный в естественных условиях микроскопии флуоресцирования. Рисунок 2A показывает график с уровня глюкозы в крови пересаженных мышей без CIT (n = 10, PTX МКЖТ, синяя линия), не пересадили мыши (n = 11, не PTX, красная линия) и мышей, получения трансплантатов, подвергается длительной CIT (PTX + 16 h МКЖТ, n = 10, зеленая линия). Все получатели ранее были вынесены гипергликемической с 312.5 мг/кг веса тела Стрептозотоцин и.п. В то время, как все получатели трансплантаты не МКЖТ смогли пережить весь период наблюдений (50 дней) с нетронутыми эндокринной функции, не пересадили мыши оставались гипергликемической за весь период наблюдений. Мышей, получения трансплантатов, подвергается 16 h МКЖТ не восстанавливалась от гипергликемии и должен был быть принесен в жертву 48 ч после трансплантационной хирургии, из-за потери веса более чем на 10-15%. Мышей, выжившие весь период наблюдений были принесены в жертву в день 50 после одного последнего измерения гликемии. Микроциркуляцию в пересаженных графтов оценивали конфокальный прижизненной флуоресцентной микроскопии 2 ч, после трансплантации. Наивный поджелудочной железы служил в качестве элементов управления. Рисунок 2B показывает шаблон регулярного капилляров в поджелудочной железе наивными. Очередной капиллярной сетки также видели в трансплантируемых графтов не подвергается длительной CIT (рис. 2 c). В противоположность этому разбивка микроциркуляции наблюдается пересаженных графтов, подвергается длительной CIT (Рисунок 2D). Шкалы бар 100 µm. данные в графе выражаются в виде ± стандартное отклонение. PTX: Пересадка поджелудочной железы; МКЖТ: холодная ишемии время; : без пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
ИРИ связанные трансплантата ущерб присущие твердых трансплантации, и он характеризуется нарушением микроциркуляции. Накопление нескольких метаболитов в ходе этапа ишемического и начало воспалительных каскады, главным образом при посредничестве кислорода и азота, приводит к повреждению тканей во время реперфузии трансплантата4. Этот Каскад может поставить под угрозу не только краткосрочные, но также долгосрочный успех и, следовательно, значительно влияет на выживание больных14. На сегодняшний день, комбинированные почки трансплантация поджелудочной железы представляет собой терапию выбора для пациентов, страдающих от типа 1 диабетом с конец стадии почечной болезни15. Несколько исследований показали, что трансплантация поджелудочной железы успешно комбинированных почки не только восстановить и защитить Трансплантат почки в диабетической получателей, но также стабилизирует или даже меняет вторичных осложнений, в том числе нейропатии, а также микро - и macroangiopathy16,17,18
Несмотря на непрерывные усилия по сокращению, замена и уточнение (3 R's) в исследований на животных в в vitro настройки просто невозможно воспроизведение сложных патофизиологических процессов как IRI. Таким образом Животные модели по-прежнему считаются идеальным инструментом для трансляционного исследования19,20. Модели мыши как один описаны здесь имеют несколько преимуществ по сравнению с крыса или других животных моделей. К ним относятся наличие огромное количество штаммов генетически четко инбредные мыши (например , трансгенных и нокаут-штаммы), множество инструментов молекулярного анализа, а также легко и дешево обработки21. Основным преимуществом описанной модели лежит в технике-шов манжет. С помощью представленный здесь технику, показатели успеха в > 90% являются достижимыми, который является значительно лучше по сравнению с ранее описанных моделей22. Используя эту технику-шов, мы значительно снизили общие осложнения как гиповолемического шока, тромбоз и стенозом анастомозов12. Еще одно преимущество этого метода состоит из дополнительных брюшной позиции лоскута, который связан с быстрое послеоперационное восстановление получателя. Кроме того шейки матки расположение делает его идеально подходит для анализа в естественных условиях , таких как живой изображений трансплантата, exterioration без любого натяжение22.
Основным недостатком данной модели является окклюзии протока поджелудочной железы, которые не напоминают клинической реальностью. В этой модели экзокринной дренаж управляется связывая холедохо панкреатического протока. В долгосрочной перспективе это приводит к помеченной фиброз и атрофия железы без ведущих к графт панкреатита22. Вследствие этого ухудшения экзокринной ткани, которые мы наблюдали в начале как на день 30 после трансплантации, мы считаем, что эта модель не подходит для длинный срок наблюдения. В противоположность этому ненарушенный Эндокринная функция делает gylcemic элементов управления получателя простой инструмент для ежедневной оценки функции трансплантата13,23,24.
Эти характеристики делают это идеальная модель для анализа начале трансплантат травмы, связанные с длительного сохранения или сохранения различных решений и методов. Для достижения оптимального успеха с этой моделью, необходимо рассмотреть несколько важных шагов. Поджелудочной железы, сам очень чувствителен к манипуляции. Таким образом нежный обработку с использованием ватные палочки во время восстановления органов и во время имплантации минимизирует механические травмы. Следует избегать прямого схватив железы с щипцами, поскольку это неизбежно приведет к тяжелой трансплантата ущерб. По той же причине селезенка восстанавливается вместе с поджелудочной железы и используется в качестве маркера. Это также устанавливается в клинической практике. Дальнейшее ловушкой включает в себя холодные перфузии, которая достигается путем перфузии через аортальный пень с помощью решения гистидин триптофана ketoglutarate перфузии 4 ° C. Настоящим можно избежать чрезмерного отек железы нежно perfusing трансплантат. Оставшийся раствор перфузии должны использоваться для увлажнения трансплантата, с целью снижения его температуры во время восстановления орган.
Что касается получателей подготовки тщательного рассечение внешнего яремной вены, а также общей сонной артерии устанавливает базу для успешного реваскуляризации. В частности, полного воздействия Вены путем удаления не только все притоки, но и окружающих жировой ткани необходим для того, чтобы избежать внешней сжатия и стенозом, оставшиеся жировой ткани. Выбор диаметра соответствующего манжету имеет решающее значение. На основе обмена опытом, для мышей, весом от 25 до 28 g, внутренний диаметр 0.57 мм для артериальной манжеты и между 0,75 и 0,8 мм для венозной манжету, уместно. Точные, чистой резки края манжеты является обязательным чтобы избежать разрывов пень судна. Дилатация сосудов, особенно артерии, достигается лучшее использование судна dilatators с тонкой советы. Как правило судно должно быть возможность расширить до дважды люмен манжету. Во время процесса everting судна над и фиксации его на манжете мы рекомендуем, стабилизации сосудистой зажимы, помещая их под лоскут кожи, как это упрощает этот важный шаг.
Как уже упоминалось манжеты техника шов представляет собой простой метод для сосудистого анастомоза и может выполняться в течение 5 мин. Однако правильное позиционирование трансплантата в районе шеи получателя имеет крайне важное значение для правильного реваскуляризации. Настоящим окончательный правильное позиционирование трансплантата в области шеи должен ожидать для того чтобы разрешить безопасно, прямо и без напряжения анастомоза Вены и артерии. Судов, которые слишком долго должны избегать, поскольку это может привести к оттоку помехи излом. По той же причине манжеты ручки на венозного анастомоза следует удалить после реперфузии. В случаях локализованного кровотечениях из поджелудочной железы трансплантата успешно гемостаз достигается нежно сжимая кровотечение стороне за 5 мин, с использованием ватные палочки. Это только успешный способ управлять такого рода осложнений.Каутеризация, хотя весьма избирательно, привели к потере трансплантата в почти всех случаях, за счет Некротический панкреатит.
Таким образом мы разработали метод трансплантации поджелудочной железы у мышей с использованием техники-шов манжет, который является технически осуществимым и microsurgically и имеет отличные показатели. Учитывая progredient фиброз поджелудочной железы вследствие окклюзии протока, эта модель подходит лучше всего для областей исследования, упором на начале трансплантат убытков. Эта рукопись предназначен для предоставления исследователям безопасно установить эту модель в их лабораториях.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Эта работа была поддержана грантов #2008-1-596 и #UNI-0404/1956 из «Tiroler Wissenschaftsfonds (TWF)» (https://www.tirol.gv.at/en/) и Грант #2013-042018 из «Förderungsprogramm MUI-старт» медицинский Университет Инсбрука.
Материалы
| Name | Company | Catalog Number | Comments |
| Adventitia Scissors | S&T | S-00102 | Straight |
| Dumont # 7 Forceps | FST | 11271- 30 | Curved Tip 0.17 x 0.1 mm |
| Yasargil Clip Mini Permanent 7mm | Aesculap | FE720K | |
| Micro vessel clip | S&T | B1 00396 V | |
| Vessel dilatator | S&T | D-5a.2, 00125 | |
| Clip applier | S & T | CAF-4 00072 | for venous cuff |
| Clip applier | Aesculap | FE572K | for the arterial cuff |
| Polyethylene tube | Portex Ltd | Inner diameter 0.75 mm for venous cuff | |
| Polymide tubing | Vention Medical | 141-0051 | Inner diameter 0.8 mm (Alternative for polyethylene tube from Portex Ltd) |
| Polymide tubing | Vention Medical | 141-0033 | Inner diameter 0.57 mm for arteriail cuff |
| Bipolar forceps | Micromed | 140-100-015 | |
| 8/0 silk ligatures | Catgut GmbH, Merkuramed | 17209008 | |
| Custodiol HTK solution | Dr. Franz Köhler Chemie | 59997 | |
| Ketamin Graeub | aniMedica GmbH | 32554 | |
| Xylasol Graeub | aniMedica GmbH | 50855 |
Ссылки
- Gruessner, A. C. 2011 update on pancreas transplantation: comprehensive trend analysis of 25,000 cases followed up over the course of twenty-four years at the International Pancreas Transplant Registry (IPTR). Rev Diabet Stud. 8 (1), 6-16 (2011).
- Troppmann, C. Complications after pancreas transplantation. Curr Opin Organ Transplant. 15 (1), 112-118 (2010).
- Fernández-Cruz, L., et al. Native and graft pancreatitis following combined pancreas-renal transplantation. Br J Surg. 80 (11), 1429-1432 (1993).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nat Med. 17 (11), 1391-1401 (2011).
- Konigsrainer, A., Habringer, C., Krausler, R., Margreiter, R. A technique of pancreas transplantation in the rat securing pancreatic juice for monitoring. Transpl. Int. 3 (3), 181-182 (1990).
- Lee, S., Tung, K., Koopmans, H., Chandler, J., Orloff, M. Pancreaticoduodenal transplantation in the rat. Transplantation. 13 (4), 421-425 (1972).
- Tori, M., Ito, T., Matsuda, H., Shirakura, R., Nozawa, M. Model of mouse pancreaticoduodenal transplantation. Microsurgery. 19 (2), 61-65 (1999).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. J Vis Exp. (92), e50753 (2014).
- Brandacher, G., et al. Tetrahydrobiopterin compounds prolong allograft survival independently of their effect on nitric oxide synthase activity. Transplantation. 81 (4), 583-589 (2006).
- Zou, Y., Brandacher, G., Margreiter, R., Steurer, W. Cervical heterotopic arterialized liver transplantation in the mouse. J Surg Res. 93 (1), 97-100 (2000).
- Zhou, Y., Gu, X., Xiang, J., Qian, S., Chen, Z. A comparative study on suture versus cuff anastomosis in mouse cervical cardiac transplant. Exp Clin Transplant. 8 (3), 245-249 (2010).
- Liu, X. Y., Xue, L., Zheng, X., Yan, S., Zheng, S. S. Pancreas transplantation in the mouse. Hepatobiliary Pancreat Dis Int. 9 (3), 254-258 (2010).
- Maglione, M., et al. Donor pretreatment with tetrahydrobiopterin saves pancreatic isografts from ischemia reperfusion injury in a mouse model. Am J Transplant. 10 (10), 2231-2240 (2010).
- Drognitz, O., Obermaier, R., von Dobschuetz, E., Pisarski, P., Neeff, H. Pancreas transplantation and ischemia-reperfusion injury: current considerations. Pancreas. 38 (2), 226-227 (2009).
- White, S., Shaw, J., Sutherland, D. Pancreas transplantation. Lancet. 373 (9677), 1808-1817 (2009).
- Morath, C., et al. Simultaneous pancreas-kidney transplantation in type 1 diabetes. Clin Transplant. 23 (Suppl 21), 115-120 (2009).
- Perseghin, G., et al. Cross-sectional assessment of the effect of kidney and kidney-pancreas transplantation on resting left ventricular energy metabolism in type 1 diabetic-uremic patients: a phosphorous-31 magnetic resonance spectroscopy study. J Am Coll Cardiol. 46 (6), 1085-1092 (2005).
- Secchi, A., Caldara, R., La Rocca, E., Fiorina, P., Di Carlo, V. Cardiovascular disease and neoplasms after pancreas transplantation. Lancet. 352 (9121), 65 (1998).
- Kirk, A. D. Crossing the bridge: large animal models in translational transplantation research. Immunol Rev. 196, 176-196 (2003).
- de Jong, M., Maina, T. Of mice and humans: are they the same?--Implications in cancer translational research. J Nucl Med. 51 (4), 501-504 (2010).
- Niimi, M. The technique for heterotopic cardiac transplantation in mice: experience of 3000 operations by one surgeon. J Heart Lung Transplant. 20 (10), 1123-1128 (2001).
- Maglione, M., et al. A novel technique for heterotopic vascularized pancreas transplantation in mice to assess ischemia reperfusion injury and graft pancreatitis. Surgery. 141 (5), 682-689 (2007).
- Cardini, B., et al. Crucial role for neuronal nitric oxide synthase in early microcirculatory derangement and recipient survival following murine pancreas transplantation. PLoS One. 9 (11), e112570 (2014).
- Maglione, M., et al. Prevention of lethal murine pancreas ischemia reperfusion injury is specific for tetrahydrobiopterin. Transpl Int. 25 (10), 1084-1095 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены