Method Article
Modelo murino de trasplante de páncreas mediante una técnica modificada del pun ¢ o
* Estos autores han contribuido por igual
En este artículo
Resumen
Entre trasplante de órganos sólidos abdominales, injertos pancreáticos son propensos a desarrollar daño de injerto asociada a lesiones reperfusión isquemia severa, llevando eventualmente a la pérdida temprana del injerto. Este protocolo describe un modelo de trasplante de páncreas murino utilizando una técnica sin sutura del manguito, ideal para el análisis de estos principios, deletéreos daños.
Resumen
Modelos de ratón tienen varias ventajas en la investigación de trasplante, incluyendo la facilidad de manejo, una variedad de cepas genéticamente bien definidas y la disponibilidad de la más amplia gama de sondas moleculares y reactivos para realizar en vivo así como en Vitro estudios. Basándonos en nuestra experiencia con los varios modelos murinos de trasplante, se desarrolló un modelo de trasplante de páncreas de heterotopic en ratones con la intención de analizar mecanismos subyacente severa isquemia reperfusión asociada a lesión del injerto daño temprano. En contraste con anterioridad técnicas descritas mediante técnicas de sutura, aquí describimos un nuevo procedimiento utilizando una técnica sin sutura del manguito.
En los últimos años hemos realizado más de 300 trasplantes de páncreas en ratones con una tasa de éxito de > 90%, una tasa de éxito nunca descrito antes en el trasplante de páncreas de ratón. La columna vertebral de esta técnica sin sutura del manguito para la revascularización del injerto consta de dos pasos principales: (I) tirando el vaso receptor sobre un manguito de polietileno/poliamida y fijándolo con una ligadura circunferencial y (II) colocar el recipiente de donantes sobre la evertido vaso receptor y fijarlo con una segunda ligadura circunferencial. La continuidad resultante de los resultados de la capa endotelial en menos lesiones trombogénicas con tasas de permeabilidad alta y, por último, las tasas de éxito alto.
En este modelo, la anastomosis arterial se logra tirando de la aorta abdominal del injerto donante sobre la arteria carótida común evertida del animal receptor. Drenaje venoso del injerto se consigue tirando de la vena porta del injerto sobre la vena yugular externa evertida del destinatario. Este manuscrito ofrece detalles y pasos cruciales de la recuperación de órganos y procedimientos de implantación de órganos, que permitirán a los investigadores con habilidades de microcirugía realizar el trasplante con éxito en sus laboratorios.
Introducción
Trasplante simultáneo de riñón y páncreas (SPK) representa el estándar actual de cuidado para pacientes que sufren de enfermedad renal en diabetes mellitus y final etapa. Trasplantes exitosos resultados en independencia de insulina a largo plazo asociada con la estabilización o incluso regresión de microangiopatía diabética y una mejor calidad de vida1. Sin embargo, a diferencia de otros trasplantes de órganos sólidos comunes, como el riñón y el trasplante del hígado, injertos pancreáticos son más susceptibles a lesión de la reperfusión de la isquemia (IRI). Reportado casos de hasta un 35% en peligro injerto, no sólo el paciente incluso, supervivencia2,3.
El estrés oxidativo, trastornos de la microcirculación, aumenta la expresión de citoquinas proinflamatorias y moléculas de adhesión que resulta finalmente activación endotelial y la pérdida de su integridad, todos se le atribuyen a esta lesión no alogénica del injerto 4. hasta ahora, los mecanismos moleculares exactos de IRI son en gran parte desconocidos y puede variar desde un órgano a órgano.
A pesar de avances importantes utilizando modelos en vitro , desarrollo de modelos animales es fundamental para profundizar en el conocimiento de mecanismos moleculares implicados en alteraciones de la IRI-asociado del injerto tras el trasplante de páncreas. Se han desarrollado varios modelos de trasplante de páncreas en roedores5,6, pero sólo uno es divulgado en ratones7. El talón de Aquiles de este altamente exigente procedimiento microsurgical es la baja tasa de supervivencia del 46%. Sin embargo, modelos de ratón representan el mejor modelo para investigaciones relacionadas con el trasplante, la más amplia variedad de herramientas de análisis molecular se puede aplicar a ellos. Basado en amplia experiencia microquirúrgica en ratones con diferentes órgano trasplantes8,9,10, hemos desarrollado una técnica nueva, altamente reproducible de páncreas heterotópico, cervical trasplante en los ratones con > 90% de éxito utilizando una técnica sin sutura del manguito. Con esta técnica, complicaciones de la anastomosis se reducen al mínimo, y se logra una alta tasa de éxito en comparación con la sutura modelo11. Hasta ahora, sólo un modelo de ratón con tasas de éxito similares ha sido descrito por Liu et al12. Sin embargo, no existen estudios publicados con este modelo hasta ahora.
Protocolo
Para evitar respuestas aloinmune y estrictamente investigar daños de injerto relacionadas con lesiones de isquemia reperfusión, debe utilizarse un par de donantes y receptores syngeneic. En este protocolo, hombre C57BL6 (H2b) 10-12 semana de edad 26 a 28 g de peso de ratones fueron utilizados como pares de donantes y receptores de tamaño comparable. Todos los animales fueron alojados en una instalación libre de patógeno de barrera y recibieron atención humana en cumplimiento de los "directores de laboratorio Animal cuidado" formulado por la sociedad nacional para la investigación médica y la "Guía para el cuidado y uso de animales de laboratorio" preparado por la Academia Nacional de Ciencias y publicado por el National Institutes of Health (NIH publicación número 86-23, revisada en 1985). El Ministerio Austriaco de educación, la ciencia y la cultura aprobó los experimentos descritos en este manuscrito (BMWF-66.011/0056-II/3b/2011).
1. páncreas contratación
- Anestesiar el animal donante con una inyección intraperitoneal (i.p.) de xilacina (5 mg/kg de peso corporal) y ketamina (100 mg/kg de peso corporal) mediante una aguja de calibre 27 (G).
- Afeitar el pelo en la región abdominal con una afeitadora eléctrica y fijar el ratón sobre el campo operatorio en una posición supina con los filamentos de la cinta.
- Limpiar el campo operatorio tres veces con gasas empapadas en clorhexidina.
- Realizar una incisión abdominal de línea media con extensión subcostal bilateral con unas tijeras. Exteriorizar las vísceras a la izquierda con palillos de algodón estéril y envolverlos en una gasa humedecida. Levante el xyphoid cranially con una pinza de mosquito para proporcionar la máxima exposición de la cavidad abdominal para los siguientes pasos.
- Utilizando una aguja de 19 G, inyectar 400 μL de una estéril 1:4 solución de cloruro de sodio de la heparina para la heparinización en la vena cava inferior (IVC). Después de retirar la aguja, eutanasia al animal por exsanguinación transecting de la aorta.
- Disecar la aorta abdominal entre el origen de la arteria mesentérica superior y la arteria renal derecha separando suavemente el tejido fibroso con unas pinzas de punta curva. Minar la aorta y atar con una ligadura de seda 8/0.
- Identificar el ligamento hepatoduodenal, que se extiende entre el postpyloric duodeno y el hilio hepático. Dividir la vía biliar por debajo de la entrada del conducto cístico después de la ligadura distal y suavemente diseccionar y transecto distal como sea posible para tener suficiente longitud para realizar la anastomosis en el recipiente de la vena porta.
- Sin rodeos con unas pinzas de punta curva, disecar la aorta abdominal a partir de la ligadura anterior (ver paso 1.6). Minar el tejido periaortic con unas pinzas de punta curva, atarla con una ligadura de seda 8/0 y transecto con tijeras.
- Con unas pinzas bipolares, coagular todas sus ramas lumbares y transecto la aorta con tijeras lo más cerca posible a la membrana, con el fin de proporcionar la suficiente longitud para la anastomosis de vasos. Por último, transecto la aorta ya atada por encima de la arteria renal izquierda.
- Perfusión del páncreas con una jeringa de 19 G con 5 mL de solución de histidina-triptófano-ketoglutarate perfusión de 4 ° C en forma anterógrada a través de la aorta abdominal, hasta que haya una clara efluente procedente de la vena porta. Aplicar a baja presión para evitar la formación de edema.
Nota: Realizar pasos 1.5 a 1.9 en una manera rápida y estandarizada para evitar cualquier sesgo cálido deterioro isquémico del injerto recuperado. - Vuelva a colocar las vísceras en la cavidad peritoneal con palillos de algodón estéril.
- Con unas pinzas de punta curva, separar el páncreas de manera gradual a partir del duodeno postpyloric y avanzar hasta el ligamento de Treitz. Para estos pasos, identificar las áreas de tejido conectivo avascular entre el páncreas y la pared duodenal.
- Sin rodeos diseccionar estas áreas utilizando pinzas de punta curva para aislar vasos tiende un puente sobre entre el páncreas y el duodeno. Pasar una ligadura de seda 8/0 alrededor de cada estructura vascular aislada y atarla.
- Por último, transecto la estructura vascular con tijeras hacia la pared duodenal. De la misma manera, usar una sutura de seda 8/0 para separar el páncreas del mesenterio, colon transverso y del estómago.
Nota: Durante este procedimiento, el conducto colédoco pancreática está ligado.
- Identificar el ligamento gastrosplénico corriendo del bazo y el estómago, las ramas gástricas cortas, levantando el estómago cranially y cortarlo con unas tijeras. Deje el bazo atado injerto recuperado.
Nota: Para minimizar el injerto recalentamiento, regar páncreas continuamente con una jeringa de 10 mL con una aguja de 19 G la solución de perfusión de histidina-triptófano-ketoglutarate frío almacenada en hielo. - Finalmente, retirar el páncreas de la región donante (figura 1B) sujetando el bazo con pinzas y ponerlo en el receptor.
- Alternativamente, para desencadenar la reperfusión de la isquemia severa, guarde el injerto en estéril, solución de perfusión de 4 ° C durante 16 horas antes de implantar en el animal receptor.
2. destinatario preparación
- Anestesiar el animal receptor con una inyección i.p. de xilacina (5 mg/kg de peso corporal) y ketamina (100 mg/kg de peso corporal) mediante una aguja de 27 G.
- Afeitado de la región cervical lateral derecho con una afeitadora eléctrica y coloque el ratón sobre el campo operatorio en una posición supina. Fijar el ratón utilizando hebras de cinta. Evitar estirar demasiado las extremidades delanteras para evitar comprometer la respiración.
- Talle del campo operativo tres veces usando gasas empapadas en clorhexidina.
- Hacer una derecha paramedian, incisión en la piel ligeramente oblicua de la incisión yugular hasta el ángulo de la mandíbula derecha.
- Claramente identificar y movilizar las ramas laterales de la vena yugular externa derecha. Coagular con pinzas bipolares y transecto con tijeras.
- Levantar el lóbulo derecho de la glándula salival submaxilar cranially, identificar el pedículo vascular y cauterizar con fórceps bipolares. Retirar el lóbulo transecting el pedículo cauterizan con tijeras.
- En analogía al paso 2.5, identificar todas las ramas mediales de la vena yugular externa, cauterizar con pinzas bipolares y transecto con tijeras.
3. implantación
- Lugar el injerto en región del cuello del receptor utilizando el bazo como un mango, con la cabeza orientada lateralmente, la cola incluyendo el bazo medialmente y los tocones de buque ventro-caudal. Palos de algodón de uso para colocar la prótesis correctamente.
- Tire suavemente de la vena porta del injerto pancreático sobre vena yugular externa del animal receptor, que ha sido previamente evertida, y en el brazalete apropiado (ver paso 2.10). Soluciónalo con una ligadura de seda 8/0 circular.
- Tire el muñón de la aorta abdominal del injerto sobre la arteria carótida común evertida del animal receptor. Soluciónalo con una circunferencial ligadura de seda 8/0 (figura 1).
- Identificar los vasos esplénicos cerca del hilio del bazo y debilitarlos con pinzas de punta curva. Atarlos con ligaduras de seda 8/0 y transecto los vasos esplénicos para extirpar el bazo. Finalmente, acortar los lazos.
- Con la abrazadera para aplicación de fórceps, quite la abrazadera del manguito venosa primero. Después quite la pinza arterial.
Nota: Si el trasplante fue exitoso, el injerto pancreático se ser reperfused inmediatamente mostrando un color rosado homogéneo y pulsación arterial visible (figura 1). - Humedezca el injerto con una solución salina normotérmico.
- Retire la manija del manguito venosa utilizando fórceps recto.
- Cerrar la herida quirúrgica con un funcionamiento sutura 6/0.
4. posoperatorio cuidado (Endpoint)
- Siguiendo el procedimiento, aplicar hasta 0,5 mL de solución salina normal por vía subcutánea (s.c.) para el reemplazo de la pérdida de líquidos intraoperatoria mediante una aguja de 19 G.
- Que el animal receptor sobre una almohadilla de calefacción hasta la completa recuperación de la anestesia.
- Una vez despierto, devolver el animal receptor a la instalación de la vivienda, donde puede tener comida y agua ad libitum.
- Para prevenir el dolor postoperatorio, administrar justo después de la operación (1) Buprenorphin (0.1 mg/kg b.w.) cada 12 h para los primeros 5 días y (2) carprofen 4 mg/kg p.v. cada 12 h s.c. durante la primera semana.
- Para estimar la ingesta nutricional adecuada, controlar peso (g) de cada animal receptor todos los días. Una pérdida de peso de más de 10-15% comparado con el peso en el día de la cirugía, apatía, lisiar, una espalda muy doblada, así como infecciones quirúrgicas laterales representan extremos.
- En este caso, así como después de alcanzar el criterio de valoración clínico, sacrificar al animal con inhalación isoflurano terminal.
Resultados
En la última década, se realizaron más de 300 trasplantes de páncreas en ratones. Después de establecer el protocolo, había una supervivencia global de > 90%. Hemorragia postoperatoria fue la principal causa de fracaso, seguida de la trombosis del injerto con pancreatitis posterior injerto necrótico letal. En ambos casos, se llegó a extremos dentro de las 24 h y los animales fueron sacrificados. No había ningún trastornos neurológicos, síntomas tales como disfagia y lado quirúrgico infecciones en esta serie.
Para investigar la función endocrina de los injertos trasplantados y por lo tanto validar la permeabilidad del modelo, hiperglucemia fue inducida en los ratones receptores por pretratamiento con una dosis única intraperitoneal aplicada streptozotocin (312,5 mg/kg de peso corporal) 4 días antes de la cirugía. Ratones fueron considerados hyperglycemic si fueron los niveles de glucemia > 300 mg/dL. Figura 2A muestra los niveles de glucosa de la sangre de los diferentes grupos. Ratones recibiendo injertos sin un tiempo de isquemia fría prolongado de 16 h alcanzaron normogylcemia dentro de 24 h después del trasplante y había mantenido este estado metabólico durante el período de observación todo. En contraste, animales trasplantados no permanecían hiperglucémicos. Ya que estábamos interesados en el impacto de daño isquemia reperfusión asociada a lesión del injerto función endocrina, agregamos un tercer grupo donde estaban expuestos los injertos 16 h prolongada tiempo de isquemia fría (CIT) y 45 minutos de tiempo de isquemia caliente (ingenio). Ratones que recibieron estos injertos no alcanzó normoglycemia y tuvieron que ser sacrificado después de 48 h debido al desarrollo de pancreatitis severa, que ha demostrado ser letal en este modelo13.
Este modelo es útil para varios proyectos para investigar isquemia reperfusión asociada a lesión del injerto daño temprano. Otras investigaciones incluyen, entre otros, microscopia confocal de la fluorescencia intravital para cuantificación de derangements microcirculación realizada 2 h después del trasplante. Contraste de microvasos de los injertos fue realzada por inyectar 0,3 mL de un 0.4% dextrano marcado con isotiocianato de fluoresceína (MW 150 000) en la vena del pene. Figura 2B muestra un patrón capilar regular de un páncreas murino de ingenuo y de un injerto de páncreas trasplantado, que no fue expuesto a CIT prolongado (figura 2). En cambio, Figura 2D muestra el desglose de la microcirculación como consecuencia de exponer el injerto pancreático a CIT. prolongada
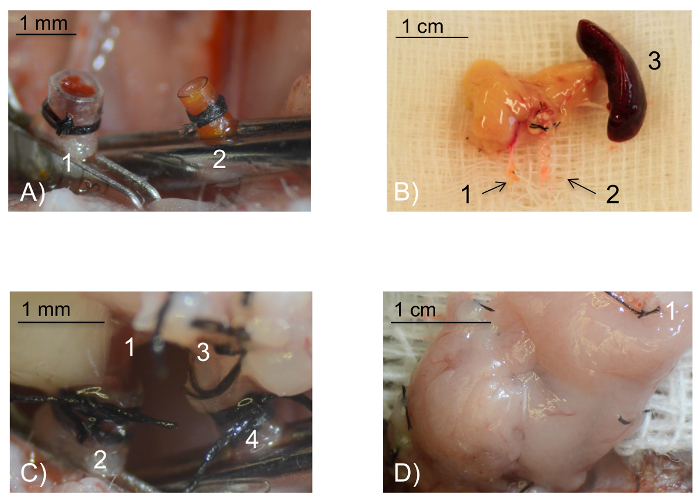
Figura 1 : Fotos intraoperatorias. (A) vista intraoperatoria de los vasos receptores preparados para la anastomosis. La vena yugular externa (1) ha sido evertida sobre el manguito de polietileno venosa y fijo con una ligadura de seda 8/0 circular. En la analogía, la arteria carótida común (2) ha sido evertida y fija sobre el manguito de poliamida arterial menor. Escala de la barra 1 mm. (B) el injerto pancreático ex situ. La vena porta (1) y el tocón de la aorta abdominal (2) necesario para la anastomosis vascular. El bazo (3) es obtenido junto con el páncreas y se utiliza como asa. El bazo se eliminarán antes de la reperfusión del injerto. La escala de la barra 1 cm. (C) vista intraoperatoria de las anastomosis. La vena porta (1) se tiró sobre el pun ¢ o de la vena yugular externa evertido (2) y fija con una corbata de seda 8/0 circular. Del mismo modo, el muñón aórtico de la aorta abdominal (3) se tira sobre el pun ¢ o de la arteria carótida común evertido (4). Escala de la barra 1 mm. (D) vista intraoperatoria de la perfusión pancreática del injerto después de 5 min de reperfusión: después de la eliminación de la vena, seguida por la pinza arterial, un injerto de páncreas trasplantado con éxito muestra un color rosado homogéneo. El bazo se ha eliminado antes de la reperfusión (1: vaso esplénico ligado). Escala de la barra 1 cm. haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Función endocrina del injerto pancreático y confocal en vivo microscopía de fluorescencia. Figura 2A muestra un gráfico de líneas con niveles de glucosa en sangre de ratones trasplantados sin CIT (n = 10, PTX sin CIT, línea azul), ratones no trasplantados (n = 11, no PTX, línea roja) y ratones recibiendo injertos expuestos a CIT prolongado (PTX + 16 h CIT, n = 10, línea verde). Todos los destinatarios previamente fueron prestados hiperglucémicos con 312,5 mg/kg b.w. streptozotocin i.p. Mientras que todos los receptores de injertos sin CIT fueron capaces de sobrevivir el período de observación todo (50 días) con función endocrina intacta, ratones trasplantados no permanecieron hiperglucémicos durante el período de observación todo. Ratones que recibieron injertos expuestos a las 16 h CIT no se recuperó de la hiperglucemia y tuvieron que ser sacrificada 48 h después de la cirugía de trasplante, debido a la pérdida de peso de más de 10-15%. Ratones sobrevivir el período de observación todo fueron sacrificados en el día 50 después de una última medición de glucemia. Microcirculación en los injertos trasplantados se evaluó mediante microscopía confocal de fluorescencia intravital 2 h después del trasplante. Páncreas de ingenuo sirvieron como controles. Figura 2B muestra un patrón regular de capilar en el páncreas de ingenuo. Una malla capilar regular también se observa en los injertos trasplantados no sometidos a CIT prolongado (figura 2). En contraste, se observa una interrupción de la microcirculación en trasplantado injertos expuestos a CIT prolongado (Figura 2D). Escala bar 100 μm. datos en el gráfico se expresa como ± desviación estándar. PTX: trasplante de páncreas; CIT: tiempo de isquemia fría; sin: sin por favor haga clic aquí para ver una versión más grande de esta figura.
Discusión
Daño del injerto asociada a IRI es inherente al trasplante de órgano sólido, y se caracteriza por una alteración de la microcirculación. Acumulación de metabolitos varios durante la fase isquémica y la iniciación de la cascada inflamatoria mediada por especies reactivas del oxígeno y el nitrógeno, resultado en daño de tejido durante la reperfusión de injerto4. Esta cascada puede poner en peligro el éxito no sólo a corto plazo, pero también a largo plazo y, por lo tanto, influye significativamente en la supervivencia de los pacientes14. Hasta la fecha, trasplante de páncreas combinado de riñón representa la terapia de elección para pacientes con tipo 1 diabetes con final de enfermedad renal de la etapa15. Varios estudios han demostrado que un trasplante de páncreas riñón combinado acertado no sólo restaurar y proteger la función renal del injerto en receptores diabéticos, pero también se estabiliza o incluso revierte las complicaciones secundarias, incluyendo neuropatía, así como micro y macroangiopathy16,17,18.
A pesar de los esfuerzos continuos de reducción, reemplazo y refinamiento (3 R) en la investigación animal, reproducción de procesos fisiopatológicos complejos como IRI es simplemente imposible en ajustes en vitro . Por lo tanto, los modelos animales son todavía considerados como la herramienta ideal para la investigación traslacional19,20. Modelos de ratón como descrito aquí tienen varias ventajas en comparación con el rata u otro animal de modelos. Estos incluyen la disponibilidad de una gran cantidad de cepas de ratón puras genéticamente definidas (por ejemplo, cepas transgénicos y knock-out), una gran cantidad de herramientas de análisis molecular, así como un fácil y barato manejo21. Una ventaja importante del modelo descrito se encuentra en la técnica de la no sutura del manguito. Mediante la técnica aquí presentada, las tasas de éxito de > el 90% son realizable, que es dramáticamente mejor comparado anteriormente descrito modelos22. Usando esta técnica sin sutura, redujo significativamente las complicaciones comunes como shock hipovolémico, trombosis y estenosis de la anastomosis12. Otra ventaja de este método consiste en la posición extra abdominal del injerto, que se asocia con una recuperación postoperatoria rápida del receptor. Además, la localización cervical lo hace perfectamente adecuado para análisis en vivo , como en proyección de imagen del injerto por exterioration sin ninguna tensión22.
El principal inconveniente de este modelo es la oclusión del conducto pancreático, que no se asemejan a la realidad clínica. En este modelo, drenaje exocrino está gestionado por atar el conducto colédoco pancreática. En el largo plazo, esto resulta en una marcada fibrosis y atrofia de la glándula sin conducen a pancreatitis22de injerto. Debido a este deterioro del tejido exocrino, que observamos tan temprano como en el día 30 después del trasplante, creemos que este modelo no es apto para la observación de largo plazo. Por el contrario, la función endocrina intacta hace controles de glucemia del destinatario una fácil herramienta para la evaluación diaria de la función del injerto13,23,24.
Estas características hacen de este un modelo ideal para el análisis precoz lesiones del injerto asociados con largos períodos de conservación o preservación diferentes soluciones y técnicas. Para lograr el éxito con este modelo, se deben considerar varios pasos cruciales. El páncreas sí mismo es muy susceptible a la manipulación. Por lo tanto, un manejo suave con palillos de algodón durante la recuperación de órganos y durante la implantación minimiza el trauma mecánico. Comprensión directa de la glándula con fórceps debe evitarse, ya que inevitablemente resultaría en daño grave del injerto. Por la misma razón, el bazo se recupera junto con el páncreas y se utiliza como asa. Esto también se establece en la práctica clínica. Una trampa más consiste en la perfusión fría, que se logra por perfusión a través del muñón aórtico utilizando solución de perfusión de histidina-triptófano-ketoglutarate del de 4 ° C. Por la presente, una hinchazón excesiva de la glándula puede evitarse inunda suavemente el injerto. La solución restante de perfusión debe utilizarse para humedecer el injerto, para mantener su temperatura más baja durante la recuperación del órgano.
Con respecto a la preparación del receptor una cuidadosa disección de la vena yugular externa, así como la arteria carótida común establece la base para el éxito de la revascularización. En particular, completa la exposición de la vena mediante la eliminación no sólo todos, sino también el tejido adiposo circundante, es necesario para evitar la estenosis y la compresión externa por tejido adiposo restante. La selección de los diámetros del manguito adecuado es crucial. Basado en la experiencia compartida, para los ratones que pesen entre 25 a 28 g, un diámetro interno de 0,57 mm para el pun ¢ o arterial y entre 0,75 y 0,8 mm para el pun ¢ o venoso, es apropiado. Precisa, corte limpio de los bordes de los puños es obligatorio para evitar el rasgado el muñón de la embarcación. Dilatación de los vasos, especialmente de la arteria, se consigue mejor mediante el uso de dilatators de vasos con puntas finas. Como regla general, el recipiente debe poder ampliar a dos veces la luz de la banda. Durante el proceso de vuelco el vaso encima y fijación del manguito, se recomienda estabilizar pinzas vasculares colocándolas debajo de una aleta de la piel, como esto facilita este paso crucial.
Como ya se mencionó, la no sutura del manguito-técnica representa un método sencillo para la anastomosis vascular y puede realizarse en 5 minutos. Sin embargo, la colocación correcta del injerto en región del cuello del destinatario es de suma importancia para la correcta revascularización. Por la presente, la colocación correcta y final del injerto en la región del cuello tiene que ser anticipado para permitir una anastomosis de la vena y la arteria segura, recta y sin tensión. Vasos que son demasiado largos deben evitarse, ya que esto podría provocar la obstrucción de la salida debido a que se doblen. Por la misma razón, la manija del manguito en la anastomosis venosa debe también eliminarse después de la reperfusión. En casos de bleedings localizados desde el injerto pancreático, éxito hemostasia se logra comprimiendo suavemente el lado sangrante durante 5 minutos usando palillos de algodón. Esta es la manera sólo éxito para gestionar este tipo de complicación.Cauterización, aunque altamente selectivo, dio lugar a la pérdida del injerto en casi todos los casos, debido a la pancreatitis necrótica.
En Resumen, hemos desarrollado un método para el trasplante de páncreas en ratones, utilizando una técnica sin sutura del manguito, que técnicamente es viable y microsurgically y tiene tasas de éxito excelente. Dada la progredient fibrosis del páncreas debido a la obstrucción del conducto, este modelo se adapta mejor para las áreas de investigación centrado en daños de injerto temprano. Este manuscrito está diseñado para permitir a los investigadores a establecer con seguridad este modelo en sus laboratorios.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Este trabajo fue apoyado por subvenciones #2008-1-596 y #UNI-0404/1956 de la "Tiroler Wissenschaftsfonds (TWF)" (https://www.tirol.gv.at/en/) y grant #2013-042018 de la "Förderungsprogramm de MUI-Start" de la Universidad médica de Innsbruck.
Materiales
| Name | Company | Catalog Number | Comments |
| Adventitia Scissors | S&T | S-00102 | Straight |
| Dumont # 7 Forceps | FST | 11271- 30 | Curved Tip 0.17 x 0.1 mm |
| Yasargil Clip Mini Permanent 7mm | Aesculap | FE720K | |
| Micro vessel clip | S&T | B1 00396 V | |
| Vessel dilatator | S&T | D-5a.2, 00125 | |
| Clip applier | S & T | CAF-4 00072 | for venous cuff |
| Clip applier | Aesculap | FE572K | for the arterial cuff |
| Polyethylene tube | Portex Ltd | Inner diameter 0.75 mm for venous cuff | |
| Polymide tubing | Vention Medical | 141-0051 | Inner diameter 0.8 mm (Alternative for polyethylene tube from Portex Ltd) |
| Polymide tubing | Vention Medical | 141-0033 | Inner diameter 0.57 mm for arteriail cuff |
| Bipolar forceps | Micromed | 140-100-015 | |
| 8/0 silk ligatures | Catgut GmbH, Merkuramed | 17209008 | |
| Custodiol HTK solution | Dr. Franz Köhler Chemie | 59997 | |
| Ketamin Graeub | aniMedica GmbH | 32554 | |
| Xylasol Graeub | aniMedica GmbH | 50855 |
Referencias
- Gruessner, A. C. 2011 update on pancreas transplantation: comprehensive trend analysis of 25,000 cases followed up over the course of twenty-four years at the International Pancreas Transplant Registry (IPTR). Rev Diabet Stud. 8 (1), 6-16 (2011).
- Troppmann, C. Complications after pancreas transplantation. Curr Opin Organ Transplant. 15 (1), 112-118 (2010).
- Fernández-Cruz, L., et al. Native and graft pancreatitis following combined pancreas-renal transplantation. Br J Surg. 80 (11), 1429-1432 (1993).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nat Med. 17 (11), 1391-1401 (2011).
- Konigsrainer, A., Habringer, C., Krausler, R., Margreiter, R. A technique of pancreas transplantation in the rat securing pancreatic juice for monitoring. Transpl. Int. 3 (3), 181-182 (1990).
- Lee, S., Tung, K., Koopmans, H., Chandler, J., Orloff, M. Pancreaticoduodenal transplantation in the rat. Transplantation. 13 (4), 421-425 (1972).
- Tori, M., Ito, T., Matsuda, H., Shirakura, R., Nozawa, M. Model of mouse pancreaticoduodenal transplantation. Microsurgery. 19 (2), 61-65 (1999).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. J Vis Exp. (92), e50753 (2014).
- Brandacher, G., et al. Tetrahydrobiopterin compounds prolong allograft survival independently of their effect on nitric oxide synthase activity. Transplantation. 81 (4), 583-589 (2006).
- Zou, Y., Brandacher, G., Margreiter, R., Steurer, W. Cervical heterotopic arterialized liver transplantation in the mouse. J Surg Res. 93 (1), 97-100 (2000).
- Zhou, Y., Gu, X., Xiang, J., Qian, S., Chen, Z. A comparative study on suture versus cuff anastomosis in mouse cervical cardiac transplant. Exp Clin Transplant. 8 (3), 245-249 (2010).
- Liu, X. Y., Xue, L., Zheng, X., Yan, S., Zheng, S. S. Pancreas transplantation in the mouse. Hepatobiliary Pancreat Dis Int. 9 (3), 254-258 (2010).
- Maglione, M., et al. Donor pretreatment with tetrahydrobiopterin saves pancreatic isografts from ischemia reperfusion injury in a mouse model. Am J Transplant. 10 (10), 2231-2240 (2010).
- Drognitz, O., Obermaier, R., von Dobschuetz, E., Pisarski, P., Neeff, H. Pancreas transplantation and ischemia-reperfusion injury: current considerations. Pancreas. 38 (2), 226-227 (2009).
- White, S., Shaw, J., Sutherland, D. Pancreas transplantation. Lancet. 373 (9677), 1808-1817 (2009).
- Morath, C., et al. Simultaneous pancreas-kidney transplantation in type 1 diabetes. Clin Transplant. 23 (Suppl 21), 115-120 (2009).
- Perseghin, G., et al. Cross-sectional assessment of the effect of kidney and kidney-pancreas transplantation on resting left ventricular energy metabolism in type 1 diabetic-uremic patients: a phosphorous-31 magnetic resonance spectroscopy study. J Am Coll Cardiol. 46 (6), 1085-1092 (2005).
- Secchi, A., Caldara, R., La Rocca, E., Fiorina, P., Di Carlo, V. Cardiovascular disease and neoplasms after pancreas transplantation. Lancet. 352 (9121), 65 (1998).
- Kirk, A. D. Crossing the bridge: large animal models in translational transplantation research. Immunol Rev. 196, 176-196 (2003).
- de Jong, M., Maina, T. Of mice and humans: are they the same?--Implications in cancer translational research. J Nucl Med. 51 (4), 501-504 (2010).
- Niimi, M. The technique for heterotopic cardiac transplantation in mice: experience of 3000 operations by one surgeon. J Heart Lung Transplant. 20 (10), 1123-1128 (2001).
- Maglione, M., et al. A novel technique for heterotopic vascularized pancreas transplantation in mice to assess ischemia reperfusion injury and graft pancreatitis. Surgery. 141 (5), 682-689 (2007).
- Cardini, B., et al. Crucial role for neuronal nitric oxide synthase in early microcirculatory derangement and recipient survival following murine pancreas transplantation. PLoS One. 9 (11), e112570 (2014).
- Maglione, M., et al. Prevention of lethal murine pancreas ischemia reperfusion injury is specific for tetrahydrobiopterin. Transpl Int. 25 (10), 1084-1095 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados