Method Article
Синтез Cd-фри InP / ZnS квантовых точек Подходит для биомедицинских применений
В этой статье
Erratum Notice
Резюме
In this protocol, the synthesis of Cd-free InP/ZnS quantum dots (QDs) is detailed. InP-based QDs are gaining popularity due to the toxicity of Cd2+ ions that may be released through nanoparticle degradation. After synthesis, QDs are solubilized in water using an amphiphilic polymer for use in biomedical applications.
Аннотация
Fluorescent nanocrystals, specifically quantum dots, have been a useful tool for many biomedical applications. For successful use in biological systems, quantum dots should be highly fluorescent and small/monodisperse in size. While commonly used cadmium-based quantum dots possess these qualities, they are potentially toxic due to the possible release of Cd2+ ions through nanoparticle degradation. Indium-based quantum dots, specifically InP/ZnS, have recently been explored as a viable alternative to cadmium-based quantum dots due to their relatively similar fluorescence characteristics and size. The synthesis presented here uses standard hot-injection techniques for effective nanoparticle growth; however, nanoparticle properties such as size, emission wavelength, and emission intensity can drastically change due to small changes in the reaction conditions. Therefore, reaction conditions such temperature, reaction duration, and precursor concentration should be maintained precisely to yield reproducible products. Because quantum dots are not inherently soluble in aqueous solutions, they must also undergo surface modification to impart solubility in water. In this protocol, an amphiphilic polymer is used to interact with both hydrophobic ligands on the quantum dot surface and bulk solvent water molecules. Here, a detailed protocol is provided for the synthesis of highly fluorescent InP/ZnS quantum dots that are suitable for use in biomedical applications.
Введение
Квантовые точки (КТ) полупроводниковые нанокристаллы, которые проявляют флуоресцентные свойства при облучении светом 1. Из-за их небольшого размера (2-5 нм), который похож на многих крупных биомолекул и простоты biofunctionalization, КТ являются чрезвычайно привлекательным инструментом для биомедицинских применений. Они нашли применение в биологической классификации, одной молекулы живых клеток изображений, доставки лекарств, изображений в естественных условиях, обнаружение патогена, и отслеживание сотового, среди многих других целей 2-8.
Cd основе КТ были наиболее часто используется в биомедицинских применений из-за их интенсивной флуоресценции и узкий пик эмиссии шириной 9. Тем не менее, проблемы были подняты в связи с потенциальной токсичности Cd 2+ 10, которые могут просочиться через деградации наночастицы. Недавно InP на основе КТ были исследованы в качестве альтернативы КТ с компакт-диска, потому что они поддерживают многие характеристики флуоресценциикомпакт-основе КТ и могут быть более биологически совместимым 11. Cd основе КТ были обнаружены значительно более токсичны, чем КТ InP основе в анализах в пробирке при таких низких концентрациях, как 10 часов вечера, после всего лишь 48 часов 11.
Цвет флуоресценции квантовых точек является размер перестраиваемого 1. То есть, как от размера КТ возрастает, флуоресцентное излучение является красное смещение. Размер и размер дисперсность КТ продуктов могут быть изменены путем изменения температуры, продолжительности реакции или ее предшественника условия концентрации в ходе реакции 12. В то время как пик излучения ИЯФ КТ обычно шире и менее интенсивны, чем КТ с компакт-диска, InP КТ могут быть сделаны в большом разнообразии цветов, призванных предотвращать спектральную перекрытие, и достаточно интенсивным для большинства биомедицинских применений 12. Синтез подробно в данном протоколе дает КТ с красной пика излучения с центром при 600 нм.
Несколько шаги AFтер синтез ядер КТ поддерживать оптическую целостность КТ и сделать их совместимыми для биологических применений. Поверхность ядра QD должен быть защищен от окисления или поверхностных дефектов, которые могут привести закалки; Поэтому, оболочка ZnS покрыта вокруг сердечника для получения InP / ZnS (ядро / оболочка) КТ 13. Это покрытие было показано, чтобы защитить фотолюминесценции продукта QD. Присутствие ионов цинка, в процессе синтеза InP КТ было показано, чтобы ограничить поверхностные дефекты, а также распределение уменьшить размер 12. Даже при наличии Zn 2+ в реакционной среде, синтез InZnP являются весьма маловероятно 12. После нанесения покрытия, полученные КТ InP / ZnS покрыты гидрофобным лигандов, таких как оксид триоктилфосфина (ТОРО) или олеиламином 12,14. Амфифильный полимер может взаимодействовать с гидрофобными лигандами на поверхности КТ, а также объемных молекул воды для придания растворимости 15 воды. Амфифильных полимеров с карбоxylate химические группы могут быть использованы в качестве "химических ручками» дополнительно функциональных групп в КТ.
Этот протокол детали синтез и функционализация водорастворимых InP / ZnS КТ с очень интенсивным флуоресценции и относительно небольшой размер-дисперсности. Эти КТ являются потенциально менее токсичны, чем обычно используемых CdSe / ZnS КТ. В данном случае синтез InP / ZnS КТ обеспечивает практическую альтернативу с компакт-диска КТ для биомедицинских применений.
протокол
1. Синтез фосфида индия / сульфида цинка (InP / ZnS) квантовыми точками
- Синтез фосфида индия (InP) квантовых точек ядер
- Установить 100 мл с круглым дном и 3-горлую колбу с, 12-дюймовым конденсатора. Добавить 30 мл олеиламином (УПВ), 0,398 г индия (III) хлорид (включая 3), 0,245 г хлорида цинка (II) (ZnCl 2) и перемешать с одновременной откачкой при КТ с использованием вакуума в течение 1 ч. Раствор должен появиться бесцветные с белым осадком.
- Использование колбонагревателя термопарой и пропорционально-интегрально-дифференциальный (ПИД) регулятор температуры, увеличить температуру раствора до 120 ° С. Откачать раствора под вакуумом в течение 20 мин, чтобы удалить примеси с низкой температурой кипения, которые могут повлиять основной рост.
Примечание: В то время как это можно использовать песочную баню и термометр, с помощью нагревательного кожуха и ПИД увеличивает равномерность и воспроизводимость продуктов реакции. - Под инертным газом (например,, N 2), обратным холодильником раствор и повышают температуру до 220 ° С в течение 15 мин. InCl 3 и ZnCl 2 полностью растворить, в результате чего бледно-желтого раствора. Разрешить стабилизации температуры в течение 10 мин.
- Чистки одноразовый, 3 мл пластиковый шприц и 4 дюйма, 22 г иглу с газообразным азотом. Используя шприц, быстро доставить 0,5 мл трис (диметиламино) фосфина (TDMAP) к раствору InCl 3. Температуру раствора незначительно уменьшается и возвращается к 220 ° С. Изменения решение от прозрачной, бледно-желтый до непрозрачного, черный.
- После 9,5 мин, удалить реакционной колбы из нагревательного кожуха, пока температура не упадет ниже 200 ° С. Для защиты целостности ядер InP, перейдем непосредственно к покрытию ZnS в шаге 1.2.1.
- Синтез сульфид цинка (ZnS) квантовая точка оболочек
- Поместите реакционной колбы со стадии 1.1.5 на нагревательной рубашкой и стабилизировать темпера тура при 200 ° С. Медленно добавить 3,58 г додекантиол (ДДТ) в течение 15 сек в раствор, содержащий InP КТ. Разрешить решение реагировать в течение 1 ч.
Примечание: толщина корпуса ZnS можно варьировать путем увеличения или уменьшения количества стеарата цинка, добавленную на шаге 1.2.4. Изменение количества ZnCl 2 или додекантиол с шагом 1.1.1 и 1.2.1 может значительно повлиять на качество КТ путем изменения кинетики реакции.- После этого удалить реакционной колбы с нагревательным кожухом и позволить раствору охладиться до приблизительно 60 ° C.
- Как только раствор InP / ZnS достигает ~ 60 ° C, добавляют 10 мл гексана и передать весь раствор примерно 45 мл до центрифужную пробирку 50 мл полипропиленовую. Центрифуга образца (3000 мкг в течение 10 мин) для удаления непрореагировавших твердых предшественников.
- Тщательно передачи супернатант в 250 мл бутылку полипропиленовую центрифужную, добавить 200 мл ацетона, и центрифуге раствора (3,000 хг в течение 10 мин), чтобы осадить InP / ZnS КТ. Этот объем может быть также разделены поровну на четыре 50 мл пробирки для центрифугирования, если центрифуга с необходимыми ротора / аксессуаров недоступен. Слейте супернатант и высушить QD осадок тщательно газообразным азотом для удаления ацетона.
- Ресуспендируют КТ в 20 мл УПВ с использованием ультразвука, трансфер в 50 мл круглым дном, 3-образным вырезом, колбу, содержащую 0,474 г стеарат цинка, и перемешать. Откачать раствора под вакуумом в течение 20 мин при комнатной температуре.
- Под азотом, повышают температуру до 180 ° С и позволяют реакции протекать в течение 3 ч. Хотя нет никаких заметных визуальных изменений к реакционному раствору, которые происходят во время этой реакции, добавляя стеарат цинка увеличивает толщину оболочки ZnS, тем самым увеличивая QY путем улучшения пассивации поверхности КТ 12.. После завершения реакции, удалить колбу с нагревательным кожухом и позволить раствору охладиться до приблизительно 60 ° C.
- После того, как Soluti InP / ZnSна течении ~ 60 ° C, добавляют 20 мл гексана и передать центрифужную пробирку 50 мл полипропиленовую. Центрифуга образца (3000 мкг в течение 10 мин), чтобы удалить непрореагировавший стеарат цинка.
- Тщательно передачи супернатант в бутылке центрифуги 250 мл полипропиленовую, добавить 200 мл ацетона, и центрифуга раствора (3000 мкг в течение 10 мин), чтобы осадить InP / ZnS КТ. Осторожно сливают супернатант и тщательно высушены азотом для удаления ацетона.
- Растворите таблетку InP / ZnS КТ в 30 мл гексана. Vortex и разрушать ультразвуком решение кратко, чтобы обеспечить полное диспергирование.
- Повторите очистку шаги 1.2.6-1.2.8 еще два раза, чтобы обеспечить тщательное удаление избытка органических лигандов. Взаимодействия между амфифильного полимера и QD в шаге 1.2 может быть нарушена в присутствии избытка лигандов.
- С расчетами, подробно описанным Се, др. 16, определить размер и концентрацию синтезированных КТ InP / ZnS с помощью УФ-Вид спектроскопии.
Примечание: Важным спектральная характеристика для этого анализа является плечо пика поглощения. Длина волны и значение поглощения максимума этого плеча используется для вычисления размера и концентрации КТ, соответственно. Эта реакция обычно дает приблизительно 5 мкмоль КТ с пиком излучения при 600 нм. Для синтеза КТ разных цветов, продолжительность и / или температура реакции может изменяться. Более длительное время реакции и / или более высокая температура раствора приводит красной смещенной эмиссионный пик. Например, увеличение температуры реакции до 240 ° C и поддержание время реакции 10 мин приведет КТ с 680 нм пика в максимальные выбросы. Аналогично, уменьшение времени реакции до 2 мин и удвоение хлорид цинка, используемый приведет КТ с 470 нм максимального пика испускания. Эти КТ InP / ZnS стабильны в течение по меньшей мере одного месяца при температуре 4 ° С в темноте в атмосфере инертного газа.
- Поместите реакционной колбы со стадии 1.1.5 на нагревательной рубашкой и стабилизировать темпера тура при 200 ° С. Медленно добавить 3,58 г додекантиол (ДДТ) в течение 15 сек в раствор, содержащий InP КТ. Разрешить решение реагировать в течение 1 ч.
2. ВодаСолюбилизация InP / ZnS квантовых точек Использование амфифильных Polymer
- водорастворимости
- Использование КТ InP / ZnS с шага 1.2.10, разбавленные часть КТ с гексаном с получением 1 мл 1 мкМ КТ.
- В пробирку центрифуги, передавать 0,25 мл InP / ZnS КТ в каждую пробирку. Добавить 1 мл ацетона или метанола в центрифужную пробирку и центрифугируют (3000 х г в течение 10 мин). Осторожно удалите супернатант и растворить осадок каждый в 1 мл тетрагидрофурана (ТГФ).
- Передача КТ InP / ZnS растворяют в ТГФ в 100 мл круглодонную колбу и разбавить 16 мл ТГФ. Чтобы уменьшить количество агрегатов в растворе, разрушать ультразвуком КТ в течение 5-10 мин.
- Растворите 30 мг поли (малеинового andhydride- альт -1-октадецене), 3- (диметиламино) -1-пропиламина (PMAL-D) в 10 мл очищенной воды молекулярного. Водяная баня обработку ультразвуком или осторожное перемешивание, пока раствор не станет прозрачным является достаточным для полного растворения полимера.Использование вихря или интенсивном перемешивании может производить много пузырьков, что затрудняет взаимодействие полимера с КТ. Добавить раствор полимера 10 мл на 100 мл круглодонную колбу, содержащую InP / ZnS КТ в ТГФ.
- Упаривают ТГФ из раствора QD / полимер с использованием роторного испарителя. Поместить колбу на бане со льдом в то время выпаривания для облегчения взаимодействия между полимером и QD. В зависимости от силы вакуума, наиболее ТГФ выпаривают через 10 мин и раствор появляется мутным.
- После того, как раствор выпаривают до 10 мл, удалить колбу из роторном испарителе и добавляют 30 мл воды молекулярную класса. Возвращение колбу на роторном испарителе и продолжать испаряться до 2 мл. Этот последний шаг испарение может занять несколько часов; обеспечить ледяную баню поддерживали.
- Удалить водорастворимые InP / ZnS КТ с круглодонную колбу с помощью пипетки. Фильтр решение QD с помощью пластикового шприца 3 мл, прикрепленный к 0,1 мкм нейлоновую SYРинге просачиваться в пробирку центрифуги 5 мл.
- Поместите КТ в 20000 MWCO мембранной диализа и диализ против 0,05 М боратный буфер рН 8,5 для удаления избытка полимера. (Медленно добавить тетрабората декагидрат 0,05 М натрия 0,05 М борной кислоты, при интенсивном перемешивании, пока рН не является 8,5, чтобы сделать этот борного буферного раствора.) С помощью вакуумного концентратора, сконцентрировать КТ в боратного буфера до 1 мл.
- Для хранения, очистить раствор с газообразным азотом перед герметизацией парафильмом. Водорастворимые InP / ZnS КТ являются стабильными в течение не менее 4 месяцев при 4 ° С в темноте.
- Использование КТ InP / ZnS с шага 1.2.10, разбавленные часть КТ с гексаном с получением 1 мл 1 мкМ КТ.
Результаты
Непокрытые ядра InP не демонстрируют существенное видимое свечение невооруженным глазом. Тем не менее, InP / ZnS (ядро / оболочка) квантовые точки появляются флуоресцировать ярко глазом при УФ облучении. Флуоресценция InP / ZnS КТ характеризовалась использованием флуоресцентной спектроскопии. Спектр флуоресценции квантовых точек в гексане (Рисунок 1) возбуждается на 533 нм демонстрирует один основной пик с центром при 600 нм с полуширина (FWHM) 73 нм. В то время как плотность (0,2) смещения на рисунке 1 может означать КТ рассеяние света, и таким образом наличие агрегированных КТ, мигающий анализа (смотри ниже) показывают, что большинство КТ одиночные, или очень небольшими группами, КТ. После нанесения покрытия с амфифильный полимерный PMAL-й, квантовый выход InP / ZnS КТ была исследована путем сравнения интегральной интенсивности флуоресценции квантовых точек с родамина B в качестве стандартного 17. Квантовый выход КТ в гексане Determined быть 7,96% в среднем (2 измерения, 7,69% и 8,22%) и 6,03% в воде в среднем (2 измерения, 5,98% и 6,08%).
Размер водорастворимого InP / ZnS КТ характеризовалась использованием как просвечивающей электронной микроскопии (ПЭМ) и динамического светорассеяния (DLS). ПЭМ-изображения, которые только визуализировать ядро нанокристаллической и оболочку (InP / ZnS), не органических лигандов на поверхности, были захвачены при номинальном увеличении 150,000X. Изображения были проанализированы с помощью Фиджи ImageJ 18 и порог доводили дать бинарных изображений. Минимальные и максимальные диаметры Фере были усреднены, чтобы определить диаметры этих водорастворимых квантовых точек. Эти данные показали, небольшие, относительно монодисперсных КТ со средним диаметром 2,74 ± 0,72 нм (фиг.2А & B). Эффективная гидродинамическая диаметр КТ в воде при рН 7, инкапсулированных в PMAL-й, была измерена с помощью DLS. Должен бытьотметить, что эффективный гидродинамический диаметр с помощью DLS измеряет сольватированной QD, включая органическими лигандами и полимеров на поверхности КТ, а также молекул воды, которые взаимодействуют с ними. Поэтому измерения DLS, как правило, значительно больше, чем измерений, полученных в ТЕМ экспериментов. В этом измерении, считались КТ сферической и в общей сложности 30 измерений были захвачены вычислить эффективный диаметр по объему с использованием БИК программное обеспечение частичных решений. Эти значения были усреднены, обеспечивая средний диаметр 14,8 ± 6,0 нм (рис 2С).
Для того, чтобы определить, есть ли синтезированные InP / ZnS КТ были пригодны для визуализации одиночных молекул, мигает анализ проводили с использованием эпифлуоресцентной микроскопии 8. Хотя это не возможно, чтобы увидеть отдельные КТ с использованием световой микроскопии, анализ "на" и "выключено" государства флуоресценции может быть использована для идентификации секИнгл КТ Puncta в флуоресцентные изображения. Puncta представляющий одну мигающий квантовую точку проявляет состояние «включено», что отличается от "выключено" состоянии. Фильм мигающих КТ (разбавляют до примерно 100 мкм в деионизированной воде) был захвачен с помощью 63x, 1.4 NA, масло-погружение цели фицирована на качестве эпифлуоресцентной микроскопом с соответствующим куба фильтра и ПЗС-камеры. Изображения были получены с 30 мс экспозиции последовательно для 500 кадров. Мигает анализ проводили с помощью анализа среднюю интенсивность одного Puncta (примерно 4 пикселя) в каждом кадре с использованием ImageJ 19 (рис 3а). Отличие разрыв между "на" и "выкл" состояний наших КТ показать свой потенциал для одиночных молекул визуализации (рис 3B).
Взаимодействие КТ InP / ZnS с клетками также была исследована как через токсичности и сотовой интернализации. ДляОба исследования, мыши нейробластомы (n2a) клетки были использованы и все эксперименты проводились в сотовой среде (50/50 D-MEM / Opti-MEM с добавлением 10% эмбриональной телячьей сыворотки и антибиотик / противогрибковым). Анализе 20 трипанового синего токсичность проводили путем инкубации клеток в течение 24 n2a и 48 ч с различными концентрациями КТ. Полученные результаты показывают, незначительное токсичность клеток n2a при концентрациях КТ между 1-5 нМ (Рисунок 4). Для наблюдения QD интернализации, клетки n2a инкубировали с водорастворимыми КТ InP / ZnS в течение 12 ч при обоих 5 и 10 нМ. Изображения клеток, инкубированных с этих КТ, вероятно, свидетельствует локализацию лизосом КТ после 12 ч (рис 5), что согласуется с другими результатами интернализации наночастиц 21.

Рисунок 1. Поглощение и флуоресценция Характеристика InP / ZnS КТ. Поглощение и исправлены спектры флуоресценции InP / ZnS в гексане, возбуждаемых на 533 нм, показывающий максимальную оптическую плотность при 600 нм и полуширину 73 нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
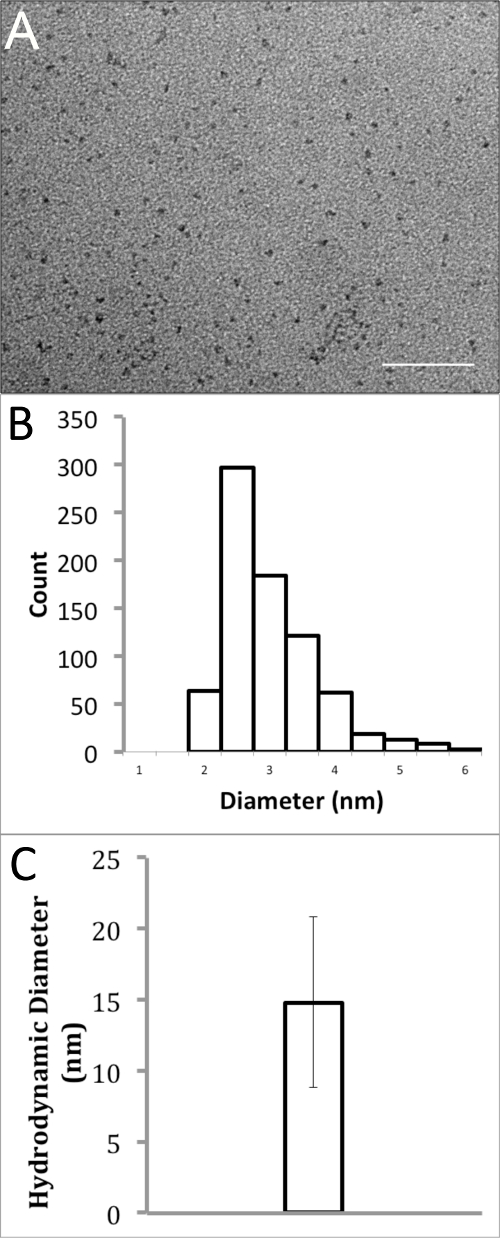
Рисунок 2. Размер Анализ полимерным покрытием InP / ZnS КТ в воде. (А) Передача электронного микроскопа InP / ZnS КТ, растворенных в воде (Шкалы = 50 нм). (Б) Распределение размера частиц гистограмма ТЕА приводит со средним диаметром 2,74 ± 0,72 нм. (C) Динамический анализ светорассеяния InP / ZnS КТ в воде, показывая средний гидродинамический диаметр 14,8 ± 6,0 нм.large.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуре.
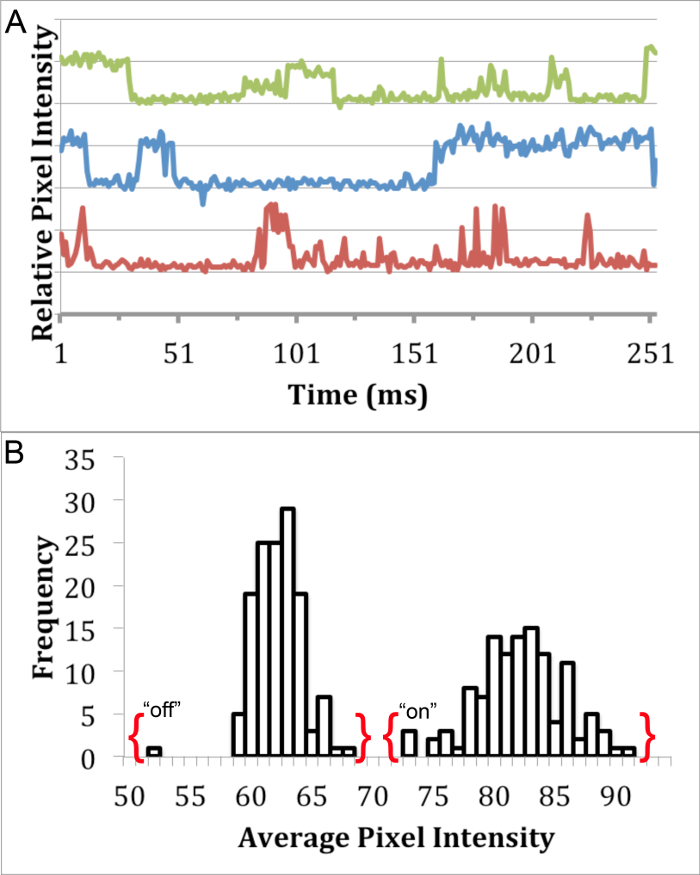
Рисунок 3. мигает Анализ InP / ZnS КТ. Одно флуоресцентного анализа Puncta подробно присутствие отличие "на" и "выключено" заявляет через (А) мигающим профиль InP / ZnS КТ в воде с использованием 460 нм ± 25 нм фильтра возбуждения , 500 нм фильтра длинный пас выбросов и 475 нм дихроичное зеркало, и (Б) гистограмма выставляется бимодальное распределение интенсивности пикселей от одного QD мигающим профиль. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
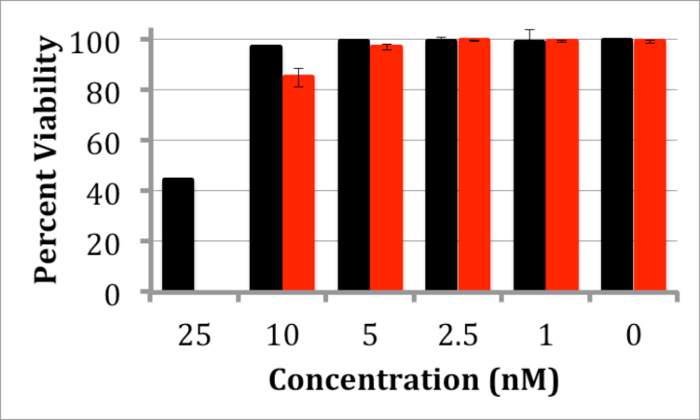
Рисунок 4. Трипановый Голубой Токсичность Количественное определение n2a клеток, обработанных InP / ZnS КТ график, изображающий жизнеспособности клеток n2a после инкубации с InP / ZnS КТ в течение 24 (черный) или 48 часов (красный) с 1 - 25 нм КТ , Незначительное токсичность наблюдается ниже 5 нМ. Столбики ошибок основаны на стандартном отклонении жизнеспособности в 3 различных измерений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
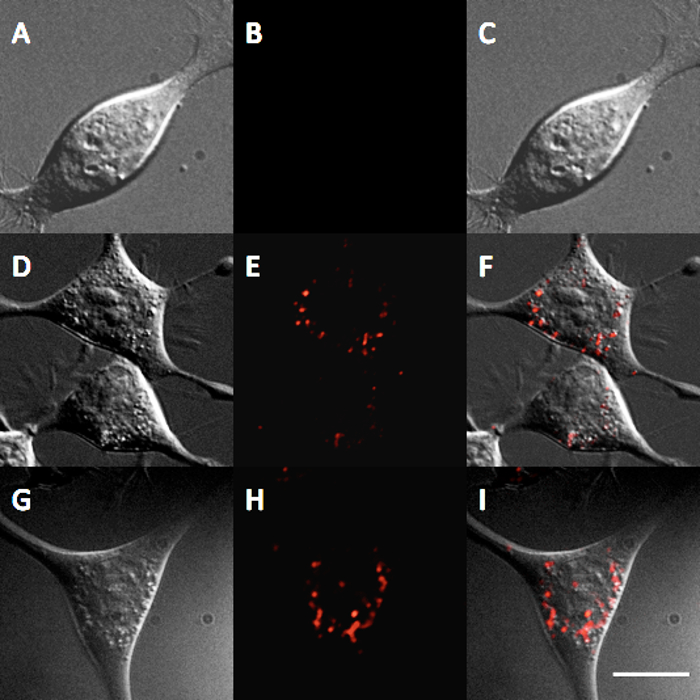
Рисунок 5. Интернализации InP / ZnS КТ в n2a клеток. Флуоресцентная микрофотография, показывающая интернализации InP / ZnS КТ после 12 ч инкубации с 0 контролем нМ (A) DIC (B) QD и (С) наложения, после 12 ч инкубации с 5 нМ КТ (D) ДВС (Е) QD и ( F) Наложение, и после 12 ч инкубации в присутствии 10 нМ КТ (G) DIC (H) QD и (I) наложения. Измерительная линейка = 10 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
Обсуждение
Этот протокол детали синтез высоко флуоресцентных квантовых точек InP / ZnS которые могут быть использованы во многих биологических системах. КТ продукты, синтезированные здесь выставлены единственный пик флуоресценции с центром при 600 нм с полушириной 73 нм (рис 1), что сопоставимо с другими описанными ранее синтезов 12. Время реакции и температура реакции чрезвычайно важные шаги в связи с их глубокое воздействие на качество синтеза QD и повторяемости. После солюбилизации в воде, КТ предпочитала иметь квантовый выход примерно на 6%. Изменение концентрации Время реакции, температуры, или предшественника позволяет настройку размера КТ и длине волны эмиссии, который может быть использован в нескольких спектральных приложений.
Размер и поверхностный заряд чрезвычайно важными факторами, которые необходимо учитывать при использовании наночастиц в биологических системах. Чтобы свести к минимуму нарушение целевых биомолекул, КТ должны поддерживать малый, пнodisperse размер. Кроме того, поверхностный заряд КТ в растворе может быть изменено, чтобы уменьшить неспецифическое связывание направлении непреднамеренных целей. Синтез КТ представленных здесь производится КТ с диаметром 2,74 ± 0,72 нм методом просвечивающей электронной микроскопии (лишь сердцевины и оболочки видны) (Фигуры 2А и 2В). Были найдены водорастворимые КТ, чтобы иметь эффективную гидродинамический диаметр 14,8 ± 6,0 нм, что сравнимо с использованием компакт-диска КТ в настоящее время используются для биологических исследований 22. Поверхностный заряд и функциональность водных КТ может быть модифицирована путем дальнейшей реакции из карбоксилатных химических групп амфифильного полимера.
Мигает анализ был использован для изучения пригодности этих InP / ZnS для визуальных исследований одиночных молекул. Так как это не возможно, чтобы визуализировать отдельные КТ с использованием световой микроскопии, моргание отдельных КТ могут быть использованы для идентификации отдельных частиц. Это мигает явление чередование дискретно &# 34; на "и" выключено "флуоресценции 23 государств, которые могут быть исследованы с помощью средней интенсивности пикселя одного флуоресцентный QD Puncta течением времени флуоресценции следы InP / ZnS КТ Puncta продемонстрировать характеристика." На "и" выкл "государств ( Фигура 3А). Кроме того, нет никакого дублирования между "включено" и "выкл" состояний одной Puncta (фиг.3В), который был использован в предыдущих исследованиях, чтобы отличить одиночные частицы 8.
Дальнейшие эксперименты были использованы для изучения пригодности этих КТ InP / ZnS для сотовых исследований. Анализе трипанового синего токсичность проводили для оценки биосовместимости КТ InP / ZnS. После инкубации в течение 24 часов до 48 часов при концентрациях КТ, начиная от 1-5 нМ наблюдалось незначительным токсичность (рисунок 4), что сопоставимо с исследований токсичности для InP / ZnS КТ 11. Существенной токсичности не наблюдалось белвл 25 нМ; эта концентрация значительно выше, чем требуется для многих биомедицинских применений. Например, рентгеновские снимки, одиночных молекул часто требуют концентрации ПМ КТ зонда маркировать репрезентативного числа поверхностно-клеточных рецепторов связаны 24. Кроме того, n2a клетки инкубировали с КТ при 5 нМ или 10 нМ в течение 12 часов в сотовых СМИ указывают, что КТ усваиваются с помощью эндоцитоза, т.е. КТ продемонстрировать образец точечные окрашивания в клетках (рисунок 5). Эти результаты указывают на пригодность этих InP / ZnS КТ для исследования клеточных процессов.
Этот протокол детали синтез и функционализация водорастворимых КТ InP / ZnS с интенсивным флуоресценции, относительно небольшой размер-дисперсности и биологической совместимости. Высокое качество этих продуктов КТ обозначается визуализации одиночных КТ в флуоресцентной микроскопии, который демонстрирует, что они подходят для одной-moleculе изображений. Предполагается, что эти CD-фри КТ являются потенциально гораздо менее токсичны для биологических систем, изучаемых, а также исследователей, изучающих их. Как таковой, использование этих КТ В основе за биомедицинских применений является разумным альтернативой КТ на компакт-дисках.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы благодарят химический факультет и выпускник колледжа в Государственном университете штата Миссури за поддержку этого проекта. Мы также признаем микроскопии Лаборатория электронов при Национальной лаборатории Фредерика по исследованию рака за использование их просвечивающего электронного микроскопа и углерода покрытием сетки.
Материалы
| Name | Company | Catalog Number | Comments |
| Oleylamine | Acros | 129540010 | |
| Zinc(II) chloride | Sigma | 030-003-00-2 | |
| Indium(III) chloride | Chem-Impex | 24560 | |
| Tris(dimethylamino)phosphine | Encompass | 50-901-10500 | |
| 1-dodecanethiol | Acros | 117625000 | |
| Hexanes | Fisher Sci | H292-4 | |
| Acetone | TransChemical | UN 1090 | |
| Zinc Stearate | Aldrich Chem | 307564-1KG | |
| Tetrahydrofuran | Acros | 34845-0010 | |
| Molecular Water | Fisher Sci | BP2470-1 | |
| Poly(maleic anhyrdride-alt-1-tetradecene), 3-(dimethylamino)-1-propylamine derivative | Sigma | 90771-1G | |
| Boric acid | Fisher Sci | BP168-500 | |
| Sodium Tetraborate Decahydrate | Fisher Sci | BP175-500 | |
| Rhodamine B | Aldrich Chem | R95-3 | |
| Nitrogen gas | Airgas | UN1066 | |
| Trypan blue | Thermo Sci | SV30084.01 | |
| 3 ml plastic Luer-lock syringe | BD | 309657 | |
| Luer-lock Needle | Air-Tite | 8300014471 | 4 inch, 22 gauge |
| 50 ml polypropyene centrifuge tube | Falcon | 352098 | |
| 250 ml centrifuge bottle | Thermo Sci | 05-562-23 | Nalgene PPCO |
| 5 ml centrifuge tubes | Argos-Tech | T2076 | |
| 1.5 ml microcentrifuge tubes | Bio Plas | 4150 | |
| 0.1 μm Syringe filter | Whatman | 6786-1301 | Puradisc 13 mm nylon filter |
| Slide-A-Lyzer MINI Dialysis Unit | Thermo Sci | 69590 | 20,000 MWCO |
| Rotary Evaporator | Heidolph | ||
| Centrifuge 5072 | Eppendorf | Swinging Bucket with 50 ml tube adapters | |
| Lambda 650 UV/VIS Spectrometer | Perkin Elmer | UV-Vis Spectrophotometer | |
| LS 55 Fluorescence Spectrometer | Perkin Elmer | Fluorometer | |
| Axio Observer.A1 | Zeiss | epifluorescence microscope | |
| AxioCam MRm | Zeiss | CCD Camera | |
| Tecnai TF20 Microscope | FEI | Transmisison Electron Miscroscope | |
| TEM Eagle CCD | FEI | TEM CCD Camera | |
| NanoBrook Omni DLS | Brookhaven | Dynamic Light Scattering Instrument |
Ссылки
- Alivisatos, A. P. Semicondictor clusters, nanocrystals, and quantum dots. Science. 271 (5251), 933-937 (1996).
- Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307 (5709), 538-544 (2005).
- Jaiswal, J. K., Mattoussi, H., Mauro, J. M., Simon, S. M. Long-term multiple color imaging of live cells using quantum dot bioconjugates. Nat. Biotechnol. 21 (1), 47-51 (2009).
- Deerinck, T. J. The application of fluorescent quantum dots to confocal, multiphoton, and electron microscopic imaging. Toxicol. Pathol. 36 (1), 112-116 (2008).
- Smith, A. M., Duan, H., Mohs, A. M., Nie, S. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60 (11), 1226-1240 (2008).
- Jamieson, T., et al. Biological applications of quantum dots. Biomaterials. 28 (31), 4717-4732 (2007).
- Lidke, D. S., Arndt-Jovin, D. J. Imaging takes a quantum leap. Physiology. 19, 322-325 (2004).
- Fichter, K. M., Flajolet, M., Greengard, P., Vu, T. Q. Kinetics of G-protein-couple receptor endosomal trafficking pathways revealed by single quantum dots. Proc. Natl. Acad. Sci. U.S.A. 107 (43), 18658-18663 (2010).
- Smith, A. M., Ruan, G., Rhyner, M. N., Nie, S. Engineering luminescent quantum dots for in vitro molecular and cellular imaging. Ann. Biomed. Eng. 34 (1), 3-14 (2006).
- Derfus, A. M., Chan, W. C. W., Bhatia, S. N. Probing the cytotoxicity of semiconductor quantum dots. Nano Lett. 4 (1), 11-18 (2004).
- Brunetti, V., et al. InP/ZnS as a safer alternative to CdSe/ZnS core/shell quantum dots: in vitro and in vivo toxicity assessment. Nanoscale. 5 (1), 307-317 (2013).
- Song, W., et al. Amine-derived synthetic approach to color-tunable InP/ZnS quantum dots with high fluorescent qualities. J. Nanopart. Res. 15 (1750), (1750).
- Dabbousi, B. O., et al. (CdSe)ZnS core-shell quantum dots: Synthesis and characterization of a size series of highly luminescent nanocrystallites. J. Phys. Chem. B. 101 (46), 9463-9475 (1997).
- Micic, O. I., Curtis, C. J., Jones, K. M., Sprague, J. R., Nozik, A. J. Synthesis and characterization of InP quantum dots. J. Phys. Chem. 98 (19), 4966-4969 (1994).
- Qi, L., Gao, X. Quantum dot-amphipol nanocomplex for intracellular delivery and realtime imaging of siRNA. ACS Nano. 2 (7), 1403-1410 (2008).
- Xie, R., Zheng, L., Peng, X. Nucleation kinetics vs chemical kinetics in the initial formation of semiconductor nanocrystals. J. Am. Chem. Soc. 131 (42), 15457-15466 (2009).
- Williams, A. T. R., Winfield, S. A., Miller, J. N. Relative fluorescence quantum yields using a computer-controlled luminescence spectrometer. Analyst. 108, 1067-1071 (1983).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Schnieder, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nat. Methods. 9, 671-675 (2012).
- Jin, Y., Kannan, S., Wu, M., Zhao, J. X. Toxicity of luminescent silica nanoparticles to living cells. Chem. Res. Toxicol. 20 (8), 1126-1133 (2007).
- Corazzari, I., Gilardino, A., Dalmazzo, S., Fubini, B., Lovisolo, D. Localization of CdSe/ZnS quantum dots in the lysosomal acidic compartment of cultured neurons and its impact on viability: potential role of ion release. Toxicol. In Vitro. 27 (2), 752-759 (2013).
- Pons, T., Uyeda, H. T., Medintz, I., Mattoussi, H. Hydrodynamic dimensions, electrophoretic mobility, and stability of hydrophilic quantum dots. J. Phys. Chem. B. 110 (41), 20308-20316 (2006).
- Durisic, N., Wiseman, P., Grutter, P., Heyes, C. D. A common mechanism underlies the dark fraction formation and fluorescence blinking of quantum dots. ACS Nano. 3 (5), 1167-1175 (2009).
- Vermehren-Schmaedick, A., et al. Heterogeneous intracellular trafficking dynamics of brain-derived neurotropic factor complexes in the neuronal soma revealed by single quantum dot tracking. PLoS ONE. 9 (4), e95113 (2014).
Erratum
Formal Correction: Erratum: Synthesis of Cd-free InP/ZnS Quantum Dots Suitable for Biomedical Applications
Posted by JoVE Editors on 2/29/2016. Citeable Link.
A correction was made to: Synthesis of Cd-free InP/ZnS Quantum Dots Suitable for Biomedical Applications. There was an error with an author's given name. The author's name was corrected to:
Katye M. Fichter
from:
Kathryn M. Fichter
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены