Method Article
Síntese de Cd-livre InP / ZnS Quantum Dots Indicado para aplicações biomédicas
Neste Artigo
Erratum Notice
Resumo
In this protocol, the synthesis of Cd-free InP/ZnS quantum dots (QDs) is detailed. InP-based QDs are gaining popularity due to the toxicity of Cd2+ ions that may be released through nanoparticle degradation. After synthesis, QDs are solubilized in water using an amphiphilic polymer for use in biomedical applications.
Resumo
Fluorescent nanocrystals, specifically quantum dots, have been a useful tool for many biomedical applications. For successful use in biological systems, quantum dots should be highly fluorescent and small/monodisperse in size. While commonly used cadmium-based quantum dots possess these qualities, they are potentially toxic due to the possible release of Cd2+ ions through nanoparticle degradation. Indium-based quantum dots, specifically InP/ZnS, have recently been explored as a viable alternative to cadmium-based quantum dots due to their relatively similar fluorescence characteristics and size. The synthesis presented here uses standard hot-injection techniques for effective nanoparticle growth; however, nanoparticle properties such as size, emission wavelength, and emission intensity can drastically change due to small changes in the reaction conditions. Therefore, reaction conditions such temperature, reaction duration, and precursor concentration should be maintained precisely to yield reproducible products. Because quantum dots are not inherently soluble in aqueous solutions, they must also undergo surface modification to impart solubility in water. In this protocol, an amphiphilic polymer is used to interact with both hydrophobic ligands on the quantum dot surface and bulk solvent water molecules. Here, a detailed protocol is provided for the synthesis of highly fluorescent InP/ZnS quantum dots that are suitable for use in biomedical applications.
Introdução
Os pontos quânticos (QDs) são semicondutor nanocristais que exibem propriedades fluorescentes quando irradiado com luz 1. Devido ao seu pequeno tamanho (2-5 nm), que é semelhante a muitas biomoléculas grandes, e facilidade de biofunctionalization, QDs são uma ferramenta extremamente atraente para aplicações biomédicas. Eles têm encontrado utilização na rotulagem biológica, imagem única molécula-célula viva, a entrega de drogas, imagem in vivo, detecção de patógenos e rastreamento de celular, entre muitos outros usos 2-8.
QDs baseada em CD foram mais comumente usados em aplicações biomédicas devido à sua intensa fluorescência e larguras de pico de emissão estreitas 9. No entanto, as preocupações foram levantadas devido ao potencial de toxicidade do Cd 2+ 10 que pode ser introduzida através da degradação das nanopartículas. Recentemente, QDs baseados em InP têm sido explorados como uma alternativa para QDs baseadas em CD porque eles mantêm muitas características de fluorescênciade QDs Cd-baseado e pode ser mais biocompatível 11. QDs baseadas em CD foram encontrados para ser significativamente mais tóxica do que QDs baseados em InP em ensaios in vitro para concentrações tão baixas quanto 10 pM, após apenas 48 h 11.
A cor de emissão de fluorescência de QDs é tamanho-ajustável 1. Isto é, como o tamanho das QD aumenta, a emissão de fluorescência é vermelho-deslocado. O tamanho e dimensão dispersibilidade dos produtos QD pode ser modificada alterando a temperatura, duração da reacção, ou em condições de concentração de precursor durante a reacção 12. Embora o pico de emissão de InP QDs é tipicamente mais ampla e menos intensa do que QDs baseadas em CD, InP QDs pode ser feita numa grande variedade de cores, destinadas a evitar sobreposição espectral, e são suficientemente intensa para a maioria das aplicações biomédicas 12. A síntese detalhada neste protocolo produz QDs com um pico de emissão vermelha centrado em 600 nm.
Várias medidas são tomadas afsíntese ter dos núcleos QD para manter a integridade óptica dos QDs e torná-los compatíveis para aplicações biológicas. A superfície do núcleo QD deve ser protegida contra a oxidação ou defeitos superficiais, que podem causar têmpera; portanto, uma concha ZnS é revestido sobre o núcleo para produzir InP / ZnS (core / shell) qds 13. Este revestimento tem sido demonstrado para proteger o fotoluminescência do produto QD. A presença de iões de zinco, durante a síntese InP QD foi mostrado para limitar os defeitos de superfície, bem como a distribuição do tamanho de redução 12. Mesmo com a presença de Zn2 + no meio de reacção, a síntese de InZnP são altamente improvável 12. Depois do revestimento, resultantes QDs InP / ZnS são revestidos em ligandos hidrofóbicos, tais como o óxido de trioctilfosfina (TOPO) ou oleilamina 12,14. Um polímero anfifílico pode interagir com ligandos hidrófobos na superfície do QD, bem como moléculas de água em massa para conferir solubilidade em água 15. polímeros anfifílicos com carbogrupos químicos xylate pode ser utilizado como "alças" químicas para funcionalizar ainda mais os QDs.
Este protocolo detalha a síntese e funcionalização de solúveis em água InP / ZnS QDs com emissão de fluorescência muito intenso e relativamente pequeno em tamanho dispersity. Estes QDs são potencialmente menos tóxico do que QDs CdSe / ZnS vulgarmente utilizados. Nisto, a síntese de InP / ZnS QDs fornece uma alternativa prática para QDs baseadas em CD para aplicações biomédicas.
Protocolo
1. Síntese de fosfeto de índio / Zinc Sulfide (INP / ZnS) Quantum Dots
- Síntese de fosfeto de índio (InP) Quantum Dot Cores
- Caber um fundo redondo de 100 ml, 3-neck, garrafa com um condensador de 12 polegadas. Adicionar 30 ml de oleilamina (OLA), cloreto de 0,398 g de índio (III) (incl 3), (II), cloreto de 0,245 g de zinco (ZnCl2) e agita-se durante a evacuação, à TA utilizando um vácuo durante 1 hora. A solução deve aparecer incolor com um precipitado branco.
- Usando uma manta de aquecimento, com um termopar e controlador de temperatura proporcional-integral-derivativo (PID), aumentar a temperatura da solução a 120 ° C. Evacuar a solução sob vácuo durante 20 min para remover as impurezas de baixo ponto de ebulição que podem afectar o crescimento do núcleo.
Nota: Embora seja possível utilizar um banho de areia e termómetro, usando uma manta de aquecimento e PID aumenta a uniformidade e a reprodutibilidade dos produtos da reacção. - Sob um gás inerte (por exemplo,, N2), refluxo a solução e aumentar a temperatura para 220 ° C durante 15 min. O InCl3 e ZnCl2 dissolver completamente, resultando numa solução amarelo pálida. Permitir que a temperatura estabilize, durante 10 min.
- Purgar a, 3 ml seringa de plástico descartável e 4 polegadas, 22 G agulha com gás nitrogênio. Usando a seringa, para entregar rapidamente 0,5 ml de tris (dimetilamino) fosfina (TDMAP) à solução de InCl3. A temperatura da solução diminui ligeiramente e retorna a 220 ° C. A solução muda de transparente, amarelo pálido a opaco, preto.
- Após 9,5 min, remover o balão de reacção a partir da manta de aquecimento até que a temperatura diminui abaixo de 200 ° C. Para proteger a integridade dos núcleos de InP, seguir diretamente para a etapa de revestimento de ZnS em 1.2.1.
- Síntese de Sulfeto de zinco Conchas (ZnS) quantum dot
- Colocar o balão de reacção a partir do passo 1.1.5 em uma manta de aquecimento e estabilizar o temperatura a 200 ° C. Adiciona-se lentamente 3,58 g dodecanotiol (DDT) ao longo de 15 seg para a solução contendo InP QDs. Permitir que a solução reagir durante 1 h.
Nota: a espessura da casca de ZnS pode ser variado aumentando ou diminuindo a quantidade de estearato de zinco adicionado no passo 1.2.4. Alterando a quantidade de ZnCl2 ou dodecanotiol em passos 1.1.1 e 1.2.1 podem ter impacto significativo na qualidade de QDs alterando a cinética da reacção.- Depois, remover o balão de reacção a partir da manta de aquecimento e deixar a solução arrefecer até cerca de 60 ° C.
- Uma vez que a solução de InP / ZnS atinge ~ 60 ° C, adicionar 10 ml de hexanos e transferir toda a solução de cerca de 45 ml para um tubo de centrífuga de polipropileno de 50 ml. Centrifugar a amostra (3000 xg durante 10 min) para remover os precursores sólidos que não reagiram.
- Transferir cuidadosamente o sobrenadante para um frasco de 250 ml de centrífuga de polipropileno, adicionar 200 ml de acetona, e a solução de centrífuga (3.000 xg durante 10 min) para precipitar QDs InP / ZnS. Este volume também pode ser dividido uniformemente em quatro tubos de 50 ml para centrifugação se uma centrífuga com as necessárias rotor / acessórios não está disponível. Decantar o sobrenadante e o sedimento secar QD cuidadosamente com azoto gasoso para remover a acetona.
- Volte a suspender as QDs em 20 ml OLA usando sonicação, transferir para um fundo redondo de 50 ml, 3-pescoço, frasco contendo 0,474 g estearato de zinco, e mexa. Evacuar a solução sob vácuo durante 20 min à temperatura ambiente.
- Sob atmosfera de azoto, aumentar a temperatura para 180 ° C e deixar a reacção prosseguir durante 3 horas. Embora não existam alterações visuais perceptíveis à solução de reacção que ocorrem durante esta reacção, a adição de estearato de zinco aumenta a espessura da casca de ZnS, aumentando, assim, QY, melhorando a passivação de superfície 12. QDs. Uma vez que a reacção está completa, remover o balão da manta de aquecimento e deixar a solução arrefecer até cerca de 60 ° C.
- Uma vez que a solução que InP / ZnSno ~ atinge 60 ° C, adicionar 20 ml de hexanos e transferir para um tubo de centrífuga de polipropileno de 50 ml. Centrifugar a amostra (3000 xg durante 10 min) para remover o estearato de zinco que não reagiu.
- Transferir cuidadosamente o sobrenadante para um frasco de centrífuga de polipropileno de 250 ml, adicionar 200 ml de acetona, e centrifuga-se a solução (3000 xg durante 10 min) para precipitar InP / ZnS QDs. Cuidadosamente decantar o sobrenadante e completamente seco com azoto gasoso para remover a acetona.
- Dissolve-se o sedimento InP / ZnS QD em 30 ml de hexano. Vortex e sonicar a solução rapidamente para assegurar a dispersão completa.
- Repita os passos de purificação 1.2.6-1.2.8 mais duas vezes para assegurar a remoção completa do excesso de ligandos orgânicos. As interacções entre o polímero anfifílico e o QD na etapa 1.2 pode ser comprometida, na presença de ligandos em excesso.
- Com cálculos detalhado por Xie, et al. 16, determinar o tamanho ea concentração dos QDs InP / ZnS sintetizados usando UV-Vis.
Nota: A característica espectral importante para esta análise é o ombro do pico de absorção. O valor do comprimento de onda e da absorvância máxima deste ombro é utilizada para calcular o tamanho e a concentração dos QDs, respectivamente. Esta reacção produz tipicamente cerca de 5 umol de QDs com um pico de emissão a 600 nm. Para sintetizar QDs de cores diferentes, a duração e / ou a temperatura da reacção pode ser alterada. Um maior tempo de reacção e / ou temperatura mais elevada dos resultados solução num pico de emissão vermelho-deslocado. Por exemplo, aumentando a temperatura da reacção a 240 ° C e mantendo o tempo de reacção de 10 min irá resultar em QDs com um pico de 680 nm no máximo as emissões. Da mesma forma, reduzindo o tempo de reacção de 2 min e dobrando o cloreto de zinco utilizado irá resultar em QDs com um pico de emissão máxima 470 nm. Estes QDs InP / ZnS são estáveis durante pelo menos um mês a 4 ° C no escuro sob atmosfera de gás inerte.
- Colocar o balão de reacção a partir do passo 1.1.5 em uma manta de aquecimento e estabilizar o temperatura a 200 ° C. Adiciona-se lentamente 3,58 g dodecanotiol (DDT) ao longo de 15 seg para a solução contendo InP QDs. Permitir que a solução reagir durante 1 h.
2. águaSolubilização de InP / ZnS Quantum Dots Usando um polímero anfifílico
- A solubilização de água
- Usando os QDs InP / ZnS do passo 1.2.10, diluir uma parte dos QDs com hexanos para se obter 1 ml de 1 uM QDs.
- Num tubo de centrífuga, transferir 0,25 ml de InP / ZnS QDs em cada tubo. Adicionar 1 ml de acetona ou metanol para o tubo de centrífuga e centrifuga-se (3000 xg durante 10 min). remover cuidadosamente o sobrenadante e dissolve-se cada um precipitado em 1 ml de tetra-hidrofurano (THF).
- Transfira os QDs InP / ZnS dissolvidos em THF em um frasco de 100 ml de fundo redondo e diluir com 16 ml THF. Para reduzir o número de agregados em solução, sonicar as QDs durante 5-10 min.
- Dissolve-se 30 mg de poli (maleico alt andhydride- -1-octadeceno), 3- (dimetilamino) -1-propilamina (PMAL-d) em 10 ml de água de grau molecular. Banho-maria de ultra-sons ou agitação suave até a solução estar translúcida é suficiente para dissolver completamente o polímero. outilização de vortex ou agitação vigorosa pode produzir muitas bolhas, o que dificulta a interacção do polímero com o QD. Adicionar a solução de polímero de 10 ml para os 100 ml balão de fundo redondo contendo InP / ZnS QDs em THF.
- Evapora-se a solução de THF de QD / polímero utilizando um evaporador rotativo. Colocar o balão num banho de gelo enquanto evaporação para facilitar a interacção entre o polímero e QD. Dependendo da força do vácuo, a maioria de THF é evaporado após 10 minutos e a solução aparece turvo.
- Uma vez que a solução é evaporada para 10 ml, retirar o balão do evaporador rotativo e adicionar 30 ml de água de grau molecular. Devolver o balão no evaporador rotativo e continuar a evaporar-se a 2 ml. Esta etapa evaporação final pode levar várias horas; assegurar o banho de gelo é mantida.
- Remover os QDs InP / ZnS solúveis em água a partir do balão de fundo redondo com uma pipeta. Filtra-se a solução QD utilizando uma seringa de plástico de 3 ml ligado a um SY de nylon de 0,1 umRinge filtrar para um tubo de centrífuga de 5 ml.
- Coloque as QDs em uma unidade de diálise de membrana de MWCO 20000 e diálise contra tampão de borato 0,05 M pH 8,5 para remover o excesso de polímero. (Lentamente adicionar tetraborato decahidrato de sódio 0,05 M a 0,05 M de ácido bórico, com agitação vigorosa, até que o pH é de 8,5 a tornar esta solução tampão de borato.) Utilizando um concentrador de vácuo, concentrar os QDs em tampão de borato a 1 ml.
- Para o armazenamento, purgar a solução com azoto antes da selagem com Parafilm. Os QDs InP / ZnS solúveis em água são estáveis durante pelo menos 4 meses a 4 ° C no escuro.
- Usando os QDs InP / ZnS do passo 1.2.10, diluir uma parte dos QDs com hexanos para se obter 1 ml de 1 uM QDs.
Resultados
Os núcleos de InP não revestidos não demonstram fluorescência visível substancial a olho nu. No entanto, InP / ZnS (core / shell) pontos quânticos parecem apresentam forte fluorescência por olho sob irradiação UV. A fluorescência de InP / ZnS QDs foi caracterizado usando espectroscopia de fluorescência. O espectro de fluorescência de QDs em hexanos (Figura 1) excitado a 533 nm demonstra um pico principal centrado a 600 nm com uma largura total a meia altura (FWHM) de 73 nm. Enquanto absorvância (0,2) deslocamento na Figura 1 poderia implicar QDs espalhamento de luz, e, portanto, a presença de agregados QDs, piscando a análise (ver infra) indicam que a maioria dos QDs são individuais, ou grupos muito pequenos, de QDs. Após revestimento com o polímero anfifílico pMAL-d, o rendimento quântico de InP / ZnS QDs foi investigada através da comparação da intensidade de fluorescência integrada dos QDs com Rodamina B como um padrão 17. O rendimento quântico de QDs em hexanos foi ddeterminado de ser de 7,96%, em média (2 medições, 7,69% e 8,22%) e 6,03% em água, em média (2 medições, 5,98% e 6,08%).
O tamanho de solúvel em água InP / ZnS QDs foi caracterizada utilizando microscopia electrónica de transmissão (TEM) e dispersão de luz dinâmica (DLS). MET, que só visualizar o núcleo nanocristais e shell (INP / ZnS), ligantes não orgânicos na superfície, foram capturados em uma ampliação nominal de 150,000X. As imagens foram analisadas utilizando o ImageJ Fiji 18 e o limiar foi ajustada para se obter imagens binárias. Os diâmetros máximo e mínimo de Feret-se a média para determinar os diâmetros destas QDs solúveis em água. Estes dados demonstraram pequenas QDs, relativamente monodispersas com um diâmetro médio de 2,74 ± 0,72 nm (Figuras 2A e B). O diâmetro hidrodinâmico eficaz dos QDs em água a pH 7, encapsulados em pMAL-d, foi medida usando a partir de DLS. Deveria sernotar-se que o diâmetro hidrodinâmico eficaz através DLS mede a QD solvatada, incluindo ligantes orgânicos e polímeros sobre a superfície do qd, bem como moléculas de água que interagem com eles. Portanto, as medidas de DLS são geralmente muito maiores do que as medições obtidos em experiências de MET. Nesta medição, foram assumidos QDs para ser de forma esférica e um total de 30 medições, foram capturadas para calcular o diâmetro efectivo em volume utilizando o software BIC soluções parciais. Estes valores foram em média, proporcionando um diâmetro médio de 14,8 ± 6,0 nm (Figura 2C).
A fim de determinar se os QDs InP / ZnS sintetizados foram adequado para imagens única molécula, piscando análise foi realizada usando microscopia de epifluorescência 8. Embora não seja possível ver QDs individuais utilizando microscopia de luz, a análise de "ligado" e "desligado" estados de emissão de fluorescência pode ser utilizado para identificar single QDs puncta em imagens de fluorescência. A puncta representando um único ponto quântico piscando apresenta um estado "ligado" que se diferencia do estado "off". Um filme de QDs piscando (diluída para cerca de 100 pM em água deionizada) foi capturado usando uma 63X, 1,4 NA, objectiva de imersão em óleo montado em um microscópio de epifluorescência, com um cubo de filtro apropriado e câmera CCD. As imagens foram capturadas com 30 exposição ms consecutivamente para 500 frames. Intermitente análise foi realizada por meio da análise da intensidade média de um único ponto lacrimal (cerca de 4 pixels) em cada quadro usando 19 ImageJ (Figura 3A). A diferença distinta entre o "on" e "off" estados de nossos QDs mostrar o seu potencial para uma única molécula de imagiologia (Figura 3B).
A interacção dos QDs InP / ZnS com células foi também investigada através de ambos toxicidade e internalização celular. Paraambos os estudos, as células de neuroblastoma de ratinho (N2a) foram usados e todas as experiências foram realizadas em meio celular (50/50 D-MEM / Opti-MEM suplementado com soro bovino fetal a 10% e antibiótico / antimicótico). Um ensaio de toxicidade de azul de tripano 20 foi realizada por incubação de células N2a para 24 e 48 horas com concentrações variáveis de QDs. Os resultados demonstram toxicidade insignificante de células N2a em concentrações entre QD 1-5 nM (Figura 4). Para observar QD internalização, as células foram incubadas com N2a QDs InP / ZnS solúvel em água por 12 horas a ambos 5 e 10 nM. Imagens de células incubadas com estas QDs parece demonstrar uma localização lisossomal de QDs após 12 horas (Figura 5), o que é consistente com outros resultados internalização de nanopartículas 21.

Figura 1. A absorvância e fluorescência de Caracterização InP / ZnS QDs. Absorvância e corrigidos espectros de emissão de fluorescência de InP / ZnS em hexano excitados a 533 nm, mostrando uma absorção máxima a 600 nm e uma FWHM de 73 nm. Por favor clique aqui para ver uma versão maior desta figura.
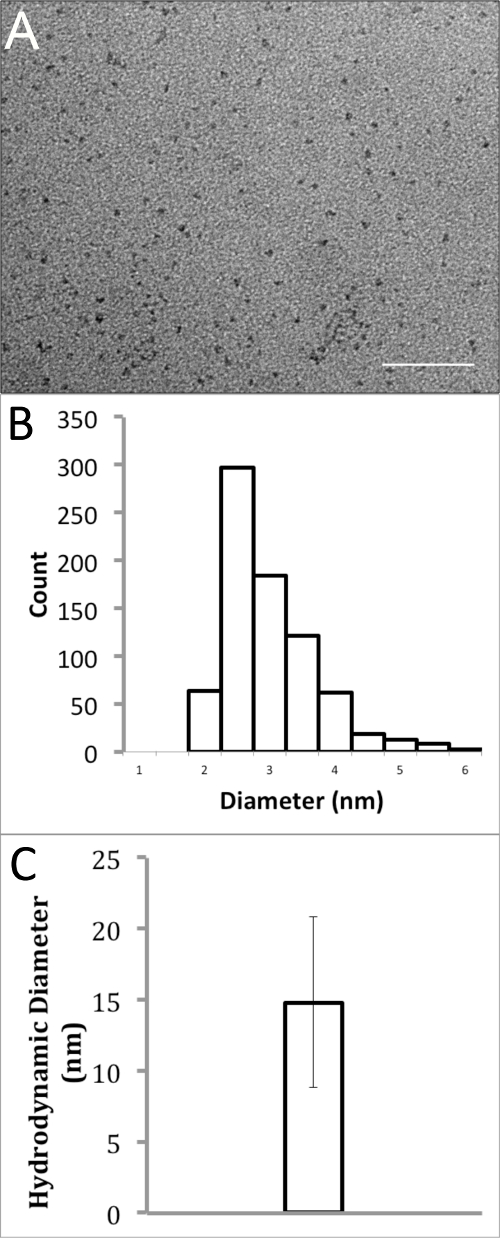
Figura 2. Análise de Tamanho de polímero revestidas de QDs de InP / ZnS em água. (A) Transmissão elétron micrografia de QDs de InP / ZnS dissolvidos em água (barra de escala = 50 nm). (B) o tamanho da partícula de distribuição do histograma de MET resulta com um diâmetro médio de 2,74 ± 0,72 nm. (C) Análise de espalhamento de luz dinâmica de InP / ZnS QDs na água, mostrando um diâmetro hidrodinâmico médio de 14,8 ± 6,0 nm.large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
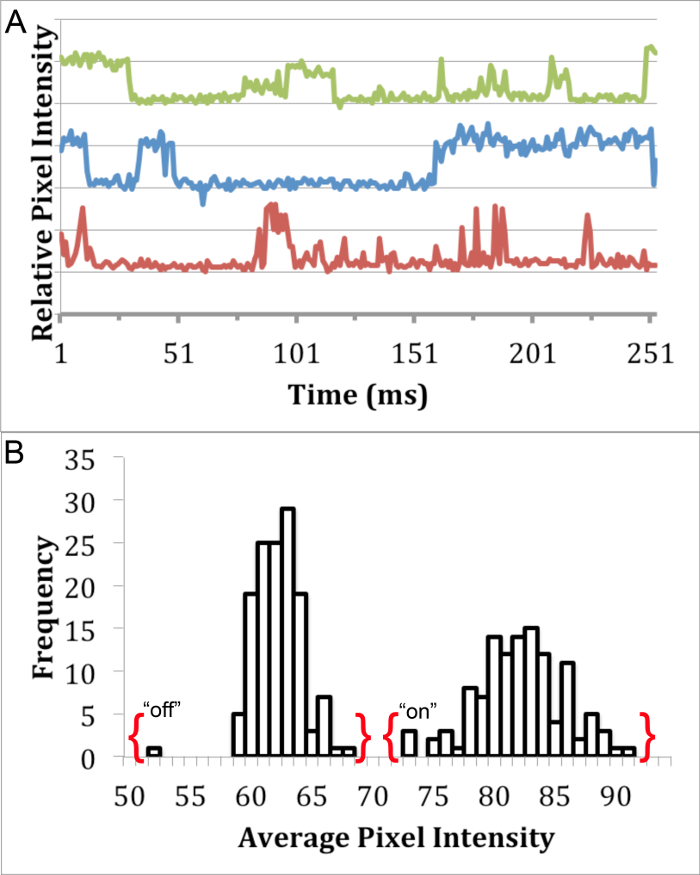
Figura 3. Piscando Análise de InP / ZnS QDs. Análise puncta fluorescente único detalhando a presença de distintas "on" e "off", afirma a (A) um perfil piscar de InP / ZnS QDs em água usando 460 nm ± 25 nm filtro de excitação , 500 nm filtro de passe longo de emissão, e 475 nm espelho dicróico, e (B) um histograma mostrando a distribuição bimodal de intensidade de pixel de um QD perfil piscar. por favor clique aqui para ver uma versão maior desta figura.
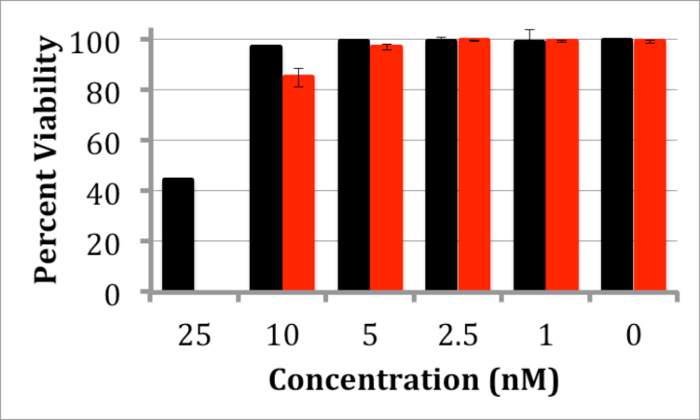
Figura 4. Azul de Tripano Toxicidade Ensaio de célula N2A tratados com InP / ZnS QDs gráfico que representa a viabilidade das células N2a após incubação com InP / ZnS QDs para 24 (preto) ou 48 h (vermelho) com 1 - 25 nm QDs . toxicidade desprezável é observado abaixo de 5 nM. As barras de erro são baseados em desvio padrão de viabilidade em 3 diferentes medições. Por favor clique aqui para ver uma versão maior desta figura.
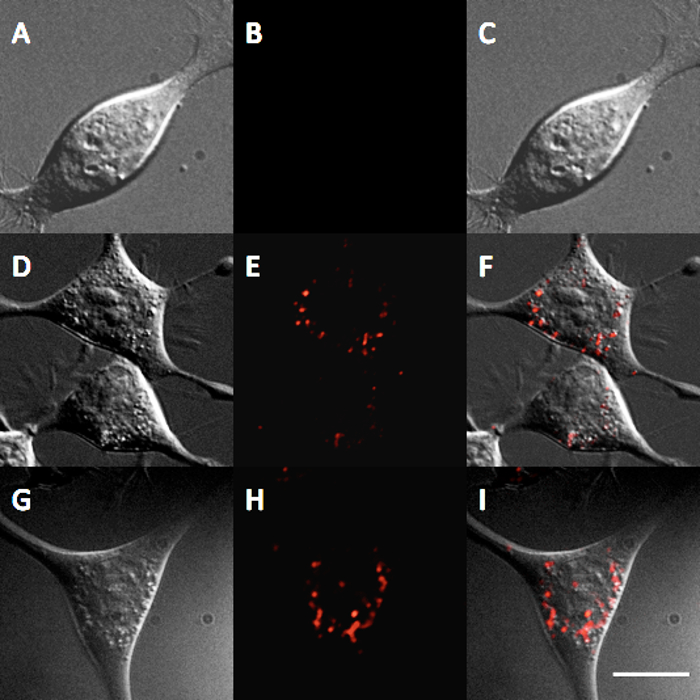
Figura 5. A internalização de InP / ZnS QDs em células N2a. Micrografia de fluorescência mostrando a internalização de InP / ZnS QDs após 12 h de incubação com 0 nM de controlo (A), DIC (B) QD, e sobreposição (C), após 12 h de incubação com 5 nM QDs DIC (D) (e) QD, e ( F) sobreposição e, após 12 horas de incubação com 10 nm QDs (G) DIC (H) QD, e I) sobreposição (. Barra de escala = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo detalha a síntese das altamente fluorescentes QDs InP / ZnS que podem ser utilizados em muitos sistemas biológicos. Os produtos sintetizados QD aqui exibiu um único pico de emissão de fluorescência centrada a 600 nm com um FWHM de 73 nm (Figura 1), que é comparável a outras sínteses descritas anteriormente 12. O tempo de reacção e temperatura da reacção são extremamente passos cruciais, devido ao seu profundo efeito sobre a qualidade de síntese QD e repetibilidade. Após solubilização em água, os QDs estavam determinados a ter um rendimento quântico de aproximadamente 6%. Variação da concentração de tempo de reacção, temperatura, ou precursor permite o ajuste do tamanho QD e comprimento de onda de emissão, o qual pode ser utilizado em aplicações multi-espectrais.
Tamanho e carga de superfície são fatores extremamente importantes a considerar quando se utiliza nanopartículas em sistemas biológicos. Para minimizar a perturbação de biomoléculas-alvo, QDs deve manter um pequeno, montamanho odisperse. Além disso, a carga de superfície das QDs em solução pode ser modificada para reduzir a ligação não específica no sentido de alvos não intencionais. A síntese de QDs aqui apresentados produzida QDs com um diâmetro de 2,74 ± 0,72 nm por TEM (apenas o núcleo e casca são visíveis) (Figuras 2A e 2B). QDs solúveis em água foram encontrados a ter um diâmetro hidrodinâmico eficaz de 14,8 ± 6,0 nm, o que é comparável ao QDs baseadas em CD actualmente utilizados para estudos biológicos 22. A carga de superfície e a funcionalidade de QDs aquosas podem ser modificados por reacção adicional dos grupos químicos de carboxilato do polímero anfifílico.
análise piscando foi usado para explorar a adequação destes InP / ZnS para estudos de imagem única molécula. Uma vez que não é possível visualizar QDs individuais usando microscopia de luz, o piscar de QDs individuais podem ser usados para identificar partículas individuais. Este fenómeno piscar é a alternância entre de discreta &# 34; on "e" off "fluorescência afirma 23, que podem ser investigados usando a intensidade média dos pixels da única puncta fluorescente QD ao longo do tempo Os traços de fluorescência de InP / ZnS QD puncta demonstrar característica." On "e" Estados off "( Figura 3A). Além disso, não existe qualquer sobreposição entre o "ligado" e "desligado" estados de um único ponto lacrimal (Figura 3B), que foi usado em estudos anteriores para distinguir partículas individuais 8.
Outras experiências foram usadas para explorar a adequação destes QDs InP / ZnS para estudos celulares. Um ensaio de toxicidade de azul de tripano foi realizada para avaliar a biocompatibilidade dos QDs InP / ZnS. Após incubação durante 24 horas até 48 horas, em concentrações que variam QD 1-5 nM, foi observada toxicidade desprezável (Figura 4), o que é comparável aos estudos de toxicidade para InP / ZnS QDs 11. toxicidade substancial não foi observado below 25 nM; esta concentração é muito maior do que o necessário para muitas aplicações biomédicas. Por exemplo, estudos única molécula de imagem muitas vezes exigem concentrações MP dos sonda QD para rotular um número representativo de receptores celulares ligados à superfície 24. Além disso, as células incubadas com N2a QDs a 5 nM ou 10 nM durante 12 horas em meios celulares indicam que QDs são internalizados através de endocitose, ou seja, QDs demonstrar um padrão de coloração pontilhada no interior das células (Figura 5). Estes resultados indicam a adequação destes InP / ZnS QDs para investigar processos celulares.
Este protocolo detalha a síntese e funcionalização de solúveis em água QDs InP / ZnS com emissão intensa fluorescência, relativamente pequeno em tamanho dispersity e compatibilidade biológica. A elevada qualidade destes produtos QD é indicado pela visualização de QDs individuais na microscopia de fluorescência, o que demonstra que eles são adequados para um único molecule imagiologia. Prevê-se que estes QDs livre de CD são potencialmente muito menos tóxico para os sistemas biológicos estudados, bem como os investigadores que estudam-los. Como tal, a utilização desses QDs Na-base para aplicações biomédicas é uma alternativa prudente QDs baseadas em CD.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem o Departamento de Química e da Faculdade de Pós-Graduação da Universidade Estadual do Missouri para o seu apoio a este projeto. Reconhecemos também o Electron Microscopy Laboratório do Laboratório Nacional Frederick para Pesquisa do Câncer para o uso de seu microscópio eletrônico de transmissão e redes revestidas de carbono.
Materiais
| Name | Company | Catalog Number | Comments |
| Oleylamine | Acros | 129540010 | |
| Zinc(II) chloride | Sigma | 030-003-00-2 | |
| Indium(III) chloride | Chem-Impex | 24560 | |
| Tris(dimethylamino)phosphine | Encompass | 50-901-10500 | |
| 1-dodecanethiol | Acros | 117625000 | |
| Hexanes | Fisher Sci | H292-4 | |
| Acetone | TransChemical | UN 1090 | |
| Zinc Stearate | Aldrich Chem | 307564-1KG | |
| Tetrahydrofuran | Acros | 34845-0010 | |
| Molecular Water | Fisher Sci | BP2470-1 | |
| Poly(maleic anhyrdride-alt-1-tetradecene), 3-(dimethylamino)-1-propylamine derivative | Sigma | 90771-1G | |
| Boric acid | Fisher Sci | BP168-500 | |
| Sodium Tetraborate Decahydrate | Fisher Sci | BP175-500 | |
| Rhodamine B | Aldrich Chem | R95-3 | |
| Nitrogen gas | Airgas | UN1066 | |
| Trypan blue | Thermo Sci | SV30084.01 | |
| 3 ml plastic Luer-lock syringe | BD | 309657 | |
| Luer-lock Needle | Air-Tite | 8300014471 | 4 inch, 22 gauge |
| 50 ml polypropyene centrifuge tube | Falcon | 352098 | |
| 250 ml centrifuge bottle | Thermo Sci | 05-562-23 | Nalgene PPCO |
| 5 ml centrifuge tubes | Argos-Tech | T2076 | |
| 1.5 ml microcentrifuge tubes | Bio Plas | 4150 | |
| 0.1 μm Syringe filter | Whatman | 6786-1301 | Puradisc 13 mm nylon filter |
| Slide-A-Lyzer MINI Dialysis Unit | Thermo Sci | 69590 | 20,000 MWCO |
| Rotary Evaporator | Heidolph | ||
| Centrifuge 5072 | Eppendorf | Swinging Bucket with 50 ml tube adapters | |
| Lambda 650 UV/VIS Spectrometer | Perkin Elmer | UV-Vis Spectrophotometer | |
| LS 55 Fluorescence Spectrometer | Perkin Elmer | Fluorometer | |
| Axio Observer.A1 | Zeiss | epifluorescence microscope | |
| AxioCam MRm | Zeiss | CCD Camera | |
| Tecnai TF20 Microscope | FEI | Transmisison Electron Miscroscope | |
| TEM Eagle CCD | FEI | TEM CCD Camera | |
| NanoBrook Omni DLS | Brookhaven | Dynamic Light Scattering Instrument |
Referências
- Alivisatos, A. P. Semicondictor clusters, nanocrystals, and quantum dots. Science. 271 (5251), 933-937 (1996).
- Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307 (5709), 538-544 (2005).
- Jaiswal, J. K., Mattoussi, H., Mauro, J. M., Simon, S. M. Long-term multiple color imaging of live cells using quantum dot bioconjugates. Nat. Biotechnol. 21 (1), 47-51 (2009).
- Deerinck, T. J. The application of fluorescent quantum dots to confocal, multiphoton, and electron microscopic imaging. Toxicol. Pathol. 36 (1), 112-116 (2008).
- Smith, A. M., Duan, H., Mohs, A. M., Nie, S. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60 (11), 1226-1240 (2008).
- Jamieson, T., et al. Biological applications of quantum dots. Biomaterials. 28 (31), 4717-4732 (2007).
- Lidke, D. S., Arndt-Jovin, D. J. Imaging takes a quantum leap. Physiology. 19, 322-325 (2004).
- Fichter, K. M., Flajolet, M., Greengard, P., Vu, T. Q. Kinetics of G-protein-couple receptor endosomal trafficking pathways revealed by single quantum dots. Proc. Natl. Acad. Sci. U.S.A. 107 (43), 18658-18663 (2010).
- Smith, A. M., Ruan, G., Rhyner, M. N., Nie, S. Engineering luminescent quantum dots for in vitro molecular and cellular imaging. Ann. Biomed. Eng. 34 (1), 3-14 (2006).
- Derfus, A. M., Chan, W. C. W., Bhatia, S. N. Probing the cytotoxicity of semiconductor quantum dots. Nano Lett. 4 (1), 11-18 (2004).
- Brunetti, V., et al. InP/ZnS as a safer alternative to CdSe/ZnS core/shell quantum dots: in vitro and in vivo toxicity assessment. Nanoscale. 5 (1), 307-317 (2013).
- Song, W., et al. Amine-derived synthetic approach to color-tunable InP/ZnS quantum dots with high fluorescent qualities. J. Nanopart. Res. 15 (1750), (1750).
- Dabbousi, B. O., et al. (CdSe)ZnS core-shell quantum dots: Synthesis and characterization of a size series of highly luminescent nanocrystallites. J. Phys. Chem. B. 101 (46), 9463-9475 (1997).
- Micic, O. I., Curtis, C. J., Jones, K. M., Sprague, J. R., Nozik, A. J. Synthesis and characterization of InP quantum dots. J. Phys. Chem. 98 (19), 4966-4969 (1994).
- Qi, L., Gao, X. Quantum dot-amphipol nanocomplex for intracellular delivery and realtime imaging of siRNA. ACS Nano. 2 (7), 1403-1410 (2008).
- Xie, R., Zheng, L., Peng, X. Nucleation kinetics vs chemical kinetics in the initial formation of semiconductor nanocrystals. J. Am. Chem. Soc. 131 (42), 15457-15466 (2009).
- Williams, A. T. R., Winfield, S. A., Miller, J. N. Relative fluorescence quantum yields using a computer-controlled luminescence spectrometer. Analyst. 108, 1067-1071 (1983).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Schnieder, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nat. Methods. 9, 671-675 (2012).
- Jin, Y., Kannan, S., Wu, M., Zhao, J. X. Toxicity of luminescent silica nanoparticles to living cells. Chem. Res. Toxicol. 20 (8), 1126-1133 (2007).
- Corazzari, I., Gilardino, A., Dalmazzo, S., Fubini, B., Lovisolo, D. Localization of CdSe/ZnS quantum dots in the lysosomal acidic compartment of cultured neurons and its impact on viability: potential role of ion release. Toxicol. In Vitro. 27 (2), 752-759 (2013).
- Pons, T., Uyeda, H. T., Medintz, I., Mattoussi, H. Hydrodynamic dimensions, electrophoretic mobility, and stability of hydrophilic quantum dots. J. Phys. Chem. B. 110 (41), 20308-20316 (2006).
- Durisic, N., Wiseman, P., Grutter, P., Heyes, C. D. A common mechanism underlies the dark fraction formation and fluorescence blinking of quantum dots. ACS Nano. 3 (5), 1167-1175 (2009).
- Vermehren-Schmaedick, A., et al. Heterogeneous intracellular trafficking dynamics of brain-derived neurotropic factor complexes in the neuronal soma revealed by single quantum dot tracking. PLoS ONE. 9 (4), e95113 (2014).
Erratum
Formal Correction: Erratum: Synthesis of Cd-free InP/ZnS Quantum Dots Suitable for Biomedical Applications
Posted by JoVE Editors on 2/29/2016. Citeable Link.
A correction was made to: Synthesis of Cd-free InP/ZnS Quantum Dots Suitable for Biomedical Applications. There was an error with an author's given name. The author's name was corrected to:
Katye M. Fichter
from:
Kathryn M. Fichter
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados