Method Article
Индуцирование государства Изоэлектрическая мозга для изучения влияния эндогенного синаптической активности на нейронную возбудимость,
В этой статье
Резюме
Эта процедура выполняет долговечные внутриклеточные записи в естественных условиях от отдельных нейронов во время физиологически соответствующих мозговых состояний и после полной отмены текущих электрических деятельности, в результате чего в изоэлектрической состоянии мозга. Физиологические константы животного тщательно контролируются при переходе к искусственному коматозного состояния.
Аннотация
Информация о процессе путь нейроны зависит как от их внутренних свойств мембраны и на динамику афферентной синаптической сети. В частности, эндогенно-генерируемой сетевую активность, которая сильно изменяется в зависимости от состояния бдительности, значительно модулирует вычисление нейронную. Для того, чтобы исследовать , как различные спонтанные церебральные динамика влияет на интегративные свойства отдельных нейронов, мы разработали новую экспериментальную стратегию у крыс , заключающийся в подавлении в естественных условиях все мозговую активность с помощью системной инъекции высокой дозы пентобарбитала натрия. Кортикальные деятельность, непрерывно контролируется комбинированным ЭГ (ЭГ) и внутриклеточных записей постепенно замедляется, что приводит к постоянному изоэлектрической профилю. Это экстремальное состояние мозга, помещая крысу в глубокий коматозное состояние, был тщательно контролироваться путем измерения физиологических констант животного на протяжении экспериментов. Внутриклеточные гecordings позволило охарактеризовать и сравнить интегративные свойства одного и того же нейроне внедренного в физиологически соответствующих корковой динамики, такие, как те, которые встречаются в цикле сон-бодрствование, а когда мозг был полностью молчит.
Введение
При отсутствии каких-либо внешних стимулов или поведенческих задач, то "отдыхает" мозг генерирует непрерывный поток электрической активности, которые могут быть записаны с кожи головы, как электроэнцефалографии (ЭЭГ) волн. Внутриклеточная коррелятом этого эндогенного активности мозга характеризуется колебаниями фона мембранного напряжения (также известный как "синаптической шум"), которые состоят из комбинации возбуждающих и тормозных синаптических потенциалов , которые отражают текущую активность афферентных сетей 1,2. Эта спонтанная активность изменяется по частоте и амплитуде с различными состояниями бдительности. Освещающий влияние сетевой активности на возбудимости и реактивности отдельных нейронов является одной из основных проблем нейронаук 3,4.
Многие экспериментальные и расчетные исследования исследовали функциональное влияние текущей синаптической активности на интегративной СВОЙСТВs нейронов. Тем не менее, роль различных нейрональных параметров, пострадавших от фонового шума синаптической остается неуловимым. Например, средний уровень деполяризации мембраны было обнаружено положительно или отрицательно 5,6 7-9 коррелирует со способностью сенсорных входов , чтобы вызвать потенциалы действия. Кроме того, в то время как некоторые исследования показывают , что колебания мембранного потенциала, в результате чего из непрерывно изменяющегося потока афферентных синаптических входов, сильно влияет на быстроту реакции отдельных нейронов путем модуляции усиления их ввода-вывода отношений 3,10-13, другие указывают , что изменения входной проводимости мембраны , опосредованные маневрового ингибирования достаточны для модуляции нейрональной усиления независимо от величины мембранных колебаний 14,15. Наконец, недавние исследования, проведенные на животных, бодрствующих подчеркнул, как обработка сенсорной информации в одном нейроне в значительной степени зависит от состояния бдительности ай ток поведенческая спроса 16,17.
Несложный стратегия для выяснения функциональной роли данного процесса в высокой степени взаимосвязанной системе, чтобы определить, каким образом его отсутствие конкретно изменяет функционирование системы. Этот метод широко используется в исследованиях нейронауки, например , с использованием экспериментальных поражений или инактивация различных областей мозга , 18-21 или фармакологической блокады специфических ионных каналов 22,23. Примечательно, что он применялся в естественных условиях , чтобы представить как функциональную динамику подключений и сетевых влияют на вычисление одноклеточ- 24-27. Тем не менее, на сегодняшний день местные манипуляции предназначены для блокирования возбуждения нейронов и / или возмущать их основные биофизические свойства могут быть частично эффективными и ограничены на сравнительно небольшие объемы мозга 28.
Чтобы преодолеть эти ограничения, мы разработали новый в естественных условиях экспериментального подхода вкрыса сравнить электрофизиологические свойства отдельных нейронов , зарегистрированных в данном состоянии головного мозга, то есть, встроенный в конкретной сети динамической, к полученным после полного подавления всего мозга синаптической активности 29. В условиях управления, два различных корковой динамики может быть сгенерирован. Сон, как electrocorticographic (ЭГ) модели были вызваны инъекции умеренных доз фенобарбитала натрия. В качестве альтернативы, быстрые ЭГ волны малой амплитуды, сравнимые с корковой активности, лежащей в основе состояния бодрствования (бодрствование-подобный рисунок) может быть получен путем введения фентанила. В дальнейшем, при сохранении той же ЭГ и внутриклеточной регистрации, полное глушение эндогенный электрической активности головного мозга была получена путем системной инъекции высокой дозы фенобарбитала натрия, характеризующийся изоэлектрической ЭГ и внутриклеточного деятельности. Поскольку индукция такой экстремальной коматозных потенциально может привести к фатальным consequenКЕС на биологические функции, тщательный и непрерывный мониторинг физиологических переменных имеет важное значение. Поэтому мы тщательно следили за частотой сердечных биений, конец приливные концентрации СО 2 (Eţco 2), O 2 насыщения (SPO 2) и температуру ядра крысы на протяжении экспериментов.
Мы оцениваем свойства отдельных нейронов во время этих различных состояний с использованием резких микроэлектродов, которые особенно подходят для длительных и стабильных записей в естественных условиях. Процедура, описанная здесь, может быть объединен с другими электрофизиологических и обработки изображений подходов и может быть распространен на другие модели на животных.
протокол
Все процедуры были проведены в соответствии с руководящими принципами Европейского Союза (Директива 2010/63 / ЕС) и одобрено комитетом по этике Чарльза Дарвина на экспериментировании животных мимо. Здесь мы опишем процедуру мы обычно используем в нашей лаборатории, однако большинство шагов могут быть адаптированы под конкретные потребности каждого.
1. Хирургическая подготовка
Примечание: Все насечки и давления точки должны быть многократно пропитывается местным анестетиком (лидокаином или бупивакаина). Настоящая процедура является терминал, если асептический препарат требуется несколько модификаций должны быть реализованы.
- Обезболить крысу с помощью пентобарбитала натрия (40 мг / кг) и кетамина (50 мг / кг) в двух локально разделенных внутрибрюшинного (IP) инъекции.
- Пусть животное идут под общим наркозом и неоднократно убедиться, что хирургическая плоскость анестезии не достигается (отсутствие реакции на пальце ноги сведите). Поместите крысу на феedback одеяло отопления и вставьте ректальный зонд для поддержания температуры ядра около 37 ° C.
- Поместите катетер в брюшную полость , чтобы облегчить последующую инъекцию анестетиков и избежать перфорирование органов путем повторных уколов 30.
- Клип волос над небольшим (~ 2 - 3 мм) области выше области, расположенной в нижнем правом или левом квадранте желудка.
Примечание: Крем для депиляции также может быть использован. - Сделайте 2 - 3 мм разрез на коже с острыми ножницами или скальпелем. Использование тупым, удалить жир и мышечные слои, пока не наблюдается брюшной полости.
- Вставка около 1 - 2 см от небольшого катетера в полости и закрыть рану с хирургическим клеем.
(. , Например, 2 французский - соответствует 0,043 мм внутренний диаметр): Примечание Диаметр и общая длина катетера должна быть минимальной , чтобы уменьшить мертвый объем. Полиуретановые трубки являются наиболее подходящими. - Сделайте петлю и шовный тон катетера к коже, чтобы закрепить ее на месте.
- Клип волос над небольшим (~ 2 - 3 мм) области выше области, расположенной в нижнем правом или левом квадранте желудка.
- Установить трахеи трубку для контроля вентиляции во время искусственного дыхания.
- Что касается предыдущего шага, подготовить интересующую область (1 - 2 см над трахеи прямо над рукояткой), удалить волосы и надрезать кожу.
- Блант рассекают первые слои жира и мышц, а затем переместить слюнной железы в сторону и подвергать трахеи, аккуратно рассекает последний слой мышц.
- Осторожно удалите ткани над трахеи и слайд-нить под ним с помощью небольших щипцов. Сделайте узел хирурга с нитью, но не тугой это еще.
- Надрезать трахеи трансверсально между двумя хрящевыми кольцами. Мазок крови в трахею, если таковые имеются.
- Вставьте интубационной трубки соответствующего диаметра и затянуть узел Нить для закрепления трубки устойчивый. Для обеспечения дополнительной устойчивости нить в дальнейшем может быть прикреплен на более высокой точке трахеи трубки.
- Suturе рана близко или использовать хирургические скобки. Избегайте хирургического клея здесь, если трахеи трубка предназначена для повторного использования.
- Установите животное в стереотаксической рамы и тщательно контролировать следующие физиологические переменные: ЭГ, SPO 2, Eţco 2, частота сердечных сокращений ( с помощью ЭКГ, ЭКГ) и внутренней температуры. Контролировать и регулировать эти переменные, чтобы сохранить надлежащую глубину анестезии и физиологического состояния. В частности, в дополнение анестезии с небольшой дозой (10 мг / кг) фенобарбитала натрия при необходимости.
- Нанесите глазную мазь на оба глаза, чтобы избежать высыхание. Клип волос над кожей головы, сделать продольный разрез (~ 2 см) и резекцию соединительной ткани, прилежащие череп, используя скальпель или кюретки.
- Сделайте небольшой (диаметром ~ 1,5 мм) краниотомия по интересующей области с бормашины.
Примечание: Здесь поле ствол первичной соматосенсорной коры целенаправленную (7 - 8 мм впереди от линии межушной, 4.5- 5,5 мм латерально от средней линии 31). Промойте несколько раз, чтобы рассеивать тепло. - Используйте дополнительные тонкий пинцет, чтобы аккуратно сделать небольшое отверстие в твердой мозговой оболочки. Зарезервировать мм область ~ 0,5 в трепанации черепа, чтобы поместить электрод ЭГ (см следующий шаг). Постоянно держать влажную кору с 0,9% раствором NaCl (или искусственной спинномозговой жидкости).
- Поместите низкий импеданс (~ 60 кОм) серебряный электрод (электрода ЭГ) на твердую мозговую оболочку, избегая области коры, не вошедшей в оболочках, и поместите эталонный электрод на кожу головы мышцы на другой стороне головы.
- На этом этапе (через 30 мин после инъекции пентобарбитала натрия в прошлом), поддерживают анестезию путем повторных инъекций пентобарбитала натрия (10-15 мг / кг / ч) или фентанил (3-6 мкг / кг / ч) через катетер IP. Первый из них будет приводить к медленным колебательным, полусна, ECOG узор тогда как последний будет приводить к десинхронизированного, пробуждения, как, коркового профиль.
- Отрегулируйте искусственную VСистема Вентиляционные монтажные таким образом , чтобы частота дыхания и объем аналогичны тем , спонтанного дыхания крысы (нормальный диапазон 70 - 115 вдох / мин 32). Затем подключите механическую вентиляцию к интубационной трубки и проверить правильность грудной клетки инфляции (с обеих сторон). Если нет, то отрегулируйте положение вентиляционной трубки по оси трахеи. При необходимости всасывать секрецию в трахее с помощью катетера, соединенного с помощью шприца или вакуумного насоса.
- Если все физиологические переменные 32-35 и ЭГ 29,36 паттерны отражают стабильную хирургической плоскости анестезии, делают внутримышечные инъекции галламина триэтиодид в каждой ноге , чтобы парализовать крыса, 40 мг / кг для первой инъекции и затем 20 мг / кг , каждый 2hr 19,29,36,50.
2. Внутриклеточные Записи
- Потянуть стекло микропипетки (резкое микроэлектродного) с наконечником ~ 0,2 мкм, такие как сопротивление в диапазоне betweeп 50 и 80 МОм после заполнения с 2 М ацетата калия (КЭК).
- Поместите пипетку в определенном держателе с серебро / серебро-хлорид проволоки (Ag / AgCl) для подключения пипеток раствора к внутриклеточной усилителю (через стадию головы). Держатель должен быть прикреплен к микроманипулятора. Поместите электрод сравнения Ag / AgCl на мышцы шеи крысы.
- Медленно вставьте пипетку в мозгу вплоть до области интереса и проверить его сопротивление, контролируя напряжение падает в ответ на текущие шаги. Используйте шум (или зап) кнопку усилителя, чтобы очистить пипетку, если это необходимо.
- Используйте ватные тампоны или синтетические треугольники поглощения, чтобы высушить краниотомия (будьте осторожны, чтобы не прикоснуться к ЭГ или внутриклеточные электроды) перед нанесением его силиконового эластомера или 4% агарозы для уменьшения движений мозга.
- Опустите пипетку в 1 - 2 мкм шагов, пока его сопротивление возрастает при приближении к клетке. Затем используйте функцию гудение усилителя к Пенетрат.е в нейрон.
3. Побудить государство изоэлектрической
- Выполните соответствующий экспериментальный протокол (например, стреляя ответы на внутриклеточно инжекции тока, отношения тока напряжения, сенсорные раздражители отклики) на данном этапе, контролируя одновременно мембранного потенциала нейрона, ЭГ и физиологические переменные.
- Убедитесь в том, что внутриклеточный электрод стабилен в клетке, анализируя устойчивость как мембранного потенциала и потенциала действия свойств на протяжении всего сеанса записи. Если нет, то не переходите к следующему шагу и ждать, пока запись не стабилизируется снова или искать другого нейрона.
- Вводят высокий, но инфракрасные смертельную дозу фенобарбитала натрия (~ 90 мг / кг, может быть ниже, чем 35 мг / кг с фенобарбиталом начальным условием и до 155 мг / кг от фентанила исходного состояния) через IP-линии.
Примечание: В течение 15 - 20 мин внутриклеточного и ЭГ ваveforms должен замедлиться с прерывистым электрическим молчанием , чтобы скоротечно достичь так называемого "Ворвалась подавления" Профиль 37,38, который постепенно разрушается до полного изоэлектрической состояния. Ожидается , что частота сердечных сокращений значительно замедляется (на ~ 10 - 20%) , но SpO 2 и EtCO 2 должны оставаться относительно стабильными. - Если изоэлектрическая состояние не достигается, вводят небольшое количество фенобарбитала натрия (~ 10% дозы шаг 3.1). Подождите 15 минут, прежде чем добавлять больше анестетика, если изоэлектрическая состояние еще не достигнуто.
- Повторите экспериментальный протокол для сравнения влияния динамики сети на интегративные свойства записанного нейрона.
Примечание: После прекращения инъекций обезболивающих, электрическая активность мозга должна полностью восстановиться в течение от 3 до 4 часов. - В конце эксперимента, вводят смертельную дозу фенобарбитала натрия (200 мг / кг, внутрибрюшинно) усыпить крысу.
Результаты
Склонение и поддержание изоэлектрической состояния мозга является деликатным в естественных условиях экспериментальной процедуры. Было доказано , чтобы быть мощным инструментом для непосредственного изучения влияния корковой сетевой активности на возбудимости нейронов и функции передачи 29. На рисунке 1 показан мониторинг с участием многих параметров, в том числе ЭГ и жизненных констант, физиологического состояния животного до (рис 1А ) и после того, как (Фигура 1В) индукция изоэлектрической состояния.

Рисунок 1. Мониторинг физиологических параметров в контроле и изоэлектрической условиях.
А и В, одновременные записи ЭГ (верхние следы) и физиологических параметров во время активного состояния коры головного мозга (А) и подводные лодкиequent изоэлектрической период (В). Температура ядра (Temp.), EtCO 2 и ПОФ 2 являются по существу стабильными в течение всего эксперимента. Частота сердечных сокращений, напротив, постепенно уменьшается после индукции изоэлектрической состояния (от 382 до 349 уд / мин), как видно на ЭКГ. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Во время сеансов управления, физиологические параметры были аналогичны тем , которые измеряются в здоровых и бодрствующих животных 32-35 и оставались неизменными после индукции изоэлектрической состояния, для частоты сердечных сокращений , которая была слегка замедлилось (рисунок 1) , за исключением. Это является важным моментом , так как гипоксия 39 или гиперкапнии 40 может заметно изменить возбудимость нейронов и , таким образом , может ввести серьезный уклон в шпильке у изучения мозга зависящих от состояния модуляции нейрональных интегративных свойств.
Мы получили статус изоэлектрической из двух различных начальных условиях , имитирующих корковых динамику эндогенно сгенерированных на ранних стадиях сна (рис 2AA, левая панель) или во время бодрствования (рис 2ab, левая панель). Эти активные состояния были либо из индуцированных путем инъекции пентобарбитала натрия (подобное сну) или фентанил (бодрствование-подобный). В обоих случаях, дальнейшее введение высокой дозы пентобарбитала натрия привело к полной отмене спонтанной активности в ЭГ и одновременно регистрируемых нейронов (рис 2aà и Ь, правые панели), отсюда и термин изоэлектрического. Подавляя продолжающуюся синаптической активности привело к значительному установившемся гиперполяризации нейрональной мембранного потенциала (Фигура 2В).
т "ВОК: Keep-together.within-страница =" 1 ">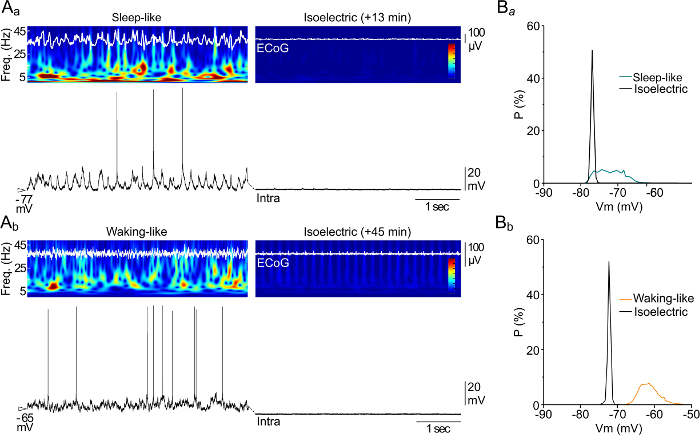
Рисунок 2. Последствия Synaptic Подавление активность на спонтанную динамику мембранного потенциала.
(A) Одновременные представительные записи ЭГ (верхние следы) и внутриклеточных деятельности (Intra, нижние следы) во время сна-типа (A A) и бодрствования типа (А б) модели (левая панели), и в течение соответствующих последующих изоэлектрическими эпох (в указанные моменты времени после подавляющих инъекции; изоэлектрической, правые панели). Анализ времени частота сигналов ЭГ (плотность энергии для 0 - частотный диапазон 50 Гц) изображается цветовых гамм. Плотности (B) вероятность (Р) значений мембранного потенциала (Vm, размер бина 0,5 мВ, 10 сек записи) от нейронов, показанных на панели A. Эта цифра была изменена, с разрешения из работы 29./ftp_upload/53576/53576fig2large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Чтобы проиллюстрировать функциональное влияние этого экстремального состояния мозга, мы извлекли пассивные и активные внутренние свойства изоэлектрическими нейронов и сравнили их с измеренными в течение соответствующего исходного состояния. Используя эту стратегию, мы показали , что нейроны могут стрелять потенциалы действия в ответ на внутриклеточной инъекции деполяризующими тока во изоэлектрической состоянии, демонстрируя , что они оставались полностью возбудимы даже после полного подавления фоновой синаптической активности (рис 3AA и Ь, изоэлектрической). Более того, мы обнаружили, что передаточная функция нейронов, оценивали путем измерения частоты стрельбы, индуцированную шагом деполяризуя тока увеличения интенсивности (Ф.И. отношения), правильно сдвинутый по сравнению с начальным активным условиях, с указаниемснижение чувствительности нейронов к слабым возбуждающим сигналам (рис 3б). Соответствующая нейронную усиление, то есть наклон кривой FI, осталась неизменной или была уменьшена , когда государственный контроль был или наяву сон - типа, соответственно (рис 3B). Удивительно, но кажущаяся входное сопротивление нейронов существенно не изменяется в отсутствие синаптического привода по сравнению с контрольными активных условиях (рис 3AA, б). Другие результаты, включая анализ населения и количественного определения временных паттернов возбуждения нейронов в активных и изоэлектрической условиях, доступны в нашей первоначальной статье 29.
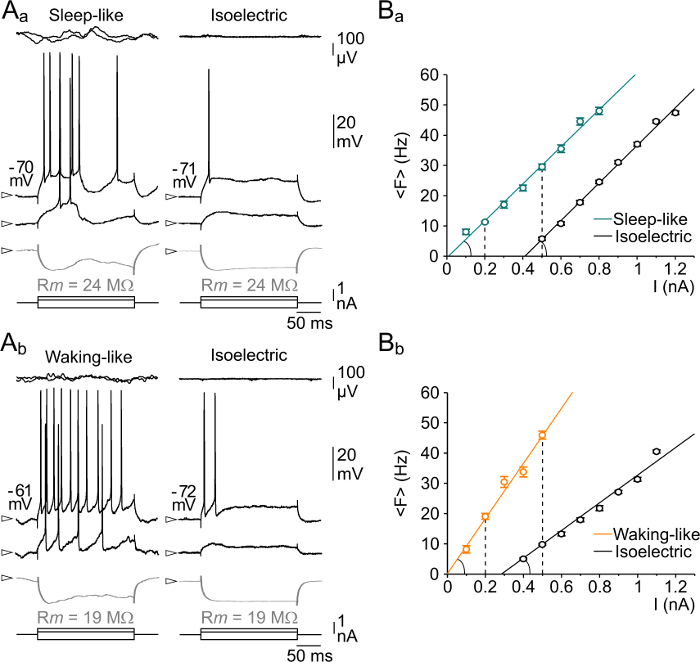
Рисунок 3. Сравнительный Влияние паттернов Три корковой активности на свойства мембран и ввода-вывода отношений.
(A) Трансформат е ответы (средние следы) из соматосенсорной корковых нейронов к деполяризующих и гиперполяризационных импульсов тока (нижняя следы) во время сна-как (А а) и бодрствования типа (А б) модели ЭГ (верхние записи) и после лишения синаптической активности (Изоэлектрическая ). Входное сопротивление мембраны (R м, значения указаны) измерялось от падения напряжения (серые следы, средние из 20 испытаний) , индуцированных гиперполяризационных текущих инъекциями импульсов (-0,4 нА). (В) , соответствующие кривые FI, обеспечивая передаточной функции нейронов , проиллюстрированных на панели (А). Скорость стрельбы была измерена в ответ на деполяризующей импульсы тока (200 мсек длительности) возрастающей интенсивности. Каждая сила тока была применена в 20 раз, а соответствующие скорости стрельбы были усреднены. Пунктирные линии обозначают клеточные ответы , показанные в (А). Эта цифра была изменена, с разрешения из работы 29.загрузить / 53576 / 53576fig3large.jpg "мишень =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Здесь мы опишем новый метод для подавления в естественных условиях спонтанной мозговой электрической активности в сети как и клеточном уровнях. Эта процедура приводит к экстремальное состояние мозга, известный как изоэлектрической коматозных 41. С клинической точки зрения, такая инертность является состояние электрического наиболее тяжелая патология, которую можно увидеть на ЭЭГ. Это главным образом связано с необратимой коме, со всеми пациентами либо умирающих или продолжающихся в постоянном вегетативном состоянии 42, но может быть , по крайней мере частично восстанавливается , когда вызванное интоксикацией с центральными препаратами нервной системы депрессанты (например, тиопентал), случайное переохлаждение 42 или асфиктический остановки сердца 43. В нашей экспериментальной парадигмы, изоэлектрической состояние постепенно достигается с помощью системной инъекции пентобарбитала натрия в больших дозах, которое сначала быстро вызывает снижение содержания частоты ЭГ, то режим "взрыв-подавление"41,42, что привело в конце концов к совершенно плоской ЭГ. На внутриклеточном уровне, исчезновение спонтанной активности следует той же временной ход с одновременным уменьшением деполяризующими и гиперпол мембранного потенциала колебаний. Таким образом, можно предположить , что введение пентобарбитала натрия первого повышает синаптическую передачу ингибиторной приводит к снижению корковых нейронов стреляющих активности, постепенная отмена возбуждающих и тормозящих синаптической передачи , что в конце концов приводит к изоэлектрической ЭГ и внутриклеточных деятельности 29,44. Подобные переходы от активного к изоэлектрическими моделей ЭГ могут быть получены после введения других анестетиков , таких как кетамин (личное наблюдение) или изофлуран 45,46.
Эта процедура может показаться относительно простым. Тем не менее, из-за чрезвычайно глубоко в коме индуцированных, поддержание основных физиологических параметров в пределахнормальные диапазоны имеет первостепенное значение для успеха эксперимента. Изменения в EtCO 2 колебания могут быть результатом слизистой пробки , образующей в трахее. В такой ситуации, вентилятор должен быть отключен и слизь быстро отсасывают или уничтожены через интубационную трубку. Кроме того, механическая стабильность препарата имеет решающее значение для внутриклеточных записей. Таким образом, особые усилия должны быть направлены на снижение сосудистой и дыхательной пульсации, тщательно регулируя тела относительно животного к голове при сохранении надлежащего выравнивания трахеи трубки, а также путем применения агарозы или силиконового эластомера на краниотомии. Кроме того, необходимо, чтобы избежать спонтанные сокращения мышц путем инъекции парализующим агента. И, наконец, экологические колебания и электрического шума должна быть уменьшена в максимально возможной степени. Другие публикации подробно основные шаги для оптимального препарата в естественных условиях , позволяющих стабильное внутриклеточные или патч-зажим , которыйЗаписи ле-клеток 29,47-50.
Способность отвязать нейронные внутренние свойства мембраны и динамики сетей имеет важное значение для рассекают механизмы, с помощью которых отдельные нейроны обрабатывают информацию в их высокосвязных среде. Как отмечалось во введении, предыдущие исследования , посвященные этому центральному вопросу фундаментальных нейронаук привели к противоречивым результатам, отчасти из - за специфических особенностей нейронов и сетей исследованных и различных экспериментальных условиях, в том числе в пробирке против препаратов в естественных условиях и, в конце концов, различные процедуры анестетика (смотри, например , 29,36,51). Мы полагаем , что данный подход может быть использован для проверки, и , возможно , примирить, результаты , полученные из уменьшенная в пробирке подготовки и от экспериментов естественных условиях. В самом деле, он позволяет непосредственно исследовать и сравнить в том же нейроне и в ходе той же экспериментальной методикевлияние различных форм афферентных синаптических входов, от бодрствования-как динамики, чтобы завершить бездеятельность, на нейрональных интегративных свойств в живом организме животного.
Одной из отличительных черт этого протокола заключается в том, что после того, как освоены, можно комбинировать с другими экспериментальными методами, такими как многоузельных поверхности и глубине ЭЭГ, генетически кодируемых флуоресцентных показателей на основе исследований и даже гемодинамической и метаболической визуализации головного мозга, чтобы исследовать многомерный свойства изоэлектрической мозга. В качестве клинических и диагностических точек зрения, так как мы показали, что нейроны все еще возбудимый во время персистирующей изоэлектрической является зависшим, было бы уместным, чтобы проверить корковых функций, например, обработку сенсорной информации, пациентов и животных моделей, погруженных в таком патологическом состоянии мозга малоподвижный образ жизни.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана грантами от Fondation де Франс, Национальным институтом де ла Санте Et де-ла-Recherche MEDICALE, Пьера и Мари Кюри университета и программы "Investissements d'Avenir 'ANR-10-IAIHU-06.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium Pentobarbital | Centravet | Pentobarbital | |
| Ketamine 500 | Merial | Imalgène 500 | |
| Fentanyl | Janssen-Cilag | Fentanyl | |
| Xylocaine | Centravet | Xylovet | |
| Gallamine triethiodide | Sigma | G8134 | |
| ECoG amplifier | A-M Systems | AC amplifier, Model 1700 | |
| Intracellular amplifier | Molecular Devices | Axoclamp 900A | |
| Data acquisition interface | Cambridge Electronic Design | CED power 1401-3 | |
| Data analysis software | Cambridge Electronic Design | Spike2 version 7 | |
| micromanipulator | Scientifica | IVM-3000 | |
| Capillary Puller | Narishige | PE-2 | |
| Borosilicate glass capillaries | Harvard Apparatus | GC150F-10 | |
| Silver wire 0.125 mm (intracellular recording) | WPI | AGT0525 | |
| Ag-AgCl reference | Phymep | E242 | |
| Silver wire 0.25 mm (ECoG recording) | WPI | AGT1025 | |
| Artificial respiration system | Minerve | Alpha Lab | |
| Physiological parameters monitoring | Digicare | LifeWindow Lite | |
| Heating Blanket | Harvard Apparatus | 507215 | |
| Stereomicroscope | Leica | M80 | |
| Scissors | FST | 15005-08 | |
| Forceps Dumont #5 | FST | 11295-10 | |
| Forceps Dumont #5SF | FST | 11252-00 | |
| IP Polyurethane catheter - 0.43x0.69 mm | Instech | BTPU-027 | |
| Silicon elastomere | WPI | KWIK-CAST | |
| Dental drill | NSK | Y1001151 and P496 | |
| Surgical glue | 3M | vetbond |
Ссылки
- Fatt, P., Katz, B. Some observations on biological noise. Nature. 166 (4223), 597-598 (1950).
- Brock, L. G., Coombs, J. S., Eccles, J. C. The recording of potentials from motoneurones with an intracellular electrode. J. Physiol. 117 (4), 431-460 (1952).
- Destexhe, A., Rudolph, M., Fellous, J. M., Sejnowski, T. J. Fluctuating synaptic conductances recreate in vivo-like activity in neocortical neurons. Neuroscience. 107 (1), 13-24 (2001).
- Silver, R. A. Neuronal arithmetic. Nat. Rev. Neurosci. 11 (7), 474-489 (2010).
- Azouz, R., Gray, C. M. Cellular mechanisms contributing to response variability of cortical neurons in vivo. J. Neurosci. 19 (6), 2209-2223 (1999).
- Sanchez-Vives, M. V., Nowak, L. G., McCormick, D. A. Membrane Mechanisms Underlying Contrast Adaptation in Cat Area 17 In Vivo. J. Neurosci. 222 (11), 4267-4285 (2000).
- Petersen, C. C. H., Hahn, T. T. G., Mehta, M., Grinvald, A., Sakmann, B. Interaction of sensory responses with spontaneous depolarization in layer 2/3 barrel cortex. Proc. Natl. Acad. Sci. U.S.A. 100 (23), 13638-13643 (2003).
- Sachdev, R. N. S., Ebner, F. F., Wilson, C. J. Effect of Subthreshold Up and Down States on the Whisker-Evoked Response in Somatosensory Cortex. J. Neurophysiol. 92 (6), 3511-3521 (2004).
- Hasenstaub, A., Sachdev, R. N. S., McCormick, D. A. State Changes Rapidly Modulate Cortical Neuronal Responsiveness. J. Neurosci. 27 (36), 9607-9622 (2007).
- Chance, F. S., Abbott, L. F., Reyes, A. D. Gain modulation from background synaptic input. Neuron. 35 (4), 773-782 (2002).
- Shu, Y., Hasenstaub, A., Badoual, M., Bal, T., McCormick, D. A. Barrages of synaptic activity control the gain and sensitivity of cortical neurons. J. Neurosci. 23 (32), 10388-10401 (2003).
- Mitchell, S. J., Silver, R. A. Shunting inhibition modulates neuronal gain during synaptic excitation. Neuron. 38 (3), 433-445 (2003).
- Prescott, S. A., De Koninck, Y. Gain control of firing rate by shunting inhibition: roles of synaptic noise and dendritic saturation. Proc. Natl. Acad. Sci. U.S.A. 100 (4), 2076-2081 (2003).
- Graham, L. J., Schramm, A. In Vivo Dynamic-Clamp Manipulation of Extrinsic and Intrinsic Conductances: Functional Roles of Shunting Inhibition and IBK in Rat and Cat Cortex. Dynamic-clamp: From principles to applications. , (2009).
- Fernandez, F. R., White, J. A. Gain control in CA1 pyramidal cells using changes in somatic conductance. J. Neurosci. 30 (1), 230-241 (2010).
- Polack, P. O., Friedman, J., Golshani, P. Cellular mechanisms of brain state-dependent gain modulation in visual cortex. Nat. Neurosci. 16 (9), 1331-1339 (2013).
- Zhou, M., Liang, F., et al. Scaling down of balanced excitation and inhibition by active behavioral states in auditory cortex. Nat. Neurosci. 17 (6), 841-850 (2014).
- Contreras, D., Destexhe, A., Sejnowski, T. J., Steriade, M. Spatiotemporal Patterns of Spindle Oscillations in Cortex and Thalamus. J. Neurosci. 17 (3), 1179-1196 (1997).
- Charpier, S., Mahon, S., Deniau, J. M. In vivo induction of striatal long-term potentiation by low-frequency stimulation of the cerebral cortex. Neuroscience. 91 (4), 1209-1222 (1999).
- Constantinople, C. M., Bruno, R. M. Effects and Mechanisms of Wakefulness on Local Cortical Networks. Neuron. 69 (6), 1061-1068 (2011).
- Poulet, J. F. A., Fernandez, L. M. J., Crochet, S., Petersen, C. C. H. Thalamic control of cortical states. Nat. Neurosci. 15 (3), 370-372 (2012).
- Hille, B. . Ion Channels of Excitable Membranes, Third Edition. , (2001).
- Sakmann, B., Neher, E. . Single-Channel Recording. , (2009).
- Ferster, D., Chung, S., Wheat, H. Orientation selectivity of thalamic input to simple cells of cat visual cortex. Nature. 380 (6571), 249-252 (1996).
- Paré, D., Shink, E., Gaudreau, H., Destexhe, A., Lang, E. J. Impact of spontaneous synaptic activity on the resting properties of cat neocortical pyramidal neurons In vivo. J. Neurophysiol. 79 (3), 1450-1460 (1998).
- Destexhe, A., Paré, D. Impact of network activity on the integrative properties of neocortical pyramidal neurons in vivo. J. Neurophysiol. 81 (4), 1531-1547 (1999).
- Kara, P., Pezaris, J. S., Yurgenson, S., Reid, R. C. The spatial receptive field of thalamic inputs to single cortical simple cells revealed by the interaction of visual and electrical stimulation. Proc. Natl. Acad. Sci. U.S.A. 99 (25), 16261-16266 (2002).
- Lomber, S. G. The advantages and limitations of permanent or reversible deactivation techniques in the assessment of neural function. J. Neurosci. Meth. 86 (2), 109-117 (1999).
- Altwegg-Boussac, T., Chavez, M., Mahon, S., Charpier, S. Excitability and responsiveness of rat barrel cortex neurons in the presence and absence of spontaneous synaptic activity in vivo. J. Physiol. 592 (16), 3577-3595 (2014).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Appl. Microbiol. 17 (2), 250-251 (1969).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates (2nd edn). , (1986).
- Wolfensohn, S. . Handbook of Laboratory Animal Management and Welfare. , (2013).
- Bester, H., Chapman, V., Besson, J. M., Bernard, J. F. Physiological Properties of the Lamina I Spinoparabrachial Neurons in the Rat. J. Neurophysiol. 83 (4), 2239-2259 (2000).
- Greene, S. A. . Veterinary Anesthesia and Pain Management Secrets. , (2002).
- Morgan, B. J., Adrian, R., Bates, M. L., Dopp, J. M., Dempsey, J. A. Quantifying hypoxia-induced chemoreceptor sensitivity in the awake rodent. J. Appl. Physiol. 117 (7), 816-824 (2014).
- Mahon, S., Deniau, J. M., Charpier, S. Relationship between EEG potentials and intracellular activity of striatal and cortico-striatal neurons: an in vivo study under different anesthetics. Cereb. Cortex. 11 (4), 360-373 (2001).
- Ganes, T., Lundar, T. The effect of thiopentone on somatosensory evoked responses and EEGs in comatose patients. J Neurol Neurosurg Psychiatry. 46 (6), 509-514 (1983).
- Schmid-Elsaesser, R., Schröder, M., Zausinger, S., Hungerhuber, E., Baethmann, A., Reulen, H. J. EEG burst suppression is not necessary for maximum barbiturate protection in transient focal cerebral ischemia in the rat. J. Neurol. Sci. 162 (1), 14-19 (1999).
- Cummins, T. R., Jiang, C., Haddad, G. G. Human neocortical excitability is decreased during anoxia via sodium channel modulation. J Clin Invest. 91 (2), 608-615 (1993).
- Gu, X. Q., Kanaan, A., Yao, H., Haddad, G. G. Chronic High-Inspired CO2 Decreases Excitability of Mouse Hippocampal Neurons. J. Neurophysiol. 97 (2), 1833-1838 (2007).
- Lehembre, R., Gosseries, O., et al. Electrophysiological investigations of brain function in coma, vegetative and minimally conscious patients. Arch Ital Biol. 150 (2/3), 122-139 (2012).
- Husain, A. M. Electroencephalographic assessment of coma. J Clin Neurophysiol. 23 (3), 208-220 (2006).
- Fink, E. L., Alexander, H., et al. An Experimental Model of Pediatric Asphyxial Cardiopulmonary Arrest in Rats. Pediatr Crit Care Med. 5 (2), 139-144 (2004).
- Lukatch, H. S., McIver, M. B. Synaptic mechanisms of thiopental-induced alterations insynchronized cortical activity. Anesthesiology. 84, 1425-1434 (1996).
- Kroeger, D., Amzica, F. Hypersensitivity of the anesthesia-induced comatose brain. J Neurosci. 27, 10597-10607 (2007).
- Kroeger, D., Florea, B., Amzica, F. Human brain activity patterns beyond the isoelectric line of extreme deep coma. PLoS ONE. 8 (9), e75257 (2013).
- Margrie, T. W., Brecht, M., Sakmann, B. In vivo, low-resistance, whole-cell recordings from neurons in the anaesthetized and awake mammalian brain. Pflugers Arch. 444 (4), 491-498 (2002).
- DeWeese, M. Whole-Cell Recording In Vivo. Current Protocols in Neuroscience. , (2007).
- Schramm, A. E., Marinazzo, D., Gener, T., Graham, L. J. The Touch and Zap Method for In Vivo Whole-Cell Patch Recording of Intrinsic and Visual Responses of Cortical Neurons and Glial Cells. PLoS ONE. 9 (5), e97310 (2014).
- Mahon, S., Charpier, S. Bidirectional Plasticity of Intrinsic Excitability Controls Sensory Inputs Efficiency in Layer 5 Barrel Cortex Neurons in Vivo. J. Neurosci. 32 (33), 11377-11389 (2012).
- Destexhe, A., Rudolph, M., Paré, D. The high-conductance state of neocortical neurons in vivo. Nat. Rev. Neurosci. 4 (9), 739-751 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены